Method Article
ラットにおける網膜下注射と網膜剥離の術中可視化
要約
この記事では、ラットにおける網膜下注射の方法について、術中の視覚化を利用して注射部位と網膜剥離の領域の両方を制御する方法について説明します。
要約
網膜下注射は、視細胞と網膜色素上皮(RPE)との間の溶液の送達であり、成分が光受容体およびRPE細胞と直接接触する網膜下空間を作り出します。この送達方法により、これらの細胞の標的治療が可能になります。網膜下注射の治療法は、特に遺伝性網膜疾患に対して開発され、承認されています。動物では、特にげっ歯類では、レンズのサイズのために網膜下注射の手順が困難な場合があります。この記事では、ラットにおける網膜下注射の方法について説明し、ヒトで行われるように、注射部位と剥離領域のサイズの両方の術中の視覚化と制御を可能にします。この手順は、全身麻酔と局所麻酔下で行われ、瞳孔の拡張が必要です。眼科用顕微鏡を使用して、網膜下注射は30 Gの強膜チャネルを介して行われ、カニューレの先端を網膜に優しく適用して網膜切開術を作成します。ラット網膜の5分の2から半分に相当する10〜25μLの容量を送達できます。眼底写真と光干渉断層撮影法を使用した術後直後の検査では、目に見える網膜下液で網膜下腔への送達が成功したことが確認されています。この手順の主なリスクには、水晶体の損傷(白内障)、剥離不全、硝子体内出血、網膜下出血、術後角膜炎などがあります。この技術は、治療薬を網膜下腔に送達することに加えて、水性または粘性製品をそれぞれ使用して短期または長期の網膜剥離を誘導するために使用されます。経強膜アプローチとは異なり、この方法は網膜剥離の正確な術中位置決めを可能にします。
概要
網膜は、眼球の内側と後部に位置する光感受性ニューロン組織です。神経網膜の外層には、光を電気化学信号に変換する専用の特殊なニューロンである光受容体が含まれているため、視覚に不可欠です。神経網膜の下にある網膜色素上皮(RPE)は、光受容体に広範な代謝サポートを提供し、視覚色素の再生とそれらの外側セグメントの定期的な更新を促進します1。
光受容体変性症は、不可逆的な視力喪失の最も一般的な原因であり、加齢性黄斑変性症、網膜色素変性症、糖尿病性網膜症、網膜剥離などのさまざまな網膜疾患で発生します1,2,3,4。これらの状態のほとんどは、光受容体の一次または二次的な喪失に起因し、多くの場合、RPEの喪失または機能障害に続発します。したがって、光受容体とRPE細胞をin vivoで研究して、その変性を防ぐことが特に重要です。現在まで、網膜ジストロフィー(網膜色素変性症を含む)や黄斑変性症(加齢性黄斑変性症を含む)など、多くの網膜疾患に対する有効な治療法は存在しません。
網膜下注射は、光受容体とRPEとの間の溶液の送達であり、成分が光受容体およびRPE細胞と直接接触する網膜下空間を作り出す。この送達方法により、これらの細胞の標的治療が可能になり、さまざまな網膜または血管の障壁を回避できます。網膜下送達のためのいくつかの治療法が開発され、特に遺伝性網膜疾患に対して承認されています5,6。
網膜下分娩のための外科的実践を調和させることが重要です。ヒトでは、標準的な手順には25Gの扁平部硝子体切除術が含まれ、水晶体が目全体に比例して小さいため、眼の後部への比較的容易なアクセスを提供します。網膜下送達は、38 Gまたは41 Gのシリコン先端の生体適合性カニューレを使用して25 Gのトロカールを介して行われ、スムーズな経網膜血流が可能になります5。
動物では、水晶体のサイズのために網膜下注射の手順が困難な場合があります。例えば、げっ歯類では、水晶体は硝子体腔の最大90%を占めます。ラットでは、レンズはマウスよりも占有するスペースが少なくなっていますが、それでも重要です(図1Aを参照)。さらに、網膜下注射は、粘性溶液を使用して網膜剥離(RD)をモデル化するために使用でき、RPE細胞7,8による網膜下液クリアランスを防止する。これらのモデルは、主に網膜疾患の治療法の開発に採用されています。
この記事では、ラットにおける網膜下送達または誘導 RD の方法について説明し、注射部位と剥離した網膜領域の完全な術中制御を可能にします。
プロトコル
実験と手順は、地元の動物倫理委員会によって承認され、地元の法律に準拠して、研究所に関連する施設で実施されました。すべての実験作業は、バイオセキュリティと安全手順に関する制度的方針(Local Animal Ethics Committee Charles Darwin CEEACD #5)に準拠し、欧州指令2010/63/EUに準拠していました。この研究では、生後8週齢の野生型の雌Long Evansラット(Rattus norvegicus)を使用しました。P23HやRCSなど、ラットのさまざまな網膜変性モデルを使用して、薬物や遺伝子治療などのさまざまな治療法の網膜下送達を試験できます。この研究で使用した試薬と機器の詳細は、資料表に記載されています。
1. 溶液の調製
- 網膜下送達:PBSまたはジメチルスルホキシドで分子を希釈して、網膜下水送達を行います。
- RDの誘導:2%ヒドロキシプロピルメチルセルロースまたは1%-5%ヒアルロン酸ナトリウムを使用して、長期RDを誘導します。
2. 実験のセットアップ
- 面取りされていない10 mm 30 Gカニューレの金属チップを10 μLまたは25 μLシリンジにセメントで固定し、マイクロインジェクターに取り付けます。
- 調製した溶液をシリンジに入れます。
3.動物の調理
- 麻酔
- 全身麻酔: 40 mg/kg ケタミンと 0.14 mg/kg メデトミジンの腹腔内注射でラットに麻酔をかけます。
注:この麻酔は、処置の期間中および術後すぐに探索するのに十分な長さ続きます。 - 瞳孔拡張:0.5%トロピカミドを1滴入れて、片方の眼に散瞳を取得します。
注:右利きの外科医の場合、左目での手術はより容易になり、 その逆も同様です。 - 局所麻酔( 図2B):手術する眼にオキシブプロカインを1滴垂らします。
- 全身麻酔: 40 mg/kg ケタミンと 0.14 mg/kg メデトミジンの腹腔内注射でラットに麻酔をかけます。
4. 顕微鏡下での手術
- 術中の視覚化:フットスイッチに接続された眼科用顕微鏡を使用して手術を行います。
- 強膜被ばく(図2C、D)
- 上まぶたと下まぶたの眼瞼縁の外側四分の一に固定された 2 つのまぶたを引っ張る縫合糸 (5-0 または 6-0) を使用します。
- 縫合糸を引っ張ると、目が穏やかに膨らみます。
- 強膜チャネル(図2E、F):30 Gの針を使用して、角膜辺縁部から約1〜2 mmの側頭球結膜を通る強膜チャネルを作成します。
注意: 斜めの針先は、レンズの接触やその後の白内障のリスクを避けるために、それ以上押し込まずにかろうじて挿入します。この段階で結膜出血を数十秒間観察します。出血をタンポナードすることは、硝子体に血液が溜まり、処置を危険にさらす可能性があるため、避けてください。チャネル領域の血液や視覚化を妨げる血液を綿棒でやさしく拭き取ります。 - 角膜保護(図2G):手順全体を通して、レンズと目のインターフェースとして涙液ジェルを使用します。
- 網膜面の可視化(図2G)
- 平らなコンタクトレンズ(直径8mm)を眼球に当てて、網膜面を適切な倍率で視覚化します。
- 顕微鏡のフットスイッチを使用して、網膜面に焦点を合わせます。
- 網膜下注射(図2H-M)
- 事前に形成された強膜チャネルを介してカニューレを垂直に挿入します(図2H)。
- カニューレを垂直に保つことにより、レンズに触れないようにしてください。
- ゆっくりと網膜に近づき、網膜の白化が観察されるまでゆっくりと押します( 図2Iの矢印)。
- 注入流によって形成された網膜切開術を通して注入しながら、先端の安定性を維持します(図2J)。網膜切開術からチップを早すぎると、製品が硝子体に注入されるため、避けてください。
- 注入後、網膜切開術から先端を取り外し、カニューレ全体を硝子体腔からゆっくりと引き抜き、レンズが触れないようにします(図2K)。
注:シリンジが空になった後、ブレブの発達が不十分な場合、または剥離した網膜領域が制限されすぎる場合は、同じ強膜チャネルを使用して再注入を行い、以前に形成した網膜切開術に先端を挿入します。. - 瞳孔腔内の血流を観察せずに、網膜剥離によって瞳孔赤色反射が変化することを確認します(図2L、M)。
- 手術終了(図2N、O)
- まぶたの縫合糸を取り外し、出血があれば慎重に綿棒で拭きます(図2N)。
- 眼圧を手動で簡単に評価します。
注:少量の硝子体液が結膜下腔に現れる可能性がありますが、活発な漏れが発生してはなりません(図2O)。
5. 術後のケアと覚醒
- 手術した眼にクロラムフェニコール-レチノール眼軟膏を塗布します。.
- 1 mLの5%グルコース一水和物を腹腔内に投与します。.
- 0.9 mg / kgのアチパメゾールを皮下注射します。.
- 動物を温度制御されたチャンバーに入れ、目を覚ますまで監視します。
結果
網膜下注射の成功は、網膜切開術を通じて網膜下空間(すなわち、光受容体とRPE層の間)への正確かつ排他的な送達に依存しており、血液は光受容体およびRPE細胞に有毒であるため、網膜下出血を回避します。成功した送達は、術中の視覚化 (図 2L)、術後直後の眼底写真、および光干渉断層撮影 (OCT) によって確認されます。眼底写真は網膜下出血を除外しますが、OCT Bスキャンは透明な網膜下液による網膜剥離(RD)を確認します(図1および図3)。さらに、眼底撮影では、処置中に気付かれない可能性のあるレンズの接触や誘発された白内障を特定できます(図3C、D)。写真撮影とOCTスキャンの両方で、剥離領域またはブレブのサイズを推定できます(図1B-E)。
ブレブのサイズにはいくつかの要因が影響します:(1)注入部位の位置:注入部位が視神経乳頭から離れているほど、剥離領域は小さくなります。(2)注入量:20〜25μLの注入量は、ラットの網膜の約半分を剥離することができます。(3)剥離した網膜の品質:網膜変性モデル(P23H、RCSなど)では、神経膠症や網膜下物質の蓄積などの変性過程によって引き起こされる光受容体とRPE細胞との間の抵抗の増加により、剥離が困難な場合があります。このような場合、誘発された網膜剥離は通常平坦であり、OCTスキャンは剥離領域を明確に描写するために重要です。
網膜微小血管を常に完全に回避できるとは限らないため、注射部位に軽度の硝子体内出血が発生する可能性があります(図3E)。しかし、このような出血は通常、網膜下腔には広がりません。
剥離が不十分な場合、問題は術中に認識する必要があり、事前に形成された網膜切開術による即時の再注入が必要です。20匹のラットを用いた実験セッションでは、2人の外科医(1人は経験者、1人は初心者)が段階的な方法を実行しました。経験豊富な外科医は10回中9回成功し、初心者は10回中6回成功しました。

図1:プロセスと結果の概要(A)ラットの眼における網膜下注射プロセスの概略図で、レンズのかなりの体積を示しています。(B,C)注入直後(B)と注入後6日後(C)の眼底撮影。矢印は注入部位を示しています。網膜剥離領域は破線で輪郭が描かれています。(D,E)注入直後 (D) および注入後 6 日間 (E) の光干渉断層撮影 B-スキャン。ON:視神経。倍率:1倍 この図の拡大版を表示するには、ここをクリックしてください。
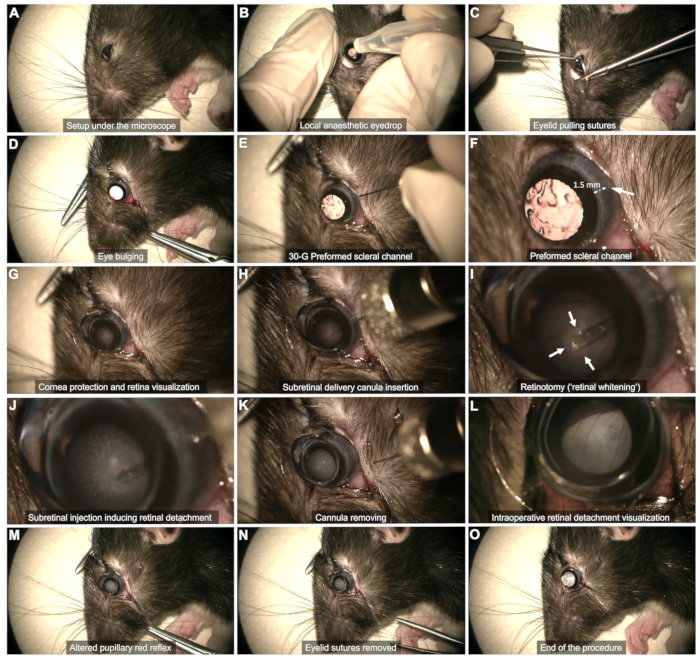
図2:網膜下注射プロトコルの手順。 このプロトコルは、全身麻酔下で8週齢のLong Evansラットで実証されています。各手順の詳細については、ビデオまたはテキストの「プロトコル」セクションを参照してください。 この図の拡大版を表示するには、ここをクリックしてください。

図3:さまざまな術後眼底撮影結果の例(A)注射部位にわずかな色素分散を伴う正常な術後の外観(矢印)。(B) 注射部位に小さな硝子体内気泡がある正常な術後の外観。これらの小さな気泡は注射器から発生し、網膜下腔でも無害です。(C,D)軽度 (C) または重大な (D) レンズ混濁 (白内障) を引き起こすレンズ接触。(E,F)軽度 (E) またはより広範な (F) 硝子体内出血は、注射部位の近くに局在し、網膜下腔には広がりません。(G)注射部位の出血が主に網膜下腔に広がっている。この場合、網膜切開術は網膜血管の損傷を引き起こしました。(H)強膜浸透に起因する広範な硝子体内出血。.倍率:1倍 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この記事では、ラットにおける経硝子体網膜下送達の方法について説明し、注射部位と剥離領域の両方の術中の視覚化と制御を行います。
このプロトコルには、強膜への曝露と網膜切開術という2つの重要なステップがあります。適切なポジショニング、露出、アクセスは、あらゆる外科的処置の基本的な前提条件です。この場合、強膜と注射部位への最適なアクセスを確保することが重要です。強膜への曝露が不十分な場合、その後のステップで回避可能な困難につながる可能性があります。さらに、網膜切開術の質が出血のリスクを決定します。それはできるだけ穏やかに、そして網膜血管からできるだけ離れて行われるべきです。正しく行われれば、重大な硝子体内出血または網膜下出血のリスクは非常に低くなります。
このアプローチを網膜下注射に使用すると、網膜剥離 (RD) の誘導はいくつかの理由で失敗する可能性があります。学習プロセスで最も困難なステップは、注射自体です。注射部位は、液体が網膜切開術を通じて網膜を横切って流れるように慎重に選択する必要があります。げっ歯類の後部硝子体が密集しているため、網膜貫通流に対する物理的な障壁として機能する可能性があります。私たちの経験では、カニューレの先端が網膜に対して約90°の位置にあると、網膜貫通がスムーズに行われます。特に最初のうちは、フルオレセインなどの色付きの溶液を使用して練習し、注入された溶液が網膜下腔にのみ流れることを確認することを強くお勧めします。
この手法には 2 つの制限があります。まず、経硝子体がレンズに触れるリスクがあります。後部水晶体嚢が保存されている場合、白内障の形成につながらないはずなので、レンズタッチは無害である可能性があります。ただし、後水晶体嚢が損傷すると、白内障形成のリスクが高くなり、特に網膜のフォローアップ検査が必要な場合、動物は実験プロジェクトに適さなくなる可能性があります。第二に、この手法はいくつかの段階で出血を引き起こす可能性があり、実験プロセスを妨げる可能性があります。結膜出血はまぶたの縫合糸から生じることがありますが、通常は問題ではなく、綿棒で洗浄することができます。さらに、手術中に2つの網膜切開術が行われますが、どちらも出血のリスクがあります。最初の網膜切開術は、実験者が網膜を盲目(強膜チャネルを介して)しているときに行われるため、強膜穿孔中に硝子体内出血を引き起こし、手順をさらに複雑にする可能性があります。まれに、網膜下出血または脈絡膜出血が発生することがあります。この「侵入網膜切開術」は、角膜9から注入することで回避できますが、このアプローチでは、可能な注射部位の範囲が大幅に制限されます。2回目の網膜切開術は、網膜血管がカニューレの先端に触れると出血のリスクが高くなります。網膜下出血は、血液成分が光受容体に対して有毒であるため、厳重に避けなければなりません10。これらのリスクがあるため、初心者の実験者は、5回に1回から10回に1回の注入の失敗率を予想する必要があります。私たちの経験では、脈絡膜剥離、眼内炎、または筋緊張亢進による網膜損傷の症例は発生していません。
あるいは、網膜下送達のための経強膜アプローチを使用する方法、つまり経硝子体通過を回避する方法が説明されています8,11。しかし、私たちの経験では、これらの手順では、正確で再現性のある注射部位やブレブは得られず、マウスを使用する場合にのみ実施すべきです。さらに、これらの手順では、RDの位置で脈絡膜と網膜色素上皮(RPE)を横切る針によるセルフシール硬化切開が必要です。これにより、網膜下色素の移動のリスクが生じ、炎症性の結果を引き起こし、RDモデル11を歪める可能性があります。さらに、注射器の先端が見えずに注射が行われるため、RDではなく脈絡膜上または脈絡膜下剥離のリスクが高まります。また、意図しない網膜切開術のリスクもあり、特に網膜が薄くて壊れやすい網膜変性モデルを扱う場合、その後の硝子体内送達につながります。
網膜下送達または誘導RDのアプリケーションには、網膜変性モデルまたはRD8,11,12,13,14の場合のさまざまな治療薬の試験が含まれます。どちらの条件でも、この手順の目標は、最終的に人間に発生するプロセスを模倣することです。経強膜アプローチと経硝子体アプローチの両方が、RDの高さと持続時間が十分である限り、RDをモデル化できます15。網膜下送達の場合、現在の方法は、ヒト以外の霊長類16およびヒト5で使用されている方法をより忠実に再現し、それによってデータの翻訳可能性を高めている。
開示事項
S.P:コンサルタントおよび個人の経済的利益-Pixium Vision、GenSight Biologics(これらの活動はいずれも、ここに示されているデータとは関係ありません)。
謝辞
この研究は、IHU FOReSIGHT(パリ)、Fondation Voir & Entendre(パリ)、UNADEV/Aviesan(「コーン光受容体ニューロプロテクション」プロジェクト、パリ)、HyVIS(ジョージア964468)、Fighting Blindness Foundation(FFB PPA Vision Restoration:PPA-0919-0772-INSERM;FFB PPAアッシャー1B:PPA-0922-0840-INSERM)。A.D.の給与は、Fondation pour la Recherche Médicale(助成金番号M2R202106013349、パリ)、Fondation de France(助成金番号WB-2023-49302、パリ)、およびフランス眼科学会からの助成金によって提供されました。スポンサーまたは資金提供組織は、この研究の設計または実施に何の役割も果たしていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
参考文献
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved