Method Article
Visualisation peropératoire de l’injection sous-rétinienne et du décollement de la rétine chez le rat
Dans cet article
Résumé
Cet article décrit les méthodes d’injection sous-rétinienne chez le rat, en utilisant la visualisation peropératoire pour contrôler à la fois le site d’injection et la zone de décollement de la rétine.
Résumé
L’injection sous-rétinienne, c’est-à-dire l’administration d’une solution entre les photorécepteurs et l’épithélium pigmentaire rétinien (EPR), crée un espace sous-rétinien où les composants sont en contact direct avec les photorécepteurs et les cellules EPR. Cette méthode d’administration permet un traitement ciblé de ces cellules. Des traitements pour l’injection sous-rétinienne ont été développés et approuvés, en particulier pour les maladies rétiniennes héréditaires. Chez les animaux, les procédures d’injection sous-rétinienne peuvent être difficiles en raison de la taille du cristallin, en particulier chez les rongeurs. Cet article décrit les méthodes d’injection sous-rétinienne chez le rat, permettant la visualisation et le contrôle peropératoires du site d’injection et de la taille de la zone détachée, comme cela est fait chez l’homme. L’intervention est réalisée sous anesthésie générale et locale et nécessite une dilatation de la pupille. À l’aide d’un microscope ophtalmique, l’injection sous-rétinienne est effectuée à travers un canal scléral de 30 G, l’extrémité de la canule étant doucement appliquée sur la rétine pour créer une rétinotomie. Des volumes allant de 10 à 25 μL peuvent être délivrés, ce qui correspond à deux cinquièmes à la moitié de la rétine du rat. Les examens postopératoires immédiats à l’aide de la photographie du fond d’œil et de la tomographie par cohérence optique confirment la réussite de l’accouchement dans l’espace sous-rétinien avec du liquide sous-rétinien visible. Les principaux risques de cette procédure comprennent les lésions du cristallin (cataracte), l’échec du décollement, l’hémorragie intravitréenne, l’hémorragie sous-rétinienne et la kératite postopératoire. En plus d’administrer des traitements dans l’espace sous-rétinien, cette technique est utilisée pour induire un décollement de la rétine à court ou à long terme à l’aide de produits aqueux ou visqueux, respectivement. Contrairement à l’approche transsclérale, cette méthode permet un positionnement peropératoire précis du décollement de la rétine.
Introduction
La rétine est un tissu neuronal sensible à la lumière situé dans la partie interne et postérieure du globe oculaire. La couche externe de la neurorétine contient des photorécepteurs, qui sont des neurones spécialisés dédiés à la conversion de la lumière en signaux électrochimiques et sont donc essentiels à la vision. L’épithélium pigmentaire rétinien (EPR), situé sous la neurorétine, fournit un soutien métabolique étendu aux photorécepteurs, facilitant la régénération visuelle des pigments et le renouvellement régulier de leurs segments externes1.
La dégénérescence des photorécepteurs est la cause la plus fréquente de perte de vision irréversible et se produit dans diverses maladies rétiniennes, telles que la dégénérescence maculaire liée à l’âge, la rétinite pigmentaire, la rétinopathie diabétique et le décollement de la rétine 1,2,3,4. La plupart de ces affections résultent d’une perte primaire ou secondaire de photorécepteurs, souvent secondaire à une perte ou à un dysfonctionnement de l’EPR. Par conséquent, il est particulièrement important d’étudier les photorécepteurs et les cellules RPE in vivo pour prévenir leur dégénérescence. À ce jour, il n’existe aucun traitement efficace pour de nombreuses maladies de la rétine, telles que les dystrophies rétiniennes (y compris la rétinite pigmentaire) ou la dégénérescence maculaire (y compris la dégénérescence maculaire liée à l’âge).
L’injection sous-rétinienne, c’est-à-dire l’administration d’une solution entre les photorécepteurs et l’EPR, crée un espace sous-rétinien où les composants sont en contact direct avec les photorécepteurs et les cellules EPR. Cette méthode d’administration permet un traitement ciblé de ces cellules, en contournant diverses barrières rétiniennes ou vasculaires. Plusieurs traitements pour l’administration sous-rétinienne ont été développés et approuvés, en particulier pour les maladies rétiniennes héréditaires 5,6.
Il est important d’harmoniser les pratiques chirurgicales pour l’accouchement sous-rétinien. Chez l’homme, la procédure standard implique une vitrectomie 25 G pars plana, qui permet un accès relativement facile au segment postérieur de l’œil car le cristallin est petit par rapport à l’œil entier. L’administration sous-rétinienne est effectuée à travers un trocart de 25 G à l’aide d’une canule biocompatible à embout en silicone de 38 G ou 41 G, permettant un flux transrétinien fluide5.
Chez les animaux, les procédures d’injection sous-rétinienne peuvent être difficiles en raison de la taille du cristallin. Par exemple, chez les rongeurs, le cristallin occupe jusqu’à 90 % de la cavité vitrée. Chez le rat, le cristallin prend moins de place que chez la souris mais reste important (voir Figure 1A). De plus, les injections sous-rétiniennes peuvent être utilisées pour modéliser le décollement de la rétine (DR) en utilisant des solutions visqueuses pour empêcher l’élimination du liquide sous-rétinien par les cellules RPE 7,8. Ces modèles sont principalement utilisés dans le développement de traitements pour les maladies de la rétine.
Cet article décrit des méthodes d’administration sous-rétinienne ou de DR induite chez le rat, permettant un contrôle peropératoire total du site d’injection et de la zone rétinienne détachée.
Protocole
Les expériences et les procédures ont été approuvées par le Comité local d’éthique animale et menées dans des installations associées au laboratoire, conformément à la législation locale. Tous les travaux expérimentaux ont respecté les politiques institutionnelles en matière de biosécurité et de procédures de sûreté (Comité Local d’Éthique Animale Charles Darwin, CEEACD #5) et ont suivi la Directive Européenne 2010/63/UE. Des rats Long Evans femelles de type sauvage de huit semaines (Rattus norvegicus) ont été utilisés dans cette étude. Divers modèles de dégénérescence rétinienne de rats, tels que P23H et RCS, peuvent être utilisés pour tester l’administration sous-rétinienne de différents traitements, y compris les médicaments et les thérapies géniques. Les détails des réactifs et de l’équipement utilisés dans cette étude sont fournis dans la table des matériaux.
1. Préparation des solutions
- Administration sous-rétinienne : Diluer des molécules dans du PBS ou du diméthylsulfoxyde pour une administration sous-rétinienne aqueuse.
- Induction de la DR : Utiliser de l’hydroxypropylméthylcellulose à 2 % ou de l’hyaluronate de sodium à 1 % à 5 % pour induire la DR à long terme.
2. Dispositif expérimental
- Montez une pointe métallique de canule non biseautée de 10 mm 30 G cimentée sur une seringue de 10 μL ou 25 μL sur un micro-injecteur.
- Chargez la solution préparée dans la seringue.
3. Préparation des animaux
- Anesthésie
- Anesthésie générale : Anesthésier les rats avec une injection intrapéritonéale de 40 mg/kg de kétamine et de 0,14 mg/kg de médétomidine.
REMARQUE : Cette anesthésie dure suffisamment longtemps pour la durée de l’intervention et pour les explorations postopératoires immédiates. - Dilatation de la pupille : Mettre une goutte de tropicamide à 0,5 % pour obtenir une mydriase dans un œil.
REMARQUE : Pour les chirurgiens droitiers, la procédure sera plus facile dans l’œil gauche, et vice versa. - Anesthésie locale ( Figure 2B) : Mettez un collyre d’oxybuprocaïne dans l’œil à opérer.
- Anesthésie générale : Anesthésier les rats avec une injection intrapéritonéale de 40 mg/kg de kétamine et de 0,14 mg/kg de médétomidine.
4. La chirurgie au microscope
- Visualisation peropératoire : Utilisez un microscope ophtalmique connecté à une pédale pour effectuer l’opération.
- Exposition sclérale (Figure 2C,D)
- Utilisez deux sutures de traction des paupières (5-0 ou 6-0) ancrées au quart externe du bord palpébral au niveau des paupières supérieures et inférieures.
- Tirez sur les sutures pour obtenir un renflement doux de l’œil.
- Canal scléral (Figure 2E,F) : À l’aide d’une aiguille de 30 G, créez un canal scléral à travers la conjonctive bulbaire temporale, à environ 1 à 2 mm du limbe cornéen.
REMARQUE : Insérez à peine la pointe de l’aiguille biseautée sans la pousser davantage pour éviter le risque de contact avec la lentille et de cataracte ultérieure. Observez l’hémorragie conjonctivale pendant des dizaines de secondes à ce stade. Évitez de tamponner le saignement, car cela peut provoquer une accumulation de sang dans le vitré et compromettre la procédure. Essuyez doucement tout sang dans la zone du canal ou qui gêne la visualisation à l’aide d’un coton-tige. - Protection de la cornée (Figure 2G) : Utilisez un gel lacrymal comme interface œil-lentille tout au long de la procédure.
- Visualisation du plan rétinien (Figure 2G)
- Placez une lentille de contact plate (8 mm de diamètre) sur la surface de l’œil pour visualiser le plan rétinien avec un grossissement approprié.
- Utilisez la pédale du microscope pour faire la mise au point sur le plan rétinien.
- Injection sous-rétinienne (Figure 2H - M)
- Insérez la canule verticalement à travers le canal scléral préformé (Figure 2H).
- Évitez de toucher le cristallin en gardant la canule verticale.
- Approchez-vous lentement de la rétine et appuyez doucement dessus jusqu’à ce qu’un blanchiment rétinien soit observé (flèches sur la figure 2I).
- Maintenir la stabilité de l’embout pendant l’injection à travers la rétinotomie formée par le flux d’injection (Figure 2J). Évitez de retirer l’embout trop tôt de la rétinotomie, car cela entraînerait l’injection du produit dans le vitré.
- Après l’injection, retirez l’extrémité de la rétinotomie, puis retirez doucement toute la canule de la cavité vitrée, en veillant à ce que le cristallin ne soit pas touché (Figure 2K).
REMARQUE : Si la bulle n’est pas suffisamment développée ou si la zone rétinienne détachée est trop restreinte une fois la seringue vide, effectuez une réinjection en utilisant le même canal scléral et en insérant l’embout dans la rétinotomie précédemment formée. - Assurez-vous que le réflexe rouge pupillaire est altéré par le décollement de la rétine sans observer le flux sanguin dans la cavité vitrée (Figure 2L,M).
- Fin de l’intervention (Figure 2N,O)
- Retirez les sutures des paupières et écouvillonnez soigneusement tout saignement (Figure 2N).
- Évaluez brièvement la pression intraoculaire manuellement.
REMARQUE : Une petite quantité de liquide vitré peut émerger dans l’espace sous-conjonctival, mais aucune fuite active ne doit se produire (Figure 2O).
5. Soins postopératoires et réveil
- Appliquez la pommade oculaire au chloramphénicol-rétinol sur l’œil opéré.
- Administrer 1 mL de glucose monohydraté à 5 % par voie intrapéritonéale.
- Injecter 0,9 mg/kg d’atipamézole par voie sous-cutanée.
- Placez l’animal dans une chambre à température contrôlée et surveillez-le jusqu’à ce qu’il se réveille.
Résultats
Le succès d’une injection sous-rétinienne repose sur une administration précise et exclusive dans l’espace sous-rétinien (c’est-à-dire entre les photorécepteurs et les couches de l’EPR) par le biais de la rétinotomie, évitant ainsi l’hémorragie sous-rétinienne, car le sang est toxique pour les photorécepteurs et les cellules de l’EPR. La réussite de l’accouchement est confirmée par la visualisation peropératoire (Figure 2L), la photographie du fond d’œil postopératoire immédiate et la tomographie par cohérence optique (OCT). La photographie du fond d’œil exclut la possibilité d’une hémorragie sous-rétinienne, tandis que les B-scans OCT confirment le décollement de la rétine (DR) avec un liquide sous-rétinien clair (Figure 1 et Figure 3). De plus, la photographie du fond d’œil peut identifier le contact du cristallin ou les cataractes induites qui peuvent passer inaperçues pendant la procédure (Figure 3C, D). La photographie et les tomodensitogrammes permettent d’estimer la taille de la zone détachée ou de la bulle (figure 1B-E).
Plusieurs facteurs influencent la taille de la bulle : (1) Emplacement du site d’injection : plus le site d’injection est éloigné du disque optique, plus la zone détachée est petite ; (2) Volume injecté : Un volume d’injection de 20 à 25 μL peut détacher environ la moitié de la rétine chez le rat ; (3) Qualité de la rétine détachée : Dans les modèles de dégénérescence rétinienne (par exemple, P23H, RCS), le décollement peut être difficile en raison de la résistance accrue entre les photorécepteurs et les cellules RPE causée par des processus dégénératifs, tels que la gliose et l’accumulation de matériel sous-rétinien. Dans de tels cas, les décollements de rétine induits sont généralement plats et les tomodensitogrammes sont cruciaux pour délimiter clairement la zone détachée.
Une hémorragie intravitréenne mineure peut survenir au point d’injection, car les microvaisseaux rétiniens ne peuvent pas toujours être complètement évités (Figure 3E). Cependant, ces hémorragies ne s’étendent généralement pas dans l’espace sous-rétinien.
En cas de détachement insuffisant, le problème doit être reconnu en peropératoire, nécessitant une réinjection immédiate par la rétinotomie préformée. Au cours d’une séance expérimentale avec 20 rats, deux chirurgiens (un expérimenté et un débutant) ont effectué la méthode étape par étape. Le chirurgien expérimenté a réussi dans 9 procédures sur 10, tandis que le débutant a réussi dans 6 procédures sur 10.

Figure 1 : Vue d’ensemble du processus et des résultats. (A) Représentation schématique du processus d’injection sous-rétinienne dans un œil de rat, montrant le volume significatif du cristallin. (B, C) Photographie du fond d’œil immédiatement après l’injection (B) et 6 jours après l’injection (C). Les pointes de flèche indiquent le site d’injection. La zone de décollement de la rétine est délimitée par une ligne pointillée. (D, E) La tomographie par cohérence optique B-scans est immédiatement après l’injection (D) et 6 jours après l’injection (E). ON : nerf optique. Grossissement : 1x. Veuillez cliquer ici pour voir une version plus grande de cette figure.
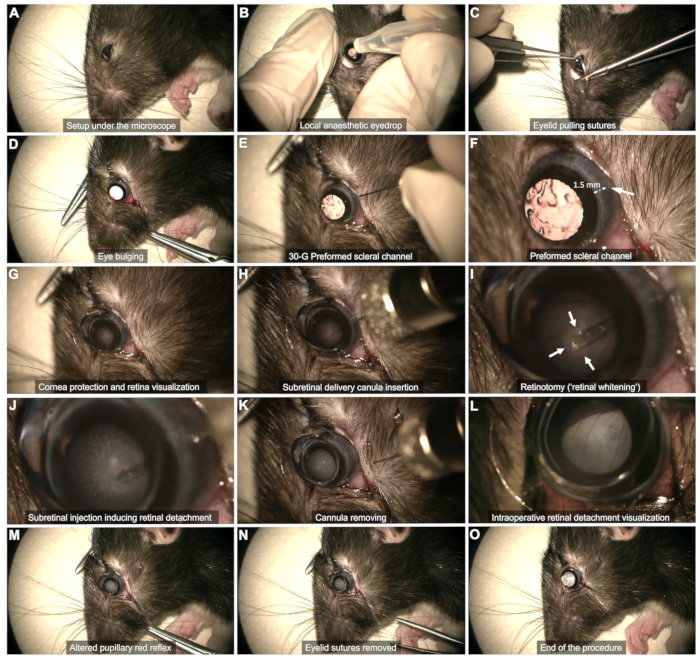
Figure 2 : Étapes du protocole d’injection sous-rétinienne. Le protocole est démontré chez un rat Long Evans âgé de 8 semaines sous anesthésie générale. Pour une description détaillée de chaque étape, reportez-vous à la vidéo ou à la section « Protocole » dans le texte. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Exemples de divers résultats de photographie du fond d’œil postopératoire. (A) Aspect postopératoire normal avec une dispersion mineure des pigments au site d’injection (flèche). (B) Aspect postopératoire normal avec une petite bulle d’air intravitréen au site d’injection. Ces petites bulles d’air proviennent de la seringue et sont inoffensives, même dans l’espace sous-rétinien. (C, D) Toucher du cristallin entraînant une opacification mineure (C) ou significative (D) du cristallin (cataracte). (E, F) Saignement intravitréen mineur (E) ou plus étendu (F) localisé près du site d’injection, sans propagation dans l’espace sous-rétinien. (G) Saignement au point d’injection se propageant principalement dans l’espace sous-rétinien. Dans ce cas, la rétinotomie a causé une lésion d’un vaisseau sanguin rétinien. (H) Hémorragie intravitréenne étendue résultant d’une pénétration sclérale. Grossissement : 1x. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Cet article décrit les méthodes d’administration sous-rétinienne transvitréenne chez le rat avec visualisation et contrôle peropératoires du site d’injection et de la zone détachée.
Ce protocole comporte deux étapes critiques : l’exposition sclérale et la rétinotomie. Un positionnement, une exposition et un accès appropriés sont des conditions préalables fondamentales à toute intervention chirurgicale. Dans ce cas, il est crucial d’assurer un accès optimal à la sclérotique et au site d’injection. Une exposition sclérale insuffisante peut entraîner des difficultés évitables dans les étapes ultérieures. De plus, la qualité de la rétinotomie détermine le risque d’hémorragie. Il doit être effectué aussi doucement que possible et aussi loin que possible de tout vaisseau rétinien. Si cela est fait correctement, le risque d’hémorragie intravitréenne ou sous-rétinienne importante est très faible.
Lors de l’utilisation de cette approche pour l’injection sous-rétinienne, l’induction du décollement de la rétine (DR) peut échouer pour plusieurs raisons. L’étape la plus difficile du processus d’apprentissage est l’injection elle-même. Le site d’injection doit être soigneusement choisi pour permettre au liquide de s’écouler à travers la rétine à travers la rétinotomie. En raison de la densité du corps vitré postérieur chez les rongeurs, il peut agir comme une barrière physique au flux transrétinien. D’après notre expérience, la pénétration transrétinienne se produit en douceur lorsque l’extrémité de la canule est positionnée à environ 90° par rapport à la rétine. Il est fortement recommandé, surtout au début, de s’entraîner à utiliser des solutions colorées, telles que la fluorescéine, pour confirmer que la solution injectée ne s’écoule que dans l’espace sous-rétinien.
Deux limites de cette technique peuvent être identifiées. Tout d’abord, le passage transvitréen risque de toucher le cristallin. Un toucher du cristallin peut être inoffensif si la capsule postérieure du cristallin est préservée, car il ne devrait pas entraîner la formation d’une cataracte. Cependant, si la capsule postérieure du cristallin est endommagée, le risque de formation de cataracte est élevé et l’animal peut ne plus convenir au projet expérimental, en particulier si des examens de suivi rétinien sont nécessaires. Deuxièmement, cette technique peut entraîner des saignements à plusieurs stades, ce qui pourrait entraver le processus expérimental. Des saignements conjonctivals peuvent résulter des sutures de la paupière, bien que cela ne pose généralement pas de problème et puisse être nettoyé avec un coton-tige. De plus, deux rétinotomies sont effectuées au cours de la procédure, qui comportent toutes deux un risque d’hémorragie. La première rétinotomie est réalisée alors que l’expérimentateur est aveugle à la rétine (par le canal scléral), ce qui peut entraîner une hémorragie intravitréenne lors de la perforation sclérale, ce qui complique encore la procédure. Rarement, des saignements sous-rétiniens ou choroïdiens peuvent survenir. Cette « rétinotomie d’entrée » peut être évitée en injectant à travers la cornée9, bien que cette approche limite considérablement la gamme de sites d’injection possibles. La deuxième rétinotomie présente un risque plus élevé de saignement si les vaisseaux rétiniens sont touchés par l’extrémité de la canule. L’hémorragie sous-rétinienne doit être strictement évitée, car les composants sanguins sont toxiques pour les photorécepteurs10. En raison de ces risques, les expérimentateurs novices doivent s’attendre à un taux d’échec de 1 sur 5 à 1 sur 10 injections. D’après notre expérience, aucun cas de décollement choroïdien, d’endophtalmie ou de lésion rétinienne induite par l’hypertonie n’a été rencontré.
Alternativement, des méthodes utilisant des approches transsclérales pour l’administration sous-rétinienne, qui évitent le passage transvitréen, ont été décrites 8,11. Cependant, d’après notre expérience, ces procédures ne permettent pas d’obtenir des sites d’injection ou des bulles précis ou reproductibles et ne doivent être effectuées qu’avec des souris. De plus, ces procédures nécessitent une incision sclérale auto-obturante avec une aiguille qui traverse la choroïde et l’épithélium pigmentaire rétinien (EPR) à l’emplacement du DR. Cela pose un risque de migration pigmentaire sous-rétinienne, ce qui peut entraîner des conséquences inflammatoires et peut déformer le modèle DR11. De plus, l’injection est effectuée sans visibilité de l’extrémité de la seringue, ce qui augmente le risque de décollement supra ou sous-choroïdien plutôt que de DR. Il existe également un risque de rétinotomie involontaire, entraînant une administration intravitréenne ultérieure, en particulier lorsque l’on travaille avec des modèles de dégénérescence rétinienne qui ont des rétines plus fines et plus fragiles.
Les applications de l’administration sous-rétinienne ou de la DR induite comprennent l’essai de diverses thérapies sur des modèles de dégénérescence rétinienne ou dans les cas de DR 8,11,12,13,14. Dans les deux cas, l’objectif de la procédure est d’imiter les processus qui se produisent finalement chez l’homme. Les approches transsclérale et transvitrée peuvent modéliser la DR, à condition que la hauteur et la durée de la DR soient suffisantes15. Dans le cas de l’administration sous-rétinienne, les méthodes actuelles reproduisent plus fidèlement celles utilisées chez les primates non humains16 et les humains5, améliorant ainsi la traduisibilité des données.
Déclarations de divulgation
S.P : Consultant et intérêts financiers personnels - Pixium Vision, GenSight Biologics (aucune de ces activités n’a de rapport avec les données présentées ici).
Remerciements
Cette étude a été soutenue par l’IHU FOReSIGHT (Paris), la Fondation Voir & Entendre (Paris), l’UNADEV/Aviesan (dans le cadre du projet « neuroprotection des photorécepteurs coniques », Paris), HyVIS (GA 964468), la Fondation Combattre la Cécité (FFB PPA Vision Restoration : PPA-0919-0772-INSERM ; FFB PPA Usher 1B : PPA-0922-0840-INSERM). Les salaires de A.D. ont été financés par des subventions de la Fondation pour la Recherche Médicale (subvention numéro M2R202106013349, Paris), de la Fondation de France (subvention numéro WB-2023-49302, Paris) et de la Société Française d’Ophtalmologie. Le commanditaire ou les organismes de financement n’ont joué aucun rôle dans la conception ou la réalisation de cette recherche.
matériels
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
Références
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon