Method Article
Coloração viva/morta para quantificar células viáveis, mas não cultiváveis, em bactérias causadoras de feridas tratadas com mel de Manuka
Neste Artigo
Resumo
O protocolo apresentado descreve um procedimento para quantificar células viáveis, mas não cultiváveis (VBNC) em culturas bacterianas tratadas com mel de Manuka.
Resumo
A resistência e tolerância a antibióticos entre as bactérias representam uma ameaça significativa à saúde global. Os mecanismos que contribuem para a resistência e tolerância aos antibióticos incluem mutações genéticas e aquisição de genes de resistência e transição para Viável, mas não cultivável (VBNC) e outros estados de dormência, respectivamente. Embora geneticamente idênticas às suas contrapartes não tolerantes a antibióticos, as células VBNC evitam os efeitos dos antibióticos permanecendo metabolicamente inativas. Os antibióticos são eficazes apenas quando seus processos-alvo, como replicação ou transcrição de DNA, estão ativos. Como os estressores ambientais, particularmente os antibióticos, podem levar as bactérias à dormência, são necessários antimicrobianos alternativos para minimizar ou prevenir essa resposta. O antimicrobiano Mel de Manuka (MH) é eficaz contra muitas bactérias, com raro desenvolvimento de resistência. Seus mecanismos antimicrobianos multifacetados o tornam um agente valioso para o tratamento de infecções bacterianas. Esta pesquisa investigou a recalcitrância da HM ao desenvolvimento de resistência a antibióticos, testando a hipótese de que a HM induz menos células VBNC do que os antibióticos convencionais. Para investigar isso, foi desenvolvido um protocolo para tratar as bactérias causadoras de feridas Staphylococcus aureus e Pseudomonas aeruginosa com concentrações inibitórias mínimas de HM ou os antibióticos convencionais tobramicina ou meropenem, que então usaram a contagem de placas viáveis para identificar células cultiváveis metabolicamente ativas e coloração viva/morta para identificar todas as células viáveis. O número de células VBNC foi igual ao número de células viáveis menos o número de células cultiváveis. Em alguns experimentos, o número de células cultiváveis foi maior do que o número de células viáveis, dando um número negativo de células VBNC; assim, o número de células VBNC não foi comparado diretamente. Em vez disso, os números de células cultiváveis e viáveis foram comparados para cada tratamento. Apenas P. aeruginosa tratada com tobramicina apresentou significativamente menos células cultiváveis do que células viáveis, indicando um maior número de células VBNC. Este protocolo é rápido e fácil e pode ser usado para avaliar a indução de células VBNC por MH em outras bactérias patogênicas.
Introdução
As bactérias no estado de dormência Viável, Mas Não Cultivável (VBNC) sobrevivem ao tratamento com antibióticos e causam doenças infecciosas recorrentes e às vezes mortais 1,2,3. Mais familiar para nós é a resistência aos antibióticos, que ocorre por meio de uma alteração genética hereditária4. A alteração genética fornece resistência a um antibiótico específico por vários mecanismos, incluindo limitar a captação de um antibiótico, aumentar o efluxo do antibiótico, modificar o alvo do antibiótico ou inativar o antibiótico4. Por outro lado, as bactérias em estados de dormência exibem uma tolerância a antibióticos mais ampla e não hereditária, reduzindo seu metabolismo 2,3. Os antibióticos têm como alvo processos metabólicos específicos, incluindo replicação de DNA e síntese da parede celular, e são ineficazes contra células VBNC metabolicamente inativas4. As células VBNC existem estocásticamente em baixo número ao lado de seus irmãos geneticamente idênticos suscetíveis a antibióticos na maioria das populações bacterianas5. No entanto, estressores ambientais, incluindo a exposição a antibióticos, induzem células bacterianas suscetíveis a entrar no estado VBNC tolerante a antibióticos 3,6. O tratamento com antibióticos matará as células suscetíveis a antibióticos dentro da população, enquanto as células VBNC dormentes permanecem. Como o próprio nome sugere, as células VBNC não são cultiváveis em meios adequados para o crescimento de seus irmãos metabolicamente ativos. No entanto, suas membranas e material genético não estão danificados e podem se reproduzir 7,8. Quando os antibióticos são removidos, estímulos específicos, como nutrientes, temperatura ou fatores do hospedeiro, são necessários para acordar as células VBNC de seu estado de dormência e restaurar o crescimento 3,9. As células VBNC foram documentadas em muitas espécies bacterianas patogênicas, incluindo P. aeruginosa e S. aureus, principais agentes etiológicos de infecções de feridas10,11.
O mel tem sido usado há muito tempo em aplicações médicas, incluindo tratamento de feridas, devido às suas propriedades antibacterianas12. O mel de Manuka (MH), derivado de flores do arbusto de Manuka (Leptospermum scoparium), tem sido conhecido por sua atividade bactericida de amplo espectro (revisado em 13,14,15). Ele mata com sucesso a maioria das bactérias causadoras de infecções humanas testadas, incluindo cepas bacterianas como Staphylococcus aureus resistente à meticilina e Enterococcus resistente à vancomicina que exibem resistência hereditária aos antibióticos tradicionais16,17. Além disso, a resistência bacteriana induzida à HM é rara, sendo detectada apenas em biofilmes de P. aeruginosa expostos ao mel e Escherichia coli cultivados em concentrações crescentes de um subconjunto do mel testado 18,19,20,21. Isso sugere que os mecanismos antimicrobianos da HM são distintos dos antibióticos convencionais e podem induzir menos ou nenhuma célula VBNC. Essa hipótese foi testada determinando como o MH afeta as populações de VBNC em comparação com os antibióticos convencionais.
As células VBNC devem ser distinguidas de seus irmãos cultiváveis metabolicamente ativos e células mortas. As células cultiváveis são contadas usando a técnica de contagem de placas viáveis, onde as células são transferidas para meios de cultura de rotina e incubadas por um período suficiente para divisões celulares suficientes para resultar em colônias observáveis. Vários métodos para distinguir células VBNC de células mortas foram desenvolvidos com base em suas membranas intactas e transcrição de baixo nível. A captação de substrato e corante fluorescente, combinada com microscopia ou citometria de fluxo, permite a contagem direta de células por microscopia ou citometria de fluxo com uma cor que indica membranas intactas22,23. Ensaios de respiração que requerem que a cadeia de transporte de elétrons esteja presente em uma membrana celular intacta também têm sido usados para distinguir entre células viáveis e mortas24. Métodos de PCR quantitativo (qPCR) combinados com corantes modificadores de DNA que impedem a amplificação também foram desenvolvidos; apenas o DNA de células viáveis será amplificado, pois as membranas intactas excluem o corante25. Embora as células VBNC estejam dormentes, elas ainda transcrevem genes em um nível baixo, e isso também pode ser usado para distingui-las de células mortas usando PCR de transcrição reversa26.
Neste trabalho, foi desenvolvido um ensaio para quantificar células VBNC em duas bactérias patogênicas causadoras de feridas, S. aureus e P. aeruginosa, tratadas com HM. Descreve o tratamento da bactéria com HM e antibióticos convencionais e o uso da contagem de placas viáveis e coloração viva/morta para detectar células cultiváveis e viáveis. Este protocolo fácil e barato permitirá a análise da capacidade da MH de induzir células VBNC resistentes a antibióticos em muitos patógenos bacterianos.
Protocolo
Como P. aeruginosa (ATCC9721) e S. aureus (ATCC29213) são classificados como agentes de nível 2 de biossegurança, as salas onde o trabalho é realizado devem ter acesso limitado e estar equipadas com uma cabine de biossegurança para manipulações que possam criar respingos ou aerossóis, como culturas agitadoras e centrifugadoras. Em todas as etapas deste protocolo, use equipamento de proteção individual (EPI), incluindo jaleco, óculos de proteção e luvas. Todos os reagentes e equipamentos usados nos experimentos estão listados na Tabela de Materiais.
1. Preparação de caldo estéril e meio de cultura de ágar
- Prepare Luria Bertani e Mueller Hinton, NaCl (0,85%), antibióticos e copos.
- Prepare o meio de caldo de acordo com as instruções do fabricante, adicionando pó de ágar a 1,5% para o meio de ágar. Adicione 0,85 g de NaCl a 100 mL de dH20 para preparar 0,85% de NaCl. Aplique fita adesiva nos recipientes, coloque-os em um recipiente seguro para autoclave e autoclave-os em um ciclo líquido apropriado para os volumes utilizados.
- Quando o ciclo de autoclave estiver concluído, resfrie o ágar a aproximadamente 60 ° C antes de despejá-lo em placas de Petri estéreis.
- Preparar 100 μg/ml de soluções-mãe dos antibióticos tobramicina e meropenem em dH2O para diluição e tratamento de bactérias. Esterilize os estoques de antibióticos usando uma seringa estéril de 5 mL conectada a um filtro estéril de 0,2 μm.
- Armazene os estoques de antibióticos esterilizados a -20 °C em várias alíquotas pequenas para evitar a perda de atividade devido a vários ciclos de congelamento e descongelamento.
2. Recuperando as cepas arquivadas de Staphylococcus aureus e Pseudomonas aeruginosa de -80 ° C (Dia 1)
- Reúna os materiais para listrar uma pequena alíquota das cepas bacterianas congeladas de seus frascos congelados de 80 ° C para ágar Luria Bertani (LB). Isso inclui vários bastões de madeira estéreis e uma placa de ágar LB rotulada com o organismo e a data.
- Abra o freezer a -80 °C, remova rapidamente os frascos de interesse e feche a porta do freezer. Abra cada frasco sequencialmente e use um bastão estéril para raspar uma pequena quantidade de bactérias congeladas na placa de ágar LB devidamente rotulada. Recoloque a tampa do frasco e devolva-a rapidamente ao freezer a -80 °C.
- Incubar as placas de ágar-LB inoculadas, com o lado do ágar voltado para cima, a 37 °C em condições aeróbias (atmosféricas) durante 18-24 h. Após o período de incubação, selar as placas de ágar-LB inoculadas com fita adesiva e conservá-las a 4 °C durante uma semana não superior. Inocular semanalmente culturas bacterianas frescas do material congelado a -80 °C, conforme necessário.
3. Preparação de S. aureus e P. aeruginosa para tratamento com Mel de Manuka (MH) e antibiótico (Dia 2)
- Reúna os materiais necessários para iniciar uma cultura de caldo LB de cada cepa, incluindo pequenos tubos de ensaio estéreis, pipetas sorológicas de 5 mL, caldo LB estéril e uma alça de inoculação. Além disso, reúna uma pipeta manual ou elétrica para uso com pipetas sorológicas, um bico de Bunsen e uma incubadora agitada.
- Trabalhando próximo à chama do bico de Bunsen, use uma pipeta sorológica para transferir 2 mL de caldo LB para dois tubos de ensaio estéreis. Esterilize a alça de inoculação na chama do bico de Bunsen e, em seguida, transfira um quarto de alça cheia de bactérias das placas de ágar LB para o tubo de ensaio devidamente rotulado com caldo LB.
- Incubar o tubo de ensaio em condições aeróbicas em uma incubadora agitada (~250 rpm) a 37 °C por 18-24 h.
4. Preparação de HM e estabelecimento de tratamentos com HM e antibióticos de S. aureus e P. aeruginosa (T = 0) (Dia 3)
- Reúna os materiais necessários para o experimento, incluindo caldo Mueller Hinton e placas de ágar, as culturas bacterianas de caldo LB do Dia 2, tubos de ensaio estéreis, estoques de antibióticos no gelo, pipetas (P20, P200 e P1000) e pontas, tubos de 15 mL, pipetas sorológicas e um pipetador e tubos de microcentrífugas.
- Preparar as soluções-mãe de MH a 25% e 50% frescas no dia em que a experiência é montada. Com base na densidade de MH (1,47 g/mL), pesar a quantidade apropriada de MH em um tubo estéril de 15 mL e adicionar a quantidade apropriada de caldo Mueller Hinton estéril. Ressuspenda o MH colocando os tubos em água morna e invertendo-os conforme necessário.
- Prepare uma diluição de 1:1000 (aproximadamente 106 UFC/mL) das culturas bacterianas durante a noite em tubos estéreis de 15 mL, adicionando 10 μL da cultura bacteriana a 10 mL de caldo Mueller Hinton.
- Use as culturas diluídas para preparar três amostras para cada espécie bacteriana: um controle não tratado, uma amostra tratada com MH (na concentração inibitória mínima, CIM) e uma amostra tratada com antibiótico (tobramicina para S. aureus ou meropenem para P. aeruginosa, na CIM).
- Adicionar a cultura bacteriana diluída, HM e antibiótico adequado às amostras nos volumes indicados nas tabelas 1 e 2.
- Transfira 0,1 mL e 0,5 mL da amostra não tratada para tubos de microcentrífuga estéreis para a contagem de placas viáveis (etapa 5) e coloração viva/morta (etapa 6), respectivamente, para as amostras T = 0.
- Incubar as amostras de controlo não tratadas, tratadas com HM e tratadas com antibióticos (tobramicina ou meropeném) em condições aeróbias a 37 °C numa incubadora agitável (250 rpm) durante 24 h. Conduza as técnicas de contagem de placas viáveis (etapa 5) e coloração viva/morta (etapa 6) nas amostras não tratadas T = 0.
5. Determinação das células cultiváveis em amostras usando o método de contagem de placas viáveis (Dia 3 - 5)
- No dia 4, após a incubação da amostra de 24 horas, colete 0,1 mL e 0,5 mL de cada amostra em tubos de microcentrífuga para a contagem de placas viáveis e coloração viva/morta (etapa 6), respectivamente. Estas serão as amostras T = 24 h.
- Conduza a contagem de placas viáveis em amostras T = 0 e T = 24 h no dia em que são coletadas, preparando diluições de 10 vezes das amostras de contagem de placas viáveis em caldo LB para obter um número contável de células (~ 25-150).
- Espalhe 50 μL de cada amostra diluída em 1/2 de uma placa de ágar LB. Incubar as placas de ágar-ágar LB em condições aeróbias a 37 °C durante 24 h.
- No dia seguinte, remova as placas de ágar LB da incubadora e identifique a placa de diluição que tem ~ 25-150 colônias. Conte o número exato de colônias na placa e use a fórmula das unidades formadoras de colônias (UFC) (UFC/mL = # colônias contadas/ (volume plaqueado, mL) (diluição usada)) para determinar o número de células cultiváveis por mL.
NOTA: A amostra T = 0 será plaqueada no Dia 3 e analisada no Dia 4; as amostras T = 24 h serão plaqueadas no Dia 4 e analisadas no Dia 5.
6. Determinação das células viáveis nas amostras usando coloração viva/morta e microscopia fluorescente (Dia 3 ou 4)
- Reúna os materiais necessários para a coloração viva/morta, incluindo NaCl estéril a 0,85% para manter um ambiente osmótico favorável para células, pipetas (P20, P200 e P1000) e pontas de pipeta estéreis, um kit de coloração viva/morta para bactérias e um hemocitômetro descartável. Obtenha acesso a um microscópio fluorescente com um conjunto de filtros de isotiocianato de fluoresceína (FITC) para detectar o corante SYTO 9, que cora células vivas.
- Adicione 0,5 mL de NaCl a 0,85% a 0,5 mL de cada uma das seguintes amostras vivas/mortas: todas as amostras não diluídas T = 0, T não diluído = 24 h MH e amostras tratadas com antibióticos e uma diluição de 1:1000 da amostra controle não tratada T = 24 h.
- Assegurar a multiplicação da contagem final de células vivas de todas as amostras por dois e multiplicar por 1000 o controlo diluído T = 24 h não tratado. Combine 1,5 μL de SYTO 9 e 1,5 μL de iodeto de propídio por amostra e, em seguida, adicione 3 μL da mistura a cada amostra. Incubar as amostras a 21 °C no escuro durante 15 min.
- Transfira 6 μL de cada amostra corada e suavemente misturada para um hemocitômetro descartável e visualize-a usando um microscópio fluorescente com o filtro FITC e lente objetiva de 40x. Tire uma foto que mostre as linhas da grade do hemocitômetro e as células verdes vivas.
- Conte as células verdes em seis campos por amostra, observando as dimensões da grade para que o número de células verdes por volume possa ser calculado.
NOTA: As dimensões de campo nos experimentos atuais são 1,05 mm x 0,6 mm x 0,1 mm, o que corresponde a 0,063 mm3 ou 6,3 x 10-5 mL. Para obter o número de células viáveis por mL, divida o número de células vivas contadas por 6,3 x 10-5 mL e multiplique-as por dois (ou 2000 se for o controle não tratado T = 24 h).
- Conte as células verdes em seis campos por amostra, observando as dimensões da grade para que o número de células verdes por volume possa ser calculado.
7. Determinação do número de células viáveis, mas não cultiváveis (VBNCs)
NOTA: Use os números de células cultiváveis obtidos da contagem de placas viáveis e o número de células viáveis obtido da coloração viva/morta para determinar o número de VBNCs.
- Calcule VBNCs/mL subtraindo o número de células cultiváveis/mL do número de células viáveis por mL.
- Use um teste de pares pareados de Wilcoxon para comparar os VBNCs/mL ou as células cultiváveis/mL com as células viáveis/mL para cada tratamento.
Resultados
As formas de vida bacterianas viáveis, mas não cultiváveis (VBNC) são induzidas por estressores, incluindo o tratamento com antibióticos, e causam infecções recorrentes devido à sua tolerância a antibióticos. Como a HM é um antimicrobiano de amplo espectro ao qual raramente foi detectada resistência, foi levantada a hipótese de que a HM induziu menos VBNCs do que os antibióticos convencionais. O método aqui descrito foi utilizado para quantificar VBNCs formadas por duas bactérias causadoras de feridas, S. aureus e P. aeruginosa. O número de VBNCs é igual ao número de células viáveis determinado pela coloração viva/morta menos o número de células cultiváveis determinado pela contagem de placas viáveis. A Tabela 3 mostra o número médio de VBNCs detectados em S. aureus e P. aeruginosa, respectivamente, com pontos de tempo e tratamentos indicados. Um desafio enfrentado nesses experimentos é quando o número viável de células é menor que o número cultivável de células e fornece um número negativo de VBNCs. Todas as células cultiváveis são viáveis, com base em sua capacidade de se reproduzir e formar colônias. Isso foi resolvido determinando se o número de células cultiváveis era significativamente diferente do número de células viáveis para cada tratamento. O número de células cultiváveis para S. aureus e P. aeruginosa tratados com antibióticos é claramente menor do que o número de células viáveis, mas apenas a P. aeruginosa tratada com meropenem tinha significativamente menos células cultiváveis do que células viáveis (Figura 1).
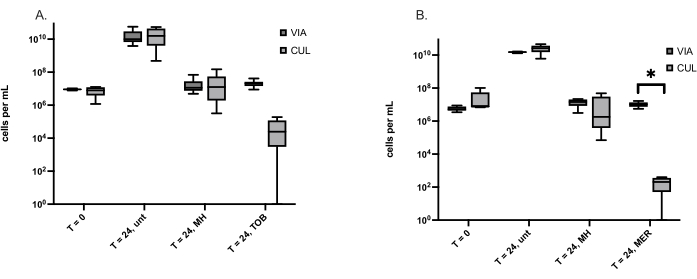
Figura 1: Células cultiváveis (CUL) e viáveis (VIA) determinadas usando a contagem de placas viáveis e coloração viva/morta, respectivamente. (A) Células de S. aureus antes do tratamento (T = 0) e em 24 h, não tratadas (unt), tratadas com Mel de Manuka (MH) ou o antibiótico tobramicina (TOB). Os gráficos de caixa representam seis experimentos independentes, cada um com uma réplica. (B) Células de P. aeruginosa antes do tratamento (T = 0) e em 24 h, não tratadas (unt), tratadas com mel de Manuka (MH) ou antibiótico meropenem (MER). Os gráficos de caixa representam cinco experimentos independentes, cada um com uma réplica. Um teste de pares pareados de Wilcoxon foi usado para comparar o número de células VIA e CUL, *p < 0,05. Clique aqui para ver uma versão maior desta figura.
| Item | Amostra não tratada | Amostra de MH, concentração final = 5% | Amostra de tobramicina, concentração final = 10 μg/mL |
| Cultura de S. aureus diluída 1:1000 | 4 mL | 2 mL | 2 mL |
| Tratamento | ________ | 0,5 mL de solução de MH a 25% | 0,250 mL de solução de 100 μg/mL |
| Caldo LB estéril | 1 mL | -------- | 0,25 mL |
| Volume final | 5 ml | 2,5 ml | 2,5 ml |
Tabela 1: Reagentes e volumes necessários para preparar amostras de tratamento antimicrobiano de S. aureus .
| Item | Amostra não tratada | Amostra de MH, concentração final = 18% | Amostra de meropeném, concentração final = 6 μg/mL |
| Cultura de P. aeruginosa diluída 1:1000 | 4 mL | 2 mL | 2 mL |
| Tratamento | ________ | 1,44 mL de solução de MH a 50% | 0,24 ml de solução a 100 μg/ml |
| Caldo LB estéril | 4 mL | 0,56 mL | 1,76 mL |
| Volume final | 8 mL | 4 mL | 4 mL |
Tabela 2: Reagentes e volumes necessários para preparar amostras de tratamento antimicrobiano de P. aeruginosa .
| Tempo e tratamento | S. aureus VBNCs | Tempo e tratamento | P. aeruginosa VBNCs |
| T = 0 | 1.30 x 106 | T = 0 | -2.05 x 107 |
| T = 24 unt | 1.30 x 106 | T = 24 unt | -1.09 x 1010 |
| T = 24 MH | -1.37 x 107 | T = 24 MH | 1.78 x 106 |
| T = 24 TOB | 2,15 x 107 | T = 24 TOB | 1.04 x 107 |
Tabela 3: O número médio de VBNCs detectados em S. aureus e P. aeruginosa. VBNCs detectados em amostras de S. aureus e P. aeruginosa subtraindo o número de células cultiváveis do número de células viáveis. As abreviaturas são as seguintes: não tratado (unt), Mel de Manuka (MH), Tobramicina.
Discussão
O protocolo aqui descrito permite a detecção de populações de células VBNC em bactérias causadoras de feridas tratadas com concentrações inibitórias mínimas (CIMs) de HM e antibióticos convencionais. As etapas críticas do protocolo incluíram a preparação das diluições de MH no dia do experimento, evitando a perda de amostra durante a coloração viva/morta e calculando o volume analisado corretamente. Para este e outros estudos, as CIMs de HM para S. aureus e P. aeruginosa foram determinadas experimentalmente27. Em preparação para testar porcentagens de MH entre 1%-20% MH, soluções estoque de 25% ou 50% foram feitas nos meios de cultura utilizados nos experimentos. Curiosamente, à medida que as amostras diluídas envelhecem, sua eficácia aumenta ligeiramente, diminuindo a CIM (Carlson, observações não publicadas). A idade da HM 100% não pareceu afetar sua eficácia, embora isso não tenha sido cuidadosamente testado. Para evitar variação na eficácia da HM, as diluições de 25% e 50% foram preparadas no dia do experimento.
Em vários experimentos, um número negativo de células VBNC foi calculado devido ao número de células viáveis ser menor que o número de células cultiváveis. Como todas as células cultiváveis são viáveis, não é possível ter menos células viáveis do que células cultiváveis. Foi levantada a hipótese de que algumas células viáveis foram perdidas durante a centrifugação das amostras pós-tratamento coletadas para análise de células vivas/mortas. Assim, em vez de centrifugar 1 mL das amostras e ressuspendê-las em NaCl 0,85%, 0,5 mL da amostra foi coletado e adicionado a 0,5 mL de NaCl 0,85%. Embora isso tenha melhorado a detecção de células viáveis em, em média, 47%, em algumas amostras, o número de células viáveis ainda era menor do que o número de células cultiváveis. Uma vez que isso impediu a comparação do número de células VBNC entre os tratamentos, as células cultiváveis e viáveis por amostra foram comparadas e mostraram que o tratamento de P. aeruginosa com meropenem, mas não MH, produziu significativamente menos células cultiváveis do que viáveis (Figura 1). Nenhuma diferença significativa entre células cultiváveis e viáveis sugeriu que muitas células VBNC não estavam presentes, enquanto significativamente menos células cultiváveis indicaram um alto número de células VBNC.
Este protocolo combina um conjunto de técnicas de microbiologia com coloração viva/morta e detecção por microscopia fluorescente para avaliar populações de células VBNC em bactérias tratadas com MH. Em comparação com outras técnicas e protocolos para detecção de células VBNC, é relativamente barato e não requer enzimas para qPCR ou PCR de transcrição reversa, nem uma máquina de PCR em tempo real25,26. Este protocolo permitirá que os pesquisadores explorem o impacto do MH em uma ampla gama de patógenos bacterianos para formar células VBNC e potencialmente revelar um mecanismo para a recalcitrância do MH à resistência bacteriana.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi financiado por duas bolsas da Eastern Washington University, a Bolsa de Pesquisa e Trabalhos Criativos do Corpo Docente para a ARC e a Bolsa de Pesquisa de Graduação e Atividades Criativas para L.T.B. Bill e Connie Cross doaram fundos para a EWU para comprar o microscópio fluorescente invertido Leica DMIL com uma câmera digital.
Materiais
| Name | Company | Catalog Number | Comments |
| Mueller Hinton broth | Fisher Bioreagents | B12322 | |
| Luria Bertani (LB) broth | Fisher Bioreagents | BP142602 | |
| BD Difco Agar | Fisher Scientific | DF0812-07-1 | |
| sodium chloride | Sigma | S3014-500g | |
| meropenem | TargetMol | T0224 | |
| tobramycin | Selleck Chemicals | S2514 | |
| Staphylococcus aureus | ATCC | ATCC29213 | |
| Pseudomonas aeruginosa | ATCC | ATCC9721 | |
| shaking incubator | Eppendorf | M13520000 | |
| incubator | Benchmark Scientific | H2200-H | |
| Manukaguard Manuka Honey | Amazon | NA | |
| DMIL inverted fluorescent microscope | Leica Microsystems | 11521265 | |
| Digital camera | Leica Microsystems | 12730522 | |
| 15 mL falcon tubes | Genesee Scientific | 28-103 | |
| serological pipets | Diagnocine | DP-LB0100005, DP-LB010010 | |
| Pipet Aid Pipettor | Drummond Scientific Company | 4-000-101 | |
| Bunsen burner | Fisher Scientific | S48108 | |
| Rainin pipets | Pipette.com | L-20, L-200, L-1000 | |
| balance | Mettler Toledo | XS603S | |
| 96-well plate | Falcon | 351172 | |
| inoculating loop | Fisher Scientific | 13-104-5 | |
| isopropanol | Fisher Scientific | BP2618-1 | |
| glass spreader | homemade | NA | |
| Live dead staining kit for bacteria | Invitrogen | L7012 | |
| microfuge tubes | Biologix Research Company | SKU 80-1500/P80-1500 | |
| tin foil | Costco | NA | |
| Figure making software | GraphPad | NA | GraphPad Prism was used for making figures and conducting statistical analyses. |
Referências
- Spoering, A., Lewis, K. Biofilms and planktonic cells of Pseudomonas aeruginosa have similar resistance to killing by antimicrobials. J Bacteriol. 183 (23), 6746-6751 (2001).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa strains producing high levels of persister cells in patients with cystic fibrosis. J Bacteriol. 192 (23), 6191-6199 (2010).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. F Microbiol. 5, 00258(2014).
- Reygaert, W. C. An overview of the antimicrobial resistance mechanisms of bacteria. AIMS Microbiol. 4 (3), 482-450 (2018).
- Ayrapetyan, M., Williams, T. C., Baxter, R., Oliver, J. D. Viable but nonculturable and persister cells coexist stochastically and are induced by human serum. Infect Immun. 83 (11), 4194-4203 (2015).
- Cabral, D. J., Wurster, J. I., Belenky, P. Antibiotic persistence as a metabolic adaptation: Stress, metabolism, the host, and new directions. PHARH2. 11 (1), 11010014(2018).
- Heidelberg, J. F., et al. Effect of aerosolization on culturability and viability of gram-negative bacteria. Appl Environ Microbiol. 63 (9), 3585-3588 (1997).
- Cook, K. L., Bolster, C. H. Survival of Campylobacter jejuni and Escherichia coli in groundwater during prolonged starvation at low temperatures. J Appl Microbiol. 103 (3), 573-583 (2007).
- Xu, H. S., et al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment. Microbl Ecol. 8 (4), 313-323 (1982).
- Qi, Z., Huang, Z., Liu, C. Metabolism differences of biofilm and planktonic Pseudomonas aeruginosa in viable but nonculturable state induced by chlorine stress. Sci Total Environ. 821, 153374(2022).
- Li, Y., et al. Study on the Viable but Non-culturable (VBNC) state formation of staphylococcus aureus and its control in food system. F Microbiol. 11, 599739(2020).
- Oryan, A., Alemzadeh, E., Moshiri, A. Biological properties and therapeutic activities of honey in wound healing: A narrative review and meta-analysis. J Tissue Viability. 25 (2), 98-118 (2016).
- Lusby, P. E., Coombes, A. L., Wilkinson, J. M. Bactericidal Activity of different honeys against pathogenic bacteria. Arch Med Res. 36 (5), 464-467 (2005).
- Mandal, M. D., Mandal, S. Honey: Its medicinal property and antibacterial activity. Asian Pac J Trop. Biomed. 1 (2), 154-160 (2011).
- Carter, D. A., et al. Therapeutic Manuka Honey: No longer so alternative. F Microbiol. 7, 00569(2016).
- Cooper, R. A., Molan, P. C., Harding, K. G. The sensitivity to honey of Gram-positive cocci of clinical significance isolated from wounds. J Appl Microbiol. 93 (5), 857-863 (2002).
- George Narelle May, C., Keith, F. Antibacterial Honey: In-vitro activity against clinical isolates of MRSA, VRE, and other multiresistant Gram-negative organisms. HMP Global Learning Network. , https://www.hmpgloballearningnetwork.com/site/wounds/article/7751 (2007).
- Blair, S. E., Cokcetin, N. N., Harry, E. J., Carter, D. A. The unusual antibacterial activity of medical-grade Leptospermum honey: Antibacterial spectrum, resistance and transcriptome analysis. Eur Soc Clin Microbiol. 28 (10), 1199-1208 (2009).
- Cooper, R. A., Jenkins, L., Henriques, A. F. M., Duggan, R. S., Burton, N. F. Absence of bacterial resistance to medical-grade manuka honey. Eur Soc Clin Microbiol. 29 (10), 1237-1241 (2010).
- Lu, J., et al. Honey can inhibit and eliminate biofilms produced by Pseudomonas aeruginosa. Sci Rep. 9 (1), 18160(2019).
- Bischofberger, A. M., Pfrunder Cardozo, K. R., Baumgartner, M., Hall, A. R. Evolution of honey resistance in experimental populations of bacteria depends on the type of honey and has no major side effects for antibiotic susceptibility. Evol Appl. 14 (5), 1314-1327 (2021).
- Cunningham, E., O'Byrne, C., Oliver, J. D. Effect of weak acids on Listeria monocytogenes survival: Evidence for a viable but nonculturable state in response to low pH. Food Control. 20 (12), 1141-1144 (2009).
- Kogure, K., Simidu, U., Taga, N. A tentative direct microscopic method for counting living marine bacteria. Can J Microbiol. 25 (3), 415-420 (1979).
- Albertini, M. C., et al. Use of multiparameter analysis for Vibrio alginolyticus viable but nonculturable state determination. Cytom J Int Soc Anal Cytol. 69 (4), 260-265 (2006).
- Nocker, A., Camper, A. K. Novel approaches toward preferential detection of viable cells using nucleic acid amplification techniques. FEMS Microbiol Lett. 291 (2), 137-142 (2009).
- Trevors, J. T. Viable but non-culturable (VBNC) bacteria: Gene expression in planktonic and biofilm cells. J Microbiol Methods. 86 (2), 266-273 (2011).
- Ankley, L. M., Monteiro, M. P., Camp, K. M., O'Quinn, R., Castillo, A. R. Manuka honey chelates iron and impacts iron regulation in key bacterial pathogens. J App Microbiol. 128 (4), 1015-1024 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados