Method Article
活/死染色,用于定量麦卢卡蜂蜜处理的伤口致病细菌中的活细胞但不可培养的细胞
摘要
所提出的方案描述了一种量化麦卢卡蜂蜜处理的细菌培养物中活但不可培养的细胞 (VBNC) 的程序。
摘要
细菌的抗生素耐药性和耐受性对全球健康构成重大威胁。导致抗生素耐药性和耐受性的机制分别包括基因突变和耐药基因的获得,以及过渡到可存活但不可培养 (VBNC) 和其他休眠状态。尽管在基因上与非抗生素耐受的细胞相同,但 VBNC 细胞通过保持代谢失活来逃避抗生素作用。抗生素只有在其目标过程(如 DNA 复制或转录)活跃时才有效。由于环境压力源,尤其是抗生素,会使细菌进入休眠状态,因此需要替代抗菌剂来尽量减少或防止这种反应。抗菌麦卢卡蜂蜜 (MH) 对许多细菌有效,罕见会出现耐药性。其多方面的抗菌机制使其成为治疗细菌感染的宝贵药物。本研究通过检验 MH 诱导的 VBNC 细胞比传统抗生素少的假设,调查了 MH 对抗生素耐药性发展的抵抗力。为了研究这一点,开发了一种方案,用最低抑制浓度的 MH 或常规抗生素妥布霉素或美罗培南处理引起伤口的细菌 金黄色葡萄球 菌和 铜绿假单胞 菌,然后使用活板计数来识别代谢活跃的可培养细胞和活/死染色来识别所有活细胞。VBNC 细胞的数量等于活细胞数减去可培养细胞数。在一些实验中,可培养细胞数高于活细胞数,VBNC 细胞数为负数;因此,没有直接比较 VBNC 细胞数。相反,比较了每种处理的可培养细胞数和活细胞数。只有用妥布霉素处理的 铜绿假单 胞菌的可培养细胞显著少于活细胞,表明 VBNC 细胞的数量更高。该方案快速简便,可用于评估其他病原菌中 VBNC 细胞的 MH 诱导。
引言
处于活但不可培养 (VBNC) 休眠状态的细菌在抗生素治疗后存活下来,并导致反复发作且有时致命的传染病 1,2,3。我们更熟悉的是抗生素耐药性,它是通过可遗传的基因变化4 发生的。遗传变化通过多种机制提供对特定抗生素的耐药性,包括限制抗生素的摄取、增加抗生素的外排、改变抗生素靶标或灭活抗生素4。相比之下,处于休眠状态的细菌通过减少其新陈代谢表现出更广泛的和非遗传性的抗生素耐受性 2,3。抗生素靶向特定的代谢过程,包括 DNA 复制和细胞壁合成,对代谢失活的 VBNC 细胞无效4。在大多数细菌种群中,VBNC 细胞与其基因相同的抗生素敏感兄弟姐妹一起随机存在5。然而,环境压力源,包括抗生素暴露,会诱导易感细菌细胞进入抗生素耐受的 VBNC 状态 3,6。抗生素治疗将杀死群体中的抗生素敏感细胞,而休眠的 VBNC 细胞仍然存在。顾名思义,VBNC 细胞不能在适合其代谢活跃的兄弟姐妹生长的培养基上培养。然而,它们的膜和遗传物质未受损,它们可以繁殖 7,8。当抗生素被去除时,需要特定的刺激,如营养物质、温度或宿主因素,才能将 VBNC 细胞从休眠状态中唤醒并恢复生长 3,9。VBNC 细胞已存在于许多病原菌种属中,包括铜绿假单胞菌和金黄色葡萄球菌,它们是伤口感染的主要病因10,11。
由于其抗菌特性,蜂蜜长期以来一直用于医疗应用,包括伤口治疗12。麦卢卡蜂蜜 (MH) 源自麦卢卡灌木 (Leptospermum scoparium) 的花朵,以其广谱杀菌活性而闻名(13,14,15 中已论述)。它成功地杀死了大多数经过测试的引起人类感染的细菌,包括对传统抗生素表现出遗传耐药性的细菌菌株,如耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌 16,17。此外,诱导细菌对 MH 的耐药性很少见,仅在暴露于蜂蜜的铜绿假单胞菌生物膜和大肠杆菌中检测到,这些大肠杆菌在浓度递增的蜂蜜测试子集中培养 18,19,20,21。这表明 MH 的抗菌机制与传统抗生素不同,可能会诱导较少或没有 VBNC 细胞。通过确定与传统抗生素相比 MH 如何影响 VBNC 人群来检验这一假设。
VBNC 细胞必须与其代谢活跃的可培养兄弟姐妹和死细胞区分开来。使用活平板计数技术对可培养细胞进行计数,其中将细胞转移到常规培养基中,并孵育足够多的细胞分裂以产生可观察的集落。已经开发了几种基于其完整膜和低水平转录区分 VBNC 细胞和死细胞的方法。底物和荧光染料摄取与显微镜或流式细胞术相结合,允许通过显微镜或流式细胞术直接计数细胞,颜色指示完整的膜22,23。要求电子传递链存在于完整细胞膜中的呼吸测定也已用于区分活细胞和死细胞24。还开发了定量 PCR (qPCR) 方法与防止扩增的 DNA 修饰染料相结合;只有来自活细胞的 DNA 会被扩增,因为完整的膜会排除染料25。尽管 VBNC 细胞处于休眠状态,但它们仍然在低水平上转录基因,这也可用于使用逆转录 PCR 将它们与死细胞区分开来 26。
在这项工作中,开发了一种测定法来量化用 MH 处理的两种引起伤口的病原菌 S. aureus 和 P. aeruginosa 中的 VBNC 细胞。它描述了用 MH 和常规抗生素处理细菌,以及使用活板计数和活/死染色来检测可培养和活细胞。这种简单且廉价的方案将允许分析 MH 在许多细菌病原体中诱导抗生素耐药 VBNC 细胞的能力。
研究方案
由于 铜绿假单 胞菌 (ATCC9721) 和 金黄色 葡萄球菌 (ATCC29213) 被归类为生物安全 2 级试剂,因此进行工作的房间必须有限制进入,并配备生物安全柜,用于可能产生飞溅或气溶胶的作,例如搅拌和离心培养物。在本方案的所有步骤中,穿戴个人防护装备 (PPE),包括实验服、防护眼镜和手套。实验中使用的所有试剂和设备均列在 材料表中。
1. 无菌肉汤和琼脂培养基的制备
- 准备 Luria Bertani 和 Mueller Hinton、NaCl (0.85%)、抗生素和玻璃器皿。
- 根据制造商的说明准备肉汤培养基,将琼脂粉加入 1.5% 的琼脂培养基中。将 0.85 g NaCl 添加到 100 mL dH20 中,制备 0.85% NaCl。在容器上贴上高压灭菌胶带,将它们放入高压灭菌器安全的容器中,并在适合所用体积的液体循环中高压灭菌。
- 高压灭菌循环完成后,将琼脂冷却至约 60 °C,然后再将其倒入无菌培养皿中。
- 在 dH2O 中制备 100 μg/mL 抗生素妥布霉素和美罗培南的储备溶液,用于稀释和处理细菌。使用连接到 0.2 μm 无菌过滤器的 5 mL 无菌注射器对抗生素原液进行消毒。
- 将灭菌的抗生素原液在 -20 °C 下以多个小等分试样储存,以防止由于多次冻融循环而导致活性损失。
2. 从 -80 °C 中检索存档的 金黄色葡萄球菌 和 铜绿假单胞 菌菌株(第 1 天)
- 收集用于将一小部分冷冻细菌菌株从其 80 °C 冷冻小瓶划线到 Luria Bertani (LB) 琼脂中的材料。这包括多个无菌木棒和一个标有生物体和日期的 LB 琼脂板。
- 打开 -80 °C 冰箱,快速取出感兴趣的样品瓶,然后关闭冰箱门。依次打开每个小瓶,并使用无菌棒将少量冷冻细菌刮到适当标记的 LB 琼脂平板上。装回样品瓶盖,并迅速将其放回 -80 °C 冰箱中。
- 将接种的 LB 琼脂平板,琼脂面朝上,在 37 °C 下在有氧(大气)条件下孵育 18-24 小时。孵育期后,用接枝胶带密封接种的 LB 琼脂平板,并在 4 °C 下储存不超过一周。根据需要每周从 -80 °C 冷冻原液中接种新鲜细菌培养物。
3. 准备金 黄色 葡萄球菌和 铜绿假单 胞菌用麦卢卡蜂蜜 (MH) 和抗生素治疗(第 2 天)
- 收集开始每个菌株的 LB 肉汤培养所需的材料,包括小型无菌试管、5 mL 血清移液管、无菌 LB 肉汤和接种环。此外,收集一个手动或电动移液器,用于血清移液管、一个本生灯和一个摇动培养箱。
- 在本生灯火焰旁边工作,使用血清移液管将 2 mL LB 肉汤转移到两个无菌试管中。在本生灯火焰中对接种环进行消毒,然后将充满细菌的四分之一环从 LB 琼脂板转移到带有 LB 肉汤的适当标记的试管中。
- 在有氧条件下,将试管在 37 °C 的振荡 (~250 rpm) 培养箱中孵育 18-24 小时。
4. MH 的制备和建立 MH 以及 金黄色 葡萄球菌和 铜绿假单胞 菌的抗生素治疗 (T = 0)(第 3 天)
- 收集实验所需的材料,包括 Mueller Hinton 肉汤和琼脂平板、第 2 天的 LB 肉汤细菌培养物、无菌试管、冰上抗生素原液、移液管(P20、P200 和 P1000)和吸头、15 mL 管、血清移液管和移液器以及微量离心管。
- 在实验设置当天准备新鲜的 25% 和 50% MH 储备溶液。根据 MH 的密度 (1.47 g/mL),称取适量的 MH 在无菌 15 mL 试管中,并加入适量的无菌 Mueller Hinton 肉汤。将试管放入温水中并根据需要倒置,以重悬 MH。
- 通过将 10 μL 细菌培养物添加到 10 mL Mueller Hinton 肉汤中,在无菌 15 mL 试管中制备 1:1000 稀释液(约 106 CFU/mL)的过夜细菌培养物。
- 使用稀释的培养物为每种细菌种类制备三个样品:未处理的对照、MH 处理的样品(最低抑制浓度 MIC)和抗生素处理的样品(金 黄色葡萄球菌 的妥布霉素或铜 绿假单 胞菌的美罗培南,在 MIC)。
- 将稀释的细菌培养物 MH 和适当的抗生素按 表 1 和 表 2 所示的体积添加到样品中。
- 将 0.1 mL 和 0.5 mL 未处理的样品转移到无菌微量离心管中,对于 T = 0 样品,分别进行活板计数(步骤 5)和活/死染色(步骤 6)。
- 将未处理的对照、MH 处理和抗生素处理的(妥布霉素或美罗培南)样品在 37 °C 的好氧条件下在振荡培养箱 (250 rpm) 中孵育 24 小时。对 T= 0 未处理的样品进行活板计数(步骤 5)和活/死染色(步骤 6)技术。
5. 使用活平板计数法测定样品中的可培养细胞(第 3 - 5 天)
- 第 4 天,在样品孵育 24 小时后,在微量离心管中收集 0.1 mL 和 0.5 mL 每个样品,分别用于活板计数和活/死染色(步骤 6)。这些将是 T = 24 小时的样品。
- 通过在 LB 肉汤中制备活平板计数样品的 10 倍稀释液,在收集 T = 0 和 T = 24 小时样品上进行活平板计数,以获得可计数数量的细胞 (~25-150)。
- 将 50 μL 每个稀释的样品涂在 1/2 的 LB 琼脂平板上。将 LB 琼脂平板在 37 °C 的好氧条件下孵育 24 小时。
- 第二天,从培养箱中取出 LB 琼脂板,并识别具有 ~25-150 个菌落的稀释板。计算平板上菌落的确切数量,并使用菌落形成单位 (CFU) 公式(CFU/mL= # 计数的菌落/(铺板体积,mL)(使用的稀释度))来确定每 mL 的可培养细胞数。
注意:T = 0 样品将在第 3 天接种,并在第 4 天进行分析;T = 24 小时的样品将在第 4 天接种,并在第 5 天进行分析。
6. 使用活/死染色和荧光显微镜测定样品中的活细胞(第 3 天或第 4 天)
- 收集活/死染色所需的材料,包括 0.85% 无菌 NaCl 以维持细胞的良好渗透环境、移液管(P20、P200 和 P1000)和无菌移液器吸头、细菌活/死染色试剂盒和一次性血细胞计数器。使用设置有异硫氰酸荧光素 (FITC) 滤光片的荧光显微镜来检测 SYTO 9 染料,该染料可对活细胞进行染色。
- 将 0.5 mL 的 0.85% NaCl 添加到 0.5 mL 的以下每个活/死样品中:所有未稀释的 T = 0 样品、未稀释的 T = 24 h MH 和抗生素处理的样品,以及 T = 24 h 未处理对照样品的 1:1000 稀释。
- 确保将所有样品的最终活细胞计数乘以 2,并将稀释的 T = 24 小时未处理的对照乘以 1000。将每个样品中的 1.5 μL SYTO 9 和 1.5 μL 碘化丙啶混合,然后向每个样品中加入 3 μL 混合物。将样品在 21 °C 下避光孵育 15 分钟。
- 将 6 μL 每个染色、轻轻混合的样品转移到一次性血球计数器中,并使用带有 FITC 滤光片和 40 倍物镜的荧光显微镜进行观察。拍摄一张同时显示血细胞计数板网格线和活绿色细胞的照片。
- 计算每个样品六个字段中的绿色细胞,注意网格的尺寸,以便计算每个体积的绿色细胞数量。
注:当前实验中的磁场尺寸为 1.05 mm x 0.6 mm x 0.1 mm,相当于 0.063 mm3 或 6.3 x 10-5 mL。为了获得每 mL 的活细胞数,将计数的活细胞数除以 6.3 x 10-5 mL,然后将它们乘以 2(如果是 T = 24 小时未处理的对照,则乘以 2000)。
- 计算每个样品六个字段中的绿色细胞,注意网格的尺寸,以便计算每个体积的绿色细胞数量。
7. 确定活但不可培养的细胞 (VBNC) 的数量
注:使用从活板计数获得的可培养细胞数和从活/死染色获得的活细胞数来确定 VBNC 的数量。
- 通过从每 mL 的活细胞数中减去可培养细胞数/mL 来计算 VBNCs/mL。
- 使用 Wilcoxon 配对检验将每次处理的 VBNC/mL 或可培养细胞/mL 与活细胞/mL 进行比较。
结果
活但不可培养 (VBNC) 细菌生命形式由压力源(包括抗生素治疗)诱导,并由于其抗生素耐受性而导致反复感染。由于 MH 是一种广谱抗菌药物,很少检测到耐药性,因此假设 MH 诱导的 VBNC 比传统抗生素少。此处描述的方法用于量化由两种引起伤口的细菌 S. aureus 和 P. aeruginosa 形成的 VBNC。VBNC 的数量等于通过活/死染色确定的活细胞数减去由活板计数确定的可培养细胞数。 表 3 显示了分别在 金黄色葡萄球菌 和 铜绿假单胞菌中检测到的 VBNC 的平均数量,以及指示的时间点和处理。这些实验中面临的一个挑战是当活细胞数小于可培养细胞数并且 VBNC 数为负数时。所有可培养细胞都是有活力的,这取决于它们繁殖和形成集落的能力。通过确定每种处理的可培养细胞数是否与活细胞数显着不同来解决此问题。抗生素处理的 金黄色 葡萄球菌和 铜绿假单 胞菌的可培养细胞数量明显少于活细胞的数量,但只有美罗培南处理的 铜绿假单 胞菌的可培养细胞明显少于活细胞(图 1)。
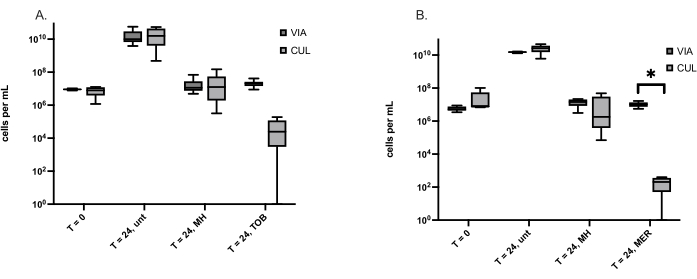
图 1:分别使用活板计数和活/死染色测定可培养细胞 (CUL) 和活细胞 (VIA)。 (A) 处理前 (T = 0) 和 24 小时时,未处理 (unt) 用麦卢卡蜂蜜 (MH) 或抗生素妥布霉素 (TOB) 处理的 金黄色 葡萄球菌细胞。箱线图表示 6 个独立试验,每个试验有 1 个仿行。(B) 处理前 (T = 0) 和 24 小时时,未处理 (unt),用麦卢卡蜂蜜 (MH) 或抗生素美罗培南 (MER) 处理的铜 绿假单 胞菌细胞。箱形图表示 5 个独立实验,每个实验都有一个仿行。Wilcoxon 匹配对检验用于比较 VIA 和 CUL 细胞数,*p < 0.05。 请单击此处查看此图的较大版本。
| 项目 | 未处理的样品 | MH 样品,终浓度 = 5% | 妥布霉素样品,终浓度 = 10 μg/mL |
| 1:1000 稀释的金黄色葡萄球菌培养物 | 4 毫升 | 2 毫升 | 2 毫升 |
| 治疗 | ________ | 0.5 mL 25% MH 溶液 | 0.250 mL 100 μg/mL 溶液 |
| 无菌 LB 肉汤 | 1 毫升 | -------- | 0.25 毫升 |
| 最终卷 | 5 毫升 | 2.5 毫升 | 2.5 毫升 |
表 1:制备 金黄色葡萄球菌 抗菌处理样品所需的试剂和体积。
| 项目 | 未处理的样品 | MH 样品,终浓度 = 18% | 美罗培南样品,终浓度 = 6 μg/mL |
| 铜绿假单胞菌培养物稀释 1:1000 | 4 毫升 | 2 毫升 | 2 毫升 |
| 治疗 | ________ | 1.44 mL 50% MH 溶液 | 0.24 mL 100 μg/mL 溶液 |
| 无菌 LB 肉汤 | 4 毫升 | 0.56 毫升 | 1.76 毫升 |
| 最终卷 | 8 毫升 | 4 毫升 | 4 毫升 |
表 2:制备 铜绿假单 胞菌抗菌处理样品所需的试剂和体积。
| 时间和治疗 | 金黄色葡萄球菌 VBNC | 时间和治疗 | 铜绿假单 胞菌VBNC |
| T = 0 | 1.30 x 106 | T = 0 | -2.05 x 107 |
| T = 24 unt | 1.30 x 106 | T = 24 unt | -1.09 x 1010 |
| T = 24 MH | -1.37 x 107 | T = 24 MH | 1.78 x 106 |
| T = 24 托布 | 2.15 x 107 | T = 24 托布 | 1.04 x 107 |
表 3:在 金黄色葡萄球菌 和 铜绿假单胞菌中检测到的 VBNC 的平均数量。 通过从活细胞的数量中减去可培养细胞的数量,在 金黄色 葡萄球菌和 铜绿假单 胞菌样本中检测到 VBNC。缩写如下:未处理 (unt)、麦卢卡蜂蜜 (MH)、妥布霉素。
讨论
此处描述的方案允许检测用 MH 和常规抗生素的最低抑制浓度 (MIC) 处理的伤口致病细菌中的 VBNC 细胞群。该方案中的关键步骤包括在实验当天制备 MH 稀释液,防止活/死染期间的样品损失,以及正确计算分析体积。对于这项研究和其他研究,实验确定了 金黄色葡萄球菌 和 铜绿假单 胞菌的 MH MIC27。为了准备测试 1%-20% MH 之间的 MH 百分比,在实验中使用的培养基中制备 25% 或 50% 的储备溶液。有趣的是,随着稀释样品的老化,它们的有效性略有增加,从而降低了 MIC(Carlson,未发表的观察结果)。100% MH 的年龄似乎不会影响其有效性,尽管这没有经过仔细测试。为避免 MH 有效性的变化,在实验当天制备了 25% 和 50% 稀释液。
在多个实验中,由于活细胞的数量小于可培养细胞的数量,因此计算出 VBNC 细胞的负数。因为所有可培养细胞都是活的,所以活细胞不可能少于可培养细胞。据推测,在离心收集用于活/死细胞分析的处理后样品时,一些活细胞丢失。因此,收集 0.5 mL 样品并加入 0.5 mL 0.85% NaCl 中,而不是离心 1 mL 样品并将其重悬于 0.85% NaCl 中。尽管这平均提高了 47% 的活细胞检测率,但在一些样品中,活细胞数仍然低于可培养细胞数。由于这排除了处理之间 VBNC 细胞数量的比较,因此比较了每个样品的可培养细胞和活细胞,并表明用美罗培南而不是 MH 处理铜 绿假单 胞菌产生的可培养细胞明显少于活细胞(图 1)。可培养细胞和活细胞之间没有显著差异,表明不存在许多 VBNC 细胞,而可培养细胞显著减少表明 VBNC 细胞数量多。
该方案将一套微生物学技术与活/死染色和荧光显微镜检测相结合,以评估 MH 处理的细菌中的 VBNC 细胞群。与检测 VBNC 细胞的其他技术和方案相比,它相对便宜,并且不需要用于 qPCR 或逆转录 PCR 的酶,也不需要实时 PCR 机器25,26。该协议将允许研究人员探索 MH 对多种细菌病原体形成 VBNC 细胞的影响,并可能揭示 MH 对细菌耐药性顽固的机制。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了东华盛顿大学的两项资助,即A.R.C的教师研究和创意工作资助,以及L.T.B.的本科生研究和创新活动资助。 Bill和Connie Cross向EWU捐赠了资金,用于购买带有数码相机的Leica DMIL倒置荧光显微镜。
材料
| Name | Company | Catalog Number | Comments |
| Mueller Hinton broth | Fisher Bioreagents | B12322 | |
| Luria Bertani (LB) broth | Fisher Bioreagents | BP142602 | |
| BD Difco Agar | Fisher Scientific | DF0812-07-1 | |
| sodium chloride | Sigma | S3014-500g | |
| meropenem | TargetMol | T0224 | |
| tobramycin | Selleck Chemicals | S2514 | |
| Staphylococcus aureus | ATCC | ATCC29213 | |
| Pseudomonas aeruginosa | ATCC | ATCC9721 | |
| shaking incubator | Eppendorf | M13520000 | |
| incubator | Benchmark Scientific | H2200-H | |
| Manukaguard Manuka Honey | Amazon | NA | |
| DMIL inverted fluorescent microscope | Leica Microsystems | 11521265 | |
| Digital camera | Leica Microsystems | 12730522 | |
| 15 mL falcon tubes | Genesee Scientific | 28-103 | |
| serological pipets | Diagnocine | DP-LB0100005, DP-LB010010 | |
| Pipet Aid Pipettor | Drummond Scientific Company | 4-000-101 | |
| Bunsen burner | Fisher Scientific | S48108 | |
| Rainin pipets | Pipette.com | L-20, L-200, L-1000 | |
| balance | Mettler Toledo | XS603S | |
| 96-well plate | Falcon | 351172 | |
| inoculating loop | Fisher Scientific | 13-104-5 | |
| isopropanol | Fisher Scientific | BP2618-1 | |
| glass spreader | homemade | NA | |
| Live dead staining kit for bacteria | Invitrogen | L7012 | |
| microfuge tubes | Biologix Research Company | SKU 80-1500/P80-1500 | |
| tin foil | Costco | NA | |
| Figure making software | GraphPad | NA | GraphPad Prism was used for making figures and conducting statistical analyses. |
参考文献
- Spoering, A., Lewis, K. Biofilms and planktonic cells of Pseudomonas aeruginosa have similar resistance to killing by antimicrobials. J Bacteriol. 183 (23), 6746-6751 (2001).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa strains producing high levels of persister cells in patients with cystic fibrosis. J Bacteriol. 192 (23), 6191-6199 (2010).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. F Microbiol. 5, 00258 (2014).
- Reygaert, W. C. An overview of the antimicrobial resistance mechanisms of bacteria. AIMS Microbiol. 4 (3), 482-450 (2018).
- Ayrapetyan, M., Williams, T. C., Baxter, R., Oliver, J. D. Viable but nonculturable and persister cells coexist stochastically and are induced by human serum. Infect Immun. 83 (11), 4194-4203 (2015).
- Cabral, D. J., Wurster, J. I., Belenky, P. Antibiotic persistence as a metabolic adaptation: Stress, metabolism, the host, and new directions. PHARH2. 11 (1), 11010014 (2018).
- Heidelberg, J. F., et al. Effect of aerosolization on culturability and viability of gram-negative bacteria. Appl Environ Microbiol. 63 (9), 3585-3588 (1997).
- Cook, K. L., Bolster, C. H. Survival of Campylobacter jejuni and Escherichia coli in groundwater during prolonged starvation at low temperatures. J Appl Microbiol. 103 (3), 573-583 (2007).
- Xu, H. S., et al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment. Microbl Ecol. 8 (4), 313-323 (1982).
- Qi, Z., Huang, Z., Liu, C. Metabolism differences of biofilm and planktonic Pseudomonas aeruginosa in viable but nonculturable state induced by chlorine stress. Sci Total Environ. 821, 153374 (2022).
- Li, Y., et al. Study on the Viable but Non-culturable (VBNC) state formation of staphylococcus aureus and its control in food system. F Microbiol. 11, 599739 (2020).
- Oryan, A., Alemzadeh, E., Moshiri, A. Biological properties and therapeutic activities of honey in wound healing: A narrative review and meta-analysis. J Tissue Viability. 25 (2), 98-118 (2016).
- Lusby, P. E., Coombes, A. L., Wilkinson, J. M. Bactericidal Activity of different honeys against pathogenic bacteria. Arch Med Res. 36 (5), 464-467 (2005).
- Mandal, M. D., Mandal, S. Honey: Its medicinal property and antibacterial activity. Asian Pac J Trop. Biomed. 1 (2), 154-160 (2011).
- Carter, D. A., et al. Therapeutic Manuka Honey: No longer so alternative. F Microbiol. 7, 00569 (2016).
- Cooper, R. A., Molan, P. C., Harding, K. G. The sensitivity to honey of Gram-positive cocci of clinical significance isolated from wounds. J Appl Microbiol. 93 (5), 857-863 (2002).
- George Narelle May, C., Keith, F. Antibacterial Honey: In-vitro activity against clinical isolates of MRSA, VRE, and other multiresistant Gram-negative organisms. HMP Global Learning Network. , (2007).
- Blair, S. E., Cokcetin, N. N., Harry, E. J., Carter, D. A. The unusual antibacterial activity of medical-grade Leptospermum honey: Antibacterial spectrum, resistance and transcriptome analysis. Eur Soc Clin Microbiol. 28 (10), 1199-1208 (2009).
- Cooper, R. A., Jenkins, L., Henriques, A. F. M., Duggan, R. S., Burton, N. F. Absence of bacterial resistance to medical-grade manuka honey. Eur Soc Clin Microbiol. 29 (10), 1237-1241 (2010).
- Lu, J., et al. Honey can inhibit and eliminate biofilms produced by Pseudomonas aeruginosa. Sci Rep. 9 (1), 18160 (2019).
- Bischofberger, A. M., Pfrunder Cardozo, K. R., Baumgartner, M., Hall, A. R. Evolution of honey resistance in experimental populations of bacteria depends on the type of honey and has no major side effects for antibiotic susceptibility. Evol Appl. 14 (5), 1314-1327 (2021).
- Cunningham, E., O'Byrne, C., Oliver, J. D. Effect of weak acids on Listeria monocytogenes survival: Evidence for a viable but nonculturable state in response to low pH. Food Control. 20 (12), 1141-1144 (2009).
- Kogure, K., Simidu, U., Taga, N. A tentative direct microscopic method for counting living marine bacteria. Can J Microbiol. 25 (3), 415-420 (1979).
- Albertini, M. C., et al. Use of multiparameter analysis for Vibrio alginolyticus viable but nonculturable state determination. Cytom J Int Soc Anal Cytol. 69 (4), 260-265 (2006).
- Nocker, A., Camper, A. K. Novel approaches toward preferential detection of viable cells using nucleic acid amplification techniques. FEMS Microbiol Lett. 291 (2), 137-142 (2009).
- Trevors, J. T. Viable but non-culturable (VBNC) bacteria: Gene expression in planktonic and biofilm cells. J Microbiol Methods. 86 (2), 266-273 (2011).
- Ankley, L. M., Monteiro, M. P., Camp, K. M., O'Quinn, R., Castillo, A. R. Manuka honey chelates iron and impacts iron regulation in key bacterial pathogens. J App Microbiol. 128 (4), 1015-1024 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
ISSN 2689-3649
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。