Method Article
마누카 꿀로 처리된 상처 유발 박테리아에서 생존 가능하지만 배양할 수 없는 세포를 정량화하기 위한 살아있는/죽은 염색
요약
제시된 프로토콜은 마누카 꿀 처리된 박테리아 배양에서 VBNC(Viable But Not Culturable Cells)를 정량화하는 절차를 설명합니다.
초록
박테리아의 항생제 내성과 내성은 전 세계 건강에 심각한 위협이 되고 있습니다. 항생제 내성 및 내성에 기여하는 기전에는 각각 유전적 돌연변이, 내성 유전자 획득, VBNC(Viable But Not Culturable) 및 기타 휴면 상태로의 전환이 포함됩니다. VBNC 세포는 항생제에 내성이 없는 세포와 유전적으로 동일하지만, 신진대사가 비활성 상태를 유지함으로써 항생제 효과를 회피합니다. 항생제는 DNA 복제 또는 전사와 같은 표적 과정이 활성화될 때만 효과적입니다. 환경적 스트레스 요인, 특히 항생제는 박테리아를 휴면 상태로 만들 수 있으므로 이러한 반응을 최소화하거나 예방하기 위해 대체 항균제가 필요합니다. 항균성 마누카 꿀(MH)은 많은 박테리아에 효과적이며 드물게 내성이 생깁니다. 다각적인 항균 메커니즘으로 인해 박테리아 감염을 치료하는 데 유용한 약제입니다. 본 연구는 MH가 기존 항생제보다 VBNC 세포 수를 줄인다는 가설을 검증하여 항생제 내성 발병에 대한 MH의 반발을 조사하였다. 이를 조사하기 위해 상처를 유발하는 박테리아인 황색포도상구균(Staphylococcus aureus )과 녹농균(Pseudomonas aeruginosa )을 MH 또는 기존 항생제인 토브라마이신(tobramycin) 또는 메로페넴(meropenem)의 최소 억제 농도로 치료하기 위한 프로토콜이 개발되었으며, 이 프로토콜은 생존 가능한 플레이트 계수를 사용하여 대사 활성 배양 가능한 세포를 식별하고 살아있는/죽은 염색을 사용하여 모든 생존 가능한 세포를 식별했습니다. VBNC 세포의 수는 생존 가능한 세포 수에서 배양 가능한 세포 수를 뺀 값과 같았습니다. 일부 실험에서는 배양 가능한 세포 수가 생존 가능한 세포 수보다 높아 음의 VBNC 세포 수를 제공했습니다. 따라서 VBNC 셀 번호는 직접 비교되지 않았습니다. 대신, 각 치료에 대해 배양 가능하고 생존 가능한 세포 수를 비교했습니다. 토브라마이신으로 처리한 녹농균(P. aeruginosa )만이 생존 세포보다 배양 가능한 세포가 현저히 적었으며, 이는 VBNC 세포의 수가 더 많았음을 나타냅니다. 이 프로토콜은 빠르고 쉬우며 다른 병원성 박테리아에서 VBNC 세포의 MH 유도를 평가하는 데 사용할 수 있습니다.
서문
VBNC(Viable But Not Culturable) 휴면 상태의 박테리아는 항생제 치료를 견뎌내고 재발성 및 때로는 치명적인 감염병을 유발합니다 1,2,3. 우리에게 더 친숙한 것은 유전적 유전자 변화4를 통해 발생하는 항생제 내성입니다. 유전적 변화는 항생제의 흡수를 제한하거나, 항생제의 유출을 증가시키거나, 항생제 표적을 변형시키거나, 항생제를 비활성화하는 등 여러 가지 기전에 의해 특정 항생제에 대한 내성을 제공합니다4. 대조적으로, 휴면 상태의 박테리아는 신진대사를 감소시킴으로써 더 광범위하고 유전되지 않는 항생제 내성을 보입니다 2,3. 항생제는 DNA 복제 및 세포벽 합성을 포함한 특정 대사 과정을 표적으로 하며 대사적으로 비활성 VBNC 세포에는 효과가 없습니다4. VBNC 세포는 대부분의 박테리아 집단에서 유전적으로 동일한 항생제에 취약한 형제 세포와 함께 확률적으로 적은 수로 존재합니다5. 그러나 항생제 노출을 포함한 환경적 스트레스 요인은 감수성이 있는 박테리아 세포가 항생제 내성 VBNC 상태로 진입하도록 유도합니다 3,6. 항생제 치료는 개체군 내에서 항생제에 취약한 세포를 죽이고 휴면 VBNC 세포는 남아 있습니다. 이름에서 알 수 있듯이 VBNC 세포는 대사 활성이 높은 형제 세포의 성장에 적합한 배지에서 배양할 수 없습니다. 그러나 그들의 막과 유전 물질은 손상되지 않았으며 7,8 번 번식 할 수 있습니다. 항생제를 제거하면 VBNC 세포를 휴면 상태에서 깨우고 성장을 회복하기 위해 영양소, 온도 또는 숙주 요인과 같은 특정 자극이 필요합니다 3,9. VBNC 세포는 상처 감염의 주요 병인인 녹농균(P. aeruginosa)과 황색포도상구레우스(S. aureus)를 포함한 많은 병원성 세균 종에서 문서화되었습니다10,11.
꿀은 항균 특성 때문에 상처 치료를 포함한 의료 분야에서 오랫동안 사용되어 왔습니다12. 마누카 덤불(Leptospermum scoparium)의 꽃에서 추출한 마누카 꿀(MH)은 광범위한 살균 활성으로 알려져 있습니다(13,14,15에서 검토). 그것은 전통적인 항생제에 대한 유전적 내성을 나타내는 메티실린 저항성 황색포도상구균 및 반코마이신 저항성 엔테로코커스와 같은 박테리아 균주를 포함하여 테스트된 인간 감염 유발 박테리아의 대다수를 성공적으로 죽입니다16,17. 또한, MH에 대한 유도 된 박테리아 내성은 드물며, 꿀에 노출 된 녹농균 생물막과 꿀 테스트 18,19,20,21의 하위 집합의 농도 증가에서 배양 된 대장균에서만 검출됩니다. 이는 MH의 항균 메커니즘이 기존 항생제와 구별되며 VBNC 세포를 더 적게 또는 전혀 유도하지 않을 수 있음을 시사합니다. 이 가설은 MH가 기존 항생제와 비교하여 VBNC 개체군에 어떤 영향을 미치는지 확인하여 테스트되었습니다.
VBNC 세포는 대사적으로 활성화된 배양 가능한 형제 세포 및 죽은 세포와 구별되어야 합니다. 배양 가능한 세포는 생존 가능한 플레이트 계수 기법을 사용하여 계수되며, 여기서 세포는 일상적인 배양 배지로 옮겨지고 관찰 가능한 콜로니를 생성하기에 충분한 세포 분열에 충분한 기간 동안 배양됩니다. VBNC 세포와 죽은 세포를 구별하는 여러 가지 방법이 온전한 막과 낮은 수준의 전사를 기반으로 개발되었습니다. 현미경 검사 또는 유세포 분석과 결합 된 기질 및 형광 염료 흡수는 온전한 막22,23을 나타내는 색상으로 현미경 검사 또는 유세포 분석으로 세포를 직접 계수 할 수 있습니다. 전자 전달 사슬이 온전한 세포막에 존재해야 하는 호흡 분석법도 생존 가능한 세포와 죽은 세포를 구별하는 데 사용되었습니다24. 증폭을 방지하는 DNA 변형 염료와 결합된 정량적 PCR(qPCR) 방법도 개발되었습니다. 생존 가능한 세포의 DNA만이 온전한 막이 염료를 제외하기 때문에 증폭됩니다25. VBNC 세포는 휴면 상태이지만 여전히 낮은 수준에서 유전자를 전사하며, 이는 역전사 PCR26을 사용하여 죽은 세포와 구별하는 데에도 사용할 수 있습니다.
이 연구에서는 MH로 처리된 두 개의 상처 유발 병원성 박테리아인 S. aureus 와 P. aeruginosa 에서 VBNC 세포를 정량화하기 위한 분석법이 개발되었습니다. MH 및 기존 항생제로 박테리아를 치료하고 배양 가능한 세포와 생존 가능한 세포를 검출하기 위해 생존 가능한 플레이트 계수 및 살아있는/죽은 염색을 사용하는 방법을 설명합니다. 이 쉽고 저렴한 프로토콜을 통해 많은 박테리아 병원체에서 항생제 내성 VBNC 세포를 유도하는 MH의 능력을 분석할 수 있습니다.
프로토콜
녹농균(P. aeruginosa, ATCC9721)과 황색포도상구균(S. aureus, ATCC29213)은 생물안전성 2등급 제제로 분류되기 때문에 작업이 수행되는 방에는 접근이 제한되어야 하며 교반 및 원심분리 배양과 같은 비말 또는 에어로졸을 생성할 수 있는 조작을 위한 생물안전 캐비닛이 설치되어 있어야 합니다. 이 프로토콜의 모든 단계에서 실험복, 보호 안경 및 장갑을 포함한 개인 보호 장비(PPE)를 착용합니다. 실험에 사용된 모든 시약과 장비는 재료 표에 나열되어 있습니다.
1. 멸균 육수 및 한천 배양 배지의 준비
- Luria Bertani 및 Mueller Hinton, NaCl(0.85%), 항생제 및 유리 제품을 준비합니다.
- 제조업체의 지침에 따라 한천 매체를 준비하고 한천 매체에 대해 1.5%에 한천 분말을 추가합니다. 0.85 g의 NaCl을 100 mL의 dH20에 첨가하여 0.85 % NaCl을 준비합니다. 용기에 오토클레이브 테이프를 바르고 오토클레이브 안전 용기에 넣은 다음 사용된 부피에 적합한 액체 사이클로 오토클레이브합니다.
- 오토클레이브 사이클이 완료되면 한천을 멸균 페트리 접시에 붓기 전에 약 60°C로 냉각합니다.
- 박테리아 희석 및 처리를 위해 dH2O에 항생제 토브라마이신 및 메로페넴의 100μg/mL 원액을 준비합니다. 0.2μm 멸균 필터에 연결된 5mL 멸균 주사기를 사용하여 항생제 스톡을 멸균합니다.
- 멸균된 항생제 재고를 -20°C에서 여러 개의 작은 부분 표본에 보관하여 여러 번의 동결-해동 주기로 인한 활성 손실을 방지합니다.
2. -80°C에서 보관된 황색포도상구균 및 녹농 균 균주 회수(1일차)
- 80°C 냉동 바이알에서 Luria Bertani(LB) 한천으로 냉동 박테리아 균주의 작은 부분 표본을 줄무늬를 만들기 위한 재료를 수집합니다. 여기에는 여러 개의 멸균 나무 막대기와 유기체와 날짜가 표시된 LB 한천 플레이트가 포함됩니다.
- -80 °C 냉동고를 열고 관심 바이알을 빠르게 제거한 다음 냉동실 도어를 닫습니다. 각 바이알을 순차적으로 열고 멸균 스틱을 사용하여 적절하게 표시된 LB 한천 플레이트에 소량의 냉동 박테리아를 긁어냅니다. 바이알 캡을 교체하고 -80°C 냉동고에 재빨리 다시 넣습니다.
- 접종된 LB 한천 플레이트를 37°C에서 18-24시간 동안 호기성(대기) 조건에서 배양합니다. 잠복기가 끝나면 접종된 LB 한천 플레이트를 그라프팅 테이프로 밀봉하고 4°C에서 일주일 이상 보관하지 않습니다. 필요에 따라 매주 -80°C 냉동 재고에서 신선한 박테리아 배양액을 접종합니다.
3. 마누카 꿀(MH) 및 항생제 치료를 위한 S. aureus 및 P. aeruginosa 의 준비(2일차)
- 소형 멸균 시험관, 5mL 혈청학적 피펫, 멸균 LB 육수 및 접종 루프를 포함하여 각 균주의 LB 육수 배양을 시작하는 데 필요한 재료를 수집합니다. 또한 혈청학적 피펫, 분젠 버너 및 진탕 인큐베이터와 함께 사용할 수동 또는 전기 피펫터를 준비하십시오.
- 분젠 버너 화염 옆에서 작업하면서 혈청학적 피펫을 사용하여 LB 육수 2mL를 두 개의 멸균 시험관으로 옮깁니다. 분젠 버너 불꽃에서 접종 루프를 살균한 다음 LB 한천 플레이트에서 박테리아로 가득 찬 쿼터 루프를 LB 육수가 있는 적절하게 라벨링된 시험관으로 옮깁니다.
- 18-24시간 동안 37°C의 진탕(~250rpm) 인큐베이터에서 유산소 조건에서 시험관을 배양합니다.
4. MH 준비 및 S. aureus 및 P. aeruginosa 의 MH 및 항생제 치료 설정(T = 0) (3일차)
- Mueller Hinton 육수 및 한천 플레이트, 2일차의 LB 육수 박테리아 배양물, 멸균 시험관, 얼음의 항생제 재고, 피펫(P20, P200 및 P1000) 및 팁, 15mL 튜브, 혈청학적 피펫 및 피펫터, 마이크로분리 튜브 등 실험에 필요한 재료를 수집합니다.
- 실험이 설정된 날 25% 및 50% MH 원액을 신선하게 준비합니다. MH(1.47g/mL)의 밀도에 따라 멸균 15mL 튜브에 적절한 양의 MH를 넣고 적절한 양의 멸균 Mueller Hinton 육수를 추가합니다. 튜브를 따뜻한 물에 넣고 필요에 따라 뒤집어 MH를 다시 현탁시킵니다.
- Mueller Hinton 육수 10mL에 박테리아 배양 10μL를 첨가하여 멸균 15mL 튜브에서 하룻밤 동안 박테리아 배양액을 1:1000 희석(약 106 CFU/mL)합니다.
- 희석된 배양물을 사용하여 각 박테리아 종에 대해 처리되지 않은 대조군, MH 처리된 샘플(최소 억제 농도, MIC) 및 항생제 처리된 샘플( MIC에서 S. aureus 의 경우 토브라마이신 또는 P. aeruginosa 의 경우 메로페넴)의 세 가지 샘플을 준비합니다.
- 희석된 박테리아 배양액, MH 및 적절한 항생제를 표 1 및 표 2에 표시된 부피의 샘플에 첨가합니다.
- T = 0 샘플에 대해 각각 생존 가능한 플레이트 수(5단계) 및 살아있는/죽은 염색(6단계)을 위해 처리되지 않은 샘플 0.1mL 및 0.5mL를 멸균 미세원심분리 튜브로 옮깁니다.
- 처리되지 않은 대조군, MH 처리 및 항생제 처리(토브라마이신 또는 메로페넴) 샘플을 37°C의 호기성 조건에서 진탕 인큐베이터(250rpm)에서 24시간 동안 배양합니다. T= 0 처리되지 않은 샘플에 대해 생존 가능한 플레이트 계수(5단계) 및 살아있는/죽은 염색(6단계) 기술을 수행합니다.
5. viable plate count 방법을 사용하여 샘플에서 배양 가능한 세포 결정(3-5일차)
- 4일차에는 24시간 샘플 배양 후 마이크로 원심분리 튜브에서 각 샘플 0.1mL 및 0.5mL를 각각 채취하여 생존 가능한 플레이트 수와 살아있는/죽은 염색(6단계)을 확인합니다. 이들은 T = 24 h 샘플입니다.
- 계수 가능한 세포 수(~25-150)를 얻기 위해 LB 브로스에서 생존 가능한 플레이트 계수 시료를 10배 희석하여 수집 당일 T = 0 및 T = 24시간 샘플에 대한 생존 플레이트 계수를 수행합니다.
- 각 희석된 시료 50μL를 LB 한천 플레이트의 1/2에 펴 바릅니다. LB 한천 플레이트를 37 ° C에서 24 시간 동안 호기성 조건에서 배양합니다.
- 다음 날, 인큐베이터에서 LB 한천 플레이트를 제거하고 ~25-150개의 콜로니가 있는 희석 플레이트를 식별합니다. 플레이트의 정확한 콜로니 수를 계수하고 콜로니 형성 단위(CFU/mL= # 콜로니 계수/(플레이팅된 부피, mL)(사용된 희석액))를 사용하여 mL당 배양 가능한 세포 수를 계산합니다.
참고: T = 0 샘플은 3일차에 도금되고 4일차에 분석됩니다. T = 24시간 샘플은 4일째에 도금되고 5일째에 분석됩니다.
6. 살아있는/죽은 염색 및 형광 현미경을 사용하여 샘플에서 생존 가능한 세포 측정(3일 또는 4일차)
- 세포에 유리한 삼투압 환경을 유지하기 위한 0.85% 멸균 NaCl, 피펫(P20, P200 및 P1000) 및 멸균 피펫 팁, 박테리아를 위한 살아있는/죽은 염색 키트, 일회용 혈구계를 포함하여 살아있는/죽은 염색에 필요한 재료를 수집합니다. 살아있는 세포를 염색하는 SYTO 9 염료를 검출하기 위해 FITC(fluorescein isothiocyanate) 필터 세트가 있는 형광 현미경에 액세스할 수 있습니다.
- 0.85% NaCl 0.5mL를 모든 희석되지 않은 T = 0 샘플, 희석되지 않은 T = 24h MH 및 항생제 처리된 샘플과 T = 24h 미처리 대조군 샘플의 1:1000 희석.
- 모든 샘플의 최종 라이브 셀 수에 2를 곱하고 희석된 T = 24시간 미처리 대조군에 1000을 곱합니다. 시료당 1.5μL의 SYTO 9와 1.5μL의 프로피듐 요오드화물을 결합한 다음 혼합물 3μL를 각 시료에 첨가합니다. 21°C의 어두운 곳에서 15분 동안 샘플을 배양합니다.
- 염색되고 부드럽게 혼합된 각 시료 6μL를 일회용 혈구계로 옮기고 FITC 필터와 40x 대물 렌즈가 있는 형광 현미경을 사용하여 확인합니다. 혈구계 그리드 선과 살아있는 녹색 세포를 모두 보여주는 사진을 찍습니다.
- 샘플당 6개의 필드에 있는 녹색 셀을 세고, 볼륨당 녹색 셀의 수를 계산할 수 있도록 그리드의 치수를 기록합니다.
참고: 현재 실험의 필드 치수는 1.05mm x 0.6mm x 0.1mm이며, 이는 0.063mm3 또는 6.3 x 10-5mL 에 해당합니다. mL당 생존 가능한 세포 수를 얻으려면 계수된 살아있는 세포 수를 6.3 x 10-5mL 로 나눈 다음 2(또는 T = 24시간 미처리 대조군인 경우 2000)를 곱합니다.
- 샘플당 6개의 필드에 있는 녹색 셀을 세고, 볼륨당 녹색 셀의 수를 계산할 수 있도록 그리드의 치수를 기록합니다.
7. 생존 가능하지만 배양 불가능한 세포(VBNC)의 수 결정
참고: 생존 플레이트 계수에서 얻은 배양 가능한 세포 수와 살아있는/죽은 염색에서 얻은 생존 세포 수를 사용하여 VBNC의 수를 측정합니다.
- mL당 생존 가능한 세포 수에서 배양 가능한 세포/mL 수를 빼서 VBNCs/mL를 계산합니다.
- Wilcoxon matched-pairs 테스트를 사용하여 각 처리에 대한 VBNC/mL 또는 배양 가능한 cells/mL를 생존 가능한 cells/mL와 비교합니다.
결과
생존 가능하지만 배양할 수 없는(VBNC) 박테리아 생명체는 항생제 치료를 포함한 스트레스 요인에 의해 유발되며 항생제 내성으로 인해 재발성 감염을 유발합니다. MH는 내성이 거의 검출되지 않는 광범위한 항균제이기 때문에 MH가 기존 항생제보다 더 적은 VBNC를 유도한다는 가설이 세워졌습니다. 여기에 설명된 방법은 두 개의 상처 유발 박테리아인 S. aureus 와 P. aeruginosa에 의해 형성된 VBNC를 정량화하는 데 사용되었습니다. VBNC의 수는 살아있는/죽은 염색에 의해 결정된 생존 가능한 세포의 수에서 생존 가능한 플레이트 수에 의해 결정된 배양 가능한 세포의 수를 뺀 값과 같습니다. 표 3 은 S. aureus 및 P. aeruginosa에서 각각 검출된 평균 VBNC의 수를 표시된 시점 및 치료법과 함께 보여줍니다. 이러한 실험에서 직면한 한 가지 과제는 생존 가능한 세포 수가 배양 가능한 세포 수보다 적고 음의 VBNC를 제공하는 경우입니다. 배양 가능한 모든 세포는 번식하고 군체를 형성하는 능력에 따라 생존 가능합니다. 이는 배양 가능한 세포 수가 각 처리에 대한 생존 가능한 세포 수와 현저하게 다른지 여부를 결정함으로써 해결되었습니다. 항생제 투여된 S. aureus 및 P. aeruginosa 의 배양 가능한 세포의 수는 분명히 생존 가능한 세포의 수보다 적지만, 메로페넴 처리된 녹농균(P. aeruginosa )만이 생존 세포보다 배양 가능한 세포가 현저히 적었습니다(그림 1).
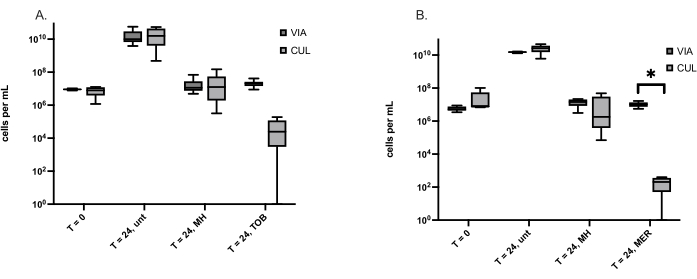
그림 1: 배양 가능한 세포(CUL) 및 생존 세포(VIA)는 각각 생존 플레이트 수와 살아있는/죽은 염색을 사용하여 측정되었습니다. (A) 처리 전(T = 0) 및 24시간 시점에 치료되지 않은(unt) S . 아우레우스 세포, 마누카 꿀(MH) 또는 항생제 토브라마이신(TOB)으로 처리. 상자 그림은 각각 1번의 반복실험이 있는 6개의 독립적인 실험을 나타냅니다. (B) P. aeruginosa 세포는 처리 전(T = 0) 및 24시간에 치료되지 않은(unt), 마누카 꿀(MH) 또는 항생제 메로페넴(MER)으로 처리됩니다. 상자 그림은 5개의 독립적인 실험을 나타내며, 각 실험에는 1번의 반복실험이 있습니다. VIA와 CUL 세포 수(*p < 0.05)를 비교하기 위해 Wilcoxon matched-pairs 테스트를 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 항목 | 처리되지 않은 시료 | MH 샘플, 최종 농도 = 5% | 토브라마이신 샘플, 최종 농도 = 10μg/mL |
| S. 아우레우스 배양 희석 1:1000 | 4 mL | 2 mL | 2 mL |
| 치료 | ________ | 0.5mL의 25% MH 용액 | 0.250mL의 100μg/mL 용액 |
| 멸균 LB 육수 | 1 mL | -------- | 0.25 밀리리터 |
| 최종 볼륨 | 5 밀리리터 | 2.5 밀리리터 | 2.5 밀리리터 |
표 1: S. aureus 항균 처리 샘플을 준비하는 데 필요한 시약 및 부피.
| 항목 | 처리되지 않은 시료 | MH 샘플, 최종 농도 = 18% | 메로페넴 시료, 최종 농도 = 6μg/mL |
| P. aeruginosa 배양 희석 1:1000 | 4 mL | 2 mL | 2 mL |
| 치료 | ________ | 1.44mL의 50% MH 용액 | 0.24mL의 100μg/mL 용액 |
| 멸균 LB 육수 | 4 mL | 0.56 밀리리터 | 1.76 밀리리터 |
| 최종 볼륨 | 8 밀리리터 | 4 mL | 4 mL |
표 2: 녹농 균 항균 처리 샘플을 준비하는 데 필요한 시약 및 부피.
| 시간과 치료 | S. 아우레우스 VBNC | 시간과 치료 | 녹농균 VBNC |
| 티 = 0 | 1.30 엑스 106 | 티 = 0 | -2.05 × 107 |
| T = 24 언트 | 1.30 엑스 106 | T = 24 언트 | -1.09 × 1010 |
| 티 = 24 MH | -1.37 x 107 | 티 = 24 MH | 1.78 엑스 106 |
| 티 = 24TOB | 2.15 엑스 107 | 티 = 24TOB | 1.04 엑스 107 |
표 3: S. aureus 및 P. aeruginosa에서 검출된 평균 VBNC 수. S. aureus 및 P. aeruginosa 샘플에서 생존 가능한 세포 수에서 배양 가능한 세포 수를 빼서 검출된 VBNCs. 약어는 다음과 같습니다 : 처리되지 않은 (unt), 마누카 꿀 (MH), 토브라마이신.
토론
여기에 설명된 프로토콜은 MH 및 기존 항생제의 최소 억제 농도(MIC)로 처리된 상처 유발 박테리아에서 VBNC 세포 집단을 검출할 수 있도록 합니다. 프로토콜의 중요한 단계에는 실험 당일 MH 희석액 준비, 살아있는/죽은 염색 중 샘플 손실 방지, 분석된 부피를 올바르게 계산하는 것이 포함되었습니다. 이 연구와 다른 연구에서 S. aureus 및 P. aeruginosa 에 대한 MH MIC를 실험적으로 측정했습니다27. 1%-20% MH 사이의 MH 비율을 테스트하기 위해 실험에 사용된 배양 배지에서 25% 또는 50%의 원액을 만들었습니다. 흥미롭게도, 희석된 샘플이 노화됨에 따라 효과가 약간 증가하여 MIC가 감소했습니다(Carlson, 미발표 관찰). 100% MH의 연대는 그 효과에 영향을 미치지 않는 것으로 보였지만 신중하게 테스트되지는 않았습니다. MH 효과의 변동을 피하기 위해 25% 및 50% 희석액을 실험 당일에 준비했습니다.
여러 실험에서 생존 가능한 세포의 수가 배양 가능한 세포의 수보다 적기 때문에 음의 수의 VBNC 세포가 계산되었습니다. 모든 배양 가능한 세포는 생존 가능하기 때문에 배양 가능한 세포보다 생존 가능한 세포가 적을 수 없습니다. 살아있는/죽은 세포 분석을 위해 수집된 후처리 샘플의 원심분리 중에 일부 생존 가능한 세포가 손실되었다는 가설이 세워졌습니다. 따라서 샘플 1mL를 원심분리하여 0.85% NaCl에 재현탁시키는 대신 0.5mL의 샘플을 채취하여 0.5mL의 0.85% NaCl에 첨가했습니다. 이로 인해 생존 가능한 세포의 검출이 평균 47% 향상되었지만, 일부 샘플에서는 생존 가능한 세포 수가 여전히 배양 가능한 세포 수보다 낮았습니다. 이는 처리제 간 VBNC 세포 수의 비교를 배제했기 때문에 대신 샘플당 배양 가능한 세포와 생존 가능한 세포를 비교한 결과 MH가 아닌 메로페넴으로 녹농 균을 처리하면 생존 세포보다 배양 가능한 세포가 현저히 적다는 것을 보여주었습니다(그림 1). 배양 가능한 세포와 생존 가능한 세포 간에 유의미한 차이는 많은 VBNC 세포가 존재하지 않음을 시사하는 반면, 배양 가능한 세포가 현저히 적은 수는 VBNC 세포의 수가 많음을 나타냅니다.
이 프로토콜은 MH 처리된 박테리아에서 VBNC 세포 집단을 평가하기 위해 형광 현미경 검사에 의한 살아있는/죽은 염색 및 검출과 미생물학 기법 제품군을 결합합니다. VBNC 세포를 검출하기 위한 다른 기술 및 프로토콜과 비교했을 때, 상대적으로 저렴하며, qPCR 또는 역전사 PCR을 위한 효소나 real-time PCR 기계가 필요하지 않다25,26. 이 프로토콜을 통해 연구자들은 광범위한 박테리아 병원체에 대한 MH의 영향을 탐구하여 VBNC 세포를 형성하고 잠재적으로 MH의 박테리아 저항성에 대한 반항적 메커니즘을 밝힐 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 이스턴 워싱턴 대학교의 두 가지 보조금, 즉 A.R.C에 대한 Faculty Research and Creative Works Grant와 L.T.B.에 대한 Undergraduate Research & Creative Activities Grant의 지원을 받았습니다. Bill과 Connie Cross는 디지털 카메라가 장착된 Leica DMIL 도립 형광 현미경을 구입하기 위해 EWU에 자금을 기부했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Mueller Hinton broth | Fisher Bioreagents | B12322 | |
| Luria Bertani (LB) broth | Fisher Bioreagents | BP142602 | |
| BD Difco Agar | Fisher Scientific | DF0812-07-1 | |
| sodium chloride | Sigma | S3014-500g | |
| meropenem | TargetMol | T0224 | |
| tobramycin | Selleck Chemicals | S2514 | |
| Staphylococcus aureus | ATCC | ATCC29213 | |
| Pseudomonas aeruginosa | ATCC | ATCC9721 | |
| shaking incubator | Eppendorf | M13520000 | |
| incubator | Benchmark Scientific | H2200-H | |
| Manukaguard Manuka Honey | Amazon | NA | |
| DMIL inverted fluorescent microscope | Leica Microsystems | 11521265 | |
| Digital camera | Leica Microsystems | 12730522 | |
| 15 mL falcon tubes | Genesee Scientific | 28-103 | |
| serological pipets | Diagnocine | DP-LB0100005, DP-LB010010 | |
| Pipet Aid Pipettor | Drummond Scientific Company | 4-000-101 | |
| Bunsen burner | Fisher Scientific | S48108 | |
| Rainin pipets | Pipette.com | L-20, L-200, L-1000 | |
| balance | Mettler Toledo | XS603S | |
| 96-well plate | Falcon | 351172 | |
| inoculating loop | Fisher Scientific | 13-104-5 | |
| isopropanol | Fisher Scientific | BP2618-1 | |
| glass spreader | homemade | NA | |
| Live dead staining kit for bacteria | Invitrogen | L7012 | |
| microfuge tubes | Biologix Research Company | SKU 80-1500/P80-1500 | |
| tin foil | Costco | NA | |
| Figure making software | GraphPad | NA | GraphPad Prism was used for making figures and conducting statistical analyses. |
참고문헌
- Spoering, A., Lewis, K. Biofilms and planktonic cells of Pseudomonas aeruginosa have similar resistance to killing by antimicrobials. J Bacteriol. 183 (23), 6746-6751 (2001).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa strains producing high levels of persister cells in patients with cystic fibrosis. J Bacteriol. 192 (23), 6191-6199 (2010).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. F Microbiol. 5, 00258 (2014).
- Reygaert, W. C. An overview of the antimicrobial resistance mechanisms of bacteria. AIMS Microbiol. 4 (3), 482-450 (2018).
- Ayrapetyan, M., Williams, T. C., Baxter, R., Oliver, J. D. Viable but nonculturable and persister cells coexist stochastically and are induced by human serum. Infect Immun. 83 (11), 4194-4203 (2015).
- Cabral, D. J., Wurster, J. I., Belenky, P. Antibiotic persistence as a metabolic adaptation: Stress, metabolism, the host, and new directions. PHARH2. 11 (1), 11010014 (2018).
- Heidelberg, J. F., et al. Effect of aerosolization on culturability and viability of gram-negative bacteria. Appl Environ Microbiol. 63 (9), 3585-3588 (1997).
- Cook, K. L., Bolster, C. H. Survival of Campylobacter jejuni and Escherichia coli in groundwater during prolonged starvation at low temperatures. J Appl Microbiol. 103 (3), 573-583 (2007).
- Xu, H. S., et al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment. Microbl Ecol. 8 (4), 313-323 (1982).
- Qi, Z., Huang, Z., Liu, C. Metabolism differences of biofilm and planktonic Pseudomonas aeruginosa in viable but nonculturable state induced by chlorine stress. Sci Total Environ. 821, 153374 (2022).
- Li, Y., et al. Study on the Viable but Non-culturable (VBNC) state formation of staphylococcus aureus and its control in food system. F Microbiol. 11, 599739 (2020).
- Oryan, A., Alemzadeh, E., Moshiri, A. Biological properties and therapeutic activities of honey in wound healing: A narrative review and meta-analysis. J Tissue Viability. 25 (2), 98-118 (2016).
- Lusby, P. E., Coombes, A. L., Wilkinson, J. M. Bactericidal Activity of different honeys against pathogenic bacteria. Arch Med Res. 36 (5), 464-467 (2005).
- Mandal, M. D., Mandal, S. Honey: Its medicinal property and antibacterial activity. Asian Pac J Trop. Biomed. 1 (2), 154-160 (2011).
- Carter, D. A., et al. Therapeutic Manuka Honey: No longer so alternative. F Microbiol. 7, 00569 (2016).
- Cooper, R. A., Molan, P. C., Harding, K. G. The sensitivity to honey of Gram-positive cocci of clinical significance isolated from wounds. J Appl Microbiol. 93 (5), 857-863 (2002).
- George Narelle May, C., Keith, F. Antibacterial Honey: In-vitro activity against clinical isolates of MRSA, VRE, and other multiresistant Gram-negative organisms. HMP Global Learning Network. , (2007).
- Blair, S. E., Cokcetin, N. N., Harry, E. J., Carter, D. A. The unusual antibacterial activity of medical-grade Leptospermum honey: Antibacterial spectrum, resistance and transcriptome analysis. Eur Soc Clin Microbiol. 28 (10), 1199-1208 (2009).
- Cooper, R. A., Jenkins, L., Henriques, A. F. M., Duggan, R. S., Burton, N. F. Absence of bacterial resistance to medical-grade manuka honey. Eur Soc Clin Microbiol. 29 (10), 1237-1241 (2010).
- Lu, J., et al. Honey can inhibit and eliminate biofilms produced by Pseudomonas aeruginosa. Sci Rep. 9 (1), 18160 (2019).
- Bischofberger, A. M., Pfrunder Cardozo, K. R., Baumgartner, M., Hall, A. R. Evolution of honey resistance in experimental populations of bacteria depends on the type of honey and has no major side effects for antibiotic susceptibility. Evol Appl. 14 (5), 1314-1327 (2021).
- Cunningham, E., O'Byrne, C., Oliver, J. D. Effect of weak acids on Listeria monocytogenes survival: Evidence for a viable but nonculturable state in response to low pH. Food Control. 20 (12), 1141-1144 (2009).
- Kogure, K., Simidu, U., Taga, N. A tentative direct microscopic method for counting living marine bacteria. Can J Microbiol. 25 (3), 415-420 (1979).
- Albertini, M. C., et al. Use of multiparameter analysis for Vibrio alginolyticus viable but nonculturable state determination. Cytom J Int Soc Anal Cytol. 69 (4), 260-265 (2006).
- Nocker, A., Camper, A. K. Novel approaches toward preferential detection of viable cells using nucleic acid amplification techniques. FEMS Microbiol Lett. 291 (2), 137-142 (2009).
- Trevors, J. T. Viable but non-culturable (VBNC) bacteria: Gene expression in planktonic and biofilm cells. J Microbiol Methods. 86 (2), 266-273 (2011).
- Ankley, L. M., Monteiro, M. P., Camp, K. M., O'Quinn, R., Castillo, A. R. Manuka honey chelates iron and impacts iron regulation in key bacterial pathogens. J App Microbiol. 128 (4), 1015-1024 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.
