Method Article
Tinción viva/muerta para cuantificar células viables pero no cultivables en bacterias causantes de heridas tratadas con miel de Manuka
En este artículo
Resumen
El protocolo presentado describe un procedimiento para cuantificar células viables pero no cultivables (VBNC) en cultivos bacterianos tratados con miel de Manuka.
Resumen
La resistencia y tolerancia a los antibióticos entre las bacterias representa una amenaza significativa para la salud mundial. Los mecanismos que contribuyen a la resistencia y tolerancia a los antibióticos incluyen mutaciones genéticas y la adquisición de genes de resistencia, y la transición a estados viables pero no cultivables (VBNC) y otros estados de latencia, respectivamente. Aunque genéticamente son idénticas a sus contrapartes no tolerantes a los antibióticos, las células VBNC evaden los efectos de los antibióticos al permanecer metabólicamente inactivas. Los antibióticos son eficaces solo cuando sus procesos objetivo, como la replicación del ADN o la transcripción, están activos. Dado que los factores estresantes ambientales, en particular los antibióticos, pueden hacer que las bacterias entren en latencia, se necesitan antimicrobianos alternativos para minimizar o prevenir esta respuesta. El antimicrobiano Miel de Manuka (MH) es eficaz contra muchas bacterias, con un raro desarrollo de resistencia. Sus mecanismos antimicrobianos multifacéticos lo convierten en un agente valioso para el tratamiento de infecciones bacterianas. Esta investigación investigó la recalcitrancia de la MH al desarrollo de resistencia a los antibióticos probando la hipótesis de que la MH induce menos células VBNC que los antibióticos convencionales. Para investigar esto, se desarrolló un protocolo para tratar las bacterias causantes de heridas Staphylococcus aureus y Pseudomonas aeruginosa con concentraciones inhibitorias mínimas de MH o los antibióticos convencionales tobramicina o meropenem, que luego utilizaron el recuento de placas viables para identificar células cultivables metabólicamente activas y la tinción viva/muerta para identificar todas las células viables. El número de células VBNC es igual al número de células viables menos el número de células cultivables. En algunos experimentos, el número de células cultivables fue mayor que el número de células viables, dando un número negativo de células VBNC; por lo tanto, los números de células VBNC no se compararon directamente. En su lugar, se compararon los números de células cultivables y viables para cada tratamiento. Solo P. aeruginosa tratada con tobramicina tenía significativamente menos células cultivables que las células viables, lo que indica un mayor número de células VBNC. Este protocolo es rápido y sencillo y se puede utilizar para evaluar la inducción de MH de células VBNC en otras bacterias patógenas.
Introducción
Las bacterias en estado de latencia viable pero no cultivable (VBNC) sobreviven al tratamiento con antibióticos y causan enfermedades infecciosas recurrentes y, a veces, mortales 1,2,3. Más familiar para nosotros es la resistencia a los antibióticos, que ocurre a través de un cambio genético hereditario4. El cambio genético proporciona resistencia a un antibiótico específico mediante varios mecanismos, incluyendo la limitación de la absorción de un antibiótico, el aumento del flujo del antibiótico, la modificación del antibiótico objetivo o la inactivación del antibiótico4. Por el contrario, las bacterias en estado de latencia exhiben una tolerancia antibiótica más amplia y no heredable al reducir su metabolismo 2,3. Los antibióticos se dirigen a procesos metabólicos específicos, incluida la replicación del ADN y la síntesis de la pared celular, y son ineficacescontra las células VBNC metabólicamente inactivas. Las células VBNC existen estocásticamente en cantidades bajas junto con sus hermanas genéticamente idénticas susceptibles a los antibióticos en la mayoría de las poblaciones bacterianas5. Sin embargo, los factores de estrés ambiental, incluida la exposición a antibióticos, inducen a las células bacterianas susceptibles a entrar en el estado VBNC tolerante a los antibióticos 3,6. El tratamiento con antibióticos matará las células susceptibles a los antibióticos dentro de la población, mientras que las células VBNC inactivas permanecen. Como su nombre indica, las células VBNC no son cultivables en medios adecuados para el crecimiento de sus hermanos metabólicamente activos. Sin embargo, sus membranas y material genético no están dañados y pueden reproducirse 7,8. Cuando se eliminan los antibióticos, se requieren estímulos específicos como los nutrientes, la temperatura o los factores del huésped para despertar a las células VBNC de su estado de latencia y restaurar el crecimiento 3,9. Las células VBNC han sido documentadas en muchas especies bacterianas patógenas, incluyendo P. aeruginosa y S. aureus, principales agentes etiológicos de infecciones de heridas10,11.
La miel se ha utilizado durante mucho tiempo en aplicaciones médicas, incluido el tratamiento de heridas, debido a sus propiedades antibacterianas12. La miel de Manuka (MH), derivada de las flores del arbusto de Manuka (Leptospermum scoparium), se ha destacado por su actividad bactericida de amplio espectro (revisado en 13,14,15). Mata con éxito la mayoría de las bacterias causantes de infecciones humanas analizadas, incluidas las cepas bacterianas como el Staphylococcus aureus resistente a la meticilina y el Enterococcus resistente a la vancomicina que exhiben resistencia hereditaria a los antibióticos tradicionales16,17. Además, la resistencia bacteriana inducida a la MH es rara, ya que solo se detecta en biopelículas de P. aeruginosa expuestas a la miel y Escherichia coli cultivadas en concentraciones crecientes de un subconjunto de la miel analizada 18,19,20,21. Esto sugiere que los mecanismos antimicrobianos de la MH son distintos de los antibióticos convencionales y pueden inducir menos o ninguna célula VBNC. Esta hipótesis se probó determinando cómo la MH afecta a las poblaciones de VBNC en comparación con los antibióticos convencionales.
Las células VBNC deben distinguirse de sus hermanas cultivables metabólicamente activas y de las células muertas. Las células cultivables se cuentan utilizando la técnica de recuento en placa viable, en la que las células se transfieren a medios de cultivo de rutina y se incuban durante un período suficiente para que haya suficientes divisiones celulares que den lugar a colonias observables. Se han desarrollado varios métodos para distinguir las células VBNC de las células muertas basándose en sus membranas intactas y en la transcripción de bajo nivel. La absorción de sustrato y colorante fluorescente, combinada con microscopía o citometría de flujo, permite el recuento directo de células por microscopía o citometría de flujo con un color que indica membranas intactas22,23. Los ensayos de respiración que requieren que la cadena de transporte de electrones esté presente en una membrana celular intacta también se han utilizado para distinguir entre células viables y muertas24. También se han desarrollado métodos de PCR cuantitativa (qPCR) combinados con colorantes modificadores del ADN que evitan la amplificación; solo se amplificará el ADN de las células viables, ya que las membranas intactas excluyen el colorante25. Aunque las células VBNC están inactivas, todavía transcriben genes a un nivel bajo, y esto también se puede usar para distinguirlas de las células muertas mediante PCR26 con transcripción inversa.
En este trabajo, se desarrolló un ensayo para cuantificar células VBNC en dos bacterias patógenas causantes de heridas, S. aureus y P. aeruginosa, tratadas con MH. Describe el tratamiento de las bacterias con MH y antibióticos convencionales y el uso del recuento de placas viables y la tinción viva/muerta para detectar células cultivables y viables. Este protocolo fácil y económico permitirá analizar la capacidad de MH para inducir células VBNC resistentes a los antibióticos en muchos patógenos bacterianos.
Protocolo
Dado que P. aeruginosa (ATCC9721) y S. aureus (ATCC29213) están clasificados como agentes de nivel de bioseguridad 2, las salas donde se realiza el trabajo deben tener acceso limitado y estar equipadas con una cabina de bioseguridad para manipulaciones que puedan crear salpicaduras o aerosoles, como cultivos agitadores y centrifugadores. En todos los pasos de este protocolo, use equipo de protección personal (EPP), que incluya una bata de laboratorio, gafas protectoras y guantes. Todos los reactivos y equipos utilizados en los experimentos se enumeran en la Tabla de Materiales.
1. Preparación de caldo estéril y medios de cultivo en agar
- Prepare Luria Bertani y Mueller Hinton, NaCl (0,85%), antibióticos y cristalería.
- Prepare el medio de caldo de acuerdo con las instrucciones del fabricante, agregando polvo de agar al 1,5% para el medio de agar. Añadir 0,85 g de NaCl a 100 mL de dH20 para preparar NaCl al 0,85%. Aplique cinta de autoclave en los recipientes, colóquelos en un recipiente apto para autoclave y autoclave en un ciclo de líquido adecuado para los volúmenes utilizados.
- Cuando se complete el ciclo del autoclave, enfríe el agar a aproximadamente 60 °C antes de verterlo en placas de Petri estériles.
- Preparar 100 μg/mL de soluciones madre de los antibióticos tobramicina y meropenem en dH2O para la dilución y tratamiento de bacterias. Esterilice las existencias de antibióticos con una jeringa estéril de 5 ml conectada a un filtro estéril de 0,2 μm.
- Almacene las existencias de antibióticos esterilizados a -20 °C en múltiples alícuotas pequeñas para evitar la pérdida de actividad debido a múltiples ciclos de congelación y descongelación.
2. Recuperación de las cepas archivadas de Staphylococcus aureus y Pseudomonas aeruginosa a -80 °C (Día 1)
- Reúna los materiales para rayar una pequeña alícuota de las cepas bacterianas congeladas de sus viales de congelación a 80 °C en agar Luria Bertani (LB). Esto incluye múltiples palitos de madera estériles y una placa de agar LB etiquetada con el organismo y la fecha.
- Abra el congelador a -80 °C, retire rápidamente los viales de interés y cierre la puerta del congelador. Abra cada vial secuencialmente y use una varilla estéril para raspar una pequeña cantidad de bacterias congeladas en la placa de agar LB debidamente etiquetada. Vuelva a colocar el tapón del vial y devuélvalo rápidamente al congelador a -80 °C.
- Incubar las placas de agar LB inoculadas, con el agar hacia arriba, a 37 °C en condiciones aeróbicas (atmosféricas) durante 18-24 h. Después del período de incubación, selle las placas de agar LB inoculadas con cinta de injerto y guárdelas a 4 °C durante no más de una semana. Inocular semanalmente cultivos bacterianos frescos del caldo congelado a -80 °C según sea necesario.
3. Preparación de S. aureus y P. aeruginosa para el tratamiento con Miel de Manuka (MH) y el antibiótico (Día 2)
- Reúna los materiales necesarios para iniciar un cultivo de caldo LB de cada cepa, incluidos pequeños tubos de ensayo estériles, pipetas serológicas de 5 mL, caldo LB estéril y un asa de inoculación. Además, reúna una pipeta manual o eléctrica para usar con pipetas serológicas, un mechero Bunsen y una incubadora agitadora.
- Trabajando junto a la llama del mechero Bunsen, use una pipeta serológica para transferir 2 mL de caldo LB a dos tubos de ensayo estériles. Esterilice el circuito de inoculación en la llama del mechero Bunsen y luego transfiera un cuarto de bucle lleno de bacterias de las placas de agar LB al tubo de ensayo debidamente etiquetado con caldo LB.
- Incubar el tubo de ensayo en condiciones aeróbicas en una incubadora agitadora (~250 rpm) a 37 °C durante 18-24 h.
4. Preparación de MH y puesta en marcha de tratamientos con MH y antibióticos de S. aureus y P. aeruginosa (T = 0) (Día 3)
- Reúna los materiales necesarios para el experimento, incluido el caldo Mueller Hinton y las placas de agar, los cultivos bacterianos de caldo LB del día 2, los tubos de ensayo estériles, las existencias de antibióticos en hielo, las pipetas (P20, P200 y P1000) y puntas, tubos de 15 ml, pipetas serológicas y una pipeta, y tubos de microfuga.
- Prepare las soluciones madre de MH al 25% y al 50% frescas el día en que se configure el experimento. En función de la densidad de MH (1,47 g/mL), pese la cantidad adecuada de MH en un tubo estéril de 15 mL y añada la cantidad adecuada de caldo Mueller Hinton estéril. Vuelva a suspender el MH colocando los tubos en agua tibia e invirtiéndolos según sea necesario.
- Prepare una dilución 1:1000 (aproximadamente 106 UFC/mL) de los cultivos bacterianos nocturnos en tubos estériles de 15 mL agregando 10 μL del cultivo bacteriano a 10 mL de caldo Mueller Hinton.
- Utilice los cultivos diluidos para preparar tres muestras para cada especie bacteriana: un control sin tratar, una muestra tratada con MH (a la concentración inhibitoria mínima, MIC) y una muestra tratada con antibióticos (tobramicina para S. aureus o meropenem para P. aeruginosa, en el MIC).
- Añadir el cultivo bacteriano diluido, MH y el antibiótico adecuado a las muestras en los volúmenes indicados en la Tabla 1 y la Tabla 2.
- Transfiera 0,1 mL y 0,5 mL de la muestra no tratada a tubos de microcentrífuga estériles para el recuento de placas viables (paso 5) y la tinción viva/muerta (paso 6), respectivamente, para las muestras T = 0.
- Incubar las muestras de control no tratadas, tratadas con MH y tratadas con antibióticos (tobramicina o meropenem) en condiciones aeróbicas a 37 °C en una incubadora agitadora (250 rpm) durante 24 h. Realice las técnicas de recuento en placa viable (paso 5) y tinción viva/muerta (paso 6) en las muestras T= 0 no tratadas.
5. Determinación de las células cultivables en muestras utilizando el método de recuento en placa viable (Día 3 - 5)
- El día 4, después de la incubación de la muestra de 24 horas, recoja 0,1 mL y 0,5 mL de cada muestra en tubos de microcentrífuga para el recuento de placas viables y la tinción viva/muerta (paso 6), respectivamente. Estas serán las muestras T = 24 h.
- Realice el recuento de placas viables en muestras T = 0 y T = 24 h el día en que se recolectan preparando diluciones de 10 veces de las muestras de recuento de placas viables en caldo LB para obtener un número contable de células (~25-150).
- Extienda 50 μL de cada muestra diluida en 1/2 placa de agar LB. Incubar las placas de agar LB en condiciones aeróbicas a 37 °C durante 24 h.
- Al día siguiente, retire las placas de agar LB de la incubadora e identifique la placa de dilución que tiene ~ 25-150 colonias. Cuente el número exacto de colonias en la placa y utilice la fórmula de unidades formadoras de colonias (UFC) (UFC/mL= # colonias contadas/ (volumen plateado, mL) (dilución utilizada)) para determinar el número de células cultivables por mL.
NOTA: La muestra T = 0 se sembrará el día 3 y se analizará el día 4; las muestras T = 24 h se sembrarán el día 4 y se analizarán el día 5.
6. Determinación de las células viables en las muestras mediante tinción viva/muerta y microscopía fluorescente (día 3 o 4)
- Reúna los materiales necesarios para la tinción de vivos/muertos, incluido el NaCl estéril al 0,85 % para mantener un entorno osmótico favorable para las células, las pipetas (P20, P200 y P1000) y las puntas de pipeta estériles, un kit de tinción de bacterias vivas/muertas y un hemocitómetro desechable. Obtenga acceso a un microscopio fluorescente con un filtro de isotiocianato de fluoresceína (FITC) para detectar el colorante SYTO 9, que tiñe las células vivas.
- Añadir 0,5 mL de NaCl al 0,85% a 0,5 mL de cada una de las siguientes muestras vivas/muertas: todas las muestras T = 0 sin diluir, T sin diluir = 24 h MH y muestras tratadas con antibióticos, y una dilución 1:1000 de la muestra de control T = 24 h sin tratar.
- Asegúrese de multiplicar por dos los recuentos finales de células vivas de todas las muestras y multiplicar por 1000 el control diluido T = 24 h sin tratar. Combine 1,5 μL de SYTO 9 y 1,5 μL de yoduro de propidio por muestra, y luego agregue 3 μL de la mezcla a cada muestra. Incubar las muestras a 21 °C en la oscuridad durante 15 min.
- Transfiera 6 μL de cada muestra teñida y mezclada suavemente a un hemocitómetro desechable y visualícela con un microscopio fluorescente con el filtro FITC y una lente de objetivo de 40x. Tome una foto que muestre las líneas de la cuadrícula del hemocitómetro y las células verdes vivas.
- Cuente las celdas verdes en seis campos por muestra, anotando las dimensiones de la cuadrícula para que se pueda calcular el número de celdas verdes por volumen.
NOTA: Las dimensiones del campo en los experimentos actuales son 1,05 mm x 0,6 mm x 0,1 mm, lo que corresponde a 0,063 mm3 o 6,3 x 10-5 mL. Para obtener el número de células viables por mL, divida el número de células vivas contadas por 6,3 x 10-5 mL, y luego multiplíquelas por dos (o 2000 si es el control T = 24 h sin tratar).
- Cuente las celdas verdes en seis campos por muestra, anotando las dimensiones de la cuadrícula para que se pueda calcular el número de celdas verdes por volumen.
7. Determinación del número de células viables pero no cultivables (VBNCs)
NOTA: Utilice el número de células cultivables obtenido del recuento de placas viables y el número de células viables obtenido de la tinción viva/muerta para determinar el número de VBNCs.
- Calcule las VBNCs/mL restando el número de células cultivables/mL del número de células viables por mL.
- Utilice una prueba de pares emparejados de Wilcoxon para comparar las VBNC/mL o las células cultivables/mL con las células viables/mL para cada tratamiento.
Resultados
Las formas de vida bacterianas viables pero no cultivables (VBNC, por sus siglas en inglés) son inducidas por factores estresantes, incluido el tratamiento con antibióticos, y causan infecciones recurrentes debido a su tolerancia a los antibióticos. Debido a que la MH es un antimicrobiano de amplio espectro al que rara vez se ha detectado resistencia, se planteó la hipótesis de que la MH indujo menos VBNC que los antibióticos convencionales. El método descrito aquí se utilizó para cuantificar las VBNC formadas por dos bacterias causantes de heridas, S. aureus y P. aeruginosa. El número de VBNC es igual al número de células viables determinado por la tinción viva/muerta menos el número de células cultivables determinado por el recuento en placa viable. En la Tabla 3 se muestra el número promedio de VBNCs detectadas en S. aureus y P. aeruginosa, respectivamente, con los puntos temporales y tratamientos indicados. Uno de los retos a los que se enfrentan estos experimentos es cuando el número viable de células es menor que el número de células cultivables y da un número negativo de VBNCs. Todas las células cultivables son viables, en función de su capacidad para reproducirse y formar colonias. Esto se abordó determinando si el número de células cultivables era significativamente diferente del número de células viables para cada tratamiento. El número de células cultivables para S. aureus y P. aeruginosa tratadas con antibióticos es claramente menor que el número de células viables, pero solo la P. aeruginosa tratada con meropenem tenía significativamente menos células cultivables que células viables (Figura 1).
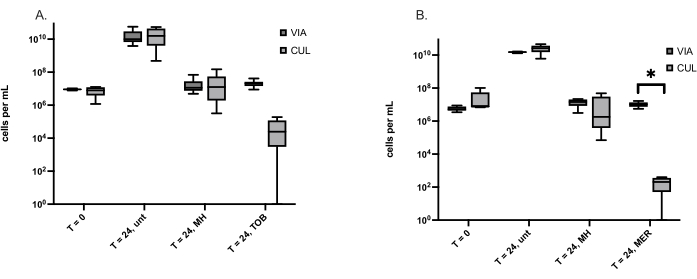
Figura 1: Células cultivables (CUL) y viables (VIA) determinadas mediante el recuento de placas viables y la tinción viva/muerta, respectivamente. (A) Células de S. aureus antes del tratamiento (T = 0) y a las 24 h, sin tratar (unt), tratadas con miel de Manuka (MH) o el antibiótico tobramicina (TOB). Los diagramas de caja representan seis experimentos independientes, cada uno con una réplica. (B) Células de P. aeruginosa antes del tratamiento (T = 0) y a las 24 h, sin tratar (unt), tratadas con Miel de Manuka (MH) o el antibiótico meropenem (MER). Los diagramas de caja representan cinco experimentos independientes, cada uno con una réplica. Se utilizó una prueba de pares emparejados de Wilcoxon para comparar los números de células VIA y CUL, *p < 0,05. Haga clic aquí para ver una versión más grande de esta figura.
| Artículo | Muestra sin tratar | Muestra MH, concentración final = 5% | Muestra de tobramicina, concentración final = 10 μg/mL |
| Cultivo de S. aureus diluido 1:1000 | 4 mL | 2 mL | 2 mL |
| Tratamiento | ________ | 0,5 mL de solución MH al 25% | 0,250 mL de solución de 100 μg/mL |
| Caldo LB estéril | 1 mL | -------- | 0,25 ml |
| Volumen final | 5 mL | 2.5 mL | 2.5 mL |
Tabla 1: Reactivos y volúmenes necesarios para la preparación de muestras de tratamiento antimicrobiano con S. aureus .
| Artículo | Muestra sin tratar | Muestra MH, concentración final = 18% | Muestra de meropenem, concentración final = 6 μg/mL |
| Cultivo de P. aeruginosa diluido 1:1000 | 4 mL | 2 mL | 2 mL |
| Tratamiento | ________ | 1,44 mL de solución MH al 50% | 0,24 mL de solución de 100 μg/mL |
| Caldo LB estéril | 4 mL | 0,56 ml | 1,76 ml |
| Volumen final | 8 mL | 4 mL | 4 mL |
Tabla 2: Reactivos y volúmenes necesarios para la preparación de muestras de tratamiento antimicrobiano con P. aeruginosa .
| Tiempo y tratamiento | S. aureus VBNC | Tiempo y tratamiento | P. aeruginosa VBNC |
| T = 0 | 1,30 x 106 | T = 0 | -2,05 x 107 |
| T = 24 unt | 1,30 x 106 | T = 24 unt | -1,09 x 1010 |
| T = 24 MH | -1,37 x 107 | T = 24 MH | 1,78 x 106 |
| T = 24 TOB | 2.15 x 107 | T = 24 TOB | 1,04 x 107 |
Tabla 3: Número promedio de VBNCs detectadas en S. aureus y P. aeruginosa. VBNCs detectadas en muestras de S. aureus y P. aeruginosa restando el número de células cultivables del número de células viables. Las abreviaturas son las siguientes: sin tratar (unt), Miel de Manuka (MH), Tobramicina.
Discusión
El protocolo descrito aquí permite la detección de poblaciones de células VBNC en bacterias causantes de heridas tratadas con concentraciones mínimas inhibitorias (MIC) de MH y antibióticos convencionales. Los pasos críticos del protocolo incluyeron la preparación de las diluciones de MH el día del experimento, la prevención de la pérdida de muestras durante la tinción viva/muerta y el cálculo correcto del volumen analizado. Para este y otros estudios, se determinaron experimentalmente las CMI de MH para S. aureus y P. aeruginosa 27. En preparación para probar porcentajes de MH entre 1% y 20% de MH, se hicieron soluciones madre de 25% o 50% en los medios de cultivo utilizados en los experimentos. Curiosamente, a medida que las muestras diluidas envejecen, su efectividad aumenta ligeramente, disminuyendo la CMI (Carlson, observaciones no publicadas). La edad del 100% de MH no pareció afectar su efectividad, aunque esto no se probó cuidadosamente. Para evitar la variación en la efectividad de la MH, las diluciones al 25% y al 50% se prepararon el día del experimento.
En múltiples experimentos, se calculó un número negativo de células VBNC debido a que el número de células viables era menor que el número de células cultivables. Debido a que todas las células cultivables son viables, no es posible tener menos células viables que células cultivables. Se planteó la hipótesis de que algunas células viables se perdieron durante la centrifugación de las muestras posteriores al tratamiento recogidas para el análisis de células vivas/muertas. Así, en lugar de centrifugar 1 mL de las muestras y resuspenderlas en NaCl al 0,85%, se recogieron 0,5 mL de la muestra y se añadieron a 0,5 mL de NaCl al 0,85%. Aunque esto mejoró la detección de células viables en un promedio del 47%, en algunas muestras, el número de células viables seguía siendo menor que el número de células cultivables. Dado que esto impedía la comparación del número de células VBNC entre los tratamientos, se compararon las células cultivables y viables por muestra y se demostró que el tratamiento de P. aeruginosa con meropenem, pero no con MH, produjo significativamente menos células cultivables que viables (Figura 1). No hubo diferencias significativas entre las células cultivables y viables que sugirieran que muchas células VBNC no estuvieran presentes, mientras que un número significativamente menor de células cultivables indicó un alto número de células VBNC.
Este protocolo combina un conjunto de técnicas microbiológicas con tinción viva/muerta y detección por microscopía fluorescente para evaluar las poblaciones de células VBNC en bacterias tratadas con MH. En comparación con otras técnicas y protocolos para la detección de células VBNC, es relativamente barata y no requiere enzimas para la qPCR o la PCR con transcripción inversa, ni una máquina de PCR en tiempo real 25,26. Este protocolo permitirá a los investigadores explorar el impacto de MH en una amplia gama de patógenos bacterianos para formar células VBNC y potencialmente revelar un mecanismo para la recalcitrancia de MH a la resistencia bacteriana.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue financiado por dos becas de la Universidad del Este de Washington, la Beca de Investigación de la Facultad y Trabajos Creativos a A.R.C y la Beca de Investigación de Pregrado y Actividades Creativas a L.T.B. Bill y Connie Cross donaron fondos a EWU para comprar el microscopio fluorescente invertido Leica DMIL con una cámara digital.
Materiales
| Name | Company | Catalog Number | Comments |
| Mueller Hinton broth | Fisher Bioreagents | B12322 | |
| Luria Bertani (LB) broth | Fisher Bioreagents | BP142602 | |
| BD Difco Agar | Fisher Scientific | DF0812-07-1 | |
| sodium chloride | Sigma | S3014-500g | |
| meropenem | TargetMol | T0224 | |
| tobramycin | Selleck Chemicals | S2514 | |
| Staphylococcus aureus | ATCC | ATCC29213 | |
| Pseudomonas aeruginosa | ATCC | ATCC9721 | |
| shaking incubator | Eppendorf | M13520000 | |
| incubator | Benchmark Scientific | H2200-H | |
| Manukaguard Manuka Honey | Amazon | NA | |
| DMIL inverted fluorescent microscope | Leica Microsystems | 11521265 | |
| Digital camera | Leica Microsystems | 12730522 | |
| 15 mL falcon tubes | Genesee Scientific | 28-103 | |
| serological pipets | Diagnocine | DP-LB0100005, DP-LB010010 | |
| Pipet Aid Pipettor | Drummond Scientific Company | 4-000-101 | |
| Bunsen burner | Fisher Scientific | S48108 | |
| Rainin pipets | Pipette.com | L-20, L-200, L-1000 | |
| balance | Mettler Toledo | XS603S | |
| 96-well plate | Falcon | 351172 | |
| inoculating loop | Fisher Scientific | 13-104-5 | |
| isopropanol | Fisher Scientific | BP2618-1 | |
| glass spreader | homemade | NA | |
| Live dead staining kit for bacteria | Invitrogen | L7012 | |
| microfuge tubes | Biologix Research Company | SKU 80-1500/P80-1500 | |
| tin foil | Costco | NA | |
| Figure making software | GraphPad | NA | GraphPad Prism was used for making figures and conducting statistical analyses. |
Referencias
- Spoering, A., Lewis, K. Biofilms and planktonic cells of Pseudomonas aeruginosa have similar resistance to killing by antimicrobials. J Bacteriol. 183 (23), 6746-6751 (2001).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa strains producing high levels of persister cells in patients with cystic fibrosis. J Bacteriol. 192 (23), 6191-6199 (2010).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. F Microbiol. 5, 00258(2014).
- Reygaert, W. C. An overview of the antimicrobial resistance mechanisms of bacteria. AIMS Microbiol. 4 (3), 482-450 (2018).
- Ayrapetyan, M., Williams, T. C., Baxter, R., Oliver, J. D. Viable but nonculturable and persister cells coexist stochastically and are induced by human serum. Infect Immun. 83 (11), 4194-4203 (2015).
- Cabral, D. J., Wurster, J. I., Belenky, P. Antibiotic persistence as a metabolic adaptation: Stress, metabolism, the host, and new directions. PHARH2. 11 (1), 11010014(2018).
- Heidelberg, J. F., et al. Effect of aerosolization on culturability and viability of gram-negative bacteria. Appl Environ Microbiol. 63 (9), 3585-3588 (1997).
- Cook, K. L., Bolster, C. H. Survival of Campylobacter jejuni and Escherichia coli in groundwater during prolonged starvation at low temperatures. J Appl Microbiol. 103 (3), 573-583 (2007).
- Xu, H. S., et al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment. Microbl Ecol. 8 (4), 313-323 (1982).
- Qi, Z., Huang, Z., Liu, C. Metabolism differences of biofilm and planktonic Pseudomonas aeruginosa in viable but nonculturable state induced by chlorine stress. Sci Total Environ. 821, 153374(2022).
- Li, Y., et al. Study on the Viable but Non-culturable (VBNC) state formation of staphylococcus aureus and its control in food system. F Microbiol. 11, 599739(2020).
- Oryan, A., Alemzadeh, E., Moshiri, A. Biological properties and therapeutic activities of honey in wound healing: A narrative review and meta-analysis. J Tissue Viability. 25 (2), 98-118 (2016).
- Lusby, P. E., Coombes, A. L., Wilkinson, J. M. Bactericidal Activity of different honeys against pathogenic bacteria. Arch Med Res. 36 (5), 464-467 (2005).
- Mandal, M. D., Mandal, S. Honey: Its medicinal property and antibacterial activity. Asian Pac J Trop. Biomed. 1 (2), 154-160 (2011).
- Carter, D. A., et al. Therapeutic Manuka Honey: No longer so alternative. F Microbiol. 7, 00569(2016).
- Cooper, R. A., Molan, P. C., Harding, K. G. The sensitivity to honey of Gram-positive cocci of clinical significance isolated from wounds. J Appl Microbiol. 93 (5), 857-863 (2002).
- George Narelle May, C., Keith, F. Antibacterial Honey: In-vitro activity against clinical isolates of MRSA, VRE, and other multiresistant Gram-negative organisms. HMP Global Learning Network. , https://www.hmpgloballearningnetwork.com/site/wounds/article/7751 (2007).
- Blair, S. E., Cokcetin, N. N., Harry, E. J., Carter, D. A. The unusual antibacterial activity of medical-grade Leptospermum honey: Antibacterial spectrum, resistance and transcriptome analysis. Eur Soc Clin Microbiol. 28 (10), 1199-1208 (2009).
- Cooper, R. A., Jenkins, L., Henriques, A. F. M., Duggan, R. S., Burton, N. F. Absence of bacterial resistance to medical-grade manuka honey. Eur Soc Clin Microbiol. 29 (10), 1237-1241 (2010).
- Lu, J., et al. Honey can inhibit and eliminate biofilms produced by Pseudomonas aeruginosa. Sci Rep. 9 (1), 18160(2019).
- Bischofberger, A. M., Pfrunder Cardozo, K. R., Baumgartner, M., Hall, A. R. Evolution of honey resistance in experimental populations of bacteria depends on the type of honey and has no major side effects for antibiotic susceptibility. Evol Appl. 14 (5), 1314-1327 (2021).
- Cunningham, E., O'Byrne, C., Oliver, J. D. Effect of weak acids on Listeria monocytogenes survival: Evidence for a viable but nonculturable state in response to low pH. Food Control. 20 (12), 1141-1144 (2009).
- Kogure, K., Simidu, U., Taga, N. A tentative direct microscopic method for counting living marine bacteria. Can J Microbiol. 25 (3), 415-420 (1979).
- Albertini, M. C., et al. Use of multiparameter analysis for Vibrio alginolyticus viable but nonculturable state determination. Cytom J Int Soc Anal Cytol. 69 (4), 260-265 (2006).
- Nocker, A., Camper, A. K. Novel approaches toward preferential detection of viable cells using nucleic acid amplification techniques. FEMS Microbiol Lett. 291 (2), 137-142 (2009).
- Trevors, J. T. Viable but non-culturable (VBNC) bacteria: Gene expression in planktonic and biofilm cells. J Microbiol Methods. 86 (2), 266-273 (2011).
- Ankley, L. M., Monteiro, M. P., Camp, K. M., O'Quinn, R., Castillo, A. R. Manuka honey chelates iron and impacts iron regulation in key bacterial pathogens. J App Microbiol. 128 (4), 1015-1024 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados