Method Article
Estimulação de pulso transcraniano para pacientes com Alzheimer
Neste Artigo
Resumo
Este artigo descreve o procedimento de estimulação do pulso transcraniano em pacientes com doença de Alzheimer. Ele discute as indicações, metodologia e perspectivas futuras em detalhes.
Resumo
A estimulação transcraniana do pulso (TPS) é uma terapia de neuromodulação não invasiva com marcação Conformité Européenne (CE) para o tratamento da doença de Alzheimer (DA). Estudos piloto iniciais demonstraram efeitos promissores na função cognitiva. Este artigo enfoca o procedimento para tratar pacientes com DA usando um dispositivo TPS neuronavegado guiado por ressonância magnética. O protocolo a ser seguido para isso é descrito em detalhes, incluindo os procedimentos necessários e as configurações do dispositivo. Uma breve visão geral dos resultados clínicos representativos publicados até o momento também é fornecida. Além de melhorias clínicas significativas na cognição e no afeto, eventos adversos (EA) e possíveis eventos adversos do dispositivo (ADE) são apresentados para fornecer dados de segurança. Finalmente, o método é discutido criticamente. No futuro, ensaios clínicos randomizados devem ser conduzidos para descartar quaisquer efeitos placebo. Atualmente, também há uma carência de estudos de longo prazo com um número maior de pacientes. Apesar dessas questões não resolvidas, o TPS tem o potencial de ser um tratamento adjuvante para pacientes com Alzheimer quando usado em um ambiente controlado e cientificamente orientado.
Introdução
As técnicas de estimulação cerebral não invasiva (NiBS) tornaram-se um foco de crescente interesse na pesquisa da demência, oferecendo estratégias terapêuticas potenciais para mitigar déficits cognitivos e funcionais associados a doenças neurodegenerativas. Evidências acumuladas sugerem que a NiBS pode melhorar a função cognitiva ou retardar o declínio cognitivo em indivíduos com doença de Alzheimer (DA) em vários estágios da condição 1,2. Entre essas técnicas, a Estimulação de Pulso Transcraniano (TPS) é particularmente notável por sua capacidade de fornecer estimulação cerebral altamente focada e direcionada com precisão, não apenas na superfície cortical, mas também em regiões cerebrais mais profundas 3,4. Os efeitos colaterais associados à STP são raros, de gravidade moderada e transitórios 3,5.
Inicialmente desenvolvida nas áreas de ortopedia e cardiologia, a terapia de ultrassom terapêutico e a terapia por ondas de choque extracorpóreas (ESWT) demonstraram promover a cicatrização dos tecidos e melhorar o fluxo sanguíneo. Na ortopedia, a TOC foi particularmente aplicada para tratar condições musculoesqueléticas, como tendinopatias e problemas de cicatrização óssea, enquanto na cardiologia foi explorada por seus efeitos na saúde vascular 6,7. O TPS foi adaptado para aplicações neurológicas, particularmente na pesquisa de Alzheimer, mostrando-se promissor no tratamento do declínio cognitivo e deficiências funcionais 8,3,4. Essa técnica usa ondas de choque para aliviar os sintomas de pacientes com doença de Alzheimer, conforme demonstrado pelos dados piloto do grupo de trabalho deste tutorial5. As ondas de choque diferem das ondas de ultrassom por não envolverem uma carga alternada de alta frequência9. O perfil da onda de choque gerado, conforme mostrado na Figura 1, ilustra claramente o pulso de pressão singular e o subsequente achatamento da amplitude durante o TPS, juntamente com a amplitude de frequência mais alta característica do ultrassom. Devido ao estresse alternado de alta frequência, a energia das ondas de ultrassom é absorvida pelo tecido, o que pode levar ao aquecimento do tecido - um efeito não observado com ondas de choque. Em outras aplicações, ondas de choque de alta energia são usadas, enquanto no TPS, a energia introduzida no tecido é de baixa energia9. Os efeitos potenciais na doença de Alzheimer foram relatados pela primeira vez como melhorias no Consórcio para Estabelecer um Registro para a Doença de Alzheimer (CERAD)3, bem como aumento da espessura cortical em várias áreas10 e mudanças na conectividade da rede de RM11.
Os mecanismos de ação do TPS estão atualmente sob investigação, com pesquisas focando em como essa técnica não invasiva modula a atividade cerebral no nível celular, potencialmente desencadeando processos de mecanotransdução que podem aumentar a neuroplasticidade e melhorar a função cognitiva 3,4. Na terapia por ondas de choque, a energia física atua na área tecidual localizada e induz a mecanotransdução12, estimulando a liberação de fatores de crescimento13,14 e óxido nítrico15. Esses efeitos, por sua vez, podem melhorar a circulação sanguínea e promover a neoangiogênese16.
O objetivo do TPS é fornecer uma terapia complementar que seja segura e possa levar à melhora dos sintomas. As áreas estimuladas podem incluir o córtex frontal bilateral, o córtex parietal lateral bilateral, o córtex precuneus estendido e o córtex temporal bilateral. O protocolo de tratamento usual consiste em seis sessões com 6.000 pulsos ao longo de 2 semanas como o primeiro ciclo de tratamento.
O procedimento é considerado seguro, pois eventos adversos foram relatados em cerca de 4% das sessões caracterizados por gravidade subjetiva moderada, transitória e sem relação causal clara com eventos adversos relacionados ao dispositivo (EAMs)5.
Embora esses resultados iniciais sejam encorajadores, é crucial que pesquisadores e médicos avaliem se o TPS é apropriado para suas aplicações específicas. Os fatores a serem considerados incluem o estágio da doença de Alzheimer, a resposta do paciente a outros tratamentos e a disponibilidade de instalações que possam administrar o TPS com segurança sob orientação especializada. Para indivíduos nos estágios iniciais a moderados da doença de Alzheimer, o TPS pode oferecer benefícios cognitivos potenciais com efeitos colaterais mínimos, mas ainda não é considerado um tratamento autônomo. Em vez disso, pode complementar as terapias existentes, como intervenções farmacológicas ou treinamento cognitivo. Os resultados dos ensaios clínicos randomizados são insuficientes até o momento. No entanto, o TPS pode ter o potencial de ser um tratamento complementar para pacientes com Alzheimer sob uso controlado e exploração científica.
Protocolo
A análise de todos os pacientes tratados com TPS fez parte do registro local aprovado pelo Comitê de Ética da Câmara Médica Regional (Ärztekammer Nordrhein, Nr. 2021026). Além disso, todos os pacientes assinaram o termo de consentimento livre e esclarecido para o tratamento. Um total de 11 pacientes foram tratados com TPS (nove homens, duas mulheres, faixa etária de 59 a 77 anos, M = 69,82). Antes do tratamento, todos os pacientes foram submetidos a um processo detalhado de consentimento informado, durante o qual foram completamente informados sobre os potenciais benefícios e riscos da estimulação do pulso transcraniano (TPS) com o sistema NEUROLITH.
1. Seleção e preparação do paciente
- Antes de iniciar essa estimulação, a seleção do paciente e o consentimento informado são cruciais. Use a marca CE para a doença de Alzheimer. Confirme o diagnóstico usando biomarcadores do LCR com base na síndrome clínica de Alzheimer. Realizar o tratamento da doença de acordo com as diretrizes nacionais ou internacionais por um neurologista ou psiquiatra.
NOTA: O TPS pode ser oferecido como um complemento em exploração científica. Como o TPS foi administrado como um tratamento complementar, todos os pacientes continuaram com seus planos regulares de tratamento médico durante todo o tratamento. Alguns pacientes estavam em uso de medicamentos antidemência e/ou antipsicóticos durante as sessões de TPS; no entanto, esses medicamentos não faziam parte do protocolo do estudo e não foram modificados ou padronizados como parte da intervenção. - Use os seguintes critérios de exclusão para TPS: O tratamento é contraindicado com patologias intracerebrais relevantes não relacionadas à doença de Alzheimer, incluindo encefalopatia vascular, trombose na área de tratamento, Fazekas grau 3, tumores, malformações vasculares, implantes metálicos e angiopatia amilóide cerebral (CAA), conforme definido pelos critérios de Boston. As contraindicações adicionais são histórico ou terapia com anticorpos em andamento, distúrbios de coagulação do sangue ou anticoagulação oral, tratamento com corticosteróides dentro de seis semanas antes da primeira aplicação, epilepsia (convulsões múltiplas ou uma única convulsão com foco em convulsão), marca-passos não aprovados para terapia TPS, síncope recorrente, distúrbios comportamentais afetivos graves que afetam a vida diária, como agressão ou psicose, gravidez e condições médicas que podem levar ao não cumprimento do protocolo. Com relação aos critérios de diagnóstico e exclusão, incluindo ressonância magnética, EEG, análise do LCR, testes laboratoriais e avaliações cognitivas e afetivas detalhadas na investigação.
2. Testes neuropsicológicos
- Realizar testes neuropsicológicos antes da primeira estimulação (linha de base) e após a última estimulação (pós-estimulação). A Escala de Avaliação da Doença de Alzheimer (ADAS) foi utilizada para este estudo.
- Antes de iniciar o ADAS, prepare o ambiente de teste para garantir que seja silencioso, confortável e livre de distrações. Realize a avaliação com um clínico ou neuropsicólogo treinado, que segue um formato estruturado para avaliar domínios cognitivos específicos.
- O ADAS consiste em dois componentes principais: a Subescala Cognitiva (ADAS-Cog) e a Subescala Não Cognitiva. Use o ADAS-Cog, que é mais comumente usado, para avaliar a memória, a linguagem, a orientação e a práxis por meio de uma série de tarefas, conforme descrito abaixo.
- Recordação de palavras: Apresente ao paciente uma lista de palavras e peça para lembrá-las imediatamente e após um atraso.
- Nomear objetos e dedos: Mostre ao paciente uma série de objetos e peça para nomeá-los corretamente.
- Seguintes comandos: Peça ao paciente para realizar ações específicas com base em instruções verbais para avaliar a compreensão e a práxis.
- Visuo-construção: Encarregue o paciente de copiar figuras geométricas para avaliar as habilidades visuoespaciais.
- Práxis ideacional: Peça ao paciente para demonstrar o uso de objetos comuns (por exemplo, um lápis ou um pente).
- Orientação: Questione o paciente sobre a data atual, o dia da semana e o local.
- Reconhecimento de palavras: Peça ao paciente para reconhecer palavras apresentadas anteriormente de uma lista de palavras que distraem.
- Habilidade linguística: Avalie a fluência e compreensão do paciente por meio de conversas estruturadas e construção de frases.
- Use a subescala não cognitiva para avaliar sintomas comportamentais, como alterações de humor, apatia ou agitação.
- Para consistência, peça ao médico que administra o teste que siga estritamente as instruções descritas no manual do ADAS. Pontue cada tarefa com base no desempenho, com pontuações mais altas indicando maior comprometimento.
- Após a última sessão de estimulação, repita o ADAS usando uma versão paralela do teste para garantir que os resultados reflitam mudanças genuínas na função cognitiva, em vez de efeitos práticos.
3. Preparação do dispositivo e ambiente
- Ligue o dispositivo. Localize o interruptor de alimentação principal na parte traseira do dispositivo e ligue-o.
- Pressione o botão de espera no painel frontal. O dispositivo levará aproximadamente 5 minutos para inicializar.
- Posicione o paciente. Certifique-se de que o paciente esteja confortavelmente sentado, com possível apoio para o pescoço. Faça com que o paciente use óculos de reconhecimento com lentes de detecção. Prenda os óculos na cabeça do paciente usando fita adesiva ou uma alça para mantê-los no lugar.
- Configure a câmera. Alinhe a câmera para garantir que a cabeça do paciente esteja totalmente visível dentro do quadro. Esta câmera é fundamental para rastreamento e calibração.
4. Teste de alta tensão (manutenção diária)
- Execute o teste de alta tensão (teste HV). Realize este teste uma vez a cada 24 h. Siga as instruções na tela para concluir o teste pressionando o botão de disparo no aplicador portátil.
5. Preparação da peça de mão
- Prepare a peça de mão aplicando uma gota de óleo de silicone na membrana da peça de mão.
- Prenda a membrana de acoplamento pré-preenchida (a peça de distância) à peça de mão, garantindo que esteja segura para um desempenho ideal.
6. Calibração para novos pacientes
- Carregue os dados de ressonância magnética do paciente. Para novos pacientes, certifique-se de que as ressonâncias magnéticas necessárias (imagens ponderadas em T1 e de alta resolução da cabeça da testa às costas, cobrindo orelha a orelha) estejam disponíveis.
- Insira o dispositivo de armazenamento externo (USB ou CD) que contém os dados de ressonância magnética na porta USB do sistema.
- Crie um perfil de paciente. Selecione Novo paciente no sistema e insira as informações necessárias. Ao criar um novo perfil de paciente no sistema, algumas informações são importadas automaticamente do MRI-CD, enquanto outros detalhes precisam ser inseridos manualmente.
- Depois de inserir o CD no sistema, o nome completo e a data de nascimento do paciente são recuperados automaticamente dos metadados do CD de ressonância magnética. Insira manualmente o plano de tratamento no sistema. Selecione o protocolo pré-configurado da Doença de Alzheimer (DA), já armazenado no sistema. Este protocolo inclui as seguintes configurações: uma frequência de 4 Hz, um nível de energia de 0,2 mJ/mm2 e 6.000 pulsos por sessão. O protocolo pode ser usado no estado em que se encontra ou ajustado com base nas preferências do médico.
- Carregue os dados de ressonância magnética e verifique a qualidade das imagens. Para verificar a qualidade dos dados de ressonância magnética, percorra manualmente as fatias individuais das imagens de ressonância magnética no sistema. Certifique-se de que todas as estruturas anatômicas estejam nítidas e bem definidas e verifique a ausência de artefatos de movimento ou distorções. Confirme se a resolução geral das imagens ponderadas em T1 é suficiente para uma neuronavegação precisa. Ajuste as seleções de imagem conforme necessário e prossiga com a calibração.
- Para calibrar as imagens, use a caneta de calibração para realizar uma calibração de 3 pontos usando os seguintes caminhos.
Caminho 1: Da testa para a nuca.
Caminho 2: De um ouvido ao outro.
Caminho 3: Execute movimentos circulares ou em zigue-zague no topo da cabeça. - Certifique-se de que as lentes de detecção estejam sempre voltadas para a câmera durante a calibração.
- Confirme se o modelo de cabeça 3D na tela está alinhado corretamente com a cabeça do paciente, girando-o para verificar os pontos de contato.
7. Configuração da região de tratamento (opcional)
- Defina as regiões de tratamento com base nas necessidades específicas do paciente. Para este estudo, o protocolo pré-configurado da doença de Alzheimer foi usado, incluindo lobo frontal bilateral, lobo parietal bilateral e precuneus. Além disso, ao protocolo inicial, adicione o córtex temporal bilateral. Use as imagens de ressonância magnética e pontos anatômicos específicos do cérebro para definir as regiões a serem estimuladas.
- Ajuste o tamanho, a forma e o número de regiões de tratamento no visor. Para ajustar os ROIs, o processo é realizado inteiramente usando os controles da tela sensível ao toque.
- Comece acessando o módulo Planejamento de Tratamento na interface principal do sistema. Neste módulo, selecione a opção Ajuste de ROI para habilitar a edição de regiões de tratamento. Uma vez no modo de ajuste, o sistema exibe um ROI padrão na tela.
- Para posicionar a ROI sobre a área anatômica desejada, como o lobo frontal, o lobo parietal, o precuneus ou o córtex temporal, use os botões de seta na tela sensível ao toque. Os botões permitem mover o ROI de forma incremental em todas as direções (para cima, para baixo, para a esquerda, para a direita) para um alinhamento preciso com a região do cérebro alvo.
- Depois de posicionar o ROI, ajuste suas dimensões (tamanho, profundidade e forma) usando os controles dedicados na tela:
Ajuste de profundidade (botão A): toque no botão de profundidade e ajuste o nível de penetração do ROI para atender aos requisitos do tratamento.
Ajuste de largura (botão B): Use o botão de ajuste de largura para expandir ou contrair o tamanho horizontal do ROI.
Ajuste de altura (botão C): Modifique a dimensão vertical do ROI tocando no controle de ajuste de altura. Salve as configurações depois de concluídas.
8. Realização do tratamento
- Aplique sequencialmente uma quantidade generosa de gel de ultrassom no couro cabeludo do paciente para uma transmissão de energia ideal.
- Comece o tratamento. Selecione o Modo de Tratamento no dispositivo e confirme se a membrana pré-preenchida está conectada corretamente. A fixação correta da membrana pré-preenchida é verificada garantindo que ela se encaixe corretamente na peça de mão. Opcionalmente, o paciente pode usar proteção auditiva durante a sessão.
- Segure a peça de mão perpendicularmente ao couro cabeludo do paciente, garantindo que ela seja movida uniformemente pela superfície. A Figura 2 ilustra o alinhamento ideal entre o paciente e o NEUROLITH durante o TPS. A Figura 3 mostra um exemplo das regiões de interesse (ROI) e a modelagem do tecido estimulado na ressonância magnética de um paciente. A Figura 4 mostra uma ilustração do dispositivo portátil durante a estimulação.
- Monitore a estimulação. Trate cada região até que as áreas alvo na tela fiquem verdes, indicando a cobertura adequada. Continue movendo a peça de mão enquanto mantém as lentes de detecção à vista da câmera para garantir o rastreamento contínuo.
NOTA: Se os óculos de reconhecimento se deslocarem ligeiramente durante o tratamento, a sessão pode prosseguir. No entanto, se os óculos forem removidos, é necessária uma recalibração. - Conclua a sessão. Para terminar o tratamento, prima o botão Stop no dispositivo. O ponto final da sessão é alcançado ao atingir 6000 pulsos.
9. Procedimentos pós-tratamento
- Limpe o equipamento. Limpe a peça de mão e a membrana destacável usando lenços aprovados (evite produtos de limpeza à base de álcool).
- Atendimento ao paciente: Limpe a área do couro cabeludo suavemente para remover qualquer gel de ultrassom restante. Se necessário, seque o cabelo do paciente com uma toalha ou secador de cabelo. Após o tratamento, aconselhe os pacientes a permanecerem por perto pelos próximos 10 a 15 minutos, caso apresentem efeitos colaterais tardios ou leves, como tontura, dor de cabeça ou desconforto no couro cabeludo, embora nenhuma observação ativa seja necessária. Incentive os pacientes a se manterem hidratados, pois isso apoia a recuperação e o bem-estar geral. Aconselhe o paciente a evitar atividade física intensa pelo resto do dia, principalmente se ele se sentir cansado ou sentir algum desconforto leve após a sessão.
- Armazenamento de dados de tratamento: Salve todos os dados de tratamento, incluindo regiões definidas, e ajuste para sessões futuras. Quaisquer observações durante o tratamento ou feedback devem ser documentadas.
Resultados
A estimulação do pulso transcraniano aliviou os sintomas de pacientes com Alzheimer, conforme demonstrado por dados piloto não controlados de 11 pacientes (nove homens, duas mulheres, faixa etária de 59 a 77 anos, M = 69,82) publicados pelo grupo de trabalho deste tutorial1. As áreas estimuladas incluíram o córtex frontal bilateral, o córtex parietal lateral bilateral e o córtex precuneus estendido. O córtex temporal bilateral foi adicionado ao protocolo. O tratamento foi administrado em seis sessões iniciais com 6.000 pulsos ao longo de 2 semanas como o primeiro ciclo de tratamento.
O protocolo de tratamento durante a estimulação envolveu pulsos de 4 Hz, 0,20 mJ/mm2 e 6000. Três dos 11 pacientes (27%) relataram eventos adversos em três das 75 sessões totais (4%). Estes incluíram dor na mandíbula (NRS 4/10), náusea (NRS 7/10) e sonolência (NRS 10/10). No entanto, nenhum deles durou mais de 24 horas, e nem todos puderam ser atribuídos diretamente à estimulação como eventos adversos do dispositivo (EAMs).
Observou-se diferença significativa no escore total do ADAS pós-estimulação em relação à linha de base, com melhora de 30,2 para 25,8 (p = 0,01), e no escore ADAS-Cog, que melhorou de 25,8 para 23,3 (p = 0,04; Figura 5). Embora alguns pacientes tenham apresentado apenas pequenas melhorias, a melhor melhora em um paciente foi de 40%, levando a uma melhora geral de 15,76% no escore total do ADAS e 8,65% no escore ADAS Cog (Figura 6). Além disso, uma diferença significativa nos sintomas depressivos foi detectada em uma subescala autorrelatada do teste ADAS. Um teste t unilateral mostrou uma redução significativa nos sintomas depressivos, conforme medido por uma subescala autorrelatada do teste ADAS. Antes da estimulação, a média era de 0,7 (DP = 1,1) e, após a estimulação, diminuiu para 0,2 (DP = 0,4; t (8) = 1,859, p < 0,01).
Uma escala de classificação subjetiva foi preenchida antes e após o período de tratamento de duas semanas. Essa escala permite que os pacientes relatem a gravidade dos sintomas e quaisquer eventos adversos percebidos em uma escala numérica de 0 a 10, com números mais altos indicando maior intensidade dos sintomas. A melhora subjetiva média da gravidade dos sintomas, medida pelo NRS, foi de 5,7 para 3,4 (p = 0,023).
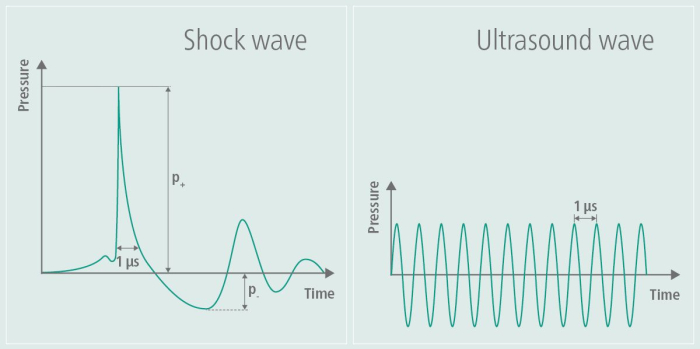
Figura 1: Onda de choque durante a estimulação. O gráfico ilustra a amplitude de um TPS no lado esquerdo da imagem e a compara com a amplitude de um ultrassom no lado direito da imagem. Durante o TPS, um pulso de pressão singular é gerado, seguido por um achatamento subsequente da amplitude. Em contraste, a amplitude do ultrassom não se achata novamente, mas é mantida, resultando em oscilações contínuas de alta frequência ao longo do tempo. Este número foi modificado de9. Clique aqui para ver uma versão maior desta figura.

Figura 2: Sistema de navegação por ressonância magnética. A imagem ilustra o alinhamento ideal entre o paciente e o NEUROLITH durante o TPS. A câmera 3D entra em contato com as lentes de detecção dos óculos e as da peça de mão. Somente se essa transmissão for garantida, a peça de mão é reconhecida na posição espacial correta e a visualização da estimulação na tela não é perturbada. Este número foi modificado de9. Clique aqui para ver uma versão maior desta figura.

Figura 3: Regiões de interesse e áreas estimuladas. A imagem mostra um exemplo das regiões de interesse (ROI) e a modelagem do tecido estimulado na ressonância magnética de um paciente. As cores diferenciam ainda mais o número de pulsos aplicados nas respectivas áreas do precuneus, bem como nas regiões frontal e parietal. A coloração verde é seguida por turquesa, azul e violeta. Violeta indica intensidade excessiva e deve ser evitado. As áreas estimuladas são visualizadas como dados simulados do sistema de navegação como áreas principalmente alcançadas, mas isso não é medido como ativação cerebral aplicada real. A estimulação temporal adicional é adicionada ao protocolo de Kempen, embora não seja predefinida como ROI. esquerda: vista axial, meio: vista sagital, direita: vista coronal. Clique aqui para ver uma versão maior desta figura.

Figura 4: Dispositivo portátil. Esta figura ilustra o dispositivo portátil em uso durante a estimulação. As etapas preparatórias críticas incluem a aplicação de uma quantidade suficiente de gel de ultrassom no couro cabeludo do paciente para garantir a transmissão ideal de energia e verificar se a membrana pré-preenchida está presa de forma segura e correta. Durante o tratamento, a peça de mão é mantida perpendicular ao couro cabeludo e movida uniformemente pela superfície para manter a estimulação consistente. Este número foi modificado de9. Clique aqui para ver uma versão maior desta figura.
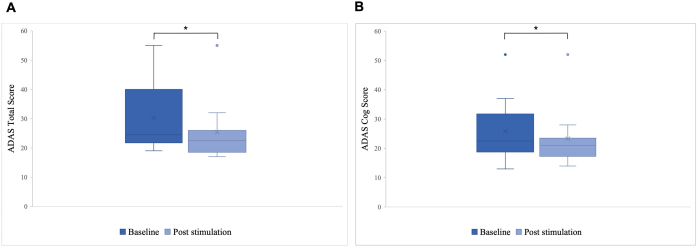
Figura 5: Escala de Avaliação da Doença de Alzheimer (ADAS) antes da primeira estimulação. Média da pontuação do grupo de pacientes na Escala de Avaliação da Doença de Alzheimer (ADAS) antes da primeira estimulação (azul escuro) e após a última estimulação (azul claro). Uma pontuação mais baixa indica melhor desempenho. O gráfico de caixa mostra a distribuição dos dados dos pacientes. (A) Pontuação total do ADAS. A linha representa a mediana do grupo (linha de base = 24,5, pós-estimulação = 22,5) e a cruz representa os escores médios (M linha de base = 30,2 (DP 11,55), M pós-estimulação = 25,8 (DP 10,71), *p = 0,01). (B) Pontuação de engrenagem ADAS. A linha representa a mediana do grupo (linha de base = 22,5, pós-estimulação = 21) e a cruz representa os escores médios (M linha de base = 25,8 (DP 10,77), M pós-estimulação = 23,3 (DP 10,27), *p = 0,04). Este número foi modificado de5. Clique aqui para ver uma versão maior desta figura.

Figura 6: Resultados de testes individuais dos pacientes em ADAS. Resultados de testes individuais dos pacientes na Escala de Avaliação da Doença de Alzheimer (ADAS) antes da primeira estimulação (linha de base) e após a última estimulação (pós-estimulação). Uma pontuação mais baixa indica melhor desempenho. Cada linha representa um paciente. (A) Pontuações individuais de cada paciente na pontuação total do ADAS. A melhor melhora foi de 15 pontos (ID 3). (B) Pontuações individuais de cada paciente na subescala ADAS cog score. A melhor melhora foi de 14 pontos (ID 3 e ID 4). Este número foi modificado de5. Clique aqui para ver uma versão maior desta figura.
Discussão
No geral, o TPS é um possível tratamento para a doença de Alzheimer. Do ponto de vista prático, o processo de estimulação é projetado para ser fácil de usar para o operador. A capacidade de definir regiões de interesse no início do procedimento, juntamente com a visualização do número de pulsos aplicados por meio de marcações codificadas por cores durante o tratamento, simplifica significativamente o manuseio da interface do usuário. A configuração das regiões de interesse também pode ser selecionada e ajustada livremente conforme necessário. As áreas estimuladas são claramente visualizadas como dados simulados, embora seja necessário um desenvolvimento adicional por parte do fabricante para exibir áreas mais profundas afetadas pelo dispositivo em níveis de energia mais baixos.
As etapas críticas do protocolo TPS incluem a colocação precisa do dispositivo de estimulação sobre as regiões cerebrais alvo, garantindo a intensidade e frequência corretas das ondas de pulso e o monitoramento cuidadoso das respostas do paciente. A solução de problemas pode incluir garantir o contato ideal entre a peça de mão e o couro cabeludo para evitar perda de energia ou estimulação abaixo do ideal. Se forem observados desconforto ou efeitos colaterais, podem ser necessários ajustes de intensidade ou reposicionamento.
Dados não controlados publicados demonstraram melhorias cognitivas clínicas 5,3, bem como aumento da espessura cortical em várias áreas do cérebro10 e alterações na conectividade da rede de RM11. Melhorias no humor também foram relatadas 5,4. Comparado a outros métodos de estimulação cerebral não invasivos, o TPS oferece várias vantagens distintas. Primeiro, combina ondas de choque mecânicas com neuronavegação precisa, permitindo a aplicação direcionada às regiões cerebrais afetadas. Ao contrário do TMS, que normalmente estimula apenas as camadas corticais superficiais, a profundidade de penetração do TPS o torna particularmente adequado para o tratamento de doenças neurodegenerativas como a doença de Alzheimer, onde estruturas cerebrais mais profundas estão envolvidas. Além disso, o TPS parece ter um perfil de segurança favorável, com efeitos colaterais mínimos e transitórios relatados em apenas 4% das sessões de tratamento, indicando que pode ser uma opção mais tolerável para pacientescom DA 5 moderada a grave.
Para investigar minuciosamente os mecanismos de ação e realizar uma análise detalhada dos possíveis fatores de risco associados à terapia com TPS, são necessários estudos básicos adicionais.
Em um estudo recente publicado por este grupo de pesquisa, a atividade da rede cerebral em pacientes com Alzheimer foi examinada antes e depois da estimulação do pulso transcraniano (TPS)17. Os resultados indicam que o TPS pode modular as oscilações e a conectividade do cérebro, melhorando potencialmente a função cognitiva na doença de Alzheimer. Um dos mecanismos propostos é que o aumento das oscilações gama pós-TPS pode facilitar a depuração glinfática no cérebro. Este possível efeito na depuração glinfática deve ser investigado em estudos futuros. Além disso, mais estudos mecanicistas são necessários para esclarecer como o TPS influencia a fisiologia da rede cerebral e se seus efeitos neuroprotetores podem retardar ou interromper a progressão da doença de Alzheimer.
Estudos pré-clínicos em animais que exploram os efeitos do TPS em cérebros saudáveis e doentes são cruciais para obter uma compreensão mais profunda dos mecanismos subjacentes. É importante notar que várias técnicas de NiBS operam por meio de mecanismos distintos1. Portanto, é essencial investigar se e como os efeitos descritos para a terapia de ultrassom18 e terapia por ondas de choque6 no tecido desempenham um papel na terapia TPS. O primeiro descreveu a possível influência do TPS nos processos de mecanotransdução, bem como seu potencial para induzir alterações vasculares, celulares e moleculares, que devem ser investigadas minuciosamente. Além disso, a modulação de processos neuroinflamatórios, com ênfase particular na dinâmica da barreira hematoencefálica, apresenta uma área intrigante para pesquisas futuras. Compreender esses efeitos pode fornecer informações valiosas sobre os mecanismos subjacentes e ajudar a otimizar o TPS para aplicações terapêuticas. Além disso, isso contribui para explorar a aplicação potencial do tratamento com TPS no tratamento de outras doenças neurodegenerativas.
O TPS mostra-se promissor como uma abordagem terapêutica; no entanto, várias limitações devem ser abordadas. Ensaios clínicos controlados com grupos placebo são essenciais para delinear com precisão os efeitos específicos do TPS. Um desafio significativo é a alta variabilidade interindividual na resposta à estimulação, que pode ser influenciada por fatores como o estágio da doença de Alzheimer (DA) e a presença de comorbidades4. Além disso, o protocolo ideal para tratamento a longo prazo permanece indefinido. As abordagens atuais incluem sessões mensais de reforço único ou a repetição de um ciclo de tratamento de 12 sessões em um ano, mas faltam evidências que apoiem a superioridade de uma abordagem sobre a outra. Pesquisas clínicas futuras devem priorizar a identificação de parâmetros de estimulação ideais, avaliando como fatores específicos do paciente (por exemplo, estágio da DA) influenciam os resultados terapêuticos e investigando os efeitos a longo prazo e a sustentabilidade da terapia TPS.
Divulgações
O autor Lars Wojtecki já recebeu subsídios de financiamento e apoio institucional da Fundação Alemã de Pesquisa, Hilde-Ulrichs-Stiftung für Parkinsonforschung, e do ParkinsonFonds Germany, BMBF / ERA-NETNEURON, DFG Forschergruppe (FOR1328), Deutsche Parkinson Vereinigung (DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB; Medtronic, UCB, Teva, Allergan, Merz, Abbvie, Roche, Bial, Merck, Novartis, Desitin, Spectrum. O autor Lars Wojtecki possuía ações da empresa BioNTech SE. O autor Lars Wojtecki é consultor das seguintes empresas: TEVA, UCB Schwarz, Desitin, Medtronic, Abbott / Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed e Vertanical. A autora Celine Cont é consultora da Storz Medical. Os demais autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Agradecemos aos pacientes por sua adesão e participação. A assistência técnica e a coleta de dados foram asseguradas com a ajuda de Veronika Hirsch e Michaela Wessler (assistentes técnicas médicas).
Materiais
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
Referências
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados