Method Article
Stimulation transcrânienne des impulsions pour les patients atteints de la maladie d’Alzheimer
Dans cet article
Résumé
Cet article décrit la procédure de stimulation transcrânienne du pouls chez les patients atteints de la maladie d’Alzheimer. Il examine en détail les indications, la méthodologie et les perspectives d’avenir.
Résumé
La stimulation transcrânienne par impulsions (TPS) est une thérapie de neuromodulation non invasive avec marquage CE (Conformité Européenne) pour le traitement de la maladie d’Alzheimer (MA). Les premières études pilotes ont démontré des effets prometteurs sur la fonction cognitive. Cet article se concentre sur la procédure de traitement des patients atteints de MA à l’aide d’un dispositif TPS guidé par IRM et neuro-navigué. Le protocole à suivre pour cela est décrit en détail, y compris les procédures nécessaires et les paramètres de l’appareil. Un bref aperçu des résultats cliniques représentatifs publiés à ce jour est également fourni. En plus des améliorations cliniques significatives de la cognition et de l’affect, les événements indésirables (EA) et les événements indésirables possibles du dispositif (EIM) sont présentés pour fournir des données de sécurité. Enfin, la méthode fait l’objet d’une discussion critique. À l’avenir, des essais contrôlés randomisés devraient être menés pour exclure tout effet placebo. Il y a également actuellement un manque d’études à long terme avec un plus grand nombre de patients. Malgré ces questions non résolues, le TPS a le potentiel d’être un traitement d’appoint pour les patients atteints de la maladie d’Alzheimer lorsqu’il est utilisé dans un cadre contrôlé et scientifiquement guidé.
Introduction
Les techniques de stimulation cérébrale non invasive (NiBS) sont devenues un centre d’intérêt croissant dans la recherche sur la démence, offrant des stratégies thérapeutiques potentielles pour atténuer les déficits cognitifs et fonctionnels associés aux maladies neurodégénératives. De plus en plus de preuves suggèrent que les NiBS pourraient améliorer la fonction cognitive ou ralentir le déclin cognitif chez les personnes atteintes de la maladie d’Alzheimer (MA) à différents stades de la maladie 1,2. Parmi ces techniques, la stimulation par impulsions transcrâniennes (TPS) se distingue particulièrement par sa capacité à fournir une stimulation cérébrale hautement ciblée et ciblée, non seulement sur la surface corticale, mais aussi dans les régions cérébrales plusprofondes3,4. Les effets secondaires associés au TPS sont rares, de gravité modérée et transitoires 3,5.
Initialement développée dans les domaines de l’orthopédie et de la cardiologie, la thérapie thérapeutique par ultrasons et la thérapie par ondes de choc extracorporelles (ESWT) favorisent la cicatrisation des tissus et améliorent la circulation sanguine. En orthopédie, l’ESWT a été particulièrement appliqué pour traiter les affections musculo-squelettiques telles que les tendinopathies et les problèmes de cicatrisation osseuse, tandis qu’en cardiologie, il a été exploré pour ses effets sur la santé vasculaire 6,7. Le TPS a été adapté pour des applications neurologiques, en particulier dans la recherche sur la maladie d’Alzheimer, ce qui s’avère prometteur pour traiter le déclin cognitif et les déficiences fonctionnelles 8,3,4. Cette technique utilise des ondes de choc pour soulager les symptômes des patients atteints de la maladie d’Alzheimer, comme le démontrent les données pilotes du groupe de travail de ce tutoriel5. Les ondes de choc diffèrent des ondes ultrasonores en ce qu’elles n’impliquent pas de charge alternative à haute fréquence9. Le profil d’ondes de choc généré, comme le montre la figure 1, illustre clairement l’impulsion de pression singulière et l’aplatissement ultérieur de l’amplitude pendant le TPS, ainsi que l’amplitude de fréquence plus élevée caractéristique des ultrasons. En raison de la contrainte alternée à haute fréquence, l’énergie des ondes ultrasonores est absorbée par les tissus, ce qui peut entraîner un réchauffement des tissus, un effet non observé avec les ondes de choc. Dans d’autres applications, des ondes de choc de haute énergie sont utilisées, tandis que dans le TPS, l’énergie introduite dans le tissu est de faible énergie9. Les effets potentiels sur la maladie d’Alzheimer ont d’abord été signalés sous forme d’améliorations dans le Consortium pour l’établissement d’un registre de la maladie d’Alzheimer (CERAD)3, ainsi que d’une augmentation de l’épaisseur corticale dans plusieurs zones10 et de changements dans la connectivité MR-réseau11.
Les mécanismes d’action du TPS sont actuellement à l’étude, la recherche se concentrant sur la façon dont cette technique non invasive module l’activité cérébrale au niveau cellulaire, déclenchant potentiellement des processus de mécanotransduction qui pourraient améliorer la neuroplasticité et la fonction cognitive 3,4. Dans la thérapie par ondes de choc, l’énergie physique agit sur la zone tissulaire localisée et induit la mécanotransduction12, stimulant la libération des facteurs de croissance13,14 et de l’oxyde nitrique15. Ces effets, à leur tour, peuvent améliorer la circulation sanguine et favoriser la néoangiogenèse16.
L’objectif du TPS est de fournir une thérapie d’appoint qui est sûre et qui pourrait entraîner une amélioration des symptômes. Les zones stimulées peuvent inclure le cortex frontal bilatéral, le cortex pariétal latéral bilatéral, le cortex précuneus étendu et le cortex temporal bilatéral. Le protocole de traitement habituel consiste en six séances avec 6 000 impulsions sur 2 semaines comme premier cycle de traitement.
La procédure est considérée comme sûre, car des événements indésirables ont été signalés dans environ 4 % des séances caractérisées par une gravité subjective modérée qui est transitoire et sans relation causale claire avec les événements indésirables liés au dispositif (EIM)5.
Bien que ces premiers résultats soient encourageants, il est crucial pour les chercheurs et les cliniciens d’évaluer si le TPS est approprié pour leurs applications spécifiques. Les facteurs à prendre en compte comprennent le stade de la maladie d’Alzheimer, la réponse du patient à d’autres traitements et la disponibilité d’installations capables d’administrer en toute sécurité le TPS sous la direction d’experts. Pour les personnes aux stades précoces à modérés de la maladie d’Alzheimer, le TPS peut offrir des avantages cognitifs potentiels avec des effets secondaires minimes, mais il n’est pas encore considéré comme un traitement autonome. Au lieu de cela, il peut compléter les thérapies existantes telles que les interventions pharmacologiques ou l’entraînement cognitif. Les résultats des essais contrôlés randomisés sont insuffisants à ce jour. Cependant, le TPS pourrait avoir le potentiel de devenir un traitement d’appoint pour les patients atteints de la maladie d’Alzheimer dans le cadre d’une utilisation contrôlée et d’une exploration scientifique.
Protocole
L’analyse de tous les patients traités par TPS faisait partie du registre local approuvé par le comité d’éthique de la chambre médicale régionale (Ärztekammer Nordrhein, n° 2021026). De plus, tous les patients ont signé un consentement écrit au traitement. Au total, 11 patients ont été traités par TPS (neuf hommes, deux femmes, tranche d’âge 59-77 ans, M = 69,82). Avant le traitement, tous les patients ont été soumis à un processus de consentement éclairé détaillé, au cours duquel ils ont été soigneusement informés des avantages et des risques potentiels de la stimulation par impulsions transcrâniennes (TPS) avec le système NEUROLITH.
1. Sélection et préparation du patient
- Avant de commencer cette stimulation, la sélection du patient et son consentement éclairé sont cruciaux. Utilisez le marquage CE pour la maladie d’Alzheimer. Confirmer le diagnostic à l’aide de biomarqueurs du LCR sur la base du syndrome clinique d’Alzheimer. Effectuer le traitement de la maladie selon les directives nationales ou internationales par un neurologue ou un psychiatre.
REMARQUE : Le TPS peut être proposé en tant qu’add-on dans le cadre de l’exploration scientifique. Étant donné que le TPS a été administré en tant que traitement d’appoint, tous les patients ont poursuivi leur plan de traitement médical habituel tout au long du traitement. Certains patients prenaient des médicaments antidémence et/ou des antipsychotiques pendant les séances de TPS ; Cependant, ces médicaments ne faisaient pas partie du protocole de l’étude et n’ont pas été modifiés ou normalisés dans le cadre de l’intervention. - Utilisez les critères d’exclusion suivants pour le TPS : Le traitement est contre-indiqué pour les pathologies intracérébrales pertinentes non liées à la maladie d’Alzheimer, y compris l’encéphalopathie vasculaire, la thrombose dans la zone de traitement, le grade 3 de Fazekas, les tumeurs, les malformations vasculaires, les implants métalliques et l’angiopathie amyloïde cérébrale (AAC) telle que définie par les critères de Boston. Les contre-indications supplémentaires sont des antécédents ou un traitement par anticorps en cours, des troubles de la coagulation sanguine ou une anticoagulation orale, un traitement par corticostéroïdes dans les six semaines précédant la première application, l’épilepsie (soit plusieurs crises, soit une seule crise avec un foyer convulsif), des stimulateurs cardiaques non approuvés pour le traitement par TPS, une syncope récurrente, des troubles comportementaux affectifs graves ayant un impact sur la vie quotidienne tels que l’agressivité ou la psychose, la grossesse et les problèmes de santé qui peuvent entraîner le non-respect du protocole. En ce qui concerne le diagnostic et les critères d’exclusion, y compris l’IRM, l’EEG, l’analyse du LCR, les tests de laboratoire et les évaluations cognitives et affectives détaillées dans le bilan.
2. Tests neuropsychologiques
- Effectuez des tests neuropsychologiques avant la première stimulation (ligne de base) et après la dernière stimulation (post-stimulation). L’échelle d’évaluation de la maladie d’Alzheimer (ADAS) a été utilisée pour cette étude.
- Avant de commencer l’ADAS, préparez l’environnement de test pour vous assurer qu’il est silencieux, confortable et exempt de distractions. Effectuez l’évaluation avec un clinicien ou un neuropsychologue qualifié, qui suit un format structuré pour évaluer des domaines cognitifs spécifiques.
- L’ADAS se compose de deux composants principaux : la sous-échelle cognitive (ADAS-Cog) et la sous-échelle non cognitive. Utilisez l’ADAS-Cog, qui est le plus couramment utilisé, pour évaluer la mémoire, le langage, l’orientation et la praxis à travers une série de tâches, comme décrit ci-dessous.
- Rappel des mots : Présentez au patient une liste de mots et demandez à les rappeler immédiatement et après un certain délai.
- Nommer les objets et les doigts : Montrez au patient une série d’objets et demandez-lui de les nommer correctement.
- Suivre les commandes : Demandez au patient d’effectuer des actions spécifiques basées sur des instructions verbales pour évaluer la compréhension et la pratique.
- Visuo-construction : Demander au patient de copier des figures géométriques pour évaluer les compétences visuospatiales.
- Praxisme idéationnelle : Demandez au patient de démontrer l’utilisation d’objets courants (p. ex., un crayon ou un peigne).
- Orientation : Interrogez le patient sur la date actuelle, le jour de la semaine et le lieu.
- Reconnaissance des mots : Demandez au patient de reconnaître les mots précédemment présentés à partir d’une liste de mots distracteurs.
- Habileté linguistique : Évaluez la fluidité et la compréhension du patient au moyen de conversations structurées et de la construction de phrases.
- Utilisez la sous-échelle non cognitive pour évaluer les symptômes comportementaux tels que les changements d’humeur, l’apathie ou l’agitation.
- Par souci de cohérence, demandez au clinicien qui administre le test de respecter strictement les instructions décrites dans le manuel ADAS. Évaluez chaque tâche en fonction de la performance, les scores les plus élevés indiquant une plus grande déficience.
- Après la dernière séance de stimulation, répétez l’ADAS en utilisant une version parallèle du test pour vous assurer que les résultats reflètent de véritables changements dans la fonction cognitive plutôt que des effets pratiques.
3. Préparation de l’appareil et de l’environnement
- Allumez l’appareil. Localisez l’interrupteur d’alimentation principal à l’arrière de l’appareil et allumez-le.
- Appuyez sur le bouton de veille situé sur le panneau avant. L’initialisation de l’appareil prend environ 5 minutes.
- Positionnez le patient. Assurez-vous que le patient est confortablement assis, avec un éventuel soutien du cou. Demandez au patient de porter des lunettes de reconnaissance avec des verres de détection. Fixez les lunettes à la tête du patient à l’aide de ruban adhésif ou d’une sangle pour les maintenir en place.
- Configurez l’appareil photo. Alignez la caméra pour vous assurer que la tête du patient est entièrement visible dans le cadre. Cette caméra est essentielle pour le suivi et l’étalonnage.
4. Test haute tension (entretien quotidien)
- Effectuez le test haute tension (test HV). Effectuez ce test une fois toutes les 24 heures. Suivez les instructions à l’écran pour terminer le test en appuyant sur le bouton de déclenchement de l’applicateur manuel.
5. Préparation de la pièce à main
- Préparez la pièce à main en appliquant une goutte d’huile de silicone sur la membrane de la pièce à main.
- Fixez la membrane d’accouplement préremplie (la pièce d’écartement) à la pièce à main, en vous assurant qu’elle est sécurisée pour des performances optimales.
6. Calibrage pour les nouveaux patients
- Chargez les données IRM du patient. Pour les nouveaux patients, assurez-vous que les examens IRM requis (images haute résolution pondérées en T1 de la tête du front vers le dos, couvrant une oreille à l’autre) sont disponibles.
- Insérez le périphérique de stockage externe (USB ou CD) contenant les données IRM dans le port USB du système.
- Créez un profil patient. Sélectionnez Nouveau patient dans le système et entrez les informations requises. Lors de la création d’un nouveau profil patient dans le système, certaines informations sont automatiquement importées à partir de l’IRM-CD, tandis que d’autres détails doivent être saisis manuellement.
- Après avoir inséré le CD dans le système, le nom complet et la date de naissance du patient sont automatiquement récupérés à partir des métadonnées du CD d’IRM. Entrez manuellement le plan de traitement dans le système. Sélectionnez le protocole préconfiguré pour la maladie d’Alzheimer (MA), déjà stocké dans le système. Ce protocole comprend les paramètres suivants : une fréquence de 4 Hz, un niveau d’énergie de 0,2 mJ/mm2 et 6 000 impulsions par session. Le protocole peut être utilisé tel quel ou ajusté en fonction des préférences du clinicien.
- Chargez les données IRM et vérifiez la qualité des images. Pour vérifier la qualité des données IRM, faites défiler manuellement les différentes tranches des images IRM dans le système. Assurez-vous que toutes les structures anatomiques sont nettes et bien définies et vérifiez l’absence d’artefacts de mouvement ou de distorsions. Confirmer que la résolution globale des images pondérées en T1 est suffisante pour une neuronavigation précise. Ajustez les sélections d’images si nécessaire et procédez à l’étalonnage.
- Pour calibrer les images, utilisez le stylet de calibrage pour effectuer un étalonnage en 3 points à l’aide des chemins suivants.
Chemin 1 : Du front à l’arrière de la tête.
Chemin 2 : D’une oreille à l’autre.
Chemin 3 : Effectuez des mouvements circulaires ou en zigzag sur le dessus de la tête. - Assurez-vous que les objectifs de détection font face à l’appareil photo à tout moment pendant l’étalonnage.
- Vérifiez que le modèle de tête 3D à l’écran s’aligne correctement avec la tête du patient en le tournant pour vérifier les points de contact.
7. Configuration de la région de traitement (facultatif)
- Définissez les régions de traitement en fonction des besoins spécifiques du patient. Pour cette étude, le protocole préconfiguré de la maladie d’Alzheimer a été utilisé, y compris le lobe frontal bilatéral, le lobe pariétal bilatéral et le précunéus. De plus, au protocole initial, ajoutez le cortex temporal bilatéral. Utilisez les images IRM et les repères anatomiques spécifiques du cerveau pour définir les régions à stimuler.
- Ajustez la taille, la forme et le nombre de zones de traitement à l’écran. Pour ajuster les retours sur investissement, le processus est entièrement effectué à l’aide des commandes de l’écran tactile.
- Commencez par accéder au module de planification du traitement sur l’interface principale du système. Dans ce module, sélectionnez l’option Ajustement de la valeur du retour sur investissement pour activer la modification des régions de traitement. Une fois en mode de réglage, le système affiche un retour sur investissement par défaut à l’écran.
- Pour positionner le retour d’intérêt sur la zone anatomique souhaitée, telle que le lobe frontal, le lobe pariétal, le précunéus ou le cortex temporal, utilisez les boutons fléchés de l’écran tactile. Les boutons permettent de déplacer le retour sur investissement de manière incrémentielle dans toutes les directions (haut, bas, gauche, droite) pour un alignement précis avec la région cérébrale cible.
- Après avoir positionné le retour d’intérêt, ajustez ses dimensions (taille, profondeur et forme) à l’aide des commandes dédiées à l’écran :
Réglage de la profondeur (bouton A) : Appuyez sur le bouton de profondeur et ajustez le niveau de pénétration du retour sur investissement pour qu’il corresponde aux exigences du traitement.
Réglage de la largeur (bouton B) : utilisez le bouton de réglage de la largeur pour agrandir ou réduire la taille horizontale du retour sur investissement.
Réglage de la hauteur (bouton C) : Modifiez la dimension verticale de la zone d’intérêt en appuyant sur la commande de réglage de la hauteur. Enregistrez les paramètres une fois l’opération terminée.
8. Déroulement du traitement
- Appliquez séquentiellement une quantité généreuse de gel à ultrasons sur le cuir chevelu du patient pour une transmission optimale de l’énergie.
- Commencez le traitement. Sélectionnez le mode de traitement sur l’appareil et vérifiez que la membrane préremplie est correctement fixée. La fixation correcte de la membrane préremplie est vérifiée en s’assurant qu’elle s’enclenche correctement sur la pièce à main. En option, le patient peut utiliser des protections auditives pendant la séance.
- Tenez la pièce à main perpendiculairement au cuir chevelu du patient, en vous assurant qu’elle est déplacée uniformément sur la surface. La figure 2 illustre l’alignement idéal entre le patient et le NEUROLITH pendant le TPS. La figure 3 montre un exemple de régions d’intérêt (ROI) et de modélisation des tissus stimulés sur l’IRM d’un patient. La figure 4 montre une illustration de l’appareil portable pendant la stimulation.
- Surveillez la stimulation. Traitez chaque région jusqu’à ce que les zones ciblées sur l’écran deviennent vertes, indiquant une couverture appropriée. Continuez à déplacer la pièce à main tout en gardant les objectifs de détection en vue de l’appareil photo pour assurer un suivi continu.
REMARQUE : Si les lunettes de reconnaissance se déplacent légèrement pendant le traitement, la séance peut continuer. Cependant, si les lunettes sont retirées, un recalibrage est nécessaire. - Concluez la session. Pour terminer le traitement, appuyez sur le bouton Stop de l’appareil. Le point final de la session est atteint lorsque l’on atteint 6000 impulsions.
9. Procédures post-traitement
- Nettoyez l’équipement. Nettoyez la pièce à main et la membrane amovible à l’aide de lingettes approuvées (évitez les nettoyants à base d’alcool).
- Soins aux patients : Nettoyez doucement la zone du cuir chevelu pour éliminer tout gel à ultrasons restant. Si nécessaire, séchez les cheveux du patient avec une serviette ou un sèche-cheveux. Après le traitement, conseillez aux patients de rester à proximité pendant les 10 à 15 minutes suivantes au cas où ils ressentiraient des effets secondaires retardés ou légers, tels que des étourdissements, des maux de tête ou une gêne du cuir chevelu, bien qu’aucune observation active ne soit requise. Encouragez les patients à rester hydratés, car cela favorise la récupération et le bien-être général. Conseillez au patient d’éviter toute activité physique intense pour le reste de la journée, en particulier s’il se sent fatigué ou s’il ressent un léger inconfort après la séance.
- Stockage des données de traitement : Enregistrez toutes les données de traitement, y compris les régions définies, et ajustez-les pour les sessions futures. Toute observation pendant le traitement ou tout retour d’information doit être documenté.
Résultats
La stimulation transcrânienne par impulsions a atténué les symptômes des patients atteints de la maladie d’Alzheimer, comme le démontrent les données pilotes non contrôlées de 11 patients (neuf hommes, deux femmes, tranche d’âge 59-77 ans, M = 69,82) publiées par le groupe de travail de ce tutoriel1. Les zones stimulées comprenaient le cortex frontal bilatéral, le cortex pariétal latéral bilatéral et le cortex précuneus étendu. Le cortex temporal bilatéral a été ajouté au protocole. Le traitement a été administré en six séances initiales avec 6 000 impulsions sur 2 semaines comme premier cycle de traitement.
Le protocole de traitement pendant la stimulation impliquait 4 Hz, 0,20 mJ/mm2 et 6000 impulsions. Trois patients sur 11 (27 %) ont signalé des effets indésirables lors de trois séances sur 75 (4 %). Ceux-ci comprenaient des douleurs à la mâchoire (NRS 4/10), des nausées (NRS 7/10) et de la somnolence (NRS 10/10). Cependant, aucun d’entre eux n’a duré plus de 24 heures, et tous n’ont pas pu être directement attribués à la stimulation en tant qu’événements indésirables du dispositif (EIM).
Une différence significative a été observée dans le score total ADAS post-stimulation par rapport à la ligne de base, avec une amélioration de 30,2 à 25,8 (p = 0,01), et dans le score ADAS-Cog, qui s’est amélioré de 25,8 à 23,3 (p = 0,04 ; Figure 5). Bien que certains patients n’aient montré que des améliorations mineures, la meilleure amélioration chez un patient était de 40 %, ce qui a conduit à une amélioration globale de 15,76 % du score total ADAS et de 8,65 % du score ADAS Cog (Figure 6). De plus, une différence significative dans les symptômes dépressifs a été détectée dans une sous-échelle auto-déclarée du test ADAS. Un test t unilatéral a montré une réduction significative des symptômes dépressifs, mesurée par une sous-échelle autodéclarée du test ADAS. Avant la stimulation, la moyenne était de 0,7 (ET = 1,1), et après la stimulation, elle a diminué à 0,2 (ET = 0,4 ; t (8) = 1,859, p < 0,01).
Une échelle d’évaluation subjective a été réalisée avant et après la période de traitement de deux semaines. Cette échelle permet aux patients de signaler la gravité de leurs symptômes et tout événement indésirable perçu sur une échelle d’évaluation numérique de 0 à 10, les chiffres les plus élevés indiquant une plus grande intensité des symptômes. L’amélioration subjective moyenne de la gravité des symptômes, telle que mesurée par le NRS, était de 5,7 à 3,4 (p = 0,023).
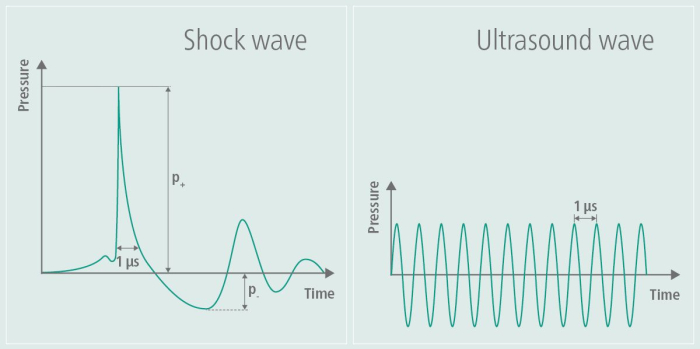
Figure 1 : Onde de choc pendant la stimulation. Le graphique illustre l’amplitude d’un TPS sur le côté gauche de l’image et la compare à l’amplitude d’une échographie sur le côté droit de l’image. Au cours du TPS, une impulsion de pression singulière est générée, suivie d’un aplatissement ultérieur de l’amplitude. En revanche, l’amplitude des ultrasons ne s’aplatit pas à nouveau mais est maintenue, ce qui entraîne des oscillations continues à haute fréquence au fil du temps. Ce chiffre a été modifié au lieu de9. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Système de navigation IRM. L’image illustre l’alignement idéal entre le patient et le NEUROLITH pendant le TPS. La caméra 3D contacte les verres de détection du masque et ceux de la pièce à main. Ce n’est que si cette transmission est garantie que la pièce à main est reconnue dans la position spatiale correcte et que la visualisation de la stimulation à l’écran n’est pas perturbée. Ce chiffre a été modifié au lieu de9. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Régions d’intérêt et zones stimulées. L’image montre un exemple des régions d’intérêt (ROI) et de la modélisation des tissus stimulés sur l’IRM d’un patient. Les couleurs différencient davantage le nombre d’impulsions appliquées dans les zones respectives du précunéus, ainsi que dans les régions frontales et pariétales. La coloration verte est suivie de turquoise, de bleu et de violet. Le violet indique une intensité excessive et doit être évité. Les zones stimulées sont visualisées comme des données simulées du système de navigation comme des zones principalement atteintes, mais cela n’est pas mesuré comme une véritable activation cérébrale appliquée. Une stimulation temporelle supplémentaire est ajoutée dans le protocole de Kempen bien qu’elle ne soit pas prédéfinie comme ROI. À gauche : vue axiale, au milieu : vue sagittale, à droite : vue coronale. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Appareil portatif. Cette figure illustre l’appareil portatif utilisé pendant la stimulation. Les étapes préparatoires critiques comprennent l’application d’une quantité suffisante de gel à ultrasons sur le cuir chevelu du patient pour assurer une transmission optimale de l’énergie et la vérification que la membrane préremplie est solidement et correctement fixée. Pendant le traitement, la pièce à main est tenue perpendiculairement au cuir chevelu et déplacée uniformément sur la surface pour maintenir une stimulation constante. Ce chiffre a été modifié au lieu de9. Veuillez cliquer ici pour voir une version agrandie de cette figure.
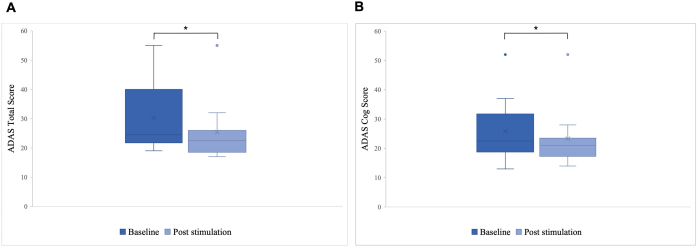
Figure 5 : Échelle d’évaluation de la maladie d’Alzheimer (ADAS) avant la première stimulation. Moyenne du score du groupe de patients sur l’échelle d’évaluation de la maladie d’Alzheimer (ADAS) avant la première stimulation (bleu foncé) et après la dernière stimulation (bleu clair). Un score inférieur indique de meilleures performances. La boîte à moustaches montre la distribution des données des patients. (A) Note totale ADAS. La ligne représente la médiane du groupe (ligne de base = 24,5, post-stimulation = 22,5), et la croix représente les scores moyens (M ligne de base = 30,2 (ET 11,55), M après stimulation = 25,8 (ET 10,71), *p = 0,01). (B) Score de rouage ADAS. La ligne représente la médiane du groupe (ligne de base = 22,5, post-stimulation = 21), et la croix représente les scores moyens (M ligne de base = 25,8 (ET 10,77), M après la stimulation = 23,3 (ET 10,27), *p = 0,04). Cette figure a été modifiée au lieu de5. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Résultats des tests individuels des patients dans l’ADAS. Résultats des tests individuels des patients sur l’échelle d’évaluation de la maladie d’Alzheimer (ADAS) avant la première stimulation (ligne de base) et après la dernière stimulation (post-stimulation). Un score inférieur indique de meilleures performances. Chaque ligne représente un patient. (A) Scores individuels de chaque patient dans le score total ADAS. La meilleure amélioration a été de 15 points (ID 3). (B) Scores individuels de chaque patient dans le score cog de la sous-échelle ADAS. La meilleure amélioration a été de 14 points (ID 3 et ID 4). Cette figure a été modifiée au lieu de5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans l’ensemble, le TPS est un traitement possible de la maladie d’Alzheimer. D’un point de vue pratique, le processus de stimulation est conçu pour être convivial pour l’opérateur. La possibilité de définir des régions d’intérêt au début de la procédure, ainsi que la visualisation du nombre d’impulsions appliquées par des marquages à code couleur pendant le traitement, simplifient considérablement la manipulation de l’interface utilisateur. Le réglage des régions d’intérêt peut également être sélectionné librement et ajusté si nécessaire. Les zones stimulées sont clairement visualisées sous forme de données simulées, bien que le fabricant doive poursuivre le développement pour afficher les zones plus profondes affectées par l’appareil à des niveaux d’énergie plus faibles.
Les étapes critiques du protocole TPS comprennent le positionnement précis du dispositif de stimulation sur les régions cérébrales ciblées, la garantie de l’intensité et de la fréquence correctes des ondes de pouls, et la surveillance minutieuse des réponses du patient. Le dépannage peut inclure d’assurer un contact optimal entre la pièce à main et le cuir chevelu pour éviter la perte d’énergie ou une stimulation sous-optimale. Si une gêne ou des effets secondaires sont observés, des ajustements d’intensité ou un repositionnement peuvent être nécessaires.
Des données non contrôlées publiées ont démontré des améliorations cognitives cliniques 5,3, ainsi qu’une augmentation de l’épaisseur corticale dans plusieurs zones du cerveau10 et des changements dans la connectivité MR-réseau11. Des améliorations de l’humeur ont également été signalées 5,4. Par rapport à d’autres méthodes de stimulation cérébrale non invasives, le TPS offre plusieurs avantages distincts. Tout d’abord, il combine des ondes de choc mécaniques avec une neuronavigation précise, permettant une application ciblée sur les régions cérébrales touchées. Contrairement à la TMS, qui ne stimule généralement que les couches corticales superficielles, la profondeur de pénétration du TPS le rend particulièrement adapté au traitement des maladies neurodégénératives comme la maladie d’Alzheimer, où des structures cérébrales plus profondes sont impliquées. De plus, le TPS semble avoir un profil d’innocuité favorable, avec des effets secondaires minimes et transitoires signalés dans seulement 4 % des séances de traitement, ce qui indique qu’il pourrait être une option plus tolérable pour les patients atteints de MA5 modérée à sévère.
Pour étudier en profondeur les mécanismes d’action et effectuer une analyse détaillée des facteurs de risque potentiels associés au traitement par TPS, des études fondamentales supplémentaires sont nécessaires.
Dans une étude récente publiée par ce groupe de recherche, l’activité du réseau cérébral chez les patients atteints de la maladie d’Alzheimer a été examinée avant et après la stimulation par impulsions transcrâniennes (TPS)17. Les résultats indiquent que le TPS peut moduler les oscillations cérébrales et la connectivité, améliorant potentiellement la fonction cognitive dans la maladie d’Alzheimer. L’un des mécanismes proposés est que l’augmentation des oscillations gamma post-TPS peut faciliter la clairance glymphatique dans le cerveau. Cet effet possible sur la clairance glymphatique devrait être étudié plus avant dans des études futures. De plus, d’autres études mécanistes sont nécessaires pour clarifier comment le TPS influence la physiologie du réseau cérébral et si ses effets neuroprotecteurs peuvent ralentir ou arrêter la progression de la maladie d’Alzheimer.
Des études précliniques sur des animaux qui explorent les effets du TPS sur les cerveaux sains et malades sont cruciales pour mieux comprendre les mécanismes sous-jacents. Il est important de noter que diverses techniques NiBS fonctionnent par le biais de mécanismes distincts1. Par conséquent, il est essentiel d’examiner si et comment les effets décrits pour la thérapie par ultrasons18 et la thérapie par ondes de choc6 sur les tissus jouent un rôle dans la thérapie TPS. Le premier décrivait l’influence possible du TPS sur les processus de mécanotransduction, ainsi que son potentiel à induire des changements vasculaires, cellulaires et moléculaires, qui doivent être étudiés de manière approfondie. De plus, la modulation des processus neuro-inflammatoires, avec un accent particulier sur la dynamique de la barrière hémato-encéphalique, présente un domaine intrigant pour les recherches futures. La compréhension de ces effets pourrait fournir des informations précieuses sur les mécanismes sous-jacents et aider à optimiser le TPS pour des applications thérapeutiques. De plus, cela contribue à l’exploration de l’application potentielle du traitement TPS dans la prise en charge d’autres maladies neurodégénératives.
Le TPS est prometteur en tant qu’approche thérapeutique ; Cependant, plusieurs limites doivent être prises en compte. Des essais cliniques contrôlés avec des groupes placebo sont essentiels pour délimiter avec précision les effets spécifiques du TPS. Un défi important est la grande variabilité interindividuelle de la réponse à la stimulation, qui peut être influencée par des facteurs tels que le stade de la maladie d’Alzheimer (MA) et la présence de comorbidités4. De plus, le protocole optimal pour un traitement à long terme n’est pas défini. Les approches actuelles comprennent des séances mensuelles de rappel unique ou la répétition d’un cycle de traitement de 12 séances dans un an, mais les preuves de la supériorité d’une approche par rapport à l’autre font défaut. Les recherches cliniques futures devraient donner la priorité à l’identification des paramètres de stimulation optimaux, à l’évaluation de l’influence des facteurs spécifiques au patient (par exemple, le stade de la MA) sur les résultats thérapeutiques et à l’étude des effets à long terme et de la durabilité du traitement par TPS.
Déclarations de divulgation
L’auteur Lars Wojtecki a précédemment reçu des subventions de financement et un soutien institutionnel de la Fondation allemande pour la recherche, Hilde-Ulrichs-Stiftung für Parkinsonforschung, et du ParkinsonFonds Germany, BMBF/ERA-NETNEURON, DFG Forschergruppe (FOR1328), Deutsche Parkinson Vereinigung (DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB ; Medtronic, UCB, Teva, Allergan, Merz, Abbvie, Roche, Bial, Merck, Novartis, Desitin, Spectrum. L’auteur Lars Wojtecki possédait des actions de la société BioNTech SE. L’auteur Lars Wojtecki est consultant auprès des sociétés suivantes : TEVA, UCB Schwarz, Desitin, Medtronic, Abbott/Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed et Vertanical. L’auteur Céline Cont est consultante chez Storz Medical. Les autres auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions les patients pour leur observance et leur participation. L’assistance technique et la collecte de données ont été assurées avec l’aide de Veronika Hirsch et Michaela Wessler (assistantes techniques médicales).
matériels
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
Références
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon