Method Article
Estimulación transcraneal del pulso para pacientes con Alzheimer
En este artículo
Resumen
Este artículo describe el procedimiento de estimulación del pulso transcraneal en pacientes con enfermedad de Alzheimer. Analiza en detalle las indicaciones, la metodología y las perspectivas futuras.
Resumen
La estimulación transcraneal por pulso (TPS) es una terapia de neuromodulación no invasiva con marcado Conformité Européenne (CE) para el tratamiento de la enfermedad de Alzheimer (EA). Los estudios piloto iniciales han demostrado efectos prometedores sobre la función cognitiva. Este artículo se centra en el procedimiento para tratar a los pacientes con EA mediante un dispositivo TPS neuronavegado guiado por resonancia magnética. El protocolo a seguir para esto se describe en detalle, incluidos los procedimientos necesarios y la configuración del dispositivo. También se ofrece una breve reseña de los resultados clínicos representativos publicados hasta la fecha. Además de las mejoras clínicas significativas en la cognición y el afecto, se presentan los eventos adversos (EA) y los posibles eventos adversos del dispositivo (ADE) para proporcionar datos de seguridad. Finalmente, se discute críticamente el método. En el futuro, se deben realizar ensayos controlados aleatorios para descartar cualquier efecto placebo. También hay una falta de estudios a largo plazo con un mayor número de pacientes. A pesar de estas preguntas no resueltas, el TPS tiene el potencial como tratamiento complementario para los pacientes con Alzheimer cuando se usa en un entorno controlado y científicamente guiado.
Introducción
Las técnicas de estimulación cerebral no invasiva (NiBS) se han convertido en un foco de creciente interés en la investigación de la demencia, ofreciendo posibles estrategias terapéuticas para mitigar los déficits cognitivos y funcionales asociados con las enfermedades neurodegenerativas. La evidencia acumulada sugiere que el NiBS podría mejorar la función cognitiva o retrasar el deterioro cognitivo en individuos con enfermedad de Alzheimer (EA) en varias etapas de la afección 1,2. Entre estas técnicas, la Estimulación de Pulso Transcraneal (TPS) es particularmente notable por su capacidad para proporcionar una estimulación cerebral altamente enfocada y dirigida con precisión, no solo en la superficie cortical sino también en regiones cerebrales más profundas 3,4. Los efectos secundarios asociados con el TPS son raros, de gravedad moderada y transitorios 3,5.
Inicialmente desarrollada en los campos de la ortopedia y la cardiología, se ha demostrado que la terapia terapéutica de ultrasonido y la terapia de ondas de choque extracorpóreas (ESWT) promueven la cicatrización de los tejidos y mejoran el flujo sanguíneo. En ortopedia, la ESWT se aplicó particularmente para tratar afecciones musculoesqueléticas como tendinopatías y problemas de cicatrización ósea, mientras que en cardiología, se exploró por sus efectos sobre la salud vascular 6,7. El TPS se ha adaptado para aplicaciones neurológicas, particularmente en la investigación del Alzheimer, mostrándose prometedor para abordar el deterioro cognitivo y las deficiencias funcionales 8,3,4. Esta técnica utiliza ondas de choque para aliviar los síntomas de los pacientes con enfermedad de Alzheimer, tal y como demuestran los datos piloto del grupo de trabajo de este tutorial5. Las ondas de choque se diferencian de las ondas ultrasónicas en que no implican una carga alterna de alta frecuencia9. El perfil de onda de choque generado, como se muestra en la Figura 1, ilustra claramente el pulso de presión singular y el posterior aplanamiento de la amplitud durante el TPS, junto con la amplitud de frecuencia más alta característica del ultrasonido. Debido a la tensión alterna de alta frecuencia, la energía de las ondas ultrasónicas es absorbida por el tejido, lo que puede provocar el calentamiento del tejido, un efecto que no se observa con las ondas de choque. En otras aplicaciones, se utilizan ondas de choque de alta energía, mientras que en TPS, la energía introducida en el tejido es de baja energía9. Los efectos potenciales sobre la enfermedad de Alzheimer se informaron por primera vez como mejoras en el Consorcio para Establecer un Registro de la Enfermedad de Alzheimer (CERAD)3, así como un aumento del grosor cortical en varias áreas10 y cambios en la conectividad de la red de RM11.
Los mecanismos de acción del TPS se encuentran actualmente en investigación, centrándose en cómo esta técnica no invasiva modula la actividad cerebral a nivel celular, desencadenando potencialmente procesos de mecanotransducción que podrían potenciar la neuroplasticidad y mejorar la función cognitiva 3,4. En la terapia con ondas de choque, la energía física actúa sobre el área de tejido localizada e induce la mecanotransducción12, estimulando la liberación de los factores de crecimiento13,14 y óxido nítrico15. Estos efectos, a su vez, pueden mejorar la circulación sanguínea y promover la neoangiogénesis16.
El objetivo del TPS es proporcionar una terapia complementaria que sea segura y que pueda conducir a una mejora de los síntomas. Las áreas estimuladas pueden incluir la corteza frontal bilateral, la corteza parietal lateral bilateral, la corteza precúneua extendida y la corteza temporal bilateral. El protocolo de tratamiento habitual consta de seis sesiones con 6.000 pulsaciones durante 2 semanas como primer ciclo de tratamiento.
El procedimiento se considera seguro, ya que se han reportado eventos adversos en aproximadamente el 4% de las sesiones, caracterizados por una gravedad subjetiva moderada, transitoria y sin una relación causal clara con los eventos adversos relacionados con el dispositivo (ADE)5.
Si bien estos resultados iniciales son alentadores, es crucial que los investigadores y los médicos evalúen si el TPS es apropiado para sus aplicaciones específicas. Los factores a considerar incluyen la etapa de la enfermedad de Alzheimer, la respuesta del paciente a otros tratamientos y la disponibilidad de instalaciones que puedan administrar TPS de manera segura bajo la orientación de expertos. Para las personas en las etapas tempranas a moderadas de la enfermedad de Alzheimer, el TPS puede ofrecer beneficios cognitivos potenciales con efectos secundarios mínimos, pero aún no se considera un tratamiento independiente. En cambio, puede complementar las terapias existentes, como las intervenciones farmacológicas o el entrenamiento cognitivo. Hasta la fecha, los resultados de los ensayos controlados aleatorios son escasos. Sin embargo, el TPS podría tener el potencial como un tratamiento complementario para los pacientes con Alzheimer bajo uso controlado y exploración científica.
Protocolo
El análisis de todos los pacientes tratados con TPS formó parte del registro local aprobado por el Comité de Ética de la Cámara Médica Regional (Ärztekammer Nordrhein, Nr. 2021026). Además, todos los pacientes firmaron su consentimiento por escrito para el tratamiento. Un total de 11 pacientes fueron tratados con TPS (nueve hombres, dos mujeres, rango de edad 59-77 años, M = 69,82). Antes del tratamiento, todos los pacientes se sometieron a un detallado proceso de consentimiento informado, durante el cual se les informó detalladamente sobre los posibles beneficios y riesgos de la estimulación transcraneal del pulso (TPS) con el sistema NEUROLITH.
1. Selección y preparación de pacientes
- Antes de iniciar esta estimulación, la selección del paciente y el consentimiento informado son cruciales. Utilice el marcado CE para la enfermedad de Alzheimer. Confirmar el diagnóstico mediante biomarcadores de LCR en base al síndrome clínico de Alzheimer. Realizar el tratamiento de la enfermedad de acuerdo con las pautas nacionales o internacionales por un neurólogo o psiquiatra.
NOTA: El TPS se puede ofrecer como un complemento en el marco de la exploración científica. Dado que el TPS se administró como un tratamiento complementario, todos los pacientes continuaron con sus planes de tratamiento médico regulares durante todo el tratamiento. Algunos pacientes estaban tomando medicamentos antidemenciales y/o antipsicóticos durante las sesiones de TPS; Sin embargo, estos medicamentos no formaron parte del protocolo del estudio y no fueron modificados ni estandarizados como parte de la intervención. - Utilice los siguientes criterios de exclusión para el TPS: El tratamiento está contraindicado con patologías intracerebrales relevantes no relacionadas con la enfermedad de Alzheimer, incluida la encefalopatía vascular, la trombosis en el área de tratamiento, Fazekas grado 3, tumores, malformaciones vasculares, implantes metálicos y angiopatía amiloide cerebral (AAC) según la definición de los criterios de Boston. Las contraindicaciones adicionales son antecedentes o tratamiento continuo con anticuerpos, trastornos de la coagulación de la sangre o anticoagulación oral, tratamiento con corticosteroides dentro de las seis semanas anteriores a la primera aplicación, epilepsia (ya sea convulsiones múltiples o una sola convulsión con un foco convulsivo), marcapasos no aprobados para la terapia TPS, síncope recurrente, trastornos afectivos graves del comportamiento que afectan la vida diaria, como agresión o psicosis, embarazo y condiciones médicas que pueden llevar al incumplimiento del protocolo. Con respecto a los criterios de diagnóstico y exclusión, incluyendo resonancia magnética, electroencefalorragia clásica, análisis de LCR, pruebas de laboratorio y evaluaciones cognitivas y afectivas detalladas en el estudio.
2. Pruebas neuropsicológicas
- Realizar pruebas neuropsicológicas antes de la primera estimulación (basal) y después de la última estimulación (post-estimulación). Para este estudio se ha utilizado la Escala de Evaluación de la Enfermedad de Alzheimer (ADAS).
- Antes de comenzar el ADAS, prepare el entorno de prueba para asegurarse de que sea silencioso, cómodo y libre de distracciones. Realice la evaluación con un clínico o neuropsicólogo capacitado, que sigue un formato estructurado para evaluar dominios cognitivos específicos.
- El ADAS consta de dos componentes principales: la Subescala Cognitiva (ADAS-Cog) y la Subescala No Cognitiva. Utilice el ADAS-Cog, que es el más utilizado, para evaluar la memoria, el lenguaje, la orientación y la praxis a través de una serie de tareas, como se describe a continuación.
- Recuerdo de palabras: Presente al paciente una lista de palabras y pídale que las recuerde inmediatamente y después de un retraso.
- Nombrar objetos y dedos: Muéstrele al paciente una serie de objetos y pídales que los nombren correctamente.
- Siguientes órdenes: Pida al paciente que realice acciones específicas basadas en instrucciones verbales para evaluar la comprensión y la praxis.
- Construcción visológica: Tarea del paciente con la copia de figuras geométricas para evaluar las habilidades visoespaciales.
- Praxis ideacional: Pida al paciente que demuestre el uso de objetos comunes (por ejemplo, un lápiz o un peine).
- Orientación: Pregúntele al paciente sobre la fecha actual, el día de la semana y el lugar.
- Reconocimiento de palabras: Pida al paciente que reconozca las palabras presentadas anteriormente de una lista de palabras distractoras.
- Habilidad lingüística: Evaluar la fluidez y comprensión del paciente a través de conversaciones estructuradas y construcción de oraciones.
- Utilice la subescala no cognitiva para evaluar los síntomas conductuales, como cambios de humor, apatía o agitación.
- Para mantener la coherencia, pídale al médico que administre la prueba que se adhiera estrictamente a las instrucciones descritas en el manual de ADAS. Puntúe cada tarea en función del rendimiento, y las puntuaciones más altas indican un mayor deterioro.
- Después de la última sesión de estimulación, repita el ADAS utilizando una versión paralela de la prueba para asegurarse de que los resultados reflejen cambios genuinos en la función cognitiva en lugar de efectos en la práctica.
3. Preparación del dispositivo y del entorno
- Encienda el dispositivo. Ubique el interruptor de alimentación principal en la parte posterior del dispositivo y enciéndalo.
- Presione el botón de espera en el panel frontal. El dispositivo tardará aproximadamente 5 minutos en inicializarse.
- Coloque al paciente. Asegúrese de que el paciente esté cómodamente sentado, con posible soporte para el cuello. Haga que el paciente use anteojos de reconocimiento con lentes de detección. Asegure los anteojos a la cabeza del paciente con cinta adhesiva o una correa para mantenerlos en su lugar.
- Configura la cámara. Alinee la cámara para asegurarse de que la cabeza del paciente sea completamente visible dentro del marco. Esta cámara es fundamental para el seguimiento y la calibración.
4. Prueba de alto voltaje (mantenimiento diario)
- Realizar la prueba de alto voltaje (prueba HV). Realice esta prueba una vez cada 24 h. Siga las instrucciones en pantalla para completar la prueba presionando el botón de disparo en el aplicador de mano.
5. Preparación de la pieza de mano
- Prepare la pieza de mano aplicando una gota de aceite de silicona sobre la membrana de la pieza de mano.
- Fije la membrana de acoplamiento precargada (la pieza distanciadora) a la pieza de mano, asegurándose de que esté segura para un rendimiento óptimo.
6. Calibración para nuevos pacientes
- Cargue los datos de resonancia magnética del paciente. Para los pacientes nuevos, asegúrese de que las resonancias magnéticas requeridas (imágenes de alta resolución con peso T1 de la cabeza desde la frente hasta la espalda, cubriendo de oreja a oreja) estén disponibles.
- Inserte el dispositivo de almacenamiento externo (USB o CD) que contiene los datos de la resonancia magnética en el puerto USB del sistema.
- Crear un perfil de paciente. Seleccione Nuevo paciente en el sistema e ingrese la información requerida. Al crear un nuevo perfil de paciente en el sistema, parte de la información se importa automáticamente desde el CD de resonancia magnética, mientras que otros detalles deben ingresarse manualmente.
- Después de insertar el CD en el sistema, el nombre completo y la fecha de nacimiento del paciente se recuperan automáticamente de los metadatos del CD de resonancia magnética. Introduzca manualmente el plan de tratamiento en el sistema. Seleccione el protocolo de enfermedad de Alzheimer (EA) preconfigurado, ya almacenado en el sistema. Este protocolo incluye los siguientes ajustes: una frecuencia de 4 Hz, un nivel de energía de 0,2 mJ/mm2 y 6.000 pulsos por sesión. El protocolo se puede utilizar tal cual o ajustarse en función de las preferencias del médico.
- Cargue los datos de la resonancia magnética y verifique la calidad de las imágenes. Para verificar la calidad de los datos de resonancia magnética, desplácese manualmente por los cortes individuales de las imágenes de resonancia magnética dentro del sistema. Asegúrese de que todas las estructuras anatómicas estén afiladas y bien definidas y compruebe la ausencia de artefactos de movimiento o distorsiones. Confirmar que la resolución general de las imágenes ponderadas en T1 es suficiente para una neuronavegación precisa. Ajuste las selecciones de imágenes según sea necesario y proceda con la calibración.
- Para calibrar las imágenes, utilice el lápiz de calibración para realizar una calibración de 3 puntos utilizando las siguientes rutas.
Camino 1: Desde la frente hasta la parte posterior de la cabeza.
Camino 2: De un oído al otro.
Camino 3: Realiza movimientos circulares o en zigzag a través de la parte superior de la cabeza. - Asegúrese de que las lentes de detección estén orientadas hacia la cámara en todo momento durante la calibración.
- Confirme que el modelo de cabeza 3D en la pantalla se alinea correctamente con la cabeza del paciente girándola para verificar los puntos de contacto.
7. Configuración de la región de tratamiento (opcional)
- Defina las regiones de tratamiento en función de las necesidades específicas del paciente. Para este estudio, se ha utilizado el protocolo preconfigurado de la enfermedad de Alzheimer que incluye lóbulo frontal bilateral, lóbulo parietal bilateral y precúneo. Además, al protocolo inicial, agregue la corteza temporal bilateral. Utilice las imágenes de resonancia magnética y los puntos de referencia anatómicos específicos del cerebro para definir las regiones que se van a estimular.
- Ajuste el tamaño, la forma y el número de regiones de tratamiento en la pantalla. Para ajustar el retorno de la inversión, el proceso se realiza íntegramente utilizando los controles de la pantalla táctil.
- Comience accediendo al módulo de planificación del tratamiento en la interfaz principal del sistema. Dentro de este módulo, seleccione la opción Ajuste de ROI para habilitar la edición de las regiones de tratamiento. Una vez en el modo de ajuste, el sistema muestra un ROI predeterminado en la pantalla.
- Para colocar el ROI sobre el área anatómica deseada, como el lóbulo frontal, el lóbulo parietal, el precúneo o la corteza temporal, utilice los botones de flecha de la pantalla táctil. Los botones permiten mover el ROI de forma incremental en todas las direcciones (arriba, abajo, izquierda, derecha) para una alineación precisa con la región del cerebro objetivo.
- Después de posicionar el ROI, ajuste sus dimensiones (tamaño, profundidad y forma) usando los controles en pantalla dedicados:
Ajuste de profundidad (botón A): Toque el botón de profundidad y ajuste el nivel de penetración del ROI para que coincida con los requisitos del tratamiento.
Ajuste de ancho (botón B): Utilice el botón de ajuste de ancho para expandir o contraer el tamaño horizontal del ROI.
Ajuste de altura (botón C): Modifique la dimensión vertical del ROI tocando el control de ajuste de altura. Guarde la configuración una vez completada.
8. Realización del tratamiento
- Aplique secuencialmente una cantidad generosa de gel de ultrasonido en el cuero cabelludo del paciente para una transmisión óptima de la energía.
- Comienza el tratamiento. Seleccione el modo de tratamiento en el dispositivo y confirme que la membrana precargada esté correctamente colocada. La correcta fijación de la membrana precargada se verifica asegurándose de que encaje correctamente en su lugar en la pieza de mano. Opcionalmente, el paciente puede usar protección auditiva durante la sesión.
- Sostenga la pieza de mano perpendicular al cuero cabelludo del paciente, asegurándose de que se mueva uniformemente por la superficie. La Figura 2 ilustra la alineación ideal entre el paciente y el NEUROLITH durante el TPS. La figura 3 muestra un ejemplo de las regiones de interés (ROI) y el modelado del tejido estimulado en la resonancia magnética de un paciente. La figura 4 muestra una ilustración del dispositivo portátil durante la estimulación.
- Controla la estimulación. Trate cada región hasta que las áreas objetivo en la pantalla se vuelvan verdes, lo que indica una cobertura adecuada. Continúe moviendo la pieza de mano mientras mantiene las lentes de detección a la vista de la cámara para garantizar un seguimiento continuo.
NOTA: Si las gafas de reconocimiento se desplazan ligeramente durante el tratamiento, la sesión puede continuar. Sin embargo, si se retiran las gafas, es necesario recalibrarlas. - Conclusión de la sesión. Para finalizar el tratamiento, presione el botón Detener en el dispositivo. El punto final de la sesión se alcanza cuando se alcanzan 6000 pulsos.
9. Procedimientos posteriores al tratamiento
- Limpie el equipo. Limpie la pieza de mano y la membrana desmontable con toallitas aprobadas (evite los limpiadores a base de alcohol).
- Cuidado del paciente: Limpie el área del cuero cabelludo suavemente para eliminar cualquier resto de gel de ultrasonido. Si es necesario, seque el cabello del paciente con una toalla o secador de pelo. Después del tratamiento, aconseje a los pacientes que permanezcan cerca durante los próximos 10-15 minutos en caso de que experimenten algún efecto secundario tardío o leve, como mareos, dolor de cabeza o molestias en el cuero cabelludo, aunque no se requiere observación activa. Aliente a los pacientes a mantenerse hidratados, ya que esto favorece la recuperación y el bienestar general. Aconseje al paciente que evite la actividad física intensa durante el resto del día, especialmente si se siente fatigado o experimenta alguna molestia leve después de la sesión.
- Almacenamiento de datos de tratamiento: Guarde todos los datos de tratamiento, incluidas las regiones definidas, y ajústelos para sesiones futuras. Cualquier observación o retroalimentación durante el tratamiento debe ser documentada.
Resultados
La estimulación transcraneal del pulso alivió los síntomas de los pacientes con Alzheimer, como lo demuestran los datos piloto no controlados de 11 pacientes (nueve hombres, dos mujeres, rango de edad 59-77 años, M = 69,82) publicados por el grupo de trabajo de este tutorial1. Las áreas estimuladas incluyeron la corteza frontal bilateral, la corteza parietal lateral bilateral y la corteza precúneua extendida. La corteza temporal bilateral se añadió al protocolo. El tratamiento se administró en seis sesiones iniciales con 6.000 pulsos durante 2 semanas como primer ciclo de tratamiento.
El protocolo de tratamiento durante la estimulación involucró 4 Hz, 0,20 mJ/mm2 y 6000 pulsos. Tres de cada 11 pacientes (27%) informaron eventos adversos en tres de las 75 sesiones totales (4%). Estos incluyeron dolor en la mandíbula (NRS 4/10), náuseas (NRS 7/10) y somnolencia (NRS 10/10). Sin embargo, ninguno de ellos duró más de 24 h, y no todos pudieron atribuirse directamente a la estimulación como eventos adversos del dispositivo (ADE).
Se observó una diferencia significativa en la puntuación total del ADAS postestimulación en comparación con la basal, con una mejora de 30,2 a 25,8 (p = 0,01), y en la puntuación del ADAS-Cog, que mejoró de 25,8 a 23,3 (p = 0,04; Figura 5). Mientras que algunos pacientes solo mostraron mejoras menores, la mejor mejoría en un paciente fue del 40 %, lo que llevó a una mejora general del 15,76 % en la puntuación total del ADAS y del 8,65 % en la puntuación del ADAS Cog (Figura 6). Además, se detectó una diferencia significativa en los síntomas depresivos en una subescala autoinformada de la prueba ADAS. Una prueba t de una cola mostró una reducción significativa de los síntomas depresivos, medidos por una subescala autoinformada de la prueba ADAS. Antes de la estimulación, la media fue de 0,7 (DE = 1,1), y después de la estimulación, disminuyó a 0,2 (DE = 0,4; t (8) = 1,859, p < 0,01).
Se completó una escala de valoración subjetiva antes y después del período de tratamiento de dos semanas. Esta escala permite a los pacientes informar sobre la gravedad de sus síntomas y cualquier evento adverso percibido en una escala de calificación numérica de 0 a 10, donde los números más altos indican una mayor intensidad de los síntomas. La mejoría subjetiva media de la gravedad de los síntomas, medida por el NRS, fue de 5,7 a 3,4 (p = 0,023).
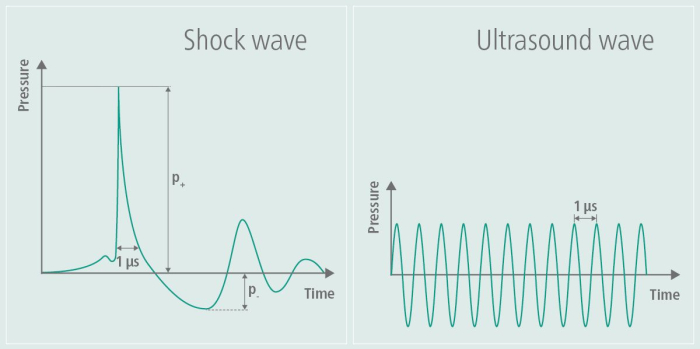
Figura 1: Onda de choque durante la estimulación. El gráfico ilustra la amplitud de un TPS en el lado izquierdo de la imagen y la compara con la amplitud de un ultrasonido en el lado derecho de la imagen. Durante el TPS, se genera un pulso de presión singular, seguido de un posterior aplanamiento de la amplitud. Por el contrario, la amplitud de los ultrasonidos no se vuelve a aplanar, sino que se mantiene, lo que da lugar a oscilaciones continuas de alta frecuencia a lo largo del tiempo. Esta cifra ha sido modificada de9. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Sistema de navegación por resonancia magnética. La imagen ilustra la alineación ideal entre el paciente y el NEUROLITH durante el TPS. La cámara 3D entra en contacto con las lentes de detección de las gafas y las de la pieza de mano. Solo si esta transmisión está garantizada, la pieza de mano se reconoce en la posición espacial correcta y la visualización de la estimulación en la pantalla no se ve perturbada. Esta cifra ha sido modificada de9. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Regiones de interés y áreas estimuladas. La imagen muestra un ejemplo de las regiones de interés (ROI) y el modelado del tejido estimulado en la resonancia magnética de un paciente. Los colores diferencian aún más el número de pulsos aplicados en las áreas respectivas del precúneo, así como en las regiones frontal y parietal. Al color verde le siguen el turquesa, el azul y el violeta. El violeta indica una intensidad excesiva y debe evitarse. Las áreas estimuladas se visualizan como datos simulados del sistema de navegación como áreas principalmente alcanzadas, pero esto no se mide como activación cerebral aplicada real. Se añade una estimulación temporal adicional en el protocolo Kempen, aunque no está predefinida como ROI. Izquierda: vista axial, centro: vista sagital, derecha: vista coronal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Dispositivo portátil. Esta figura ilustra el dispositivo portátil en uso durante la estimulación. Los pasos preparatorios críticos incluyen la aplicación de una cantidad suficiente de gel de ultrasonido en el cuero cabelludo del paciente para garantizar una transmisión óptima de la energía y la verificación de que la membrana precargada esté unida de forma segura y correcta. Durante el tratamiento, la pieza de mano se mantiene perpendicular al cuero cabelludo y se mueve uniformemente por la superficie para mantener una estimulación constante. Esta cifra ha sido modificada de9. Haga clic aquí para ver una versión más grande de esta figura.
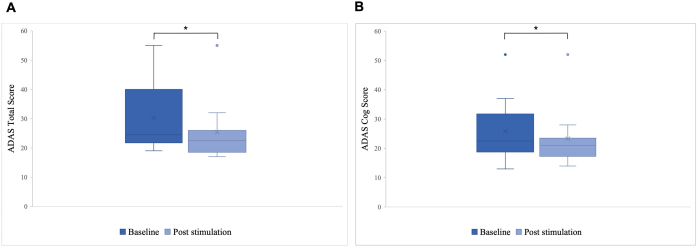
Figura 5: Escala de Valoración de la Enfermedad de Alzheimer (ADAS) antes de la primera estimulación. Media de la puntuación del grupo de pacientes en la Escala de Evaluación de la Enfermedad de Alzheimer (ADAS) antes de la primera estimulación (azul oscuro) y después de la última estimulación (azul claro). Una puntuación más baja indica un mejor rendimiento. El diagrama de caja muestra la distribución de los datos de los pacientes. (A) Puntuación total de ADAS. La línea representa la mediana del grupo (basal = 24,5, post-estimulación = 22,5), y la cruz representa las puntuaciones medias (M basal = 30,2 (DE 11,55), M post-estimulación = 25,8 (DE 10,71), *p = 0,01). (B) Puntuación de engranajes ADAS. La línea representa la mediana del grupo (basal =22,5, post-estimulación = 21), y la cruz representa las puntuaciones medias (M basal = 25,8 (DE 10,77), M post-estimulación = 23,3 (DE 10,27), *p = 0,04). Esta cifra ha sido modificada de5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Resultados de las pruebas individuales de los pacientes en ADAS. Resultados de las pruebas individuales de los pacientes en la Escala de Evaluación de la Enfermedad de Alzheimer (ADAS) antes de la primera estimulación (basal) y después de la última estimulación (post-estimulación). Una puntuación más baja indica un mejor rendimiento. Cada línea representa a un paciente. (A) Puntuaciones individuales de cada paciente en la puntuación total del ADAS. La mejor mejora fue de 15 puntos (ID 3). (B) Puntuaciones individuales de cada paciente en la subescala ADAS cog score. La mejor mejora fue de 14 puntos (ID 3 e ID 4). Esta cifra ha sido modificada de5. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En general, el TPS es un posible tratamiento para la enfermedad de Alzheimer. Desde un punto de vista práctico, el proceso de estimulación está diseñado para ser fácil de usar para el operador. La capacidad de definir regiones de interés al comienzo del procedimiento, junto con la visualización del número de pulsos aplicados a través de marcas codificadas por colores durante el tratamiento, simplifica significativamente el manejo de la interfaz de usuario. La configuración de las regiones de interés también se puede seleccionar y ajustar libremente según sea necesario. Las áreas estimuladas se visualizan claramente como datos simulados, aunque es necesario un mayor desarrollo por parte del fabricante para mostrar las áreas más profundas afectadas por el dispositivo a niveles de energía más bajos.
Los pasos críticos en el protocolo TPS incluyen la colocación precisa del dispositivo de estimulación sobre las regiones cerebrales objetivo, asegurando la intensidad y frecuencia correctas de las ondas de pulso, y un monitoreo cuidadoso de las respuestas del paciente. La solución de problemas puede incluir garantizar un contacto óptimo entre la pieza de mano y el cuero cabelludo para evitar la pérdida de energía o la estimulación subóptima. Si se observan molestias o efectos secundarios, es posible que se requieran ajustes de intensidad o reposicionamiento.
Los datos no controlados publicados han demostrado mejoras cognitivas clínicas 5,3, así como un aumento del grosor cortical en varias áreas del cerebro10 y cambios en la conectividad de la red de RM11. También se han reportado mejoras en el estado de ánimo 5,4. En comparación con otros métodos de estimulación cerebral no invasivos, el TPS ofrece varias ventajas distintivas. En primer lugar, combina ondas de choque mecánicas con una neuronavegación precisa, lo que permite una aplicación específica en las regiones cerebrales afectadas. A diferencia de la TMS, que normalmente sólo estimula las capas corticales superficiales, la profundidad de penetración de la TPS la hace especialmente adecuada para el tratamiento de enfermedades neurodegenerativas como el Alzheimer, en las que están implicadas estructuras cerebrales más profundas. Además, el TPS parece tener un perfil de seguridad favorable, con efectos secundarios mínimos y transitorios reportados en solo el 4% de las sesiones de tratamiento, lo que indica que puede ser una opción más tolerable para pacientes con EA 5 de moderada agrave.
Para investigar a fondo los mecanismos de acción y realizar un análisis detallado de los posibles factores de riesgo asociados con la terapia con TPS, se requieren estudios fundamentales adicionales.
En un estudio reciente publicado por este grupo de investigación, se examinó la actividad de la red cerebral en pacientes con Alzheimer antes y después de la estimulación transcraneal del pulso (TPS)17. Los resultados indican que el TPS puede modular las oscilaciones cerebrales y la conectividad, lo que podría mejorar la función cognitiva en la enfermedad de Alzheimer. Uno de los mecanismos propuestos es que el aumento de las oscilaciones gamma después de la TPS puede facilitar la eliminación glinfática en el cerebro. Este posible efecto sobre el aclaramiento glinfático debe investigarse más a fondo en estudios futuros. Además, se necesitan más estudios mecanicistas para aclarar cómo el TPS influye en la fisiología de la red cerebral y si sus efectos neuroprotectores pueden ralentizar o detener la progresión de la enfermedad de Alzheimer.
Los estudios preclínicos en animales que exploran los efectos del TPS en cerebros sanos y enfermos son cruciales para obtener una comprensión más profunda de los mecanismos subyacentes. Es importante tener en cuenta que varias técnicas de NiBS operan a través de distintos mecanismos1. Por lo tanto, es esencial investigar si los efectos descritos para la terapia de ultrasonido18 y la terapia con ondas de choque6 sobre el tejido juegan un papel en la terapia con TPS. El primero describió la posible influencia del TPS en los procesos de mecanotransducción, así como su potencial para inducir cambios vasculares, celulares y moleculares, que deben ser investigados a fondo. Además, la modulación de los procesos neuroinflamatorios, con especial énfasis en la dinámica de la barrera hematoencefálica, presenta un área intrigante para futuras investigaciones. La comprensión de estos efectos podría proporcionar información valiosa sobre los mecanismos subyacentes y ayudar a optimizar el TPS para aplicaciones terapéuticas. Además, esto contribuye a explorar la posible aplicación del tratamiento con TPS en el tratamiento de otras enfermedades neurodegenerativas.
El TPS se muestra prometedor como enfoque terapéutico; Sin embargo, hay varias limitaciones que deben abordarse. Los ensayos clínicos controlados con grupos de placebo son esenciales para delinear con precisión los efectos específicos del TPS. Un desafío significativo es la alta variabilidad interindividual en la respuesta a la estimulación, que puede estar influenciada por factores como la etapa de la enfermedad de Alzheimer (EA) y la presencia de comorbilidades4. Además, el protocolo óptimo para el tratamiento a largo plazo sigue sin definirse. Los enfoques actuales incluyen sesiones mensuales de refuerzo único o la repetición de un ciclo de tratamiento de 12 sesiones dentro de un año, pero faltan pruebas que respalden la superioridad de un enfoque sobre el otro. La investigación clínica futura debe priorizar la identificación de los parámetros de estimulación óptimos, la evaluación de cómo los factores específicos del paciente (p. ej., la etapa de la EA) influyen en los resultados terapéuticos y la investigación de los efectos a largo plazo y la sostenibilidad de la terapia con TPS.
Divulgaciones
El autor Lars Wojtecki ha recibido anteriormente subvenciones y apoyo institucional de la Fundación Alemana de Investigación, Hilde-Ulrichs-Stiftung für Parkinsonforschung, y el ParkinsonFonds Germany, BMBF/ERA-NETNEURON, DFG Forschergruppe (FOR1328), Deutsche Parkinson Vereinigung (DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB; Medtronic, UCB, Teva, Allergan, Merz, Abbvie, Roche, Bial, Merck, Novartis, Desitin, Spectrum. El autor Lars Wojtecki poseía acciones en la empresa BioNTech SE. El autor Lars Wojtecki es consultor de las siguientes empresas: TEVA, UCB Schwarz, Desitin, Medtronic, Abbott/Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed y Vertanical. La autora, Celine Cont, es consultora de Storz Medical. El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Agradecimientos
Agradecemos a los pacientes por su cumplimiento y participación. La asistencia técnica y la recopilación de datos se aseguraron con la ayuda de Veronika Hirsch y Michaela Wessler (asistentes técnicas médicas).
Materiales
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
Referencias
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados