Method Article
알츠하이머병 환자를 위한 경두개 맥박 자극
요약
이 논문은 알츠하이머병 환자의 경두개 맥박 자극 절차에 대해 설명합니다. 징후, 방법론 및 향후 전망에 대해 자세히 설명합니다.
초록
경두개 펄스 자극법(Transcranial Pulse Stimulation, TPS)은 알츠하이머병(Alzheimer's disease, AD) 치료를 위한 유럽연합(Conformité Européenne, CE) 마크가 있는 비침습적 신경조절 요법입니다. 초기 파일럿 연구는 인지 기능에 대한 유망한 효과를 보여주었습니다. 이 기사는 MRI 유도 신경 탐색 TPS 장치를 사용하여 AD 환자를 치료하는 절차에 중점을 둡니다. 이를 위해 따라야 할 프로토콜은 필요한 절차 및 장치 설정을 포함하여 자세히 설명되어 있습니다. 현재까지 발표된 대표적인 임상 결과에 대한 간략한 개요도 제공됩니다. 인지 및 정서에 대한 상당한 임상적 개선 외에도 부작용(AE) 및 가능한 부작용(ADE)을 제시하여 안전성 데이터를 제공합니다. 마지막으로, 이 방법에 대해 비판적으로 논의합니다. 앞으로는 위약 효과를 배제하기 위해 무작위 대조 임상시험을 실시해야 한다. 또한 현재로서는 더 많은 수의 환자를 대상으로 한 장기 연구가 부족합니다. 이러한 해결되지 않은 질문에도 불구하고, TPS는 통제되고 과학적으로 안내된 환경에서 사용될 때 알츠하이머 환자를 위한 보조 치료법으로 사용될 수 있는 잠재력을 가지고 있습니다.
서문
비침습적 뇌 자극(NiBS) 기술은 치매 연구에 대한 관심이 높아지는 초점이 되었으며, 신경 퇴행성 질환과 관련된 인지 및 기능 결핍을 완화하기 위한 잠재적인 치료 전략을 제공합니다. 축적된 증거에 따르면 NiBS는 알츠하이머병(AD)을 앓고 있는 개인의 다양한 단계에 걸쳐 인지 기능을 향상시키거나 인지 기능 저하를 늦출 수 있습니다 1,2. 이러한 기법 중에서도 경두개 펄스 자극(Transcranial Pulse Stimulation, TPS)은 피질 표면뿐만 아니라 더 깊은 뇌 영역에서도 고도로 집중되고 정밀하게 표적화된 뇌 자극을 전달하는 능력으로 특히 주목할 만합니다 3,4. TPS와 관련된 부작용은 드물고, 중증도는 보통이며, 일시적이다 3,5.
정형외과 및 심장학 분야에서 처음 개발된 치료용 초음파 요법과 체외 충격파 요법(ESWT)은 조직 치유를 촉진하고 혈류를 개선하는 것으로 나타났습니다. 정형외과에서는 건병증 및 뼈 치유 문제와 같은 근골격계 질환을 치료하기 위해 ESWT가 특히 적용되었으며, 심장학에서는 혈관 건강에 미치는 영향을 조사했습니다 6,7. TPS는 신경학적 응용, 특히 알츠하이머 연구에 적용되어 인지 기능 저하 및 기능 장애를 해결하는 데 유망한 것으로 나타났습니다 8,3,4. 이 기술은 충격파를 사용하여 알츠하이머병 환자의 증상을 완화하며, 이는 이 튜토리얼5의 작업 그룹의 파일럿 데이터에 의해 입증되었습니다. 충격파는 고주파 교대 부하9를 포함하지 않는다는 점에서 초음파와 다릅니다. 그림 1에서 볼 수 있듯이 생성된 충격파 프로파일은 초음파의 고주파 진폭 특성과 함께 TPS 중 단일 압력 펄스와 그에 따른 진폭의 평탄화를 명확하게 보여줍니다. 고주파 교대 응력으로 인해 초음파의 에너지가 조직에 흡수되어 충격파에서는 관찰되지 않는 효과인 조직 온난화로 이어질 수 있습니다. 다른 응용 분야에서는 고에너지 충격파가 사용되는 반면 TPS에서는 조직에 도입된 에너지가 저에너지입니다9. 알츠하이머병에 대한 잠재적 영향은 컨소시엄 to Establish a Alzheimer's Disease (CERAD)3의 개선, 여러 영역의 대뇌피질 두께 증가10 및 MR-네트워크 연결성의 변화11로 처음 보고되었습니다.
TPS의 작용 기전은 현재 연구 중이며, 이 비침습적 기법이 세포 수준에서 뇌 활동을 조절하여 신경 가소성을 향상시키고 인지 기능을 향상시킬 수 있는 기계 전달 과정을 잠재적으로 촉발하는 방법에 대한 연구가 진행 중입니다 3,4. 충격파 요법에서 물리적 에너지는 국소 조직 영역에 작용하여 기계 전달12을 유도하여 성장 인자13, 14 및 산화 질소15의 방출을 자극합니다. 이러한 효과는 혈액 순환을 촉진하고 신생혈관 신생을 촉진할 수 있다16.
TPS의 목표는 안전하고 증상을 개선할 수 있는 추가 요법을 제공하는 것입니다. 자극된 영역에는 양측 전두엽 피질(bilateral frontal cortex), 양측 외측 두정엽 피질(bilateral lateral parietal cortex), 확장된 전두엽 피질(extended precuneus cortex) 및 양측 측두엽 피질(bilateral temporal cortex)이 포함될 수 있습니다. 일반적인 치료 프로토콜은 첫 번째 치료 주기로 2주 동안 6,000번의 펄스를 사용하는 6개의 세션으로 구성됩니다.
이 절차는 일시적인 중간 정도의 주관적 중증도를 특징으로 하는 세션의 약 4%에서 부작용이 보고되었으며 부작용 장치 관련 사례(ADE)와 명확한 인과 관계가 없기 때문에 안전한 것으로 간주됩니다5.
이러한 초기 결과는 고무적이지만, 연구자와 임상의가 TPS가 특정 응용 분야에 적합한지 여부를 평가하는 것이 중요합니다. 고려해야 할 요소에는 알츠하이머병의 병기, 다른 치료에 대한 환자의 반응, 전문가의 지도하에 TPS를 안전하게 투여할 수 있는 시설의 가용성 등이 포함됩니다. 알츠하이머병의 초기에서 중등도 단계에 있는 개인의 경우, TPS는 최소한의 부작용으로 잠재적인 인지적 이점을 제공할 수 있지만, 아직 단독 치료법으로 간주되지는 않습니다. 대신, 약물 개입이나 인지 훈련과 같은 기존 치료법을 보완할 수 있습니다. 무작위 대조 임상시험의 결과는 현재까지 부족하다. 그러나 TPS는 통제된 사용과 과학적 탐구에 따라 알츠하이머 환자를 위한 추가 치료법으로 잠재력을 가질 수 있습니다.
프로토콜
모든 TPS 치료 환자에 대한 분석은 지역 의료 회의소 윤리 위원회(Ärztekammer Nordrhein, Nr. 2021026)가 승인한 지역 등록부의 일부였습니다. 또한 모든 환자가 치료에 대한 서면 동의서에 서명했습니다. 총 11명의 환자(남성 9명, 여성 2명, 59-77세, M=69.82)가 TPS로 치료를 받았다. 치료 전에 모든 환자는 상세한 정보에 입각한 동의 절차를 거쳤으며, 이 과정에서 NEUROLITH 시스템을 통한 경두개 펄스 자극(TPS)의 잠재적 이점과 위험에 대해 철저히 정보를 받았습니다.
1. 환자 선택 및 준비
- 이러한 자극을 시작하기 전에 환자 선택과 정보에 입각한 동의가 중요합니다. 알츠하이머병에 CE 마크를 사용하십시오. 알츠하이머 임상 증후군을 기반으로 CSF 바이오마커를 사용하여 진단을 확인합니다. 신경과 의사 또는 정신과 의사의 국내 또는 국제 지침에 따라 질병 치료를 수행합니다.
참고: TPS는 과학적 탐구에서 추가 기능으로 제공될 수 있습니다. TPS는 추가 치료법으로 시행되었기 때문에 모든 환자는 치료 기간 동안 정기적인 치료 계획을 계속했습니다. 일부 환자는 TPS 세션 동안 항치매제 및/또는 항정신병 약물을 복용했습니다. 그러나 이러한 약물은 연구 프로토콜의 일부가 아니었으며 중재의 일부로 수정되거나 표준화되지 않았습니다. - TPS에 대한 다음 제외 기준을 사용하십시오: 치료는 혈관성 뇌병증, 치료 부위의 혈전증, Fazekas 등급 3, 종양, 혈관 기형, 금속 임플란트 및 보스턴 기준에 의해 정의된 대뇌 아밀로이드 혈관병증(CAA)을 포함하여 알츠하이머병과 관련이 없는 관련 뇌내 병리와 함께 금기입니다. 추가 금기 사항으로는 항체 요법 병력 또는 진행 중인 항체 요법, 혈액 응고 장애 또는 경구 항응고제, 첫 번째 적용 전 6주 이내의 코르티코스테로이드 치료, 간질(다발성 발작 또는 발작에 초점을 맞춘 단일 발작), TPS 요법이 승인되지 않은 심박 조율기, 재발성 실신, 공격성 또는 정신병과 같은 일상 생활에 영향을 미치는 심각한 정서적 행동 장애, 임신 및 프로토콜을 준수하지 않을 수 있는 의학적 상태. MRI, EEG, CSF 분석, 실험실 테스트, 정밀 검사에서 상세한 인지 및 정서적 평가를 포함한 진단 및 제외 기준과 관련하여.
2. 신경 심리학적 검사
- 첫 번째 자극 전(기준선)과 마지막 자극 후(자극 후)에 신경 심리학 검사를 수행합니다. 이 연구에는 알츠하이머병 평가 척도(ADAS)가 사용되었습니다.
- ADAS를 시작하기 전에 테스트 환경이 조용하고 편안하며 방해 요소가 없는지 확인합니다. 훈련된 임상의나 신경심리학자와 함께 평가를 수행하며, 이들은 구조화된 형식을 따라 특정인지 영역을 평가합니다.
- ADAS는 인지 하위 척도(ADAS-Cog)와 비인지 하위 척도의 두 가지 주요 구성 요소로 구성됩니다. 가장 일반적으로 사용되는 ADAS-Cog를 사용하여 아래에 설명된 일련의 작업을 통해 기억, 언어, 방향 및 실습을 평가합니다.
- 단어 회상: 환자에게 단어 목록을 제시하고 지연 후 즉시 단어를 기억하도록 요청하십시오.
- 물건과 손가락 이름 짓기: 환자에게 일련의 물건을 보여주고 올바른 이름을 지어달라고 요청합니다.
- 다음 명령: 환자에게 이해력과 실습을 평가하기 위해 구두 지시에 따라 특정 행동을 수행하도록 요청합니다.
- Visuo-construction: 시공간 기술을 평가하기 위해 환자에게 기하학적 도형을 복사하는 과제를 부여합니다.
- 관념화 실습: 환자에게 일반적인 물건(예: 연필 또는 빗)의 사용을 시연하도록 요청합니다.
- 오리엔테이션: 환자에게 현재 날짜, 요일 및 위치에 대해 질문합니다.
- 단어 인식: 환자에게 주의를 산만하게 하는 단어 목록에서 이전에 제시된 단어를 인식하도록 요청합니다.
- 언어 능력: 구조화된 대화와 문장 구성을 통해 환자의 유창성과 이해도를 평가합니다.
- 비인지적 하위 척도를 사용하여 기분 변화, 무관심 또는 동요와 같은 행동 증상을 평가합니다.
- 일관성을 위해 검사를 시행하는 임상의에게 ADAS 매뉴얼에 설명된 지침을 엄격하게 준수하도록 요청하십시오. 성과에 따라 각 작업에 점수를 매기고, 점수가 높을수록 손상이 더 크다는 것을 나타냅니다.
- 마지막 자극 세션 후, 병렬 버전의 테스트를 사용하여 ADAS를 반복하여 결과가 연습 효과가 아닌 인지 기능의 진정한 변화를 반영하는지 확인합니다.
3. 장치 및 환경 준비
- 장치를 켭니다. 장치 뒷면에 있는 주 전원 스위치를 찾아 켭니다.
- 전면 패널의 대기 버튼을 누릅니다. 장치를 초기화하는 데 약 5분 정도 걸립니다.
- 환자를 배치합니다. 환자가 목을 지지할 수 있는 편안한 좌석에 앉아 있는지 확인하십시오. 환자에게 감지 렌즈가 있는 인식 안경을 착용하게 합니다. 테이프나 스트랩을 사용하여 안경을 환자의 머리에 고정하여 제자리에 고정합니다.
- 카메라를 설정합니다. 환자의 머리가 프레임 내에서 완전히 보이도록 카메라를 정렬합니다. 이 카메라는 추적 및 보정에 매우 중요합니다.
4. 고전압 테스트 (일일 유지 보수)
- 고전압 테스트(HV-Test)를 수행합니다. 24시간마다 한 번씩 이 테스트를 수행하십시오. 화면의 지시에 따라 휴대용 애플리케이터의 트리거 버튼을 눌러 테스트를 완료하십시오.
5. 핸드피스 준비
- 핸드피스의 멤브레인에 실리콘 오일 한 방울을 바르고 핸드피스를 준비합니다.
- 미리 채워진 커플링 멤브레인(거리 조각)을 핸드피스에 부착하여 최적의 성능을 위해 고정되었는지 확인합니다.
6. 신규 환자를 위한 교정
- 환자의 MRI 데이터를 불러옵니다. 신규 환자의 경우 필요한 MRI 스캔(T1 가중치, 이마에서 등, 귀에서 귀까지 머리의 고해상도 이미지)을 사용할 수 있는지 확인하십시오.
- MRI 데이터가 포함된 외부 저장 장치(USB 또는 CD)를 시스템의 USB 포트에 삽입합니다.
- 환자 프로필을 만듭니다. 시스템에서 새 환자 를 선택하고 필요한 정보를 입력합니다. 시스템에서 새 환자 프로필을 생성할 때 일부 정보는 MRI-CD에서 자동으로 가져오지만 다른 세부 정보는 수동으로 입력해야 합니다.
- CD를 시스템에 삽입하면 MRI CD의 메타데이터에서 환자의 전체 이름과 생년월일이 자동으로 검색됩니다. 치료 계획을 시스템에 수동으로 입력합니다. 시스템에 이미 저장되어 있는 사전 구성된 알츠하이머병(AD) 프로토콜을 선택합니다. 이 프로토콜에는 4Hz의 주파수, 0.2mJ/mm2의 에너지 수준 및 세션당 6,000펄스 설정이 포함됩니다. 프로토콜은 그대로 사용하거나 임상의의 선호도에 따라 조정할 수 있습니다.
- MRI 데이터를 불러오고 영상의 품질을 확인합니다. MRI 데이터의 품질을 확인하려면 시스템 내에서 MRI 이미지의 개별 슬라이스를 수동으로 스크롤합니다. 모든 해부학적 구조가 날카롭고 잘 정의되어 있는지 확인하고 움직임, 인공물이나 왜곡이 없는지 확인하십시오. T1 가중치 영상의 전체 해상도가 정확한 신경 탐색에 충분한지 확인합니다. 필요에 따라 이미지 선택을 조정하고 보정을 진행합니다.
- 이미지를 보정하려면 보정 펜을 사용하여 다음 경로를 사용하여 3점 보정을 수행합니다.
경로 1: 이마에서 머리 뒤쪽까지.
경로 2: 한쪽 귀에서 다른 쪽 귀로.
경로 3: 머리 꼭대기를 가로질러 원형 또는 지그재그 동작을 수행합니다. - 보정하는 동안 감지 렌즈가 항상 카메라를 향하고 있는지 확인하십시오.
- 화면의 3D 머리 모델을 회전시켜 접점을 확인하여 환자의 머리와 올바르게 정렬되는지 확인합니다.
7. 치료 부위 설정(선택 사항)
- 환자의 특정 요구 사항에 따라 치료 영역을 정의합니다. 이 연구를 위해 양측 전두엽(bilateral frontal lobe), 양측 두정엽(bilateral parietal lobe) 및 전두엽(precuneus)을 포함하여 사전 구성된 알츠하이머병 프로토콜이 사용되었습니다. 또한 초기 프로토콜에 양측 측두엽 피질을 추가합니다. MRI 이미지와 뇌의 특정 해부학적 랜드마크를 사용하여 자극할 영역을 정의합니다.
- 디스플레이에서 치료 영역의 크기, 모양 및 수를 조정합니다. ROI를 조정하기 위해 프로세스는 전적으로 터치 디스플레이 컨트롤을 사용하여 수행됩니다.
- 시스템의 기본 인터페이스에서 Treatment Planning 모듈에 액세스하여 시작합니다. 이 모듈에서 ROI Adjustment 옵션을 선택하여 처리 영역을 편집할 수 있습니다. 조정 모드에 들어가면 시스템이 화면에 기본 ROI를 표시합니다.
- ROI를 전두엽, 두정엽, 전두엽 또는 측두엽 피질과 같은 원하는 해부학적 영역에 배치하려면 터치 디스플레이의 화살표 버튼을 사용합니다. 버튼을 사용하면 ROI를 모든 방향(위, 아래, 왼쪽, 오른쪽)으로 점진적으로 이동하여 대상 뇌 영역과 정확하게 정렬할 수 있습니다.
- ROI를 배치한 후 전용 화면 컨트롤을 사용하여 ROI의 치수(크기, 깊이 및 모양)를 조정합니다.
깊이 조정(버튼 A): 깊이 버튼을 누르고 치료 요구 사항에 맞게 ROI의 침투 수준을 조정합니다.
너비 조정(버튼 B): 너비 조정 버튼을 사용하여 ROI의 수평 크기를 확장하거나 축소합니다.
높이 조정(버튼 C): 높이 조정 컨트롤을 눌러 ROI의 수직 치수를 수정합니다. 완료되면 설정을 저장합니다.
8. 치료 실시
- 최적의 에너지 전달을 위해 환자의 두피에 충분한 양의 초음파 젤을 순차적으로 바르십시오.
- 치료를 시작합니다. 장치에서 처리 모드를 선택하고 미리 충전된 멤브레인이 올바르게 부착되었는지 확인합니다. 미리 채워진 멤브레인의 올바른 부착은 핸드피스의 제자리에 제대로 딸깍 소리가 나도록 확인하여 확인합니다. 선택 사항: 환자는 세션 중에 청력 보호구를 사용할 수 있습니다.
- 핸드피스를 환자의 두피에 수직으로 잡고 표면을 가로질러 고르게 움직이도록 합니다. 그림 2 는 TPS 동안 환자와 NEUROLITH 사이의 이상적인 정렬을 보여줍니다. 그림 3 은 관심 영역(ROI)과 환자의 MRI에서 자극된 조직의 모델링의 예를 보여줍니다. 그림 4 는 자극 중 휴대용 장치의 그림을 보여줍니다.
- 자극을 모니터링합니다. 디스플레이의 대상 영역이 녹색으로 바뀌어 적절한 적용 범위를 나타낼 때까지 각 영역을 치료하십시오. 지속적인 추적을 보장하기 위해 감지 렌즈를 카메라 시야에 유지하면서 핸드피스를 계속 움직입니다.
참고: 치료 중 인식 안경이 약간 움직이면 세션을 진행할 수 있습니다. 그러나 안경을 제거하면 재보정이 필요합니다. - 세션을 마칩니다. 치료를 종료하려면 장치의 중지 버튼을 누르십시오. 세션 종료 지점은 6000 펄스에 도달할 때 달성됩니다.
9. 후처리 절차
- 장비를 청소하십시오. 승인된 물티슈를 사용하여 핸드피스와 분리 가능한 멤브레인을 청소합니다(알코올 기반 세제는 사용하지 마십시오).
- 환자 관리: 두피 부위를 부드럽게 청소하여 남아 있는 초음파 젤을 제거합니다. 필요한 경우 수건이나 헤어드라이어로 환자의 머리를 말리십시오. 치료 후, 환자에게 현기증, 두통 또는 두피 불편감과 같은 지연되거나 경미한 부작용이 발생할 경우 적극적인 관찰이 필요하지 않지만 다음 10-15분 동안 근처에 머물도록 조언합니다. 환자가 수분을 유지하도록 권장하면 전반적인 회복과 웰빙에 도움이 됩니다. 환자에게 남은 하루 동안, 특히 세션 후 피로감을 느끼거나 가벼운 불편함을 느끼는 경우 격렬한 신체 활동을 피하도록 조언합니다.
- 치료 데이터 저장: 정의된 영역을 포함한 모든 치료 데이터를 저장하고 향후 세션에 맞게 조정합니다. 치료 중 관찰 또는 피드백 중 관찰 사항은 문서화해야 합니다.
결과
경두개 펄스 자극은 이 튜토리얼1의 실무 그룹에서 발표한 11명의 환자(남성 9명, 여성 2명, 연령 범위 59-77세, M = 69.82)의 통제되지 않은 파일럿 데이터에 의해 입증된 바와 같이 알츠하이머 환자의 증상을 완화했습니다. 자극된 영역에는 양측 전두엽 피질(bilateral frontal cortex), 양측 외측 두정엽 피질(bilateral lateral parietal cortex) 및 확장된 전두엽 피질(extended precuneus cortex)이 포함되었습니다. 양측 측두엽 피질(bilateral temporal cortex)이 프로토콜에 추가되었습니다. 치료는 첫 번째 치료 주기로 2주 동안 6,000번의 펄스로 6개의 초기 세션으로 투여되었습니다.
자극 중 치료 프로토콜에는 4Hz, 0.20mJ/mm2 및 6000 펄스가 포함되었습니다. 환자 11명 중 3명(27%)이 총 75회 세션 중 3회(4%)에서 부작용을 보고했다. 여기에는 턱 통증(NRS 4/10), 메스꺼움(NRS 7/10) 및 졸음(NRS 10/10)이 포함되었습니다. 그러나 이들 중 어느 것도 24시간 이상 지속되지 않았으며, 모든 것이 부작용(ADE)으로 자극에 직접적으로 기인할 수 있는 것은 아닙니다.
기준선과 비교한 자극 후 ADAS 총점에서는 30.2에서 25.8로 개선되었고(p=0.01), ADAS-Cog 점수에서는 25.8에서 23.3으로 개선되었으며(p=0.04; 그림 5). 일부 환자는 경미한 개선만 보였지만 환자 한 명에서 가장 좋은 개선은 40%였으며, 이는 ADAS 총점에서 15.76%, ADAS Cog 점수에서 8.65%의 전반적인 개선으로 이어졌습니다(그림 6). 또한, ADAS 테스트의 자가 보고 하위 척도에서 우울 증상의 유의미한 차이가 감지되었습니다. 외측 t-테스트는 ADAS 테스트의 자가 보고 하위 척도로 측정된 바와 같이 우울 증상이 유의하게 감소한 것으로 나타났습니다. 자극 전에는 평균이 0.7(SD=1.1)이었고, 자극 후에는 0.2(SD=0.4; t(8)=1.859, p< 0.01)로 감소했다.
주관적 평가 척도는 2주간의 치료 기간 전후에 완료되었습니다. 이 척도를 통해 환자는 자신의 증상 중증도와 인지된 부작용을 0에서 10까지의 숫자 평가 척도로 보고할 수 있으며, 숫자가 높을수록 증상 강도가 더 크다는 것을 나타냅니다. NRS로 측정한 증상 중증도의 평균 주관적 개선은 5.7에서 3.4(p=0.023)였다.
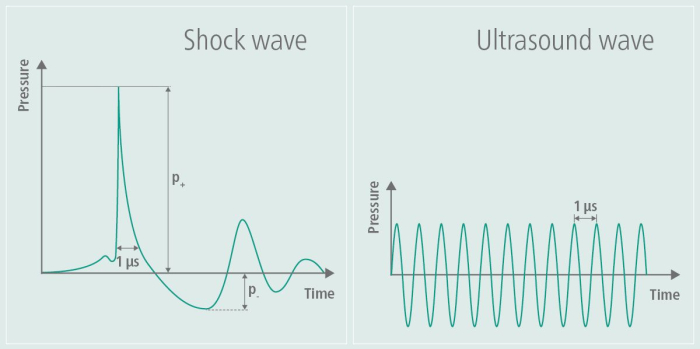
그림 1: 자극 중 충격파. 그래프는 이미지 왼쪽에 있는 TPS의 진폭을 보여주고 이미지 오른쪽에 있는 초음파의 진폭과 비교합니다. TPS 동안 단일 압력 펄스가 생성된 후 진폭이 평탄해집니다. 대조적으로, 초음파의 진폭은 다시 평평해지지 않고 유지되어 시간이 지남에 따라 연속적인 고주파 진동이 발생합니다. 이 수치는9에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: MRI 내비게이션 시스템. 이 이미지는 TPS 동안 환자와 NEUROLITH 사이의 이상적인 정렬을 보여줍니다. 3D 카메라는 고글의 감지 렌즈와 핸드피스의 감지 렌즈와 접촉합니다. 이 전송이 보장되는 경우에만 핸드피스가 올바른 공간 위치에서 인식되고 화면에서 자극의 시각화가 방해받지 않습니다. 이 수치는9에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 관심 영역과 자극 영역. 이 이미지는 관심 영역(ROI)과 환자의 MRI에서 자극된 조직의 모델링의 예를 보여줍니다. 색상은 전두엽(precuneus)의 각 영역과 전두엽(frontal and parietal) 영역에 적용되는 펄스의 수를 더욱 구별합니다. 녹색 색상 다음에는 청록색, 파란색 및 보라색이 있습니다. 보라색은 과도한 강도를 나타내므로 피해야 합니다. 자극된 영역은 주로 도달한 영역으로서 내비게이션 시스템의 시뮬레이션 데이터로 시각화되지만, 이는 실제로 적용된 뇌 활성화로 측정되지 않습니다. 추가적인 시간적 자극은 ROI로 사전 정의되어 있지는 않지만 Kempen 프로토콜에 추가됩니다. 왼쪽: 축 방향도, 가운데: 시상면도, 오른쪽: 관상도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 휴대용 장치. 이 그림은 자극 중에 사용되는 휴대용 장치를 보여줍니다. 중요한 준비 단계에는 최적의 에너지 전달을 보장하기 위해 환자의 두피에 충분한 양의 초음파 젤을 바르고 미리 채워진 멤브레인이 안전하고 올바르게 부착되었는지 확인하는 것이 포함됩니다. 치료 중에는 핸드피스를 두피에 수직으로 잡고 표면을 가로질러 고르게 움직여 일관된 자극을 유지합니다. 이 수치는9에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
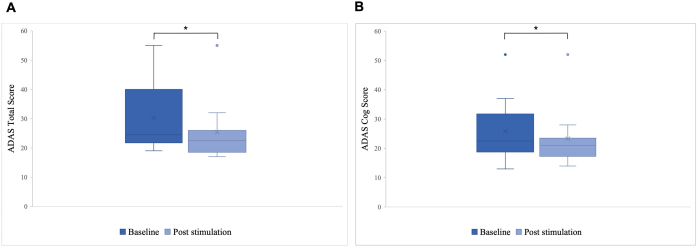
그림 5: 첫 번째 자극 전 알츠하이머병 평가 척도(ADAS). 첫 번째 자극 전(진한 파란색)과 마지막 자극 후(연한 파란색)에 대한 알츠하이머병 평가 척도(ADAS)의 환자 그룹 점수의 평균입니다. 점수가 낮을수록 성능이 우수함을 나타냅니다. 상자 그림은 환자 데이터의 분포를 보여줍니다. (A) ADAS 총점. 선은 그룹의 중앙값(기준선 = 24.5, 자극 후 = 22.5)을 나타내고 십자가는 평균 점수(M 기준선 = 30.2(SD 11.55), M 자극 후 = 25.8(SD 10.71), *p = 0.01)을 나타냅니다. (B) ADAS 톱니바퀴 점수. 선은 그룹의 중앙값(기준선 = 22.5, 자극 후 = 21)을 나타내고 십자가는 평균 점수(M 기준선 = 25.8 (SD 10.77), M 자극 후 = 23.3 (SD 10.27), *p = 0.04)을 나타냅니다. 이 수치는5에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: ADAS에 투입된 환자의 개별 검사 결과. 첫 번째 자극(기준선) 전(기준선)과 마지막 자극(자극 후) 후(자극 후)에 대한 알츠하이머병 평가 척도(ADAS)의 환자에 대한 개별 검사 결과. 점수가 낮을수록 성능이 우수함을 나타냅니다. 각 선은 한 명의 환자를 나타냅니다. (A) ADAS 총점에 있는 각 환자의 개별 점수. 가장 좋은 개선은 15점(ID 3)이었습니다. (B) 하위 척도 ADAS 톱니바퀴 점수에 있는 각 환자의 개별 점수. 가장 좋은 개선은 14점(ID 3 및 ID 4)이었습니다. 이 수치는5에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
전반적으로 TPS는 알츠하이머병에 대한 가능한 치료법입니다. 실용적인 관점에서 자극 프로세스는 작업자가 사용자 친화적으로 설계되었습니다. 시술 시작 시 관심 영역을 정의할 수 있는 기능과 치료 중 색상으로 구분된 표시를 통해 적용된 펄스 수를 시각화할 수 있어 사용자 인터페이스 처리가 크게 간소화됩니다. 관심 영역의 설정도 자유롭게 선택하고 필요에 따라 조정할 수 있습니다. 자극된 영역은 시뮬레이션된 데이터로 명확하게 시각화되지만, 더 낮은 에너지 수준에서 장치의 영향을 받는 더 깊은 영역을 표시하려면 제조업체의 추가 개발이 필요합니다.
TPS 프로토콜의 중요한 단계에는 표적 뇌 부위에 자극 장치를 정밀하게 배치하고, 맥파의 정확한 강도와 주파수를 보장하고, 환자 반응을 주의 깊게 모니터링하는 것이 포함됩니다. 문제 해결에는 에너지 손실이나 최적이 아닌 자극을 방지하기 위해 핸드피스와 두피 사이의 최적 접촉을 확인하는 것이 포함될 수 있습니다. 불편함이나 부작용이 관찰되면 강도를 조정하거나 위치를 변경해야 할 수 있습니다.
발표된 통제되지 않은 데이터는 임상적인지 개선5,3뿐만 아니라 여러 뇌 영역의 피질 두께 증가 10 및 MR-네트워크 연결성의 변화11을 입증했습니다. 기분의 개선도 보고되었다 5,4. 다른 비침습적 뇌 자극 방법과 비교하여 TPS는 몇 가지 뚜렷한 이점을 제공합니다. 첫째, 기계적 충격파와 정밀한 신경 항법을 결합하여 영향을 받는 뇌 영역에 표적 적용을 가능하게 합니다. 일반적으로 표재성 피질층만 자극하는 TMS와 달리, TPS는 침투 깊이가 있어 더 깊은 뇌 구조가 관여하는 알츠하이머병과 같은 신경퇴행성 질환을 치료하는 데 특히 적합합니다. 또한, TPS는 치료 세션의 4%에서만 최소 및 일시적 부작용이 보고되는 등 양호한 안전성 프로파일을 가지고 있는 것으로 보이며, 이는 중등도에서 중증의 AD5 환자에게 더 견딜 수 있는 옵션일 수 있음을 나타냅니다.
TPS 요법과 관련된 잠재적 위험 요인에 대한 자세한 분석을 수행하고 작용 기전을 철저히 조사하기 위해서는 추가적인 기초 연구가 필요합니다.
이 연구 그룹에서 발표한 최근 연구에서는 알츠하이머 환자의 뇌 네트워크 활동을 경두개 펄스 자극(TPS) 전후와 후로 조사했습니다17. 결과는 TPS가 뇌 진동과 연결성을 조절하여 알츠하이머병의 인지 기능을 잠재적으로 향상시킬 수 있음을 나타냅니다. 제안된 메커니즘 중 하나는 TPS 후 증가된 감마 진동이 뇌의 글림프 청소를 촉진할 수 있다는 것입니다. 글림프 제거율에 대한 이러한 가능한 영향은 향후 연구에서 추가로 조사되어야 합니다. 또한, TPS가 뇌 네트워크 생리학에 어떤 영향을 미치는지, 그리고 TPS의 신경 보호 효과가 알츠하이머병의 진행을 늦추거나 멈출 수 있는지 여부를 명확히 하기 위해 추가적인 기계론적 연구가 필요합니다.
TPS가 건강한 뇌와 병든 뇌 모두에 미치는 영향을 조사하는 전임상 동물 연구는 기본 메커니즘을 더 깊이 이해하는 데 매우 중요합니다. 다양한 NiBS 기술이 별개의 메커니즘을 통해 작동한다는 점에 유의하는 것이 중요합니다1. 그러므로, 초음파 요법18 과 충격파 요법6 이 조직에 미치는 영향이 TPS 요법에서 어떤 역할을 하는지, 그리고 어떻게 작용하는지 조사하는 것이 필수적이다. 전자는 TPS가 메카노트랜스duction 과정에 미칠 수 있는 영향과 혈관, 세포 및 분자 변화를 유도할 수 있는 잠재력에 대해 설명했으며, 이를 철저히 조사해야 합니다. 또한, 혈액-뇌 장벽 역학에 특히 중점을 둔 신경 염증 과정의 조절은 향후 연구를 위한 흥미로운 영역을 제시합니다. 이러한 효과를 이해하면 기본 메커니즘에 대한 귀중한 통찰력을 얻을 수 있으며 치료 응용 분야를 위해 TPS를 최적화하는 데 도움이 될 수 있습니다. 또한, 이는 다른 신경퇴행성 질환 관리에 TPS 치료의 잠재적 적용을 탐구하는 데 기여합니다.
TPS는 치료적 접근 방식으로서 가능성을 보여줍니다. 그러나 몇 가지 제한 사항을 해결해야 합니다. 위약군을 사용한 대조군 임상시험은 TPS의 구체적인 효과를 정확하게 규명하는 데 필수적입니다. 중요한 문제는 자극에 대한 반응에서 개인간 변동성이 높다는 것인데, 이는 알츠하이머병(Alzheimer's disease, AD)의 병기 및 동반 질환의 존재와 같은 요인의 영향을 받을 수 있다4. 또한 장기 치료를 위한 최적의 프로토콜은 아직 정의되지 않았습니다. 현재의 접근법에는 한 달에 한 번 부스터 샷을 투여하거나 1년 내에 12회의 치료 주기를 반복하는 것이 포함되지만, 한 가지 접근법이 다른 접근법보다 우월하다는 것을 뒷받침하는 증거는 부족합니다. 향후 임상 연구는 최적의 자극 매개변수를 식별하고, 환자별 요인(예: 알츠하이머병 병기)이 치료 결과에 미치는 영향을 평가하고, TPS 요법의 장기적 효과와 지속 가능성을 조사하는 데 우선순위를 두어야 합니다.
공개
저자 Lars Wojtecki는 이전에 독일 연구 재단, Hilde-Ulrichs-Stiftung für Parkinsonforschung, ParkinsonFonds Germany, BMBF/ERA-NETNEURON, DFG Forschergruppe(FOR1328), Deutsche Parkinson Vereinigung(DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB; 메드트로닉, UCB, 테바, 엘러간, 메르츠, 애브비, 로슈, 비알, 머크, 노바티스, 데시틴, 스펙트럼. 저자 Lars Wojtecki는 BioNTech SE의 주식을 소유하고 있습니다. 저자 Lars Wojtecki는 TEVA, UCB Schwarz, Desitin, Medtronic, Abbott/Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed 및 Vertanical의 컨설턴트입니다. 저자 셀린 콘트(Celine Cont)는 스토츠 메디컬(Storz Medical)의 컨설턴트입니다. 나머지 저자는 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 연구가 수행되었다고 선언합니다.
감사의 말
환자분들의 순응과 참여에 감사드립니다. 기술 지원 및 데이터 수집은 Veronika Hirsch와 Michaela Wessler(의료 기술 보조)의 도움으로 이루어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
참고문헌
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유