Method Article
Técnicas para amostragem rápida de seis órgãos cruciais em Xenopus adultos
Neste Artigo
Resumo
Este artigo apresenta um guia para amostragem de seis órgãos significativos e diversos em Xenopus adultos que podem ser acessados de forma rápida e fácil: o ventrículo cardíaco, o lobo do fígado, o pâncreas, os corpos adiposos, os rins pareados e a pele.
Resumo
Xenopus tem sido um poderoso organismo modelo para entender o desenvolvimento e a doença dos vertebrados por mais de cem anos. Embora as técnicas de análise experimental e dissecação do embrião tenham sido bem documentadas, as descrições das estruturas e órgãos adultos de Xenopus , juntamente com as técnicas para trabalhar com adultos, não foram atualizadas para levar em consideração os requisitos de abordagens modernas como proteômica quantitativa e transcriptômica de célula única. As perspectivas centradas no tipo celular e no gene requerem observações contrastantes em estágios embrionários com as dos tecidos adultos. Os órgãos da larva sofrem mudanças significativas em sua estrutura geral, morfologia e localização anatômica ao longo da transição larval para adulta, principalmente durante a remodelação maciça da metamorfose. O estabelecimento de padrões robustos para identificação e dissecção de órgãos é crucial para garantir que os conjuntos de dados resultantes de estudos realizados em diferentes laboratórios possam ser consistentes. O presente protocolo identifica seis dos órgãos do Xenopus adulto, demonstrando métodos para dissecção e amostragem do ventrículo cardíaco, fígado, corpo adiposo, pâncreas, rim pareado e pele do Xenopus adulto. Dependendo dos métodos de preservação, os órgãos dissecados podem ser usados para proteômica quantitativa, transcriptômica de célula única/núcleo, hibridização in situ , imuno-histoquímica, histologia, etc. Este protocolo visa padronizar a amostragem de tecidos e facilitar as investigações multilaboratoriais dos sistemas de órgãos adultos.
Introdução
Embora a "dissecação digital" de Xenopus adulto esteja disponível1, a amostragem replicável de órgãos e tecidos de Xenopus adulto permanece um desafio sem as instruções detalhadas disponíveis para outros modelos adultos (por exemplo, camundongos 2,3,4). Este artigo tem como objetivo fornecer orientações claras para amostragem precisa e replicável de órgãos de Xenopus adultos, semelhante ao que está atualmente disponível para suas larvas5. A ênfase é colocada na facilidade de conclusão para manter o máximo de frescor e tornar o protocolo acessível a todos os usuários.
Embora exista um guia de dissecação completo para Rana sp.6, bem como vários guias de dissecação em sala de aula para outros anuros7, nenhum guia de dissecação e amostragem de Xenopus está disponível atualmente. Para aqueles que não estão familiarizados com as práticas de amostragem ou anatomia dos anfíbios, as pequenas diferenças entre Xenopus e outros anuros tornam esses recursos abaixo do ideal para amostragem de tecido replicável.
Muitos tecidos valiosos não estão incluídos e são até descartados no presente guia; Isso é para garantir o frescor do tecido. Seis amostras são limitadas o suficiente para garantir que esses tecidos possam ser coletados em menos de uma hora após o coração começar a bater, independentemente da experiência ou nível de habilidade do usuário. Guias mais avançados e detalhados para coletar muitos outros tecidos estão sendo preparados como artigos complementares separados.
Para usuários menos experientes, é sempre recomendável que este protocolo seja tentado primeiro em animais que estão sendo sacrificados por outros motivos que não a experimentação antes de amostrar quaisquer animais que sejam difíceis de substituir (ou seja, transgênicos, animais de idade avançada, etc.). Idealmente, todos os animais amostrados serão saudáveis e, se fêmeas, não terão ovulado nas últimas duas semanas.
Protocolo
Todos os experimentos foram realizados de acordo com as normas e regulamentos do IACUC (Comitê Institucional de Cuidados e Uso de Animais) da Harvard Medical School (IS 00001365_3). Os resultados representativos são mostrados para um macho albino maduro perfundido e não perfundido Xenopus laevis.
1. Preparação experimental
NOTA: Se o protocolo de perfusão8 estiver sendo seguido antes da amostragem, pule para a etapa 2.2.
- Certifique-se de que a instituição de pesquisa aprovou a técnica de eutanásia descrita neste protocolo.
- Preparar uma solução de 5 g/L de MS-222 (metanossulfonato de tricaína) e 5 g/L de bicarbonato de sódio (ver Tabela de Materiais). O volume deve ser superior ao volume necessário para cobrir completamente os animais sujeitos à eutanásia. Verifique o pH para garantir que esteja ≥7.
- Realizar a eutanásia primária colocando o Xenopus na solução de eutanásia; O animal permanecerá submerso por um total de 1 h.
- Configure a estação de dissecação para que, imediatamente após a amostragem, todos os tecidos possam ser enxaguados em PBS resfriado ou PBS9 0,7x (dependendo das necessidades experimentais), verificados e aparados sob uma luz de ampliação de 5x (ou mais). Esta estação também deve permitir que o usuário substitua todas as pinças e tesouras ou limpe-as entre os usos.
- Uma vez que a rã esteja na solução por 1 h, a eutanásia primária foi concluída. Remova o sapo e verifique a perda de resposta à dor realizando uma pitada no pé.
- Registre os detalhes apropriados para o animal, como espécie, cepa, sexo, idade e estado de saúde, bem como se ele foi perfundido. Pese o Xenopus e faça medições adicionais, como o comprimento do focinho-respiradouro.
- Coloque o sapo de costas e prenda os membros proximais ao corpo (Figura 1).
- Usando uma tesoura de dissecção, corte a pele, suba pela linha média e depois lateralmente, fazendo dois retalhos.
- Consultando a Figura 2, identifique a linha alba e use uma pinça para agarrá-la e puxá-la para longe da cavidade celômica. Corte a musculatura cuidadosamente usando uma tesoura. Faça duas abas fora da parede da cavidade. Corte ou prenda todas as abas fora do caminho.
- Identifique o coração que ainda estará batendo. Use uma tesoura de dissecação para reduzir os ossos coracóides (Figura 2) para obter melhor acesso ao coração.
NOTA: Se o coração parou de bater antes da amostragem, deve-se observar que o frescor da amostra foi comprometido.
2. Amostragem
NOTA: Se o animal foi perfundido, pule para a etapa 2.2.
- Identifique o pericárdio fino e puxe-o com uma pinça de tecido (Figura 3).
- Usando a ponta da tesoura de iridectomia, perfure suavemente o pericárdio, tomando cuidado para não cortar os tecidos subjacentes. Descasque o pericárdio para longe das 3 câmaras do coração.
- Use uma pinça para agarrar o ventrículo pelo ápice, identificar onde ele se liga às aurículas e ao tronco arterial (Figura 4) e cortá-lo abaixo dessas inserções (Figura 5). Se necessário, apare o ventrículo para que nenhum tecido das aurículas ou do tronco arterial fique visível, e o tecido da válvula de cor clara ainda seja visível dentro do ventrículo.
NOTA: Em animais não perfundidos, a remoção do ventrículo pode ser qualificada como eutanásia secundária. - Os 3 lobos do fígado serão visíveis (Figura 6 e Figura 7). Segure a borda do lobo esquerdo (à direita do espectador) e levante-a suavemente para que os ductos hepáticos e císticos fiquem visíveis (Figura 8). Faça uma amostra do 1/3 inferior do lóbulo abaixo desses acessórios (Figura 9).
- Para obter melhor acesso aos tecidos de uma rã, é útil remover o ovário. Identifique o ovário que está envolto em uma camada de peritônio visceral chamada epitélio germinativo. Desloque suavemente os lóbulos até que estejam em seus respectivos lados para tornar a área de fixação visível (Figura 10). Esses anexos são diretamente ventrais ao rim emparelhado.
- Usando uma tesoura, remova os ovários o mais próximo possível dos rins sem danificá-los (Figura 11).
- Inspecione o lobo medial (também chamado de lobo anterior) do fígado e observe como ele se conecta ao estômago e ao duodeno através do mesentério e do ducto hepatopancreático (também chamado de ducto colédoco comum) (Figura 6, Figura 7 e Figura 8).
- Corte o mesentério, o ligamento hepatoduodenal usando uma tesoura de iridectomia, bem como o ducto hepatopancreático onde ele encontra o duodeno. Corte a conexão do pâncreas e do ducto hepatopancreático ao lobo medial do fígado para que nenhum tecido hepático escuro fique preso (Figura 12).
- Segure o estômago com uma pinça dentada e a extremidade superior do pâncreas com uma pinça de tecido. Sob ampliação de 5x, retire suavemente o pâncreas do estômago (Figura 13).
NOTA: Se não sair limpo, o tecido pancreático restante ficará visível e poderá ser retirado em fragmentos. Alternativamente, o pâncreas pode ser metodicamente descolamento usando tesouras de iridectomia e pinças de tecido. - Consultando a Figura 14A, identifique a bexiga urinária e remova-a, cortando o mais próximo possível da cloaca. Descarte este lenço.
- Consultando a Figura 14B, identifique o intestino grosso e puxe-o para cortar o intestino grosso o mais próximo possível da cloaca. Remova e descarte todo o canal alimentar, cortando o peritônio onde ele se liga ao baço. Os corpos gordos agora estarão totalmente acessíveis.
- Separe os corpos gordurosos para que fiquem de lado. A área sobre o rim, onde o corpo gorduroso se conecta ao peritônio, será visível. Segure a base do corpo gorduroso esquerdo (à direita do espectador) e use uma tesoura para cortá-lo do peritônio, deixando uma pequena margem para que o rim não seja danificado (Figura 15).
- Remova e descarte o corpo gordo restante. Os rins emparelhados agora estarão totalmente visíveis.
- Em rãs fêmeas ou machos com ovidutos vestigiais distintos, segure um oviduto e puxe-o para longe do rim e da cloaca (Figura 16). Corte o oviduto onde ele encontra a cloaca e continue a puxá-lo para longe do rim, cortando quaisquer anexos peritoneais claros à medida que se tornam aparentes. Descarte este lenço.
- Repita este processo com o oviduto restante.
- Os rins ainda estão cobertos por peritônio claro (retroperitoneal)10. Use uma pinça para agarrar os rins e cortar o peritônio em sua extremidade inferior.
- Levante os rins para fora da cavidade celômica, usando uma tesoura para cortar o peritônio o mais próximo possível dos rins sem danificá-los (Figura 17).
- Sob ampliação de 5x, corte o excesso de peritônio e qualquer outro tecido remanescente (corpos de gordura, baço). Se o sapo for fêmea, certifique-se de que qualquer tecido ovariano restante seja removido (Figura 18). Se o sapo for macho, remova cuidadosamente o testículo e verifique se há um oviduto vestigial, que pode não ser visível sem ampliação (Figura 19).
- Remova os pinos do animal, vire-o em seu ventrum e prenda novamente os membros do animal.
- Selecione o membro posterior para amostrar e fixe o pé desse membro.
- Remova uma aba de pele em forma de amêndoa sobre o gastrocnêmio / tibiofíbula (Figura 20).
Resultados
Utilizando a Figura 1 à Figura 20 e seguindo todas as etapas deste protocolo, o ventrículo cardíaco, o lobo esquerdo do fígado, o pâncreas, os corpos adiposos esquerdos, rins pareados e um retalho de pele foram excisados de forma limpa dentro de uma hora após a eutanásia. Dentro desse tempo, as amostras são enxaguadas e aparadas para que apareçam, conforme mostrado na Figura 21.
Figura 1: Xenopus fixado. Uma fêmea madura X. tropicalis presa em cada membro. Clique aqui para ver uma versão maior desta figura.
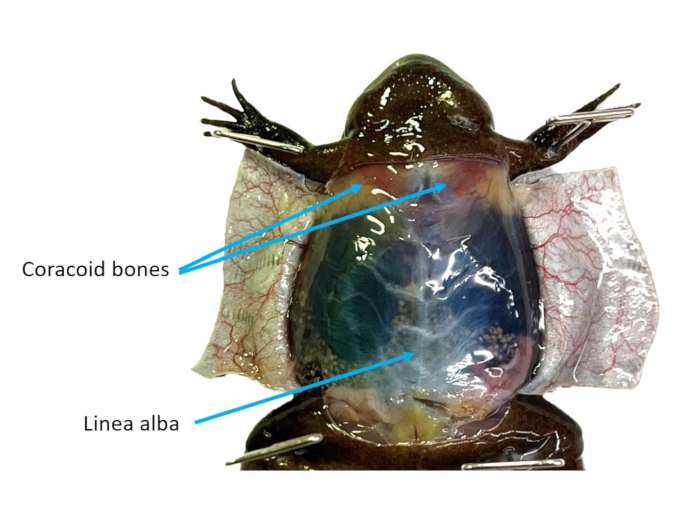
Figura 2: Parede abdominal. A pele ventral de uma fêmea de X. tropicalis é cortada em retalhos, tornando visíveis os ossos da linha alba e do coracoide. Clique aqui para ver uma versão maior desta figura.
Figura 3: Coração fechado pelo pericárdio. O ápice do ventrículo cardíaco é agarrado através do pericárdio. Clique aqui para ver uma versão maior desta figura.
Figura 4: Ventrículo cardíaco e tronco arterial. O ventrículo de um X laevis perfundido, sendo agarrado, mostrando sua ligação ao tronco arterial. Clique aqui para ver uma versão maior desta figura.
Figura 5: Diagrama do coração. Um diagrama das estruturas relevantes do coração com uma linha tracejada indicando onde amostrar o ventrículo. Clique aqui para ver uma versão maior desta figura.
Figura 6: Diagrama hepatopancreático. Um diagrama dos 3 lobos do fígado, pâncreas e órgãos associados. Clique aqui para ver uma versão maior desta figura.
Figura 7: Órgãos hepatopancreáticos. Um macho albino X . laevis perfundido com 3 lobos de fígado, pâncreas e órgãos associados marcados. Clique aqui para ver uma versão maior desta figura.
Figura 8: Ductos císticos e hepáticos. O lobo esquerdo do fígado está sendo levantado para mostrar os ductos císticos e hepáticos em X. laevis perfundidos. Clique aqui para ver uma versão maior desta figura.
Figura 9: Amostragem hepática. O lobo esquerdo do fígado de um X. tropicalis não perfundido é cortado sob as inserções dos ductos hepáticos. Clique aqui para ver uma versão maior desta figura.
Figura 10: Fixação do ovário. Com os lobos dos ovários em seus respectivos lados, a continuidade do epitélio germinativo até a parede peritoneal (sobre os rins) é visível. Duas linhas tracejadas brancas indicam onde cortar esses anexos. Clique aqui para ver uma versão maior desta figura.
Figura 11: Remoção do ovário. O ovário de um X. laevis não perfundido é afastado dos rins emparelhados. Clique aqui para ver uma versão maior desta figura.
Figura 12: Incisões de mesentério. A cavidade celômica de um X. laevis não perfundido, após a amostragem do ventrículo cardíaco e do lobo esquerdo do fígado, bem como a remoção do ovário. Uma linha tracejada branca indica onde cortar o ligamento e o ducto hepatopancreático, enquanto uma linha tracejada verde indica onde separar o pâncreas do lobo medial do fígado. Clique aqui para ver uma versão maior desta figura.

Figura 13: Amostragem do pâncreas. O pâncreas de um X. laevis não perfundido está sendo arrancado do estômago. Clique aqui para ver uma versão maior desta figura.
Figura 14: Remoção de órgãos. (A) A bexiga urinária de um X. laevis não perfundido é puxada para longe da cloaca com uma linha tracejada indicando onde cortá-la. (B) O intestino grosso de um X. laevis não perfundido está sendo afastado da cloaca com uma linha tracejada indicando onde cortá-lo. Clique aqui para ver uma versão maior desta figura.
Figura 15: Amostragem de corpo gordo. Os corpos adiposos, ligados ao peritônio na extremidade superior dos rins pareados, são retirados da cavidade celômica com uma linha tracejada mostrando onde cortá-los. Observe que adjacente a esta fixação, este macho X. tropicalis tem 1 testículo, bem como um par de ovidutos vestigiais distintos. Clique aqui para ver uma versão maior desta figura.
Figura 16: Remoção do oviduto. O oviduto de um X. laevis perfundido é puxado para longe do rim emparelhado, tornando o peritônio claro visível. Uma linha tracejada indica onde incisar o peritônio. Clique aqui para ver uma versão maior desta figura.
Figura 17: Amostragem renal. Os rins emparelhados de um X. laevis não perfundido estão sendo retirados da cavidade celômica. Clique aqui para ver uma versão maior desta figura.
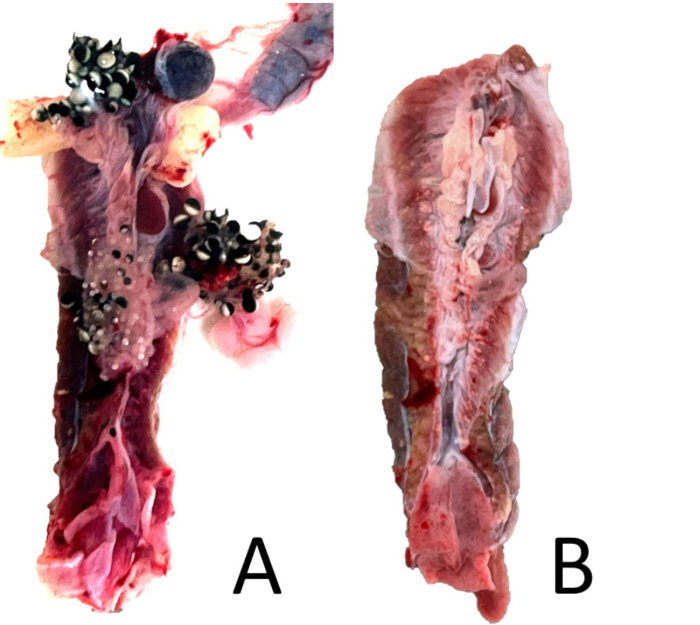
Figura 18: Corte renal. (A) Uma visão ventral do rim emparelhado de uma fêmea não perfundida de X. laevis com órgãos peritoneais associados anexados. (B) O mesmo rim com órgãos associados removidos, mas com algum tecido peritoneal remanescente. Clique aqui para ver uma versão maior desta figura.
Figura 19: Remoção do testículo. Os rins pareados de X. tropicalis não perfundidos com um testículo removido. Clique aqui para ver uma versão maior desta figura.
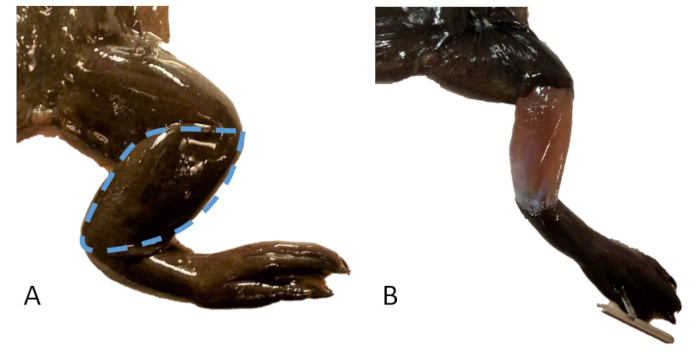
Figura 20: Amostragem de pele. (A) A perna direita de um X. tropicalis com uma linha tracejada indicando a área da pele a ser amostrada. (B) A perna direita de um X. tropicalis com uma amostra de pele removida sobre a tibiofíbula. Clique aqui para ver uma versão maior desta figura.

Figura 21: Resultados representativos da amostragem de órgãos. Amostras de ventrículo cardíaco, fígado, pâncreas, corpo gorduroso, rim pareado e pele retiradas de um albino X. laevis perfundido e não perfundido. Clique aqui para ver uma versão maior desta figura.
Discussão
Como este protocolo visa maximizar o frescor, algumas amostras podem incluir tecidos indesejados. Por exemplo, o ducto hepatopancreático e algum mesentério são amostrados com o pâncreas, e algum tecido peritoneal, glândulas supra-renais e ureteres sempre serão amostrados com os rins pareados. Se o frescor não for uma preocupação, uma amostragem mais precisa pode ser obtida usando técnicas modificadas.
A aparência e a localização dos órgãos são comparáveis entre os sexos e as espécies de Xenopus. No entanto, a cor dos tecidos varia significativamente com base no fato de os animais terem sido perfundidos ou não. É por esta razão que imagens de animais perfundidos e não perfundidos são incluídas.
Uma restrição deste protocolo é que a velocidade e a reprodutibilidade são priorizadas em relação à coleta de amostras que melhor representam a totalidade do tecido desejado. Por exemplo, a seção do lobo esquerdo do fígado amostrada aqui não pode representar adequadamente todos os três lobos do tecido hepático. Se houver erros na amostragem, as opções de solução de problemas são afetadas pelo potencial de variação entre diferentes seções de tecido. Por exemplo, não se sabe se o lobo direito do fígado, o corpo gorduroso direito ou uma porção diferente da pele seriam alternativas funcionais aos tecidos desejados. Nesses casos, deve-se usar de discrição, com base nas necessidades da pesquisa, antes de substituir cortes de tecido.
Outra limitação deste protocolo é que, se os animais amostrados apresentarem defeitos anatômicos drásticos ou problemas de saúde clinicamente significativos, os órgãos da cavidade celômica podem não aparecer como descrito aqui. Granulomas foram encontrados nos tecidos de rãs infectadas com Mycobacterium spp.11,12, e casos prévios de síndrome de hiperestimulação ovariana parecem levar a uma apresentação anormal dos órgãos13.
Embora este método tenha sido desenvolvido para Xenopus de laboratório, existem semelhanças significativas na aparência desses órgãos em muitos anfíbios não cecilianos e répteis com membros14. A parte de amostragem deste protocolo pode ser facilmente modificada para outros modelos, como axolotes ou anolis verdes.
Divulgações
Os autores declaram não haver interesses conflitantes.
Agradecimentos
Este trabalho foi apoiado pelo R24OD031956 de concessão OD do NIH. Agradecemos a Samantha Jalbert, Jill Ralston e Cora Anderson por sua assistência e apoio, bem como ao nosso editor e revisores anônimos por seus comentários úteis
Materiais
| Name | Company | Catalog Number | Comments |
| 5x Magnifying Glass with LED Light and Stand | amazon.com | B08QJ6J8P1 | light must not produce heat |
| Disposable Transfer Pipets | VWR | 414004-036 | |
| Dissecting Fine-Pointed Forceps | Fisher Scinetific | 08-875 | |
| Dissecting scissors sharp piont, straight 6.5" | VWR | 76457-374 | |
| Dissection Tray | Fisher Scinetific | 14-370-284 | styrofoam sheets are an acceptable alternative |
| Euthanasia container | US Plastic | Item 2860 | alternative opaque containers acceptable |
| Euthanasia container lid | US Plastic | Item 3047 | |
| Iridectomy Scissors 6" | vwr | 470018-938 | iris scissors are an acceptable alternative |
| MS-222: Syncaine (formerly tricaine) | Pentair AES | TRS1 | |
| PBS 1x | Corning | 21-040-CV | |
| Sodium Bicarbonate, Powder, USP | Fisher Scientific | 18-606-333 | |
| Specimen Forceps, Serrated | VWR | 82027-442 | |
| T-Pins for Dissecting | Fisher Scinetific | S99385 |
Referências
- Porro, L. B., Richards, C. T. Digital dissection of the model organism Xenopus laevis using contrast-enhanced computed tomography. J Anat. 231 (2), 169-191 (2017).
- Ruehl-Fehlert, C., et al. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55 (23), 91-106 (2003).
- Kittel, B., et al. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Morawietz, G., et al. Revised guides for organ sampling and trimming in rats and mice - Part 3 - A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Patmann, M. D., Shewade, L. H., Schneider, K. A., Buchholz, D. R. Xenopus tadpole tissue harvest. Cold Spring Harb Protoc. 2017 (11), 097675(2017).
- Lőw, P., Molnár, K., Kriska, G. Dissection of a Frog (Rana sp.). Atlas of Animal Anatomy and Histology. , 213-263 (2016).
- O'Rourke, D. P. Amphibians used in research and teaching. ILAR J. 48 (3), 183-187 (2007).
- Jonas-Closs, R. A., Peshkin, L. Effective rapid blood perfusion in Xenopus. JoVE. (issue), e65287(2023).
- Balls, M., Worley, R. S. Amphibian cells in vitro. II. Effects of variations in medium osmolarity on a permanent cells line isolated from Xenopus. Exp Cell Res. 76 (2), 333-336 (1973).
- Holz, P. H., Raidal, S. R. Comparative renal anatomy of exotic species. Vet North Am Exot Anim Pract. 9 (1), 1-11 (2006).
- Trott, K. A., et al. Characterization of a Mycobacterium ulcerans-like infection in a colony of African tropical clawed frogs (Xenopus tropicalis). Comp Med. 54 (3), 309-317 (2004).
- Fremont-Rahl, J. J., et al. Mycobacterium liflandii outbreak in a research colony of Xenopus (Silurana) tropicalis frogs. Vet Pathol. 48 (4), 856-867 (2011).
- Green, S. L., Parker, J., Davis, C., Bouley, D. M. Ovarian hyperstimulation syndrome in gonadotropin-treated laboratory South African clawed frogs (Xenopus laevis). J Am Assoc Lab Anim Sci. 46 (3), 64-67 (2007).
- Vitt, L. J., Caldwell, J. P. Anatomy of amphibians and reptiles. Herpetol. Herpetol. , 35-81 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados