Method Article
تقنيات لأخذ عينات سريعة من ستة أعضاء حاسمة في Xenopus البالغين
In This Article
Summary
تقدم هذه المقالة دليلا لأخذ عينات من ستة أعضاء مهمة ومتنوعة في Xenopus للبالغين يمكن الوصول إليها بسرعة وسهولة: بطين القلب وشحمة الكبد والبنكرياس والأجسام الدهنية والكلى المقترنة والجلد.
Abstract
كان Xenopus كائنا نموذجيا قويا لفهم تطور الفقاريات وأمراضها لأكثر من مائة عام. في حين تم توثيق التحليل التجريبي وتقنيات تشريح الجنين بشكل جيد ، لم يتم تحديث أوصاف هياكل وأعضاء Xenopus البالغة ، جنبا إلى جنب مع تقنيات العمل مع البالغين ، لمراعاة متطلبات الأساليب الحديثة مثل البروتينات الكمية والنسخ أحادي الخلية. تتطلب وجهات النظر من نوع الخلية والجينات ملاحظات متناقضة في المراحل الجنينية لتلك الموجودة في الأنسجة البالغة. تخضع أعضاء اليرقة لتغييرات كبيرة في هيكلها العام ، ومورفولوجيتها ، وموقعها التشريحي على طول انتقال اليرقات إلى البالغين ، وعلى الأخص أثناء إعادة تشكيل التحول الهائل. يعد وضع معايير قوية لتحديد الأعضاء وتشريحها أمرا بالغ الأهمية لضمان اتساق مجموعات البيانات الناتجة عن الدراسات التي أجريت في مختبرات مختلفة. يحدد البروتوكول الحالي ستة من الأعضاء في Xenopus البالغ ، مما يوضح طرق تشريح وأخذ عينات من بطين القلب والكبد والجسم الدهني والبنكرياس والكلى المزدوجة وجلد Xenopus البالغ. اعتمادا على طرق الحفظ ، يمكن استخدام الأعضاء المشرحة للبروتينات الكمية ، ونسخ الخلية المفردة / النوى ، والتهجين في الموقع ، والكيمياء الهيستولوجية المناعية ، والأنسجة ، إلخ. يهدف هذا البروتوكول إلى توحيد أخذ عينات الأنسجة وتسهيل التحقيقات متعددة المختبرات لأنظمة الأعضاء البالغة.
Introduction
على الرغم من أن "التشريح الرقمي" ل Xenopus البالغ " متاح1 ، إلا أن أخذ عينات الأعضاء والأنسجة القابلة للتكرار من Xenopus البالغ لا يزال يمثل تحديا بدون التعليمات التفصيلية المتاحة لنماذج البالغين الأخرى (مثل الفئران2،3،4). تهدف هذه المقالة إلى توفير إرشادات واضحة لأخذ عينات دقيقة وقابلة للتكرار من أعضاء Xenopus البالغة على غرار ما هو متاح حاليا ليرقاتها5. يتم التركيز على سهولة الإكمال للحفاظ على أقصى قدر من النضارة وجعل البروتوكول في متناول جميع المستخدمين.
على الرغم من وجود دليل تشريح شامل ل Rana sp.6 ، بالإضافة إلى العديد من أدلة تشريح الفصول الدراسية ل anurans7 الأخرى ، لا يتوفر حاليا دليل تشريح وأخذ عينات Xenopus. بالنسبة لأولئك الذين ليسوا على دراية بممارسات أخذ العينات أو تشريح البرمائيات ، فإن الاختلافات الصغيرة بين Xenopus و anurans الأخرى تجعل هذه الموارد دون المستوى الأمثل لأخذ عينات الأنسجة القابلة للتكرار.
لم يتم تضمين العديد من الأنسجة القيمة بل يتم التخلص منها في هذا الدليل ؛ هذا لضمان نضارة الأنسجة. ست عينات محدودة بما يكفي لضمان إمكانية جمع هذه الأنسجة في أقل من ساعة بعد أن يبدأ القلب في النبض ، بغض النظر عن خبرة أو مستوى مهارة المستخدم. ويجري إعداد أدلة أكثر تقدما وتفصيلا لجمع العديد من الأنسجة الأخرى كأوراق مصاحبة منفصلة.
بالنسبة للمستخدمين الأقل خبرة ، يوصى دائما بتجربة هذا البروتوكول أولا على التي يتم قتلها رحيما لأسباب أخرى غير التجريب قبل أخذ عينات من أي يصعب استبدالها (مثل الجينات المحورة ، في سن متقدمة ، وما إلى ذلك). من الناحية المثالية ، ستكون جميع التي تم أخذ عينات منها صحية ، وإذا كانت أنثى ، فلن تكون قد تم التبويض في الأسبوعين الماضيين.
Protocol
تم إجراء جميع التجارب وفقا لقواعد وأنظمة كلية الطب بجامعة هارفارد IACUC (اللجنة المؤسسية لرعاية واستخدام) (IS 00001365_3). تم عرض النتائج التمثيلية لكل من ذكر ألبينو ناضج غير مثقوب وغير مثقوب Xenopus laevis.
1. التحضير التجريبي
ملاحظة: إذا تم اتباع بروتوكول التروية8 قبل أخذ العينات، فانتقل إلى الخطوة 2.2.
- تأكد من أن المؤسسة البحثية قد وافقت على تقنية القتل الرحيم الموضحة في هذا البروتوكول.
- تحضير محلول 5 غ/لتر MS-222 (تريكايين ميثان سلفونات) و5 غ/لتر بيكربونات الصوديوم (انظر جدول المواد). يجب أن يكون الحجم أكبر من الحجم المطلوب لتغطية التي يتم قتلها رحيما بالكامل. تحقق من الرقم الهيدروجيني للتأكد من أنه ≥7.
- إجراء القتل الرحيم الأولي عن طريق وضع Xenopus في محلول القتل الرحيم ؛ سيبقى مغمورا لمدة 1 ساعة.
- قم بإعداد محطة التشريح بحيث يمكن شطف جميع الأنسجة بعد أخذ العينات مباشرة في برنامج تلفزيوني مبرد أو 0.7x PBS9 (حسب الاحتياجات التجريبية) ، وفحصها ، وتقليمها تحت ضوء تكبير 5x (أو أكبر). يجب أن تمكن هذه المحطة المستخدم أيضا من استبدال جميع الملقط والمقص أو مسحها نظيفة بين الاستخدامات.
- بمجرد أن يكون الضفدع في المحلول لمدة 1 ساعة ، يكون القتل الرحيم الأولي قد اكتمل. قم بإزالة الضفدع وتحقق من فقدان استجابة الألم عن طريق إجراء قرصة القدم.
- سجل التفاصيل المناسبة للحيوان ، مثل الأنواع والسلالة والجنس والعمر والحالة الصحية وكذلك ما إذا كان معطرا. قم بوزن Xenopus وأخذ أي قياسات إضافية ، مثل طول فتحة الخطم.
- ضع الضفدع على ظهره وثبت الأطراف القريبة من الجسم (الشكل 1).
- باستخدام مقص التشريح ، قم بقطع الجلد ، حتى خط الوسط ، ثم بشكل جانبي ، مما يجعل اثنين من اللوحات.
- بالرجوع إلى الشكل 2 ، حدد الخط العريض واستخدم الملقط للإمساك به وسحبه بعيدا عن التجويف القولوني. قطع من خلال العضلات بعناية باستخدام مقص. اصنع اثنين من اللوحات من جدار التجويف. قص أو دبوس جميع اللوحات بعيدا عن الطريق.
- حدد القلب الذي سيظل ينبض. استخدم مقص التشريح لتقليل العظام الغرابية (الشكل 2) للوصول بشكل أفضل إلى القلب.
ملاحظة: إذا توقف القلب عن النبض قبل أخذ العينات ، تجدر الإشارة إلى أن نضارة العينة قد تعرضت للخطر.
2. أخذ العينات
ملاحظة: إذا تم ترشيح ، فانتقل إلى الخطوة 2.2.
- حدد التامور الرقيق واسحبه مشدودا بملقط الأنسجة (الشكل 3).
- باستخدام طرف مقص استئصال القزحية ، قم بثقب التامور برفق ، مع الحرص على عدم قطع الأنسجة الكامنة. قشر التامور بعيدا عن 3 غرف من القلب.
- استخدم الملقط للإمساك بالبطين من القمة ، وحدد مكان ارتباطه بالأذن والجذع الشرياني (الشكل 4) ، وقم بقصه أسفل هذه المرفقات (الشكل 5). إذا لزم الأمر ، قم بقص البطين بحيث لا تكون الأنسجة من الأذن أو الجذع الشرياني مرئية ، وسيظل نسيج الصمام ذو اللون الفاتح مرئيا داخل البطين.
ملاحظة: في غير المفعمة بالحيوية ، قد تكون إزالة البطين بمثابة قتل رحيم ثانوي. - ستكون 3 فصوص من الكبد مرئية (الشكل 6 والشكل 7). أمسك شفة الفص الأيسر (على يمين المشاهد) وارفعها برفق بحيث تكون القنوات الكبدية والكيسية مرئية (الشكل 8). عينة من الجزء السفلي 1/3 من الفص أسفل هذه المرفقات (الشكل 9).
- للوصول بشكل أفضل إلى أنسجة أنثى الضفدع ، من المفيد إزالة المبيض. حدد المبيض المغلف بطبقة من الصفاق الحشوي تسمى الظهارة الجرثومية. حرك الفصوص برفق حتى تصبح على جانبي كل منها لجعل منطقة التعلق مرئية (الشكل 10). هذه المرفقات بطنية مباشرة للكلية المقترنة.
- باستخدام المقص ، قم بإزالة المبايض بالقرب من الكلى قدر الإمكان دون إتلافها (الشكل 11).
- افحص الفص الإنسي (ويسمى أيضا الفص الأمامي) للكبد ولاحظ كيفية اتصاله بالمعدة والاثني عشر من خلال المساريق والقناة الكبدية (وتسمى أيضا القناة الصفراوية المشتركة) (الشكل 6 والشكل 7 والشكل 8).
- قطع الرباط المساريقي والكبد الاثني عشر باستخدام مقص استئصال القزحية وكذلك القناة الكبدية حيث تلتقي بالاثني عشر. قطع اتصال البنكرياس والقناة الكبدية بالفص الإنسي للكبد بحيث لا يتم ربط أنسجة الكبد الداكنة (الشكل 12).
- أمسك المعدة بالملقط المسنن والطرف العلوي للبنكرياس بملقط الأنسجة. تحت تكبير 5x ، ندف البنكرياس برفق من المعدة (الشكل 13).
ملاحظة: إذا لم يتم التخلص منه بشكل نظيف ، فستكون أنسجة البنكرياس المتبقية مرئية ويمكن التقاطها في شظايا. بدلا من ذلك ، يمكن فصل البنكرياس بشكل منهجي باستخدام مقص استئصال القزحية وملقط الأنسجة. - بالإشارة إلى الشكل 14 أ ، حدد المثانة البولية وقم بإزالتها ، مع قطعها بالقرب من العباءة قدر الإمكان. تخلص من هذا المنديل.
- بالرجوع إلى الشكل 14 ب، حدد الأمعاء الغليظة واسحبها مشدودة لقطع الأمعاء الغليظة بالقرب من العباءة قدر الإمكان. إزالة وتجاهل القناة الهضمية بأكملها ، وقطع الصفاق حيث تعلق على الطحال. سيتم الآن الوصول إلى الأجسام الدهنية بالكامل.
- ندف بعيدا عن الأجسام الدهنية بحيث تكون على جانبيها. ستكون المنطقة فوق الكلى ، حيث يتصل الجسم الدهني بالصفاق ، مرئية. أمسك قاعدة الجسم الدهني الأيسر (على يمين المشاهد) واستخدم المقص لقطعه بعيدا عن الصفاق ، تاركا هامشا صغيرا حتى لا تتلف الكلى (الشكل 15).
- إزالة وتجاهل الجسم الدهني المتبقي. ستكون الكلى المقترنة مرئية بالكامل الآن.
- في إناث الضفادع أو الذكور ذات قنوات البيض الأثرية المميزة ، أمسك قناة البيض واسحبها بعيدا عن الكلى والعباءة (الشكل 16). قطع قناة البيض حيث تلتقي بالعباءة واستمر في سحبها بعيدا عن الكلى ، وقطع أي مرفقات بريتونية واضحة عندما تصبح واضحة. تخلص من هذا المنديل.
- كرر هذه العملية مع قناة البيض المتبقية.
- لا تزال الكلى مغطاة بالصفاق الصافي (خلف الصفاق)10. استخدم الملقط لفهم الكلى وقطع الصفاق في نهايتها السفلية.
- ارفع الكلى من التجويف القولوني ، باستخدام مقص لقطع الصفاق بالقرب من الكلى قدر الإمكان دون إتلافها (الشكل 17).
- تحت التكبير 5x ، قم بقطع الصفاق الزائد وأي أنسجة أخرى متبقية (الأجسام الدهنية والطحال). إذا كان الضفدع أنثى ، فتأكد من إزالة أي نسيج مبيض متبقي (الشكل 18). إذا كان الضفدع ذكرا ، فقم بإزالة الخصية بعناية وتحقق من وجود قناة بيض أثرية ، والتي قد لا تكون مرئية بدون تكبير (الشكل 19).
- قم بإزالة الدبابيس من ، واقلبها على بطنه ، وأعد تثبيت أطراف.
- حدد أيا من الطرفين الخلفيين لأخذ عينة منه وقم بتثبيت قدم هذا الطرف.
- قم بإزالة رفرف جلدي على شكل لوز من فوق الساق / الشظية الظنبوبية (الشكل 20).
النتائج
من خلال استخدام الشكل 1 إلى الشكل 20 واتباع جميع خطوات هذا البروتوكول ، تم استئصال البطين القلبي والفص الأيسر من الكبد والبنكرياس والأجسام الدهنية اليسرى والكلى المقترنة وسديلة من الجلد بشكل نظيف في غضون ساعة من القتل الرحيم. خلال هذا الوقت ، يتم شطف العينات وتقليمها بحيث تظهر ، كما هو موضح في الشكل 21.
الشكل 1: زينوبوس مثبت. أنثى ناضجة X. tropicalis مثبتة من خلال كل طرف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
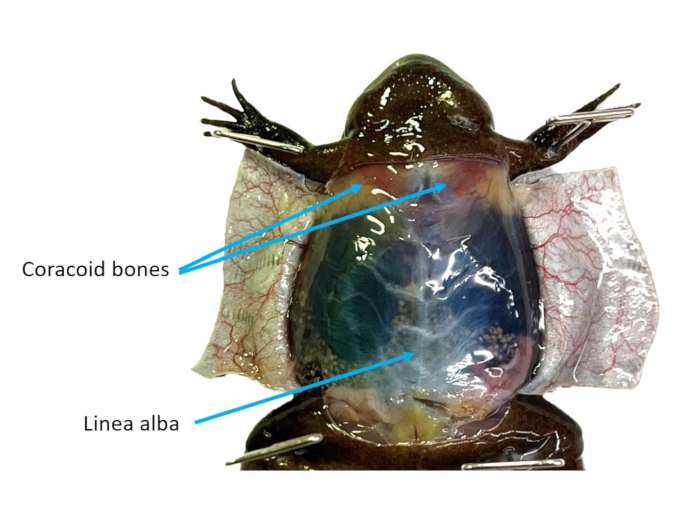
الشكل 2: جدار البطن. يتم قطع الجلد البطني لأنثى X. tropicalis إلى اللوحات ، مما يجعل عظام الخطي والعظم الغرابي مرئية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: قلب التأمور المغلق. يتم إمساك قمة البطين القلبي من خلال التامور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 4: بطين القلب وجذع الشرايين. البطين من laevis X perfed ، يجري استيعابها ، وتبين ارتباطها بالجذع الشرياني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: مخطط القلب. رسم تخطيطي للهياكل ذات الصلة للقلب مع خط متقطع يشير إلى مكان أخذ عينة من البطين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 6: مخطط كبدي أكبداني. رسم تخطيطي ل 3 فصوص من الكبد والبنكرياس والأعضاء المرتبطة بهما. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 7: الأعضاء الكبدية. ذكر ألبينو X. laevis مع 3 فصوص من الكبد والبنكرياس والأعضاء المرتبطة بها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 8: القنوات الكيسية والكبدية. يتم رفع الفص الأيسر من الكبد لإظهار القنوات الكيسية والكبدية في X. laevis. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 9: أخذ عينات من الكبد. يتم قطع فص الكبد الأيسر من X. tropicalis غير المفعم تحت مرفقات القنوات الكبدية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 10: ارتباط المبيض. مع فصوص المبيض على جانبيها ، تكون استمرارية الظهارة الجرثومية للجدار البريتوني (فوق الكلى) مرئية. يشير خطان متقطعان أبيضان إلى مكان قطع هذه المرفقات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 11: إزالة المبيض. يتم سحب المبيض من X. laevis غير مثقوب ، بعيدا عن الكلى المقترنة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 12: شقوق المساريق. التجويف القولوني ل X. laevis غير المفعم بالحيوية ، بعد أخذ عينات من بطين القلب والفص الأيسر من الكبد وكذلك إزالة المبيض. يشير الخط الأبيض المتقطع إلى مكان قطع الرباط والقناة الكبدية ، بينما يشير الخط المتقطع الأخضر إلى مكان فصل البنكرياس عن الفص الإنسي للكبد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 13: أخذ عينات البنكرياس. يتم مضايقة بنكرياس X. laevis غير المفعم بالحيوية من المعدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 14: إزالة الأعضاء. (أ) تسحب المثانة البولية ل X. laevis غير المثقوبة بعيدا عن العباءة بخط متقطع يشير إلى مكان قطعها. (ب) الأمعاء الغليظة ل X. laevis غير المفرغة ، يتم سحبها بعيدا عن العباءة بخط متقطع يشير إلى مكان قطعها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 15: أخذ عينات من الجسم الدهني. يتم سحب الأجسام الدهنية ، المرتبطة بالصفاق في الطرف العلوي من الكلى المقترنة ، من تجويف coelomic بخط متقطع يوضح مكان قطعها. لاحظ أنه بجوار هذا المرفق ، يحتوي هذا الذكر X. tropicalis على 1 خصية بالإضافة إلى زوج من قنوات البيض الأثرية المتميزة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 16: إزالة قناة البيض. يتم سحب قناة البيض الخاصة ب X. laevis المثقوبة بعيدا عن الكلية المقترنة ، مما يجعل الصفاق الصافي مرئيا. يشير الخط المتقطع إلى مكان شق الصفاق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 17: أخذ عينات من الكلى. يتم رفع الكلى المقترنة من X. laevis غير المفعمة من تجويف coelomic. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
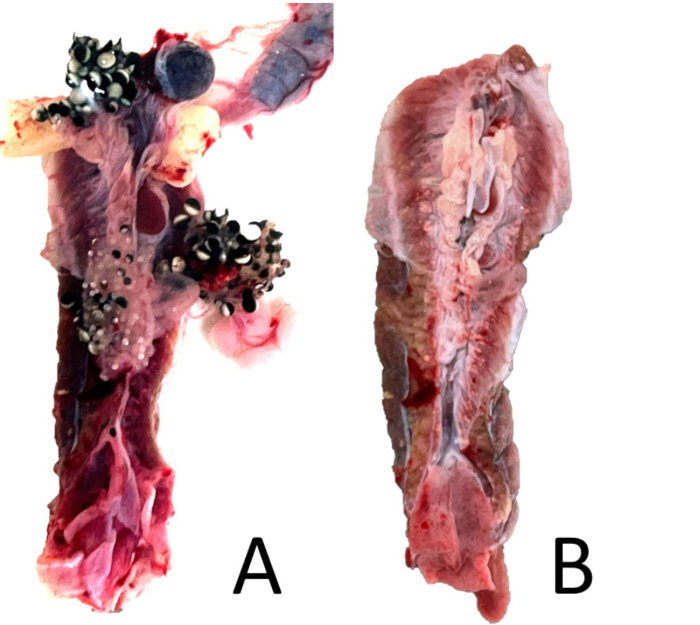
الشكل 18: تقليم الكلى. (أ) منظر بطني لكلية أنثى X. laevis غير مثقوبة مع الأعضاء البريتونية المرتبطة بها. ب: نفس الكلية مع إزالة الأعضاء المرتبطة بها، ولكن مع بقاء بعض الأنسجة البريتونية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 19: إزالة الخصية. الكلى المقترنة من X. tropicalis غير المفعمة مع إزالة خصية واحدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
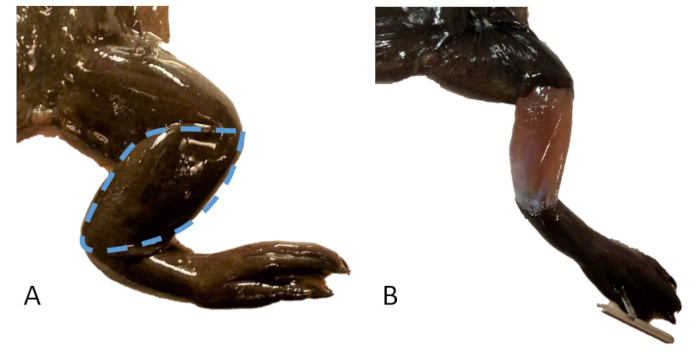
الشكل 20: أخذ عينات من الجلد. أ: الساق اليمنى ل X. tropicalis مع خط متقطع يشير إلى منطقة الجلد المراد أخذ عينات منها. ب: الساق اليمنى ل X. tropicalis مع إزالة عينة من الجلد فوق الشظية الظنبوبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 21: النتائج التمثيلية لأخذ عينات الأعضاء. عينات من بطين القلب والكبد والبنكرياس والجسم الدهني والكلى المقترنة والجلد مأخوذة من ألبينو X. laevis.
Discussion
نظرا لأن هذا البروتوكول يهدف إلى زيادة النضارة إلى أقصى حد ، فقد تتضمن بعض العينات أنسجة غير مرغوب فيها. على سبيل المثال ، يتم أخذ عينات من القناة الكبدية وبعض المساريق مع البنكرياس ، وسيتم دائما أخذ عينات من بعض الأنسجة البريتونية والغدد الكظرية والحالب مع الكلى المقترنة. إذا لم تكن النضارة مصدر قلق ، فيمكن تحقيق أخذ عينات أكثر دقة باستخدام تقنيات معدلة.
مظهر وموقع الأعضاء قابلة للمقارنة بين الجنسين وأنواع Xenopus. ومع ذلك ، يختلف لون الأنسجة اختلافا كبيرا بناء على ما إذا كانت قد تم تعطيرها أم لا. ولهذا السبب يتم تضمين صور لكل من المفعمة وغير المعطوبة.
أحد قيود هذا البروتوكول هو إعطاء الأولوية للسرعة والتكاثر على جمع العينات التي تمثل على أفضل وجه كامل الأنسجة المطلوبة. على سبيل المثال، لا يمكن أن يمثل جزء الفص الأيسر من الكبد الذي أخذ عينة منه هنا جميع الفصوص الثلاثة لأنسجة الكبد تمثيلا كافيا. إذا كانت هناك أخطاء في أخذ العينات ، فإن خيارات استكشاف الأخطاء وإصلاحها تتأثر بإمكانية الاختلاف بين أقسام الأنسجة المختلفة. على سبيل المثال ، من غير المعروف ما إذا كان الفص الأيمن من الكبد أو الجسم الدهني الأيمن أو جزء مختلف من الجلد سيكون بدائل وظيفية للأنسجة المرغوبة. في هذه الحالات ، يجب استخدام السلطة التقديرية ، بناء على احتياجات البحث ، قبل استبدال أقسام الأنسجة.
هناك قيد آخر لهذا البروتوكول وهو أنه إذا كانت التي يتم أخذ عينات منها تعاني من عيوب تشريحية جذرية أو مشاكل صحية مهمة سريريا ، فقد لا تظهر الأعضاء الموجودة في التجويف القولوني كما هو موضح هنا. تم العثور على الأورام الحبيبية في أنسجة الضفادع المصابة بالمتفطرة spp.11،12 ، ويبدو أن الحالات السابقة لمتلازمة فرط تنبيه المبيض تؤدي إلى عرض غير طبيعي للأعضاء13.
على الرغم من أن هذه الطريقة قد تم تطويرها لمختبر Xenopus ، إلا أن هناك أوجه تشابه كبيرة في مظهر هذه الأعضاء داخل العديد من البرمائيات غير القيصرية والزواحف ذات الأطراف14. يمكن بسهولة تعديل جزء أخذ العينات من هذا البروتوكول لنماذج أخرى ، مثل axolotls أو anole الأخضر.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من خلال منحة التطوير التنظيمي للمعاهد الوطنية للصحة R24OD031956. نشكر سامانثا جالبرت وجيل رالستون وكورا أندرسون على مساعدتهم ودعمهم بالإضافة إلى محررنا والمراجعين الأقران المجهولين على ملاحظاتهم المفيدة
Materials
| Name | Company | Catalog Number | Comments |
| 5x Magnifying Glass with LED Light and Stand | amazon.com | B08QJ6J8P1 | light must not produce heat |
| Disposable Transfer Pipets | VWR | 414004-036 | |
| Dissecting Fine-Pointed Forceps | Fisher Scinetific | 08-875 | |
| Dissecting scissors sharp piont, straight 6.5" | VWR | 76457-374 | |
| Dissection Tray | Fisher Scinetific | 14-370-284 | styrofoam sheets are an acceptable alternative |
| Euthanasia container | US Plastic | Item 2860 | alternative opaque containers acceptable |
| Euthanasia container lid | US Plastic | Item 3047 | |
| Iridectomy Scissors 6" | vwr | 470018-938 | iris scissors are an acceptable alternative |
| MS-222: Syncaine (formerly tricaine) | Pentair AES | TRS1 | |
| PBS 1x | Corning | 21-040-CV | |
| Sodium Bicarbonate, Powder, USP | Fisher Scientific | 18-606-333 | |
| Specimen Forceps, Serrated | VWR | 82027-442 | |
| T-Pins for Dissecting | Fisher Scinetific | S99385 |
References
- Porro, L. B., Richards, C. T. Digital dissection of the model organism Xenopus laevis using contrast-enhanced computed tomography. J Anat. 231 (2), 169-191 (2017).
- Ruehl-Fehlert, C., et al. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55 (23), 91-106 (2003).
- Kittel, B., et al. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Morawietz, G., et al. Revised guides for organ sampling and trimming in rats and mice - Part 3 - A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Patmann, M. D., Shewade, L. H., Schneider, K. A., Buchholz, D. R. Xenopus tadpole tissue harvest. Cold Spring Harb Protoc. 2017 (11), 097675(2017).
- Lőw, P., Molnár, K., Kriska, G. Dissection of a Frog (Rana sp.). Atlas of Animal Anatomy and Histology. , 213-263 (2016).
- O'Rourke, D. P. Amphibians used in research and teaching. ILAR J. 48 (3), 183-187 (2007).
- Jonas-Closs, R. A., Peshkin, L. Effective rapid blood perfusion in Xenopus. JoVE. (issue), e65287(2023).
- Balls, M., Worley, R. S. Amphibian cells in vitro. II. Effects of variations in medium osmolarity on a permanent cells line isolated from Xenopus. Exp Cell Res. 76 (2), 333-336 (1973).
- Holz, P. H., Raidal, S. R. Comparative renal anatomy of exotic species. Vet North Am Exot Anim Pract. 9 (1), 1-11 (2006).
- Trott, K. A., et al. Characterization of a Mycobacterium ulcerans-like infection in a colony of African tropical clawed frogs (Xenopus tropicalis). Comp Med. 54 (3), 309-317 (2004).
- Fremont-Rahl, J. J., et al. Mycobacterium liflandii outbreak in a research colony of Xenopus (Silurana) tropicalis frogs. Vet Pathol. 48 (4), 856-867 (2011).
- Green, S. L., Parker, J., Davis, C., Bouley, D. M. Ovarian hyperstimulation syndrome in gonadotropin-treated laboratory South African clawed frogs (Xenopus laevis). J Am Assoc Lab Anim Sci. 46 (3), 64-67 (2007).
- Vitt, L. J., Caldwell, J. P. Anatomy of amphibians and reptiles. Herpetol. Herpetol. , 35-81 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved