Method Article
Techniques d’échantillonnage rapide de six organes cruciaux chez le xénope adulte
Dans cet article
Résumé
Cet article présente un guide pour l’échantillonnage de six organes significatifs et diversifiés chez le xénope adulte qui peuvent être rapidement et facilement accessibles : le ventricule cardiaque, le lobe du foie, le pancréas, les corps adipeux, les reins appariés et la peau.
Résumé
Le xénope est un puissant organisme modèle pour comprendre le développement et la maladie des vertébrés depuis plus de cent ans. Bien que les techniques d’analyse expérimentale et de dissection de l’embryon aient été bien documentées, les descriptions des structures et des organes du xénope adulte, ainsi que les techniques de travail avec les adultes, n’ont pas été mises à jour pour tenir compte des exigences des approches modernes telles que la protéomique quantitative et la transcriptomique unicellulaire. Les perspectives centrées sur le type de cellule et le gène nécessitent des observations contrastées dans les stades embryonnaires par rapport à celles des tissus adultes. Les organes de la larve subissent des changements importants dans leur structure globale, leur morphologie et leur emplacement anatomique tout au long de la transition larvaire-adulte, notamment lors d’un remodelage massif de la métamorphose. Il est essentiel d’établir des normes solides pour l’identification et la dissection des organes afin de garantir la cohérence des ensembles de données résultant d’études réalisées dans différents laboratoires. Le présent protocole identifie six des organes du xénope adulte, démontrant des méthodes de dissection et d’échantillonnage du ventricule cardiaque, du foie, du corps adipeux, du pancréas, des reins appariés et de la peau du xénope adulte. Selon les méthodes de conservation, les organes disséqués peuvent être utilisés pour la protéomique quantitative, la transcriptomique unicellulaire/noyaux, l’hybridation in situ , l’immunohistochimie, l’histologie, etc. Ce protocole vise à normaliser l’échantillonnage des tissus et à faciliter les investigations multi-laboratoires des systèmes d’organes adultes.
Introduction
Bien que la « dissection numérique » du xénope adulte soit disponible1, l’échantillonnage reproductible d’organes et de tissus du xénope adulte reste difficile sans les instructions détaillées disponibles pour d’autres modèles adultes (par exemple, souris2, 3, 4). Cet article vise à fournir des conseils clairs pour un échantillonnage précis et reproductible d’organes de xénope adultes, similaire à ce qui est actuellement disponible pour leurs larves5. L’accent est mis sur la facilité de réalisation afin de conserver un maximum de fraîcheur et de rendre le protocole accessible à tous les utilisateurs.
Bien qu’il existe un guide de dissection complet pour Rana sp.6, ainsi que de nombreux guides de dissection en classe pour d’autres anoures7, aucun guide de dissection et d’échantillonnage de Xenopus n’est actuellement disponible. Pour ceux qui ne sont pas familiers avec les pratiques d’échantillonnage ou l’anatomie des amphibiens, les petites différences entre le xénope et les autres anoures rendent ces ressources sous-optimales pour l’échantillonnage de tissus reproductible.
De nombreux tissus précieux ne sont pas inclus et sont même jetés dans le présent guide ; Il s’agit d’assurer la fraîcheur des tissus. Six échantillons sont suffisamment limités pour garantir que ces tissus peuvent être prélevés en moins d’une heure après que le cœur commence à battre, quel que soit l’expérience ou le niveau de compétence de l’utilisateur. Des guides plus avancés et détaillés pour la collecte de nombreux autres tissus sont en cours de préparation en tant qu’articles d’accompagnement distincts.
Pour les utilisateurs moins expérimentés, il est toujours recommandé de tester d’abord ce protocole sur les animaux euthanasiés pour des raisons autres que l’expérimentation avant d’échantillonner les animaux difficiles à remplacer (c’est-à-dire les transgéniques, les animaux d’un âge avancé, etc.). Idéalement, tous les animaux échantillonnés seront en bonne santé et, s’ils sont femelles, n’auront pas été ovulés au cours des deux dernières semaines.
Protocole
Toutes les expériences ont été réalisées conformément aux règles et règlements de l’IACUC (Institutional Animal Care and Use Committee) de la Harvard Medical School (IS 00001365_3). Les résultats représentatifs sont présentés pour un mâle albinos mature perfusé et non perfusé, Xenopus laevis.
1. Préparation expérimentale
REMARQUE : Si le protocolede perfusion 8 est suivi avant l’échantillonnage, passez à l’étape 2.2.
- S’assurer que l’établissement de recherche a approuvé la technique d’euthanasie décrite dans le présent protocole.
- Préparez une solution de 5 g/L de MS-222 (méthanesulfonate de tricaïne) et de 5 g/L de bicarbonate de sodium (voir le tableau des matières). Le volume doit être supérieur au volume requis pour couvrir complètement les animaux euthanasiés. Vérifiez le pH pour vous assurer qu’il est ≥7.
- Effectuer l’euthanasie primaire en plaçant le xénope dans la solution d’euthanasie ; L’animal restera immergé pendant un total de 1 h.
- Installez la station de dissection de sorte qu’immédiatement après l’échantillonnage, tous les tissus puissent être rincés dans du PBS réfrigéré ou du PBS9 0,7x (selon les besoins expérimentaux), vérifiés et coupés sous une lumière de grossissement de 5x (ou plus). Cette station doit également permettre à l’utilisateur de remplacer toutes les pinces et ciseaux ou de les essuyer entre les utilisations.
- Une fois que la grenouille a été dans la solution pendant 1 h, l’euthanasie primaire a été terminée. Retirez la grenouille et vérifiez la perte de réponse à la douleur en effectuant un pincement du pied.
- Consigner les détails appropriés pour l’animal, comme l’espèce, la souche, le sexe, l’âge et l’état de santé, ainsi que s’il a été perfusé. Pesez le xénope et prenez des mesures supplémentaires, telles que la longueur du museau et du cloaque.
- Placez la grenouille sur son dos et épinglez les membres à proximité du corps (figure 1).
- À l’aide de ciseaux de dissection, coupez à travers la peau, le long de la ligne médiane, puis latéralement, en faisant deux rabats.
- En vous référant à la figure 2, identifiez la linea alba et utilisez des pinces pour la saisir et l’éloigner de la cavité cœlomique. Découpez soigneusement la musculature à l’aide de ciseaux. Faites deux rabats à partir de la paroi de la cavité. Coupez ou épinglez tous les rabats à l’écart.
- Identifiez le cœur qui battra encore. Utilisez des ciseaux à disséquer pour réduire les os coracoïdes (Figure 2) afin de mieux accéder au cœur.
REMARQUE : Si le cœur a cessé de battre avant l’échantillonnage, il convient de noter que la fraîcheur de l’échantillon a été compromise.
2. Échantillonnage
REMARQUE : Si l’animal a été perfusé, passez à l’étape 2.2.
- Identifiez le péricarde mince et tirez-le avec une pince à tissus (Figure 3).
- À l’aide de la pointe des ciseaux d’iridectomie, perforez doucement le péricarde en faisant attention de ne pas couper les tissus sous-jacents. Décollez le péricarde des 3 cavités du cœur.
- À l’aide d’une pince, saisissez le ventricule par l’apex, identifiez l’endroit où il s’attache aux oreillettes et au tronc artériel (figure 4) et coupez-le sous ces attaches (figure 5). Si nécessaire, coupez le ventricule de manière à ce qu’aucun tissu des oreillettes ou du tronc artériel ne soit visible, et que le tissu valvulaire de couleur claire soit toujours visible à l’intérieur du ventricule.
REMARQUE : Chez les animaux non perfusés, l’ablation du ventricule peut être considérée comme une euthanasie secondaire. - Les 3 lobes du foie seront visibles (Figure 6 et Figure 7). Saisissez la lèvre du lobe gauche (à droite de l’observateur) et soulevez-la doucement pour que les canaux hépatiques et kystiques soient visibles (Figure 8). Prélevez un échantillon du 1/3 inférieur du lobe sous ces accessoires (Figure 9).
- Pour obtenir un meilleur accès aux tissus d’une grenouille femelle, il est utile d’enlever l’ovaire. Identifiez l’ovaire qui est enveloppé dans une couche de péritoine viscéral appelée épithélium germinal. Déplacez doucement les lobes jusqu’à ce qu’ils soient sur leurs côtés respectifs pour rendre la zone d’attache visible (Figure 10). Ces attaches sont directement ventrales au rein apparié.
- À l’aide de ciseaux, retirez les ovaires le plus près possible des reins sans les endommager (Figure 11).
- Inspectez le lobe médial (également appelé lobe antérieur) du foie et notez comment il se connecte à l’estomac et au duodénum par le mésentère et le canal hépatopancréatique (également appelé canal cholédoque) (Figure 6, Figure 7 et Figure 8).
- Sectionnez le mésentère, le ligament hépatoduodénal à l’aide de ciseaux d’iridectomie ainsi que le canal hépatopancréatique où il rencontre le duodénum. Sectionner la connexion du pancréas et du canal hépatopancréatique au lobe médial du foie afin qu’aucun tissu hépatique foncé ne soit attaché (figure 12).
- Saisissez l’estomac avec une pince dentée et l’extrémité supérieure du pancréas avec une pince à tissus. Sous un grossissement de 5x, taquinez doucement le pancréas de l’estomac (Figure 13).
REMARQUE : S’il ne se détache pas proprement, le tissu pancréatique restant sera visible et pourra être prélevé en fragments. Alternativement, le pancréas peut être méthodiquement détaché à l’aide de ciseaux d’iridectomie et de pinces à tissus. - En vous référant à la figure 14A, identifiez la vessie et retirez-la en coupant le plus près possible du cloaque. Jetez ce tissu.
- En vous référant à la figure 14B, identifiez le gros intestin et tirez-le pour sectionner le gros intestin aussi près que possible du cloaque. Retirez et jetez tout le tube digestif, en sectionnant le péritoine où il s’attache à la rate. Les corps adipeux seront désormais entièrement accessibles.
- Séparez les corps gras de manière à ce qu’ils soient sur leurs côtés respectifs. La zone au-dessus du rein, où le corps adipeux se connecte au péritoine, sera visible. Saisissez la base du corps adipeux gauche (à droite du spectateur) et utilisez des ciseaux pour le couper du péritoine, en laissant une petite marge pour que le rein ne soit pas endommagé (Figure 15).
- Retirez et jetez le reste du corps gras. Les reins appariés seront maintenant entièrement visibles.
- Chez les grenouilles femelles ou les mâles avec des oviductes vestigiaux distincts, saisissez un oviducte et retirez-le du rein et du cloaque (figure 16). Coupez l’oviducte à l’endroit où il rencontre le cloaque et continuez à le retirer du rein, en coupant toutes les attaches péritonéales claires lorsqu’elles deviennent apparentes. Jetez ce tissu.
- Répétez ce processus avec l’oviducte restant.
- Les reins sont encore recouverts d’un péritoine clair (rétropéritonéal)10. Utilisez des pinces pour saisir les reins et sectionner le péritoine à leur extrémité inférieure.
- Soulevez les reins hors de la cavité cœlomique à l’aide de ciseaux pour sectionner le péritoine le plus près possible des reins sans les endommager (Figure 17).
- Sous un grossissement de 5x, coupez l’excès de péritoine et tout autre tissu restant (corps adipeux, rate). Si la grenouille est une femelle, assurez-vous d’enlever tout tissu ovarien restant (figure 18). Si la grenouille est un mâle, retirez soigneusement le testicule et vérifiez s’il y a un oviducte vestigial, qui peut ne pas être visible sans grossissement (figure 19).
- Retirez les goupilles de l’animal, retournez-le sur son ventre et épinglez à nouveau les membres de l’animal.
- Sélectionnez l’un ou l’autre des membres postérieurs à échantillonner et épinglez le pied de ce membre.
- Retirez un lambeau de peau en forme d’amande sur le gastrocnémien/tibiopéroné (figure 20).
Résultats
En utilisant les figures 1 à 20 et en suivant toutes les étapes de ce protocole, le ventricule cardiaque, le lobe gauche du foie, le pancréas, les corps adipeux gauches, les reins appariés et un lambeau de peau ont été proprement excisés dans l’heure qui a suivi l’euthanasie. Pendant ce temps, les échantillons sont rincés et parés de manière à ce qu’ils apparaissent, comme le montre la figure 21.
Figure 1 : Xenopus épinglé. Une femelle mature X. tropicalis épinglée à travers chaque membre. Veuillez cliquer ici pour voir une version agrandie de cette figure.
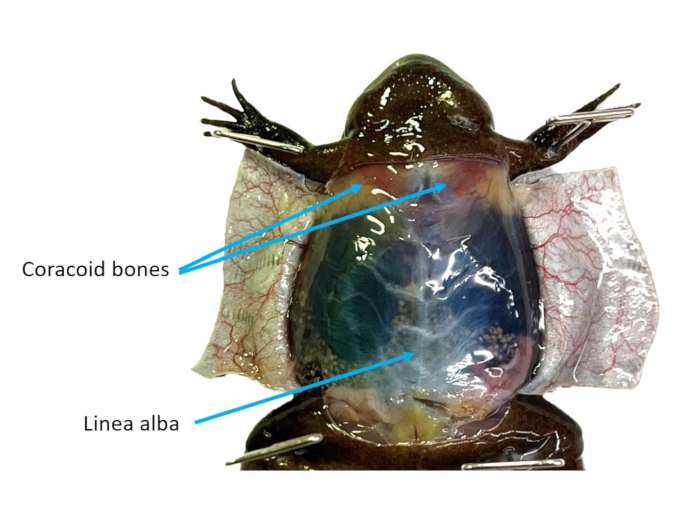
Figure 2 : Paroi abdominale. La peau ventrale d’une femelle X. tropicalis est coupée en rabats, ce qui rend visibles la linea alba et les os coracoïdes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 3 : Cœur fermé dans le péricarde. L’apex du ventricule cardiaque est saisi à travers le péricarde. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 4 : Ventricule cardiaque et tronc artériel. Le ventricule d’un X laevis perfusé, étant saisi, montrant son attachement au tronc artériel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 5 : Schéma cardiaque. Un schéma des structures pertinentes du cœur avec une ligne pointillée indiquant où prélever le ventricule. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 6 : Schéma hépatopancréatique. Un schéma des 3 lobes du foie, du pancréas et des organes associés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 7 : Organes hépatopancréatiques. Un mâle perfusé, albinos, X. laevis avec 3 lobes du foie, du pancréas et des organes associés marqués. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 8 : Canaux cystiques et hépatiques. Le lobe gauche du foie est soulevé pour montrer les canaux kystiques et hépatiques chez X. laevis perfusés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 9 : Prélèvement hépatique. Le lobe gauche du foie d’un X. tropicalis non perfusé est sectionné sous les attaches des canaux hépatiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 10 : Fixation de l’ovaire. Avec les lobes de l’ovaire sur leurs côtés respectifs, la continuité de l’épithélium germinal à la paroi péritonéale (au-dessus des reins) est visible. Deux lignes pointillées blanches indiquent où couper ces attachements. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 11 : Ablation des ovaires. L’ovaire d’un X. laevis non perfusé est éloigné des reins appariés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 12 : Incisions de mésentère. La cavité cœlomique d’un X. laevis non irrigué, suite au prélèvement du ventricule cardiaque et du lobe gauche du foie ainsi qu’à l’ablation de l’ovaire. Une ligne pointillée blanche indique où sectionner le ligament et le canal hépatopancréatique, tandis qu’une ligne pointillée verte indique où sectionner le pancréas du lobe médial du foie. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 13 : Prélèvement du pancréas. Le pancréas d’un X. laevis non perfusé est en train d’être retiré de l’estomac. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 14 : Ablation d’organes. (A) La vessie d’un X. laevis non perfusé est retirée du cloaque par une ligne pointillée indiquant où la couper. (B) Le gros intestin d’un X. laevis non perfusé est retiré du cloaque par une ligne pointillée indiquant où le sectionner. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 15 : Échantillonnage du corps gras. Les corps adipeux, attachés au péritoine à l’extrémité supérieure des reins appariés, sont retirés de la cavité cœlomique par une ligne pointillée indiquant où les couper. Notez qu’à côté de cet attachement, ce mâle X. tropicalis a 1 testicule ainsi qu’une paire d’oviductes vestigiaux distincts. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 16 : Enlèvement de l’oviducte. L’oviducte d’un X. laevis perfusé est tiré loin du rein apparié, ce qui rend visible le péritoine clair. Une ligne pointillée indique où inciser le péritoine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 17 : Prélèvement de reins. Les reins appariés d’un X. laevis non perfusé sont en train d’être retirés de la cavité cœlomique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
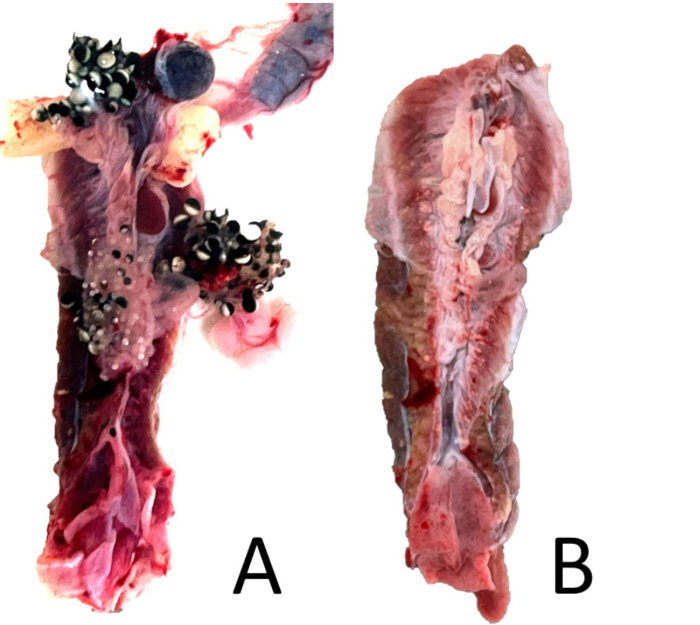
Figure 18 : Parage des reins. (A) Une vue ventrale du rein apparié d’une femelle X. laevis non perfusée avec les organes péritonéaux associés attachés. (B) Le même rein avec les organes associés enlevés mais avec un peu de tissu péritonéal restant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 19 : Ablation des testicules. Les reins appariés de X. tropicalis non perfusés avec un testicule enlevé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
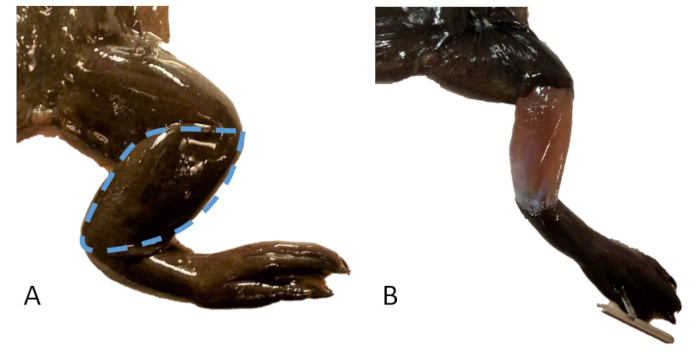
Figure 20 : Prélèvement cutané. (A) La patte droite d’un X. tropicalis avec une ligne pointillée indiquant la zone de peau à échantillonner. (B) La jambe droite d’un X. tropicalis avec un échantillon de peau prélevé sur le tibiofibulé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 21 : Résultats représentatifs du prélèvement d’organes. Échantillons du ventricule cardiaque, du foie, du pancréas, du corps adipeux, du rein apparié et de la peau prélevés sur un albinos X. laevis, perfusé et non perfusé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Comme ce protocole vise à maximiser la fraîcheur, certains échantillons peuvent inclure des tissus indésirables. Par exemple, le canal hépatopancréatique et une partie du mésentère sont échantillonnés avec le pancréas, et certains tissus péritonéaux, glandes surrénales et uretères seront toujours échantillonnés avec les reins appariés. Si la fraîcheur n’est pas un problème, un échantillonnage plus précis peut être obtenu à l’aide de techniques modifiées.
L’apparence et l’emplacement des organes sont comparables entre les sexes et les espèces de Xénope. Cependant, la couleur des tissus varie considérablement selon que les animaux ont été perfusés ou non. C’est pour cette raison que des images d’animaux perfusés et non perfusés sont incluses.
L’une des contraintes de ce protocole est que la vitesse et la reproductibilité sont prioritaires par rapport à la collecte d’échantillons qui représentent le mieux l’intégralité du tissu souhaité. Par exemple, la section du lobe gauche du foie échantillonnée ici ne peut pas représenter adéquatement les trois lobes du tissu hépatique. S’il y a des erreurs dans l’échantillonnage, les options de dépannage sont affectées par le potentiel de variation entre les différentes sections de tissu. Par exemple, on ne sait pas si le lobe droit du foie, le corps adipeux droit ou une autre partie de la peau seraient des alternatives fonctionnelles aux tissus souhaités. Dans ces cas, il faut faire preuve de discrétion, en fonction des besoins de la recherche, avant de substituer des sections de tissu.
Une autre limite de ce protocole est que si les animaux échantillonnés présentent des anomalies anatomiques drastiques ou des problèmes de santé cliniquement significatifs, les organes de la cavité cœlomique peuvent ne pas apparaître comme décrit ici. Des granulomes ont été trouvés dans les tissus de grenouilles infectées par Mycobacterium spp.11,12, et des cas antérieurs de syndrome d’hyperstimulation ovarienne semblent conduire à une présentation anormale des organes13.
Bien que cette méthode ait été développée pour le xénope de laboratoire, il existe des similitudes significatives dans l’apparence de ces organes chez de nombreux amphibiens non céciliens et reptiles à membres14. La partie échantillonnage de ce protocole pourrait facilement être modifiée pour d’autres modèles, tels que les axolotls ou l’anole vert.
Déclarations de divulgation
Les auteurs ne déclarent pas d’intérêts concurrents.
Remerciements
Ce travail a été soutenu par la subvention OD des NIH R24OD031956. Nous remercions Samantha Jalbert, Jill Ralston et Cora Anderson pour leur aide et leur soutien, ainsi que notre rédactrice en chef et nos pairs examinateurs anonymes pour leurs commentaires utiles
matériels
| Name | Company | Catalog Number | Comments |
| 5x Magnifying Glass with LED Light and Stand | amazon.com | B08QJ6J8P1 | light must not produce heat |
| Disposable Transfer Pipets | VWR | 414004-036 | |
| Dissecting Fine-Pointed Forceps | Fisher Scinetific | 08-875 | |
| Dissecting scissors sharp piont, straight 6.5" | VWR | 76457-374 | |
| Dissection Tray | Fisher Scinetific | 14-370-284 | styrofoam sheets are an acceptable alternative |
| Euthanasia container | US Plastic | Item 2860 | alternative opaque containers acceptable |
| Euthanasia container lid | US Plastic | Item 3047 | |
| Iridectomy Scissors 6" | vwr | 470018-938 | iris scissors are an acceptable alternative |
| MS-222: Syncaine (formerly tricaine) | Pentair AES | TRS1 | |
| PBS 1x | Corning | 21-040-CV | |
| Sodium Bicarbonate, Powder, USP | Fisher Scientific | 18-606-333 | |
| Specimen Forceps, Serrated | VWR | 82027-442 | |
| T-Pins for Dissecting | Fisher Scinetific | S99385 |
Références
- Porro, L. B., Richards, C. T. Digital dissection of the model organism Xenopus laevis using contrast-enhanced computed tomography. J Anat. 231 (2), 169-191 (2017).
- Ruehl-Fehlert, C., et al. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55 (23), 91-106 (2003).
- Kittel, B., et al. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Morawietz, G., et al. Revised guides for organ sampling and trimming in rats and mice - Part 3 - A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Patmann, M. D., Shewade, L. H., Schneider, K. A., Buchholz, D. R. Xenopus tadpole tissue harvest. Cold Spring Harb Protoc. 2017 (11), 097675(2017).
- Lőw, P., Molnár, K., Kriska, G. Dissection of a Frog (Rana sp.). Atlas of Animal Anatomy and Histology. , 213-263 (2016).
- O'Rourke, D. P. Amphibians used in research and teaching. ILAR J. 48 (3), 183-187 (2007).
- Jonas-Closs, R. A., Peshkin, L. Effective rapid blood perfusion in Xenopus. JoVE. (issue), e65287(2023).
- Balls, M., Worley, R. S. Amphibian cells in vitro. II. Effects of variations in medium osmolarity on a permanent cells line isolated from Xenopus. Exp Cell Res. 76 (2), 333-336 (1973).
- Holz, P. H., Raidal, S. R. Comparative renal anatomy of exotic species. Vet North Am Exot Anim Pract. 9 (1), 1-11 (2006).
- Trott, K. A., et al. Characterization of a Mycobacterium ulcerans-like infection in a colony of African tropical clawed frogs (Xenopus tropicalis). Comp Med. 54 (3), 309-317 (2004).
- Fremont-Rahl, J. J., et al. Mycobacterium liflandii outbreak in a research colony of Xenopus (Silurana) tropicalis frogs. Vet Pathol. 48 (4), 856-867 (2011).
- Green, S. L., Parker, J., Davis, C., Bouley, D. M. Ovarian hyperstimulation syndrome in gonadotropin-treated laboratory South African clawed frogs (Xenopus laevis). J Am Assoc Lab Anim Sci. 46 (3), 64-67 (2007).
- Vitt, L. J., Caldwell, J. P. Anatomy of amphibians and reptiles. Herpetol. Herpetol. , 35-81 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon