Method Article
Técnicas para la toma rápida de muestras de seis órganos cruciales en Xenopus adulto
En este artículo
Resumen
Este artículo presenta una guía para tomar muestras de seis órganos significativos y diversos en Xenopus adultos a los que se puede acceder rápida y fácilmente: el ventrículo cardíaco, el lóbulo hepático, el páncreas, los cuerpos grasos, los riñones emparejados y la piel.
Resumen
Xenopus ha sido un poderoso organismo modelo para comprender el desarrollo y las enfermedades de los vertebrados durante más de cien años. Si bien las técnicas experimentales de análisis y disección del embrión han sido bien documentadas, las descripciones de las estructuras y órganos de Xenopus adultos, junto con las técnicas para trabajar con adultos, no se han actualizado para tener en cuenta los requisitos de enfoques modernos como la proteómica cuantitativa y la transcriptómica de una sola célula. Las perspectivas centradas en el tipo de célula y en los genes requieren observaciones contrastantes en las etapas embrionarias con las de los tejidos adultos. Los órganos de la larva experimentan cambios significativos en su estructura general, morfología y ubicación anatómica a lo largo de la transición de larva a adulto, sobre todo durante la remodelación masiva de la metamorfosis. Establecer estándares sólidos para la identificación y disección de órganos es crucial para garantizar que los conjuntos de datos resultantes de los estudios realizados en diferentes laboratorios puedan ser coherentes. El presente protocolo identifica seis de los órganos en el Xenopus adulto, demostrando métodos para la disección y la toma de muestras del ventrículo cardíaco, el hígado, el cuerpo graso, el páncreas, el riñón emparejado y la piel del Xenopus adulto. Dependiendo de los métodos de preservación, los órganos disecados se pueden utilizar para proteómica cuantitativa, transcriptómica de células individuales/núcleos, hibridación in situ , inmunohistoquímica, histología, etcétera. Este protocolo tiene como objetivo estandarizar el muestreo de tejidos y facilitar las investigaciones multilaboratorio de los sistemas de órganos adultos.
Introducción
Aunque la "disección digital" de Xenopus adultoestá disponible 1, el muestreo replicable de órganos y tejidos de Xenopus adulto sigue siendo un desafío sin las instrucciones detalladas disponibles para otros modelos adultos (por ejemplo, ratones 2,3,4). Este artículo tiene como objetivo proporcionar una guía clara para el muestreo preciso y replicable de órganos de Xenopus adulto similar a lo que está disponible actualmente para sus larvas5. Se hace hincapié en la facilidad de finalización para mantener la máxima frescura y hacer que el protocolo sea accesible para todos los usuarios.
Aunque existe una guía de disección completa para Rana sp.6, así como numerosas guías de disección en el aula para otros anuros7, actualmente no se dispone de una guía de disección y muestreo de Xenopus. Para aquellos que no están familiarizados con las prácticas de muestreo o la anatomía de los anfibios, las pequeñas diferencias entre Xenopus y otros anuros hacen que estos recursos no sean óptimos para el muestreo de tejidos replicables.
Muchos tejidos valiosos no están incluidos e incluso se descartan en la presente guía; Esto es para garantizar la frescura de los tejidos. Seis muestras son lo suficientemente limitadas como para garantizar que estos tejidos se puedan recolectar en menos de una hora después de que el corazón comience a latir, independientemente de la experiencia o el nivel de habilidad del usuario. Se están preparando guías más avanzadas y detalladas para recolectar muchos otros tejidos como documentos complementarios separados.
Para los usuarios menos experimentados, siempre se recomienda que este protocolo se pruebe primero en los animales que se sacrifican por razones distintas a la experimentación antes de tomar muestras de cualquier animal que sea difícil de reemplazar (es decir, transgénicos, animales de edad avanzada, etcétera). Lo ideal es que todos los animales muestreados estén sanos y, si son hembras, no hayan ovulado en las últimas dos semanas.
Protocolo
Todos los experimentos se realizaron de acuerdo con las normas y reglamentos del Comité Institucional de Cuidado y Uso de Animales (IS 00001365_3) de la Escuela de Medicina de Harvard. Se muestran los resultados representativos tanto para un macho albino maduro perfundido como para un macho albino maduro no perfundido, Xenopus laevis.
1. Preparación experimental
NOTA: Si se sigue el protocolode perfusión 8 antes de la toma de muestras, vaya al paso 2.2.
- Asegurarse de que la institución de investigación ha aprobado la técnica de eutanasia descrita en este protocolo.
- Prepare una solución de 5 g/L de MS-222 (metanosulfonato de tricaína) y 5 g/L de bicarbonato de sodio (ver Tabla de Materiales). El volumen debe ser mayor que el volumen requerido para cubrir completamente a los animales que se van a sacrificar. Verifique el pH para asegurarse de que esté ≥7.
- Realizar la eutanasia primaria colocando el Xenopus en la solución de eutanasia; El animal permanecerá sumergido un total de 1 h.
- Configure la estación de disección de modo que inmediatamente después de la toma de muestras, todos los tejidos puedan enjuagarse con PBS frío o PBS9 de 0,7x (dependiendo de las necesidades experimentales), revisarse y recortarse bajo una luz de aumento de 5x (o más). Esta estación también debe permitir al usuario reemplazar todas las pinzas y tijeras o limpiarlas entre usos.
- Una vez que la rana ha estado en la solución durante 1 h, se ha completado la eutanasia primaria. Retire la rana y verifique la pérdida de respuesta al dolor realizando un pellizco en el pie.
- Registre los detalles apropiados para el animal, como la especie, la cepa, el sexo, la edad y el estado de salud, así como si fue perfundido. Pesa al Xenopus y toma cualquier medida adicional, como la longitud del hocico.
- Coloque la rana boca arriba y sujete las extremidades proximales al cuerpo (Figura 1).
- Con unas tijeras de disección, corta la piel, sube por la línea media y luego lateralmente, haciendo dos solapas.
- Refiriéndose a la Figura 2, identifique la línea alba y use fórceps para agarrarla y alejarla de la cavidad celómica. Corta la musculatura con cuidado con unas tijeras. Haz dos solapas fuera de la pared de la cavidad. Corta o sujeta con alfileres todas las solapas para que no estorben.
- Identifica el corazón que seguirá latiendo. Use tijeras de disección para reducir los huesos coracoideos (Figura 2) para obtener un mejor acceso al corazón.
NOTA: Si el corazón ha dejado de latir antes de la toma de muestras, debe tenerse en cuenta que la frescura de la muestra se ha visto comprometida.
2. Muestreo
NOTA: Si el animal ha sido perfundido, vaya al paso 2.2.
- Identifique el pericardio delgado y tire de él con pinzas de tejido (Figura 3).
- Con la punta de las tijeras de iridectomía, perfore suavemente el pericardio, teniendo cuidado de no cortar los tejidos subyacentes. Pela el pericardio lejos de las 3 cavidades del corazón.
- Use fórceps para agarrar el ventrículo por el ápice, identificar dónde se une a las aurículas y al tronco arterial (Figura 4) y cortarlo por debajo de estas inserciones (Figura 5). Si es necesario, recorte el ventrículo de modo que no se vean tejidos de las aurículas o del tronco arterial, y el tejido valvular de color claro seguirá siendo visible dentro del ventrículo.
NOTA: En animales no perfundidos, la extirpación del ventrículo puede calificar como eutanasia secundaria. - Los 3 lóbulos del hígado serán visibles (Figura 6 y Figura 7). Agarre el labio del lóbulo izquierdo (a la derecha del espectador) y levántelo suavemente para que los conductos hepáticos y císticos sean visibles (Figura 8). Tome muestras del 1/3 inferior del lóbulo debajo de estos accesorios (Figura 9).
- Para obtener un mejor acceso a los tejidos de una rana hembra, es útil extirpar el ovario. Identifica el ovario que está envuelto en una capa de peritoneo visceral llamada epitelio germinal. Mueva suavemente los lóbulos hasta que estén de sus lados respectivos para hacer visible el área de inserción (Figura 10). Estas uniones son directamente ventrales al riñón pareado.
- Con unas tijeras, extraiga los ovarios lo más cerca posible de los riñones sin dañarlos (Figura 11).
- Inspeccione el lóbulo medial (también llamado lóbulo anterior) del hígado y observe cómo se conecta con el estómago y el duodeno a través del mesenterio y el conducto hepatopancreático (también llamado conducto biliar común) (Figura 6, Figura 7 y Figura 8).
- Cortar el mesenterio, el ligamento hepatoduodenal con unas tijeras de iridectomía, así como el conducto hepatopancreático donde se une con el duodeno. Cortar la conexión del páncreas y el conducto hepatopancreático con el lóbulo medial del hígado para que no quede tejido hepático oscuro adherido (figura 12).
- Agarre el estómago con pinzas dentadas y el extremo superior del páncreas con pinzas de tejido. Con un aumento de 5x, separe suavemente el páncreas del estómago (Figura 13).
NOTA: Si no se desprende limpiamente, el tejido pancreático restante será visible y se puede cortar en fragmentos. Alternativamente, el páncreas se puede separar metódicamente con tijeras de iridectomía y pinzas de tejido. - Refiriéndose a la Figura 14A, identifique la vejiga urinaria y retírela, cortando lo más cerca posible de la cloaca. Deseche este pañuelo.
- Refiriéndose a la Figura 14B, identifique el intestino grueso y tire de él para cortar el intestino grueso lo más cerca posible de la cloaca. Retire y deseche todo el canal alimentario, cortando el peritoneo donde se une al bazo. Los cuerpos gordos ahora serán completamente accesibles.
- Separa los cuerpos gordos para que estén de lado respectivo. El área sobre el riñón, donde el cuerpo graso se conecta con el peritoneo, será visible. Agarre la base del cuerpo graso izquierdo (a la derecha del espectador) y utilice unas tijeras para cortarlo del peritoneo, dejando un pequeño margen para que el riñón no se dañe (Figura 15).
- Retire y deseche el cuerpo graso restante. Los riñones emparejados ahora serán completamente visibles.
- En ranas hembras o machos con oviductos vestigiales distintos, agarre un oviducto y retírelo del riñón y la cloaca (Figura 16). Corte el oviducto donde se une con la cloaca y continúe separándolo del riñón, cortando cualquier unión peritoneal clara a medida que se haga evidente. Deseche este pañuelo.
- Repita este proceso con el oviducto restante.
- Los riñones todavía están cubiertos con un peritoneo transparente (retroperitoneal)10. Use fórceps para agarrar los riñones y cortar el peritoneo en su extremo inferior.
- Levantar los riñones fuera de la cavidad celómica, usando tijeras para cortar el peritoneo lo más cerca posible de los riñones sin dañarlos (Figura 17).
- Con un aumento de 5x, corte el exceso de peritoneo y cualquier otro tejido restante (cuerpos grasos, bazo). Si la rana es hembra, asegúrese de que se haya eliminado cualquier resto de tejido ovárico (Figura 18). Si la rana es macho, retire con cuidado el testículo y verifique si hay un oviducto vestigial, que puede no ser visible sin aumento (Figura 19).
- Retira los alfileres del animal, colócalo sobre su ventrum y vuelve a sujetar las extremidades del animal.
- Seleccione cualquiera de las extremidades traseras para tomar muestras y sujetar el pie de esa extremidad.
- Retire un colgajo de piel en forma de almendra sobre el gastrocnemio/tibioperoné (Figura 20).
Resultados
Al utilizar la Figura 1 a la Figura 20 y seguir todos los pasos de este protocolo, el ventrículo cardíaco, el lóbulo izquierdo del hígado, el páncreas, los cuerpos grasos izquierdos, los riñones emparejados y un colgajo de piel se extirparon limpiamente dentro de una hora después de la eutanasia. Dentro de este tiempo, las muestras se enjuagan y recortan para que aparezcan, como se muestra en la Figura 21.
Figura 1: Xenopus inmovilizado. Una hembra madura de X. tropicalis clavada a través de cada extremidad. Haga clic aquí para ver una versión más grande de esta figura.
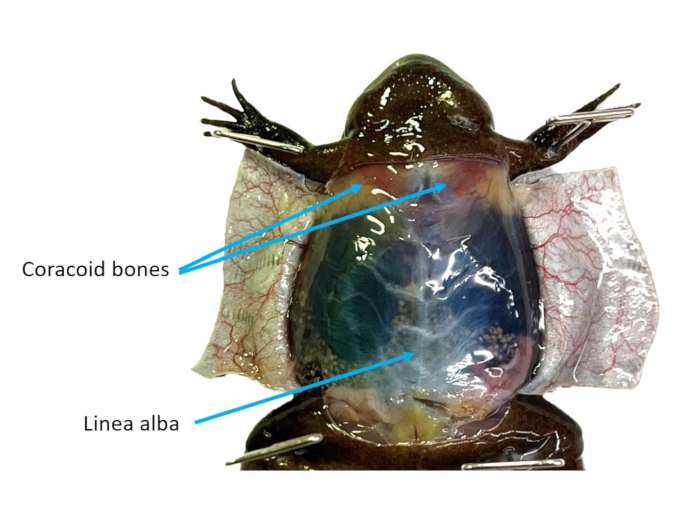
Figura 2: Pared abdominal. La piel ventral de una hembra de X. tropicalis se corta en solapas, lo que hace visibles la línea alba y los huesos coracoides. Haga clic aquí para ver una versión más grande de esta figura.
Figura 3: Corazón encerrado en el pericardio. El vértice del ventrículo cardíaco se agarra a través del pericardio. Haga clic aquí para ver una versión más grande de esta figura.
Figura 4: Ventrículo cardíaco y tronco arterial. El ventrículo de un laevis X perfundido, al ser agarrado, mostrando su unión al tronco arterial. Haga clic aquí para ver una versión más grande de esta figura.
Figura 5: Diagrama del corazón. Diagrama de las estructuras relevantes del corazón con una línea discontinua que indica dónde tomar la muestra del ventrículo. Haga clic aquí para ver una versión más grande de esta figura.
Figura 6: Diagrama hepatopancreático. Diagrama de los 3 lóbulos del hígado, el páncreas y los órganos asociados. Haga clic aquí para ver una versión más grande de esta figura.
Figura 7: Órganos hepatopancreáticos. Un macho perfundido y albino de X. laevis con 3 lóbulos de hígado, páncreas y órganos asociados marcados. Haga clic aquí para ver una versión más grande de esta figura.
Figura 8: Conductos císticos y hepáticos. Se levanta el lóbulo izquierdo del hígado para mostrar los conductos quísticos y hepáticos en X . laevis perfundido. Haga clic aquí para ver una versión más grande de esta figura.
Figura 9: Toma de muestras de hígado. El lóbulo hepático izquierdo de un X. tropicalis no perfundido se corta debajo de las uniones de los conductos hepáticos. Haga clic aquí para ver una versión más grande de esta figura.
Figura 10: Inserción del ovario. Con los lóbulos del ovario en sus respectivos lados, la continuidad del epitelio germinal con la pared peritoneal (sobre los riñones) es visible. Dos líneas discontinuas blancas indican dónde cortar estos adjuntos. Haga clic aquí para ver una versión más grande de esta figura.
Figura 11: Extracción de ovarios. El ovario de un X. laevis no perfundido se separa de los riñones emparejados. Haga clic aquí para ver una versión más grande de esta figura.
Figura 12: Incisiones de mesenterio. Cavidad celómica de un X. laevis no perfundido, tras la toma de muestras del ventrículo cardíaco y del lóbulo izquierdo del hígado, así como la extirpación del ovario. Una línea discontinua blanca indica dónde cortar el ligamento y el conducto hepatopancreático, mientras que una línea discontinua verde indica dónde cortar el páncreas del lóbulo medial del hígado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 13: Toma de muestras de páncreas. El páncreas de un X. laevis sin perfundir está siendo arrancado del estómago. Haga clic aquí para ver una versión más grande de esta figura.
Figura 14: Extracción de órganos. (A) La vejiga urinaria de un X. laevis no perfundido se separa de la cloaca con una línea discontinua que indica dónde cortarla. (B) El intestino grueso de un X. laevis no perfundido, se separa de la cloaca con una línea discontinua que indica dónde cortarlo. Haga clic aquí para ver una versión más grande de esta figura.
Figura 15: Muestreo de grasa corporal. Los cuerpos grasos, unidos al peritoneo en el extremo superior de los riñones emparejados, se extraen de la cavidad celómica con una línea discontinua que muestra dónde cortarlos. Nótese que adyacente a esta fijación, este macho de X. tropicalis tiene 1 testículo, así como un par de oviductos vestigiales distintos. Haga clic aquí para ver una versión más grande de esta figura.
Figura 16: Extracción del oviducto. El oviducto de un X. laevis perfundido se separa del riñón pareado, lo que hace visible el peritoneo transparente. Una línea discontinua indica dónde incidir el peritoneo. Haga clic aquí para ver una versión más grande de esta figura.
Figura 17: Toma de muestras de riñón. Los riñones emparejados de un X. laevis no perfundido se están levantando de la cavidad celómica. Haga clic aquí para ver una versión más grande de esta figura.
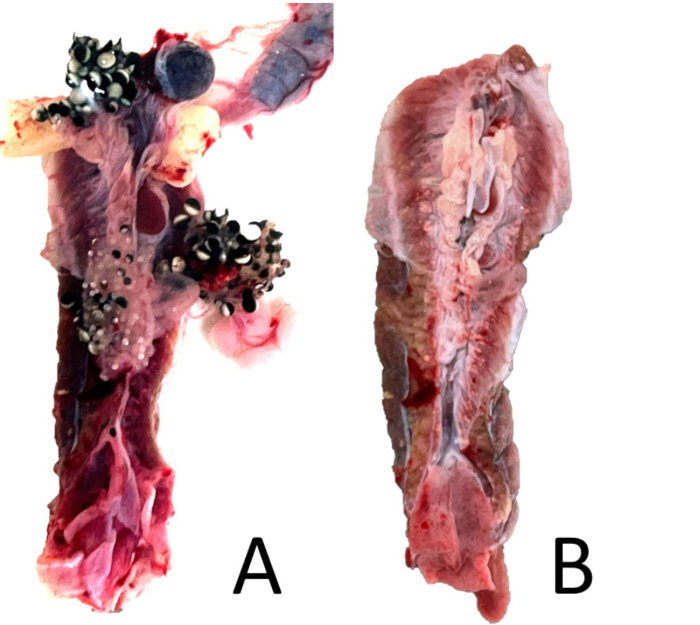
Figura 18: Extirpación del riñón. (A) Una vista ventral del riñón emparejado de una hembra de X. laevis sin perfundir con los órganos peritoneales asociados unidos. (B) El mismo riñón con los órganos asociados extirpados, pero con algo de tejido peritoneal restante. Haga clic aquí para ver una versión más grande de esta figura.
Figura 19: Extirpación de testículos. Los riñones emparejados de X. tropicalis no perfundido con un testículo extirpado. Haga clic aquí para ver una versión más grande de esta figura.
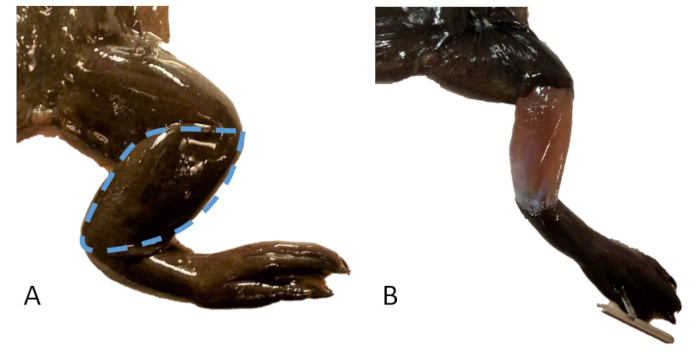
Figura 20: Toma de muestras de piel. (A) La pata derecha de un X. tropicalis con una línea discontinua que indica el área de piel que se va a muestrear. (B) La pata derecha de un X. tropicalis con una muestra de piel extraída sobre el tibiopero. Haga clic aquí para ver una versión más grande de esta figura.

Figura 21: Resultados representativos de la toma de muestras de órganos. Muestras de corazón, ventrículo, hígado, páncreas, cuerpo graso, riñón emparejado y piel tomadas de un albino perfundido y no perfundido X. laevis. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Como este protocolo tiene como objetivo maximizar la frescura, algunas muestras pueden incluir tejidos no deseados. Por ejemplo, el conducto hepatopancreático y parte del mesenterio se muestrean con el páncreas, y parte del tejido peritoneal, las glándulas suprarrenales y los uréteres siempre se muestrearán con los riñones emparejados. Si la frescura no es una preocupación, se puede lograr un muestreo más preciso utilizando técnicas modificadas.
La apariencia y ubicación de los órganos son comparables entre sexos y especies de Xenopus. Sin embargo, el color de los tejidos varía significativamente en función de si los animales han sido perfundidos o no. Es por esta razón que se incluyen imágenes de animales perfundidos y no perfundidos.
Una limitación de este protocolo es que se prioriza la velocidad y la reproducibilidad sobre la recolección de muestras que mejor representen la totalidad del tejido deseado. Por ejemplo, la sección del lóbulo izquierdo del hígado muestreada aquí no puede representar adecuadamente los tres lóbulos del tejido hepático. Si hay errores en el muestreo, las opciones para la resolución de problemas se ven afectadas por la posibilidad de variación entre las diferentes secciones de tejido. Por ejemplo, no se sabe si el lóbulo derecho del hígado, el cuerpo graso correcto o una porción diferente de la piel serían alternativas funcionales a los tejidos deseados. En estos casos, se debe actuar con discreción, en función de las necesidades de la investigación, antes de sustituir secciones de tejido.
Otra limitación de este protocolo es que si los animales que se muestrean tienen defectos anatómicos drásticos o problemas de salud clínicamente significativos, los órganos de la cavidad celómica pueden no aparecer como se describe aquí. Se han encontrado granulomas en los tejidos de ranas infectadas con Mycobacterium spp.11,12, y casos previos de síndrome de hiperestimulación ovárica parecen conducir a una presentación anormal de los órganos13.
Aunque este método ha sido desarrollado para Xenopus de laboratorio, existen similitudes significativas en la apariencia de estos órganos dentro de muchos anfibios no cecilios y reptiles con extremidades. La porción de muestreo de este protocolo podría modificarse fácilmente para otros modelos, como los ajolotes o el anolis verde.
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Este trabajo fue financiado por el R24OD031956 de subvenciones OD de los NIH. Agradecemos a Samantha Jalbert, Jill Ralston y Cora Anderson por su asistencia y apoyo, así como a nuestro editor y revisores anónimos por sus útiles comentarios
Materiales
| Name | Company | Catalog Number | Comments |
| 5x Magnifying Glass with LED Light and Stand | amazon.com | B08QJ6J8P1 | light must not produce heat |
| Disposable Transfer Pipets | VWR | 414004-036 | |
| Dissecting Fine-Pointed Forceps | Fisher Scinetific | 08-875 | |
| Dissecting scissors sharp piont, straight 6.5" | VWR | 76457-374 | |
| Dissection Tray | Fisher Scinetific | 14-370-284 | styrofoam sheets are an acceptable alternative |
| Euthanasia container | US Plastic | Item 2860 | alternative opaque containers acceptable |
| Euthanasia container lid | US Plastic | Item 3047 | |
| Iridectomy Scissors 6" | vwr | 470018-938 | iris scissors are an acceptable alternative |
| MS-222: Syncaine (formerly tricaine) | Pentair AES | TRS1 | |
| PBS 1x | Corning | 21-040-CV | |
| Sodium Bicarbonate, Powder, USP | Fisher Scientific | 18-606-333 | |
| Specimen Forceps, Serrated | VWR | 82027-442 | |
| T-Pins for Dissecting | Fisher Scinetific | S99385 |
Referencias
- Porro, L. B., Richards, C. T. Digital dissection of the model organism Xenopus laevis using contrast-enhanced computed tomography. J Anat. 231 (2), 169-191 (2017).
- Ruehl-Fehlert, C., et al. Revised guides for organ sampling and trimming in rats and mice--part 1. Exp Toxicol Pathol. 55 (23), 91-106 (2003).
- Kittel, B., et al. Revised guides for organ sampling and trimming in rats and mice--Part 2. A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 413-431 (2004).
- Morawietz, G., et al. Revised guides for organ sampling and trimming in rats and mice - Part 3 - A joint publication of the RITA and NACAD groups. Exp Toxicol Pathol. 55, 433-449 (2004).
- Patmann, M. D., Shewade, L. H., Schneider, K. A., Buchholz, D. R. Xenopus tadpole tissue harvest. Cold Spring Harb Protoc. 2017 (11), 097675(2017).
- Lőw, P., Molnár, K., Kriska, G. Dissection of a Frog (Rana sp.). Atlas of Animal Anatomy and Histology. , 213-263 (2016).
- O'Rourke, D. P. Amphibians used in research and teaching. ILAR J. 48 (3), 183-187 (2007).
- Jonas-Closs, R. A., Peshkin, L. Effective rapid blood perfusion in Xenopus. JoVE. (issue), e65287(2023).
- Balls, M., Worley, R. S. Amphibian cells in vitro. II. Effects of variations in medium osmolarity on a permanent cells line isolated from Xenopus. Exp Cell Res. 76 (2), 333-336 (1973).
- Holz, P. H., Raidal, S. R. Comparative renal anatomy of exotic species. Vet North Am Exot Anim Pract. 9 (1), 1-11 (2006).
- Trott, K. A., et al. Characterization of a Mycobacterium ulcerans-like infection in a colony of African tropical clawed frogs (Xenopus tropicalis). Comp Med. 54 (3), 309-317 (2004).
- Fremont-Rahl, J. J., et al. Mycobacterium liflandii outbreak in a research colony of Xenopus (Silurana) tropicalis frogs. Vet Pathol. 48 (4), 856-867 (2011).
- Green, S. L., Parker, J., Davis, C., Bouley, D. M. Ovarian hyperstimulation syndrome in gonadotropin-treated laboratory South African clawed frogs (Xenopus laevis). J Am Assoc Lab Anim Sci. 46 (3), 64-67 (2007).
- Vitt, L. J., Caldwell, J. P. Anatomy of amphibians and reptiles. Herpetol. Herpetol. , 35-81 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados