Method Article
Estabelecimento de organoides tumorais derivados do câncer de pâncreas e fibroblastos a partir de tecido fresco
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os organoides tumorais revolucionaram a pesquisa do câncer e a abordagem da medicina personalizada. Eles representam um modelo de tumor clinicamente relevante que permite aos pesquisadores ficar um passo à frente do tumor na clínica. Este protocolo estabelece organoides tumorais a partir de amostras de tecido tumoral pancreático fresco e xenoenxertos derivados do paciente de origem adenocarcinoma pancreático.
Resumo
Os organoides tumorais são modelos tumorais tridimensionais (3D) ex vivo que recapitulam as características-chave biológicas dos tecidos tumorais primários originais. Organoides tumorais derivados de pacientes têm sido usados em pesquisas translacionais sobre câncer e podem ser aplicados para avaliar a sensibilidade e resistência ao tratamento, interações célula-célula e interações de células tumorais com o microambiente tumoral. Os organoides tumorais são sistemas de cultura complexos que requerem técnicas avançadas de cultura celular e meios de cultura com coquetéis específicos de fatores de crescimento e uma membrana basal biológica que mimetiza o ambiente extracelular. A capacidade de estabelecer culturas de tumores primários depende muito do tecido de origem, da celularidade e das características clínicas do tumor, como o grau tumoral. Além disso, a coleta de amostras de tecido, a qualidade e quantidade do material, bem como o correto biobanco e armazenamento são elementos cruciais desse procedimento. As capacidades técnicas do laboratório também são fatores cruciais a serem considerados. Aqui, relatamos um POP/protocolo validado que é técnica e economicamente viável para a cultura de organoides tumorais ex vivo a partir de amostras de tecido fresco de origem adenocarcinoma pancreático, seja a partir de tecido doador primário ressecado a fresco ou xenoenxertos derivados do paciente (PDX). A técnica aqui descrita pode ser realizada em laboratórios com cultura básica de tecidos e instalações em camundongos e é adaptada para ampla aplicação no campo da oncologia translacional.
Introdução
Os organoides tumorais são culturas tridimensionais (3D) organizadas ex vivo que são derivadas do tecido tumoral fresco e fornecem modelos de câncer. Os organoides tumorais recapitulam as características biológicas fundamentais do tumor primário original1,2,3,4 e podem ser expandidos por até vários meses e criopreservados, semelhante às linhagens celulares imortalizadas convencionais. Os organoides tumorais fornecem um biobanco de modelos tumorais derivados do paciente para medicina translacional/personalizada5 e representam um importante avanço nos sistemas/modelos de biologia de células cancerosas. Organoides tumorais derivados do paciente podem ser usados como modelos ex vivo para predizer a eficácia de terapias oncológicas/farmacológicas (neo)adjuvantes, para as quais culturas são estabelecidas a partir de tecido tumoral fresco e ensaios de sensibilidade a drogas ou farmacotipagem são realizados em uma base específica do paciente para identificar agentes eficazes para linhas de terapiasubsequentes1,4. Além disso, os organoides tumorais superam a limitação da disponibilidade de tecido tumoral primário e, mais importante, fornecem um excelente sistema alternativo ou complementar aos modelos de camundongos in vivo, como os xenoenxertos derivados do paciente (PDX)2. A complexidade dos organoides tumorais aumenta se as células tumorais primárias são combinadas com células estromais encontradas no microambiente tumoral (TME), como fibroblastos associados ao câncer (CAFs), células endoteliais e células imunes, que mimetizam o funcionamento e a complexa celularidade do tumor primário. Organoides tumorais têm sido estabelecidos para vários tipos de tumores utilizando protocolos padronizados6,7,8,9,10. A propagação organoide a partir de diferentes tumores sólidos, incluindo tecido colorretal e câncer de mama, é bem estabelecida e tecnicamente acessível 11,12,13,14,15.
Ressecções cirúrgicas de tumores ou biópsias tumorais fornecem espécimes de tecido tumoral primário. Idealmente, os espécimes de tecido tumoral devem vir do centro da massa tumoral ou da borda invasora do tumor, bem como do tecido de aparência normal adjacente ao tumor. Em comparação com culturas 2D convencionais, os organoides tumorais requerem vários "add-ons", incluindo uma membrana basal biológica (como Matrigel, hidrogel ou um arcabouço à base de colágeno), que imita a TME extracelular, e um meio de crescimento líquido que fornece nutrientes e fatores de crescimento específicos e suporta a proliferação e viabilidade celular em cultura16.
Os passos mais básicos na cultura de células primárias são lavar o tecido em solução salina para evitar contaminação, cortar/digerir mecanicamente o tumor em pequenos pedaços de 1-3 mm3 e tratamento com colagenase para a digestão enzimática do tecido. A mistura digerida é então filtrada para remover grandes fragmentos de tecido, ressuspensa em uma membrana basal biológica como Matrigel, e plaqueada como cúpulas em placas de cultura de baixa fixação para aumentar o crescimento não aderente. As cúpulas da matriz da membrana basal são cobertas com meio de cultura líquido e suplementadas com glutamina e antibióticos para evitar contaminação, bem como com fatores de crescimento específicos dependendo do tipo de tecido 7,8,9,16,17. Outras células relevantes presentes no tumor em massa e na EMT também podem ser isoladas, como fibroblastos associados ao câncer (CAFs) e células imunes. Essa técnica, recentementerevisada18, permite o estabelecimento de coculturas com diferentes tipos celulares para estudar a resposta à terapia em um ambiente tumoral mais "realista". Além disso, as interações célula-célula e a interação entre células tumorais e componentes da matriz biológica circundante podem ser estudadas.
A taxa de sucesso relatada do estabelecimento organoide tumoral usando tecido fresco de biópsias ou tecido tumoral gastrointestinal ressecado é de cerca de 50%11, e a taxa de sucesso deste último é amplamente dependente do tipo e origem dotecido4, particularmente do grau tumoral e da celularidade tumoral global. Modelos tumorais tridimensionais têm complexidade variável, desde agregados unicelulares simples até modelos de engenharia altamente complexos consistindo de vários tipos celulares. A terminologia utilizada para descrever culturas 3D na literatura é altamente inconsistente 19,20,21, pois diferentes termos como esferoides, tumoresferas e organoides são usados, embora a diferença entre eles não seja clara. Como um consenso claro sobre a definição ainda não foi alcançado, neste artigo, um organoide tumoral é descrito como uma cultura de células tumorais organizada embebida em uma membrana basal biológica.
Neste trabalho, um protocolo validado é relatado para o estabelecimento de organoides tumorais a partir de amostras de tecido fresco provenientes de adenocarcinoma ductal pancreático (ADP) primário ressecado ou derivado do PDX, e esse protocolo pode ser realizado na maioria dos laboratórios com instalações básicas de cultura de tecidos. Este protocolo foi adaptado de vários protocolos relatados no estado da arte que são atualmente usados para estabelecer organoides tumorais ou tumoróides a partir do tecido tumoral digestivo dos grupos de David Tuveson9, HansClevers8 e Aurel Perren7.
Este protocolo não discute como o tecido fresco é retirado. Para obter tecido tumoral humano fresco de alta qualidade, é importante ter uma coordenação eficiente entre os cirurgiões que coletam o tecido e o departamento de patologia que extrai a amostra de tecido para cultura de organoides. Da mesma forma, ao usar PDX como fonte de tecido fresco, a coordenação eficiente com a pessoa que coleta a amostra de tecido também é importante. É fundamental obter a amostra de tecido o mais rápido possível (dentro de 30-60 min a partir do momento da colheita), a fim de manter uma alta qualidade.
Protocolo
Todos os procedimentos foram realizados em conformidade com as diretrizes institucionais para o bem-estar dos animais de experimentação aprovadas pelo Comitê de Ética da Universidade Autônoma de Madrid (CEI 103-1958-A337) e La Comunidad de Madrid (PROEX 294/19) e de acordo com as diretrizes de Conduta Ética no Cuidado e Uso de Animais conforme estabelecido nos Princípios Orientadores Internacionais para Pesquisa Biomédica Envolvendo Animais, desenvolvido pelo Conselho das Organizações Internacionais de Ciências Médicas (CIOMS). O protocolo seguiu os princípios éticos para pesquisa biomédica com assinatura do termo de consentimento livre e esclarecido. Obteve-se aprovação ética prévia para o uso de tecido fresco para o estabelecimento das culturas de organoides tumorais. As amostras foram fornecidas pelo BioBank Hospital Ramón y Cajal-IRYCIS (Registro Nacional de Biobancos B.0000678), integrado à Plataforma de Biobancos e Biomodelos do ISCIII (PT20/00045), e processadas seguindo procedimentos operacionais padrão com a devida aprovação ética. Os tumores foram implantados por via subcutânea, como previamente descrito22, em camundongos fêmeas NU-Foxn1nu nuas imunocomprometidas com 6 semanas de idade (ver Tabela de Materiais) e passados in vivo para estabelecer PDXs PDAC.
1. Preparação experimental
- Manusear amostras humanas em um gabinete de biossegurança classe II.
- Use jaleco, luvas de proteção e óculos durante todo o procedimento para evitar a infecção por patógenos transmitidos por tecidos.
NOTA: Um mínimo de 3 h é necessário para processar a amostra de tecido fresco e placa os organoides e fibroblastos. - Processar as amostras de tecido fresco 22 no prazo máximo de24 h após a colheita e armazenar a 4 °C em meio de cultura de tecidos (DMEM suplementado com FBS a 10% e penicilina-estreptomicina a 1%) até o processamento.
- Mantenha todas as amostras e reagentes no gelo durante todo o procedimento e certifique-se de pré-ajustar uma centrífuga refrigerada a 4 °C e usá-la em baixa velocidade para evitar danificar a preparação celular.
- Guarde as pontas das pipetas P1.000 e P200 em um freezer de −20 °C para usar durante o protocolo.
- Alíquota da matriz da membrana basal (ver Tabela de Materiais) antes do uso. Para esse protocolo, recomendam-se alíquotas de 250 mL.
2. Processamento de tecido tumoral primário fresco para estabelecer organoides tumorais e fibroblastos primários
NOTA: Um mínimo de 3 h é necessário para processar a amostra de tecido fresco (tumores humanos ressecáveis primários ou PDXs) e para plaquear os organoides tumorais e fibroblastos. Um esboço do processo de preparação dos organoides é mostrado na Figura 1, desde a digestão dos tecidos até o plaqueamento dos organoides tumorais. Antes de iniciar o protocolo, retire uma alíquota da matriz da membrana basal do freezer de -20 °C e deixe-a no gelo por aproximadamente 30-60 minutos antes do uso.
- Colocar uma placa de cultura de 6 poços em uma incubadora de cultura celular a 37 °C 3 h antes de plaquear os organoides.
- Medir, fotografar e lavar o tecido (passo 1.3) com 3 mL de DMEM-F12 Avançado (Meio de Águia Modificado de Dulbecco (DMEM)/Mistura de Nutrientes F-12 Ham (F12), suplementado com 5% de soro fetal bovino (FBS), 15 mM Hepes, 1% L-Glutamina, 1% Penicilina-Estreptomicina, 125 ng/mL Anfotericina B, 0,1 mg/mL Normocina) (ver Tabela de Materiais) pipetando para cima e para baixo e, em seguida, lavar com 3 mL de solução salina tamponada com fosfato (PBS) pipetando para cima e para baixo.
- Retirar o meio por aspiração da placa de cultura de tecidos e cortar o tecido em pedaços de 1 mm3 em uma placa de cultura de tecido estéril usando duas lâminas estéreis e 2 mL de meio de digestão (DMEM-F12 avançado + 10 mg de colagenase IV/mL, 0,000625% de tripsina-EDTA e 10 μg/mL de DNase). Recolher o tecido num tubo de 50 ml com 5 ml de meio de digestão total e incubar durante 1 h a 37 °C com digestão mecânica com equipamento comercialmente disponível (ver Tabela de Materiais) ou com mistura periódica da amostra, pipetando a amostra para cima e para baixo.
- Adicionar 5 mL de DMEM-F12 avançado para inativar a tripsina e filtrar a amostra através de um filtro de poros de 70 μm para remover grandes detritos.
- Adicionar 2 mL de DMEM com FBS a 10% na parte superior do filtro e coletar os restos de detritos e tecidos para estabelecer culturas de fibroblastos (ver etapa 5).
- Centrifugar o filtrado a 200-300 x g por 5 min à temperatura ambiente, e aspirar o sobrenadante, deixando apenas o pellet celular. Adicionar 5 mL de DMEM-F12 avançado e centrifugar por 5 min a 300 x g.
- Ressuspender o pellet em 4 mL de tampão de lise de cloreto de amônio e potássio (ACK, ver Tabela de Materiais). Passar a mistura para um tubo de 15 ml e incubar à temperatura ambiente durante 2 minutos para lisar os glóbulos vermelhos.
NOTA: Esta etapa de lise de glóbulos vermelhos pode ser removida quando não há evidência visível de contaminação. - Centrifugar a 300 x g por 5 min à temperatura ambiente e aspirar o sobrenadante. Adicionar 5 mL de DMEM-F12 avançado e centrifugar por 5 min a 300 x g.
- Adicionar 1 ml de reagente de dissociação celular comercialmente disponível (ver Tabela de Materiais) suplementado com DNase (1 μg/ml) ao pellet celular e incubar durante 2-3 minutos à temperatura ambiente.
- Centrifugar a 300 x g por 5 min e aspirar o sobrenadante. Adicionar 5 mL de DMEM-F12 avançado e ressuspender o pellet de células.
- Pipetar para cima e para baixo 30 vezes com uma pipeta P1.000 para dissociar as células, centrifugar por 5 min a 300 x g e remover o sobrenadante.
- Pegue as pontas das pipetas P1.000 e P200 do freezer de -20 °C e ressuspenda o pellet de células na matriz de membrana usando uma pipeta P1.000 e pontas frias (50 μL por gota, levando em conta o volume do pellet, seis a sete cúpulas por poço). Retire a placa previamente aquecida da incubadora. Ajuste uma pipeta P200 para 48 μL e use pontas frias para criar cúpulas da matriz da membrana basal na placa de 6 poços pré-aquecida.
- Coloque a placa com as cúpulas de células da matriz da membrana basal na incubadora de 37 °C 5% CO2 por 15 minutos para solidificar a matriz da membrana basal.
- Adicionar 2-2,5 mL de DMEM-F12 avançado, suplementado com 20 ng/mL de fator de crescimento epidérmico humano recombinante (EGF), 100 ng/mL de fator de crescimento da placenta humana (PlGF), 10 ng/mL de fator de crescimento básico de fibroblastos humanos recombinante (bFGF), 769 ng/mL de fator de crescimento semelhante à insulina 1 (IGF-1) e 10,5 μM de inibidor de ROCK (DMEM-F12 avançado + fatores de crescimento) (ver Tabela de Materiais).
3. Monitoramento dos organoides
- Monitorar visualmente a cultura organoide tumoral nos primeiros 7 dias e, posteriormente, três vezes por semana.
- Troque o meio duas vezes por semana com DMEM-F12 avançado contendo 20 ng/mL de fator de crescimento epidérmico humano recombinante (EGF), 100 ng/mL de fator de crescimento da placenta humana (PlGF), 10 ng/mL de fator de crescimento básico de fibroblastos humanos recombinante (bFGF), 769 ng/mL de fator de crescimento semelhante à insulina 1 (IGF-1) e 10,5 μM de inibidor de ROCK (DMEM-F12 avançado + fatores de crescimento).
- Capturar imagens da cultura organoide tumoral periodicamente nos dias 1, 3, 7, 10 e 15 dias após o processamento da amostra e plaqueamento da cultura na matriz para observar o crescimento e a viabilidade.
4. Passagem e crioarmazenamento dos organoides
- Retire o meio de cultura da placa de 6 poços.
- Adicionar 1 ml de um reagente de recuperação celular adequado (ver Tabela de Materiais) para dissociar a matriz da membrana basal e obter uma suspensão celular, e recuperar o sobrenadante num tubo de 15 ml. Se a matriz não se dissociar imediatamente, incubar a amostra a 4 °C durante 15-20 min até se dissolver completamente.
- Adicionar 1 ml do mesmo reagente de recuperação celular utilizado no passo 4.2 ao orifício da placa para recuperar células dissociadas adicionais e adicionar o sobrenadante ao mesmo tubo de 15 ml do passo 4.2.
- Adicionar 5 mL de DMEM-F12 frio e centrifugar a 200 x g por 5 min.
- Retire o sobrenadante e seque o pellet cuidadosamente, removendo qualquer líquido restante com uma pipeta de 5 mL; Evite ao máximo movimentar o tubo. Ressuspender o pellet celular em duas vezes o volume original da matriz da membrana basal para obter uma passagem de 1:2.
- Para o crioarmazenamento das culturas organoides, ressuspender o pellet obtido na etapa 4,5 em 1 mL de meio de congelamento (DMSO 10%, FBS 20%, DMEM-F12 50%, inibidor ROCK 10,5 μM) e armazenar a −80 °C.
NOTA: O volume da matriz da membrana basal pode ser ajustado para realizar diferentes passagens, como 1:1 (usando o mesmo volume da matriz da membrana basal que o original) ou 1:3 (adicionando três vezes o volume original da matriz da membrana basal).
5. Estabelecimento de fibroblastos
- Após recuperar os detritos e restos teciduais em 2 mL de DMEM com SFB a 10%, adicioná-lo a uma placa de 6 poços e incubar a 37 °C com CO2 a 5%.
- Remover os restos de tecido das culturas de fibroblastos da etapa 2.5 pela aspiração do meio 2 dias ou 3 dias após o plaqueamento, e substituir por DMEM fresco com SFB a 10%.
- Monitorar visualmente a cultura de fibroblastos três vezes por semana e trocar o meio de cultura pelo menos duas vezes por semana usando DMEM suplementado com SFB a 10%.
Resultados
É importante documentar como a cultura organoide tumoral progride ao longo do tempo, particularmente nas primeiras semanas, a fim de estimar como a cultura se comportará nos ensaios a jusante. A Figura 2 mostra um exemplo de ótimo isolamento de células tumorais e estabelecimento de organoides tumorais a partir de tecido fresco durante um período de 15 dias. Às vezes, há um grande volume de restos celulares na amostra, e é difícil visualizar os organoides tumorais em desenvolvimento, como mostra a Figura 3. Além disso, o fenótipo dos organoides em desenvolvimento pode variar de organoides isolados e arredondados (Figura 4A) a culturas esferoides/agregadas (Figura 4B-D), e isso depende da origem do tumor. Os fibroblastos são um subproduto comum do estabelecimento de cultura de células tumorais primárias de tumores sólidos, especialmente aqueles com alto conteúdo de estroma, e muitas vezes podem contaminar a cultura de organoides. A Figura 5 mostra como essas células migraram das cúpulas da matriz da membrana basal e aderiram às placas de cultura após aproximadamente 7 dias. Essas células consomem os nutrientes do meio de cultura, comprometendo o crescimento ideal dos organoides.
Os fibroblastos primários podem ser obtidos como cultura isolada quando migram para fora dos cortes teciduais, aderem às placas de cultura e crescem como cultura monocamada, como mostra a Figura 6. Este protocolo recomenda o uso de meio DMEM padrão com SFB a 10% para a cultura dos fibroblastos. No entanto, um meio especializado para fibroblastos também pode ser usado. Os fibroblastos aderidos são visíveis aproximadamente 7 dias após o plaqueamento (Figura 6).

Figura 1: Processamento de amostras de tecido fresco para estabelecimento de organoides tumorais. Um esboço do processo de preparação de organoides tumorais é mostrado, desde a digestão do tecido até o plaqueamento dos organoides. Clique aqui para ver uma versão maior desta figura.

Figura 2: Cultura organoide tumoral estabelecida a partir de PDX originado de tumor PDAC fresco. A progressão da cultura organoide tumoral ao longo de vários dias é mostrada, com imagens dos organoides em um plano microscópico nos dias 1, 3, 7, 10 e 15. Barra de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Exemplos de cultura organoide tumoral não ótima no dia 2 com excesso de debris celulares. Barra de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Organoides tumorais estabelecidos de diferentes tecidos PDAC PDX mostrando diferenças de tamanho e morfologia. Os organoides tumorais podem ter um fenótipo arredondado clássico (A) ou (B-D) uma aparência mais esferoide/agregada. O tamanho médio dos organoides varia de 80 uM a 100 uM, embora alguns organoides possam ser tão grandes quanto 200 uM. Barra de escala: 20 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Exemplos de cultura organoide tumoral (A-C) não ótima contaminada com CAFs/fibroblastos após 30 dias em cultura. Barra de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
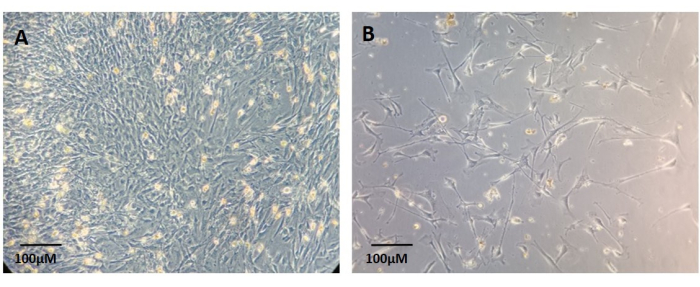
Figura 6: Exemplos de culturas primárias de fibroblastos estabelecidas a partir dos remanescentes do tecido tumoral primário digerido . (A) Cultura confluente. (B) Cultura não confluente. Barra de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Solução de problemas do estabelecimento de cultura de organoides tumorais. Clique aqui para baixar este arquivo.
Discussão
Grandes avanços nas terapias farmacológicas do câncer são desafiadores, pois a probabilidade de aprovação de fármacos em ensaios clínicos oncológicos de fase I é de 5,1%, sendo a menor de todos os tipos dedoenças23. A principal razão é que o câncer é muito heterogêneo e, portanto, as coortes de pacientes não respondem uniformemente como esperado ao tratamento dado, o que destaca que uma abordagem mais personalizada é necessária. Culturas bidimensionais (2D) têm sido usadas em pesquisas translacionais sobre câncer há muitos anos, mas carecem da organização 3D estrutural encontrada em tumores primários. Assim, não refletem com precisão as respostas terapêuticas dos pacientes e a comunicação das células tumorais entre si ou com seu microambiente 3,23. O princípio central subjacente de todos os sistemas de cultura 3D é promover a interação celular com o ambiente e organizar as células de maneira espacialmente relevante, semelhante ao tumor primário (in situ). A morfologia dos organoides tumorais varia de redonda, de massa e semelhante à uva a estrelada, dependendo da natureza inerente das células cultivadas e das condições de cultivo utilizadas, como mostrado na Figura 4. Culturas estabelecidas de organoides tumorais derivadas do paciente podem ser tratadas com o mesmo tratamento de primeira linha usado no paciente para confirmar que o organoide tumoral recapitula a situação clínica (ou seja, a resposta à terapia clínica)1,13,24,25.
Os organoides tumorais também podem ser tratados com novos agentes farmacológicos, o que fornece uma abordagem exploratória para identificar novas terapias que poderiam ser usadas em linhas de tratamento subsequentes na clínica quando as opções de terapia padrão tiverem sido esgotadas. A cultura é monitorada continuamente para avaliar a resposta das culturas de organoides tumorais ao agente em tempo real. Um estudo de viabilidade da caracterização molecular e imuno-histoquímica de tumores de xenoenxerto derivados de pacientes (PDX) e organoides derivados de PDX mostrou que a morfologia, expressão proteica e alterações genômicas foram comparáveis entre os dois modelos. Além disso, um estudo de prova de conceito de farmacotipagem mostrou que as predições in vivo e ex vivo também foram comparáveis e, portanto, concluiu que o uso de organoides tumorais como modelo de câncer/doença é uma abordagem viável e robusta que pode ser aplicada no cenário clínico2.
Uma série de desafios relacionados ao estabelecimento de culturas de organoides tumorais provenientes de diferentes tipos tumorais tem sido destacada e recentemente revisada26,27,28. As questões-chave incluem a "contaminação/supercrescimento" por células saudáveis, que formam organoides com uma taxa de crescimento mais alta do que as células cancerosas, o alto custo de manutenção da cultura em comparação com culturas 2D, a baixa taxa de estabelecimento, inconsistências no perfil de mutação somática e histologia entre a cultura ex vivo e o tumor de origem, heterogeneidade do tumor primário, o uso de uma matriz extracelular baseada em murina, que pode não ser ideal para células humanas e pode impedir a liberação de fármacos, a ausência de ETM e células associadas, a interferência de fatores de crescimento ou inibidores moleculares na resposta ao fármaco e a falta de protocolos padronizados e validados para o estabelecimento e manutenção de organoides tumorais. No entanto, ao longo dos anos, o uso de modelos de tumores primários na pesquisa do câncer tem aumentado, e as técnicas de cultivo e manutenção de culturas primárias têm melhorado. Estas delicadas culturas ex vivo são estabelecidas e mantidas pela adição de suplementos para promover o crescimento celular e estabilidade. O inibidor de Rho quinase (ROCK) é agora rotineiramente adicionado às culturas primárias para evitar a apoptose e aumentar a adesão célula-célula, promovendo assim a expansão a longo prazo de culturas primárias estáveis in vitro 29. Além disso, também aumenta a sobrevivência de células-tronco criopreservadas descongeladas, o que é importante na geração de estoques congelados de culturas organoides29. A suplementação com heparina também pode ser utilizada para potencializar a expansão das células-tronco, aumentando a sinalização WNT e FGF e, assim, a proliferação celular30. Outros reagentes importantes utilizados neste protocolo validado para otimizar o estabelecimento organoide tumoral incluem a Accutase e a DNase. A accutase é um reagente de digestão suave recomendado para segregar células-tronco individuais ou descolá-las das superfícies de cultura, e ajuda a manter a viabilidade celular melhor do que o uso de outros reagentes projetados para esse fim, como a tripsina31. No entanto, as colagenases também podem ser usadas para atingir especificamente o tipo de colágeno incorporado à membrana basal biológica. A DNase tem sido utilizada em métodos de isolamento celular há muitos anos32 para eliminar restos de DNA de células mortas e necróticas durante o protocolo de extração e, assim, prevenir a aglomeração/agregação de células devido ao aumento da viscosidade do preparo da amostra. Os pellets celulares são frequentemente tratados com tampão de lise, mas essa etapa pode ser excluída quando não há evidência visível de contaminação de hemácias da amostra de tecido8 (Arquivo Suplementar 1).
O estabelecimento bem sucedido de organoides tumorais não vem sem complicações biológicas inerentes. Idealmente, os tecidos para culturas de organoides tumorais devem ser processados no mesmo dia da colheita para otimizar a viabilidade celular. O congelamento de tecidos nem sempre é recomendado, pois pode reduzir significativamente a viabilidade celular. Entretanto, organoides tumorais podem ser estabelecidos utilizando-se amostras congeladas ou criopreservadas lentamente em meio de congelamento contendo DMSO33,34, o que permite o envio de amostras e biobanco. Em alguns casos, é possível obter culturas 2D a partir de culturas de organoides tumorais que foram passadas várias vezes pela recuperação das células tumorais aderidas às placas após a remoção das cúpulas da matriz da membrana basal. Em nossa experiência, a taxa de sucesso do estabelecimento organoide tumoral é muito maior com tecido PDX PDAC do que com tecido PDAC fresco derivado de um espécimeressecado4. Isso se deve ao fato de que pedaços maiores de tecido PDX PDAC fresco estão geralmente disponíveis, e esse tecido tem maior celularidade, provavelmente devido ao ambiente in vivo mais hospitaleiro fornecido pelo modelo PDX em comparação com abordagens ex vivo. Agentes atóxicos podem ser adicionados ao meio de cultura para monitorar a viabilidade celular e a proliferação da cultura. Além disso, o crescimento excessivo de organoides não neoplásicos deve ser evitado com condições seletivas35,36. O tecido pancreático pode conter enzimas digestivas que podem afetar a viabilidade das células tumorais isoladas; Assim, a tripsina pode ser adicionada à etapa de digestão para superar esse problema4. Muitos outros fatores, como o estado do paciente/tecido (isto é, tratado ou não com terapia oncológica), o tipo de tumor, a contaminação da amostra da sala de cirurgia e o grau original do tumor, também podem influenciar significativamente a capacidade de estabelecer um organoide tumoral. Da mesma forma, nem todo tecido possui células tumorais viáveis suficientes para estabelecer culturas primárias. Isso é particularmente verdadeiro para tumores PDAC, que são notoriamente ricos em estroma (aproximadamente 90%-95%) e contêm uma pequena porcentagem de células tumorais epiteliais. Além disso, tecidos com alto conteúdo de estroma podem ser difíceis de cortar e dissociar para obter células tumorais únicas para cultura. Meios de digestão especializados e comercialmente disponíveis podem ser adicionados, ou equipamentos de dissociação mecânica também podem ser usados se o tecido não for totalmente digerido. Alternativamente, uma dissociação completa do tecido pode ser obtida pelo corte contínuo usando duas lâminas de bisturi até que o tecido tenha uma aparência semilíquida (veja a demonstração em vídeo).
Há muitas armadilhas técnicas durante o procedimento que também devem ser destacadas. Por exemplo, restos de tecido podem bloquear o filtro, e o filtro deve então ser trocado, pois os restos impedem a passagem do sobrenadante líquido. A etapa de filtração pode ser repetida várias vezes para recuperar a quantidade máxima de células tumorais dissociadas. Além disso, é importante verificar a pastilha de células após cada etapa de centrifugação, pois às vezes é difícil ver quando há um número baixo de células. A pipetagem dos pellets celulares deve ser realizada de forma suave e lenta, pois a pipetagem agressiva pode resultar em perda de células ou redução da viabilidade celular. Além disso, ao preparar a mistura matriz-célula, deve-se usar meios pré-resfriados a 4 °C e pontas refrigeradas armazenadas a -20 °C, pois a matriz se solidifica rapidamente. Finalmente, e como mencionado acima, DNase ajuda a prevenir a aglomeração de células durante a preparação da amostra. A aliquota dos reagentes utilizados no protocolo e o preparo de misturas de fatores de crescimento também são recomendados para evitar o congelamento-descongelamento repetitivo dos reagentes.
O isolamento de fibroblastos primários é de interesse, pois eles são um tipo celular importante no ADP e podem ser usados para experimentos subsequentes de co-cultura para determinar os efeitos da ETM no crescimento de células tumorais. Após cerca de 1 semana, os fibroblastos migraram para fora dos cortes de tecido e geralmente podem ser vistos aderidos às placas de cultura e crescendo como uma cultura de monocamada. Entretanto, a presença de fibroblastos na cultura também apresenta desvantagens, pois consomem os nutrientes do meio de cultura e, assim, comprometem o crescimento ótimo dos organoides tumorais. Placas de fixação ultrabaixa (ULA) são frequentemente recomendadas para a cultura de organoides tumorais para limitar o crescimento de fibroblastos, pois se ligam facilmente a placas padrão tratadas com cultura celular. Este protocolo validado recomenda o uso de meios DMEM padrão com SFB a 10% para a cultura de fibroblastos primários, embora meios especializados para fibroblastos também possam ser usados.
É importante documentar o estado da cultura organoide tumoral ao longo do tempo, especialmente durante a primeira semana, pois a cultura se comporta de forma diferente dependendo da qualidade, quantidade e fonte do tecido (tumores humanos ressecáveis primários versus PDXs). Agentes atóxicos podem ser adicionados ao meio de cultura para monitorar a viabilidade celular e a proliferação da cultura. As culturas devem ser monitoradas visualmente diariamente durante os primeiros 7 dias e depois duas a três vezes por semana. Além disso, o meio deve ser trocado a cada 4-5 dias ou quando parecer ácido (aparece amarelo), tomando cuidado para não danificar as cúpulas da matriz da membrana basal. No início, grandes aglomerados marrons podem aparecer devido a uma alta densidade celular. No entanto, este deve desaparecer após a primeira passagem, permitindo assim que organoides tumorais claramente definidos sejam obtidos em um fundo claro da matriz da membrana basal. Recomenda-se tirar fotografias dos organoides tumorais, especialmente durante as primeiras 3 semanas, a fim de determinar o fenótipo visual e a taxa de crescimento dos organoides tumorais. A passagem da cultura de organoides tumorais também é um desafio técnico. Geralmente, o meio de cultura é removido e as cúpulas da matriz são desassociadas com reagentes à base de tripsina ou especializados a 4 °C até que a matriz da membrana basal se dissolva completamente. O pellet de célula é então ressuspendido em matriz fresca, e o volume é ajustado para realizar a passagem desejada, como 1:1 (usando o mesmo volume de matriz do original) ou 1:3 (adicionando três vezes o volume original da abordagem). O grupo de David Tuveson, composto por especialistas em organoides pancreáticos, fornece recursos on-line com protocolos para estabelecer, manter e colorir organoides pancreáticos37.
Os organoides tumorais ex vivo derivados do paciente fornecem um modelo pré-clínico valioso para avaliar a sensibilidade ao tratamento específico do paciente para aplicação em medicina personalizada. Além disso, esses modelos são modelos tumorais fisiologicamente mais relevantes em comparação com as tradicionais monocamadas de células aderentes 2D. Uma nomenclatura clara e consistente de modelos tumorais 3D com acompanhamento periódico fotográfico e descritivo da cultura é necessária no campo do modelo tumoral. Além disso, trabalhar com protocolos padronizados é de extrema importância para o sucesso dessa tecnologia na clínica na determinação da sensibilidade a drogas em uma base específica para o paciente. Os pesquisadores que utilizam essa tecnologia devem estar cientes dos obstáculos e armadilhas desses modelos sensíveis e complexos. No entanto, trabalhar com um protocolo validado e condições claramente definidas e opções de solução de problemas ajudará a evitar problemas técnicos e otimizar o estabelecimento e a manutenção da cultura. Aqui, um protocolo validado é fornecido para estabelecer organoides tumorais e isolar fibroblastos que pode ser prontamente implementado em muitos laboratórios de oncologia translacional com equipamento padrão e experiência em cultura de tecidos.
Divulgações
Nenhum.
Agradecimentos
Este estudo foi apoiado pelo financiamento da Plataforma biobancos y biomodelos - Unidades de las Plataformas ISCIII de apoyo ala I+D+i en Biomedicina y Ciencias de la Salud (PT20/00045), Programa de Investigação e Inovação Horizonte 2020 da União Europeia ao abrigo do acordo de subvenção n.º 857381, projeto VISION (Estratégias para reforçar a excelência científica e a capacidade de inovação para o diagnóstico precoce de cancros gastrointestinais), Chamada intramuros para novos projetos de pesquisa para pesquisadores clínicos e grupos de pesquisa emergentes IRYCIS (2021/0446), Projeto Organoides Derivados do Paciente 2.0 (CIBERONC) e o projeto TRANSCAN II JTC 2017 chamada "Estabelecendo um algoritmo para o diagnóstico precoce e acompanhamento de pacientes com tumores neuroendócrinos pancreáticos (NExT)", número de concessão 1.1.1.5/ERANET/20/03. As amostras biológicas utilizadas neste protocolo foram cedidas pelo BioBank Hospital Ramón y Cajal-IRYCIS (B.0000678) e integradas à Plataforma de Biobancos e Biomodelos do ISCIII (PT20/00045). Também gostaríamos de agradecer a Yvonne Kohl, Agapi Kataki Vita Rovita e Thorsten Knoll por seu inestimável apoio para desenvolver este protocolo como parte dos projetos NExT e VISION.
Materiais
| Name | Company | Catalog Number | Comments |
| 6 well Costar Ultra-low Attachment plates | Biofil | TCP011006 | |
| 70 μm pore strainer | VWR | 732-2758 | |
| Ammonium Chloride Potassium (ACK) Lysis Buffer | Gibco | A10492-01 | |
| Amphotericin B | Gibco | 15290018 | |
| Cell culture incubator (21% O2, 5% CO2 and 37 ºC) | Nuaire | NU-4750E | |
| Cell recovery solution | Corning | 354253 | |
| Collagenase IV | Gibco | 17104019 | |
| DMEM/F-12 (1:1)(1X) with L-Glutamine and HEPES | Gibco | 31330-038 | |
| DNase | Roche | 10104159001 | |
| Fetal Bovine Serum (FBS) | Corning | 35-079-CV | |
| Freezing container, Nalgene | Merck | C1562 | |
| gentleMACS Octo Dissociator | Milteny Biotec | 130-096-427 | |
| HEPES | Gibco | 15630056 | |
| Human Placenta Growth Factor (PlGF) | enQuireBio | QP6485-EC-100UG | |
| Immunocompromised female 6-week-old NU-Foxn1nu nude mice | Janvier, France | ||
| Insulin-like growth factor-1 (IGF-1) | Invitrogen | RP10931 | |
| L-Glutamine | Corning | 354235 | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| Normocin | InvivoGen | ant-nr-2 | |
| Pasteur pipettes | Deltalab | 200007 | |
| Penicillin Streptomycin Solution (100x) | Corning | 30-002-CI | |
| Phosphate-Buffered Saline (PBS) | Corning | 21-040-CV | |
| Recombinant Human Basic Fibroblast Growth Factor (bFGF) | Gibco | PHG0026 | |
| Recombinant Human Epidermal Growth Factor (EGF) | Gibco | PHG0311 | |
| ROCK Inhibitor Y-27632 (Dihydrochloride) | STEMCELL | 72304 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | |
| Surgical Blades | Nahita | FMB018 | |
| Trypsin | Gibco | 25300054 |
Referências
- April-Monn, S. L., et al. Patient-derived tumoroids of advanced high-grade neuroendocrine neoplasms mimic patient chemotherapy responses and guide the design of personalized combination therapies. bioRxiv. , (2022).
- Frappart, P. O., et al. Pancreatic cancer-derived organoids - A disease modeling tool to predict drug response. United European Gastroenterology Journal. 8 (5), 594-606 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Aberle, M. R., et al. Patient-derived organoid models help define personalized management of gastrointestinal cancer. The British Journal of Surgery. 105 (2), e48-e60 (2018).
- Yoshida, G. J. Applications of patient-derived tumor xenograft models and tumor organoids. Journal of Hematology & Oncology. 13 (1), 4 (2020).
- Hong, H. K., et al. Efficient primary culture model of patient-derived tumor cells from colorectal cancer using a Rho-associated protein kinase inhibitor and feeder cells. Oncology Reports. 42 (5), 2029-2038 (2019).
- April-Monn, S. L., et al. 3D primary cell culture: A novel preclinical model for pancreatic neuroendocrine tumors (PanNETs). Neuroendocrinology. 111 (3), 273-287 (2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), e106 (2020).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 5739 (2020).
- Yu, J., Huang, W. The progress and clinical application of breast cancer organoids. International Journal of Stem Cells. 13 (3), 295 (2020).
- Barbáchano, A., et al. Organoids and colorectal cancer. Cancers. 13 (11), 2657 (2021).
- Michels, B. E., et al. Human colon organoids reveal distinct physiologic and oncogenic Wnt responses. Journal of Experimental Medicine. 216 (3), 704-720 (2019).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Porter, R. J., Murray, G. I., McLean, M. H. Current concepts in tumour-derived organoids. British Journal of Cancer. 123 (8), 1209-1218 (2020).
- Wang, Q., Guo, F., Jin, Y., Ma, Y. Applications of human organoids in the personalized treatment for digestive diseases. Signal Transduction and Targeted Therapy. 7 (1), 336 (2022).
- Wang, J., et al. Patient-derived tumor organoids: New progress and opportunities to facilitate precision cancer immunotherapy. Frontiers in Oncology. 12, 1382 (2022).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17 (1), 1-15 (2015).
- Marsee, A., et al. Building consensus on definition and nomenclature of hepatic, pancreatic, and biliary organoids. Cell Stem Cell. 28 (5), 816-832 (2021).
- Mueller, M. T., et al. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 137 (3), 1102-1113 (2009).
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. 20 (2), 273-286 (2019).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Chen, P., et al. Patient-derived organoids can guide personalized-therapies for patients with advanced breast cancer. Advanced Science. 8 (22), 2101176 (2021).
- Furbo, S., et al. Use of patient-derived organoids as a treatment selection model for colorectal cancer: A narrative review. Cancers. 14 (4), 1069 (2022).
- Xu, H., Jiao, D., Liu, A., Wu, K. Tumor organoids: Applications in cancer modeling and potentials in precision medicine. Journal of Hematology & Oncology. 15 (1), 58 (2022).
- Xu, H., et al. Organoid technology in disease modelling, drug development, personalized treatment and regeneration medicine. Experimental Hematology & Oncology. 7 (1), 30 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Ling, L., et al. Effect of heparin on the biological properties and molecular signature of human mesenchymal stem cells. Gene. 576, 292-303 (2016).
- Bajpai, R., Lesperance, J., Kim, M., Terskikh, A. V. Efficient propagation of single cells Accutase-dissociated human embryonic stem cells. Molecular Reproduction and Development. 75 (5), 818-827 (2008).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Walsh, A. J., et al. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889 (2016).
- Bui, B. N., et al. Organoids can be established reliably from cryopreserved biopsy catheter-derived endometrial tissue of infertile women. Reproductive BioMedicine Online. 41 (3), 465-473 (2020).
- Verissimo, C. S., et al. Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening. eLife. 5, e18489 (2016).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Protocols for Generating, Manipulating, and Analyzing Pancreatic Organoid Cultures. Cold Spring Harbor Laboratory. Tuveson Lab Available from: https://tuvesonlab.labsites.cshl.edu/protocolsreagents/ (2023)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados