Method Article
膵臓癌由来腫瘍オルガノイドおよび線維芽細胞の新鮮組織からの樹立
* これらの著者は同等に貢献しました
要約
腫瘍オルガノイドは、がん研究と個別化医療へのアプローチに革命をもたらしました。これらは、臨床的に関連性のある腫瘍モデルであり、研究者は診療所で腫瘍の一歩先を行くことができます。このプロトコルは、新鮮な膵臓腫瘍組織サンプルおよび膵臓腺癌起源の患者由来の異種移植片から腫瘍オルガノイドを確立します。
要約
腫瘍オルガノイドは、元の原発腫瘍組織の生物学的重要な特徴を再現する3次元(3D) ex vivo 腫瘍モデルです。患者由来の腫瘍オルガノイドは、トランスレーショナルがん研究で使用されており、治療の感受性と抵抗性、細胞間相互作用、および腫瘍微小環境との腫瘍細胞相互作用の評価に適用できます。腫瘍オルガノイドは複雑な培養系であり、高度な細胞培養技術と、特定の成長因子カクテルを用いた培地、および細胞外環境を模倣した生物学的基底膜が必要です。原発腫瘍培養を確立する能力は、起源組織、細胞性、および腫瘍の悪性度などの腫瘍の臨床的特徴に大きく依存します。さらに、組織サンプルの収集、材料の質と量、および正しいバイオバンクと保管は、この手順の重要な要素です。また、研究所の技術力も重要な要素です。ここでは、膵臓腺癌由来の新鮮な組織サンプルからの ex vivo 腫瘍オルガノイドの培養に技術的および経済的に実行可能な検証済みのSOP/プロトコルを報告します。本明細書に記載の技術は、基本的な組織培養およびマウス設備を有する実験室で実施することができ、トランスレーショナル腫瘍学分野における幅広い応用のために調整される。
概要
腫瘍オルガノイドは、新鮮な腫瘍組織に由来するex vivoの3次元(3D)組織化培養物であり、がんモデルを提供します。腫瘍オルガノイドは、元の原発腫瘍の生物学的重要な特徴を再現しており1,2,3,4、従来の不死化細胞株と同様に、最大数ヶ月間増殖して凍結保存することができます。腫瘍オルガノイドは、トランスレーショナル/個別化医療5のための患者由来腫瘍モデルのバイオバンクを提供し、がん細胞生物学システム/モデルにおける重要な進歩を表しています。患者由来の腫瘍オルガノイドは、新鮮な腫瘍組織から培養を確立し、その後の治療ラインに有効な薬剤を特定するために患者固有のベースで薬物感受性アッセイまたは薬物型決定が実施される(ネオ)アジュバント腫瘍学的/薬理学的治療の有効性を予測するためのex vivoモデルとして使用できます1,4.さらに、腫瘍オルガノイドは、原発腫瘍組織の利用可能性の限界を克服し、さらに重要なことに、患者由来異種移植片(PDX)などのin vivoマウスモデルに対する優れた代替または補完的なシステムを提供します2。原発腫瘍細胞が、がん関連線維芽細胞(CAF)、内皮細胞、免疫細胞など、腫瘍微小環境(TME)に見られる間質細胞と組み合わされ、原発腫瘍の機能と複雑な細胞性を模倣すると、腫瘍オルガノイドの複雑さが増します。腫瘍オルガノイドは、標準化されたプロトコル6、7、8、9、10を使用して、多くの腫瘍タイプに対して確立されています。結腸直腸癌や乳がん組織を含むさまざまな固形腫瘍からのオルガノイド増殖は十分に確立されており、技術的に手頃な価格です11、12、13、14、15。
外科的腫瘍切除または腫瘍生検は、原発腫瘍組織標本を提供する。理想的には、腫瘍組織標本は、腫瘍塊の中心または腫瘍の浸潤縁、および腫瘍に隣接する正常に見える組織から採取する必要があります。従来の2D培養と比較して、腫瘍オルガノイドは、細胞外TMEを模倣する生物学的基底膜(マトリゲル、ハイドロゲル、コラーゲンベースの足場など)や、特定の栄養素と成長因子を供給し、培養における細胞増殖と生存率をサポートする液体増殖培地など、いくつかの「アドオン」を必要とします16。
初代細胞培養の最も基本的なステップは、汚染を防ぐために生理食塩水で組織を洗浄し、腫瘍を機械的に1〜3mm3の小片に切断/消化し、組織の酵素消化のためにコラゲナーゼで処理することです。次に、消化された混合物をろ過して大きな組織断片を除去し、マトリゲルなどの生物学的基底膜に再懸濁し、非接着性増殖を促進するために低接着性培養プレートにドーム状に播種します。基底膜マトリックスドームは液体培養培地で覆われ、グルタミンと抗生物質が添加され、組織タイプに応じて特定の成長因子が添加されます7,8,9,16,17。がん関連線維芽細胞(CAF)や免疫細胞など、バルク腫瘍およびTME内に存在する他の関連細胞も単離され得る。最近見直されたこの技術18は、より「現実的な」腫瘍環境で治療に対する反応を研究するために、異なる細胞タイプとの共培養を確立することを可能にします。さらに、細胞間相互作用や、腫瘍細胞と周囲の生物学的マトリックスの成分との相互作用を研究することができます。
生検または切除された消化管腫瘍組織からの新鮮組織を使用した腫瘍オルガノイド確立の成功率は約50%であり11、後者からの成功率は、組織の種類と起源4、特に腫瘍の悪性度と全体的な腫瘍細胞性に大きく依存します。3次元腫瘍モデルには、単純な単細胞凝集体から、さまざまな細胞タイプで構成される非常に複雑な工学的モデルまで、さまざまな複雑さがあります。文献で3D培養を説明するために使用される用語は、スフェロイド、腫瘍球、オルガノイドなどの異なる用語が使用されているため、非常に一貫性がありません19,20,21が、それらの違いは不明です。定義に関する明確なコンセンサスはまだ得られていないため、この記事では、腫瘍オルガノイドを生物学的基底膜に埋め込まれた組織化された腫瘍細胞培養として説明しています。
本明細書では、新鮮な原発切除またはPDX由来の膵管腺癌(PDAC)に由来する新鮮な組織サンプルからの腫瘍オルガノイドの確立について検証済みのプロトコルが報告されており、このプロトコルは基本的な組織培養施設を備えたほとんどの実験室で実施できます。このプロトコルは、David Tuveson9、Hans Clevers8、および Aurel Perren7 のグループからの消化器系腫瘍組織から腫瘍オルガノイドまたは腫瘍型を確立するために現在使用されているいくつかの最先端の報告されたプロトコルから適応されています。
このプロトコルでは、新鮮な組織がどのように収穫されるかについては説明しません。高品質の新鮮なヒト腫瘍組織を得るためには、組織を採取する外科医と、オルガノイド培養のために組織サンプルを抽出する病理学部門との間の効率的な調整が重要です。同様に、PDXを新鮮な組織源として使用する場合、組織サンプルを採取する人との効率的な調整も重要です。高品質を維持するためには、組織サンプルをできるだけ早く(採取時間から30〜60分以内に)入手することが重要です。
プロトコル
すべての手順は、マドリッド自治大学倫理委員会(CEI 103-1958-A337)およびマドリッド市議会(PROEX 294/19)によって承認された実験動物の福祉に関する制度的ガイドラインに準拠し、動物を含む生物医学研究のための国際指導原則に記載されている動物の世話と使用における倫理的行動に関するガイドラインに従って実施されました。 国際医学機関評議会(CIOMS)によって開発されました。プロトコルは、書面によるインフォームドコンセントによる生物医学研究の倫理原則に従った。腫瘍オルガノイド培養の確立のための新鮮組織の使用については、事前の倫理的承認が得られました。サンプルは、BioBank Hospital Ramón y Cajal-IRYCIS(National Registry of Biobanks B.0000678)から提供され、ISCIII(PT20/00045)のバイオバンクおよびバイオモデルプラットフォームに統合され、適切な倫理的承認を得て、標準操作手順に従って処理されました。腫瘍は、前述のように22、免疫不全の6週齢の雌のNU-Foxn1nuヌードマウス( 資料表参照)に皮下移植され、 in vivo で継代されてPDAC PDXが確立されました。
1. 実験準備
- クラスIIのバイオセーフティキャビネットでヒトサンプルを取り扱います。
- 組織媒介性病原体による感染を避けるために、処置中は白衣、保護手袋、眼鏡を着用してください。
注:新鮮な組織サンプルを処理し、オルガノイドと線維芽細胞をプレーティングするには、最低3時間が必要です。 - 採取から最大24時間以内に新鮮な組織サンプル22 を処理し、処理するまで組織培養培地(10%FBSおよび1%ペニシリン-ストレプトマイシンを添加したDMEM)中で4°Cで保存します。
- 手順全体を通してすべてのサンプルと試薬を氷上に保管し、細胞調製の損傷を防ぐために、冷蔵遠心分離機を4°Cにプリセットし、低速で使用してください。
- P1,000およびP200ピペットチップは-20°Cの冷凍庫に保管し、プロトコル中に使用してください。
- 使用前に基底膜マトリックス( 材料表を参照)を分注してください。このプロトコルでは、250 mLのアリコートが推奨されます。
2.腫瘍オルガノイドと原発性線維芽細胞を確立するための新鮮な原発腫瘍組織の処理
注:新鮮な組織サンプル(原発性ヒト切除可能腫瘍またはPDX)を処理し、腫瘍オルガノイドと線維芽細胞をプレーティングするには、最低3時間が必要です。オルガノイド調製プロセスの概要を 図1に示します(組織消化から腫瘍オルガノイドのプレーティングまで)。プロトコルを開始する前に、-20°Cの冷凍庫から基底膜マトリックスのアリコートを取り出し、使用前に約30〜60分間氷上に置いておきます。
- オルガノイドをプレーティングする3時間前に、6ウェル培養プレートを37°Cの細胞培養インキュベーターに入れます。
- 3 mLのAdvanced DMEM-F12(ダルベッコ修正イーグル培地(DMEM)/栄養混合物F-12ハム(F12))で組織を測定、写真撮影、洗浄(ステップ1.3)、5%ウシ胎児血清(FBS)、15 mM Hepes、1%L-グルタミン、1%ペニシリン-ストレプトマイシン、125 ng/mLアムホテリシンB、0.1 mg/mLノルモシン)(材料表を参照)でピペッティングして上下にピペッティングし、3 mLのリン酸緩衝生理食塩水(PBS)でピペッティングして洗浄します。
- 2枚の滅菌ブレードと2 mLの消化培地(Advanced DMEM-F12 + 10 mgコラゲナーゼIV/mL、0.000625%トリプシン-EDTA、および10 μg/mL DNase)を使用して、組織を滅菌組織培養プレートで1 mm3に切断します。合計5 mLの消化培地を含む50 mLチューブに組織を採取し、市販の機器( 材料表を参照)による機械的消化、またはサンプルをピペッティングしてサンプルを上下にピペッティングして、37°Cで1時間インキュベートします。
- 5 mL の Advanced DMEM-F12 を添加してトリプシンを不活化し、70 μm のポアストレーナーでサンプルをろ過して大きな破片を取り除きます。
- 2 mLのDMEMと10%FBSをフィルターの上部に加え、破片と組織残骸を回収して線維芽細胞の培養を確立します(ステップ5を参照)。
- 濾液を室温で200〜300× g で5分間遠心分離し、細胞ペレットのみを残して上清を吸引する。5 mL の Advanced DMEM-F12 を加え、300 x g で 5 分間遠心分離します。
- ペレットを4 mLの塩化アンモニウムカリウム(ACK、 材料表を参照)溶解緩衝液に再懸濁します。混合物を15 mLチューブに通し、室温で2分間インキュベートして赤血球を溶解します。
注:この赤血球溶解ステップは、汚染の目に見える証拠がない場合に除去できます。 - 室温で300× g で5分間遠心分離し、上清を吸引する。5 mL の Advanced DMEM-F12 を加え、300 x g で 5 分間遠心分離します。
- DNase(1 μg/mL)を添加した市販の細胞解離試薬( 材料表参照)1 mLを細胞ペレットに加え、室温で2〜3分間インキュベートします。
- 300 x g で 5 分間遠心分離し、上清を吸引します。5 mL の Advanced DMEM-F12 を加え、細胞ペレットを再懸濁します。
- P1,000ピペットで30回上下にピペットして細胞を解離し、300 x gで5分間遠心分離し、上清を除去します。
- -20°Cの冷凍庫からP1,000およびP200ピペットチップを取り出し、P1,000ピペットとコールドチップ(ペレット容量を考慮して1滴あたり50 μL、ウェルあたり6〜7ドーム)を使用して細胞ペレットをメンブレンマトリックスに再懸濁します。以前に加熱したプレートをインキュベーターから取り出します。P200 ピペットを 48 μL にセットし、コールドチップを使用して、予熱した 6 ウェルプレートに基底メンブレンマトリックスのドームを作成します。
- 基底膜マトリックスセルドームの入ったプレートを37°C、5%CO2 インキュベーターに15分間入れて、基底膜マトリックスを固化させます。
- 2〜2.5 mLのAdvanced DMEM-F12を添加し、20 ng / mLの組換えヒト上皮成長因子(EGF)、100 ng / mLのヒト胎盤成長因子(PlGF)、10 ng / mL組換えヒト塩基性線維芽細胞増殖因子(bFGF)、769 ng / mLのインスリン様成長因子-1(IGF-1)、および10.5 μMのROCK阻害剤(Advanced DMEM-F12 +成長因子)を添加します( 材料表を参照)。
3. オルガノイドのモニタリング
- 腫瘍オルガノイド培養を最初の7日間は目視で監視し、その後は週に3回監視します。
- 20 ng/mL 組換えヒト上皮成長因子(EGF)、100 ng/mL ヒト胎盤増殖因子(PlGF)、10 ng/mL 組換えヒト塩基性線維芽細胞増殖因子(bFGF)、769 ng/mL インスリン様成長因子-1(IGF-1)、10.5 μM ROCK 阻害剤(Advanced DMEM-F12 + 成長因子)を含む Advanced DMEM-F12 で培地を週に 2 回交換します。
- サンプルを処理し、培養物をマトリックスにプレーティングした後、1日目、3日目、7日目、10日目、および15日目に定期的に腫瘍オルガノイド培養の画像を撮影し、増殖と生存率を観察します。
4. オルガノイドの継代と凍結保存
- 6ウェルプレートから培地を取り出します。
- 適切な細胞回収試薬( 材料表を参照)を1 mL添加して基底膜マトリックスの解離と細胞懸濁液の取得を行い、15 mLチューブで上清を回収します。マトリックスがすぐに解離しない場合は、サンプルを完全に溶解するまで4°Cで15〜20分間インキュベートします。
- ステップ4.2で使用したのと同じ細胞回収試薬1 mLをプレートのウェルに添加して、追加の解離細胞を回収し、ステップ4.2と同じ15 mLチューブに上清を加えます。
- 5 mLのコールドアドバンストDMEM-F12を加え、200 x g で5分間遠心分離します。
- 上清を取り除き、5 mLのピペットで残りの液体を取り除き、ペレットを慎重に乾燥させます。チューブはできるだけ動かさないでください。細胞ペレットを基底膜マトリックスの元の容量の2倍に再懸濁し、1:2の継代を得ます。
- オルガノイド培養物の凍結保存には、ステップ4.5で得られたペレットを1mLの凍結培地(10%DMSO、20%FBS、50%DMEM-F12、10.5μM ROCK阻害剤)に再懸濁し、−80°Cで保存します。
注:基底膜マトリックスの体積は、1:1(元の基底膜マトリックスと同じ容量を使用)や1:3(基底膜マトリックスの元の体積の3倍を追加する)など、さまざまな継代を実行するように調整できます。
5.線維芽細胞の確立
- 10% FBS を含む 2 mL の DMEM で破片と組織残骸を回収した後、これを 6 ウェルプレートに添加し、5% CO2 で 37 °C でインキュベートします。
- プレーティングの2日後または3日後に培地の吸引により、ステップ2.5の線維芽細胞培養物から組織残骸を除去し、10%FBSを含む新鮮なDMEMと交換します。
- 線維芽細胞培養を週に3回目視でモニタリングし、10%FBSを添加したDMEMを使用して培養培地を週に2回以上交換します。
結果
腫瘍オルガノイド培養が時間の経過とともに、特に最初の数週間でどのように進行するかを記録し、培養物が下流のアッセイでどのように振る舞うかを推定することが重要です。図2は、15日間にわたる新鮮な組織からの最適な腫瘍細胞の単離と腫瘍オルガノイドの確立の例を示しています。サンプル中に大量の細胞破片があり、図3に示すように、発生中の腫瘍オルガノイドを見るのが難しい場合があります。さらに、発生中のオルガノイドの表現型は、単離された丸みを帯びたオルガノイド(図4A)からスフェロイド/凝集体様培養物(図4B-D)までさまざまであり、これは腫瘍の起源によって異なります。線維芽細胞は、固形腫瘍、特に間質含有量の高い腫瘍からの原発腫瘍細胞培養確立の一般的な副産物であり、オルガノイド培養物を汚染することがよくあります。図5は、これらの細胞が基底膜マトリックスドームから移動し、約7日後に培養プレートに接着する様子を示しています。これらの細胞は培地からの栄養素を消費するため、オルガノイドの最適な増殖が損なわれます。
初代線維芽細胞は、 図6に示すように、組織切片から移動し、培養プレートに付着し、単層培養物として増殖すると、単離培養物として得ることができます。このプロトコルでは、線維芽細胞の培養に10%FBSを含む標準的なDMEM培地を使用することを推奨しています。しかし、線維芽細胞専用の培地を使用することもできる。付着した線維芽細胞は、プレーティング後約7日で確認できます(図6)。

図1:腫瘍オルガノイドを樹立するための新鮮な組織サンプルの処理。 腫瘍オルガノイド調製プロセスの概要は、組織消化からオルガノイドのプレーティングまでです。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:新鮮なPDAC腫瘍に由来するPDXから確立された腫瘍オルガノイド培養。 数日間にわたる腫瘍オルガノイド培養の進行を、1日目、3日目、7日目、10日目、および15日目の1つの顕微鏡平面内のオルガノイドの画像とともに示しています。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:過剰な細胞破片を伴う2日目の最適でない腫瘍オルガノイド培養の例。 スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:サイズと形態の違いを示す異なるPDAC PDX組織から確立された腫瘍オルガノイド。腫瘍オルガノイドは、(A)古典的な丸みを帯びた表現型、または(B-D)よりスフェロイド/凝集体型の外観を有することがある。オルガノイドの平均サイズは80 uMから100 uMの範囲ですが、一部のオルガノイドは200 uMにもなる場合があります。スケールバー:20 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。

図5:30日間の培養後にCAF/線維芽細胞に汚染された最適でない腫瘍オルガノイド培養(A-C)の例。 スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
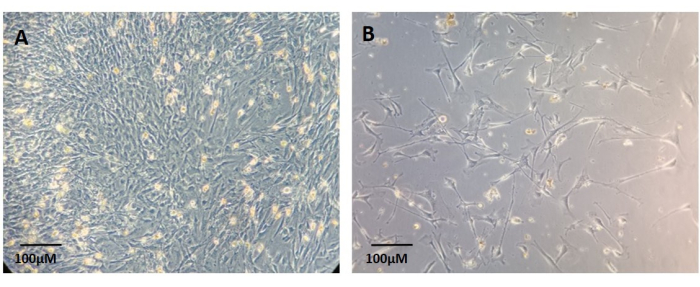
図6:消化された原発腫瘍組織の残骸から確立された初代線維芽細胞培養の例 。 (A)コンフルエント培養。(B)非コンフルエント培養。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足ファイル1:腫瘍オルガノイド培養確立のトラブルシューティング。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
がん第I相臨床試験で薬剤が承認される可能性は5.1%であり、全疾患タイプ23の中で最も低いため、薬物療法の大きな進歩は困難である。主な理由は、がんは非常に不均一であるため、患者コホートは特定の治療に対して期待どおりに均一に反応せず、より個別化されたアプローチが必要であることを浮き彫りにしています。2次元(2D)培養は、トランスレーショナルがん研究で長年使用されてきましたが、原発腫瘍に見られる構造的な3D構成を欠いています。したがって、それらは患者の治療反応と腫瘍細胞の相互または微小環境とのコミュニケーションを正確に反映していません3,23。すべての3D培養システムの根底にある基本原理は、細胞と周囲との相互作用を促進し、原発腫瘍(in situ)と同様に、空間的に適切な方法で細胞を組織化することです。腫瘍オルガノイドの形態は、図4に示すように、培養細胞の固有の性質と使用する培養条件に応じて、円形、塊状、ブドウ状、星状などさまざまです。確立された患者由来の腫瘍オルガノイド培養物は、腫瘍オルガノイドが臨床状況(すなわち、臨床治療反応)を再現することを確認するために、患者に使用されるのと同じ第一選択治療で治療することができます1,13,24,25。
腫瘍オルガノイドは新規薬理学的薬剤で治療することもでき、標準治療の選択肢が枯渇した場合に、クリニックの後続の治療ラインで使用できる新規治療法を特定するための探索的アプローチを提供します。培養物を継続的にモニターし、薬剤に対する腫瘍オルガノイド培養物の応答をリアルタイムで評価します。患者由来異種移植腫瘍(PDX)およびPDX由来オルガノイドの分子および免疫組織化学的特性評価の実現可能性研究では、形態、タンパク質発現、およびゲノム変化が2つのモデル間で同等であることが示されました。さらに、ファーマコタイピングの概念実証研究では、 in vivo と ex vivo の予測も同等であることが示され、腫瘍オルガノイドをがん/疾患モデルとして使用することは、臨床現場で適用できる実行可能で堅牢なアプローチであると結論付けました2。
異なる腫瘍型に由来する腫瘍オルガノイド培養の確立に関連するさまざまな課題が本明細書で強調され、最近レビューされています26,27,28。主な問題には、がん細胞よりも高い増殖速度でオルガノイドを形成する健康な細胞による「汚染/異常増殖」、2D培養と比較して培養維持のコストが高いこと、確立率が低いこと、ex vivo培養と起源腫瘍の間の体細胞変異プロファイルと組織学の不一致、原発腫瘍の不均一性、マウスベースの細胞外マトリックスの使用などがあります。 これはヒト細胞に最適ではなく、薬物送達、TMEおよび関連細胞の不在、成長因子または分子阻害剤の薬物応答への干渉、および腫瘍オルガノイドの確立と維持のための標準化および検証されたプロトコルの欠如を妨げる可能性があります。しかし、長年にわたり、がん研究における原発腫瘍モデルの使用が増加し、原発培養を培養および維持する技術が向上しています。これらのデリケートなex vivo培養は、細胞の成長と安定性を促進するためのサプリメントを添加することによって確立され、維持されます。Rhoキナーゼ阻害剤(ROCK)は、アポトーシスを回避し、細胞間接着を促進するために、現在、初代培養物に日常的に添加されており、安定したin vitro培養の長期的な拡大を促進しています29。さらに、それはまた、オルガノイド培養物の凍結ストックを生成する際に重要な、融解凍結保存幹細胞の生存率を増加させる29。ヘパリンを補給することは、WNTおよびFGFシグナル伝達を増加させ、したがって細胞増殖を増加させることにより、幹細胞の増殖を促進するためにも使用されることがある30。腫瘍オルガノイドの確立を最適化するためにこの検証済みプロトコルで使用される他の重要な試薬には、アキュターゼとDNaseが含まれます。アキュターゼは、個々の幹細胞を分離したり、培養表面から剥離したりするために推奨される穏やかな消化試薬であり、トリプシン31など、この目的のために設計された他の試薬を使用するよりも細胞の生存率を維持するのに役立ちます。しかしながら、コラゲナーゼは、生物学的基底膜に組み込まれたコラーゲン型を特異的に標的とするためにも使用され得る。DNaseは、抽出プロトコル中に死細胞や壊死細胞からDNAの残骸を除去し、サンプル調製の粘度の増加による細胞の凝集/凝集を防ぐために、長年にわたって細胞単離法で使用されてきました32。細胞ペレットはしばしば溶解緩衝液で処理されるが、組織試料8の赤血球汚染の目に見える証拠がない場合、このステップは除外することができる(補足ファイル1)。
腫瘍オルガノイドの確立の成功には、固有の生物学的合併症がないわけではありません。理想的には、腫瘍オルガノイド培養用の組織は、細胞生存率を最適化するために、採取と同じ日に処理する必要があります。組織の凍結は、細胞の生存率を大幅に低下させる可能性があるため、常に推奨されるわけではありません。しかしながら、腫瘍オルガノイドは、DMSO含有凍結培地中で瞬間凍結またはゆっくりと凍結保存された試料を用いて確立することができ33,34、これは、試料の輸送およびバイオバンキングを可能にする。場合によっては、基底膜マトリックスドームを除去した後、プレートに付着した腫瘍細胞の回収によって、数回継代された腫瘍オルガノイド培養物から2D培養を得ることができる。我々の経験では、腫瘍オルガノイド確立の成功率は、切除標本由来の新鮮なPDAC組織よりもPDX PDAC組織の方がはるかに高い4。これは、通常、新鮮なPDX PDAC組織のより大きな断片が利用可能であり、この組織は細胞性が高いという事実によるものであり、おそらく、ex vivoベースのアプローチと比較して、PDXモデルによって提供されるより快適なin vivo環境が原因です。無毒の薬剤を培地に添加して、細胞の生存率と培養物の増殖をモニターすることができます。さらに、非腫瘍性オルガノイドの異常増殖は、選択条件を用いて避けなければならない35,36。膵臓組織には、単離された腫瘍細胞の生存率に影響を与える可能性のある消化酵素が含まれている可能性があります。したがって、この問題を克服するために、消化ステップにトリプシンを添加してもよい4。患者/組織の状態(すなわち、腫瘍学的治療による治療または未治療)、腫瘍の種類、手術室からのサンプルの汚染、および腫瘍の元の悪性度など、他の多くの要因も、腫瘍オルガノイドを確立する能力に大きな影響を与える可能性があります。同様に、すべての組織が初代培養を確立するのに十分な生存可能な腫瘍細胞を持っているわけではありません。これは、間質に富むことで有名(約90%-95%)で、上皮腫瘍細胞の割合が少ないPDAC腫瘍に特に当てはまります。さらに、間質含有量の高い組織は、培養用の単一の腫瘍細胞を得るために切断および解離することが困難な場合があります。特殊な市販の消化培地を添加することもでき、組織が完全に消化されない場合は、機械的な解離装置を使用することもできます。あるいは、組織が半液体の外観になるまで、2枚のメスの刃を使用して連続的に切断することにより、完全な組織解離を達成することができます(ビデオデモンストレーションを参照)。
手順中には、強調しなければならない多くの技術的な落とし穴があります。例えば、組織の残骸がフィルターを塞ぐ可能性があり、その残骸が液体上清の通過を妨げるため、フィルターを交換する必要があります。濾過ステップを数回繰り返して、解離した腫瘍細胞の最大量を回収することができる。さらに、細胞数が少ないと確認しにくい場合があるため、各遠心分離ステップ後に細胞ペレットを確認することが重要です。細胞ペレットのピペッティングは、積極的なピペッティングは細胞の損失や細胞生存率の低下につながる可能性があるため、穏やかかつゆっくりと行う必要があります。さらに、マトリックスとセルの混合物を調製する際には、マトリックスが急速に固化するため、4°Cに予冷した培地と-20°Cで保存した冷蔵チップを使用する必要があります。最後に、前述したように、DNaseはサンプル調製中の細胞の凝集を防ぐのに役立ちます。また、プロトコールで使用する試薬を分注し、成長因子ミックスを調製することで、試薬の凍結融解を繰り返すことを避けることも推奨されます。
原発性線維芽細胞はPDACにおいて重要な細胞型であり、その後の共培養実験に使用して腫瘍細胞増殖に対するTMEの効果を判定することができるため、原発性線維芽細胞の単離は興味深いものです。約1週間後、線維芽細胞は組織切片から移動し、通常、培養プレートに付着し、単層培養物として成長しているのが見られます。しかしながら、培養物中の線維芽細胞の存在は、それらが培地からの栄養素を消費し、したがって腫瘍オルガノイドの最適な増殖を損なうという欠点も有する。超低接着性(ULA)プレートは、標準的な細胞培養処理プレートに容易に付着するため、線維芽細胞の増殖を制限するために腫瘍オルガノイドの培養に推奨されることがよくあります。この検証済みのプロトコルでは、初代線維芽細胞の培養に10%FBSを含む標準的なDMEM培地の使用を推奨していますが、線維芽細胞専用の培地を使用することもできます。
培養は組織の質、量、および発生源(原発性ヒト切除可能腫瘍とPDX)によって異なる挙動を示すため、腫瘍オルガノイド培養の状態を経時的に、特に最初の1週間は記録することが重要です。無毒の薬剤を培地に添加して、細胞の生存率と培養物の増殖をモニターすることができます。培養は、最初の7日間は毎日目視で監視し、その後は週に2〜3回監視する必要があります。さらに、培地は4〜5日ごと、または酸性に見える(黄色に見える)ときに、基底膜マトリックスドームを損傷しないように注意して交換する必要があります。最初は、細胞密度が高いため、大きな茶色の塊が現れることがあります。しかし、これは最初の継代後には消失するはずであり、したがって、基底膜マトリックスの明確な背景で明確に定義された腫瘍オルガノイドを得ることができます。腫瘍オルガノイドの視覚表現型と増殖速度を決定するために、特に最初の3週間は腫瘍オルガノイドの写真を撮ることが推奨されます。腫瘍オルガノイド培養の継代も技術的な課題です。一般的には、培地を除去し、基底膜マトリックスが完全に溶解するまで、4°Cでトリプシンベースまたは特殊な試薬とマトリックスドームを解離します。次に、細胞ペレットを新しいマトリックスに再懸濁し、1:1(元のマトリックス容量と同じマトリックス容量を使用)や1:3(アプローチの元の容量の3倍を追加する)など、目的の継代を実行するように容量を調整します。膵臓オルガノイドの専門家で構成されるDavid Tuvesonのグループは、膵臓オルガノイドの確立、維持、および染色のためのプロトコルをオンラインリソースで提供しています37。
患者由来の ex vivo 腫瘍オルガノイドは、個別化医療への応用に向けて患者固有の治療感受性を評価するための貴重な前臨床モデルを提供します。さらに、これらのモデルは、従来の2D接着細胞単層と比較して、より生理学的に関連性のある腫瘍モデルです。腫瘍モデル分野では、培養の定期的な写真および記述的なフォローアップを伴う3D腫瘍モデルの明確で一貫した命名法が必要です。さらに、標準化されたプロトコルを使用することは、患者固有の基準で薬剤感受性を決定する際に、臨床でこの技術を成功させるために最も重要です。この技術を使用する研究者は、これらの繊細で複雑なモデルの障害や落とし穴に注意する必要があります。ただし、検証済みのプロトコルと明確に定義された条件とトラブルシューティングオプションを使用して作業することで、技術的な問題を回避し、文化の確立と維持を最適化することができます。ここでは、腫瘍オルガノイドを樹立し、線維芽細胞を単離するための検証済みのプロトコルが提供されており、標準的な機器と組織培養の経験を持つ多くのトランスレーショナル腫瘍学ラボで容易に実施できます。
開示事項
何一つ。
謝辞
この研究は、助成金契約第857381号に基づく欧州連合のHorizon 2020 Research and Innovation Programme(消化器がんの早期診断のための科学的卓越性とイノベーション能力を強化するための戦略)であるPlataforma biobancos y biomodelos - Unidades de las Plataformas ISCIII de apoyo ala I+D+i en Biomedicina y Ciencias de la Salud(PT20/00045)からの資金提供によって支援されました。 臨床研究者および新興研究グループIRYCIS(2021/0446)、患者由来オルガノイド2.0プロジェクト(CIBERONC)、およびTRANSCAN IIプロジェクトJTC 2017の募集「膵神経内分泌腫瘍(NExT)患者の早期診断とフォローアップのためのアルゴリズムの確立」、助成金番号1.1.1.5 / ERANET / 20/03。このプロトコルで使用された生物学的サンプルは、BioBank Hospital Ramón y Cajal-IRYCIS(B.0000678)から提供され、ISCIII(PT20/00045)のバイオバンクおよびバイオモデルプラットフォームに統合されました。また、Yvonne Kohl氏、Agapi Kataki Vita Rovita氏、Thorsten Knoll氏には、NExTおよびVISIONプロジェクトの一環としてこのプロトコルを開発するための貴重なサポートをいただいたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 6 well Costar Ultra-low Attachment plates | Biofil | TCP011006 | |
| 70 μm pore strainer | VWR | 732-2758 | |
| Ammonium Chloride Potassium (ACK) Lysis Buffer | Gibco | A10492-01 | |
| Amphotericin B | Gibco | 15290018 | |
| Cell culture incubator (21% O2, 5% CO2 and 37 ºC) | Nuaire | NU-4750E | |
| Cell recovery solution | Corning | 354253 | |
| Collagenase IV | Gibco | 17104019 | |
| DMEM/F-12 (1:1)(1X) with L-Glutamine and HEPES | Gibco | 31330-038 | |
| DNase | Roche | 10104159001 | |
| Fetal Bovine Serum (FBS) | Corning | 35-079-CV | |
| Freezing container, Nalgene | Merck | C1562 | |
| gentleMACS Octo Dissociator | Milteny Biotec | 130-096-427 | |
| HEPES | Gibco | 15630056 | |
| Human Placenta Growth Factor (PlGF) | enQuireBio | QP6485-EC-100UG | |
| Immunocompromised female 6-week-old NU-Foxn1nu nude mice | Janvier, France | ||
| Insulin-like growth factor-1 (IGF-1) | Invitrogen | RP10931 | |
| L-Glutamine | Corning | 354235 | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| Normocin | InvivoGen | ant-nr-2 | |
| Pasteur pipettes | Deltalab | 200007 | |
| Penicillin Streptomycin Solution (100x) | Corning | 30-002-CI | |
| Phosphate-Buffered Saline (PBS) | Corning | 21-040-CV | |
| Recombinant Human Basic Fibroblast Growth Factor (bFGF) | Gibco | PHG0026 | |
| Recombinant Human Epidermal Growth Factor (EGF) | Gibco | PHG0311 | |
| ROCK Inhibitor Y-27632 (Dihydrochloride) | STEMCELL | 72304 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | |
| Surgical Blades | Nahita | FMB018 | |
| Trypsin | Gibco | 25300054 |
参考文献
- April-Monn, S. L., et al. Patient-derived tumoroids of advanced high-grade neuroendocrine neoplasms mimic patient chemotherapy responses and guide the design of personalized combination therapies. bioRxiv. , (2022).
- Frappart, P. O., et al. Pancreatic cancer-derived organoids - A disease modeling tool to predict drug response. United European Gastroenterology Journal. 8 (5), 594-606 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Aberle, M. R., et al. Patient-derived organoid models help define personalized management of gastrointestinal cancer. The British Journal of Surgery. 105 (2), e48-e60 (2018).
- Yoshida, G. J. Applications of patient-derived tumor xenograft models and tumor organoids. Journal of Hematology & Oncology. 13 (1), 4 (2020).
- Hong, H. K., et al. Efficient primary culture model of patient-derived tumor cells from colorectal cancer using a Rho-associated protein kinase inhibitor and feeder cells. Oncology Reports. 42 (5), 2029-2038 (2019).
- April-Monn, S. L., et al. 3D primary cell culture: A novel preclinical model for pancreatic neuroendocrine tumors (PanNETs). Neuroendocrinology. 111 (3), 273-287 (2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), e106 (2020).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 5739 (2020).
- Yu, J., Huang, W. The progress and clinical application of breast cancer organoids. International Journal of Stem Cells. 13 (3), 295 (2020).
- Barbáchano, A., et al. Organoids and colorectal cancer. Cancers. 13 (11), 2657 (2021).
- Michels, B. E., et al. Human colon organoids reveal distinct physiologic and oncogenic Wnt responses. Journal of Experimental Medicine. 216 (3), 704-720 (2019).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Porter, R. J., Murray, G. I., McLean, M. H. Current concepts in tumour-derived organoids. British Journal of Cancer. 123 (8), 1209-1218 (2020).
- Wang, Q., Guo, F., Jin, Y., Ma, Y. Applications of human organoids in the personalized treatment for digestive diseases. Signal Transduction and Targeted Therapy. 7 (1), 336 (2022).
- Wang, J., et al. Patient-derived tumor organoids: New progress and opportunities to facilitate precision cancer immunotherapy. Frontiers in Oncology. 12, 1382 (2022).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17 (1), 1-15 (2015).
- Marsee, A., et al. Building consensus on definition and nomenclature of hepatic, pancreatic, and biliary organoids. Cell Stem Cell. 28 (5), 816-832 (2021).
- Mueller, M. T., et al. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 137 (3), 1102-1113 (2009).
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. 20 (2), 273-286 (2019).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Chen, P., et al. Patient-derived organoids can guide personalized-therapies for patients with advanced breast cancer. Advanced Science. 8 (22), 2101176 (2021).
- Furbo, S., et al. Use of patient-derived organoids as a treatment selection model for colorectal cancer: A narrative review. Cancers. 14 (4), 1069 (2022).
- Xu, H., Jiao, D., Liu, A., Wu, K. Tumor organoids: Applications in cancer modeling and potentials in precision medicine. Journal of Hematology & Oncology. 15 (1), 58 (2022).
- Xu, H., et al. Organoid technology in disease modelling, drug development, personalized treatment and regeneration medicine. Experimental Hematology & Oncology. 7 (1), 30 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Ling, L., et al. Effect of heparin on the biological properties and molecular signature of human mesenchymal stem cells. Gene. 576, 292-303 (2016).
- Bajpai, R., Lesperance, J., Kim, M., Terskikh, A. V. Efficient propagation of single cells Accutase-dissociated human embryonic stem cells. Molecular Reproduction and Development. 75 (5), 818-827 (2008).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Walsh, A. J., et al. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889 (2016).
- Bui, B. N., et al. Organoids can be established reliably from cryopreserved biopsy catheter-derived endometrial tissue of infertile women. Reproductive BioMedicine Online. 41 (3), 465-473 (2020).
- Verissimo, C. S., et al. Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening. eLife. 5, e18489 (2016).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Protocols for Generating, Manipulating, and Analyzing Pancreatic Organoid Cultures. Cold Spring Harbor Laboratory. Tuveson Lab Available from: https://tuvesonlab.labsites.cshl.edu/protocolsreagents/ (2023)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved