Method Article
从新鲜组织中建立胰腺癌来源的肿瘤类器官和成纤维细胞
* 这些作者具有相同的贡献
摘要
肿瘤类器官彻底改变了癌症研究和个性化医疗方法。它们代表了一种临床相关的肿瘤模型,使研究人员能够在临床上领先于肿瘤。该方案从新鲜的胰腺肿瘤组织样本和胰腺癌来源的患者来源的异种移植物中建立肿瘤类器官。
摘要
肿瘤类器官是三维 (3D) 离体 肿瘤模型,可概括原始原发肿瘤组织的生物学关键特征。患者来源的肿瘤类器官已用于转化癌症研究,可用于评估治疗敏感性和耐药性、细胞间相互作用以及肿瘤细胞与肿瘤微环境的相互作用。肿瘤类器官是复杂的培养系统,需要先进的细胞培养技术和具有特定生长因子混合物和模拟细胞外环境的生物基底膜的培养基。建立原发性肿瘤培养的能力很大程度上取决于肿瘤的起源组织、细胞性和临床特征,例如肿瘤分级。此外,组织样本采集、材料质量和数量以及正确的生物样本库和储存是该程序的关键要素。实验室的技术能力也是需要考虑的关键因素。在这里,我们报告了一种经过验证的 SOP/方案,该方案在技术和经济上是可行的,可用于从胰腺癌来源的新鲜组织样本中培养离体肿瘤类器官,无论是来自新鲜的原发性切除的患者供 体 组织或患者来源的异种移植物 (PDX)。本文描述的技术可以在具有基本组织培养和小鼠设施的实验室中进行,并且是为转化肿瘤学领域的广泛应用而量身定制的。
引言
肿瘤类器官是体外三维 (3D) 组织培养物,来源于新鲜肿瘤组织并提供癌症模型。肿瘤类器官概括了原始原发肿瘤1、2、3、4 的生物学关键特征,可以扩增长达数月并冷冻保存,类似于传统的永生化细胞系。肿瘤类器官为转化/个性化医学提供了患者来源的肿瘤模型的生物库5,代表了癌细胞生物学系统/模型的重要进展。患者来源的肿瘤类器官可用作离体模型,以预测(新)辅助肿瘤/药物治疗的疗效,从新鲜肿瘤组织建立培养物,并在患者特异性的基础上进行药物敏感性测定或药物分型,以确定后续治疗线的有效药物1,4.此外,肿瘤类器官克服了原发肿瘤组织可用性的限制,更重要的是,它为体内小鼠模型(如患者来源的异种移植物 (PDX)2))提供了极好的替代或补充系统。如果原发性肿瘤细胞与肿瘤微环境 (TME) 中发现的基质细胞(例如癌症相关成纤维细胞 (CAF)、内皮细胞和免疫细胞)结合,则肿瘤类器官的复杂性会增加,这些细胞模仿原发肿瘤的功能和复杂细胞性。已使用标准化方案6、7、8、9、10 为许多肿瘤类型建立了肿瘤类器官。类器官从不同的实体瘤(包括结直肠癌和乳腺癌组织)传播是公认的,并且在技术上是负担得起的11,12,13,14,15。
手术肿瘤切除术或肿瘤活检可提供原发性肿瘤组织标本。理想情况下,肿瘤组织标本应来自肿瘤肿块的中心或肿瘤的侵袭边缘,以及与肿瘤相邻的正常组织。与传统的 2D 培养相比,肿瘤类器官需要几个"附加组件",包括模拟细胞外 TME 的生物基底膜(如基质凝胶、水凝胶或基于胶原的支架),以及提供特定营养物质和生长因子并支持培养物中细胞增殖和活力的液体生长培养基16。
原代细胞培养中最基本的步骤是在盐水溶液中洗涤组织以防止污染,机械地将肿瘤切割/消化成 1-3 mm3 的小块,并用胶原酶处理以酶消化组织。然后过滤消化的混合物以除去大的组织碎片,重悬于生物基底膜(如基质胶)中,并在低附着培养板中作为圆顶接种以增强非附着生长。基底膜基质圆顶覆盖有液体培养基,并补充谷氨酰胺和抗生素以避免污染,以及取决于组织类型的特定生长因子7,8,9,16,17。也可以分离出存在于块状肿瘤和 TME 中的其他相关细胞,例如癌症相关成纤维细胞 (CAF) 和免疫细胞。该技术最近已被审查18,允许建立与不同细胞类型的共培养物,以研究在更"现实"的肿瘤环境中对治疗的反应。此外,可以研究细胞间相互作用以及肿瘤细胞与周围生物基质成分之间的相互作用。
据报道,使用活检新鲜组织或切除的胃肠道肿瘤组织建立肿瘤类器官的成功率约为 50%11,后者的成功率很大程度上取决于组织类型和来源4,特别是肿瘤分级和整体肿瘤细胞性。三维肿瘤模型具有不同的复杂性,从简单的单细胞聚集体到由各种细胞类型组成的高度复杂的工程模型。文献中用于描述 3D 培养物的术语高度不一致 19,20,21,因为使用了不同的术语,例如球状体、肿瘤球和类器官,尽管它们之间的区别尚不清楚。由于尚未就定义达成明确的共识,在本文中,肿瘤类器官被描述为嵌入生物基底膜中的有组织的肿瘤细胞培养物。
在此,报道了一种经过验证的方案,用于从源自新鲜原发性切除或PDX衍生的胰腺导管腺癌(PDAC)的新鲜组织样本中建立肿瘤类器官,并且该协议可以在大多数具有基本组织培养设施的实验室中进行。该协议改编自目前用于从David Tuveson9,Hans Clevers8和Aurel Perren7组的消化肿瘤组织建立肿瘤类器官或肿瘤样的几种最新报道的方案。
该协议不讨论如何收获新鲜组织。为了获得高质量的新鲜人类肿瘤组织,在收获组织的外科医生和提取组织样本进行类器官培养的病理科之间进行有效协调非常重要。同样,当使用 PDX 作为新鲜组织源时,与采集组织样本的人进行有效协调也很重要。为了保持高质量,尽快获得组织样本(在收获后 30-60 分钟内)至关重要。
研究方案
所有程序均按照马德里自治大学伦理委员会(CEI 103-1958-A337)和马德里自治大学(PROEX 294/19)批准的实验动物福利机构指南进行,并符合《涉及动物的生物医学研究的国际指导原则》中规定的动物护理和使用道德行为准则, 由国际医学科学组织理事会(CIOMS)开发。该协议遵循具有书面知情同意书的生物医学研究的伦理原则。使用新鲜组织建立肿瘤类器官培养物已获得事先伦理批准。样本由 Ramón y Cajal-IRYCIS 生物样本库医院(国家生物样本库 B.0000678 登记处)提供,整合到 ISCIII 的生物样本库和生物模型平台 (PT20/00045) 中,并按照标准操作程序进行处理,并获得适当的伦理批准。如前所述,将肿瘤皮下植入免疫功能低下的 6 周龄雌性 NU-Foxn1nu 裸鼠中(参见材料表),并在体内传代以建立 PDAC PDX。
1.实验准备
- 在 II 类生物安全柜中处理人体样本。
- 在整个手术过程中穿好实验服、戴防护手套和眼镜,以避免被组织传播的病原体感染。
注意:处理新鲜组织样品并铺板类器官和成纤维细胞至少需要 3 小时。 - 在收获后最多24小时内处理新鲜组织样品22 ,并在4°C下储存在组织培养基(补充有10%FBS和1%青霉素 - 链霉素)中直至处理。
- 在整个过程中将所有样品和试剂保持在冰上,并确保将冷冻离心机预设至4°C并以低速使用,以免损坏细胞制剂。
- 将P1,000和P200移液器吸头储存在-20°C冰箱中,以便在方案期间使用。
- 使用前将基底膜基质等分(见 材料表)。对于该方案,建议使用 250 mL 等分试样。
2. 处理新鲜的原发性肿瘤组织,建立肿瘤类器官和原发性成纤维细胞
注意:处理新鲜组织样本(原发性人类可切除肿瘤或PDX)并接种肿瘤类器官和成纤维细胞至少需要3小时。类器官制备过程的概述如图1所示,从组织消化到肿瘤 类器官的铺板。在开始方案之前,从-20°C冰箱中取出基底膜基质的等分试样,并在使用前将其置于冰上约30-60分钟。
- 在接种类器官之前,将6孔培养板置于37°C细胞培养箱中3小时。
- 用 3 mL Advanced DMEM-F12(Dulbecco 改良的 Eagle 培养基 (DMEM)/营养混合物 F-12 火腿 (F12),补充有 5% 胎牛血清 (FBS)、15 mM Hepes、1% L-谷氨酰胺、1% 青霉素 - 链霉素、125 ng/mL 两性霉素 B、0.1 mg/mL Normocin)(参见材料表)测量、拍照和洗涤组织(步骤 1.3),方法是上下移液,然后用 3 mL 磷酸盐缓冲盐水 (PBS) 上下移液洗涤。
- 通过抽吸从组织培养板中取出培养基,并使用两个无菌刀片和 2 mL 消化培养基(高级 DMEM-F12 + 10 mg 胶原酶 IV/mL、0.000625% 胰蛋白酶-EDTA 和 10 μg/mL DNase)在无菌组织培养板中将组织切成 1 mm3 块。将组织收集在含有5mL总消化培养基的50mL管中,并在37°C下用市售设备(参见 材料表)进行机械消化孵育1小时,或通过上下移液样品来定期混合样品。
- 加入 5 mL Advanced DMEM-F12 以灭活胰蛋白酶,并通过 70 μm 孔过滤器过滤样品以去除大碎屑。
- 向过滤器顶部加入含有10%FBS的2mLDMEM,并收集碎片和组织残留物以建立成纤维细胞培养物(参见步骤5)。
- 在室温下以200-300× g 离心滤液5分钟,并吸出上清液,仅留下细胞沉淀。加入 5 mL Advanced DMEM-F12,并以 300 x g 离心 5 分钟。
- 将沉淀重悬于 4 mL 氯化铵钾(ACK,参见 材料表)裂解缓冲液中。将混合物放入 15 mL 试管中,并在室温下孵育 2 分钟以裂解红细胞。
注意:当没有可见的污染证据时,可以删除此红细胞裂解步骤。 - 在室温下以300× g 离心5分钟,并吸出上清液。加入 5 mL Advanced DMEM-F12,并以 300 x g 离心 5 分钟。
- 向细胞沉淀中加入 1 mL 补充有 DNase (1 μg/mL) 的市售细胞解离试剂(参见 材料表),并在室温下孵育 2-3 分钟。
- 以300× g 离心5分钟,并吸出上清液。加入 5 mL Advanced DMEM-F12,并重悬细胞沉淀。
- 用P1,000移液管上下移液30次以解离细胞,以300× g离心5分钟,并除去上清液。
- 从-20°C冰箱中取出P1,000和P200移液器吸头,并使用P1,000移液器和冷吸头(每滴50μL,考虑到沉淀体积,每孔6至7个圆顶)将细胞沉淀重悬于膜基质中。从培养箱中取出先前加热的板。将P200移液器设置为48μL,并使用冷吸头在预热的6孔板中形成基底膜基质的圆顶。
- 将带有基底膜基质 - 细胞圆顶的板放入37°C 5%CO2 培养箱中15分钟以固化基底膜基质。
- 加入 2-2.5 mL Advanced DMEM-F12,补充 20 ng/mL 重组人表皮生长因子 (EGF)、100 ng/mL 人胎盘生长因子 (PlGF)、10 ng/mL 重组人碱性成纤维细胞生长因子 (bFGF)、769 ng/mL 胰岛素样生长因子-1 (IGF-1) 和 10.5 μM ROCK 抑制剂(Advanced DMEM-F12 + 生长因子)(参见 材料表)。
3. 监测类器官
- 前 7 天目视监测肿瘤类器官培养,之后每周监测 3 次。
- 用含有 20 ng/mL 重组人表皮生长因子 (EGF)、100 ng/mL 人胎盘生长因子 (PlGF)、10 ng/mL 重组人碱性成纤维细胞生长因子 (bFGF)、769 ng/mL 胰岛素样生长因子-1 (IGF-1) 和 10.5 μM ROCK 抑制剂(Advanced DMEM-F12 + 生长因子)的高级 DMEM-F12 每周更换培养基两次。
- 在第 1 天、第 3 天、第 7 天、第 10 天和第 15 天定期捕获肿瘤类器官培养物的图像,然后处理样品并将培养物接种在基质中以观察生长和活力。
4. 类器官的传代和冷冻储存
- 从 6 孔板中取出培养基。
- 加入 1 mL 适当的细胞回收试剂(参见 材料表)以解离基底膜基质并获得细胞悬液,并在 15 mL 试管中回收上清液。如果基质没有立即解离,则将样品在4°C孵育15-20分钟直至完全溶解。
- 将步骤4.2中使用的相同细胞回收试剂的1mL加入板孔中以回收其他解离的细胞,并将上清液加入与步骤4.2相同的15mL管中。
- 加入 5 mL 冷的 Advanced DMEM-F12,并以 200 x g 离心 5 分钟。
- 取出上清液,用 5 mL 移液管除去任何剩余的液体,小心地干燥沉淀;尽可能避免移动管子。将细胞沉淀重悬于原始体积两倍的基底膜基质中,以获得 1:2 的传代。
- 对于类器官培养物的冷冻储存,将步骤4.5中获得的沉淀重悬于1mL冷冻培养基(10%DMSO,20%FBS,50%DMEM-F12,10.5μROCK抑制剂)中,并储存在-80°C。
注:基底膜基质的体积可以调整以执行不同的传代,例如1:1(使用与原始基底膜基质相同体积)或1:3(添加基底膜基质原始体积的三倍)。
5.成纤维细胞的建立
- 在含有10%FBS的2mL DMEM中回收碎片和组织残留物后,将其添加到6孔板中,并在37°C下用5%CO2孵育。
- 在电镀后2天或3天通过吸取培养基从步骤2.5中除去成纤维细胞培养物中的组织残留物,并用含有10%FBS的新鲜DMEM替换。
- 每周目视监测成纤维细胞培养物三次,并使用补充有10%FBS的DMEM每周至少更换两次培养基。
结果
重要的是要记录肿瘤类器官培养物如何随时间推移,特别是在最初的几周内,以便估计培养物在下游检测中的表现。图 2 显示了在 15 天内从新鲜组织中分离最佳肿瘤细胞和建立肿瘤类器官的示例。有时,样本中有大量的细胞碎片,很难看到正在发育的肿瘤类器官,如图3所示。此外,发育中的类器官的表型可以从分离的圆形类器官(图4A)到球状/聚集体培养物(图4B-D)不等,这取决于肿瘤的起源。成纤维细胞是实体瘤(尤其是基质含量高的原发性肿瘤细胞培养物)建立的常见副产物,并且经常会污染类器官培养物。图 5 显示了这些细胞如何在大约 7 天后从基底膜基质圆顶迁移并粘附在培养板上。这些细胞消耗培养基中的营养物质,从而影响类器官的最佳生长。
当原代成纤维细胞从组织切片中迁移出来,粘附在培养板上,并作为单层培养物生长时,可以作为分离的培养物获得, 如图 6 所示。该方案推荐使用具有10%FBS的标准DMEM培养基进行成纤维细胞的培养。但是,也可以使用专门用于成纤维细胞的培养基。贴壁成纤维细胞在电镀后约7天可见(图6)。

图 1:处理新鲜组织样本以建立肿瘤类器官。 图中概述了肿瘤类器官制备过程,从组织消化到类器官的铺板。 请点击这里查看此图的较大版本.

图 2:从源自新鲜 PDAC 肿瘤的 PDX 建立的肿瘤类器官培养物。 显示了肿瘤类器官培养在几天内的进展,在第 1 天、第 3 天、第 7 天、第 10 天和第 15 天在一个微观平面上显示类器官的图像。比例尺:100μm。 请点击这里查看此图的较大版本.

图 3:第 2 天具有过量细胞碎片的非最佳肿瘤类器官培养示例。 比例尺:100μm。 请点击这里查看此图的较大版本.

图 4:来自不同 PDAC PDX 组织的已建立肿瘤类器官,显示出大小和形态的差异。肿瘤类器官可以具有 (A) 经典的圆形表型或 (B-D) 更球状/聚集体的外观。类器官的平均大小范围为 80 uM 至 100 uM,尽管某些类器官可能高达 200 uM。比例尺:20μm。 请点击这里查看此图的较大版本.

图 5:培养 30 天后被 CAF/成纤维细胞污染的非最佳肿瘤类器官培养 (A-C) 示例。 比例尺:100μm。 请点击这里查看此图的较大版本.
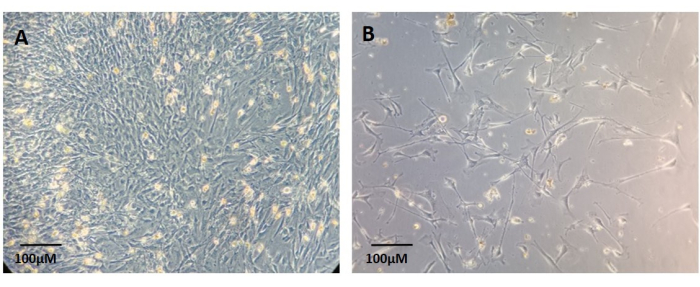
图 6:从消化的原发性肿瘤组织的残余物中建立的原代成纤维细胞培养物示例 。 (A) 汇合培养。(B) 非汇合培养。比例尺:100μm。 请点击这里查看此图的较大版本.
补充文件1:肿瘤类器官培养建立的故障排除。请点击这里下载此文件。
讨论
药物癌症治疗的重大进展具有挑战性,因为药物在I期肿瘤临床试验中获得批准的可能性为5.1%,是所有疾病类型中最低的23。主要原因是癌症的异质性很强,因此,患者队列对给定治疗的反应并不一致,这凸显了需要一种更加个性化的方法。二维 (2D) 培养物已用于转化癌症研究多年,但缺乏原发性肿瘤中发现的结构性 3D 组织。因此,它们不能准确反映患者治疗反应和肿瘤细胞彼此之间或与其微环境的通信3,23。所有 3D 培养系统的基本核心原理是促进细胞与周围环境的相互作用,并以空间相关的方式组织细胞,类似于原发肿瘤(原位)。肿瘤类器官的形态从圆形、团块状、葡萄状到星状不等,具体取决于培养细胞的固有性质和所使用的培养条件,如图 4 所示。已建立的患者来源的肿瘤类器官培养物可以使用与患者相同的一线治疗进行治疗,以确认肿瘤类器官概括了临床情况(即临床治疗反应)1,13,24,25。
肿瘤类器官也可以用新型药物治疗,这为确定新疗法提供了一种探索性方法,当标准治疗方案用尽时,这些疗法可用于临床的后续治疗线。持续监测培养物,以实时评估肿瘤类器官培养物对药物的反应。对患者来源的异种移植肿瘤 (PDX) 和 PDX 来源的类器官的分子和免疫组织化学表征的可行性研究表明,两种模型之间的形态、蛋白质表达和基因组改变具有可比性。此外,一项药型概念验证研究表明, 体内 和 离体 预测也具有可比性,因此得出结论,使用肿瘤类器官作为癌症/疾病模型是一种可行且稳健的方法,可应用于临床环境2.
本文强调了与建立源自不同肿瘤类型的肿瘤类器官培养物相关的一系列挑战,最近进行了综述26,27,28。关键问题包括健康细胞的"污染/过度生长",形成的类器官的生长速度高于癌细胞,与2D培养相比,培养维持成本高,建立率低,体细胞突变谱和组织学在离体培养物和起源肿瘤之间的不一致,原发性肿瘤异质性,使用基于小鼠的细胞外基质, 这对人类细胞来说可能不是最佳的,并且可能会阻碍药物递送、TME 和相关细胞的缺失、生长因子或分子抑制剂对药物反应的干扰,以及缺乏用于建立和维持肿瘤类器官的标准化和经过验证的方案。然而,多年来,原发性肿瘤模型在癌症研究中的使用有所增加,培养和维持原发性培养的技术也得到了改进。这些精致的离体培养物是通过添加补充剂来建立和维持的,以促进细胞生长和稳定性。Rho 激酶抑制剂 (ROCK) 现在常规添加到原代培养物中,以避免细胞凋亡并增强细胞间粘附,从而促进稳定的原代体外培养物的长期扩增29。此外,它还增加了解冻冻存干细胞的存活率,这在生成类器官培养物的冷冻储备液时很重要29。补充肝素也可用于通过增加 WNT 和 FGF 信号传导来增强干细胞的扩增,从而增加细胞增殖30。该经验证的方案中用于优化肿瘤类器官建立的其他重要试剂包括 Accutase 和 DNase。Accutase 是一种温和的消化试剂,推荐用于分离单个干细胞或将其从培养表面分离出来,它比使用为此目的设计的其他试剂(如胰蛋白酶31)更有助于保持细胞活力。然而,胶原酶也可用于特异性靶向掺入生物基底膜的胶原蛋白类型。DNase 已在细胞分离方法中使用多年32,用于在提取方案中去除死细胞和坏死细胞中的 DNA 残留物,从而防止由于样品制备粘度增加而导致的细胞结块/聚集。细胞沉淀通常用裂解缓冲液处理,但当没有可见的组织样本红细胞污染证据时,可以排除此步骤8(补充文件1)。
肿瘤类器官的成功建立并非没有固有的生物学并发症。理想情况下,用于肿瘤类器官培养的组织应在收获的同一天处理,以优化细胞活力。并不总是建议冷冻组织,因为它可能会显着降低细胞活力。然而,可以使用在含有DMSO的冷冻培养基33,34中快速冷冻或缓慢冷冻保存的样品来建立肿瘤类器官,这允许样品运输和生物样本库。在某些情况下,可以从肿瘤类器官培养物中获得 2D 培养物,这些培养物在去除基底膜基质圆顶后通过恢复附着在板上的肿瘤细胞传代了多次。根据我们的经验,PDX PDAC组织建立肿瘤类器官的成功率远高于来自切除标本的新鲜PDAC组织4。这是因为通常可以使用较大的新鲜PDX PDAC组织,并且该组织具有更高的细胞性,这可能是由于与基于离体的方法相比,PDX模型提供了更宜居的体内环境。可以在培养基中加入无毒剂,以监测细胞活力和培养物的增殖情况。此外,必须使用选择性条件35,36避免非肿瘤类器官的过度生长。胰腺组织可能含有消化酶,这些酶可能影响分离的肿瘤细胞的活力;因此,可以将胰蛋白酶加入到消化步骤中来克服这个问题4。许多其他因素,例如患者/组织的状态(即,接受肿瘤治疗或未接受治疗)、肿瘤类型、手术室样本的污染以及肿瘤的原始分级,也会显着影响建立肿瘤类器官的能力。同样,并非每个组织都有足够的活肿瘤细胞来建立原代培养物。对于PDAC肿瘤尤其如此,PDAC肿瘤富含基质(约90%-95%),并且含有一小部分上皮肿瘤细胞。此外,基质含量高的组织可能难以切割和解离以获得用于培养的单个肿瘤细胞。如果组织未完全消化,可以添加专门的市售消化培养基,也可以使用机械解离设备。或者,可以通过使用两个手术刀刀片连续切割来实现彻底的组织解离,直到组织具有半液体外观(参见视频演示)。
在此过程中,还必须强调许多技术陷阱。例如,组织残留物可能会堵塞过滤器,因此必须更换过滤器,因为残留物会阻碍液体上清液的通过。过滤步骤可以重复数次,以回收最大量的解离肿瘤细胞。此外,在每个离心步骤后检查细胞沉淀也很重要,因为有时很难看到细胞数量何时较低。细胞沉淀的移液应轻柔而缓慢地进行,因为激进的移液可能导致细胞损失或细胞活力降低。此外,在制备基质-细胞混合物时,应使用预冷至4°C的培养基和储存在-20°C的冷藏吸头,因为基质会迅速凝固。最后,如上所述,脱氧核糖核酸酶有助于防止样品制备过程中细胞结块。还建议将方案中使用的试剂分装并制备生长因子混合物,以避免试剂的重复冻融。
原代成纤维细胞的分离是值得关注的,因为它们是PDAC中的重要细胞类型,可用于随后的共培养实验,以确定TME对肿瘤细胞生长的影响。大约 1 周后,成纤维细胞已从组织切片中迁移出来,通常可以看到附着在培养板上并作为单层培养物生长。然而,培养物中成纤维细胞的存在也有缺点,因为它们会消耗培养基中的营养物质,从而损害肿瘤类器官的最佳生长。超低附着 (ULA) 板通常被推荐用于培养肿瘤类器官以限制成纤维细胞生长,因为它们很容易附着在标准细胞培养处理的板上。该经验证的方案建议使用含有 10% FBS 的标准 DMEM 培养基培养原代成纤维细胞,但也可以使用专门的成纤维细胞培养基。
记录肿瘤类器官培养随时间变化的状态非常重要,尤其是在第一周,因为培养物的行为取决于组织质量、数量和来源(原发性人类可切除肿瘤与 PDX)。可以在培养基中加入无毒剂,以监测细胞活力和培养物的增殖情况。在最初的 7 天内,必须每天对培养物进行目视监测,然后每周进行 2 至 3 次。此外,介质必须每 4-5 天更换一次,或在出现酸性(呈黄色)时更换一次,注意不要损坏基底膜基质圆顶。起初,由于细胞密度高,可能会出现大的棕色团块。然而,这应该在第一次传代后消失,从而允许在基底膜基质的清晰背景上获得明确定义的肿瘤类器官。建议拍摄肿瘤类器官的照片,尤其是在前 3 周,以确定肿瘤类器官的视觉表型和生长速度。肿瘤类器官培养的传代也是一个技术挑战。通常,除去培养基,并在4°C下将基质圆顶与基于胰蛋白酶的试剂或专用试剂解离,直到基底膜基质完全溶解。然后将细胞沉淀重悬于新鲜基质中,并调整体积以执行所需的传代,例如 1:1(使用与原始基质相同的基质体积)或 1:3(增加原始方法体积的三倍)。David Tuveson 小组由胰腺类器官专家组成,提供在线资源,包括建立、维持和染色胰腺类器官的方案37。
患者来源的 离体 肿瘤类器官为评估患者特异性治疗敏感性提供了有价值的临床前模型,可用于个性化医疗。此外,与传统的 2D 贴壁细胞单层相比,这些模型是更具生理相关性的肿瘤模型。在肿瘤模型领域,需要对 3D 肿瘤模型进行清晰一致的命名,并定期对培养物进行摄影和描述性随访。此外,使用标准化方案对于该技术在临床上成功确定患者特定的药物敏感性至关重要。使用这项技术的研究人员应该意识到这些敏感和复杂模型的障碍和陷阱。但是,使用经过验证的协议以及明确定义的条件和故障排除选项将有助于避免技术问题并优化培养物的建立和维护。在这里,提供了一个经过验证的方案,用于建立肿瘤类器官和分离成纤维细胞,该方案可以在许多具有标准设备和组织培养经验的转化肿瘤学实验室中轻松实施。
披露声明
没有。
致谢
这项研究得到了 Plataforma biobancos y biomodelos - Unidades de las Plataformas ISCIII de apoyo ala I+D+i en Biomedicina y Ciencias de la Salud (PT20/00045)、欧盟地平线 2020 研究和创新计划资助的资助,根据第 857381 号赠款协议,项目 VISION(加强胃肠道癌症早期诊断的科学卓越和创新能力的战略), 为临床研究人员和新兴研究小组 IRYCIS (2021/0446)、患者衍生类器官 2.0 项目 (CIBERONC) 和 TRANSCAN II 项目征集新研究项目 JTC 2017 呼吁"建立胰腺神经内分泌肿瘤患者早期诊断和随访的算法 (NExT)",批准号 1.1.1.5/ERANET/20/03。本协议中使用的生物样本由Ramón y Cajal-IRYCIS生物银行医院(B.0000678)提供,并集成到ISCIII(PT20/00045)的生物样本库和生物模型平台中。我们还要感谢 Yvonne Kohl、Agapi Kataki Vita Rovita 和 Thorsten Knoll 对开发该协议作为 NExT 和 VISION 项目的一部分的宝贵支持。
材料
| Name | Company | Catalog Number | Comments |
| 6 well Costar Ultra-low Attachment plates | Biofil | TCP011006 | |
| 70 μm pore strainer | VWR | 732-2758 | |
| Ammonium Chloride Potassium (ACK) Lysis Buffer | Gibco | A10492-01 | |
| Amphotericin B | Gibco | 15290018 | |
| Cell culture incubator (21% O2, 5% CO2 and 37 ºC) | Nuaire | NU-4750E | |
| Cell recovery solution | Corning | 354253 | |
| Collagenase IV | Gibco | 17104019 | |
| DMEM/F-12 (1:1)(1X) with L-Glutamine and HEPES | Gibco | 31330-038 | |
| DNase | Roche | 10104159001 | |
| Fetal Bovine Serum (FBS) | Corning | 35-079-CV | |
| Freezing container, Nalgene | Merck | C1562 | |
| gentleMACS Octo Dissociator | Milteny Biotec | 130-096-427 | |
| HEPES | Gibco | 15630056 | |
| Human Placenta Growth Factor (PlGF) | enQuireBio | QP6485-EC-100UG | |
| Immunocompromised female 6-week-old NU-Foxn1nu nude mice | Janvier, France | ||
| Insulin-like growth factor-1 (IGF-1) | Invitrogen | RP10931 | |
| L-Glutamine | Corning | 354235 | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| Normocin | InvivoGen | ant-nr-2 | |
| Pasteur pipettes | Deltalab | 200007 | |
| Penicillin Streptomycin Solution (100x) | Corning | 30-002-CI | |
| Phosphate-Buffered Saline (PBS) | Corning | 21-040-CV | |
| Recombinant Human Basic Fibroblast Growth Factor (bFGF) | Gibco | PHG0026 | |
| Recombinant Human Epidermal Growth Factor (EGF) | Gibco | PHG0311 | |
| ROCK Inhibitor Y-27632 (Dihydrochloride) | STEMCELL | 72304 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | |
| Surgical Blades | Nahita | FMB018 | |
| Trypsin | Gibco | 25300054 |
参考文献
- April-Monn, S. L., et al. Patient-derived tumoroids of advanced high-grade neuroendocrine neoplasms mimic patient chemotherapy responses and guide the design of personalized combination therapies. bioRxiv. , (2022).
- Frappart, P. O., et al. Pancreatic cancer-derived organoids - A disease modeling tool to predict drug response. United European Gastroenterology Journal. 8 (5), 594-606 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Aberle, M. R., et al. Patient-derived organoid models help define personalized management of gastrointestinal cancer. The British Journal of Surgery. 105 (2), e48-e60 (2018).
- Yoshida, G. J. Applications of patient-derived tumor xenograft models and tumor organoids. Journal of Hematology & Oncology. 13 (1), 4 (2020).
- Hong, H. K., et al. Efficient primary culture model of patient-derived tumor cells from colorectal cancer using a Rho-associated protein kinase inhibitor and feeder cells. Oncology Reports. 42 (5), 2029-2038 (2019).
- April-Monn, S. L., et al. 3D primary cell culture: A novel preclinical model for pancreatic neuroendocrine tumors (PanNETs). Neuroendocrinology. 111 (3), 273-287 (2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), e106 (2020).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 5739 (2020).
- Yu, J., Huang, W. The progress and clinical application of breast cancer organoids. International Journal of Stem Cells. 13 (3), 295 (2020).
- Barbáchano, A., et al. Organoids and colorectal cancer. Cancers. 13 (11), 2657 (2021).
- Michels, B. E., et al. Human colon organoids reveal distinct physiologic and oncogenic Wnt responses. Journal of Experimental Medicine. 216 (3), 704-720 (2019).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Porter, R. J., Murray, G. I., McLean, M. H. Current concepts in tumour-derived organoids. British Journal of Cancer. 123 (8), 1209-1218 (2020).
- Wang, Q., Guo, F., Jin, Y., Ma, Y. Applications of human organoids in the personalized treatment for digestive diseases. Signal Transduction and Targeted Therapy. 7 (1), 336 (2022).
- Wang, J., et al. Patient-derived tumor organoids: New progress and opportunities to facilitate precision cancer immunotherapy. Frontiers in Oncology. 12, 1382 (2022).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17 (1), 1-15 (2015).
- Marsee, A., et al. Building consensus on definition and nomenclature of hepatic, pancreatic, and biliary organoids. Cell Stem Cell. 28 (5), 816-832 (2021).
- Mueller, M. T., et al. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 137 (3), 1102-1113 (2009).
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. 20 (2), 273-286 (2019).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Chen, P., et al. Patient-derived organoids can guide personalized-therapies for patients with advanced breast cancer. Advanced Science. 8 (22), 2101176 (2021).
- Furbo, S., et al. Use of patient-derived organoids as a treatment selection model for colorectal cancer: A narrative review. Cancers. 14 (4), 1069 (2022).
- Xu, H., Jiao, D., Liu, A., Wu, K. Tumor organoids: Applications in cancer modeling and potentials in precision medicine. Journal of Hematology & Oncology. 15 (1), 58 (2022).
- Xu, H., et al. Organoid technology in disease modelling, drug development, personalized treatment and regeneration medicine. Experimental Hematology & Oncology. 7 (1), 30 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Ling, L., et al. Effect of heparin on the biological properties and molecular signature of human mesenchymal stem cells. Gene. 576, 292-303 (2016).
- Bajpai, R., Lesperance, J., Kim, M., Terskikh, A. V. Efficient propagation of single cells Accutase-dissociated human embryonic stem cells. Molecular Reproduction and Development. 75 (5), 818-827 (2008).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Walsh, A. J., et al. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889 (2016).
- Bui, B. N., et al. Organoids can be established reliably from cryopreserved biopsy catheter-derived endometrial tissue of infertile women. Reproductive BioMedicine Online. 41 (3), 465-473 (2020).
- Verissimo, C. S., et al. Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening. eLife. 5, e18489 (2016).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Protocols for Generating, Manipulating, and Analyzing Pancreatic Organoid Cultures. Cold Spring Harbor Laboratory. Tuveson Lab Available from: https://tuvesonlab.labsites.cshl.edu/protocolsreagents/ (2023)
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。