Method Article
Mise en place d’organoïdes tumoraux et de fibroblastes dérivés du cancer du pancréas à partir de tissus frais
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les organoïdes tumoraux ont révolutionné la recherche sur le cancer et l’approche de la médecine personnalisée. Ils représentent un modèle de tumeur cliniquement pertinent qui permet aux chercheurs de garder une longueur d’avance sur la tumeur en clinique. Ce protocole établit des organoïdes tumoraux à partir d’échantillons frais de tissus tumoraux pancréatiques et de xénogreffes dérivées de patients d’origine adénocarcinome pancréatique.
Résumé
Les organoïdes tumoraux sont des modèles tumoraux ex vivo tridimensionnels (3D) qui récapitulent les principales caractéristiques biologiques des tissus tumoraux primaires d’origine. Les organoïdes tumoraux dérivés de patients ont été utilisés dans la recherche translationnelle sur le cancer et peuvent être appliqués pour évaluer la sensibilité et la résistance au traitement, les interactions cellule-cellule et les interactions des cellules tumorales avec le microenvironnement tumoral. Les organoïdes tumoraux sont des systèmes de culture complexes qui nécessitent des techniques de culture cellulaire avancées et des milieux de culture avec des cocktails de facteurs de croissance spécifiques et une membrane basale biologique qui imite l’environnement extracellulaire. La capacité d’établir des cultures tumorales primaires dépend fortement du tissu d’origine, de la cellularité et des caractéristiques cliniques de la tumeur, telles que le grade de la tumeur. De plus, la collecte d’échantillons de tissus, la qualité et la quantité des matériaux, ainsi qu’une biobanque et un stockage corrects sont des éléments cruciaux de cette procédure. Les capacités techniques du laboratoire sont également des facteurs cruciaux à prendre en compte. Ici, nous rapportons une SOP/protocole validé qui est techniquement et économiquement réalisable pour la culture d’organoïdes tumoraux ex vivo à partir d’échantillons de tissus frais d’origine adénocarcinome pancréatique, soit à partir de tissus de donneurs primaires primaires frais réséqués de patients, soit de xénogreffes dérivées de patients (PDX). La technique décrite ici peut être réalisée dans des laboratoires avec des installations de culture tissulaire et de souris de base et est adaptée à une large application dans le domaine de l’oncologie translationnelle.
Introduction
Les organoïdes tumoraux sont des cultures organisées en trois dimensions (3D) ex vivo qui sont dérivées de tissus tumoraux frais et fournissent des modèles de cancer. Les organoïdes tumoraux récapitulent les principales caractéristiques biologiques de la tumeur primaire d’origine 1,2,3,4 et peuvent être étendus jusqu’à plusieurs mois et cryoconservés, comme les lignées cellulaires immortalisées conventionnelles. Les organoïdes tumoraux fournissent une biobanque de modèles tumoraux dérivés de patients pour la médecine translationnelle/personnalisée5 et représentent une avancée importante dans les systèmes/modèles de biologie des cellules cancéreuses. Les organoïdes tumoraux dérivés du patient peuvent être utilisés comme modèles ex vivo pour prédire l’efficacité des thérapies oncologiques/pharmacologiques (néo)adjuvantes, pour lesquelles des cultures sont établies à partir de tissus tumoraux frais et des tests de sensibilité aux médicaments ou des pharmacotypages sont effectués sur une base spécifique au patient afin d’identifier des agents efficaces pour les lignes de traitement ultérieures 1,4. De plus, les organoïdes tumoraux surmontent la limitation de la disponibilité du tissu tumoral primaire et, plus important encore, fournissent un excellent système alternatif ou complémentaire aux modèles murins in vivo, tels que les xénogreffes dérivées du patient (PDX)2. La complexité des organoïdes tumoraux est augmentée si les cellules tumorales primaires sont combinées avec des cellules stromales qui se trouvent dans le microenvironnement tumoral (ETM), telles que les fibroblastes associés au cancer (CAF), les cellules endothéliales et les cellules immunitaires, qui imitent le fonctionnement et la cellularité complexe de la tumeur primaire. Des organoïdes tumoraux ont été établis pour de nombreux types de tumeurs à l’aide de protocoles standardisés 6,7,8,9,10. La propagation des organoïdes à partir de différentes tumeurs solides, y compris les tissus colorectaux et cancéreux du sein, est bien établie et techniquement abordable 11,12,13,14,15.
Les résections tumorales chirurgicales ou les biopsies tumorales fournissent des échantillons de tissus tumoraux primaires. Idéalement, les échantillons de tissu tumoral devraient provenir du centre de la masse tumorale ou du bord envahisseur de la tumeur, ainsi que des tissus d’apparence normale adjacents à la tumeur. Par rapport aux cultures 2D conventionnelles, les organoïdes tumoraux nécessitent plusieurs « add-ons », y compris une membrane basale biologique (telle que le Matrigel, l’hydrogel ou un échafaudage à base de collagène), qui imite l’ETM extracellulaire, et un milieu de croissance liquide qui fournit des nutriments et des facteurs de croissance spécifiques et soutient la prolifération et la viabilité cellulaires en culture16.
Les étapes les plus élémentaires de la culture cellulaire primaire sont le lavage du tissu dans une solution saline pour éviter la contamination, la découpe/digestion mécanique de la tumeur en petits morceaux de 1 à 3 mm3 et le traitement avec de la collagénase pour la digestion enzymatique du tissu. Le mélange digéré est ensuite filtré pour éliminer les gros fragments de tissus, remis en suspension dans une membrane basale biologique telle que Matrigel, et plaqué sous forme de dômes dans des plaques de culture à faible adhérence pour améliorer la croissance sans attachement. Les dômes de la matrice membranaire basale sont recouverts d’un milieu de culture liquide et complétés par de la glutamine et des antibiotiques pour éviter la contamination, ainsi que par des facteurs de croissance spécifiques en fonction du type de tissu 7,8,9,16,17. D’autres cellules pertinentes présentes dans la tumeur en vrac et l’ETM peuvent également être isolées, telles que les fibroblastes associés au cancer (CAF) et les cellules immunitaires. Cette technique, qui vient d’être revue18, permet la mise en place de co-cultures avec différents types de cellules pour étudier la réponse au traitement dans un environnement tumoral plus « réaliste ». De plus, les interactions cellule-cellule et l’interaction entre les cellules tumorales et les composants de la matrice biologique environnante peuvent être étudiées.
Le taux de réussite rapporté de l’établissement d’organoïdes tumoraux à l’aide de tissus frais provenant de biopsies ou de tissus tumoraux gastro-intestinaux réséqués est d’environ 50 %11, et le taux de réussite de ce dernier dépend largement du type et de l’origine des tissus4, en particulier du grade de la tumeur et de la cellularité tumorale globale. Les modèles de tumeurs tridimensionnels ont une complexité variable, allant de simples agrégats unicellulaires à des modèles techniques très complexes composés de différents types de cellules. La terminologie utilisée pour décrire les cultures 3D dans la littérature est très incohérente 19,20,21, car différents termes tels que sphéroïdes, tumorsphères et organoïdes sont utilisés, bien que la différence entre eux ne soit pas claire. Comme un consensus clair sur la définition n’a pas encore été atteint, dans cet article, un organoïde tumoral est décrit comme une culture de cellules tumorales organisée intégrée dans une membrane basale biologique.
Dans le présent document, un protocole validé est rapporté pour l’établissement d’organoïdes tumoraux à partir d’échantillons de tissus frais provenant d’adénocarcinomes canalaires pancréatiques (PDAC) primaires réséqués ou dérivés de PDX, et ce protocole peut être effectué dans la plupart des laboratoires disposant d’installations de culture tissulaire de base. Ce protocole a été adapté à partir de plusieurs protocoles de pointe qui sont actuellement utilisés pour établir des organoïdes tumoraux ou des tumoroïdes à partir de tissus tumoraux digestifs des groupes de David Tuveson9, Hans Clevers8 et Aurel Perren7.
Ce protocole ne traite pas de la façon dont les tissus frais sont récoltés. Pour obtenir du tissu tumoral humain frais de haute qualité, il est important d’avoir une coordination efficace entre les chirurgiens qui prélèvent le tissu et le service de pathologie qui extrait l’échantillon de tissu pour la culture organoïde. De même, lors de l’utilisation de PDX comme source de tissus frais, une coordination efficace avec la personne qui prélève l’échantillon de tissu est également importante. Il est essentiel d’obtenir l’échantillon de tissu le plus rapidement possible (dans les 30 à 60 minutes suivant le moment de la récolte) afin de maintenir une qualité élevée.
Protocole
Toutes les procédures ont été effectuées conformément aux directives institutionnelles pour le bien-être des animaux de laboratoire approuvées par le Comité d’éthique de l’Universidad Autónoma de Madrid (CEI 103-1958-A337) et La Comunidad de Madrid (PROEX 294/19) et conformément aux directives pour une conduite éthique dans le soin et l’utilisation des animaux telles qu’énoncées dans les Principes directeurs internationaux pour la recherche biomédicale impliquant des animaux. élaboré par le Conseil des organisations internationales des sciences médicales (CIOMS). Le protocole suivait les principes éthiques de la recherche biomédicale avec un consentement éclairé écrit. Une approbation éthique préalable a été obtenue pour l’utilisation de tissus frais pour l’établissement des cultures d’organoïdes tumoraux. Les échantillons ont été fournis par l’hôpital BioBank Ramón y Cajal-IRYCIS (Registre national des biobanques B.0000678), intégrés à la plateforme de biobanques et de biomodèles de l’ISCIII (PT20/00045), et traités selon les procédures opérationnelles standard avec l’approbation éthique appropriée. Les tumeurs ont été implantées par voie sous-cutanée,comme décrit précédemment, chez des souris nues femelles NU-Foxn1nu immunodéprimées âgées de 6 semaines (voir le tableau des matériaux) et transmises in vivo pour établir des PDX PDAC.
1. Préparation expérimentale
- Manipuler des échantillons humains dans une enceinte de sécurité biologique de classe II.
- Portez une blouse de laboratoire, des gants de protection et des lunettes tout au long de la procédure pour éviter l’infection par des agents pathogènes transmis par les tissus.
REMARQUE : Un minimum de 3 heures est nécessaire pour traiter l’échantillon de tissu frais et plaquer les organoïdes et les fibroblastes. - Traiter les échantillons de tissus frais 22 dans un délai maximum de24 h à compter du prélèvement, et les conserver à 4 °C dans un milieu de culture tissulaire (DMEM complété par 10 % de FBS et 1 % de pénicilline-streptomycine) jusqu’au traitement.
- Conservez tous les échantillons et réactifs sur la glace pendant toute la procédure, et assurez-vous de prérégler une centrifugeuse réfrigérée à 4 °C et de l’utiliser à basse vitesse pour éviter d’endommager la préparation cellulaire.
- Conservez les pointes de pipette P1 000 et P200 dans un congélateur à −20 °C pour les utiliser pendant le protocole.
- Aliquoter la matrice de la membrane basale (voir le tableau des matériaux) avant utilisation. Pour ce protocole, 250 mL d’aliquotes sont recommandées.
2. Traitement du tissu tumoral primaire frais pour établir des organoïdes tumoraux et des fibroblastes primaires
REMARQUE : Un minimum de 3 heures est nécessaire pour traiter l’échantillon de tissu frais (tumeurs résécables humaines primaires ou PDX) et pour plaquer les organoïdes tumoraux et les fibroblastes. Un aperçu du processus de préparation des organoïdes est présenté à la figure 1, de la digestion des tissus au placage des organoïdes tumoraux. Avant de commencer le protocole, sortez une aliquote de la matrice de la membrane basale du congélateur à −20 °C et laissez-la sur glace pendant environ 30 à 60 minutes avant utilisation.
- Mettre une plaque de culture à 6 puits dans un incubateur de culture cellulaire à 37 °C 3 h avant de plaquer les organoïdes.
- Mesurez, photographiez et lavez le tissu (étape 1.3) avec 3 mL de DMEM-F12 avancé (Dulbecco’s Modified Eagle’s Medium (DMEM)/Nutrient Mixture F-12 Ham (F12), complété par 5 % de sérum de veau fœtal (FBS), 15 mM de Hepes, 1 % de L-glutamine, 1 % de pénicilline-streptomycine, 125 ng/mL d’amphotéricine B, 0,1 mg/mL de normocine) (voir le tableau des matériaux) en pipetant de haut en bas, puis lavez avec 3 mL de solution saline tamponnée au phosphate (PBS) en pipetant de haut en bas.
- Retirer le milieu par aspiration de la plaque de culture tissulaire et couper le tissu en3 morceaux de 1 mm dans une plaque de culture tissulaire stérile à l’aide de deux lames stériles et de 2 mL de milieu de digestion (DMEM-F12 avancé + 10 mg de collagénase IV/mL, 0,000625 % de trypsine-EDTA et 10 μg/mL de DNase). Prélever le tissu dans un tube de 50 mL avec un total de 5 mL de milieu de digestion et incuber pendant 1 h à 37 °C par digestion mécanique à l’aide d’un équipement disponible dans le commerce (voir le tableau des matériaux) ou par mélange périodique de l’échantillon, en pipetant l’échantillon de haut en bas.
- Ajouter 5 mL de DMEM-F12 avancé pour inactiver la trypsine et filtrer l’échantillon à travers une crépine de 70 μm pour éliminer les gros débris.
- Ajouter 2 mL de DMEM avec 10 % de FBS sur le dessus du filtre et recueillir les débris et les restes de tissus pour établir des cultures de fibroblastes (voir l’étape 5).
- Centrifuger le filtrat à 200-300 x g pendant 5 min à température ambiante et aspirer le surnageant en ne laissant que la pastille de cellule. Ajouter 5 mL d’Advanced DMEM-F12 et centrifuger pendant 5 min à 300 x g.
- Remettre la pastille en suspension dans 4 mL de tampon de lyse au chlorure d’ammonium-potassium (ACK, voir le tableau des matériaux). Passer le mélange dans un tube de 15 mL et incuber à température ambiante pendant 2 min pour lyser les globules rouges.
REMARQUE : Cette étape de lyse des globules rouges peut être retirée lorsqu’il n’y a aucun signe visible de contamination. - Centrifuger à 300 x g pendant 5 min à température ambiante, et aspirer le surnageant. Ajouter 5 mL d’Advanced DMEM-F12 et centrifuger pendant 5 min à 300 x g.
- Ajouter 1 mL de réactif de dissociation cellulaire disponible dans le commerce (voir le tableau des matériaux) complété par de la DNase (1 μg/mL) à la pastille cellulaire et incuber pendant 2 à 3 minutes à température ambiante.
- Centrifuger à 300 x g pendant 5 min et aspirer le surnageant. Ajouter 5 mL d’Advanced DMEM-F12 et remettre en suspension la pastille cellulaire.
- Pipeter 30 fois de haut en bas avec une pipette P1 000 pour dissocier les cellules, centrifuger pendant 5 min à 300 x g et retirer le surnageant.
- Prélever les pointes de pipette P1 000 et P200 dans le congélateur à −20 °C et remettre en suspension la pastille cellulaire dans la matrice membranaire à l’aide d’une pipette P1 000 et d’embouts froids (50 μL par goutte, en tenant compte du volume de pastilles, six à sept dômes par puits). Sortez la plaque préalablement chauffée de l’incubateur. Réglez une pipette P200 sur 48 μL et utilisez des pointes froides pour créer des dômes de la matrice de la membrane basale dans la plaque préchauffée à 6 puits.
- Placez la plaque avec les dômes de la matrice de la membrane basale dans l’incubateur à 37 °C à 5 % de CO2 pendant 15 min pour solidifier la matrice de la membrane basale.
- Ajouter 2 à 2,5 mL de DMEM-F12 avancé, complété par 20 ng/mL de facteur de croissance épidermique humain recombinant (EGF), 100 ng/mL de facteur de croissance du placenta humain (PlGF), 10 ng/mL de facteur de croissance des fibroblastes humains basiques recombinants (bFGF), 769 ng/mL de facteur de croissance analogue à l’insuline-1 (IGF-1) et 10,5 μM d’inhibiteur de ROCK (DMEM-F12 avancé + facteurs de croissance) (voir le tableau des matériaux).
3. Surveillance des organoïdes
- Surveillez visuellement la culture d’organoïdes tumoraux pendant les 7 premiers jours, puis trois fois par semaine par la suite.
- Changez le milieu deux fois par semaine avec Advanced DMEM-F12 contenant 20 ng/mL de facteur de croissance épidermique humain recombinant (EGF), 100 ng/mL de facteur de croissance du placenta humain (PlGF), 10 ng/mL de facteur de croissance des fibroblastes humains basiques recombinants (bFGF), 769 ng/mL de facteur de croissance analogue à l’insuline-1 (IGF-1) et 10,5 μM d’inhibiteur de ROCK (Advanced DMEM-F12 + facteurs de croissance).
- Capturez des images de la culture d’organoïdes tumoraux périodiquement le jour 1, le jour 3, le jour 7, le jour 10 et le jour 15 après avoir traité l’échantillon et plaqué la culture dans la matrice pour observer la croissance et la viabilité.
4. Passage et cryostockage des organoïdes
- Retirez le milieu de culture de la plaque à 6 puits.
- Ajouter 1 mL d’un réactif de récupération cellulaire approprié (voir le tableau des matériaux) pour dissocier la matrice de la membrane basale et obtenir une suspension cellulaire, puis récupérer le surnageant dans un tube de 15 mL. Si la matrice ne se dissocie pas immédiatement, incuber l’échantillon à 4 °C pendant 15 à 20 minutes jusqu’à ce qu’il soit complètement dissous.
- Ajouter 1 mL du même réactif de récupération cellulaire que celui utilisé à l’étape 4.2 dans le puits de la plaque pour récupérer d’autres cellules dissociées, et ajouter le surnageant dans le même tube de 15 mL qu’à l’étape 4.2.
- Ajouter 5 mL de DMEM-F12 avancé froid et centrifuger à 200 x g pendant 5 min.
- Retirez le surnageant et séchez soigneusement la pastille en enlevant tout liquide restant à l’aide d’une pipette de 5 mL ; Évitez autant que possible de déplacer le tube. Remettre en suspension la pastille cellulaire dans deux fois le volume d’origine de la matrice de la membrane basale afin d’obtenir un passage de 1 :2.
- Pour la cryoconservation des cultures organoïdes, remettre en suspension la pastille obtenue à l’étape 4.5 dans 1 mL de milieu de congélation (10 % de DMSO, 20 % de FBS, 50 % de DMEM-F12, inhibiteur de ROCK de 10,5 μM) et conserver à −80 °C.
REMARQUE : Le volume de la matrice de la membrane basale peut être ajusté pour effectuer différents passages, tels que 1 :1 (en utilisant le même volume de matrice de membrane basale que l’original) ou 1 :3 (en ajoutant trois fois le volume d’origine de la matrice de la membrane basale).
5. Mise en place de fibroblastes
- Après avoir récupéré les débris et les restes de tissus dans 2 mL de DMEM avec 10 % de FBS, ajoutez-le à une plaque à 6 puits et incubez à 37 °C avec 5 % de CO2.
- Retirez les restes de tissus des cultures de fibroblastes de l’étape 2.5 par aspiration du milieu 2 jours ou 3 jours après le placage, et remplacez-les par du DMEM frais avec 10% de FBS.
- Surveillez visuellement la culture des fibroblastes trois fois par semaine et changez le milieu de culture au moins deux fois par semaine à l’aide de DMEM complété par 10 % de FBS.
Résultats
Il est important de documenter l’évolution de la culture d’organoïdes tumoraux au fil du temps, en particulier au cours des premières semaines, afin d’estimer le comportement de la culture dans les tests en aval. La figure 2 montre un exemple d’isolement optimal des cellules tumorales et d’établissement d’organoïdes tumoraux à partir de tissus frais sur une période de 15 jours. Parfois, il y a un grand volume de débris cellulaires dans l’échantillon, et il est difficile de voir les organoïdes tumoraux en développement, comme le montre la figure 3. De plus, le phénotype des organoïdes en développement peut varier d’organoïdes isolés et arrondis (Figure 4A) à des cultures sphéroïdes/granulats (Figure 4B-D), et cela dépend de l’origine de la tumeur. Les fibroblastes sont un sous-produit courant de l’établissement de la culture de cellules tumorales primaires à partir de tumeurs solides, en particulier celles à forte teneur en stroma, et peuvent souvent contaminer la culture d’organoïdes. La figure 5 montre comment ces cellules ont migré des dômes de la matrice de la membrane basale et ont adhéré aux plaques de culture après environ 7 jours. Ces cellules consomment les nutriments du milieu de culture, compromettant ainsi la croissance optimale des organoïdes.
Les fibroblastes primaires peuvent être obtenus sous forme de culture isolée lorsqu’ils migrent hors des coupes de tissus, adhèrent aux plaques de culture et se développent sous forme de culture monocouche, comme le montre la figure 6. Ce protocole recommande l’utilisation d’un milieu DMEM standard avec 10% de FBS pour la culture des fibroblastes. Cependant, un milieu spécialisé pour les fibroblastes peut également être utilisé. Les fibroblastes adhérents sont visibles environ 7 jours après le placage (Figure 6).

Figure 1 : Traitement d’échantillons de tissus frais pour établir des organoïdes tumoraux. Un aperçu du processus de préparation des organoïdes tumoraux est présenté, de la digestion des tissus au placage des organoïdes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Culture d’organoïdes tumoraux établie à partir d’un PDX provenant d’une tumeur PDAC fraîche. La progression de la culture d’organoïdes tumoraux sur plusieurs jours est montrée, avec des images des organoïdes dans un plan microscopique les jours 1, 3, 7, 10 et 15. Barre d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Exemples d’une culture d’organoïdes tumoraux non optimale au jour 2 avec un excès de débris cellulaires. Barre d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Organoïdes tumoraux établis à partir de différents tissus PDAC PDX montrant des différences de taille et de morphologie. Les organoïdes tumoraux peuvent avoir un phénotype arrondi classique (A) ou (B-D) un aspect plus sphéroïde/agrégat. La taille moyenne des organoïdes varie de 80 μM à 100 μM, bien que certains organoïdes puissent atteindre 200 μM. Barre d’échelle : 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Exemples d’une culture d’organoïdes tumoraux (A-C) non optimale contaminée par des CAF/fibroblastes après 30 jours de culture. Barre d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
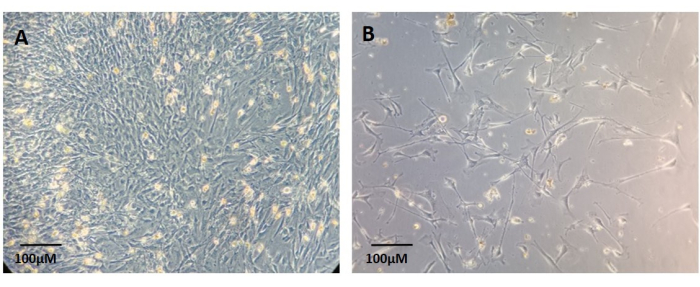
Figure 6 : Exemples de cultures de fibroblastes primaires établies à partir des restes du tissu tumoral primaire digéré. (A) Culture confluente. (B) Culture non confluente. Barre d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier complémentaire 1 : Dépannage de l’établissement d’une culture d’organoïdes tumoraux. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les progrès majeurs dans les thérapies pharmacologiques contre le cancer sont difficiles, car la probabilité d’approbation des médicaments dans les essais cliniques de phase I en oncologie est de 5,1 %, ce qui est le plus bas de tous les types de maladie23. La raison principale est que le cancer est très hétérogène et, par conséquent, les cohortes de patients ne répondent pas uniformément comme prévu au traitement donné, ce qui souligne qu’une approche plus personnalisée est nécessaire. Les cultures bidimensionnelles (2D) sont utilisées dans la recherche translationnelle sur le cancer depuis de nombreuses années, mais n’ont pas l’organisation structurelle 3D que l’on trouve dans les tumeurs primaires. Ainsi, ils ne reflètent pas avec précision les réponses thérapeutiques des patients et la communication des cellules tumorales entre elles ou avec leur microenvironnement 3,23. Le principe de base sous-jacent de tous les systèmes de culture 3D est de favoriser l’interaction cellulaire avec l’environnement et d’organiser les cellules d’une manière spatialement pertinente, similaire à celle de la tumeur primitive (in situ). La morphologie des organoïdes tumoraux varie de ronde, massive et semblable à du raisin à étoilée en fonction de la nature inhérente des cellules cultivées et des conditions de culture utilisées, comme le montre la figure 4. Les cultures d’organoïdes tumoraux dérivées du patient peuvent être traitées avec le même traitement de première intention que celui utilisé chez le patient afin de confirmer que l’organoïde tumoral récapitule la situation clinique (c’est-à-dire la réponse au traitement clinique)1,13,24,25.
Les organoïdes tumoraux peuvent également être traités avec de nouveaux agents pharmacologiques, ce qui fournit une approche exploratoire pour identifier de nouvelles thérapies qui pourraient être utilisées dans les lignes de traitement ultérieures en clinique lorsque les options thérapeutiques standard ont été épuisées. La culture est surveillée en permanence pour évaluer la réponse des cultures d’organoïdes tumoraux à l’agent en temps réel. Une étude de faisabilité de la caractérisation moléculaire et immunohistochimique de la tumeur de xénogreffe dérivée du patient (PDX) et des organoïdes dérivés de PDX a montré que la morphologie, l’expression des protéines et les altérations génomiques étaient comparables entre les deux modèles. De plus, une étude de preuve de concept de pharmacotypage a montré que les prédictions in vivo et ex vivo étaient également comparables et, par conséquent, a conclu que l’utilisation d’organoïdes tumoraux comme modèle de cancer/maladie est une approche réalisable et robuste qui peut être appliquée dans le cadre clinique2.
Une série de défis liés à l’établissement de cultures d’organoïdes tumoraux provenant de différents types de tumeurs ont été mis en évidence ici et récemment examinés26,27,28. Les principaux problèmes sont la « contamination/prolifération » par les cellules saines, qui forment des organoïdes avec un taux de croissance plus élevé que les cellules cancéreuses, le coût élevé de la maintenance de la culture par rapport aux cultures 2D, le faible taux d’établissement, les incohérences dans le profil de mutation somatique et l’histologie entre la culture ex vivo et la tumeur d’origine, l’hétérogénéité de la tumeur primaire, l’utilisation d’une matrice extracellulaire à base de murine, ce qui peut ne pas être optimal pour les cellules humaines et peut entraver l’administration du médicament, l’absence de l’ETM et des cellules associées, l’interférence de facteurs de croissance ou d’inhibiteurs moléculaires avec la réponse au médicament, et l’absence de protocoles standardisés et validés pour l’établissement et le maintien des organoïdes tumoraux. Cependant, au fil des ans, l’utilisation de modèles de tumeurs primaires dans la recherche sur le cancer a augmenté, et les techniques de culture et de maintenance des cultures primaires se sont améliorées. Ces cultures ex vivo délicates sont établies et maintenues par l’ajout de suppléments pour favoriser la croissance et la stabilité cellulaires. L’inhibiteur de la kinase Rho (ROCK) est maintenant systématiquement ajouté aux cultures primaires pour éviter l’apoptose et améliorer l’adhésion cellule-cellule, favorisant ainsi l’expansion à long terme de cultures primaires in vitro stables29. De plus, il augmente également la survie des cellules souches cryoconservées décongelées, ce qui est important lors de la génération de stocks congelés de cultures organoïdes29. La supplémentation en héparine peut également être utilisée pour améliorer l’expansion des cellules souches en augmentant la signalisation WNT et FGF et, par conséquent, la prolifération cellulaire30. D’autres réactifs importants utilisés dans ce protocole validé pour optimiser l’établissement des organoïdes tumoraux comprennent l’Accutase et la DNase. L’accutase est un réactif de digestion douce recommandé pour séparer les cellules souches individuelles ou les détacher des surfaces de culture, et il aide à maintenir la viabilité cellulaire mieux que l’utilisation d’autres réactifs conçus à cet effet, tels que la trypsine31. Cependant, les collagénases peuvent également être utilisées pour cibler spécifiquement le type de collagène incorporé dans la membrane basale biologique. La DNase est utilisée dans les méthodes d’isolement cellulaire depuis de nombreuses années32 pour éliminer les restes d’ADN des cellules mortes et nécrotiques pendant le protocole d’extraction et, ainsi, empêcher l’agglutination/agrégation des cellules en raison de la viscosité accrue de la préparation de l’échantillon. Les pastilles cellulaires sont souvent traitées avec un tampon de lyse, mais cette étape peut être exclue lorsqu’il n’y a pas de signe visible de contamination par les globules rouges de l’échantillon de tissu8 (Fichier supplémentaire 1).
L’établissement réussi d’organoïdes tumoraux ne va pas sans complications biologiques inhérentes. Idéalement, les tissus destinés aux cultures d’organoïdes tumoraux devraient être traités le même jour que le prélèvement afin d’optimiser la viabilité cellulaire. La congélation des tissus n’est pas toujours recommandée car elle peut réduire considérablement la viabilité cellulaire. Cependant, les organoïdes tumoraux peuvent être établis à l’aide d’échantillons qui ont été surgelés ou lentement cryoconservés dans un milieu de congélation contenant du DMSO33,34, ce qui permet l’expédition d’échantillons et la biobanque. Dans certains cas, il est possible d’obtenir des cultures 2D à partir de cultures d’organoïdes tumoraux qui ont été passées plusieurs fois par la récupération des cellules tumorales attachées aux plaques après avoir retiré les dômes de la matrice de la membrane basale. D’après notre expérience, le taux de réussite de l’établissement d’organoïdes tumoraux est beaucoup plus élevé avec le tissu PDX PDAC qu’avec le tissu PDAC frais dérivé d’un échantillon réséqué4. Cela est dû au fait que de plus gros morceaux de tissu PDX PDAC frais sont généralement disponibles, et que ce tissu a une cellularité plus élevée, probablement en raison de l’environnement in vivo plus hospitalier fourni par le modèle PDX par rapport aux approches ex vivo. Des agents non toxiques peuvent être ajoutés au milieu de culture pour surveiller la viabilité cellulaire et la prolifération de la culture. De plus, la prolifération d’organoïdes non néoplasiques doit être évitée en utilisant des conditions sélectives35,36. Le tissu pancréatique peut contenir des enzymes digestives qui pourraient affecter la viabilité des cellules tumorales isolées ; Ainsi, la trypsine peut être ajoutée à l’étape de digestion pour surmonter ce problème4. De nombreux autres facteurs, tels que l’état du patient/tissu (c’est-à-dire traité ou non avec un traitement oncologique), le type de tumeur, la contamination de l’échantillon de la salle d’opération et le grade d’origine de la tumeur, peuvent également influencer de manière significative la capacité d’établir un organoïde tumoral. De même, tous les tissus n’ont pas suffisamment de cellules tumorales viables pour établir des cultures primaires. Cela est particulièrement vrai pour les tumeurs PDAC, qui sont notoirement riches en stroma (environ 90 % à 95 %) et contiennent un faible pourcentage de cellules tumorales épithéliales. De plus, les tissus à forte teneur en stroma peuvent être difficiles à couper et à dissocier pour obtenir des cellules tumorales uniques à cultiver. Des milieux de digestion spécialisés et disponibles dans le commerce peuvent être ajoutés, ou un équipement de dissociation mécanique peut également être utilisé si le tissu n’est pas complètement digéré. Alternativement, une dissociation complète des tissus peut être obtenue en coupant en continu à l’aide de deux lames de scalpel jusqu’à ce que le tissu ait un aspect semi-liquide (voir la démonstration vidéo).
Il existe de nombreux pièges techniques au cours de la procédure qui doivent également être soulignés. Par exemple, les restes de tissus peuvent obstruer le filtre, et le filtre doit alors être changé, car les restes empêchent le passage du surnageant liquide. L’étape de filtration peut être répétée plusieurs fois pour récupérer le maximum de cellules tumorales dissociées. De plus, il est important de vérifier la pastille de cellule après chaque étape de centrifugation, car il est parfois difficile de voir quand le nombre de cellules est faible. Le pipetage des pastilles cellulaires doit être effectué doucement et lentement, car un pipetage agressif peut entraîner une perte de cellules ou une réduction de la viabilité cellulaire. De plus, lors de la préparation du mélange matrice-cellule, il convient d’utiliser des fluides prérefroidis à 4 °C et des embouts réfrigérés stockés à −20 °C, car la matrice se solidifie rapidement. Enfin, et comme mentionné ci-dessus, la DNase aide à prévenir l’agglutination des cellules lors de la préparation des échantillons. Il est également recommandé d’aliquoter les réactifs utilisés dans le protocole et de préparer des mélanges de facteurs de croissance afin d’éviter la congélation-décongélation répétitive des réactifs.
L’isolement des fibroblastes primaires est intéressant, car ils constituent un type de cellule important dans la PDAC et peuvent être utilisés pour des expériences de co-culture ultérieures afin de déterminer les effets de l’ETM sur la croissance des cellules tumorales. Après environ 1 semaine, les fibroblastes ont migré hors des sections de tissu et peuvent généralement être vus attachés aux plaques de culture et se développant sous forme de culture monocouche. Cependant, la présence de fibroblastes dans la culture présente également des inconvénients, car ils consomment les nutriments du milieu de culture et, par conséquent, compromettent la croissance optimale des organoïdes tumoraux. Les plaques à fixation ultra-faible (ULA) sont souvent recommandées pour la culture d’organoïdes tumoraux afin de limiter la croissance des fibroblastes, car elles se fixent facilement aux plaques standard traitées par culture cellulaire. Ce protocole validé recommande l’utilisation de milieux DMEM standard avec 10 % de FBS pour la culture de fibroblastes primaires, bien que des milieux spécialisés pour les fibroblastes puissent également être utilisés.
Il est important de documenter l’état de la culture d’organoïdes tumoraux au fil du temps, en particulier au cours de la première semaine, car la culture se comporte différemment en fonction de la qualité, de la quantité et de la source des tissus (tumeurs résécables humaines primaires par rapport aux PDX). Des agents non toxiques peuvent être ajoutés au milieu de culture pour surveiller la viabilité cellulaire et la prolifération de la culture. Les cultures doivent faire l’objet d’un suivi visuel quotidien pendant les 7 premiers jours, puis deux à trois fois par semaine. De plus, le milieu doit être changé tous les 4-5 jours ou lorsqu’il apparaît acide (apparaît jaune), en prenant soin de ne pas endommager les dômes de la matrice de la membrane basale. Au début, de grandes touffes brunes peuvent apparaître en raison d’une densité cellulaire élevée. Cependant, cela devrait disparaître après le premier passage, permettant ainsi d’obtenir des organoïdes tumoraux clairement définis sur un fond clair de la matrice de la membrane basale. Il est recommandé de prendre des photographies des organoïdes tumoraux, en particulier pendant les 3 premières semaines, afin de déterminer le phénotype visuel et le taux de croissance des organoïdes tumoraux. Le passage de la culture d’organoïdes tumoraux est également un défi technique. Généralement, le milieu de culture est retiré et les dômes matriciels sont dissociés avec des réactifs à base de trypsine ou des réactifs spécialisés à 4 °C jusqu’à ce que la matrice de la membrane basale se dissolve complètement. La pastille cellulaire est ensuite remise en suspension dans une matrice fraîche et le volume est ajusté pour effectuer le passage souhaité, tel que 1 :1 (en utilisant le même volume de matrice que l’original) ou 1 :3 (en ajoutant trois fois le volume d’origine de l’approche). Le groupe de David Tuveson, composé d’experts en organoïdes pancréatiques, fournit des ressources en ligne avec des protocoles pour établir, maintenir et colorer les organoïdes pancréatiques37.
Les organoïdes tumoraux ex vivo dérivés du patient fournissent un modèle préclinique précieux pour évaluer la sensibilité du traitement spécifique au patient en vue d’une application en médecine personnalisée. De plus, ces modèles sont des modèles tumoraux physiologiquement plus pertinents que les monocouches cellulaires adhérentes 2D traditionnelles. Une nomenclature claire et cohérente des modèles tumoraux 3D avec un suivi photographique et descriptif périodique de la culture est nécessaire dans le domaine des modèles tumoraux. De plus, travailler avec des protocoles standardisés est de la plus haute importance pour le succès de cette technologie en clinique dans la détermination de la sensibilité des médicaments sur une base spécifique au patient. Les chercheurs qui utilisent cette technologie doivent être conscients des obstacles et des pièges de ces modèles sensibles et complexes. Cependant, travailler avec un protocole validé et des conditions et des options de dépannage clairement définies aidera à éviter les problèmes techniques et à optimiser l’établissement et la maintenance de la culture. Ici, un protocole validé est fourni pour l’établissement d’organoïdes tumoraux et l’isolement des fibroblastes qui peuvent être facilement mis en œuvre dans de nombreux laboratoires d’oncologie translationnelle avec un équipement standard et une expérience de la culture tissulaire.
Déclarations de divulgation
Aucun.
Remerciements
Cette étude a été financée par la Plataforma biobancos y biomodelos - Unidades de las Plataformas ISCIII de apoyo ala I+D+i en Biomedicina y Ciencias de la Salud (PT20/00045), le programme de recherche et d’innovation Horizon 2020 de l’Union européenne dans le cadre de la convention de subvention n° 857381, le projet VISION (Stratégies visant à renforcer l’excellence scientifique et la capacité d’innovation pour le diagnostic précoce des cancers gastro-intestinaux), Appel intra-muros pour de nouveaux projets de recherche pour les chercheurs cliniciens et les groupes de recherche émergents IRYCIS (2021/0446), Patient Derived Organoids 2.0 Project (CIBERONC) et le projet TRANSCAN II JTC 2017 appel « Établissement d’un algorithme pour le diagnostic précoce et le suivi des patients atteints de tumeurs neuroendocrines pancréatiques (NExT) », numéro de subvention 1.1.1.5/ERANET/20/03. Les échantillons biologiques utilisés dans ce protocole ont été fournis par l’hôpital BioBank Ramón y Cajal-IRYCIS (B.0000678) et intégrés dans la plateforme Biobanques et biomodèles de l’ISCIII (PT20/00045). Nous tenons également à remercier Yvonne Kohl, Agapi Kataki Vita Rovita et Thorsten Knoll pour leur soutien inestimable dans le développement de ce protocole dans le cadre des projets NExT et VISION.
matériels
| Name | Company | Catalog Number | Comments |
| 6 well Costar Ultra-low Attachment plates | Biofil | TCP011006 | |
| 70 μm pore strainer | VWR | 732-2758 | |
| Ammonium Chloride Potassium (ACK) Lysis Buffer | Gibco | A10492-01 | |
| Amphotericin B | Gibco | 15290018 | |
| Cell culture incubator (21% O2, 5% CO2 and 37 ºC) | Nuaire | NU-4750E | |
| Cell recovery solution | Corning | 354253 | |
| Collagenase IV | Gibco | 17104019 | |
| DMEM/F-12 (1:1)(1X) with L-Glutamine and HEPES | Gibco | 31330-038 | |
| DNase | Roche | 10104159001 | |
| Fetal Bovine Serum (FBS) | Corning | 35-079-CV | |
| Freezing container, Nalgene | Merck | C1562 | |
| gentleMACS Octo Dissociator | Milteny Biotec | 130-096-427 | |
| HEPES | Gibco | 15630056 | |
| Human Placenta Growth Factor (PlGF) | enQuireBio | QP6485-EC-100UG | |
| Immunocompromised female 6-week-old NU-Foxn1nu nude mice | Janvier, France | ||
| Insulin-like growth factor-1 (IGF-1) | Invitrogen | RP10931 | |
| L-Glutamine | Corning | 354235 | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| Normocin | InvivoGen | ant-nr-2 | |
| Pasteur pipettes | Deltalab | 200007 | |
| Penicillin Streptomycin Solution (100x) | Corning | 30-002-CI | |
| Phosphate-Buffered Saline (PBS) | Corning | 21-040-CV | |
| Recombinant Human Basic Fibroblast Growth Factor (bFGF) | Gibco | PHG0026 | |
| Recombinant Human Epidermal Growth Factor (EGF) | Gibco | PHG0311 | |
| ROCK Inhibitor Y-27632 (Dihydrochloride) | STEMCELL | 72304 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | |
| Surgical Blades | Nahita | FMB018 | |
| Trypsin | Gibco | 25300054 |
Références
- April-Monn, S. L., et al. Patient-derived tumoroids of advanced high-grade neuroendocrine neoplasms mimic patient chemotherapy responses and guide the design of personalized combination therapies. bioRxiv. , (2022).
- Frappart, P. O., et al. Pancreatic cancer-derived organoids - A disease modeling tool to predict drug response. United European Gastroenterology Journal. 8 (5), 594-606 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Aberle, M. R., et al. Patient-derived organoid models help define personalized management of gastrointestinal cancer. The British Journal of Surgery. 105 (2), e48-e60 (2018).
- Yoshida, G. J. Applications of patient-derived tumor xenograft models and tumor organoids. Journal of Hematology & Oncology. 13 (1), 4 (2020).
- Hong, H. K., et al. Efficient primary culture model of patient-derived tumor cells from colorectal cancer using a Rho-associated protein kinase inhibitor and feeder cells. Oncology Reports. 42 (5), 2029-2038 (2019).
- April-Monn, S. L., et al. 3D primary cell culture: A novel preclinical model for pancreatic neuroendocrine tumors (PanNETs). Neuroendocrinology. 111 (3), 273-287 (2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), e106 (2020).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 5739 (2020).
- Yu, J., Huang, W. The progress and clinical application of breast cancer organoids. International Journal of Stem Cells. 13 (3), 295 (2020).
- Barbáchano, A., et al. Organoids and colorectal cancer. Cancers. 13 (11), 2657 (2021).
- Michels, B. E., et al. Human colon organoids reveal distinct physiologic and oncogenic Wnt responses. Journal of Experimental Medicine. 216 (3), 704-720 (2019).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Porter, R. J., Murray, G. I., McLean, M. H. Current concepts in tumour-derived organoids. British Journal of Cancer. 123 (8), 1209-1218 (2020).
- Wang, Q., Guo, F., Jin, Y., Ma, Y. Applications of human organoids in the personalized treatment for digestive diseases. Signal Transduction and Targeted Therapy. 7 (1), 336 (2022).
- Wang, J., et al. Patient-derived tumor organoids: New progress and opportunities to facilitate precision cancer immunotherapy. Frontiers in Oncology. 12, 1382 (2022).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17 (1), 1-15 (2015).
- Marsee, A., et al. Building consensus on definition and nomenclature of hepatic, pancreatic, and biliary organoids. Cell Stem Cell. 28 (5), 816-832 (2021).
- Mueller, M. T., et al. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 137 (3), 1102-1113 (2009).
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. 20 (2), 273-286 (2019).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Chen, P., et al. Patient-derived organoids can guide personalized-therapies for patients with advanced breast cancer. Advanced Science. 8 (22), 2101176 (2021).
- Furbo, S., et al. Use of patient-derived organoids as a treatment selection model for colorectal cancer: A narrative review. Cancers. 14 (4), 1069 (2022).
- Xu, H., Jiao, D., Liu, A., Wu, K. Tumor organoids: Applications in cancer modeling and potentials in precision medicine. Journal of Hematology & Oncology. 15 (1), 58 (2022).
- Xu, H., et al. Organoid technology in disease modelling, drug development, personalized treatment and regeneration medicine. Experimental Hematology & Oncology. 7 (1), 30 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Ling, L., et al. Effect of heparin on the biological properties and molecular signature of human mesenchymal stem cells. Gene. 576, 292-303 (2016).
- Bajpai, R., Lesperance, J., Kim, M., Terskikh, A. V. Efficient propagation of single cells Accutase-dissociated human embryonic stem cells. Molecular Reproduction and Development. 75 (5), 818-827 (2008).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Walsh, A. J., et al. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889 (2016).
- Bui, B. N., et al. Organoids can be established reliably from cryopreserved biopsy catheter-derived endometrial tissue of infertile women. Reproductive BioMedicine Online. 41 (3), 465-473 (2020).
- Verissimo, C. S., et al. Targeting mutant RAS in patient-derived colorectal cancer organoids by combinatorial drug screening. eLife. 5, e18489 (2016).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Protocols for Generating, Manipulating, and Analyzing Pancreatic Organoid Cultures. Cold Spring Harbor Laboratory. Tuveson Lab Available from: https://tuvesonlab.labsites.cshl.edu/protocolsreagents/ (2023)
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon