Method Article
Cultura Tridimensional de Tecido Adiposo Termogênico Vascularizado a partir de Fragmentos Microvasculares
Neste Artigo
Resumo
Aqui, apresentamos um protocolo detalhado delineando o uso de fragmentos microvasculares isolados de tecido adiposo humano ou de roedores como uma abordagem direta para a engenharia de tecido adiposo bege vascularizado funcional.
Resumo
A engenharia do tecido adiposo termogênico (por exemplo, tecido adiposo bege ou marrom) tem sido investigada como uma terapia potencial para doenças metabólicas ou para o design de microtecidos personalizados para triagem de saúde e testes de drogas. As estratégias atuais são frequentemente bastante complexas e falham em retratar com precisão as propriedades multicelulares e funcionais do tecido adiposo termogênico. Fragmentos microvasculares, pequenos microvasos intactos constituídos por arteríolas, vênulas e capilares isolados do tecido adiposo, servem como uma única fonte autóloga de células que permitem a vascularização e a formação de tecido adiposo. Este artigo descreve métodos para otimizar as condições de cultura para permitir a geração de tecido adiposo termogênico tridimensional, vascularizado e funcional a partir de fragmentos microvasculares, incluindo protocolos para isolamento de fragmentos microvasculares do tecido adiposo e condições de cultura. Adicionalmente, as melhores práticas são discutidas, assim como as técnicas de caracterização dos tecidos modificados, e resultados de amostras de fragmentos microvasculares de roedores e humanos são fornecidos. Essa abordagem tem potencial para ser utilizada para o entendimento e desenvolvimento de tratamentos para obesidade e doenças metabólicas.
Introdução
O objetivo deste protocolo é descrever uma abordagem para o desenvolvimento de tecido adiposo bege vascularizado a partir de uma única fonte potencialmente autóloga, o fragmento microvascular (MVF). Demonstrou-se que os tecidos adiposos marrom e bege exibem propriedades benéficas relacionadas à regulação metabólica; entretanto, o pequeno volume desses depósitos de tecido adiposo em adultos limita o potencial impacto sobre o metabolismo sistêmico, particularmente em condições de doenças como obesidade ou diabetes tipo 21,2,3,4,5,6,7. Há significativo interesse na gordura marrom/bege como alvo terapêutico para a prevenção dos efeitos metabólicos deletérios associados à obesidade e suas comorbidades 8,9,10,11,12.
As FVM são estruturas vasculares que podem ser isoladas diretamente do tecido adiposo, cultivadas e mantidas em uma configuração tridimensional por longos períodos de tempo13,14,15. Trabalhos anteriores de nosso grupo, entre outros, começaram a explorar a capacidade multicelular e multipotente das MVFs, especificamente no que se refere à formação de tecido adiposo16,17,18. Como um acúmulo deste trabalho, demonstramos recentemente que MVFs derivados de modelos de roedores com diabetes tipo 2 esaudáveis19 e de indivíduos humanos (adultos com mais de 50 anos de idade)20 continham células capazes de serem induzidas a formar tecido adiposo termogênico, ou bege.
Trata-se de uma abordagem inovadora a partir da qual se utiliza uma única fonte de FMV, capaz não só de criar tecido adiposo bege, mas também de seu componente vascular associado e crítico21. O uso dessa técnica pode ser de grande valia para estudos que buscam uma abordagem simples de engenharia tecidual para a formação de tecido adiposo termogênico. Ao contrário de outros métodos que aspiram a manipular tecido adiposo bege 22,23,24,25,26,27,28, o processo descrito neste estudo não requer o uso de múltiplos tipos celulares ou regimes complexos de indução. Modelos vascularizados de gordura bege e branca podem ser criados com MVFs provenientes de fontes de roedores e humanos, demonstrando grande potencial de tradução. O produto final deste protocolo é um tecido adiposo termogênico bege projetado com uma estrutura e função metabólica comparáveis ao tecido adiposo marrom. De modo geral, este protocolo apresenta a ideia de que uma FMVM de fonte facilmente acessível e possivelmente autóloga pode ser uma intervenção terapêutica e uma ferramenta valiosa para o estudo de distúrbios metabólicos.
Protocolo
Este estudo foi conduzido em conformidade com a Lei de Bem-Estar Animal e os Regulamentos de Implementação de Bem-Estar Animal de acordo com os princípios do Guia para o Cuidado e Uso de Animais de Laboratório. Todos os procedimentos com animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Texas em San Antonio.
NOTA: Para as etapas descritas abaixo, são utilizados ratos Lewis machos. Pequenos ajustes no protocolo devem ser feitos para uma fêmea, bem como para a coleta de fragmento microvascular (MVF)de camundongo 29. Para protocolos utilizando MVFs humanas (h-MVFs), as únicas etapas necessárias são a ressuspensão das h-MVFs seguindo o protocolo do fabricante, preparo do meio de crescimento (1,3), formação de hidrogéis de fibrina (5) e cultura (6). Para obter uma visão geral do protocolo, consulte a Figura 1.

Figura 1: Delineamento experimental. Detalhamento de seis etapas fundamentais, antes da análise, para a formação de tecido adiposo termogênico utilizando FMV. Clique aqui para ver uma versão maior desta figura.
1. Preparação dos reagentes
NOTA: Os reagentes abaixo correspondem a um rato, pesado e feito dentro de uma biocapuz.
- Preparar albumina de soro bovino (BSA) em PBS.
- Preparar 10 mg/mL (1,0%) de BSA em PBS para ser diluído para as etapas de lavagem (1 mg/mL, 0,1%) e digestão (4 mg/mL, 0,4%).
- Preparar diferentes concentrações de BSA, conforme mencionado na etapa 1.1.1, seguindo as etapas 1.1.3-1.1.5.
- 10 mg/mL de BSA em PBS (1% de BSA em PBS)
- Adicionar 500 mg de BSA e 500 mL de PBS a um tubo cônico de 50 mL e vórtice a solução para dissolver a BSA.
- Se se formarem bolhas excessivas, centrifugar a solução a 350 x g durante 2 minutos. Filtrar esterilizar a solução com um filtro líquido de nylon de 0,22 μm.
- 1 mg/mL de BSA em PBS (0,1% de BSA em PBS)
- Diluir 15 ml de 10 mg/ml de BSA em PBS 1:10 com PBS adicionando 15 ml de 10 mg/ml de BSA em PBS a 135 ml de PBS num frasco estéril de 500 ml e agitar suavemente o frasco para garantir uma mistura homogénea.
- 4 mg/mL de BSA em PBS (0,4% de BSA em PBS)
- Diluir 35 mL de 10 mg/mL de BSA em PBS 1:2.5 com PBS adicionando 35 mL de 10 mg/mL de BSA em PBS + 57,5 mL de PBS em um frasco estéril de 100 mL e agitar suavemente o frasco para garantir uma mistura homogênea.
- Preparar colagenase em BSA para a digestão de almofadas de gordura picadas.
- Preparar 6 mg/mL de colagenase.
- Em um tubo cônico de 50 mL, pesar 72 mg de colagenase (rótulo "para Epi").
- Em três tubos cônicos de 50 mL, pesar 144 mg de colagenase (rótulo "para Ing 1", "para Ing 2" e "para SubQ") cada.
- Conservar a colagenase pesada a 4 °C até à utilização.
NOTA: Não adicione BSA/PBS até antes da digestão. - Adicionar 12 mL de 4 mg/mL de BSA em PBS ao tubo contendo 72 mg de colagenase.
- Adicionar 24 mL de 4 mg/mL de BSA em PBS aos tubos contendo 144 mg de colagenase.
- Agitar os tubos para garantir uma solução homogénea e filtrar esterilizar a solução com um filtro de rede de nylon de 0,22 μm.
- Preparar 6 mg/mL de colagenase.
- Preparar meios de crescimento suplementados com Ácido Aminocapróico (ACA) para alimentar/diferenciar a MFM isolada.
- Meio de crescimento (GM): Suplemento DMEM com SFB a 20%, penicilina-estreptomicina a 1% (caneta estreptogênica), profilático a 0,2% de micoplasma e ac-ACL 1 mg/mL.
- Preparar meio adipogênico branco (WAM).
- Indução de WAM: Suplemento DMEM/F12 com 20% de SFB, 1% de radiografia por caneta, 0,2% profilático de micoplasma, 10 μg/mL de insulina, 10 μm de forskolina, 1 μm de dexametasona e 1 mg/mL de ACA.
NOTA: Para h-MVFs, além disso, adicione 125 μM de indometacina. - Manutenção da WAM: Suplemento DMEM/F12 com SFB a 20%, caneta estreptogênica a 1%, profilática a 0,2% de micoplasma, insulina a 5 μg/mL e ac-ACA a 1 mg/mL.
NOTA: Para h-MVFs, altere a concentração de insulina para 10 μg/mL.
- Indução de WAM: Suplemento DMEM/F12 com 20% de SFB, 1% de radiografia por caneta, 0,2% profilático de micoplasma, 10 μg/mL de insulina, 10 μm de forskolina, 1 μm de dexametasona e 1 mg/mL de ACA.
- Preparar meio adipogênico bege (MAB).
- Indução de MAB: Suplemento DMEM/F12 com SFB a 20%, estreptococo a 1%, profilático a 0,2% de micoplasma, 10 μg/mL de insulina, 10 μm de forskolina, 1 μm de dexametasona, 1 μm de rosiglitazona, 20 nM de 3,3′,5-Triiodo-L-tironina (T3) e 1 mg/mL de AAC.
NOTA: Para h-MVFs, altere a concentração de T3 para 120 nM. - Manutenção da MAS: Suplemento DMEM/F12 com 20% de SFB, 1% de estreptococo, 0,2% profilático de micoplasma, 5 μg/ml de insulina, 10 μm de forskolina, 1 μm de rosiglitazona, 20 nM de T3 e 1 mg/mL de ACA.
NOTA: Para h-MVFs, alterar a concentração de insulina para 10 μg/mL e a concentração de T3 para 120 nM.
- Indução de MAB: Suplemento DMEM/F12 com SFB a 20%, estreptococo a 1%, profilático a 0,2% de micoplasma, 10 μg/mL de insulina, 10 μm de forskolina, 1 μm de dexametasona, 1 μm de rosiglitazona, 20 nM de 3,3′,5-Triiodo-L-tironina (T3) e 1 mg/mL de AAC.
- Preparar trombina (só precisa ser feita se a solução alíquota de estoque não estiver disponível) para fazer o agente de coagulação a ser usado em géis de fibrina.
- 10 U/mL de trombina em ddH2O:
- Ressuspenda o pó de trombina usando 1-5 mL de ddH2O no frasco para injetáveis do fabricante e transfira a ressuspensão para um copo de 250 mL.
- Leve a solução para 100 mL e pipete a solução para cima e para baixo várias vezes para garantir uma mistura homogênea. Aliquot a solução em tubos cônicos de 15 mL (~10 mL/tubo) e armazenar as alíquotas em um freezer de -20 °C.
NOTA: Para usar, descongelar a trombina à temperatura ambiente (TR).
- 10 U/mL de trombina em ddH2O:
2. Preparação de ferramentas/materiais
NOTA: Toda a instrumentação deve ser autoclavada/esterilizada antes do uso.
- Isolamento da gordura epididimal/inguinal/subcutânea (cirurgia a ser realizada em área cirúrgica definida)
- Garantir a disponibilidade de absorventes descartáveis, duas tesouras, um hemostático (opcional), duas pinças e quatro tubos cônicos de 50 mL com 10-15 mL de BSA 1 mg/mL (0,1%) em PBS.
- Isolamento de fragmentos microvasculares
- Para a picagem (a ser feita em biohood), assegure-se da disponibilidade de três placas de Petri estéreis de 100 mm não revestidas, um par de pinças e uma tesoura curva.
- Para digestão e isolamento (a ser feito em biohood), garantir a disponibilidade de uma tesoura, um par de pinças, oito placas de Petri estéreis de 100 mm não revestidas, três placas de Petri estéreis de 35 mm não revestidas, colagenase pesada e a 4 °C, quatro frascos de 250 mL, um suporte plástico com um furo no centro, quatro telas de 500 μM (cortadas em 3 em quadrados arredondados), quatro telas de 37 μM (cortadas em 3 em quadrados arredondados) e 11 tubos cônicos de 50 mL.
- Ressuspensão de fibrina
- Para hidrogéis de fibrina (a serem feitos em um biohood), certifique-se de que fibrinogênio, trombina e meios de crescimento (feitos durante a preparação do reagente) estejam disponíveis.
3. Protocolo de isolamento de gordura
- Etapas preliminares
- Encha um copo com etanol para lavar e higienizar os instrumentos cirúrgicos antes de usá-los. Em seguida, prepare a mesa para manusear o rato e tenha um vácuo pronto para aspirar o pelo gerado durante a etapa de barbear.
- Preparar um balde com gelo onde serão colocados os tubos cônicos de 50 mL previamente preparados, cada um contendo 10 mL de 1 mg/mL de BSA. Rotule os tubos de acordo.
OBS: Pode ser necessário ter dois tubos cônicos separados para a gordura inguinal, uma vez que dois lados precisam ser extraídos e a quantidade de gordura coletada dessa região tende a ser a maior em comparação com o epidídimo e o subcutâneo posterior. - Comece com um rato eutanasiado na área cirúrgica definida com as ferramentas cirúrgicas necessárias. Geralmente, o CO2 é usado para eutanásia dos ratos seguindo os protocolos da IACUC.
- Usando cortadores de cabelo, raspe o rato ao redor da área de interesse. Especificamente, faça a barba entre as virilhas e metade do abdômen para isolamento da gordura epididimal e inguinal (use o barbeador menor para o pelo nesta região). Faça a barba de todo o dorso para obter a gordura subcutânea posterior localizada entre as escápulas (é melhor usar um barbeador maior, pois o pelo é mais grosso na parte de trás do rato).
- Prepare assepticamente o rato pulverizando-o com etanol a 70%. Geralmente, recomenda-se limpar a área que será cortada duas vezes.
- Isolamento de diferentes depósitos de gordura
- Inguinal (subcutâneo)
- Na posição supina, levante a pele abaixo do pênis com uma tesoura. Iniciar a incisão com tesoura, iniciando no centro e cortando lateralmente, formando um formato de "V" e fazendo um loop até a parte de trás do rato para acessar todo o depósito de gordura. Lembre-se de cortar superficialmente para que a gordura abaixo esteja intacta. Durante a etapa de corte, garantir a separação da pele da gordura cortando o tecido da fáscia interconectado (Figura 2A).
- Uma vez que a fáscia é adequadamente cortada, certifique-se de que os dois lados da gordura inguinal são visíveis (a gordura inguinal se estende da área da virilha em direção às costas). Em seguida, remova a gordura dos dois lados em dois tubos cônicos separados contendo 10 mL de 1 mg/mL de BSA (Figura 2B).
- Epidídimo (visceral)
- Colher a gordura epididimal cortando a pele abdominal e cuidadosamente através da fina camada ao redor dos testículos (Figura 2C).
- Com pinças, puxe suavemente o tecido adiposo para fora e corte-o usando tesoura. Evite dissecar os principais vasos sanguíneos visíveis (se o testículo e o epidídimo forem colhidos, remova-os durante a etapa de limpeza na biohood).
- Coloque cuidadosamente a gordura removida em um tubo cônico de 50 mL com 10 mL de BSA 1 mg/mL em PBS.
OBS: A retirada da gordura epididimal deve ser feita após a retirada da gordura inguinal. A gordura epididimal é geralmente menor em volume e localizada abaixo da gordura inguinal, abaixo da pele abdominal ao redor do testículo e do epidídimo.
- Subcutâneo posterior
- Virar o rato em decúbito ventral (dorsal para cima) e, com uma tesoura grande, cortar a pele do dorso (a pele dessa região é grossa) até o couro cabeludo, tomando cuidado para não cortar muito fundo, logo abaixo da pele (Figura 2D).
- Corte a fáscia conectando a pele ao tecido; A gordura localiza-se na região interescapular. Anote para diferenciar/separar a gordura subcutânea da gordura marrom. A gordura marrom está mais próxima da coluna vertebral (Figura 2E).
- Isolar e colocar a gordura no(s) tubo(s) cônico(s) correspondente(s) de 50 mL com 10 mL de BSA 1 mg/mL em PBS.
- Inguinal (subcutâneo)
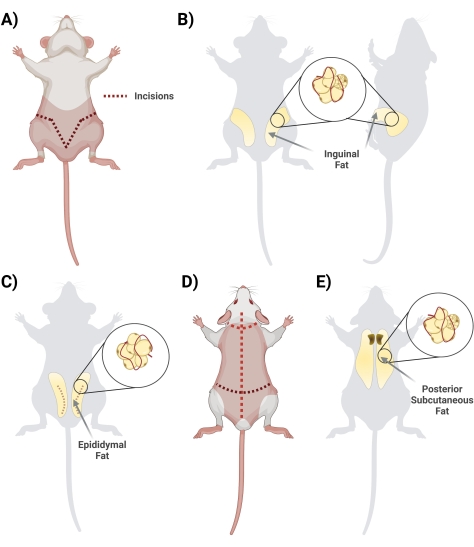
Figura 2: Isolamento dos diferentes depósitos de tecido adiposo. (A) Incisões iniciais necessárias para excisão do tecido adiposo inguinal. (B) Localização do depósito de gordura inguinal. (C) Localização do depósito de gordura epididimal, observando-se incisão da pele externa necessária para o acesso. (D) Incisões adicionais necessárias uma vez que os camundongos são colocados propensos a acessar gordura adicional. (E) Localização do depósito de gordura subcutânea posterior. Clique aqui para ver uma versão maior desta figura.
4. Protocolo de isolamento de fragmentos microvasculares
- Colocar 50 ml de tubo(s) cónico(s) contendo gordura excisada do rato em biohood.
- Usando pinças, coloque a gordura em uma placa de Petri padrão de 100 mm (com ~0,5 mL de 1 mg/mL de BSA em PBS para manter o tecido hidratado).
- Limpar e remover quaisquer vasos sanguíneos visíveis e músculos/tecidos estranhos da gordura.
- Pique a gordura com uma tesoura por ~10 min (pice o suficiente para que possa ser transferida com uma pipeta de 10 mL).
- Verifique se há grumos adicionando ~0,5 mL de 1 mg/mL de BSA em PBS; Continue picando, se necessário.
- Transferir a gordura picada para um balão estéril de 250 ml com uma pipeta de 10 ml.
Observação : observe o volume usando um pipet. - Adicionar BSA suficiente (1 mg/mL) para que o volume final seja de 20 mL.
- Adicionar 4 mg/mL de BSA em PBS à colagenase (concentração final de colagenase: 6 mg/mL) (ou seja, 12 mL para os 72 mg de colagenase ou 24 mL para os 144 mg de colagenase).
Observação : não adicione até que a picagem é concluída, pois é sensível ao tempo. - Agite suavemente o tubo cónico para garantir uma solução homogénea e filtre esterilizar a solução com um filtro líquido de nylon de 0,22 μm.
- Para a gordura epididimal, digerir por ~8-10 min; para a gordura subcutânea inguinal e posterior, digerir por ~15-20 min em banho-maria a 37 °C, agitando o frasco em movimento circular durante todo o trajeto (pare no momento em que a gordura chega onde restam apenas alguns grumos).
- Transfira a gordura digerida para um tubo cônico de 50 mL (deve haver ~30 mL/tubo) e rotule o tubo como "gordura digerida".
- Gire o tubo a 400 x g por 4 min; após a fiação, o pellet deve estar vermelho (Figura 3A).
- Durante o giro, colocar a tela estéril de 37 μM e as telas de 500 μM em uma placa de Petri estéril com 5 mL de 1 mg/mL de BSA em PBS para pré-embeber antes do uso.
- Após o spin, decantar o sobrenadante em um tubo cônico de 50 mL rotulado como "resíduo". Realizar a decantação suavemente para remover a gordura superficial e não perturbar o pellet feito de MVFs.
- Adicionar 10 mL de 1 mg/mL de BSA em PBS ao tubo contendo o pellet ("gordura digerida"). Triturar (pipetar para cima e para baixo) o pellet 2x.
- Evite ficar muito áspero no pellet para não atrapalhar os fragmentos.
- Coloque a tela de 500 μM em uma nova placa de Petri acima do suporte de tela de plástico (Figura 3B).
- Pipetar 10 mL do tubo "pastilha digerida" sobre uma tela de 500 μM usando círculos concêntricos (Figura 3C).
- Lavar o filtro com mais 5 ml de 1 mg/ml de BSA em PBS. As células desejadas serão filtradas para a placa de Petri; portanto, descarte a tela de 500 μM, mas guarde o líquido filtrado dentro da placa de Petri.
- Coloque a tela de 37 μM em uma nova placa de Petri acima do suporte de tela de plástico.
- Troque o pipet para eliminar quaisquer aglomerações antes de usar a tela de 37 μM.
- Pipetar o líquido obtido da primeira filtração sobre a tela de 37 μM usando círculos concêntricos.
- Lavar o filtro com mais 5 ml de 1 mg/ml de BSA em PBS. As células desejadas permanecerão no filtro, portanto, descarte o líquido filtrado, mas salve a tela de 37 μM.
- Deslizar a tela de 37 μM para uma nova placa de Petri contendo 5 mL de 1 mg/mL de BSA em PBS.
- Agite o prato batendo contra um suporte cônico para desalojar os fragmentos. Não agite muito vigorosamente, pois o líquido/células pode derramar-se para fora da placa de Petri.
- Enxaguar o filtro com mais 5 mL de 1 mg/mL de BSA em PBS. As células desejadas permanecerão em solução líquida na placa de Petri. Guarde a tela de 37 μM e o fragmento deslocado contendo líquido dentro da placa de Petri para as etapas seguintes.
- Transferir o fragmento BSA + contendo líquido para um tubo cônico estéril de 50 mL.
- Repita o enxágue da tela de 37 μM várias vezes mais vezes (cada vez com ~5 mL de 1 mg/mL de BSA em PBS) e adicione ao tubo cônico. Repita até que o volume total coletado seja de ~15-20 mL. Finalmente, as células desejadas serão coletadas da solução líquida na placa de Petri e colocadas em um tubo cônico; neste momento, descartar a tela de 37 μM após o enxágue final, mas guardar os fragmentos desalojados contendo líquido dentro do tubo cônico de 50 mL.
- Encaixe a extremidade de uma ponta de pipeta de 200 μL usando uma tesoura. Agitar suavemente o tubo de 50 ml, retirar duas amostras de 20 μL e colocá-las numa placa de Petri limpa de 35 mm.
- Contar o número de fragmentos em cada amostra na placa de Petri para obter o número total de MVFs isolados.
Total de Fragmentos =
- Gire o fragmento remanescente deslocado contendo líquido em um tubo cônico de 50 mL a 400 x g por 4 min para coletar o MVF.
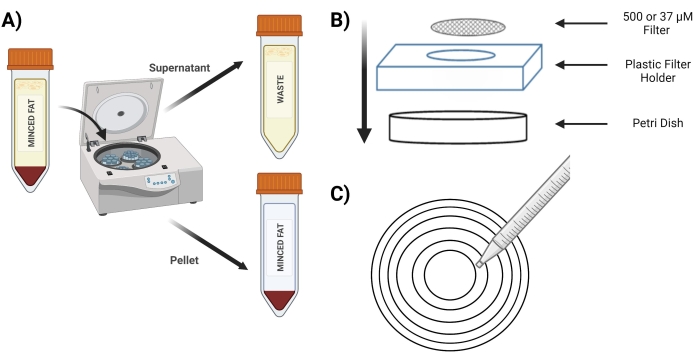
Figura 3: Isolamento das MVFs . (A) Pós-digestão do tecido adiposo, representação da separação das MVFs contendo pellet e sobrenadante após um spin-down. (B) Disposição dos suprimentos para filtração e aprisionamento de MVFs. (C) Ilustração do método do círculo concêntrico para as etapas de filtração/lavagem. Clique aqui para ver uma versão maior desta figura.
5. Formação de hidrogéis de fibrina
- Exemplos de cálculos:
NOTA: Abaixo estão os cálculos para MVFs semeadas a ~15.000-20.000 MVF/mL e a relação fibrinogênio:gel de trombina em 2:5, com fibrinogênio usado na concentração de 20 mg/mL.- Para fazer cinco géis de 250 μL, é necessário um volume total de 1.250 μL. Sempre contabilize os erros de pipetagem, portanto, faça o suficiente para 1,5 mL de géis.
- Calcule o volume de fibrinogênio necessário da seguinte forma:
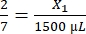 , X1 = 428,57 μL de fibrinogênio
, X1 = 428,57 μL de fibrinogênio - Calcule o volume de trombina necessário da seguinte forma:
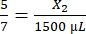 , X2 = 1.071,43 μL de trombina
, X2 = 1.071,43 μL de trombina - Para o volume necessário de 428,57 μL, fazer 500 μL de fibrinogênio da seguinte forma:
20 mg/mL * 0,5 mL = 10 mg de fibrinogênio. Ressuspendê-lo em 500 μL de DMEM - Para obter cada gel, calcule o volume de fibrinogênio e trombina da seguinte forma:
- Fibrinogênio:
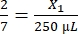 , X1 = 71,43 μL de fibrinogênio (em DMEM) + MVF
, X1 = 71,43 μL de fibrinogênio (em DMEM) + MVF - Trombina:
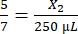 , X2 = 178,57 μL de trombina
, X2 = 178,57 μL de trombina
- Fibrinogênio:
- Calcule o volume de fibrinogênio necessário da seguinte forma:
- Para fazer cinco géis de 250 μL, é necessário um volume total de 1.250 μL. Sempre contabilize os erros de pipetagem, portanto, faça o suficiente para 1,5 mL de géis.
- Fundição em gel de fibrina MVF
- Decantar a maior parte do líquido no fragmento girado no tubo cônico de 50 mL. Use uma pipeta para remover o pequeno volume de líquido que pega na borda do tubo cônico.
- Adicionar trombina nos poços onde serão confeccionados os géis (Figura 4A).
- Clipe a extremidade de uma ponta de pipeta de 200 μL e ressuspenda as MVFs suavemente usando fibrinogênio para obter uma densidade final de ~15.000-20.000 MVF/mL uma vez no gel.
- Encaixe suavemente a extremidade de uma ponta de pipeta de 200 μL e pipeta MVF+Fibrinogênio na solução de trombina. Pipete rapidamente para cima e para baixo para garantir uma mistura homogênea. Repita até que todos os géis estejam prontos (Figura 4B).
- Coloque a(s) placa(s) de poço em uma incubadora (37 °C, 5% CO2) por ~15 min para permitir a reticulação em gel (Figura 4C).
- Adicionar 100-150 μL de meio de crescimento a cada poço.
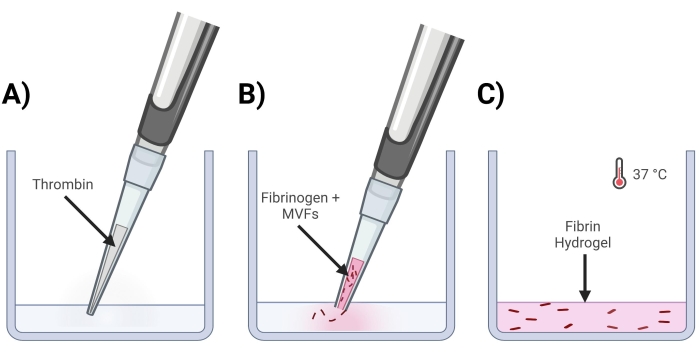
Figura 4: Formação dos géis de fibrina MVF . (A) Uma mistura de trombina de 5/7 partes é pipetada para o poço correspondente. (B) Em seguida, com uma ponta de pipeta cortada (para não perturbar as MVFs), uma mistura de fibrinogênio+MVF de 2/7 partes é pipetada no poço e misturada suavemente. (C) Por último, todos os géis completos são colocados numa incubadora a 37 °C, permitindo que o hidrogel se solidifique totalmente antes de o meio ser colocado por cima. Clique aqui para ver uma versão maior desta figura.
6. Condições de cultivo de MVFs
- Para a cultura de tecido adiposo bege e branco não vascularizado (+ Controle MG), utilizar as linhas do tempo19 mostradas na Figura 5.
- Para a cultura do tecido adiposo branco e bege vascularizado (+ Controle MG), utilizar as linhas do tempo19 mostradas na Figura 6.
- Os hidrogéis devem ser mantidos em incubadora (37 °C, 5% CO2) durante a cultura do estudo, sendo os meios trocados em dias alternados. Para fixação e manuseio de amostras para análise, consultar trabalhos publicados anteriormente16,19,20.
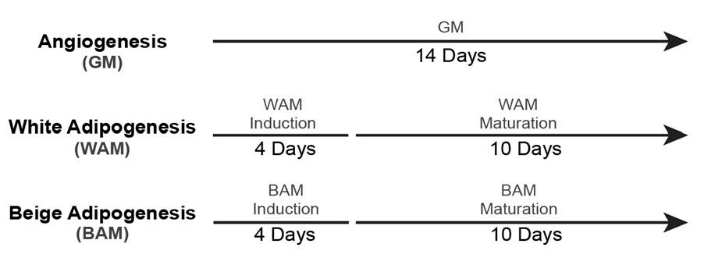
Figura 5: Momento da formação do tecido adiposo não vascularizado. Esse valor foi modificado a partir de Acosta et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 6: Tempo para formação de tecido adiposo vascularizado. Esse valor foi modificado a partir de Acosta et al.19. Clique aqui para ver uma versão maior desta figura.
Resultados
Existem algumas características morfológicas fenotípicas importantes do tecido adiposo bege/marrom: é multilocular/contém pequenas gotículas lipídicas, possui um grande número de mitocôndrias (a razão de sua aparência caracteristicamente "acastanhada" in vivo), correspondentemente tem uma alta taxa de consumo de oxigênio/bioenergética mitocondrial, é altamente vascularizado, tem aumento da lipólise/captação de glicose estimulada por insulina e, mais notoriamente, expressa altos níveis de proteína desacopladora 1 (UCP1), uma proteína mitocondrial envolvida na respiração termogênica19,30.
Nesse sentido, ao caracterizar a capacidade de diferenciação dos CVM em tecido adiposo bege, foi realizada uma análise que permitiu visualizar (Figura 7, Figura 8), confirmar geneticamente (Figura 9, Figura 10) e mensurar funcionalmente (Figura 11) a transformação dos FMV.
Nas Figuras 7 e 8, por meio do BODIPY, coloração lipídica, e obtenção de imagens dos hidrogéis por microscopia confocal, observou-se a visualização do dimensionamento e localização dos lipídios nos adipócitos diferenciados16,17,19. Notadamente, nesta análise, especialmente na comparação entre as condições, os grupos BAM devem apresentar tamanhos lipídicos menores (indicativos de formação de tecido adiposo bege), quantificáveis através do NIH ImageJ19,20.
Usando RT-qPCR 16,19,20, na Figura 9 e na Figura 10, de forma mais distinta, a expressão de UCP1 é, em geral, aumentada significativamente após a exposição da MVF ao MAB.
Por fim, analisando a bioenergética mitocondrial (Figura 11), fica evidente que os grupos MAB apresentam níveis caracteristicamente mais elevados de taxa de consumo de oxigênio (OCR), medidos por meio do teste de estresse mitoSeahorse19,20.
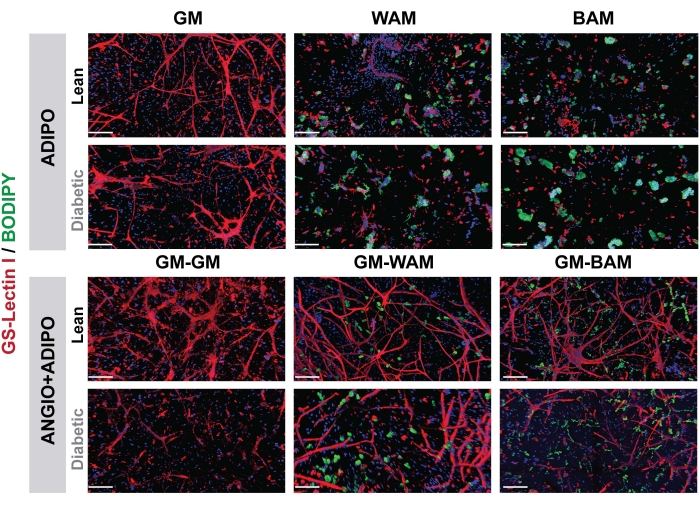
Figura 7: Avaliação histológica da fm-r. MVFs r-MVFs derivadas de diabéticos magros ou tipo 2 foram expostos a meios adipogênicos WAM ou BAM diretos (painel superior, ADIPO) ou BAM diretos (painel inferior, ANGIO+ADIPO) para obter tecido adiposo branco ou bege não vascularizado ou vascularizado, respectivamente (barras de escala = 200 μm). Esse valor foi modificado a partir de Acosta et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 8: Avaliação histológica da h-MVF. h-MVF foram expostos a WAM ou BAM direto (ADIPO) para obter tecido adiposo branco ou bege não vascularizado, respectivamente (barras de escala = 200 μm). Esse valor foi modificado a partir de Gonzalez et al.20. Clique aqui para ver uma versão maior desta figura.
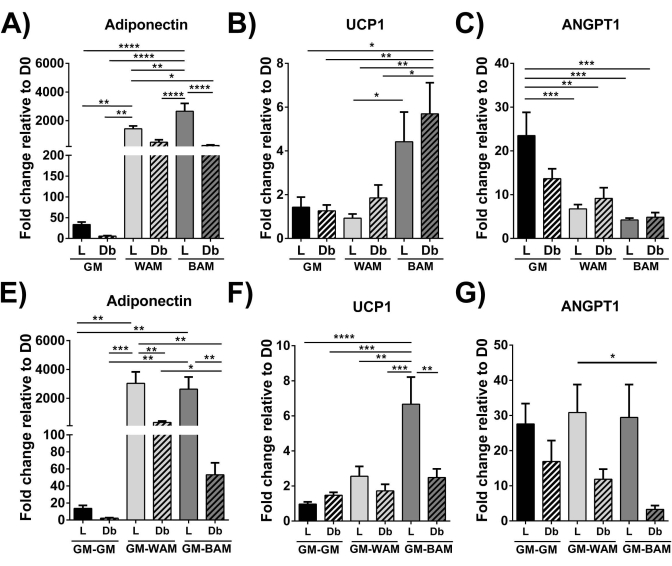
Figura 9: Avaliação da r-MVF através de RT-qPCR. R-MVF derivado de (A-C) ou diabético tipo 2 (Db) exposto a WAM ou BAM direta ou indireta (E-G) foi avaliado para (A,E) adipogênese (Adiponectina), (B,F) termogênese (UCP1) e (C,G) angiogênese (ANGPT1). Os resultados são apresentados como média ± erro padrão de duas réplicas experimentais (n = 4). * = p < 0,05, ** = p < 0,01, *** = p < 0,001 e **** = p < 0,0001. D0 = Dia 0. Testes de análise de variância (ANOVA) de dois fatores com análises de comparações múltiplas de Holm-Sidak para determinar diferenças entre os grupos. A significância estatística foi definida como p < 0,05. Esse valor foi modificado a partir de Acosta et al.19. Clique aqui para ver uma versão maior desta figura.
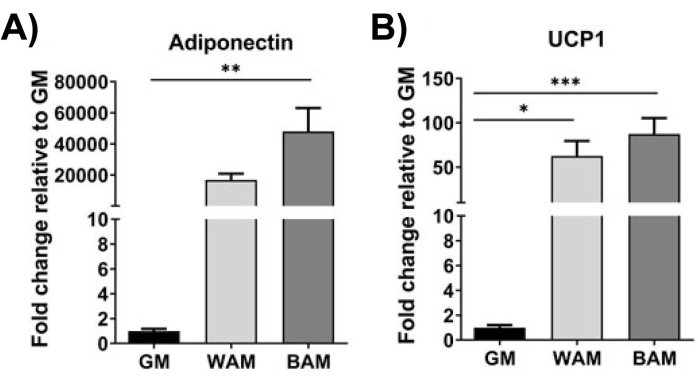
Figura 10: Avaliação da h-MVF através de RT-qPCR. h-MVFs expostos à WAM direta ou BAM foram avaliados para (A) adipogênese (Adiponectina) e (B) termogênese (UCP1). Os resultados são apresentados como média ± erro padrão de duas réplicas experimentais (n = 4). * = p < 0,05, ** = p < 0,01, *** = p < 0,001 e **** = p < 0,0001. Testes de análise de variância (ANOVA) one-way com análises de comparações múltiplas de Holm-Sidak para determinar diferenças entre os grupos. A significância estatística foi definida como p < 0,05. Esse valor foi modificado a partir de Gonzalez et al.20. Clique aqui para ver uma versão maior desta figura.
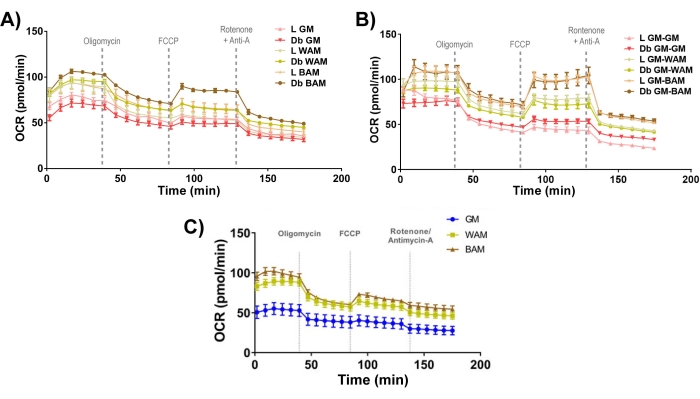
Figura 11: Avaliação funcional da fvmv e da fvm-h. MVFs magros (L) ou diabéticos tipo 2 (Db) derivados de mMVFs expostos a (A) WAM ou BAM direta ou (B) indireta ou (C) h-MVFs expostos a WAM ou BAM direta foram avaliados funcionalmente por meio da medição da taxa de consumo de oxigênio (OCR). Os resultados são apresentados como média ± erro padrão de duas réplicas experimentais (n = 4). Esse valor foi modificado a partir de Acosta et al.19. e Gonzalez et al.20. Clique aqui para ver uma versão maior desta figura.
Discussão
O campo da engenharia do tecido adiposo marrom/bege é em grande parte imaturo 22,23,24,25,26,27,28, com a maior parte dos modelos adiposos sendo desenvolvidos para o tecido adiposo branco 8,22,31. Microtecidos marrons/beges projetados tipicamente consistem em múltiplas fontes celulares ou alterações genéticas para obter um subconjunto das características fenotípicas do tecido adiposo marrom nativo 8,11,32. A abordagem aqui descrita apresenta uma maneira de fonte única, potencialmenteautóloga18,33 de criar gordura bege funcional, estruturalmente relevante e vascularizada, utilizando fragmentos microvasculares (MVFs). As FVM são mais notavelmente conhecidas como fonte de formação de tecido adiposo branco 14,16,17,1 8,34, embora recentemente tenhamos demonstrado sua capacidade de formação de gordura bege proveniente de fontes roedoras, humanas e doentes, como mostrado aqui 19,20. Dado o considerável interesse em utilizar gordura bege/marrom para seu potencial terapêutico ou de modelagem de doenças, esta técnica tem amplas aplicações nos campos do metabolismo, obesidade e distúrbios relacionados.
Existem vários pontos-chave descritos no protocolo. Primeiro, há diferenças entre a utilização de MVFs de ratos versus humanos. O uso de derivados de roedores (seja de camundongos 29 ou ratos) tem, até agora, dominado amplamente a pesquisa com MVFs, com trabalhos olhando para eles em uma infinidade de condições, como obesidade 35, diabetes tipo 136,37, diabetes tipo 219 e envelhecimento 38, e até mesmo diferenças entre depósitos adiposos 39 ou gênero40. Embora as FVM, dada sua origem, possam ser isoladas autologamente dos depósitos adiposos subcutâneos de adultos usando procedimentos minimamente invasivos padrão41, a vascularização baseada em FMV não tem sido realizada na prática clínica. Entretanto, estudos pré-clínicos em que MVFs humanas foram retiradas de lipoaspirado demonstraram suapossibilidade18,33. Para o nosso grupo especificamente, como mostrado nos dados representativos, a formação de tecido adiposo bege vascularizado é atualmente limitada a MVFs derivadas de roedores. Como demonstrado anteriormente por nosso grupo e outros18, a obtenção do equilíbrio entre crescimento vascular e diferenciação de adipócitos é altamente sensível, comprovadamente dependente dos fatoresintroduzidos42, e a diferenciação temporal éprovocada16. Uma limitação do protocolo descrito é que mais desenvolvimento é necessário para otimizar as condições propícias à formação de tecido adiposo bege h-MVF vascularizado. Além disso, mais trabalhos analisando a resposta desses arcabouços in vivo e derivados de outros estados doentes, juntamente com etapas de otimização associadas são necessários.
Além disso, é descrito aqui um protocolo para o isolamento de r-MVFs de três diferentes depósitos de tecido adiposo em ratos machos. Trabalhos anteriores de Später et al.39 discutiram diferenças entre a capacidade de vascularização de MVFs viscerais versus subcutâneas derivadas de depósito, observando que as MVFs de depósito subcutâneo tinham uma capacidade diminuída de vascularização, uma característica que atribuíram ao excesso de contaminação do tecido conjuntivo. Ressalta-se que, para nossos estudos, conforme apresentado aqui nos "dados representativos", foram utilizados apenas os depósitos subcutâneo inguinal e subcutâneo posterior. A opção pelo uso exclusivo de MVFs derivadas do subcutâneo foi feita para mimetizar mais de perto estudos translacionais em que lipoaspirados, ou procedimentos similares, coletam exclusivamente tecido adiposo subcutâneo. Além disso, o fato de estudos in vivo apontando tecido adiposo bege estarem sendo desenvolvidos dentro do tecido adiposo subcutâneo, que contém um subconjunto distinto de pré-adipócitos ou adipócitos brancos que se transdiferenciam, forneceu uma justificativa adicional para nossa decisão43. Trabalhos anteriores de nosso grupo não mostraram diferenças perceptíveis entre as MVFs originadas de depósitos viscerais ou subcutâneos de roedores saudáveis para serem submetidos tanto à angiogênese quanto à formação de tecido adiposo branco16. Todas essas variáveis devem ser consideradas no delineamento de estudos futuros.
Por fim, ao tentar modificar ou solucionar problemas do método descrito, alguns pontos essenciais devem ser deliberados. Primeiro, a etapa de digestão enzimática do tecido adiposo é extremamente importante; cuidados especiais devem ser tomados e a otimização garantida para reproduzir consistentemente MVFs de tamanho e qualidade semelhantes. Dada a grande variação entre os tipos de gordura e os volumes de gordura (altamente dependente da idade do animal, tamanho, saúde e cuidados tomados no momento do isolamento de gordura [evitar contaminantes e eficiência de extração]), o tempo de digestão pode variar, portanto, são fornecidas as faixas que melhor se encaixam com nossos equipamentos/animais. No entanto, a personalização deve ser considerada para obter os melhores resultados. Além disso, ao manusear o FMV, durante a digestão pós-enzimática, cuidados especiais devem ser tomados para evitar rugosidades desnecessárias e posterior quebra de fragmentos. Finalmente, deve-se estar ciente de que as formulações em meio, o hidrogel de escolha44 e as condições de cultura são altamente personalizáveis com base nos resultados pretendidos. Como mostrado aqui, MVFs derivados de diferentes fontes (por exemplo, MVFs magras vs. diabéticas) têm diferentes graus de diferenciação, portanto, ao projetar experimentos, controles adequados e grupos experimentais devem ser incluídos.
Em conclusão, à medida que o campo da engenharia de tecido adiposo termogênico cresce, é fundamental construir sistemas biológico-relevantes que mimetizem estrutural, genética e funcionalmente o tecido adiposo bege/marrom nativo. Os MVFs apresentam uma abordagem empolgante e única para esse desafio, pois eles, como descrito aqui, fornecem um método simples de fonte única para criar imitações biológicas de gordura bege. Portanto, eles têm um potencial significativo para utilização do entendimento ou desenvolvimento de tratamentos para obesidade e doenças metabólicas.
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Dr. Acosta é apoiado pelos subsídios do National Institutes of Health CA148724 e TL1TR002647. O Dr. Gonzalez é apoiado pelo Instituto Nacional de Diabetes e Doenças Digestivas e Renais dos Institutos Nacionais de Saúde, sob o número de prêmio F32-0DK122754. Este trabalho foi apoiado, em parte, pelo National Institutes of Health (5SC1DK122578) e pelo Departamento de Engenharia Biomédica da Universidade do Texas em San Antonio. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a opinião oficial do National Institutes of Health. As figuras foram parcialmente criadas com Biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
Referências
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados