Method Article
ثقافة ثلاثية الأبعاد للأنسجة الدهنية الحرارية الوعائية من شظايا الأوعية الدموية الدقيقة
In This Article
Summary
هنا ، نقدم بروتوكولا مفصلا يحدد استخدام شظايا الأوعية الدموية الدقيقة المعزولة من القوارض أو الأنسجة الدهنية البشرية كنهج مباشر لهندسة الأنسجة الدهنية الوظيفية ذات الأوعية الدموية البيج.
Abstract
تم التحقيق في الأنسجة الدهنية الحرارية الهندسية (على سبيل المثال ، الأنسجة الدهنية البيج أو البني) كعلاج محتمل للأمراض الأيضية أو لتصميم الأنسجة الدقيقة الشخصية للفحص الصحي واختبار الأدوية. غالبا ما تكون الاستراتيجيات الحالية معقدة للغاية وتفشل في تصوير الخصائص متعددة الخلايا والوظيفية للأنسجة الدهنية الحرارية بشكل كامل. شظايا الأوعية الدموية الدقيقة ، والأوعية الدقيقة الصغيرة السليمة التي تتكون من الشرايين والأوردة والشعيرات الدموية المعزولة من الأنسجة الدهنية ، تعمل كمصدر ذاتي واحد للخلايا التي تمكن من تكوين الأوعية الدموية والأنسجة الدهنية. توضح هذه المقالة طرقا لتحسين ظروف الاستزراع لتمكين توليد الأنسجة الدهنية ثلاثية الأبعاد والأوعية الدموية والوظيفية الحرارية من شظايا الأوعية الدموية الدقيقة ، بما في ذلك بروتوكولات عزل شظايا الأوعية الدموية الدقيقة من الأنسجة الدهنية وظروف الثقافة. بالإضافة إلى ذلك ، تتم مناقشة أفضل الممارسات ، وكذلك تقنيات توصيف الأنسجة المهندسة ، ويتم تقديم نتائج العينات من كل من شظايا القوارض والأوعية الدموية الدقيقة البشرية. هذا النهج لديه القدرة على استخدامه لفهم وتطوير علاجات السمنة وأمراض التمثيل الغذائي.
Introduction
الهدف من هذا البروتوكول هو وصف نهج لتطوير الأنسجة الدهنية البيج الوعائية من مصدر واحد ، يحتمل أن يكون ذاتيا ، جزء الأوعية الدموية الدقيقة (MVF). وقد ثبت أن الأنسجة الدهنية البنية والبيج تعرض خصائص مفيدة تتعلق بتنظيم التمثيل الغذائي. ومع ذلك ، فإن الحجم الصغير لمستودعات الأنسجة الدهنية هذه لدى البالغين يحد من التأثير المحتمل على التمثيل الغذائي الجهازي ، خاصة في الحالات المرضية مثل السمنة أو مرض السكري من النوع 21،2،3،4،5،6،7. هناك اهتمام كبير بالدهون البنية / البيج كهدف علاجي لمنع الآثار الأيضية الضارة المرتبطة بالسمنة والأمراض المصاحبةلها 8،9،10،11،12.
MVFs هي هياكل الأوعية التي يمكن عزلها مباشرة من الأنسجة الدهنية ، وزراعتها ، والحفاظ عليها في تكوين ثلاثي الأبعاد لفترات طويلة من الزمن13،14،15. بدأ العمل السابق من مجموعتنا ، وغيرها ، في استغلال القدرة متعددة الخلايا ومتعددة القدرات ل MVFs ، وتحديدا فيما يتعلق بتكوين الأنسجة الدهنية16،17،18. كتراكم لهذا العمل ، أثبتنا مؤخرا أن MVFs المشتقة من نماذج القوارض لمرض السكري الصحي والنوع 219 ومن البشر (البالغين الذين تزيد أعمارهم عن 50 عاما)20 تحتوي على خلايا قادرة على تحريضها لتشكيل أنسجة دهنية مولدة للحرارة أو بيج.
هنا هو نهج مبتكر يتم من خلاله استخدام MVF مصدر واحد ، ليس فقط قادرا على إنشاء الأنسجة الدهنية البيج ولكن أيضا المكون الوعائي المرتبط بهوالحرج 21. يمكن أن يكون استخدام هذه التقنية ذا قيمة كبيرة للدراسات التي تبحث عن نهج هندسي مباشر للأنسجة لتشكيل الأنسجة الدهنية الحرارية. على عكس الطرق الأخرى التي تطمح إلى هندسة الأنسجة الدهنية البيج22،23،24،25،26،27،28 ، لا تتطلب العملية الموضحة في هذه الدراسة استخدام أنواع متعددة من الخلايا أو أنظمة تحريض معقدة. يمكن إنشاء نماذج للدهون البيج والأبيض الوعائية باستخدام MVFs الناشئة من القوارض والمصادر البشرية ، مما يدل على إمكانات ترجمة كبيرة. المنتج النهائي لهذا البروتوكول هو نسيج دهني حراري بيج مهندس مع بنية ووظيفة أيضية مماثلة للأنسجة الدهنية البنية. بشكل عام ، يقدم هذا البروتوكول فكرة أن مصدر MVF الذي يمكن الوصول إليه بسهولة وربما يكون ذاتيا قد يكون تدخلا علاجيا مفيدا وأداة لدراسة الاضطرابات الأيضية.
Protocol
أجريت هذه الدراسة وفقا لقانون رعاية الحيوان واللوائح التنفيذية لرعاية الحيوان وفقا لمبادئ دليل رعاية واستخدام المختبر. تمت الموافقة على جميع إجراءات الحيوانات من قبل اللجنة المؤسسية لرعاية واستخدام الحيوان في جامعة تكساس في سان أنطونيو.
ملاحظة: بالنسبة للخطوات الموضحة أدناه ، يتم استخدام ذكور فئران لويس. يجب إجراء تعديلات طفيفة على البروتوكول للإناث ، وكذلك مجموعة جزء الأوعية الدموية الدقيقة للفأر (MVF)29. بالنسبة للبروتوكولات التي تستخدم MVFs البشرية (h-MVFs) ، فإن الخطوات الوحيدة المطلوبة هي إعادة تعليق h-MVFs باتباع بروتوكول الشركة المصنعة ، وإعداد وسائط النمو (1.3) ، وتشكيل الهلاميات المائية الفيبرين (5) ، والزراعة (6). للحصول على نظرة عامة على البروتوكول ، يرجى الاطلاع على الشكل 1.

الشكل 1: مخطط تجريبي. تفصيل ست خطوات رئيسية ، قبل التحليل ، لتشكيل الأنسجة الدهنية الحرارية باستخدام MVF. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد الكاشف
ملاحظة: الكواشف أدناه تتوافق مع فأر واحد ، وزنه وصنعه داخل غطاء حيوي.
- تحضير ألبومين مصل الأبقار (BSA) في برنامج تلفزيوني.
- تحضير 10 ملغ / مل (1.0٪) BSA في برنامج تلفزيوني ليتم تخفيفه لخطوات الغسيل (1 ملغ / مل ، 0.1٪) والهضم (4 ملغ / مل ، 0.4٪).
- تحضير تركيزات مختلفة من BSA ، كما هو مذكور في الخطوة 1.1.1 ، باتباع الخطوات 1.1.3-1.1.5.
- 10 ملغ/مل من BSA في PBS (1٪ BSA في PBS)
- أضف 500 مجم من BSA و 500 مل من PBS إلى أنبوب مخروطي سعة 50 مل ودوامة الحل لحل BSA.
- إذا تشكلت فقاعات مفرطة ، قم بطرد المحلول عند 350 × جم لمدة 2 دقيقة. مرشح تعقيم الحل مع مرشح صافي النايلون 0.22 ميكرومتر.
- 1 ملغ/مل BSA في برنامج تلفزيوني (0.1٪ BSA في برنامج تلفزيوني)
- قم بتخفيف 15 مل من 10 مجم / مل من BSA في PBS 1:10 باستخدام PBS بإضافة 15 مل من 10 مجم / مل BSA في PBS إلى 135 مل من PBS في زجاجة معقمة سعة 500 مل ورج الزجاجة برفق لضمان خليط متجانس.
- 4 ملغ/مل BSA في PBS (0.4٪ BSA في PBS)
- قم بتخفيف 35 مل من 10 مجم / مل BSA في PBS 1: 2.5 باستخدام PBS عن طريق إضافة 35 مل من 10 مجم / مل BSA في PBS + 57.5 مل من PBS في زجاجة معقمة سعة 100 مل ورج الزجاجة برفق لضمان خليط متجانس.
- تحضير كولاجيناز في BSA لهضم منصات الدهون المفرومة.
- تحضير 6 ملغ / مل كولاجيناز.
- في أنبوب مخروطي سعة 50 مل ، تزن 72 مجم من كولاجيناز (التسمية "ل Epi").
- في ثلاثة أنابيب مخروطية سعة 50 مل ، تزن 144 مجم من كولاجيناز (التسمية "ل Ing 1" و "for Ing 2" و "for SubQ") لكل منها.
- يخزن كولاجيناز المثقل على حرارة 4 درجات مئوية حتى الاستخدام.
ملاحظة: لا تقم بإضافة BSA / PBS حتى قبل الهضم مباشرة. - أضف 12 مل من 4 مجم / مل BSA في PBS إلى الأنبوب الذي يحتوي على 72 مجم من كولاجيناز.
- أضف 24 مل من 4 مجم / مل BSA في PBS إلى الأنابيب التي تحتوي على 144 مجم من الكولاجيناز.
- هز الأنابيب لضمان حل متجانس ومرشح تعقيم المحلول بفلتر صافي نايلون 0.22 ميكرومتر.
- تحضير 6 ملغ / مل كولاجيناز.
- تحضير وسائط النمو المكملة بحمض أمينوكابرويك (ACA) لتغذية / تمييز MVF المعزول.
- وسائط النمو (GM): مكمل DMEM مع 20٪ FBS ، 1٪ بنسلين-ستربتومايسين (بكتيريا القلم) ، 0.2٪ ميكوبلازما وقائية ، و 1 ملغ / مل ACA.
- تحضير الوسائط الدهنية البيضاء (WAM).
- تحريض WAM: مكمل DMEM / F12 مع 20٪ FBS ، 1٪ بكتيريا قلم ، 0.2٪ ميكوبلازما وقائية ، 10 ميكروغرام / مل أنسولين ، 10 ميكرومتر من فورسكولين ، 1 ميكرومتر من ديكساميثازون ، و 1 ملغ / مل ACA.
ملاحظة: بالنسبة ل h-MVFs ، بالإضافة إلى ذلك ، أضف 125 ميكرومتر من الإندوميتاسين. - صيانة WAM: مكمل DMEM / F12 مع 20٪ FBS ، 1٪ بكتيريا قلم ، 0.2٪ ميكوبلازما وقائية ، 5 ميكروغرام / مل أنسولين ، و 1 ملغ / مل ACA.
ملاحظة: بالنسبة ل h-MVFs ، قم بتغيير تركيز الأنسولين إلى 10 ميكروغرام / مل.
- تحريض WAM: مكمل DMEM / F12 مع 20٪ FBS ، 1٪ بكتيريا قلم ، 0.2٪ ميكوبلازما وقائية ، 10 ميكروغرام / مل أنسولين ، 10 ميكرومتر من فورسكولين ، 1 ميكرومتر من ديكساميثازون ، و 1 ملغ / مل ACA.
- تحضير الوسائط الدهنية البيج (BAM).
- تحريض BAM: مكمل DMEM / F12 مع 20٪ FBS ، 1٪ بكتيريا قلم ، 0.2٪ ميكوبلازما وقائية ، 10 ميكروغرام / مل أنسولين ، 10 ميكرومتر من فورسكولين ، 1 ميكرومتر من ديكساميثازون ، 1 ميكرومتر من روزيجليتازون ، 20 نانومتر 3،3 ′،5-ثلاثي يودو-إل-ثيرونين (T3) ، و 1 مجم / مل ACA.
ملاحظة: بالنسبة إلى h-MVFs ، قم بتغيير تركيز T3 إلى 120 نانومتر. - صيانة BAM: مكمل DMEM / F12 مع 20٪ FBS ، 1٪ بكتيريا قلم ، 0.2٪ ميكوبلازما وقائية ، 5 ميكروغرام / مل أنسولين ، 10 ميكرومتر من فورسكولين ، 1 ميكرومتر من روزيجليتازون ، 20 نانومتر T3 ، و 1 ملغ / مل ACA.
ملاحظة: بالنسبة ل h-MVFs ، قم بتغيير تركيز الأنسولين إلى 10 ميكروغرام / مل وتركيز T3 إلى 120 نانومتر.
- تحريض BAM: مكمل DMEM / F12 مع 20٪ FBS ، 1٪ بكتيريا قلم ، 0.2٪ ميكوبلازما وقائية ، 10 ميكروغرام / مل أنسولين ، 10 ميكرومتر من فورسكولين ، 1 ميكرومتر من ديكساميثازون ، 1 ميكرومتر من روزيجليتازون ، 20 نانومتر 3،3 ′،5-ثلاثي يودو-إل-ثيرونين (T3) ، و 1 مجم / مل ACA.
- تحضير الثرومبين (يجب إجراؤه فقط إذا كان محلول المخزون غير متوفر) لجعل عامل التخثر يستخدم في المواد الهلامية الفيبرين.
- 10 وحدة / مل ثرومبين في ddH2O:
- أعد تعليق مسحوق الثرومبين باستخدام 1-5 مل من ddH2O في القارورة من الشركة المصنعة وانقل إعادة التعليق إلى دورق سعة 250 مل.
- ارفع المحلول إلى 100 مل وقم بسحب المحلول لأعلى ولأسفل عدة مرات لضمان خليط متجانس. قم بقسمة المحلول في أنابيب مخروطية سعة 15 مل (~ 10 مل / أنبوب) وقم بتخزين القسامات في فريزر -20 درجة مئوية.
ملاحظة: للاستخدام ، قم بإذابة الثرومبين في درجة حرارة الغرفة (RT).
- 10 وحدة / مل ثرومبين في ddH2O:
2. إعداد الأداة / المواد
ملاحظة: يجب تعقيم / تعقيم جميع الأجهزة قبل الاستخدام.
- عزل الدهون في البربخ / الأربية / تحت الجلد (يجب إجراء الجراحة في منطقة جراحية محددة)
- تأكد من توفر وسادات تحتية يمكن التخلص منها ، ومقصان ، ومرقئ واحد (اختياري) ، وملقطان ، وأربعة أنابيب مخروطية سعة 50 مل مع 10-15 مل من 1 مجم / مل BSA (0.1٪) في برنامج تلفزيوني.
- عزل شظايا الأوعية الدموية الدقيقة
- للفرم (يتم في غطاء حيوي) ، تأكد من توفر ثلاثة أطباق بتري معقمة غير مطلية مقاس 100 مم ، وزوج واحد من الملقط ، ومقص واحد منحني.
- للهضم والعزل (يتم القيام به في غطاء حيوي) ، تأكد من توفر زوج واحد من المقصات ، زوج واحد من الملقط ، ثمانية أطباق بتري معقمة غير مغلفة 100 مم ، ثلاثة أطباق بتري معقمة غير مغلفة 35 مم ، وزن كولاجيناز وعند 4 درجات مئوية ، أربع قوارير سعة 250 مل ، حامل بلاستيكي واحد به ثقب في المركز ، أربع شاشات 500 ميكرومتر (مقطعة إلى 3 في مربعات مستديرة) ، أربع شاشات 37 ميكرومتر (مقطعة إلى 3 في مربعات مستديرة) ، و 11 أنابيب مخروطية 50 مل.
- إعادة تعليق الفيبرين
- بالنسبة للهلاميات المائية الفيبرينية (التي يجب إجراؤها في غطاء حيوي) ، تأكد من توفر الفيبرينوجين والثرومبين ووسائط النمو (المصنوعة أثناء تحضير الكاشف).
3. بروتوكول عزل الدهون
- الخطوات الأولية
- املأ دورقا بالإيثانول لغسل وتعقيم الأدوات الجراحية قبل استخدامها. بعد ذلك ، قم بإعداد الطاولة للتعامل مع الفئران واحصل على فراغ جاهز لاستنشاق الفراء المتولد أثناء خطوة الحلاقة.
- قم بإعداد دلو بالثلج حيث سيتم وضع الأنابيب المخروطية سعة 50 مل المعدة مسبقا ، والتي يحتوي كل منها على 10 مل من 1 مجم / مل من BSA. قم بتسمية الأنابيب وفقا لذلك.
ملاحظة: قد يكون من الضروري وجود أنبوبين مخروطيين منفصلين للدهون الأربية ، حيث يجب استخراج جانبين وتميل كمية الدهون التي تم جمعها من هذه المنطقة إلى أن تكون الأكبر مقارنة بالبربخ وتحت الجلد الخلفي. - ابدأ بفأر تم قتله رحيما في المنطقة الجراحية المحددة بالأدوات الجراحية المطلوبة. بشكل عام ، يتم استخدام CO2 للقتل الرحيم للفئران باتباع بروتوكولات IACUC.
- باستخدام كليبرز الشعر ، احلق الفئران حول منطقة الاهتمام. على وجه التحديد ، احلق بين الفخذين ونصف البطن لعزل الدهون في البربخ والأربية (استخدم ماكينة الحلاقة الأصغر للفراء في هذه المنطقة). حلق الظهر بالكامل للحصول على الدهون الخلفية تحت الجلد الموجودة بين الكتفين (من الأفضل استخدام ماكينة حلاقة أكبر لأن الفراء أكثر سمكا على الجانب الخلفي من الفئران).
- تحضير الفئران بشكل معقم عن طريق رشها بنسبة 70 ٪ من الإيثانول. بشكل عام ، يوصى بتنظيف المنطقة التي سيتم قطعها مرتين.
- عزل مستودعات الدهون المختلفة
- الأربية (تحت الجلد)
- في وضع ضعيف ، ارفع الجلد أسفل القضيب بمقص. ابدأ الشق بالمقص ، بدءا من الوسط والقطع بشكل جانبي ، وتشكيل شكل "V" والتكرار على مؤخرة الفئران للوصول إلى مستودع الدهون بأكمله. تذكر أن تقطع بشكل سطحي حتى تكون الدهون أدناه سليمة. أثناء خطوة القطع ، تأكد من فصل الجلد عن الدهون عن طريق قطع أنسجة اللفافة المترابطة (الشكل 2 أ).
- بمجرد قطع اللفافة بشكل مناسب ، تأكد من أن جانبي الدهون الأربية مرئيان (تمتد الدهون الأربية من منطقة الفخذ باتجاه الظهر). بعد ذلك ، قم بإزالة الدهون من الجانبين في أنبوبين مخروطيين منفصلين يحتويان على 10 مل من 1 مجم / مل من BSA (الشكل 2 ب).
- البربخ (الحشوي)
- احصد دهون البربخ عن طريق قطع جلد البطن وبعناية من خلال الطبقة الرقيقة المحيطة بالخصيتين (الشكل 2C).
- باستخدام الملقط ، اسحب الأنسجة الدهنية برفق واقطعها باستخدام المقص. تجنب تشريح أي أوعية دموية مرئية رئيسية (في حالة حصاد الخصية والبربخ ، قم بإزالتها أثناء خطوة التنظيف في الغطاء الحيوي).
- ضع الدهون التي تمت إزالتها بعناية في أنبوب مخروطي سعة 50 مل مع 10 مل من 1 مجم / مل BSA في برنامج تلفزيوني.
ملاحظة: يجب أن تتم إزالة دهون البربخ بعد إزالة الدهون الأربية. عادة ما تكون دهون البربخ أصغر حجما وتقع أسفل الدهون الأربية ، أسفل جلد البطن المحيط بالخصية والبربخ.
- تحت الجلد الخلفي
- اقلب الفئران المعرضة (الجانب الظهري لأعلى) ، وباستخدام مقص كبير ، قم بقص جلد الظهر (الجلد في هذه المنطقة سميك) وصولا إلى فروة الرأس ، مع الحرص على عدم قطع عميق جدا ، أسفل الجلد مباشرة (الشكل 2 د).
- قطع اللفافة التي تربط الجلد بالأنسجة. تقع الدهون في المنطقة بين الكتفين. قم بتدوين ملاحظة لتمييز / فصل الدهون تحت الجلد عن الدهون البنية. الدهون البنية أقرب إلى العمود الفقري (الشكل 2E).
- عزل ووضع الدهون في الأنبوب (الأنابيب) المخروطية المقابلة 50 مل مع 10 مل من 1 ملغ / مل BSA في PBS.
- الأربية (تحت الجلد)
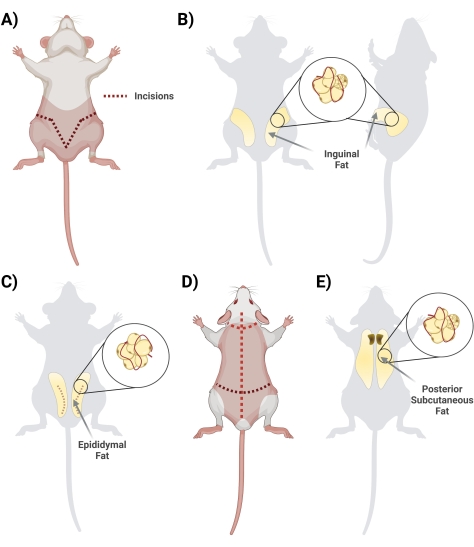
الشكل 2: عزل مستودعات الأنسجة الدهنية المختلفة. أ: الشقوق الأولية اللازمة لاستئصال النسيج الدهني الأربي. (ب) موقع مستودع الدهون الأربية. (ج) موقع مستودع دهون البربخ ، مع ملاحظة شق الجلد الخارجي اللازم للوصول. (د) الشقوق الإضافية اللازمة بمجرد وضع الفئران عرضة للوصول إلى الدهون الإضافية. (ه) موقع مستودع الدهون الخلفي تحت الجلد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. بروتوكول عزل شظايا الأوعية الدموية الدقيقة
- ضع 50 مل من الأنابيب المخروطية التي تحتوي على الدهون المستأصلة من الفئران في العلاط الحيوي.
- باستخدام الملقط ، ضع الدهون في طبق بتري قياسي 100 مم (مع ~ 0.5 مل من 1 مجم / مل BSA في برنامج تلفزيوني للحفاظ على رطوبة الأنسجة).
- تنظيف وإزالة أي أوعية دموية مرئية وأنسجة عضلية / دخيلة من الدهون.
- فرم الدهون بالمقص لمدة ~ 10 دقائق (اللحم المفروم بدرجة كافية بحيث يمكن نقلها باستخدام ماصة 10 مل).
- تحقق من وجود كتل عن طريق إضافة ~ 0.5 مل من 1 ملغ / مل BSA في PBS ؛ استمر في الفرم إذا لزم الأمر.
- انقل الدهون المفرومة إلى قارورة معقمة سعة 250 مل باستخدام ماصة سعة 10 مل.
ملاحظة: لاحظ وحدة التخزين باستخدام ماصة. - أضف ما يكفي من BSA (1 مجم / مل) بحيث يكون الحجم النهائي 20 مل.
- أضف 4 ملغ/مل من الأحماض الأمينية الأساسية في برنامج تلفزيوني إلى كولاجيناز (التركيز النهائي للكولاجيناز: 6 ملغ/مل) (أي 12 مل ل 72 ملغم من كولاجيناز أو 24 مل ل 144 ملغ من كولاجيناز).
ملاحظة: لا تضف حتى يكتمل الفرم لأنه حساس للوقت. - هز الأنبوب المخروطي برفق لضمان وجود محلول متجانس ومرشح تعقيم المحلول باستخدام مرشح صافي نايلون 0.22 ميكرومتر.
- للدهون البربخية ، هضم لمدة ~ 8-10 دقيقة. بالنسبة للدهون الأربية والخلفية تحت الجلد ، قم بهضمها لمدة ~ 15-20 دقيقة في حمام مائي 37 درجة مئوية ، مع هز القارورة بحركة دائرية طوال الوقت (توقف في اللحظة التي تصل فيها الدهون إلى حيث لا يوجد سوى عدد قليل من الكتل المتبقية).
- انقل الدهون المهضومة إلى أنبوب مخروطي سعة 50 مل (يجب أن يكون هناك ~ 30 مل / أنبوب) ، وقم بتسمية الأنبوب على أنه "دهون مهضومة".
- أدر الأنبوب عند 400 × جم لمدة 4 دقائق ؛ بعد الغزل ، يجب أن تكون الحبيبات حمراء (الشكل 3 أ).
- أثناء الدوران ، ضع الشاشة المعقمة 37 ميكرومتر وشاشات 500 ميكرومتر في طبق بتري معقم مع 5 مل من 1 مجم / مل BSA في برنامج تلفزيوني للنقع المسبق قبل الاستخدام.
- بعد الدوران ، صب المادة الطافية في أنبوب مخروطي سعة 50 مل يسمى "نفايات". قم بإجراء الصب برفق لإزالة الدهون السطحية وعدم إزعاج الحبيبات المصنوعة من MVFs.
- أضف 10 مل من 1 مجم / مل من BSA في برنامج تلفزيوني إلى الأنبوب الذي يحتوي على الحبيبات ("الدهون المهضومة"). سحن (ماصة لأعلى ولأسفل) بيليه 2x.
- تجنب أن تكون خشنا جدا على الحبيبات حتى لا تعطل الشظايا.
- ضع شاشة 500 ميكرومتر في طبق بتري جديد فوق حامل الشاشة البلاستيكي (الشكل 3 ب).
- ماصة 10 مل من أنبوب "الحبيبات المهضومة" على شاشة 500 ميكرومتر باستخدام دوائر متحدة المركز (الشكل 3C).
- اغسل الفلتر ب 5 مل إضافية من 1 مجم / مل BSA في برنامج تلفزيوني. سوف تتسرب الخلايا المطلوبة إلى طبق بتري ؛ لذلك ، تخلص من شاشة 500 ميكرومتر ولكن احفظ السائل المصفى داخل طبق بتري.
- ضع شاشة 37 ميكرومتر في طبق بتري جديد فوق حامل الشاشة البلاستيكية.
- قم بتغيير الماصة للتخلص من أي كتل قبل استخدام شاشة 37 ميكرومتر.
- ماصة السائل الذي تم الحصول عليه من الترشيح الأول على شاشة 37 ميكرومتر باستخدام دوائر متحدة المركز.
- اغسل الفلتر ب 5 مل إضافية من 1 مجم / مل BSA في برنامج تلفزيوني. ستبقى الخلايا المطلوبة في المرشح ، وبالتالي تخلص من السائل المصفى ، ولكن احفظ شاشة 37 ميكرومتر.
- حرك شاشة 37 ميكرومتر إلى طبق بتري جديد يحتوي على 5 مل من 1 مجم / مل BSA في PBS.
- هز الطبق عن طريق النقر عليه على حامل مخروطي لإزاحة الشظايا. لا تهتز بقوة كبيرة ، حيث قد ينسكب السائل / الخلايا من طبق بتري.
- اشطف الفلتر ب 5 مل إضافية من 1 مجم / مل من BSA في PBS. ستبقى الخلايا المرغوبة في محلول سائل في طبق بتري. احفظ شاشة 37 ميكرومتر والجزء المخلوع الذي يحتوي على سائل داخل طبق بتري للخطوات التالية.
- انقل جزء BSA + الذي يحتوي على سائل إلى أنبوب مخروطي معقم سعة 50 مل.
- كرر شطف الشاشة 37 ميكرومتر عدة مرات (في كل مرة مع ~ 5 مل من 1 ملغ / مل BSA في PBS) وأضفه إلى الأنبوب المخروطي. كرر حتى الحجم الإجمالي الذي تم جمعه هو ~ 15-20 مل. في النهاية ، سيتم جمع الخلايا المطلوبة من المحلول السائل في طبق بتري ووضعها في أنبوب مخروطي ؛ في هذه المرحلة ، تخلص من شاشة 37 ميكرومتر بعد الشطف النهائي ولكن احفظ الشظايا التي تم إزاحتها والتي تحتوي على سائل داخل الأنبوب المخروطي سعة 50 مل.
- قص طرف طرف ماصة 200 ميكرولتر باستخدام المقص. هز أنبوب 50 مل برفق ، وإزالة عينتين من 20 ميكرولتر ، ووضعها في طبق بتري نظيف 35 ملم.
- احسب عدد الأجزاء في كل عينة في طبق بتري للحصول على العدد الإجمالي ل MVFs المعزولة.
إجمالي الشظايا =
- قم بتدوير الجزء المتبقي الذي تم إزاحته والذي يحتوي على سائل في أنبوب مخروطي سعة 50 مل عند 400 × جم لمدة 4 دقائق لجمع MVF.
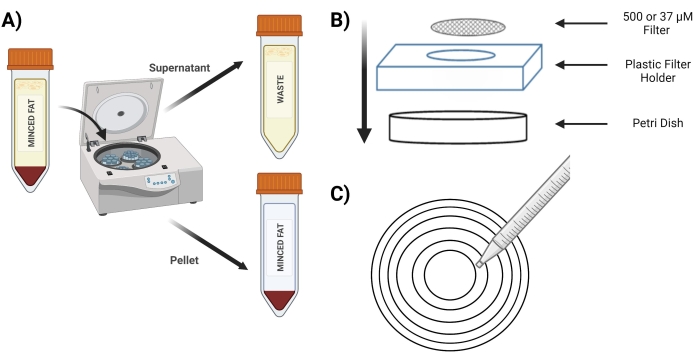
الشكل 3: عزل MVFs . (أ) بعد هضم الأنسجة الدهنية ، تصوير لفصل MVFs التي تحتوي على حبيبات وطاف بعد الدوران. (ب) تخطيط الإمدادات لترشيح وحبس MVFs. (ج) توضيح طريقة الدائرة متحدة المركز لخطوات الترشيح / الغسيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تشكيل الهلاميات المائية الفيبرين
- أمثلة على العمليات الحسابية:
ملاحظة: فيما يلي حسابات MVFs المصنفة عند ~ 15000-20000 MVF / mL ونسبة هلام الفيبرينوجين: الثرومبين عند 2: 5 ، مع استخدام الفيبرينوجين بتركيز 20 مجم / مل.- لصنع خمسة مواد هلامية سعة 250 ميكرولتر ، يلزم حجم إجمالي قدره 1250 ميكرولتر. ضع في اعتبارك دائما أخطاء السحب ، وبالتالي ، اصنع ما يكفي ل 1.5 مل من المواد الهلامية.
- احسب حجم الفيبرينوجين المطلوب على النحو التالي:
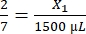 ، X1 = 428.57 ميكرولتر من الفيبرينوجين
، X1 = 428.57 ميكرولتر من الفيبرينوجين - احسب حجم الثرومبين المطلوب على النحو التالي:
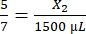 ، X2 = 1,071.43 ميكرولتر من الثرومبين
، X2 = 1,071.43 ميكرولتر من الثرومبين - بالنسبة للحجم المطلوب البالغ 428.57 ميكرولتر ، اصنع 500 ميكرولتر من الفيبرينوجين على النحو التالي:
20 مجم / مل * 0.5 مل = 10 مجم من الفيبرينوجين. أعد تعليق هذا في 500 ميكرولتر من DMEM - للحصول على كل هلام ، احسب حجم الفيبرينوجين والثرومبين على النحو التالي:
- الفيبرينوجين:
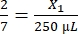 ، X1 = 71.43 ميكرولتر من الفيبرينوجين (في DMEM) + MVF
، X1 = 71.43 ميكرولتر من الفيبرينوجين (في DMEM) + MVF - الثرومبين:
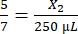 ، X2 = 178.57 ميكرولتر من الثرومبين
، X2 = 178.57 ميكرولتر من الثرومبين
- الفيبرينوجين:
- احسب حجم الفيبرينوجين المطلوب على النحو التالي:
- لصنع خمسة مواد هلامية سعة 250 ميكرولتر ، يلزم حجم إجمالي قدره 1250 ميكرولتر. ضع في اعتبارك دائما أخطاء السحب ، وبالتالي ، اصنع ما يكفي ل 1.5 مل من المواد الهلامية.
- صب جل الفيبرين MVF
- صب معظم السائل في الجزء المغزول لأسفل في الأنبوب المخروطي سعة 50 مل. استخدم ماصة لإزالة الحجم الصغير من السائل الذي يمسك بحافة الأنبوب المخروطي.
- أضف الثرومبين إلى الآبار حيث سيتم صنع المواد الهلامية (الشكل 4 أ).
- قص نهاية طرف ماصة 200 ميكرولتر وأعد تعليق MVFs برفق باستخدام الفيبرينوجين للحصول على كثافة نهائية ~ 15000-20000 MVF / mL مرة واحدة في الجل.
- قم بقص نهاية طرف ماصة سعة 200 ميكرولتر وماصة MVF + Fibrinogen في محلول الثرومبين برفق. قم بالسحب بسرعة لأعلى ولأسفل لضمان خليط متجانس. كرر حتى يتم صنع جميع المواد الهلامية (الشكل 4 ب).
- ضع لوحة (لوحات) البئر في حاضنة (37 درجة مئوية ، 5٪ CO2) لمدة ~ 15 دقيقة للسماح بتشابك الهلام (الشكل 4C).
- أضف 100-150 ميكرولتر من وسائط النمو إلى كل بئر.
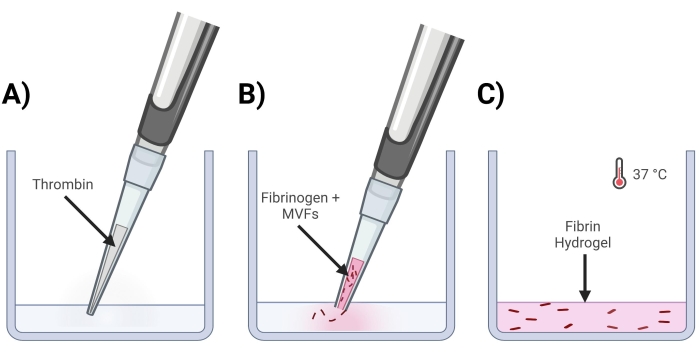
الشكل 4: تكوين جل الفيبرين MVF . (أ) يتم سحب خليط الثرومبين المكون من 5/7 أجزاء في البئر المقابلة. (ب) بعد ذلك ، باستخدام طرف ماصة مقطوع (لعدم إزعاج MVFs) ، يتم سحب خليط من الفيبرينوجين + MVF المكون من 2/7 جزء في البئر وخلطه برفق. (ج) أخيرا ، يتم وضع جميع المواد الهلامية المكتملة في حاضنة عند 37 درجة مئوية ، مما يسمح للهيدروجيل بالتصلب تماما قبل وضع الوسائط في الأعلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. ظروف زراعة MVFs
- لزراعة الأنسجة الدهنية البيضاء والبيج غير الوعائية (+ GM Control) ، استخدم الجداول الزمنية19 الموضحة في الشكل 5.
- لزراعة الأنسجة الدهنية البيضاء والبيج الوعائية (+ GM Control) ، استخدم الجداول الزمنية19 الموضحة في الشكل 6.
- يجب الاحتفاظ بالهلاميات المائية في حاضنة (37 درجة مئوية ، 5٪ CO2) طوال مدة الاستزراع للدراسة ، مع تغيير الوسائط كل يومين. لتثبيت العينات ومعالجتها للتحليل ، راجع الأعمال المنشورة سابقا16،19،20.
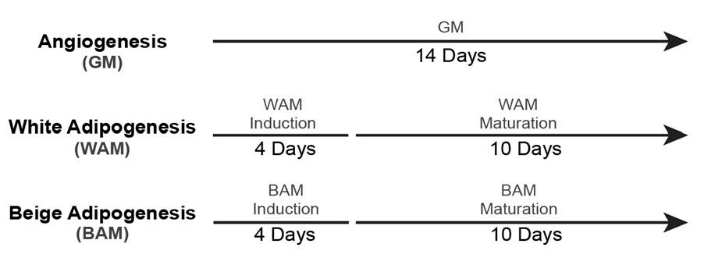
الشكل 5: توقيت تكوين الأنسجة الدهنية غير الوعائية. تم تعديل هذا الرقم من Acosta et al.19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: توقيت تكوين الأنسجة الدهنية الوعائية. تم تعديل هذا الرقم من Acosta et al.19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
هناك عدد قليل من الخصائص المورفولوجية المظهرية الرئيسية للأنسجة الدهنية البيج / البني: إنه متعدد العيون / يحتوي على قطرات دهنية صغيرة ، ويمتلك عددا كبيرا من الميتوكوندريا (سبب مظهره "البني" المميز في الجسم الحي) ، في المقابل لديه معدل استهلاك مرتفع للأكسجين / الطاقة الحيوية للميتوكوندريا ، وهو شديد الأوعية الدموية ، وزاد من امتصاص تحلل الدهون / الجلوكوز المحفز بالأنسولين ، والأكثر شهرة ، يعبر عن مستويات عالية من بروتين الفصل 1 (UCP1) ، وهو بروتين ميتوكوندريا يشارك في التنفس الحراري19,30.
وفقا لذلك ، عند توصيف قدرة MVFs على التمايز إلى أنسجة دهنية بيج ، تم إجراء تحليل يسمح لنا بالتصور (الشكل 7 ، الشكل 8) ، والتأكيد الوراثي (الشكل 9 ، الشكل 10) ، والقياس الوظيفي (الشكل 11) تحول MVF.
في الشكل 7 والشكل 8 ، من خلال استخدام BODIPY ، صبغة دهنية ، وتصوير الهلاميات المائية باستخدام الفحص المجهري متحد البؤر ، شوهد تصور تحجيم وموقع الدهون في الخلايا الشحميةالمتمايزة 16،17،19. والجدير بالذكر أنه في هذا التحليل ، خاصة بالمقارنة بين الظروف ، يجب أن تعرض مجموعات BAM أحجام دهون أصغر (تدل على تكوين الأنسجة الدهنية البيج) ، قابلة للقياس الكمي من خلال NIH ImageJ19,20.
باستخدام RT-qPCR16،19،20 ، في الشكل 9 والشكل 10 ، بشكل أكثر تميزا ، يزداد التعبير عن UCP1 ، في جميع المجالات ، بشكل كبير عند التعرض MVF ل BAM.
أخيرا ، بالنظر إلى علم الطاقة الحيوية للميتوكوندريا (الشكل 11) ، من الواضح أن مجموعات BAM لديها مستويات أعلى من معدل استهلاك الأكسجين (OCR) ، تم قياسها باستخدام اختبار إجهاد فرس البحرميتو 19,20.
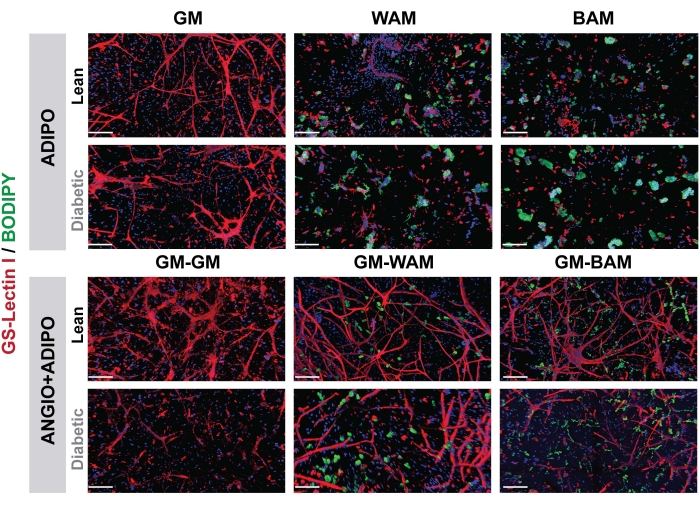
الشكل 7: التقييم النسيجي r-MVF. تم تعريض r-MVFs المشتقة من مرض السكري من النوع 2 إما مباشرة (اللوحة العلوية ، ADIPO) أو غير مباشرة (اللوحة السفلية ، ANGIO + ADIPO) WAM أو BAM للحصول على أنسجة دهنية بيضاء أو بيج غير وعائية أو وعائية ، على التوالي (قضبان المقياس = 200 ميكرومتر). تم تعديل هذا الرقم من Acosta et al.19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: التقييم النسيجي h-MVF. تعرض h-MVF ل WAM أو BAM المباشر (ADIPO) للحصول على أنسجة دهنية بيضاء أو بيج غير وعائية ، على التوالي (قضبان المقياس = 200 ميكرومتر). () عدل هذا الرقم من غونزاليس بوراس وآخرين.20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
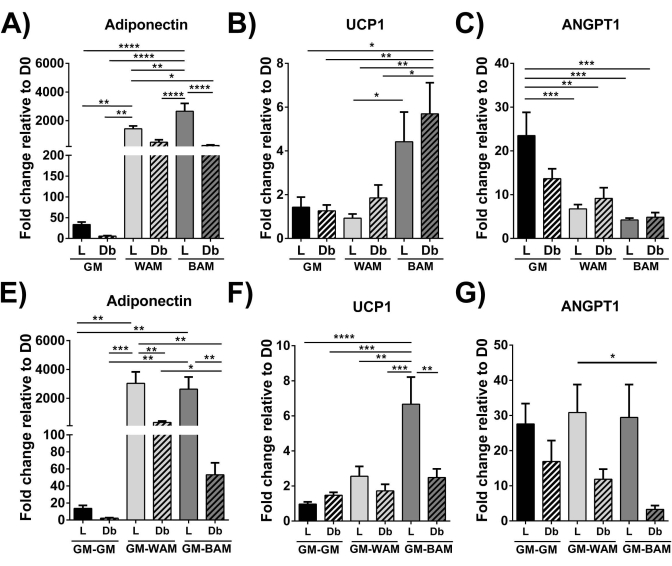
الشكل 9: تقييم r-MVF من خلال RT-qPCR. تم تقييم العجاف (L) أو النوع 2 المشتق من السكري (Db) r-MVF المعرض إما ل (A-C) المباشر أو (E-G) WAM أو BAM غير المباشر ل (A ، E) تكوين الدهون (Adiponectin) ، (B ، F) التوليد الحراري (UCP1) ، و (C ، G) تولد الأوعية (ANGPT1). تم الإبلاغ عن النتائج كمتوسط ± الخطأ المعياري لاثنين من النسخ المتماثلة التجريبية (n = 4). * = p < 0.05 و ** = p < 0.01 و *** = p < 0.001 و **** = p < 0.0001 . د0 = اليوم 0. اختبارات تحليل التباين ثنائي الاتجاه (ANOVA) مع تحليلات المقارنة المتعددة لهولم سيداك لتحديد الاختلافات بين المجموعات. تم تعريف الدلالة الإحصائية على أنها p < 0.05. تم تعديل هذا الرقم من Acosta et al.19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
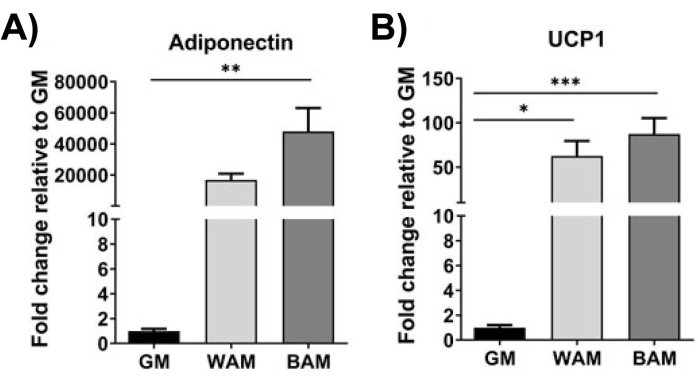
الشكل 10: تقييم h-MVF من خلال RT-qPCR. تم تقييم h-MVFs المعرضة ل WAM أو BAM المباشر من أجل (A) تكوين الدهون (Adiponectin) و (B) التوليد الحراري (UCP1). تم الإبلاغ عن النتائج كمتوسط ± الخطأ المعياري لاثنين من النسخ المتماثلة التجريبية (n = 4). * = p < 0.05 و ** = p < 0.01 و *** = p < 0.001 و **** = p < 0.0001 . اختبار تحليل التباين أحادي الاتجاه (ANOVA) مع تحليلات المقارنة المتعددة لهولم سيداك لتحديد الاختلافات بين المجموعات. تم تعريف الدلالة الإحصائية على أنها p < 0.05. () عدل هذا الرقم من غونزاليس بوراس وآخرين.20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
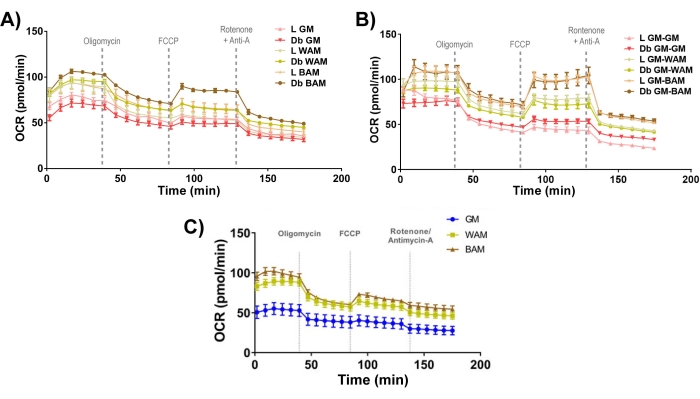
الشكل 11: التقييم الوظيفي r-MVF و h-MVF. تم تقييم r-MVFs المشتقة من العجاف (L) أو النوع 2 من مرض السكري (Db) المعرضة إما ل (A) المباشر أو (B) WAM أو BAM المباشر أو (C) h-MVFs المعرضة ل WAM أو BAM المباشر وظيفيا من خلال قياس معدل استهلاك الأكسجين (OCR). تم الإبلاغ عن النتائج كمتوسط ± الخطأ المعياري لاثنين من النسخ المتماثلة التجريبية (n = 4). تم تعديل هذا الرقم من Acosta et al.19. وغونزاليس بوراس وآخرون 20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
مجال هندسة الأنسجة الدهنية ذات اللون البني / البيج غير ناضج إلى حد كبير 22،23،24،25،26،27،28 ، مع تطوير الجزء الأكبر من النماذج الدهنية للأنسجة الدهنية البيضاء8،22،31. تتكون الأنسجة الدقيقة ذات اللون البني / البيج المهندسة عادة من مصادر خلايا متعددة أو تغيرات جينية للحصول على مجموعة فرعية من الخصائص المظهرية للأنسجة الدهنية البنية الأصلية8،11،32. يقدم النهج الموصوف هنا طريقة18,33 أحادية المصدر ، يحتمل أن تكون ذاتية المصدر لإنشاء دهون بيج وظيفية وذات صلة هيكليا والأوعية الدموية باستخدام شظايا الأوعية الدموية الدقيقة (MVFs). تعرف MVFs بشكل ملحوظ كمصدر لتكوين الأنسجة الدهنية البيضاء 14،16،17،18،34 ، على الرغم من أننا أثبتنا مؤخرا قدرتها على تكوين الدهون البيج النابعة من مصادر القوارض والإنسان والأمراض ، كما هو موضح هنا 19,20. نظرا للاهتمام الكبير باستخدام الدهون البيج / البنية لإمكاناتها العلاجية أو نمذجة الأمراض ، فإن هذه التقنية لها تطبيقات بعيدة المدى في مجالات التمثيل الغذائي والسمنة والاضطرابات ذات الصلة.
هناك العديد من النقاط الرئيسية الموضحة في البروتوكول. أولا ، هناك اختلافات بين استخدام الفئران مقابل MVFs البشرية. حتى الآن ، سيطر استخدام القوارض المشتقة (إما من الفئران 29 أو الفئران) إلى حد كبير على الأبحاث مع MVFs ، مع العمل الذي يبحث فيها في العديد من الحالات مثل السمنة 35 ، ومرض السكري من النوع 1 36،37 ، ومرض السكري من النوع 219 ، والشيخوخة38 ، وحتى الاختلافات بين المستودعات الدهنية 39 أو الجنس40. على الرغم من أن MVFs ، نظرا لأصلها ، يمكن عزلها ذاتيا عن المستودعات الدهنية تحت الجلد للبالغين باستخدام الإجراءات القياسية طفيفة التوغل41 ، لم يتم إجراء الأوعية الدموية القائمة على MVF في الممارسة السريرية. ومع ذلك ، فقد أظهرت الدراسات قبل السريرية حيث تم حصاد MVFs البشرية من شفط الدهون إمكانية18,33. بالنسبة لمجموعتنا على وجه التحديد ، كما هو موضح في البيانات التمثيلية ، يقتصر تكوين الأنسجة الدهنية البيج الوعائية حاليا على MVFs المشتقة من القوارض. كما هو موضح سابقا من قبل مجموعتنا وآخرين18 ، فإن الحصول على توازن نمو الأوعية وتمايز الخلايا الشحمية أمر حساس للغاية ، وثبت أنه يعتمد على العوامل المقدمة42 ، ويتم إثارة تمايز النقطة الزمنية16. أحد قيود البروتوكول الموصوف هو أن هناك حاجة إلى مزيد من التطوير لتحسين الظروف المؤدية إلى تكوين الأنسجة الدهنية البيج h-MVF الوعائية. بالإضافة إلى ذلك ، هناك حاجة إلى مزيد من العمل الذي يبحث في استجابة هذه السقالات في الجسم الحي والمشتقة من حالات مريضة أخرى ، إلى جانب خطوات التحسين المرتبطة بها.
علاوة على ذلك ، الموصوف هنا هو بروتوكول لعزل r-MVFs من ثلاثة مستودعات مختلفة للأنسجة الدهنية في ذكور الفئران. ناقش العمل السابق من Später et al.39 الاختلافات بين قدرة الأوعية الدموية ل MVFs الحشوية مقابل MVFs المشتقة من المستودع تحت الجلد ، مشيرا إلى أن MVFs تحت الجلد في المستودع لديها قدرة منخفضة على الأوعية الدموية ، وهي ميزة نسبوها إلى تلوث النسيج الضام الزائد. وتجدر الإشارة إلى أنه بالنسبة لدراساتنا ، كما هو موضح هنا في "البيانات التمثيلية" ، تم استخدام المستودعات تحت الجلد الأربية والخلفية فقط. تم اختيار استخدام MVFs المشتقة تحت الجلد فقط لتقليد الدراسات الانتقالية بشكل أوثق حيث تجمع شفط الدهون ، أو الإجراءات المماثلة ، الأنسجة الدهنية تحت الجلد حصريا. بالإضافة إلى ذلك ، فإن حقيقة أن الدراسات في الجسم الحي يتم تطوير الأنسجة الدهنية البيج التي تشير إلى تحديد الأنسجة الدهنية داخل الجلد ، والتي تحتوي على مجموعة فرعية متميزة من الخلايا الدهنية أو الخلايا الشحمية البيضاء التي تتمايز ، قدمت أساسا منطقيا إضافيا لقرارنا43. أظهر العمل السابق من مجموعتنا عدم وجود اختلافات ملحوظة بين MVFs الناشئة عن مستودعات الحشوية أو تحت الجلد للقوارض السليمة للخضوع لكل من تكوين الأوعية وتكوين الأنسجة الدهنية البيضاء16. يجب مراعاة كل هذه المتغيرات عند تصميم الدراسات المستقبلية.
أخيرا ، عند محاولة تعديل الطريقة الموضحة أو استكشاف الأخطاء وإصلاحها ، يجب مناقشة بعض النقاط الأساسية. أولا ، خطوة هضم الأنسجة الدهنية إنزيميا مهمة للغاية. يجب توخي الحذر بشكل خاص وضمان التحسين لإعادة إنتاج MVFs ذات الحجم والجودة المتماثلين باستمرار. نظرا للتباين الكبير بين أنواع الدهون وأحجام الدهون (يعتمد بشكل كبير على عمر الحيوان وحجمه وصحته والعناية التي يتم اتخاذها في وقت عزل الدهون [تجنب الملوثات وكفاءة الاستخراج]) ، يمكن أن يختلف وقت الهضم ، وبالتالي يتم توفير النطاقات التي تتناسب بشكل أفضل مع معداتنا / حيواناتنا. ومع ذلك ، ينبغي النظر في التخصيص للحصول على أفضل النتائج. بالإضافة إلى ذلك ، عند التعامل مع MVF ، أثناء الهضم بعد الأنزيمية ، يجب توخي الحذر بشكل خاص لتجنب الخشونة غير الضرورية وزيادة تفتيت الشظايا. أخيرا ، يجب أن يدرك المرء أن تركيبات الوسائط ، وهيدروجيل الاختيار44 ، وظروف الاستزراع قابلة للتخصيص بدرجة كبيرة بناء على النتائج المرجوة. كما هو موضح هنا ، فإن MVFs المشتقة من مصادر مختلفة (على سبيل المثال ، MVFs الخالية من الدهون مقابل السكري) لها درجات مختلفة من التمايز ، لذلك عند تصميم التجارب ، يجب تضمين الضوابط المناسبة والمجموعات التجريبية.
في الختام ، مع نمو مجال هندسة الأنسجة الدهنية الحرارية ، من الأهمية بمكان بناء أنظمة بيولوجية ذات صلة تحاكي هيكليا ووراثيا ووظيفيا الأنسجة الدهنية الأصلية باللون البيج / البني. تقدم MVFs نهجا مثيرا وفريدا لهذا التحدي ، لأنها ، كما هو موضح هنا ، توفر طريقة بسيطة أحادية المصدر لإنشاء تقليد بيولوجي للدهون البيج. لذلك ، لديهم إمكانات كبيرة للاستفادة من فهم أو تطوير علاجات للسمنة وأمراض التمثيل الغذائي.
Disclosures
يعلن المؤلفون أن البحث قد أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
يتم دعم الدكتور أكوستا من قبل المعاهد الوطنية للصحة منح CA148724 و TL1TR002647. يتم دعم الدكتور غونزاليس بوراس من قبل المعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى التابع للمعاهد الوطنية للصحة ، تحت رقم الجائزة F32-0DK122754. تم دعم هذا العمل ، جزئيا ، من قبل المعاهد الوطنية للصحة (5SC1DK122578) وجامعة تكساس في قسم الهندسة الطبية الحيوية في سان أنطونيو. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة الآراء الرسمية للمعاهد الوطنية للصحة. تم إنشاء الأرقام جزئيا باستخدام Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
References
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved