Method Article
Coltura tridimensionale di tessuto adiposo termogenico vascolarizzato da frammenti microvascolari
In questo articolo
Riepilogo
Qui, presentiamo un protocollo dettagliato che delinea l'uso di frammenti microvascolari isolati da roditori o tessuto adiposo umano come approccio diretto per progettare tessuto adiposo beige funzionale e vascolarizzato.
Abstract
L'ingegneria del tessuto adiposo termogenico (ad esempio, tessuti adiposi beige o bruni) è stata studiata come potenziale terapia per le malattie metaboliche o per la progettazione di microtessuti personalizzati per lo screening sanitario e i test farmacologici. Le strategie attuali sono spesso piuttosto complesse e non riescono a rappresentare accuratamente le proprietà multicellulari e funzionali del tessuto adiposo termogenico. I frammenti microvascolari, piccoli microvasi intatti composti da arteriole, venule e capillari isolati dal tessuto adiposo, fungono da singola fonte autologa di cellule che consentono la vascolarizzazione e la formazione del tessuto adiposo. Questo articolo descrive i metodi per ottimizzare le condizioni di coltura per consentire la generazione di tessuti adiposi termogenici tridimensionali, vascolarizzati e funzionali da frammenti microvascolari, compresi i protocolli per l'isolamento di frammenti microvascolari da tessuto adiposo e condizioni di coltura. Inoltre, vengono discusse le migliori pratiche, così come le tecniche per caratterizzare i tessuti ingegnerizzati e vengono forniti i risultati dei campioni da frammenti microvascolari sia di roditori che umani. Questo approccio ha il potenziale per essere utilizzato per la comprensione e lo sviluppo di trattamenti per l'obesità e le malattie metaboliche.
Introduzione
L'obiettivo di questo protocollo è quello di descrivere un approccio per lo sviluppo di tessuto adiposo beige vascolarizzato da una singola fonte potenzialmente autologa, il frammento microvascolare (MVF). I tessuti adiposi marroni e beige hanno dimostrato di mostrare proprietà benefiche legate alla regolazione metabolica; Tuttavia, il piccolo volume di questi depositi di tessuto adiposo negli adulti limita il potenziale impatto sul metabolismo sistemico, in particolare in condizioni malate come l'obesità o il diabete di tipo 2 1,2,3,4,5,6,7. C'è un significativo interesse per il grasso marrone / beige come bersaglio terapeutico per prevenire gli effetti metabolici dannosi legati all'obesità e alle sue comorbidità 8,9,10,11,12.
Gli MVF sono strutture vascolari che possono essere isolate direttamente dal tessuto adiposo, coltivate e mantenute in una configurazione tridimensionale per lunghi periodi di tempo13,14,15. Il lavoro precedente del nostro gruppo, e di altri, ha iniziato a sfruttare la capacità multicellulare e multipotente degli MVF, in particolare per quanto riguarda la formazione del tessuto adiposo16,17,18. Come conclusione di questo lavoro, abbiamo recentemente dimostrato che gli MVF derivati da modelli di roditori di diabete sano e di tipo 219 e da soggetti umani (adulti di età superiore ai 50 anni)20 contenevano cellule in grado di essere indotte a formare tessuto adiposo termogenico o beige.
Ecco un approccio innovativo da cui viene utilizzato un MVF da una singola fonte, non solo in grado di creare tessuto adiposo beige ma anche la sua componente vascolare associata e critica21. L'uso di questa tecnica potrebbe essere di grande valore per gli studi che cercano un approccio semplice di ingegneria tissutale per la formazione del tessuto adiposo termogenico. A differenza di altri metodi che aspirano a progettare il tessuto adiposo beige 22,23,24,25,26,27,28, il processo descritto in questo studio non richiede l'uso di più tipi di cellule o complessi regimi di induzione. I modelli di grasso beige e bianco vascolarizzati possono essere creati con MVF provenienti da fonti di roditori e umani, dimostrando un grande potenziale di traduzione. Il prodotto finale di questo protocollo è un tessuto adiposo termogenico beige ingegnerizzato con una struttura e una funzione metabolica paragonabili al tessuto adiposo bruno. Nel complesso, questo protocollo presenta l'idea che una fonte facilmente accessibile e possibilmente autologa MVF possa essere un utile intervento terapeutico e uno strumento per studiare i disturbi metabolici.
Protocollo
Questo studio è stato condotto in conformità con la legge sul benessere degli animali e i regolamenti di attuazione sul benessere degli animali in conformità con i principi della Guida per la cura e l'uso degli animali da laboratorio. Tutte le procedure sugli animali sono state approvate dall'Institutional Animal Care and Use Committee dell'Università del Texas a San Antonio.
NOTA: Per i passaggi descritti di seguito, vengono utilizzati ratti Lewis maschi. Lievi aggiustamenti del protocollo devono essere effettuati per una femmina, così come la raccolta di frammenti microvascolari di topo (MVF)29. Per i protocolli che utilizzano MVF umani (h-MVF), gli unici passaggi richiesti sono la risospensione degli h-MVF seguendo il protocollo del produttore, la preparazione dei terreni di crescita (1.3), la formazione di idrogel di fibrina (5) e la coltura (6). Per una panoramica del protocollo, vedere la Figura 1.

Figura 1: Schema sperimentale. Suddivisione di sei fasi chiave, prima dell'analisi, per la formazione di tessuto adiposo termogenico utilizzando MVF. Fare clic qui per visualizzare una versione ingrandita di questa figura.
1. Preparazione del reagente
NOTA: I reagenti riportati di seguito corrispondono a un ratto, pesato e realizzato all'interno di una biocappa.
- Preparare l'albumina sierica bovina (BSA) in PBS.
- Preparare 10 mg/mL (1,0%) di BSA in PBS da diluire per le fasi di lavaggio (1 mg/ml, 0,1%) e digestione (4 mg/ml, 0,4%).
- Preparare diverse concentrazioni di BSA, come indicato al punto 1.1.1, seguendo i passaggi 1.1.3-1.1.5.
- 10 mg/mL BSA in PBS (1% BSA in PBS)
- Aggiungere 500 mg di BSA e 500 mL di PBS in un tubo conico da 50 mL e vortice la soluzione per sciogliere la BSA.
- Se si formano bolle eccessive, centrifugare la soluzione a 350 x g per 2 minuti. Filtrare sterilizzare la soluzione con un filtro in rete di nylon da 0,22 μm.
- 1 mg/mL di BSA in PBS (0,1% BSA in PBS)
- Diluire 15 mL di 10 mg/mL di BSA in PBS 1:10 con PBS aggiungendo 15 mL di 10 mg/mL di BSA in PBS a 135 mL di PBS in un flacone sterile da 500 mL e agitare delicatamente il flacone per ottenere una miscela omogenea.
- 4 mg/mL BSA in PBS (0,4% BSA in PBS)
- Diluire 35 mL di 10 mg/mL di BSA in PBS 1:2.5 con PBS aggiungendo 35 mL di 10 mg/mL di BSA in PBS + 57,5 mL di PBS in un flacone sterile da 100 mL e agitare delicatamente il flacone per garantire una miscela omogenea.
- Preparare la collagenasi in BSA per la digestione dei cuscinetti di grasso tritato.
- Preparare 6 mg/mL di collagenasi.
- In un tubo conico da 50 ml, pesare 72 mg di collagenasi (etichetta "per Epi").
- In tre tubi conici da 50 ml, pesare 144 mg di collagenasi (etichetta "per Ing 1", "per Ing 2" e "per SubQ") ciascuno.
- Conservare la collagenasi pesata a 4 °C fino all'uso.
NOTA: Non aggiungere BSA/PBS fino a poco prima della digestione. - Aggiungere 12 mL di 4 mg/mL BSA in PBS al tubo contenente 72 mg di collagenasi.
- Aggiungere 24 mL di 4 mg/mL di BSA in PBS alle provette contenenti 144 mg di collagenasi.
- Agitare i tubi per garantire una soluzione omogenea e filtrare sterilizzare la soluzione con un filtro in rete di nylon da 0,22 μm.
- Preparare 6 mg/mL di collagenasi.
- Preparare terreni di crescita integrati con acido aminocaproico (ACA) per nutrire / differenziare il MVF isolato.
- Terreni di coltura (GM): Integrare DMEM con 20% FBS, 1% penicillina-streptomicina (streptococco penna), 0,2% micoplasma profilattico, e 1 mg / mL ACA.
- Preparare terreni adipogeni bianchi (WAM).
- Induzione WAM: Integrare DMEM / F12 con 20% FBS, 1% di streptococco a penna, 0,2% di profilassi micoplasma, 10 μg / mL di insulina, 10 μm di forskolina, 1 μm di desametasone e 1 mg / mL ACA.
NOTA: Per gli h-MVF, inoltre, aggiungere 125 μM di indometacina. - Mantenimento WAM: Integrare DMEM / F12 con 20% FBS, 1% di streptococco a penna, 0,2% di profilassi micoplasma, 5 μg / mL di insulina e 1 mg / mL di ACA.
NOTA: Per gli h-MVF, modificare la concentrazione di insulina a 10 μg/ml.
- Induzione WAM: Integrare DMEM / F12 con 20% FBS, 1% di streptococco a penna, 0,2% di profilassi micoplasma, 10 μg / mL di insulina, 10 μm di forskolina, 1 μm di desametasone e 1 mg / mL ACA.
- Preparare mezzi adipogenici beige (BAM).
- Induzione BAM: Supplemento DMEM/F12 con 20% FBS, 1% streptococco a penna, 0,2% profilassi micoplasmatica, 10 μg/mL di insulina, 10 μm di forskolina, 1 μm di desametasone, 1 μm di rosiglitazone, 20 nM 3,3′,5-Triiodo-L-tironina (T3) e 1 mg/mL ACA.
NOTA: per gli h-MVF, modificare la concentrazione di T3 a 120 nM. - Mantenimento BAM: Integrare DMEM/F12 con 20% FBS, 1% di streptococco a penna, 0,2% di profilassi micoplasma, 5 μg/ml di insulina, 10 μm di forskolina, 1 μm di rosiglitazone, 20 nM T3 e 1 mg/mL di ACA.
NOTA: Per gli h-MVF, modificare la concentrazione di insulina a 10 μg/ml e la concentrazione di T3 a 120 nM.
- Induzione BAM: Supplemento DMEM/F12 con 20% FBS, 1% streptococco a penna, 0,2% profilassi micoplasmatica, 10 μg/mL di insulina, 10 μm di forskolina, 1 μm di desametasone, 1 μm di rosiglitazone, 20 nM 3,3′,5-Triiodo-L-tironina (T3) e 1 mg/mL ACA.
- Preparare la trombina (deve essere prodotta solo se la soluzione madre aliquotata non è disponibile) per produrre l'agente coagulante da utilizzare nei gel di fibrina.
- 10 U/mL trombina in ddH2O:
- Risospendere la polvere di trombina utilizzando 1-5 mL di ddH2O nel flaconcino del produttore e trasferire la risospensione in un becher da 250 ml.
- Portare la soluzione a 100 ml e pipettare la soluzione su e giù numerose volte per garantire una miscela omogenea. Aliquot la soluzione in provette coniche da 15 mL (~10 mL/tubo) e conservare le aliquote in un congelatore a -20 °C.
NOTA: Per l'uso, scongelare la trombina a temperatura ambiente (RT).
- 10 U/mL trombina in ddH2O:
2. Preparazione di utensili/materiali
NOTA: Tutta la strumentazione deve essere sterilizzata in autoclave prima dell'uso.
- Isolamento del grasso epididimo/inguinale/sottocutaneo (intervento chirurgico da eseguire in un'area chirurgica definita)
- Garantire la disponibilità di sottocuscinetti monouso, due forbici, un emostatico (opzionale), due pinze e quattro tubi conici da 50 ml con 10-15 ml di 1 mg/mL BSA (0,1%) in PBS.
- Isolamento di frammenti microvascolari
- Per la tritatura (da eseguire in una biocappa), assicurarsi della disponibilità di tre piastre di Petri sterili da 100 mm non rivestite, un paio di pinze e un paio di forbici curve.
- Per la digestione e l'isolamento (da eseguire in una biocappa), assicurarsi della disponibilità di un paio di forbici, un paio di pinze, otto piastre di Petri sterili da 100 mm non rivestite, tre piastre di Petri sterili da 35 mm non rivestite, collagenasi pesata e a 4 °C, quattro palloni da 250 ml, un supporto di plastica con un foro al centro, quattro schermi da 500 μM (tagliati in 3 in quadrati arrotondati), quattro schermi da 37 μM (tagliati in 3 in quadrati arrotondati) e 11 tubi conici da 50 ml.
- Risospensione della fibrina
- Per gli idrogel di fibrina (da fare in una biocappa), assicurarsi che fibrinogeno, trombina e mezzi di crescita (prodotti durante la preparazione del reagente) siano disponibili.
3. Protocollo di isolamento del grasso
- Fasi preliminari
- Riempire un becher con etanolo per lavare e disinfettare gli strumenti chirurgici prima di utilizzarli. Quindi, preparare il tavolo per la manipolazione del ratto e avere un aspirapolvere pronto per aspirare la pelliccia generata durante la fase di rasatura.
- Preparare un secchio con ghiaccio dove verranno posizionati i tubi conici da 50 ml precedentemente preparati, ciascuno contenente 10 ml di 1 mg/mL di BSA. Etichettare i tubi di conseguenza.
NOTA: Potrebbe essere necessario avere due tubi conici separati per il grasso inguinale, poiché è necessario estrarre due lati e la quantità di grasso raccolto da questa regione tende ad essere la più grande rispetto all'epididimo e al sottocutaneo posteriore. - Inizia con un ratto eutanasia nell'area chirurgica definita con gli strumenti chirurgici necessari. Generalmente, la CO2 viene utilizzata per eutanasia dei ratti seguendo i protocolli IACUC.
- Usando tagliacapelli, radere il ratto intorno all'area di interesse. In particolare, radersi tra l'inguine e metà dell'addome per l'isolamento del grasso epididimo e inguinale (utilizzare il rasoio più piccolo per la pelliccia in questa regione). Rasare l'intera schiena per ottenere il grasso sottocutaneo posteriore situato tra le scapole (è meglio usare un rasoio più grande poiché la pelliccia è più spessa sul retro del ratto).
- Preparare asetticamente il ratto spruzzandolo con etanolo al 70%. Generalmente, si consiglia di pulire l'area che verrà tagliata due volte.
- Isolamento di diversi depositi di grasso
- Inguinale (sottocutaneo)
- In posizione supina, sollevare la pelle sotto il pene con un paio di forbici. Inizia l'incisione con le forbici, iniziando dal centro e tagliando lateralmente, formando una forma a "V" e avvolgendo il retro del ratto per accedere all'intero deposito di grasso. Ricordati di tagliare superficialmente in modo che il grasso sottostante sia intatto. Durante la fase di taglio, assicurarsi la separazione della pelle dal grasso tagliando il tessuto della fascia interconnesso (Figura 2A).
- Una volta che la fascia è tagliata in modo appropriato, assicurarsi che i due lati del grasso inguinale siano visibili (il grasso inguinale si estende dalla zona inguinale verso la parte posteriore). Quindi, rimuovere il grasso dai due lati in due tubi conici separati contenenti 10 ml di 1 mg/mL di BSA (Figura 2B).
- Epididimo (viscerale)
- Raccogliere il grasso dell'epididimo tagliando attraverso la pelle addominale e con attenzione attraverso lo strato sottile che circonda i testicoli (Figura 2C).
- Con una pinza, estrarre delicatamente il tessuto adiposo e ritagliarlo usando le forbici. Evitare di sezionare i principali vasi sanguigni visibili (se il testicolo e l'epididimo vengono raccolti, rimuoverli durante la fase di pulizia nella biocappa).
- Posizionare con cautela il grasso rimosso in un tubo conico da 50 mL con 10 mL di 1 mg/mL BSA in PBS.
NOTA: La rimozione del grasso dell'epididimo deve essere effettuata dopo che il grasso inguinale è stato rimosso. Il grasso dell'epididimo è generalmente di volume più piccolo e si trova sotto il grasso inguinale, sotto la pelle addominale che circonda il testicolo e l'epididimo.
- Sottocutaneo posteriore
- Girare il ratto prono (lato dorsale verso l'alto) e, usando grandi forbici, tagliare la pelle della schiena (la pelle in questa regione è spessa) fino al cuoio capelluto, facendo attenzione a non tagliare troppo in profondità, appena sotto la pelle (Figura 2D).
- Tagliare la fascia che collega la pelle al tessuto; Il grasso si trova nella regione interscapolare. Prendi nota per differenziare / separare il grasso sottocutaneo dal grasso bruno. Il grasso bruno è più vicino alla colonna vertebrale (Figura 2E).
- Isolare e posizionare il grasso nei corrispondenti tubi conici da 50 mL con 10 mL di 1 mg/mL di BSA in PBS.
- Inguinale (sottocutaneo)
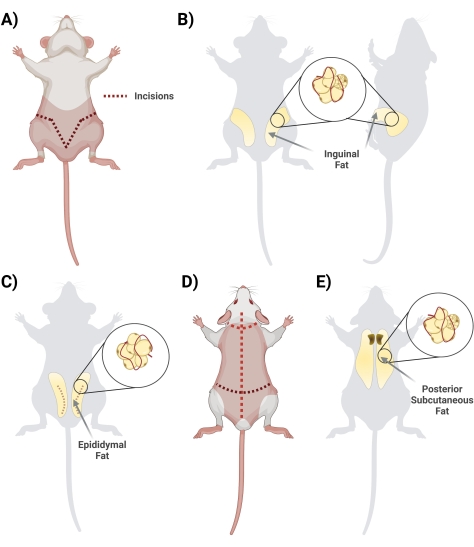
Figura 2: Isolamento di diversi depositi di tessuto adiposo. (A) Incisioni iniziali necessarie per l'escissione del tessuto adiposo inguinale. B) Ubicazione del deposito di grasso inguinale. (C) Posizione del deposito di grasso epididimale, notando l'incisione della pelle esterna necessaria per l'accesso. (D) Ulteriori incisioni necessarie una volta che i topi sono inclini ad accedere al grasso aggiuntivo. (E) Posizione del deposito adiposo sottocutaneo posteriore. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Protocollo di isolamento del frammento microvascolare
- Introdurre 50 mL di tubici, conici, contenenti grasso asportato dal ratto nella biocappa.
- Usando una pinza, posizionare il grasso in una capsula di Petri standard da 100 mm (con ~ 0,5 ml di 1 mg / mL BSA in PBS per mantenere il tessuto idratato).
- Pulire e rimuovere eventuali vasi sanguigni visibili e muscoli / tessuto estraneo dal grasso.
- Tritare il grasso con le forbici per ~ 10 minuti (tritare abbastanza da poter essere trasferito con un pipet da 10 ml).
- Verificare la presenza di grumi aggiungendo ~ 0,5 ml di 1 mg / mL BSA in PBS; Continuare a tritare se necessario.
- Trasferire il grasso tritato in un matraccio sterile da 250 ml con un pipetta da 10 ml.
NOTA: annotare il volume utilizzando un pipet. - Aggiungere una quantità sufficiente di BSA (1 mg/ml) in modo che il volume finale sia di 20 ml.
- Aggiungere 4 mg/mL di BSA in PBS alla collagenasi (concentrazione finale di collagenasi: 6 mg/ml) (cioè 12 ml per i 72 mg di collagenasi o 24 ml per i 144 mg di collagenasi).
NOTA: non aggiungere fino al completamento della tritatura in quanto è sensibile al fattore tempo. - Agitare delicatamente il tubo conico per garantire una soluzione omogenea e il filtro sterilizzare la soluzione con un filtro a rete di nylon da 0,22 μm.
- Per il grasso dell'epididimo, digerire per ~ 8-10 min; per il grasso sottocutaneo inguinale e posteriore, digerire per ~15-20 minuti a bagnomaria a 37 °C, agitando il matraccio con movimenti circolari (fermarsi nel momento in cui il grasso arriva dove rimangono solo pochi grumi).
- Trasferire il grasso digerito in un tubo conico da 50 ml (dovrebbero esserci ~ 30 ml / tubo) ed etichettare il tubo come "grasso digerito".
- Ruotare il tubo a 400 x g per 4 minuti; dopo la filatura, il pellet deve essere rosso (Figura 3A).
- Durante la rotazione, posizionare lo schermo sterile da 37 μM e gli schermi da 500 μM in una capsula di Petri sterile con 5 ml di 1 mg/mL di BSA in PBS per immergere prima dell'uso.
- Dopo la centrifuga, decantare il surnatante in un tubo conico da 50 mL etichettato come "rifiuto". Eseguire la decantazione delicatamente per rimuovere il grasso superficiale e non disturbare il pellet fatto di MVF.
- Aggiungere 10 ml di 1 mg/mL di BSA in PBS al tubo contenente il pellet ("grasso digerito"). Triturare (pipetta su e giù) il pellet 2x.
- Evitare di essere troppo ruvidi sul pellet per non disturbare i frammenti.
- Posizionare lo schermo da 500 μM in una nuova capsula di Petri sopra il supporto dello schermo in plastica (Figura 3B).
- Pipet 10 mL dal tubo "pellet digerito" su uno schermo da 500 μM utilizzando cerchi concentrici (Figura 3C).
- Lavare il filtro con altri 5 ml di 1 mg/mL di BSA in PBS. Le cellule desiderate filtreranno attraverso la capsula di Petri; pertanto, scartare lo schermo da 500 μM ma salvare il liquido filtrato all'interno della capsula di Petri.
- Posizionare lo schermo da 37 μM in una nuova capsula di Petri sopra il supporto dello schermo in plastica.
- Sostituire il pipettuccio per eliminare eventuali grumi prima di utilizzare lo schermo da 37 μM.
- Pipet il liquido ottenuto dalla prima filtrazione sullo schermo da 37 μM utilizzando cerchi concentrici.
- Lavare il filtro con altri 5 ml di 1 mg/mL di BSA in PBS. Le celle desiderate rimarranno nel filtro, quindi scarteranno il liquido filtrato, ma salveranno lo schermo da 37 μM.
- Far scorrere lo schermo da 37 μM in una nuova capsula di Petri contenente 5 mL di 1 mg/mL di BSA in PBS.
- Agitare il piatto picchiettandolo contro un supporto conico per rimuovere i frammenti. Non agitare troppo vigorosamente, poiché il liquido / le cellule potrebbero fuoriuscire dalla capsula di Petri.
- Risciacquare il filtro con altri 5 ml di 1 mg/mL di BSA in PBS. Le cellule desiderate rimarranno in soluzione liquida nella capsula di Petri. Conservare lo schermo da 37 μM e il frammento rimosso contenente liquido all'interno della capsula di Petri per i seguenti passaggi.
- Trasferire il frammento contenente BSA+ contenente liquido in un tubo conico sterile da 50 ml.
- Ripetere il risciacquo dello schermo da 37 μM più volte (ogni volta con ~5 mL di 1 mg/mL BSA in PBS) e aggiungere al tubo conico. Ripetere fino a quando il volume totale raccolto è ~ 15-20 ml. In definitiva, le cellule desiderate saranno raccolte dalla soluzione liquida nella capsula di Petri e poste in un tubo conico; a questo punto, scartare lo schermo da 37 μM dopo il risciacquo finale ma conservare i frammenti spostati contenenti liquido all'interno del tubo conico da 50 ml.
- Ritagliare l'estremità di una punta di pipetta da 200 μL usando le forbici. Agitare delicatamente il tubo da 50 ml, rimuovere due campioni da 20 μL e metterli in una capsula di Petri pulita da 35 mm.
- Contare il numero di frammenti in ciascun campione nella capsula di Petri per ottenere il numero totale di MVF isolati.
Totale frammenti =
- Ruotare il frammento rimanente spostato contenente liquido in un tubo conico da 50 mL a 400 x g per 4 minuti per raccogliere l'MVF.
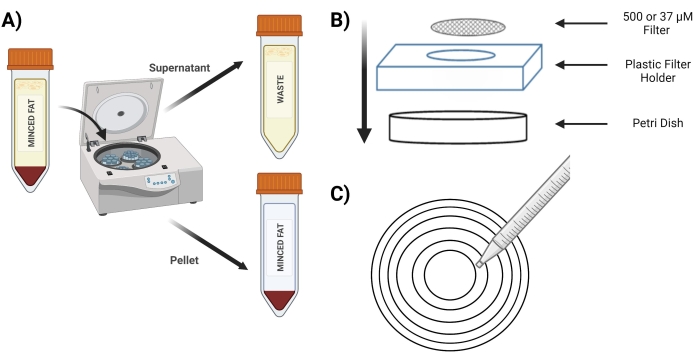
Figura 3: Isolamento degli MVF . (A) Dopo la digestione del tessuto adiposo, rappresentazione della separazione di MVF contenenti pellet e surnatante a seguito di uno spin-down. (B) Disposizione delle forniture per la filtrazione e l'intrappolamento degli MVF. (C) Illustrazione del metodo del cerchio concentrico per le fasi di filtrazione/lavaggio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Formazione di idrogel di fibrina
- Esempi di calcoli:
NOTA: Di seguito sono riportati i calcoli per MVF seminati a ~ 15.000-20.000 MVF / ml e il rapporto fibrinogeno: gel trombinico a 2: 5, con fibrinogeno utilizzato a una concentrazione di 20 mg / ml.- Per la produzione di cinque gel da 250 μL, è necessario un volume totale di 1.250 μL. Tenere sempre conto degli errori di pipettaggio, quindi, fare abbastanza per 1,5 ml di gel.
- Calcolare il volume di fibrinogeno richiesto come segue:
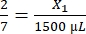 , X1 = 428,57 μL di fibrinogeno
, X1 = 428,57 μL di fibrinogeno - Calcolare il volume di trombina richiesto come segue:
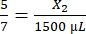 , X2 = 1.071,43 μL di trombina
, X2 = 1.071,43 μL di trombina - Per il volume richiesto di 428,57 μL, produrre 500 μL di fibrinogeno come segue:
20 mg / ml * 0,5 ml = 10 mg di fibrinogeno. Risospenderlo in 500 μL di DMEM - Per ottenere ogni gel, calcolare il volume di fibrinogeno e trombina come segue:
- Fibrinogeno:
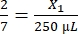 , X1 = 71,43 μL di fibrinogeno (in DMEM) + MVF
, X1 = 71,43 μL di fibrinogeno (in DMEM) + MVF - Trombina:
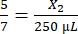 , X2 = 178,57 μL di trombina
, X2 = 178,57 μL di trombina
- Fibrinogeno:
- Calcolare il volume di fibrinogeno richiesto come segue:
- Per la produzione di cinque gel da 250 μL, è necessario un volume totale di 1.250 μL. Tenere sempre conto degli errori di pipettaggio, quindi, fare abbastanza per 1,5 ml di gel.
- Fusione in gel di fibrina MVF
- Decantare la maggior parte del liquido nel frammento filato verso il basso nel tubo conico da 50 ml. Utilizzare una pipetta per rimuovere il piccolo volume di liquido che si blocca sul bordo del tubo conico.
- Aggiungere trombina nei pozzetti dove verranno prodotti i gel (Figura 4A).
- Tagliare l'estremità di una punta di pipetta da 200 μL e risospendere delicatamente gli MVF usando il fibrinogeno per ottenere una densità finale di ~ 15.000-20.000 MVF / mL una volta nel gel.
- Agganciare delicatamente l'estremità di una punta di pipetta da 200 μL e del pipet MVF+Fibrinogeno nella soluzione di trombina. Pipe rapidamente su e giù per garantire una miscela omogenea. Ripetere l'operazione fino a quando tutti i gel sono fatti (Figura 4B).
- Posizionare le piastre del pozzetto in un'incubatrice (37 °C, 5% CO2) per ~ 15 minuti per consentire la reticolazione del gel (Figura 4C).
- Aggiungere 100-150 μL di terreno di coltura a ciascun pozzetto.
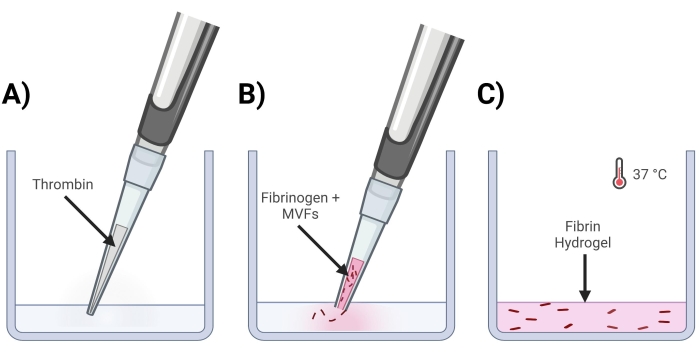
Figura 4: Formazione di gel di fibrina MVF . (A) Una miscela di trombina in 5/7 parti viene pipettata nel pozzetto corrispondente. (B) Successivamente, con una punta di pipetta tagliata (per non disturbare gli MVF), una miscela di fibrinogeno + MVF in 2/7 parti viene pipettata nel pozzetto e delicatamente miscelata. (C) Infine, tutti i gel completati vengono inseriti in un incubatore a 37 °C, consentendo all'idrogel di solidificarsi completamente prima che il mezzo sia posizionato sopra. Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Condizioni di coltura degli MVF
- Per la coltura di tessuto adiposo bianco e beige non vascolarizzato (+ GM Control), utilizzare le tempistiche19 mostrate nella Figura 5.
- Per la coltura di tessuto adiposo vascolarizzato bianco e beige (+ GM Control), utilizzare le tempistiche19 mostrate nella Figura 6.
- Gli idrogel devono essere conservati in un incubatore (37 °C, 5% CO2) per tutta la durata della coltura per lo studio, con il cambio dei terreni a giorni alterni. Per la fissazione e la manipolazione dei campioni per l'analisi, fare riferimento ai lavori pubblicati in precedenza16,19,20.
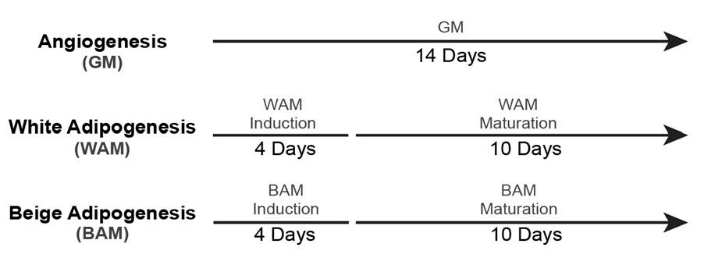
Figura 5: Tempistica per la formazione di tessuto adiposo non vascolarizzato. Questa cifra è stata modificata da Acosta et al.19. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Tempistica per la formazione del tessuto adiposo vascolarizzato. Questa cifra è stata modificata da Acosta et al.19. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Ci sono alcune caratteristiche morfologiche fenotipiche chiave del tessuto adiposo beige / marrone: è multiloculare / contiene piccole goccioline lipidiche, possiede un gran numero di mitocondri (la ragione del suo aspetto tipicamente "brunastro" in vivo), ha corrispondentemente un alto tasso di consumo di ossigeno / bioenergetica mitocondriale, è altamente vascolarizzato, ha aumentato la lipolisi / assorbimento di glucosio stimolato dall'insulina e, più notoriamente, esprime alti livelli di proteina disaccoppiante 1 (UCP1), una proteina mitocondriale coinvolta nella respirazione termogenica19,30.
Di conseguenza, nel caratterizzare la capacità degli MVF di differenziarsi in tessuto adiposo beige, è stata condotta un'analisi che ci avrebbe permesso di visualizzare (Figura 7, Figura 8), confermare geneticamente (Figura 9, Figura 10) e misurare funzionalmente (Figura 11) la trasformazione dell'MVF.
Nella Figura 7 e nella Figura 8, attraverso l'uso di BODIPY, una colorazione lipidica, e l'imaging degli idrogel utilizzando la microscopia confocale, la visualizzazione del dimensionamento e della posizione dei lipidi negli adipociti differenziati è stata osservata16,17,19. In particolare, in questa analisi, specialmente nel confronto tra condizioni, i gruppi BAM dovrebbero mostrare dimensioni lipidiche più piccole (indicative della formazione di tessuto adiposo beige), quantificabili attraverso NIH ImageJ19,20.
Utilizzando RT-qPCR 16,19,20, in Figura 9 e Figura 10, più distintamente, l'espressione di UCP1 è, su tutta la linea, aumentata significativamente dopo l'esposizione MVF al BAM.
Infine, osservando la bioenergetica mitocondriale (Figura 11), è evidente che i gruppi BAM hanno livelli di consumo di ossigeno (OCR) tipicamente più elevati, misurati utilizzando uno stress test di mito Seahorse19,20.
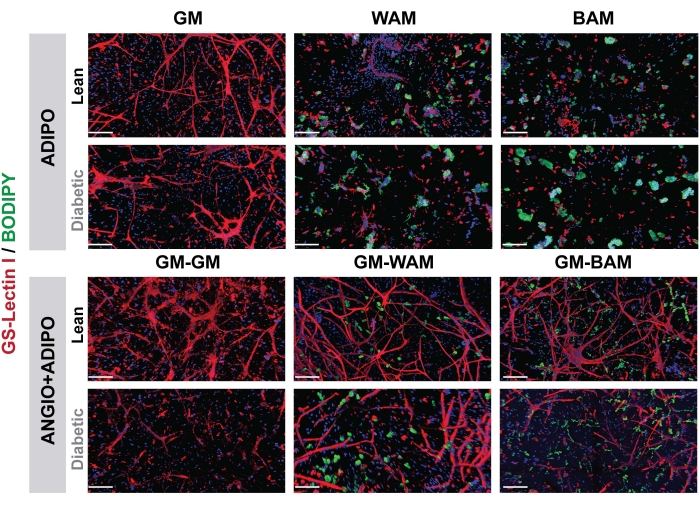
Figura 7: Valutazione istologica r-MVF. Gli r-MVF di derivazione diabetica magra o di tipo 2 sono stati esposti a WAM o BAM diretti (pannello superiore, ADIPO) o indiretti (pannello inferiore, ANGIO + ADIPO) per ottenere rispettivamente tessuto adiposo bianco o beige non vascolarizzato o vascolarizzato (barre di scala = 200 μm). Questa cifra è stata modificata da Acosta et al.19. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 8: valutazione istologica h-MVF. h-MVF è stato esposto a WAM o BAM diretto (ADIPO) per ottenere rispettivamente tessuto adiposo bianco o beige non vascolarizzato (barre di scala = 200 μm). Questa cifra è stata modificata da Gonzalez Porras et al.20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
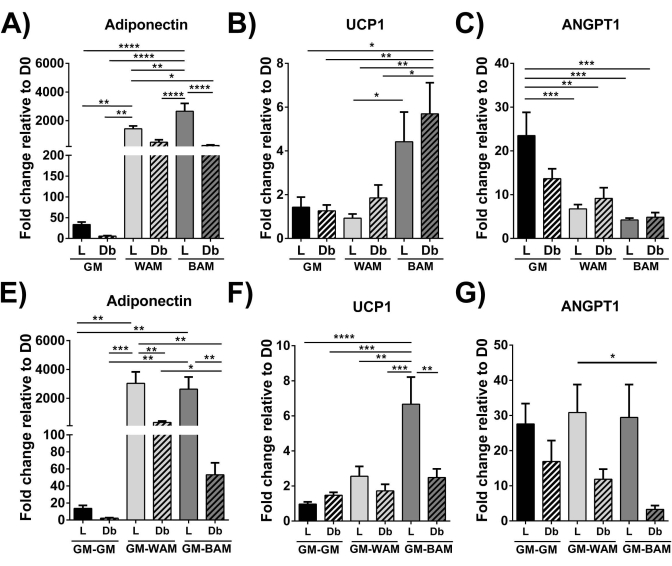
Figura 9: Valutazione r-MVF tramite RT-qPCR. Sono stati valutati r-MVF derivati da diabetici magri (L) o di tipo 2 (Db) esposti a WAM o BAM diretti (A-C) diretti o (E-G) indiretti per (A,E) adipogenesi (Adiponectina), (B,F) termogenesi (UCP1) e (C,G) angiogenesi (ANGPT1). I risultati sono riportati come errore medio ± standard di due repliche sperimentali (n = 4). * = p < 0,05, ** = p < 0,01, *** = p < 0,001 e **** = p < 0,0001. D0 = Giorno 0. Analisi bidirezionale della varianza (ANOVA) con analisi di confronto multiplo di Holm-Sidak per determinare le differenze tra i gruppi. La significatività statistica è stata definita come p < 0,05. Questa cifra è stata modificata da Acosta et al.19. Fare clic qui per visualizzare una versione ingrandita di questa figura.
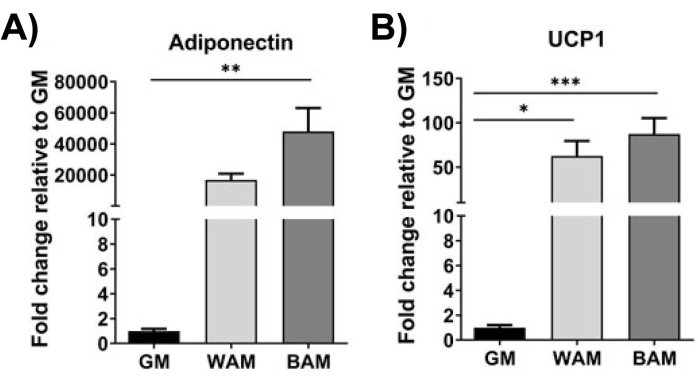
Figura 10: Valutazione h-MVF tramite RT-qPCR. Gli h-MVF esposti a WAM o BAM diretti sono stati valutati per (A) adipogenesi (Adiponectina) e (B) termogenesi (UCP1). I risultati sono riportati come errore medio ± standard di due repliche sperimentali (n = 4). * = p < 0,05, ** = p < 0,01, *** = p < 0,001 e **** = p < 0,0001. Test di analisi unidirezionale della varianza (ANOVA) con analisi di confronto multiplo di Holm-Sidak per determinare le differenze tra i gruppi. La significatività statistica è stata definita come p < 0,05. Questa cifra è stata modificata da Gonzalez Porras et al.20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
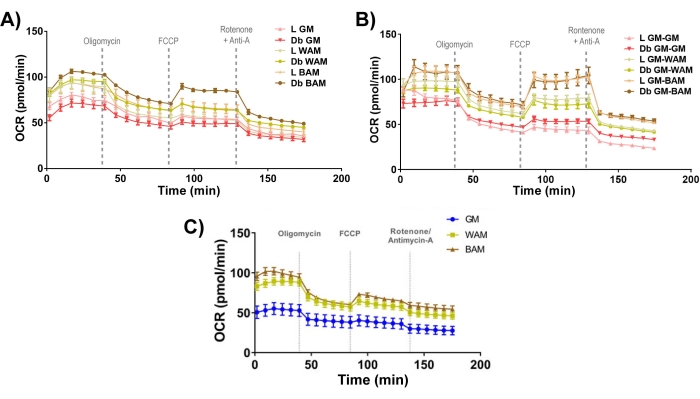
Figura 11: Valutazione funzionale di r-MVF e h-MVF. Gli r-MVF derivati da diabetici magri (L) o di tipo 2 (Db) esposti a WAM o BAM diretti (A) diretti o (B) indiretti o (C) h-MVF esposti a WAM o BAM diretti sono stati valutati funzionalmente attraverso la misurazione del tasso di consumo di ossigeno (OCR). I risultati sono riportati come errore medio ± standard di due repliche sperimentali (n = 4). Questa cifra è stata modificata da Acosta et al.19. e Gonzalez Porras et al.20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Il campo dell'ingegneria del tessuto adiposo marrone / beige è in gran parte immaturo 22,23,24,25,26,27,28, con la maggior parte dei modelli adiposi sviluppati per il tessuto adiposo bianco 8,22,31. I microtessuti marrone/beige ingegnerizzati consistono tipicamente in più fonti cellulari o alterazioni genetiche per ottenere un sottoinsieme delle caratteristiche fenotipiche del tessuto adiposo bruno nativo 8,11,32. L'approccio qui descritto presenta un modo18,33 a fonte singola, potenzialmente autologo, di creare grasso beige funzionale, strutturalmente rilevante e vascolarizzato utilizzando frammenti microvascolari (MVF). Gli MVF sono noti in particolare come fonte di formazione di tessuto adiposo bianco 14,16,17,1 8,34, anche se abbiamo recentemente dimostrato la loro capacità di formazione di grasso beige derivante da fonti roditrici, umane e malate, come mostrato qui 19,20. Dato il notevole interesse nell'utilizzo del grasso beige / marrone per il suo potenziale terapeutico o di modellazione della malattia, questa tecnica ha applicazioni inverosimili nei campi del metabolismo, dell'obesità e dei disturbi correlati.
Ci sono diversi punti chiave descritti nel protocollo. In primo luogo, ci sono differenze tra l'utilizzo di MVF di ratto rispetto a quello umano. L'uso di roditori derivati (sia da topi 29 che ratti) ha, finora, ampiamente dominato la ricerca con MVF, con il lavoro che li ha esaminati in una moltitudine di condizioni come obesità35, diabete di tipo 136,37, diabete di tipo 2 19 e invecchiamento38, e persino differenze tra depositi adiposi 39 o genere40. Sebbene gli MVF, data la loro origine, possano essere isolati autologamente dai depositi adiposi sottocutanei degli adulti utilizzando procedure standard minimamente invasive41, la vascolarizzazione basata su MVF non è stata eseguita nella pratica clinica. Tuttavia, studi preclinici in cui MVF umani sono stati raccolti da lipoaspirato hanno dimostrato la sua possibilità18,33. Per il nostro gruppo in particolare, come mostrato nei dati rappresentativi, la formazione di tessuto adiposo beige vascolarizzato è attualmente limitata agli MVF derivati dai roditori. Come precedentemente dimostrato dal nostro gruppo e da altri18, ottenere l'equilibrio tra crescita dei vasi e differenziazione degli adipociti è altamente sensibile, dimostrato che dipende dai fattori introdotti42, e la differenziazione dei punti temporali è provocata16. Una limitazione del protocollo descritto è che è necessario un ulteriore sviluppo per ottimizzare le condizioni favorevoli alla formazione di tessuto adiposo beige h-MVF vascolarizzato. Inoltre, sono necessari ulteriori lavori che esaminino la risposta di questi scaffold in vivo e derivanti da altri stati patologici, insieme alle relative fasi di ottimizzazione.
Inoltre, qui è descritto un protocollo per l'isolamento di r-MVF da tre diversi depositi di tessuto adiposo in ratti maschi. Precedenti lavori di Später et al.39 hanno discusso le differenze tra la capacità di vascolarizzazione degli MVF viscerali rispetto a quelli derivati dal deposito sottocutaneo, osservando che gli MVF di deposito sottocutaneo avevano una ridotta capacità di vascolarizzazione, una caratteristica che attribuivano all'eccesso di contaminazione del tessuto connettivo. Va notato che, per i nostri studi, come presentato qui nei "dati rappresentativi", sono stati utilizzati solo i depositi sottocutanei inguinali e sottocutanei posteriori. La scelta di utilizzare esclusivamente MVF di derivazione sottocutanea è stata fatta per imitare più da vicino gli studi traslazionali in cui il lipoaspirato, o procedure simili, raccolgono esclusivamente tessuto adiposo sottocutaneo. Inoltre, il fatto che studi in vivo che individuano il tessuto adiposo beige siano in fase di sviluppo all'interno del tessuto adiposo sottocutaneo, che contiene un sottoinsieme distinto di preadipociti o adipociti bianchi che si differenziano, ha fornito un ulteriore razionale per la nostra decisione43. Il lavoro precedente del nostro gruppo non ha mostrato differenze discernibili tra gli MVF provenienti da depositi viscerali o sottocutanei di roditori sani per subire sia l'angiogenesi che la formazione di tessuto adiposo bianco16. Tutte queste variabili dovrebbero essere considerate quando si progettano studi futuri.
Infine, quando si tenta di modificare o risolvere i problemi del metodo descritto, è necessario deliberare alcuni punti essenziali. In primo luogo, la fase di digestione enzimatica del tessuto adiposo è estremamente importante; è necessario prestare particolare attenzione e garantire l'ottimizzazione per riprodurre in modo coerente MVF di dimensioni e qualità simili. Data la grande variazione tra tipi di grassi e volumi di grasso (fortemente dipendenti dall'età, dalle dimensioni, dalla salute e dalla cura degli animali al momento dell'isolamento del grasso [evitare contaminanti ed efficienza di estrazione]), il tempo di digestione può variare, quindi vengono forniti intervalli che meglio si adattano alle nostre attrezzature / animali. Tuttavia, la personalizzazione dovrebbe essere considerata per ottenere risultati ottimali. Inoltre, quando si maneggia l'MVF, durante la digestione post-enzimatica, è necessario prestare particolare attenzione per evitare rugosità non necessarie e ulteriori frammenti di rottura. Infine, si dovrebbe essere consapevoli del fatto che le formulazioni dei media, l'idrogel di scelta44 e le condizioni di coltura sono altamente personalizzabili in base ai risultati previsti. Come mostrato qui, gli MVF derivati da fonti diverse (ad esempio, MVF magri rispetto a quelli diabetici) hanno diversi gradi di differenziazione, quindi quando si progettano esperimenti, dovrebbero essere inclusi controlli adeguati e gruppi sperimentali.
In conclusione, man mano che il campo dell'ingegneria del tessuto adiposo termogenico cresce, è fondamentale costruire sistemi biologicamente rilevanti che imitino strutturalmente, geneticamente e funzionalmente il tessuto adiposo nativo beige / marrone. Gli MVF presentano un approccio entusiasmante e unico a questa sfida, in quanto, come descritto qui, forniscono un semplice metodo di origine unica per creare imitazioni biologiche del grasso beige. Pertanto, hanno un potenziale significativo per l'utilizzo della comprensione o dello sviluppo di trattamenti per l'obesità e le malattie metaboliche.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Il Dr. Acosta è supportato dalle sovvenzioni del National Institutes of Health CA148724 e TL1TR002647. Il Dr. Gonzalez Porras è supportato dal National Institute of Diabetes and Digestive and Kidney Diseases del National Institutes of Health, con il numero di premio F32-0DK122754. Questo lavoro è stato supportato, in parte, dal National Institutes of Health (5SC1DK122578) e dall'Università del Texas presso il Dipartimento di Ingegneria Biomedica di San Antonio. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente il punto di vista ufficiale del National Institutes of Health. Le figure sono state parzialmente create con Biorender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
Riferimenti
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon