Method Article
Cultivo tridimensional de tejido adiposo termogénico vascularizado a partir de fragmentos microvasculares
En este artículo
Resumen
Aquí, presentamos un protocolo detallado que describe el uso de fragmentos microvasculares aislados de tejido graso humano o de roedores como un enfoque directo para diseñar tejido adiposo beige vascularizado funcional.
Resumen
La ingeniería de tejido adiposo termogénico (por ejemplo, tejidos adiposos beige o marrones) se ha investigado como una terapia potencial para enfermedades metabólicas o para el diseño de microtejidos personalizados para la detección de la salud y las pruebas de drogas. Las estrategias actuales son a menudo bastante complejas y no logran representar con precisión las propiedades multicelulares y funcionales del tejido adiposo termogénico. Los fragmentos microvasculares, pequeños microvasos intactos compuestos por arteriolas, vénulas y capilares aislados del tejido adiposo, sirven como una única fuente autóloga de células que permiten la vascularización y la formación de tejido adiposo. Este artículo describe métodos para optimizar las condiciones de cultivo para permitir la generación de tejidos adiposos termogénicos tridimensionales, vascularizados y funcionales a partir de fragmentos microvasculares, incluidos los protocolos para aislar fragmentos microvasculares del tejido adiposo y las condiciones de cultivo. Además, se discuten las mejores prácticas, al igual que las técnicas para caracterizar los tejidos diseñados, y se proporcionan resultados de muestras de fragmentos microvasculares humanos y de roedores. Este enfoque tiene el potencial de ser utilizado para la comprensión y el desarrollo de tratamientos para la obesidad y las enfermedades metabólicas.
Introducción
El objetivo de este protocolo es describir un enfoque para desarrollar tejido adiposo beige vascularizado a partir de una sola fuente potencialmente autóloga, fragmento microvascular (MVF). Se ha demostrado que los tejidos adiposos marrones y beige muestran propiedades beneficiosas relacionadas con la regulación metabólica; Sin embargo, el pequeño volumen de estos depósitos de tejido adiposo en adultos limita el impacto potencial sobre el metabolismo sistémico, particularmente en condiciones enfermas como la obesidad o la diabetes tipo 2 1,2,3,4,5,6,7. Existe un interés significativo en la grasa marrón/beige como diana terapéutica para prevenir los efectos metabólicos nocivos relacionados con la obesidad y sus comorbilidades 8,9,10,11,12.
Los MVF son estructuras de vasos que pueden aislarse directamente del tejido adiposo, cultivarse y mantenerse en una configuración tridimensional durante largos períodos de tiempo13,14,15. Trabajos previos de nuestro grupo, y otros, han comenzado a explotar la capacidad multicelular y multipotente de los MVF, específicamente en lo que se refiere a la formación de tejido adiposo16,17,18. Como preparación de este trabajo, recientemente demostramos que los MVF derivados de modelos de roedores de diabetes sana y tipo 219 y de sujetos humanos (adultos mayores de 50 años)20 contenían células capaces de ser inducidas a formar tejido adiposo termogénico o beige.
Aquí se trata de un enfoque innovador a partir del cual se utiliza una MVF de una sola fuente, no sólo capaz de crear tejido adiposo beige sino también su componente vascular asociado y crítico21. El uso de esta técnica podría ser de gran valor para los estudios que buscan un enfoque directo de ingeniería tisular para la formación de tejido adiposo termogénico. A diferencia de otros métodos que aspiran a diseñar tejido adiposo beige 22,23,24,25,26,27,28, el proceso descrito en este estudio no requiere el uso de múltiples tipos de células o regímenes de inducción complejos. Se pueden crear modelos vascularizados de color beige y grasa blanca con MVF procedentes de roedores y fuentes humanas, lo que demuestra un gran potencial de traducción. El producto final de este protocolo es un tejido graso termogénico beige diseñado con una estructura y función metabólica comparable al tejido adiposo marrón. En general, este protocolo presenta la idea de que una MVF de fuente fácilmente accesible y posiblemente autóloga puede ser una intervención terapéutica y una herramienta que vale la pena para estudiar los trastornos metabólicos.
Protocolo
Este estudio se realizó de conformidad con la Ley de Bienestar Animal y el Reglamento de Bienestar Animal de Implementación de acuerdo con los principios de la Guía para el Cuidado y Uso de Animales de Laboratorio. Todos los procedimientos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Texas en San Antonio.
NOTA: Para los pasos descritos a continuación, se utilizan ratas Lewis macho. Se deben realizar ligeros ajustes de protocolo para una hembra, así como para la colección de fragmentos microvasculares de ratón (MFV)29. Para los protocolos que utilizan MVF humanos (h-MVF), los únicos pasos necesarios son la resuspensión de h-MVF siguiendo el protocolo del fabricante, la preparación de medios de crecimiento (1.3), la formación de hidrogeles de fibrina (5) y el cultivo (6). Para obtener una descripción general del protocolo, consulte la figura 1.

Figura 1: Esquema experimental. Desglose de seis pasos clave, antes del análisis, para la formación de tejido adiposo termogénico mediante MFM. Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación del reactivo
NOTA: Los reactivos a continuación corresponden a una rata, pesada y fabricada dentro de una biohood.
- Preparar la albúmina sérica bovina (BSA) en PBS.
- Preparar 10 mg/ml (1,0%) de BSA en PBS para diluir para las etapas de lavado (1 mg/ml, 0,1%) y digestión (4 mg/ml, 0,4%).
- Preparar diferentes concentraciones de BSA, como se menciona en el paso 1.1.1, siguiendo los pasos 1.1.3-1.1.5.
- 10 mg/ml de BSA en PBS (BSA al 1% en PBS)
- Agregue 500 mg de BSA y 500 ml de PBS a un tubo cónico de 50 ml y vortex la solución para disolver el BSA.
- Si se forman burbujas excesivas, centrifugar la solución a 350 x g durante 2 min. Esterilice la solución con un filtro de red de nylon de 0,22 μm.
- 1 mg/ml de BSA en PBS (0.1% BSA en PBS)
- Diluya 15 ml de 10 mg/ml de BSA en PBS 1:10 con PBS agregando 15 ml de 10 mg/ml de BSA en PBS a 135 ml de PBS en un frasco estéril de 500 ml y agite suavemente el frasco para asegurar una mezcla homogénea.
- 4 mg/ml de BSA en PBS (0.4% BSA en PBS)
- Diluir 35 ml de 10 mg/ml de BSA en PBS 1:2.5 con PBS agregando 35 ml de 10 mg/ml de BSA en PBS + 57,5 ml de PBS en un frasco estéril de 100 ml y agitar suavemente el frasco para asegurar una mezcla homogénea.
- Preparar colagenasa en BSA para la digestión de almohadillas de grasa picada.
- Prepare 6 mg/ml de colagenasa.
- En un tubo cónico de 50 ml, pesar 72 mg de colagenasa (etiqueta "para Epi").
- En tres tubos cónicos de 50 ml, pesar 144 mg de colagenasa (etiqueta "para Ing 1", "para Ing 2" y "para SubQ") cada uno.
- Conservar la colagenasa pesada a 4 °C hasta su uso.
NOTA: No agregue BSA / PBS hasta justo antes de la digestión. - Añadir 12 ml de 4 mg/ml de BSA en PBS al tubo que contiene 72 mg de colagenasa.
- Agregue 24 ml de 4 mg/ml de BSA en PBS a los tubos que contienen 144 mg de colagenasa.
- Agite los tubos para asegurar una solución homogénea y filtre esterilizar la solución con un filtro de red de nylon de 0,22 μm.
- Prepare 6 mg/ml de colagenasa.
- Preparar medios de crecimiento suplementados con ácido aminocaproico (ACA) para alimentar/diferenciar el MVF aislado.
- Medios de crecimiento (GM): Suplemento DMEM con 20% FBS, 1% penicilina-estreptomicina (estreptococo pluma), 0.2% profiláctico de micoplasma, y 1 mg / ml ACA.
- Prepare medios adipogénicos blancos (WAM).
- Inducción WAM: Suplemento DMEM/F12 con 20% FBS, 1% estreptococo pluma, 0,2% profiláctico de micoplasma, 10 μg/ml insulina, 10 μm de forskolina, 1 μm de dexametasona y 1 mg/ml ACA.
NOTA: Para los h-MVF, además, añadir 125 μM de indometacina. - Mantenimiento WAM: Complemente DMEM/F12 con 20% FBS, 1% de estreptococo de pluma, 0,2% profiláctico de micoplasma, 5 μg/ml de insulina y 1 mg/ml de ACA.
NOTA: Para h-MVF, cambie la concentración de insulina a 10 μg/ml.
- Inducción WAM: Suplemento DMEM/F12 con 20% FBS, 1% estreptococo pluma, 0,2% profiláctico de micoplasma, 10 μg/ml insulina, 10 μm de forskolina, 1 μm de dexametasona y 1 mg/ml ACA.
- Preparar medios adipogénicos beige (BAM).
- Inducción de BAM: Suplemento DMEM/F12 con 20% FBS, 1% estreptococo pluma, 0,2% profiláctico de micoplasma, 10 μg/ml insulina, 10 μm de forskolina, 1 μm de dexametasona, 1 μm de rosiglitazona, 20 nM 3,3′,5-Triyodo-L-tironina (T3) y 1 mg/ml ACA.
NOTA: Para h-MVF, cambie la concentración de T3 a 120 nM. - Mantenimiento de BAM: Suplemento DMEM/F12 con 20% FBS, 1% estreptococo pluma, 0,2% profiláctico de micoplasma, 5 μg/ml insulina, 10 μm de forskolina, 1 μm de rosiglitazona, 20 nM T3 y 1 mg/ml ACA.
NOTA: Para los h-MVF, cambie la concentración de insulina a 10 μg/ml y la concentración de T3 a 120 nM.
- Inducción de BAM: Suplemento DMEM/F12 con 20% FBS, 1% estreptococo pluma, 0,2% profiláctico de micoplasma, 10 μg/ml insulina, 10 μm de forskolina, 1 μm de dexametasona, 1 μm de rosiglitazona, 20 nM 3,3′,5-Triyodo-L-tironina (T3) y 1 mg/ml ACA.
- Preparar la trombina (sólo es necesario hacerlo si la solución alicotizada madre no está disponible) para hacer el agente de coagulación que se utilizará en los geles de fibrina.
- 10 U/ml de trombina enddH2O:
- Resuspender el polvo de trombina usando 1-5 ml deddH2Oen el vial del fabricante y transferir la resuspensión a un vaso de precipitados de 250 ml.
- Elevar la solución a 100 ml y pipetear la solución hacia arriba y hacia abajo varias veces para asegurar una mezcla homogénea. Alícuota la solución en tubos cónicos de 15 ml (~10 ml/tubo) y almacenar las alícuotas en un congelador a -20 °C.
NOTA: Para usar, descongele la trombina a temperatura ambiente (RT).
- 10 U/ml de trombina enddH2O:
2. Preparación de herramientas/materiales
NOTA: Toda la instrumentación debe ser esterilizada en autoclave antes de su uso.
- Aislamiento de grasa epididimaria/inguinal/subcutánea (cirugía que se realizará en un área quirúrgica definida)
- Asegurar la disponibilidad de almohadillas desechables, dos tijeras, un hemostático (opcional), dos fórceps y cuatro tubos cónicos de 50 ml con 10-15 ml de BSA de 1 mg/ml (0,1%) en PBS.
- Aislamiento de fragmentos microvasculares
- Para el picado (que se realizará en una biocampana), asegúrese de la disponibilidad de tres placas de Petri estériles de 100 mm sin recubrimiento, un par de pinzas y un par de tijeras curvas.
- Para la digestión y el aislamiento (que se realizará en una biocapa), garantizar la disponibilidad de un par de tijeras, un par de pinzas, ocho placas de Petri estériles de 100 mm sin recubrimiento, tres placas de Petri estériles de 35 mm sin recubrir, colagenasa pesada y a 4 °C, cuatro matraces de 250 ml, un soporte de plástico con un orificio en el centro, cuatro pantallas de 500 μM (cortadas en 3 en cuadrados redondeados), cuatro cribas de 37 μM (cortadas en 3 en cuadrados redondeados) y 11 tubos cónicos de 50 ml.
- Resuspensión de fibrina
- Para los hidrogeles de fibrina (que se deben hacer en una biohood), asegúrese de que el fibrinógeno, la trombina y los medios de crecimiento (producidos durante la preparación del reactivo) estén disponibles.
3. Protocolo de aislamiento de grasa
- Pasos preliminares
- Llene un vaso de precipitados con etanol para lavar y desinfectar los instrumentos quirúrgicos antes de usarlos. A continuación, prepare la mesa para manipular a la rata y tenga un vacío listo para aspirar el pelaje generado durante el paso de afeitado.
- Prepare un cubo con hielo donde se colocarán los tubos cónicos de 50 ml previamente preparados, cada uno con 10 ml de 1 mg / ml de BSA. Etiquete los tubos en consecuencia.
NOTA: Puede ser necesario tener dos tubos cónicos separados para la grasa inguinal, ya que es necesario extraer dos lados y la cantidad de grasa recolectada de esta región tiende a ser la más grande en comparación con el epidídimo y la subcutánea posterior. - Comience con una rata sacrificada en el área quirúrgica definida con las herramientas quirúrgicas requeridas. Generalmente, elCO2 se utiliza para sacrificar a las ratas siguiendo los protocolos de IACUC.
- Usando cortapelos, afeite a la rata alrededor del área de interés. Específicamente, afeitarse entre las ingles y la mitad del abdomen para el aislamiento de la grasa epididimaria e inguinal (use la afeitadora más pequeña para el pelaje en esta región). Afeite toda la espalda para obtener la grasa subcutánea posterior ubicada entre las escápulas (es mejor usar una afeitadora más grande ya que el pelaje es más grueso en la parte posterior de la rata).
- Prepare asépticamente a la rata rociándola con etanol al 70%. Generalmente, se recomienda limpiar el área que se va a cortar dos veces.
- Aislamiento de diferentes depósitos de grasa
- Inguinal (subcutánea)
- En posición supina, levante la piel debajo del pene con unas tijeras. Comience la incisión con tijeras, comenzando en el centro y cortando lateralmente, formando una forma de "V" y enrollándose en la parte posterior de la rata para acceder a todo el depósito de grasa. Recuerde cortar superficialmente para que la grasa de abajo esté intacta. Durante el paso de corte, asegúrese de separar la piel de la grasa cortando el tejido de la fascia interconectado (Figura 2A).
- Una vez que la fascia se corta adecuadamente, asegúrese de que los dos lados de la grasa inguinal sean visibles (la grasa inguinal se extiende desde el área de la ingle hacia la espalda). A continuación, retire la grasa de los dos lados en dos tubos cónicos separados que contienen 10 ml de 1 mg / ml BSA (Figura 2B).
- Epidídimo (visceral)
- Cosechar la grasa del epidídimo cortando a través de la piel abdominal y cuidadosamente a través de la capa delgada que rodea los testículos (Figura 2C).
- Con fórceps, tire suavemente del tejido graso y córtelo con tijeras. Evite diseccionar cualquier vaso sanguíneo visible importante (si se cosechan el testículo y el epidídimo, retírelos durante el paso de limpieza en la biohood).
- Coloque cuidadosamente la grasa eliminada en un tubo cónico de 50 ml con 10 ml de 1 mg / ml de BSA en PBS.
NOTA: La eliminación de la grasa del epidídimo debe hacerse después de que se haya eliminado la grasa inguinal. La grasa del epidídimo es generalmente más pequeña en volumen y se encuentra debajo de la grasa inguinal, debajo de la piel abdominal que rodea el testículo y el epidídimo.
- Subcutánea posterior
- Gire la rata boca abajo (lado dorsal hacia arriba) y, usando tijeras grandes, corte la piel de la espalda (la piel en esta región es gruesa) hasta el cuero cabelludo, teniendo cuidado de no cortar demasiado profundo, justo debajo de la piel (Figura 2D).
- Cortar la fascia que conecta la piel con el tejido; La grasa se encuentra en la región interescapular. Haga una nota para diferenciar / separar la grasa subcutánea de la grasa marrón. La grasa marrón está más cerca de la columna vertebral (Figura 2E).
- Aísle y coloque la grasa en los tubos cónicos correspondientes de 50 ml con 10 ml de BSA de 1 mg/ml en PBS.
- Inguinal (subcutánea)
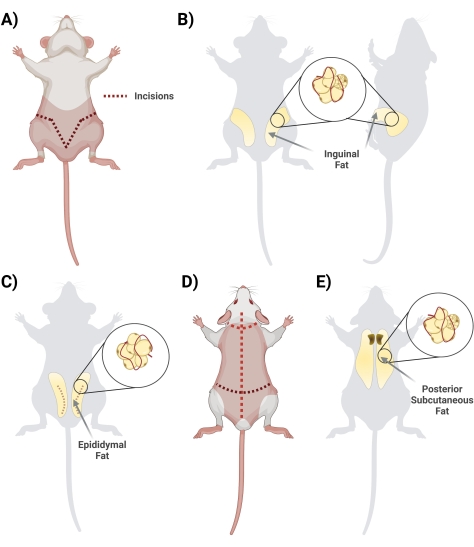
Figura 2: Aislamiento de diferentes depósitos de tejido adiposo . (A) Incisiones iniciales necesarias para la escisión del tejido adiposo inguinal. (B) Ubicación del depósito de grasa inguinal. (C) Ubicación del depósito de grasa del epidídimo, observando la incisión de la piel externa necesaria para el acceso. (D) Se necesitan incisiones adicionales una vez que los ratones se colocan propensos a acceder a grasa adicional. (E) Ubicación del depósito de grasa subcutánea posterior. Haga clic aquí para ver una versión más grande de esta figura.
4. Protocolo de aislamiento de fragmentos microvasculares
- Coloque 50 ml de tubo cónico (s) que contienen grasa extirpada de la rata en biohood.
- Usando fórceps, coloque la grasa en una placa de Petri estándar de 100 mm (con ~0.5 ml de 1 mg / ml de BSA en PBS para mantener el tejido hidratado).
- Limpie y elimine cualquier vaso sanguíneo visible y tejido muscular/extraño de la grasa.
- Picar la grasa con tijeras durante ~ 10 min (picar lo suficiente para que se pueda transferir con una pipeta de 10 ml).
- Verifique si hay grumos agregando ~ 0.5 ml de 1 mg / ml BSA en PBS; Continúe picando si es necesario.
- Transferir la grasa picada a un matraz estéril de 250 ml con una pipeta de 10 ml.
NOTA: Anote el volumen usando una pipeta. - Agregue suficiente BSA (1 mg / ml) para que el volumen final sea de 20 ml.
- Agregue 4 mg / ml de BSA en PBS a la colagenasa (concentración final de colagenasa: 6 mg / ml) (es decir, 12 ml para los 72 mg de colagenasa o 24 ml para los 144 mg de colagenasa).
NOTA: No agregue hasta que se complete el picado, ya que es sensible al tiempo. - Agite suavemente el tubo cónico para asegurar una solución homogénea y esterilice la solución con un filtro de red de nylon de 0,22 μm.
- Para la grasa del epidídimo, digiera durante ~ 8-10 min; para la grasa inguinal y subcutánea posterior, digerir durante ~ 15-20 min en un baño de agua a 37 ° C, agitando el matraz con un movimiento circular (deténgase en el momento en que la grasa llegue a donde solo quedan unos pocos grupos).
- Transfiera la grasa digerida en un tubo cónico de 50 ml (debe haber ~ 30 ml / tubo) y etiquete el tubo como "grasa digerida".
- Gire el tubo a 400 x g durante 4 min; después del centrifugado, el pellet debe ser rojo (Figura 3A).
- Durante el centrifugado, coloque la pantalla estéril de 37 μM y las pantallas de 500 μM en una placa de Petri estéril con 5 ml de BSA de 1 mg / ml en PBS para remojar antes de su uso.
- Después del centrifugado, decantar el sobrenadante en un tubo cónico de 50 ml etiquetado como "residuo". Realizar la decantación suavemente para eliminar la grasa superficial y no perturbar el pellet hecho de MVF.
- Agregue 10 ml de 1 mg/ml de BSA en PBS al tubo que contiene el pellet ("grasa digerida"). Triturar (pipetear arriba y abajo) el pellet 2x.
- Evite ser demasiado áspero con el pellet para no interrumpir los fragmentos.
- Coloque la pantalla de 500 μM en una nueva placa de Petri sobre el soporte de la pantalla de plástico (Figura 3B).
- Pipeta 10 ml del tubo "pellet digerido" sobre una pantalla de 500 μM utilizando círculos concéntricos (Figura 3C).
- Lave el filtro con 5 ml adicionales de 1 mg/ml de BSA en PBS. Las células deseadas se filtrarán a través de la placa de Petri; por lo tanto, deseche la pantalla de 500 μM pero guarde el líquido filtrado dentro de la placa de Petri.
- Coloque la pantalla de 37 μM en una nueva placa de Petri sobre el soporte de la pantalla de plástico.
- Cambie la pipeta para eliminar cualquier grumo antes de usar la pantalla de 37 μM.
- Pipeta del líquido obtenido de la primera filtración sobre la pantalla de 37 μM utilizando círculos concéntricos.
- Lave el filtro con 5 ml adicionales de 1 mg/ml de BSA en PBS. Las celdas deseadas permanecerán en el filtro, por lo tanto, deseche el líquido filtrado, pero guarde la pantalla de 37 μM.
- Deslice la pantalla de 37 μM en una nueva placa de Petri que contenga 5 ml de BSA de 1 mg/ml en PBS.
- Agite el plato golpeándolo contra un soporte cónico para desalojar los fragmentos. No agite demasiado vigorosamente, ya que el líquido / células pueden derramarse fuera de la placa de Petri.
- Enjuague el filtro con 5 ml adicionales de 1 mg/ml de BSA en PBS. Las células deseadas permanecerán en solución líquida en la placa de Petri. Guarde la pantalla de 37 μM y el fragmento desalojado que contiene líquido dentro de la placa de Petri para los siguientes pasos.
- Transfiera el líquido que contiene BSA + al tubo cónico estéril de 50 ml.
- Repita el enjuague de la pantalla de 37 μM varias veces más (cada vez con ~ 5 ml de 1 mg / ml BSA en PBS) y agregue al tubo cónico. Repita hasta que el volumen total recogido sea ~15-20 mL. En última instancia, las células deseadas se recogerán de la solución líquida en la placa de Petri y se colocarán en un tubo cónico; en este punto, deseche la pantalla de 37 μM después del enjuague final, pero guarde los fragmentos desalojados que contienen líquido dentro del tubo cónico de 50 ml.
- Recorte el extremo de una punta de pipeta de 200 μL con unas tijeras. Agite suavemente el tubo de 50 ml, retire dos muestras de 20 μL y colóquelas en una placa de Petri limpia de 35 mm.
- Contar el número de fragmentos en cada muestra en la placa de Petri para obtener el número total de MVFs aislados.
Total de fragmentos =
- Girar el fragmento restante que contiene líquido en un tubo cónico de 50 ml a 400 x g durante 4 min para recoger el MVF.
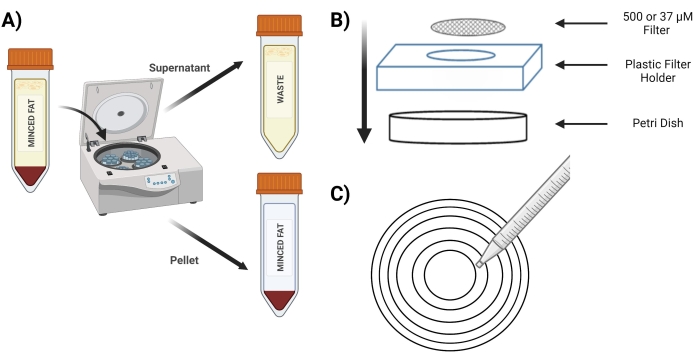
Figura 3: Aislamiento de MVF. (A) Post digestión del tejido adiposo, representación de la separación de MVF que contienen pellet y sobrenadante después de un spin-down. (B) Disposición de los suministros para la filtración y el atrapamiento de MVF. (C) Ilustración del método de círculo concéntrico para las etapas de filtración/lavado. Haga clic aquí para ver una versión más grande de esta figura.
5. Formación de hidrogeles de fibrina
- Ejemplos de cálculos:
NOTA: A continuación se presentan los cálculos para MVF sembrados en ~ 15,000-20,000 MVF / ml y la relación gel fibrinógeno: trombina en 2: 5, con fibrinógeno utilizado a una concentración de 20 mg / ml.- Para hacer cinco geles de 250 μL, se requiere un volumen total de 1,250 μL. Siempre tenga en cuenta los errores de pipeteo, por lo tanto, haga suficiente para 1.5 ml de geles.
- Calcule el volumen de fibrinógeno requerido de la siguiente manera:
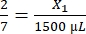 , X1 = 428,57 μL de fibrinógeno
, X1 = 428,57 μL de fibrinógeno - Calcule el volumen de trombina requerido de la siguiente manera:
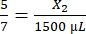 , X2 = 1.071,43 μL de trombina
, X2 = 1.071,43 μL de trombina - Para el volumen requerido de 428,57 μL, producir 500 μL de fibrinógeno de la siguiente manera:
20 mg/ml * 0,5 ml = 10 mg de fibrinógeno. Resuspender esto en 500 μL de DMEM - Para obtener cada gel, calcule el volumen de fibrinógeno y trombina de la siguiente manera:
- Fibrinógeno:
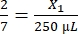 , X1 = 71,43 μL de fibrinógeno (en DMEM) + MVF
, X1 = 71,43 μL de fibrinógeno (en DMEM) + MVF - Trombina:
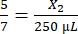 , X2 = 178,57 μL de trombina
, X2 = 178,57 μL de trombina
- Fibrinógeno:
- Calcule el volumen de fibrinógeno requerido de la siguiente manera:
- Para hacer cinco geles de 250 μL, se requiere un volumen total de 1,250 μL. Siempre tenga en cuenta los errores de pipeteo, por lo tanto, haga suficiente para 1.5 ml de geles.
- MVF fundición de gel de fibrina
- Decantar la mayor parte del líquido en el fragmento hilado en el tubo cónico de 50 ml. Use una pipeta para eliminar el pequeño volumen de líquido que se engancha en el borde del tubo cónico.
- Agregue trombina en los pocillos donde se harán los geles (Figura 4A).
- Recorte el extremo de una punta de pipeta de 200 μL y resuspenda los MVF suavemente usando fibrinógeno para obtener una densidad final de ~ 15,000-20,000 MVF / ml una vez en el gel.
- Sujete suavemente el extremo de una punta de pipeta de 200 μL y la pipeta MVF+Fibrinógeno en la solución de trombina. Pipetea rápidamente hacia arriba y hacia abajo para asegurar una mezcla homogénea. Repita hasta que se hagan todos los geles (Figura 4B).
- Coloque la(s) placa(s) del pocillo en una incubadora (37 °C, 5%CO2) durante ~15 min para permitir la reticulación en gel (Figura 4C).
- Agregue 100-150 μL de medios de crecimiento a cada pocillo.
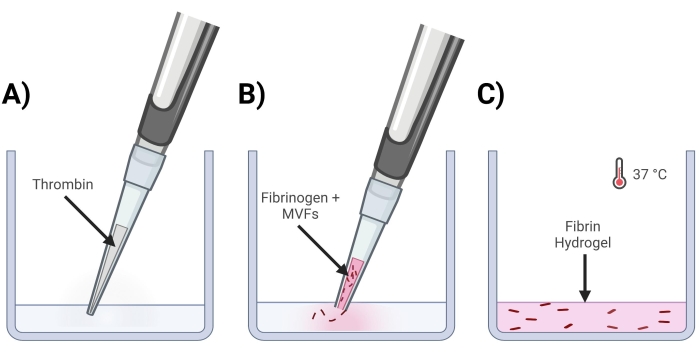
Figura 4: Formación de geles de fibrina MVF . (A) Una mezcla de trombina de 5/7 partes se pipetea en el pocillo correspondiente. (B) A continuación, con una punta de pipeta recortada (para no perturbar los MVF), se pipetea una mezcla de 2/7 partes de fibrinógeno + MVF en el pocillo y se mezcla suavemente. (C) Por último, todos los geles terminados se colocan en una incubadora a 37 °C, lo que permite que el hidrogel se solidifique completamente antes de colocar el medio en la parte superior. Haga clic aquí para ver una versión más grande de esta figura.
6. Condiciones de cultivo de los MFM
- Para cultivar tejido adiposo blanco y beige no vascularizado (+ GM Control), utilice las líneas de tiempo19 que se muestran en la Figura 5.
- Para el cultivo de tejido adiposo blanco y beige vascularizado (+ GM Control), utilice las líneas de tiempo19 que se muestran en la Figura 6.
- Los hidrogeles deben mantenerse en una incubadora (37 °C, 5%CO2) durante la duración del cultivo para el estudio, y los medios deben cambiarse cada dos días. Para la fijación y manipulación de muestras para análisis, consultar trabajos publicados anteriormente16,19,20.
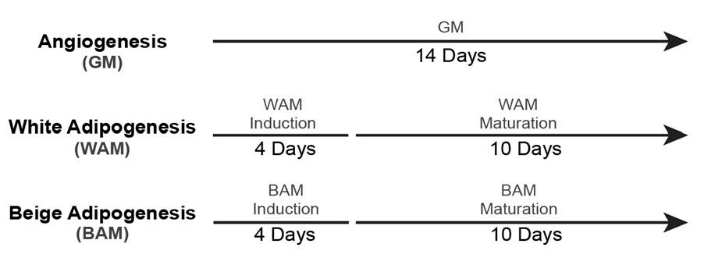
Figura 5: Tiempo para la formación de tejido adiposo no vascularizado. Esta figura ha sido modificada a partir de Acosta et al.19. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Tiempo para la formación de tejido adiposo vascularizado. Esta figura ha sido modificada a partir de Acosta et al.19. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Hay algunas características morfológicas fenotípicas clave del tejido adiposo beige / marrón: es multilocular / contiene pequeñas gotas de lípidos, posee una gran cantidad de mitocondrias (la razón de su apariencia característicamente "pardusca" in vivo), tiene una alta tasa de consumo de oxígeno / bioenergética mitocondrial, está altamente vascularizada, ha aumentado la lipólisis / absorción de glucosa estimulada por la insulina y, lo más notorio, expresa altos niveles de proteína de desacoplamiento 1 (UCP1), una proteína mitocondrial implicada en la respiración termogénica 19,30.
En consecuencia, al caracterizar la capacidad de los MVF para diferenciarse en tejido adiposo beige, se realizó un análisis que nos permitiría visualizar (Figura 7, Figura 8), confirmar genéticamente (Figura 9, Figura 10) y medir funcionalmente (Figura 11) la transformación del MVF.
En la Figura 7 y Figura 8, mediante el uso de BODIPY, una tinción lipídica, e imagen de los hidrogeles mediante microscopía confocal, se observó la visualización del tamaño y localización de los lípidos en los adipocitos diferenciados16,17,19. En particular, en este análisis, especialmente en comparación entre condiciones, los grupos BAM deben mostrar tamaños de lípidos más pequeños (indicativos de formación de tejido adiposo beige), cuantificables a través de NIH ImageJ19,20.
Usando RT-qPCR 16,19,20, en la Figura 9 y la Figura 10, de manera más distintiva, la expresión de UCP1 aumenta, en general, significativamente tras la exposición de MVF a BAM.
Por último, al observar la bioenergética mitocondrial (Figura 11), es evidente que los grupos BAM tienen niveles característicamente más altos de tasa de consumo de oxígeno (OCR), medidos mediante una prueba de esfuerzo de Seahorse mito19,20.
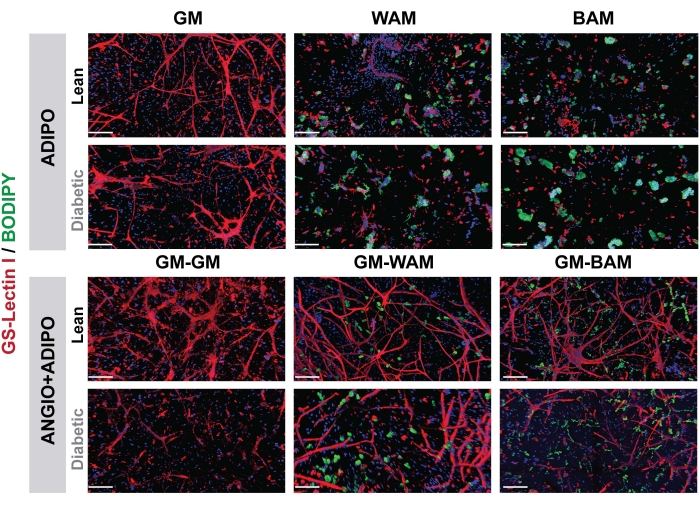
Figura 7: evaluación histológica r-MVF. Los r-MVF magros o derivados de diabéticos tipo 2 se expusieron a medios adipogénicos WAM o BAM directos (panel superior, ADIPO) o indirectos (panel inferior, ANGIO + ADIPO) para obtener tejido adiposo blanco o beige no vascularizado o vascularizado, respectivamente (barras de escala = 200 μm). Esta figura ha sido modificada a partir de Acosta et al.19. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: evaluación histológica h-MVF. h-MVF fueron expuestos a WAM o BAM directo (ADIPO) para obtener tejido adiposo blanco o beige no vascularizado, respectivamente (barras de escala = 200 μm). Esta cifra ha sido modificada de González Porras et al.20. Haga clic aquí para ver una versión más grande de esta figura.
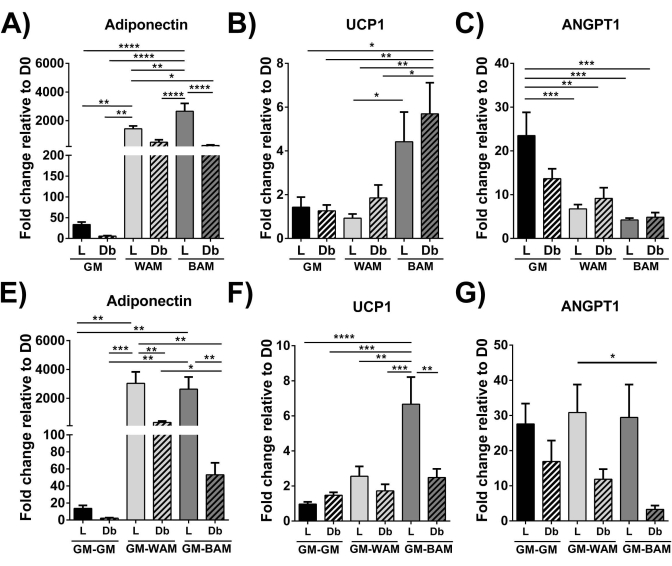
Figura 9: evaluación de r-MVF mediante RT-qPCR. Se evaluaron los r-MVF derivados de diabéticos (Db) magros (L) o tipo 2 expuestos a WAM o BAM directos o (E-G) directos o indirectos (E-G) para la adipogénesis (Adiponectina), la termogénesis (UCP1) (B, F) y la angiogénesis (C, G) (ANGPT1). Los resultados se informan como media ± error estándar de dos réplicas experimentales (n = 4). * = p < 0,05, ** = p < 0,01, *** = p < 0,001, y **** = p < 0,0001 . D0 = Día 0. Pruebas de análisis bidireccional de varianza (ANOVA) con análisis de comparación múltiple de Holm-Sidak para determinar las diferencias entre los grupos. La significación estadística se definió como p < 0,05. Esta figura ha sido modificada a partir de Acosta et al.19. Haga clic aquí para ver una versión más grande de esta figura.
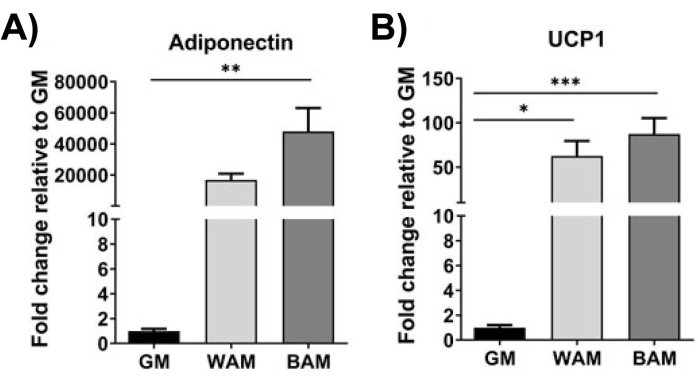
Figura 10: evaluación de h-MVF mediante RT-qPCR. Se evaluaron los h-MVF expuestos a WAM o BAM directo para (A) adipogénesis (adiponectina) y (B) termogénesis (UCP1). Los resultados se informan como media ± error estándar de dos réplicas experimentales (n = 4). * = p < 0,05, ** = p < 0,01, *** = p < 0,001, y **** = p < 0,0001 . Pruebas de análisis de varianza unidireccional (ANOVA) con análisis de comparación múltiple de Holm-Sidak para determinar las diferencias entre los grupos. La significación estadística se definió como p < 0,05. Esta cifra ha sido modificada de González Porras et al.20. Haga clic aquí para ver una versión más grande de esta figura.
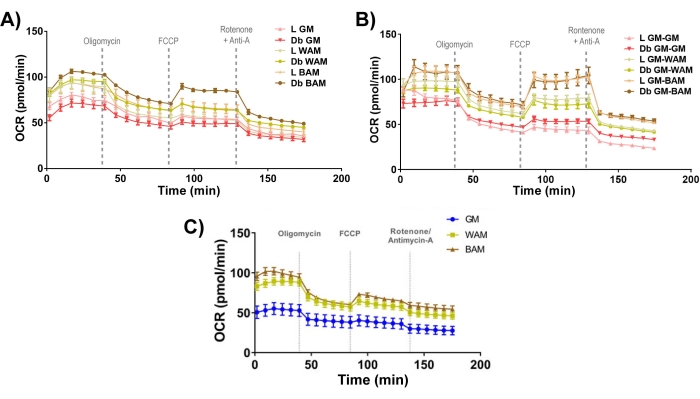
Figura 11: evaluación funcional de r-MVF y h-MVF. Los r-MVF derivados de diabéticos magros (L) o tipo 2 (Db) expuestos a (A) WAM o BAM directos o (B) indirectos o (C) h-MVF expuestos a WAM o BAM directos se evaluaron funcionalmente a través de la medición de la tasa de consumo de oxígeno (OCR). Los resultados se informan como media ± error estándar de dos réplicas experimentales (n = 4). Esta figura ha sido modificada a partir de Acosta et al.19. y González Porras et al.20. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El campo de la ingeniería de tejidos adiposos marrones/beige es en gran medida inmaduro 22,23,24,25,26,27,28, con la mayor parte de los modelos adiposos desarrollados para el tejido adiposo blanco 8,22,31. Los microtejidos marrones/beige diseñados típicamente consisten en múltiples fuentes celulares o alteraciones genéticas para obtener un subconjunto de las características fenotípicas del tejido adiposo marrón nativo 8,11,32. El enfoque descrito en este documento presenta una forma de fuente única, potencialmente autóloga18,33 de crear grasa beige funcional, estructuralmente relevante y vascularizada utilizando fragmentos microvasculares (MVF). Los MVF son más conocidos como una fuente de formación de tejido adiposo blanco 14,16,17,1 8,34, aunque recientemente hemos demostrado su capacidad para la formación de grasa beige derivada de fuentes de roedores, humanos y enfermos, como se muestra aquí 19,20. Dado el considerable interés en la utilización de grasa beige / marrón por su potencial terapéutico o de modelado de enfermedades, esta técnica tiene aplicaciones descabelladas en los campos del metabolismo, la obesidad y los trastornos relacionados.
Hay varios puntos clave descritos en el protocolo. En primer lugar, existen diferencias entre la utilización de MVF de rata y humana. El uso de derivados de roedores (ya sea de ratones 29 o ratas) ha dominado, hasta ahora, en gran medida la investigación con MVF, con trabajos que los analizan en una multitud de afecciones como la obesidad 35, la diabetes tipo 1 36,37, la diabetes tipo 219 y el envejecimiento 38, e incluso las diferencias entre los depósitos adiposos 39 o el género40. Aunque los MFV, dado su origen, pueden aislarse autólogamente de los depósitos adiposos subcutáneos de adultos utilizando procedimientos estándar mínimamente invasivos41, la vascularización basada en MVF no se ha realizado en la práctica clínica. Sin embargo, estudios preclínicos donde los MVF humanos fueron cosechados del lipoaspirado han demostrado su posibilidad18,33. Para nuestro grupo específicamente, como se muestra en los datos representativos, la formación de tejido adiposo beige vascularizado se limita actualmente a MVF derivados de roedores. Como ya lo demostraron nuestro grupo y otros18, la obtención del equilibrio entre el crecimiento de los vasos y la diferenciación de los adipocitos es altamente sensible, se ha demostrado que depende de los factores introducidos42, y la diferenciación de puntos de tiempo es provocada16. Una limitación del protocolo descrito es que se necesita un mayor desarrollo para optimizar las condiciones propicias para la formación de tejido adiposo beige h-MVF vascularizado. Además, se necesita más trabajo que analice la respuesta de estos andamios in vivo y derivados de otros estados enfermos, junto con los pasos de optimización asociados.
Además, aquí se describe un protocolo para el aislamiento de r-MVF de tres depósitos de tejido adiposo diferentes en ratas macho. Trabajos previos de Später et al.39 discutieron las diferencias entre la capacidad de vascularización de los MVF viscerales versus los subcutáneos derivados de depósitos, señalando que los MVF de depósito subcutáneo tenían una capacidad disminuida para vascularizar, una característica que atribuyeron al exceso de contaminación del tejido conectivo. Cabe señalar que, para nuestros estudios, como se presenta aquí en los "datos representativos", solo se utilizaron los depósitos inguinales subcutáneos y subcutáneos posteriores. La elección de utilizar únicamente MVF derivados de la subvía subcutánea se hizo para imitar más de cerca los estudios traslacionales en los que el lipoaspirado, o procedimientos similares, recogen exclusivamente tejido adiposo subcutáneo. Además, el hecho de que se estén desarrollando estudios in vivo que señalan tejido adiposo beige dentro del tejido adiposo subcutáneo, que contiene un subconjunto distinto de preadipocitos o adipocitos blancos que se transdiferencian, proporcionó una justificación adicional para nuestra decisión43. Trabajos previos de nuestro grupo no mostraron diferencias discernibles entre los MFV originados en depósitos viscerales o subcutáneos de roedores sanos para someterse tanto a angiogénesis como a formación de tejido adiposo blanco16. Todas estas variables deben ser consideradas al diseñar estudios futuros.
Por último, al intentar modificar o solucionar problemas del método descrito, se deben deliberar algunos puntos esenciales. Primero, el paso de digerir enzimáticamente el tejido adiposo es extremadamente importante; Se debe tener especial cuidado y garantizar la optimización para reproducir consistentemente MVF de tamaño y calidad similares. Dada la gran variación entre los tipos de grasa y los volúmenes de grasa (altamente dependiente de la edad, el tamaño, la salud y el cuidado del animal en el momento del aislamiento de la grasa [evitar contaminantes y eficiencia de extracción]), el tiempo de digestión puede variar, por lo tanto, se proporcionan los rangos que mejor se adaptan a nuestro equipo / animales. Sin embargo, la personalización debe considerarse para obtener resultados óptimos. Además, al manipular el MFV, durante la digestión postenzimática, se debe tener especial cuidado para evitar rugosidades innecesarias y romper aún más los fragmentos. Finalmente, uno debe ser consciente de que las formulaciones de medios, el hidrogel de la opción44 y las condiciones de cultivo son altamente personalizables en función de los resultados previstos. Como se muestra aquí, los MVF derivados de diferentes fuentes (por ejemplo, MVF magros vs. diabéticos) tienen diferentes grados de diferenciación, por lo que al diseñar experimentos, se deben incluir controles adecuados y grupos experimentales.
En conclusión, a medida que crece el campo de la ingeniería de tejido adiposo termogénico, es fundamental construir sistemas biológicamente relevantes que imiten estructural, genética y funcionalmente el tejido adiposo beige / marrón nativo. Los MVF presentan un enfoque emocionante y único para este desafío, ya que, como se describe aquí, proporcionan un método simple de fuente única para crear imitaciones biológicas de grasa beige. Por lo tanto, tienen un potencial significativo para la utilización de la comprensión o el desarrollo de tratamientos para la obesidad y las enfermedades metabólicas.
Divulgaciones
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
El Dr. Acosta cuenta con el apoyo de las subvenciones CA148724 y TL1TR002647 de los Institutos Nacionales de Salud. El Dr. González Porras cuenta con el apoyo del Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales de los Institutos Nacionales de Salud, bajo el número de adjudicación F32-0DK122754. Este trabajo fue apoyado, en parte, por los Institutos Nacionales de Salud (5SC1DK122578) y el Departamento de Ingeniería Biomédica de la Universidad de Texas en San Antonio. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales de los Institutos Nacionales de Salud. Las figuras fueron creadas parcialmente con Biorender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
Referencias
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados