Method Article
Imagem da migração de neutrófilos na pele de camundongos para investigar a remodelação da membrana subcelular em condições fisiológicas
Neste Artigo
Resumo
A migração de neutrófilos depende da remodelação rápida e contínua da membrana plasmática em resposta ao quimioatraente e suas interações com o microambiente extracelular. Descrito aqui é um procedimento baseado em Microscopia Subcelular Intravital para investigar a dinâmica de remodelação da membrana em neutrófilos injetados na orelha de camundongos anestesiados.
Resumo
O estudo do recrutamento e função de células imunes em tecidos tem sido um campo muito ativo nas últimas duas décadas. Os neutrófilos estão entre as primeiras células imunes a atingir o local da inflamação e a participar da resposta imune inata durante a infecção ou dano tecidual. Até agora, a migração de neutrófilos foi visualizada com sucesso usando vários sistemas experimentais in vitro baseados em estimulação uniforme ou migração confinada sob agarose ou canais microfluídicos. No entanto, esses modelos não recapitulam o microambiente complexo que os neutrófilos encontram in vivo. O desenvolvimento de técnicas baseadas em microscopia multifotônica (MPM), como a microscopia subcelular intravital (ISMic), oferece uma ferramenta única para visualizar e investigar a dinâmica dos neutrófilos em resoluções subcelulares sob condições fisiológicas. Em particular, a orelha de um camundongo anestesiado vivo oferece uma vantagem experimental para acompanhar a migração intersticial de neutrófilos em tempo real devido à sua facilidade de acessibilidade e falta de exposição cirúrgica. O ISMic fornece a resolução óptica, a velocidade e a profundidade de aquisição necessárias para rastrear processos celulares e, mais importante, subcelulares em 3D ao longo do tempo (4D). Além disso, a imagem multimodal do microambiente intersticial (ou seja, vasos sanguíneos, células residentes, matriz extracelular) pode ser facilmente realizada usando uma combinação de camundongos transgênicos expressando marcadores fluorescentes selecionados, marcação exógena por meio de sondas fluorescentes, fluorescência intrínseca do tecido e sinais gerados por segundo / terceiro harmônico. Este protocolo descreve 1) a preparação de neutrófilos para transferência adotiva para a orelha do camundongo, 2) diferentes configurações para imagens subcelulares ideais, 3) estratégias para minimizar artefatos de movimento enquanto mantém uma resposta fisiológica, 4) exemplos de remodelação de membrana observados em neutrófilos usando ISMic e 5) um fluxo de trabalho para a análise quantitativa de remodelação de membrana em neutrófilos migratórios in vivo.
Introdução
A migração celular dirigida é um evento crítico que ocorre durante diferentes processos fisiológicos e patológicos, incluindo desenvolvimento, resposta imune, reparo tecidual e iniciação, progressão e disseminação do tumor 1,2. Esse processo depende de sinais quimiotáticos extracelulares específicos detectados por seus receptores cognatos na membrana plasmática e, em seguida, transduzidos em intrincados sinais intracelulares. Essas vias, por sua vez, ativam a migração celular por meio de uma série de respostas, incluindo ativação local do citoesqueleto, tráfego e remodelação da membrana e polarização celular3. Dois tipos distintos de migração celular foram bem caracterizados: mesenquimal e amebóide4. A migração mesenquimal é relativamente lenta (<1 μm/min), depende de forte adesão entre as células e a matriz extracelular (MEC) e depende da degradação da matriz induzida por metaloproteases. Em contraste, a migração amebóide, uma característica das células imunes que respondem rapidamente a estímulos inflamatórios, é mais rápida (>10 μm/min) e utiliza aderências fracas para navegar pela MEC. Independentemente da modalidade, a migração celular requer uma remodelação constante da membrana plasmática, resultando na geração de estruturas protrusivas na borda de ataque das células, que são fortemente coordenadas com a retração da membrana na parte traseira1.
Para desvendar os mecanismos moleculares subjacentes a esses processos subcelulares, é fundamental visualizar a dinâmica das membranas nas células migratórias em uma resolução temporal e espacial apropriada. Além disso, como a remodelação da membrana é fortemente influenciada pelas propriedades do microambiente tecidual ao redor das células migratórias, é crucial obter imagens desse processo diretamente no tecido nativo, em animais vivos. Isso é feito usando microscopia intravital (IVM)5. A primeira imagem de MIV foi realizada ~ 200 anos atrás, quando o extravasamento de leucócitos foi visualizado usando um microscópio de transiluminação simples6 e, posteriormente, a MIV foi usada principalmente em organismos modelo semitransparentes, como peixe-zebra e Drosophila 7,8. Nas últimas duas décadas, a MIV tem sido usada com sucesso para investigar processos celulares em camundongos, ratos e mamíferos maiores, como porcos 5,9. Isso foi possível devido a 1) desenvolvimentos significativos na microscopia confocal e multifóton (MP) e 2) o aumento da tecnologia de edição de genes, como o CRISPR-Cas9, que permitiu a engenharia rápida de uma variedade de modelos animais para expressar proteínas e repórteres marcados com fluorescência. Além disso, a visualização de células individuais e seu microambiente durante processos como iniciação tumoral, migração celular e resposta imune tem sido possibilitada por outras formas de marcação exógena, como a introdução sistêmica de corantes para marcar a vasculatura10,11, e a excitação de moléculas endógenas, como o colágeno por meio da Segunda Geração Harmônica (SHG)10, 12 e fibras nervosas através da Terceira Geração Harmônica (THG)11,13. Finalmente, um aprimoramento nas técnicas para minimizar os artefatos de movimento devido aos batimentos cardíacos e à respiração levou ao desenvolvimento da microscopia subcelular intravital (ISMic), que permitiu aos pesquisadores obter imagens e investigar vários eventos subcelulares diretamente em animais vivos em um nível de resolução semelhante aos observados in vitro 14,15,16,17 . Exemplos de ISMic incluem a investigação da dinâmica do citoesqueleto durante a exocitose 14,15,16,17 e endocitose 15, remodelação dinâmica do citoesqueleto durante a migração celular17,18, localização e metabolismo mitocondrial19,20 e sinalização de cálcio no cérebro21.
Este protocolo detalha as diferentes etapas e procedimentos para investigar a remodelação da membrana celular em uma resolução subcelular durante a migração de neutrófilos na pele da orelha de um camundongo vivo usando ISMic. Essa abordagem é baseada em protocolos descritos anteriormente 22,23 e adaptada para alcançar maior resolução espacial e temporal.
Protocolo
Todos os experimentos e procedimentos em animais foram aprovados pelo Comitê de Cuidados e Uso de Animais do Instituto Nacional do Câncer (National Institutes of Health, Bethesda, MD, EUA) (protocolos LCMB-031 e LCMB-035) e estavam em conformidade com todos os regulamentos éticos relevantes. Camundongos machos e fêmeas com idades entre 2 e 6 meses foram usados para os experimentos. Os camundongos hospedeiros mT/mG e wild-type (WT) estão em um fundo FVB/NJ, enquanto os camundongos LyzM-Cre x mTmG estão em um fundo C57BL/6.
1. Materiais e preparação de reagentes e ferramentas
- Cubra tubos, pratos e agulhas/seringas com PBS + 1% de BSA (sem cálcio e magnésio) durante a noite sob agitação.
- Limpe cuidadosamente as superfícies e ferramentas/instrumentos a serem usados para o trabalho com animais usando etanol a 70% ou em autoclavagem.
- Para purificação de neutrófilos, prepare o seguinte: 3 tubos de 15 mL, 1 prato de 60 mm, 1 tubo de 1,5 mL; HBSS contendo 10 mM HEPES (pH 7,3); solução de lise de glóbulos vermelhos (ACK); Histopaco 1077; e Histopaco 1119.
- Para injeções de neutrófilos, prepare o seguinte: 1 seringa de baixo volume (10 μL), 1 agulha chanfrada 33 G, isoflurano e solução anestésica (cetamina, xilazina e acepromazina a 80 mg · kg-1, 2 mg · kg-1 e 4 mg · kg-1, respectivamente, em solução salina).
2. Purificação de neutrófilos de um camundongo doador
- Eutanasiar o camundongo doador de acordo com os regulamentos institucionais locais.
- Colete ossos longos do animal (fêmur, tíbia e úmero), atentando para preservar a integridade óssea e evitando cortar a cabeça dos ossos durante a coleta24.
- Em um prato de 60 mm revestido com BSA, remova os músculos e o tecido adiposo. Corte as cabeças dos ossos para ter acesso à medula e, em seguida, lave e homogeneize a medula óssea usando uma seringa (agulha 27 G) cheia de HBSS.
- Filtrar a solução para um tubo revestido com BSA de 15 ml utilizando um filtro de 40 μm e centrifugar a 400 x g durante 5 min à temperatura ambiente (RT).
- Aspire o sobrenadante, ressuspenda o pellet em 1 mL de ACK por 30 s para lisar os glóbulos vermelhos e, em seguida, adicione 9 mL de HBSS para interromper a lise. Centrifugar a solução a 400 x g durante 5 min em RT.
- Prepare um gradiente de degrau de densidade em um tubo revestido com BSA de 15 mL colocando suavemente 4 mL de 1119 Histopaque na parte inferior do tubo e, em seguida, colocando suavemente 4 mL de 1077 Histopaque na parte superior. Tome cuidado extra para evitar misturar as duas camadas.
- Aspire o sobrenadante e ressuspenda o pellet celular em 2 mL de HBSS. Coloque suavemente a solução em camadas sobre o gradiente de degrau preparado acima. Gire a 1.000 x g por 30 min em RT com a menor velocidade de aceleração e desaceleração possível ("sem freio" é preferível).
- Do topo do tubo, aspire suavemente metade da camada 1077 Histopaque. Recolha a metade restante da camada 1077 Histopaque e a metade superior da camada 1119 Histopaque num novo tubo revestido com BSA. A suspensão celular turva entre as duas camadas de densidade contém predominantemente neutrófilos.
- Adicione HBSS para atingir um volume final de 15 mL e misture suavemente invertendo o tubo. Gire a 400 x g por 5 min em RT.
- Após centrifugação, ressuspender e lavar o sedimento celular com 10 mL de HBSS e centrifugar a 400 x g durante 5 min à temperatura ambiente. Repita o procedimento e, em seguida, ressuspenda o pellet em 15 mL de HBSS para determinar o número de células usando um contador de células. Finalmente, gire e ressuspenda as células em 1 mL de HBSS e transfira para um tubo revestido com BSA de 1,5 mL.
- Após a purificação, mantenha a suspensão de neutrófilos no tubo revestido com BSA sob agitação suave por 30 min em um rotador de tubo em RT até a rotulagem e / ou injeção.
NOTA: Uma purificação bem-sucedida produz 10-20 x 106 neutrófilos por camundongo com 95% de pureza. A pureza é avaliada por citometria de fluxo, usando marcadores de neutrófilos previamente descritos (Ly6G+, Ly6C-, Gr1+ e CD11b+)25,26.
NOTA: Protocolos sobre purificação de neutrófilos do sangue periférico humano e medula óssea de camundongos estão disponíveis anteriormente24,27.
3. Marcação de neutrófilos
NOTA: Para visualizar os neutrófilos, eles foram purificados de camundongos LyzM-Cre mT / mG , nos quais as células mieloides expressam um peptídeo direcionado à membrana fundido com a GFP. Além disso, neutrófilos purificados de camundongos do tipo selvagem (WT) foram marcados in vitro. As etapas a seguir descrevem o procedimento usado para marcar neutrófilos purificados com um corante fluorescente verde permeável a células comerciais e podem ser adaptados a qualquer outra sonda fluorescente compatível com MPM de sua escolha.
- Adicione o corante fluorescente verde (concentração recomendada pelo fabricante; aqui, 1 μM) à suspensão de neutrófilos (purificada de camundongo WT) em um tubo revestido com BSA de 1,5 mL. Incubar durante 30 min em RT sob agitação suave num rotador de tubos.
- Lave três vezes com HBSS, gire a 400 x g por 5 min em RT e ressuspenda o pellet em 1 mL de HBSS.
- Mantenha a suspensão de neutrófilos no tubo revestido com BSA sob agitação suave em um rotador de tubo em RT até o procedimento de injeção.
NOTA: A injeção de neutrófilos marcados realizada logo após a marcação é altamente preferida. No entanto, se necessário, os neutrófilos marcados podem ser mantidos sob agitação por mais 10 a 15 minutos após a marcação sem comprometer a integridade da resposta dos neutrófilos in vivo. A agitação de longo prazo (mais de 60 minutos após a rotulagem) levará à aglomeração, morte de neutrófilos e observações enganosas in vivo. - Imediatamente antes da injeção, ressuspenda o pellet celular em solução salina para atingir uma densidade de 2-5 x 106 células por 20 μL.
4. Injeção de neutrófilos
NOTA: A anestesia deve ser realizada seguindo as diretrizes do Comitê de Cuidados e Uso de Animais da instituição local.
- Coloque o animal em uma câmara fechada e administre isoflurano a 3% a 5% (vazão de 2 L/min) usando um vaporizador calibrado conectado a um concentrador de oxigênio.
- Avalie se o animal está inconsciente testando o reflexo de retirada da pata ao beliscar a pata traseira. Em seguida, transfira o animal para uma almofada de aquecimento (37° C) para manter a temperatura corporal. Continue a administrar o isoflurano (1%-2%; taxa de fluxo de 0,5 L / min) através de um cone nasal.
NOTA DE SEGURANÇA: Para limitar a exposição do pessoal ao isoflurano tóxico, recomenda-se o uso de um sistema dispensador equipado com uma unidade de filtragem para recapturar o isoflurano circulante. - Para otimizar a qualidade da imagem, remova os pelos da orelha usando um aparador fino. Este procedimento também pode ser realizado um ou dois dias antes do experimento.
NOTA: O uso de creme depilatório é desencorajado, pois é conhecido por exacerbar a resposta inflamatória na pele do camundongo e introduzir artefatos de imagem. - Coloque o animal de lado. Usando fita cirúrgica, segure a borda da orelha e alise-a ao longo da almofada de aquecimento. Aplique suavemente a fita para evitar qualquer dano ao ouvido.
- Encha uma seringa equipada com uma agulha de 33 G com a suspensão de neutrófilos (2-5 x 106 células por 20 μL) e monte-a em um micromanipulador.
NOTA: O ângulo de injeção entre a agulha e a orelha em uma almofada de aquecimento deve estar entre 10° e 30° para minimizar os danos aos tecidos e aumentar o sucesso da injeção celular. - Mova suavemente a agulha (com o chanfro para cima) em direção à orelha e perfure lentamente a pele. Assim que a agulha estiver dentro da pele, empurre lentamente o pistão e forneça 2-3 μL de suspensão celular.
NOTA: Áreas com vasos sanguíneos visíveis devem ser evitadas, pois danificar um vaso sanguíneo resulta em uma resposta imune indesejada e complexa à injeção e problemas com a imagem. - Repita a injeção em 2-3 áreas diferentes da orelha, de preferência com 2-3 mm de distância. Não "encha demais" a orelha com a suspensão celular.
NOTA: A injeção deve ser realizada no centro da orelha. A periferia da orelha é fina e deve ser manuseada com cuidado, pois pode ser facilmente danificada, enquanto a parte central é mais espessa, contendo vasos sanguíneos maiores e menos folículos pilosos, e pode suportar maiores volumes de injeção. - Remova cuidadosamente a fita cirúrgica e deixe o animal recuperar a consciência sob supervisão. Deixe o animal descansar por 1 h antes da imagem para permitir que o tecido e as células se recuperem do procedimento de injeção.
5. Anestesia para IVM
NOTA: Uma anestesia mais profunda melhora significativamente a qualidade da imagem, diminuindo os artefatos de movimento devido aos batimentos cardíacos e à respiração. Camundongos injetados com neutrófilos são submetidos a anestesia química, que fornece sedação mais profunda do que a anestesia induzida por gás. A anestesia deve ser realizada seguindo as diretrizes do Comitê de Cuidados e Uso de Animais da instituição local.
- Uma hora após a recuperação da injeção de neutrófilos, anestesiar os animais por meio de uma injeção subcutânea contendo uma mistura de xilazina/cetamina/acepromazina (80 mg·kg-1, 2 mg·kg-1 e 4 mg·kg-1, respectivamente) em solução salina.
NOTA: Para garantir a reprodutibilidade e confiabilidade dos resultados, os animais devem ser mantidos aquecidos desde o momento da anestesia até o final do experimento usando uma almofada de aquecimento ou almofada de circulação de água conectada a uma bomba de aquecimento. - Para manter a anestesia além de 1 h, injete uma mistura de cetamina / acepromazina (40 mg · kg-1 e 2 mg · kg-1 , respectivamente) por via subcutânea a cada 40 minutos. Monitore os camundongos anestesiados periodicamente em busca de sinais de consciência, testando o reflexo de retirada da pata.
- Além disso, para procedimentos de imagem com duração superior a 1 h, aplique uma pomada oftálmica estéril não medicamentosa nos olhos para evitar o ressecamento da córnea durante a anestesia e mantenha a hidratação corporal por meio de injeções subcutâneas de solução salina (200 μL a cada hora).
NOTA: Como alternativa, um sistema baseado em perfusão controlado digitalmente pode ser usado para garantir uma injeção periódica e suave da solução anestésica e/ou fornecer fluidos. Um driver de seringa automatizado pode ser configurado para fornecer o volume desejado de anestésico e fornecer hidratação por períodos mais longos. Para este fim, uma agulha de infusão alada pode ser inserida por via subcutânea na pele dorsal do animal e fixada com fita cirúrgica.
6. Exames de imagem
NOTA: A configuração do animal e os parâmetros de imagem descritos aqui são otimizados para um microscópio multifotônico invertido equipado com uma única linha de laser para excitar e coletar simultaneamente as emissões dos diferentes fluoróforos.
- Antes de colocar o animal anestesiado na platina do microscópio, certifique-se de que o microscópio esteja ligado e que a platina e as lentes estejam pré-aquecidas a 37 °C. Cubra o orifício no palco com uma lamínula de vidro (espessura # 1 ou 1,5) alinhada com a lente aquecida.
- Mova o animal para o palco com cuidado. Se a imagem for planejada para uma longa duração (>1 h), aplique pomada oftálmica e proteja o sistema de perfusão baseado em infusão alada conforme descrito acima.
- Coloque uma gota de solução salina no centro da lamínula e coloque a orelha injetada com neutrófilos em cima dela. Alise suavemente a orelha usando um cotonete estéril no centro da lamínula para remover bolsas de ar.
NOTA: A aplicação de solução salina (ou PBS) entre a orelha e a lamínula reduz a refração da luz devido às bolsas de ar, garantindo assim um índice de refração uniforme e qualidade de imagem superior. - Prenda a orelha pressionando suavemente uma vara de madeira (removida do cotonete) na lateral da orelha mais próxima da cabeça do animal e travando-a com fita adesiva (Figura 1A).
NOTA: Um bastão de madeira seguro minimiza os artefatos de movimento devido aos batimentos cardíacos e à respiração e aumenta drasticamente a qualidade da imagem. É importante ressaltar que a vara de madeira deve ser presa apenas o suficiente para estabilizar a orelha sem prejudicar o fluxo sanguíneo. - Usando a ocular do microscópio, encontre uma área de interesse e mude para o modo de aquisição multifotônica.
- Defina o comprimento de onda de excitação do laser para 900-930 nm para permitir a aquisição simultânea de GFP/corante fluorescente verde, mTomato e colágeno-I (via SHG).
- Defina o conjunto apropriado de espelhos e combinação de filtros nos detectores para coletar a luz emitida (filtros passa-banda: Azul = 410-460 nm, Verde = 495-540 nm, Vermelho = 580-640 nm).
NOTA: Os neutrófilos injetados, quando marcados com um corante fluorescente verde, exibem uma forte fluorescência verde, tornando-os visíveis sob a ocular do microscópio, mesmo se injetados em porções mais profundas da orelha. - Determine a configuração mais apropriada para a configuração de hardware. Mesmo que as células migratórias possam ser rastreadas com um intervalo de 30 s a 1 min, imagine eventos subcelulares com uma velocidade mais alta (intervalo de pelo menos <10 s). No exemplo abaixo, duas configurações de imagem diferentes são apresentadas para mostrar a diferença entre o IVM clássico e o ISMic.
- Na abordagem clássica de MIV para rastrear a migração celular e investigar o tecido do camundongo hospedeiro (Figura 1), use uma lente de 30x e um scanner galvo com um tamanho de imagem de 512 x 512 pixels (tamanho de pixel de 0,83 μm) e defina o deslocamento do eixo z usando o estágio motorizado com um tamanho de passo de 2 μm, permitindo imagens de um volume de 30 μm de profundidade a cada 30 s.
- Na abordagem ISMic para remodelação de membrana altamente dinâmica de imagem em uma ampliação e resolução mais altas (Figura 2), use uma lente de 40x e um scanner ressonante com média de 3x e tamanho de imagem de 512 x 512 pixels (tamanho de pixel de 0,25 μm) e defina o deslocamento do eixo z usando um piezo com um tamanho de passo de 1 μm, permitindo imagens de volume de 20 μm de profundidade a cada 4-5 s.
- Desencadeie a migração de neutrófilos induzindo uma lesão estéril por laser. Focalizar o laser de excitação a uma potência elevada suficiente para atingir pelo menos 80 mW22, numa área estreita do tecido (20 μm x 20 μm) durante 10 s.
- Identifique a lesão induzida pelo laser por seus fortes sinais autofluorescentes que aparecem em todos os canais e pela alteração resultante do arranjo do colágeno (Figura 1D).
NOTA: Para obter resultados confiáveis, a lesão deve ser sempre induzida o mais longe possível dos vasos sanguíneos; Se rompidas, as células sanguíneas liberadas no tecido afetarão a qualidade da imagem, além de resultar em uma forte reação imunológica geral. - Salve os dados no final da experimentação para análises posteriores.
- Eutanásia do animal de acordo com as diretrizes institucionais locais. Se necessário, o tecido pode ser coletado para fixação e processamento posterior.
7. Análise representativa dos dados
NOTA: Os dados podem ser visualizados e analisados com o software do microscópio, software de terceiros ou programas personalizados. O procedimento e as ferramentas utilizadas dependem das necessidades específicas dos investigadores. Aqui é mostrado um exemplo de um fluxo de trabalho para quantificar a curvatura da membrana e as mudanças na área local na borda de ataque e na parte traseira dos neutrófilos migratórios.
- Abra os arquivos de imagem com Imaris ou Fiji para visualizar a migração dos neutrófilos em 4D e determinar a qualidade do experimento.
NOTA: Imaris e Fiji podem ler o formato de imagem de várias marcas de microscópios. - Processe os dados com as etapas a seguir executando scripts de código MATLAB personalizados. Leia os arquivos de imagem selecionados com o pacote Bio-Formats28 para MATLAB. Segmente cada quadro do volume 3D com o algoritmo Otsu29 para identificar as células individuais.
- Rastreie os objetos identificados com base no critério de deslocamento mínimo30.
- Determine os contornos e limites ativos do objeto.
- Gere uma projeção máxima para cada objeto identificado em um período de tempo.
- Aplique a função bwboundaries no MATLAB à projeção máxima de cada objeto identificado da etapa 7.2 para gerar 100 pontos de limite.
- Otimize os pontos de contorno identificados com o algoritmo de contorno dinâmico para obter precisão de subpixel31 (Figura 3A) usando as funções no pacote MATLAB baixado via http://www.iacl.ece.jhu.edu/static/gvf/.
- Sobreponha os limites do objeto e o índice de trajetória do objeto determinado pelo rastreamento na etapa 7.3 com a projeção máxima da imagem original para gerar uma saída de um filme 2D sobreposto para visualização e verificação manual.
- No filme sobreposto, selecione manualmente todos os objetos identificados como células migratórias, excluindo objetos que não são células, objetos em contato e objetos com limites incompletos. Registre os índices de rastreamento, os quadros inicial e final de cada trajetória de célula em uma planilha para ser usada como entrada para as etapas a seguir implementadas pelos scripts de código do MATLAB.
- Rastreie os pontos de limite da célula de cada quadro para o próximo de acordo com o critério de deslocamento mínimo. Use a função Polyarea no MATLAB para calcular a área sublinhada por pontos de contorno adjacentes em dois períodos de tempo consecutivos (Figura 3C). Se o limite da célula local se mover para fora da célula, atribua um sinal positivo à mudança de área. Se o limite da célula local se mover para dentro da célula, atribua um sinal negativo à mudança de área.
- Meça a curvatura da membrana local em cada ponto de limite para cada quadro, ajustando seus pontos de limite vizinhos a um círculo (5 de cada lado; total 11)32 (Figura 3B).
- Gere quimógrafos usando a função imagesc no MATLAB (Figuras 3D, E) para mostrar as mudanças das características subcelulares ao longo do tempo e relacionar com a posição da célula.
Resultados
Aqui, dois conjuntos diferentes de resultados são apresentados para ilustrar o IVM clássico e o ISMic que fornecem resolução celular e subcelular, respectivamente. No primeiro exemplo, os neutrófilos foram purificados de um camundongo do tipo selvagem (WT), marcados com Cell Tracker Green para corar o citoplasma e injetados em um camundongo transgênico expressando uma proteína fluorescente direcionada à membrana plasmática (camundongo mTomato, também conhecido como mT / mG33, Figura 1 e Filme 1 e Filme 2). Este camundongo receptor permitiu a visualização de características estruturais no tecido da orelha, como vasos sanguíneos, células residentes e folículos pilosos (Figura 1C e Filme 1) por meio da abordagem baseada em MIV (etapa 6.8.1). As fibras colágenas, reveladas via SHG (detectadas na metade do comprimento de onda da excitação), foram dispostas em uma intrincada rede na derme, onde os neutrófilos foram injetados. Ao longo da borda dos folículos pilosos (HF), foi observada uma camada de células epiteliais (ou seja, queratinócitos). Ocasionalmente, artefatos de pêlos residuais resultando em depressão local da pele foram visualizados (H). As lesões induzidas pelo laser foram facilmente visualizadas devido à sua forte autofluorescência detectada em todos os canais e pelas alterações do arranjo do colágeno (Figura 1D). Uma visão mais completa da arquitetura 3D da pele e da localização dos neutrófilos injetados pode ser apreciada no Filme 1, que retrata uma pilha Z da pele das camadas externa para interna e uma renderização de volume 3D. A imagem de lapso de tempo mostrou os neutrófilos coletando amostras da pele da orelha e interagindo com a ECM e o tecido hospedeiro (Filme 2). A aquisição de imagens nessa resolução e a aquisição de uma pilha Z a cada 30 s permitem realizar o rastreamento celular e a medição de parâmetros de motilidade (ou seja, velocidade e direcionalidade), mas uma análise precisa e detalhada da remodelação da membrana é um desafio nessa resolução.
No segundo exemplo, a remodelação da membrana foi avaliada por meio da abordagem ISMic (etapa 6.8.2) usando neutrófilos que expressam mGFP purificados de camundongos LyzM-cre mT / mG e injetados em animais WT (Figura 2A, fluxograma experimental). Usando o protocolo ISMic (Filme 3 e imagens estáticas na Figura 2B) e após a lesão a laser, a remodelação dinâmica da membrana plasmática é observada durante a migração, e a formação de saliências da membrana na borda de ataque e a retração da parte traseira das células são claramente visualizadas (Figura 2 e Filme 3). As sequências de lapso de tempo destacadas no Filme 3 revelam a complexidade das interações com o ECM. De fato, os neutrófilos migraram através do espaço intersticial movendo-se ao longo das fibras ou nos espaços entre elas. Finalmente, aspectos quantitativos como as mudanças na curvatura e as mudanças de área na frente e atrás das células foram quantificados para cada ponto de tempo. Usando a célula descrita na Figura 2B como exemplo, a dinâmica local da membrana plasmática foi analisada usando um pipeline de algoritmo (consulte a etapa 7) com base na identificação de 100 pontos de contorno subjacentes à superfície da célula (Figura 3A). As mudanças na curvatura local (Figura 3B) e na área sublinhada por saliências da membrana plasmática (Figura 3C) foram calculadas para cada ponto de contorno e relatadas para cada período de tempo como quimógrafos (Figura 3D, E). Tanto a frente quanto a parte de trás das células mantêm uma curvatura maior do que a lateral das células (Figura 3D); mudanças de área negativas (retrações, regiões azuis) são mais aparentes na parte de trás das células do que na borda de ataque, onde as mudanças de área positivas são mais proeminentes (saliências, regiões vermelhas) (Figura 3E).
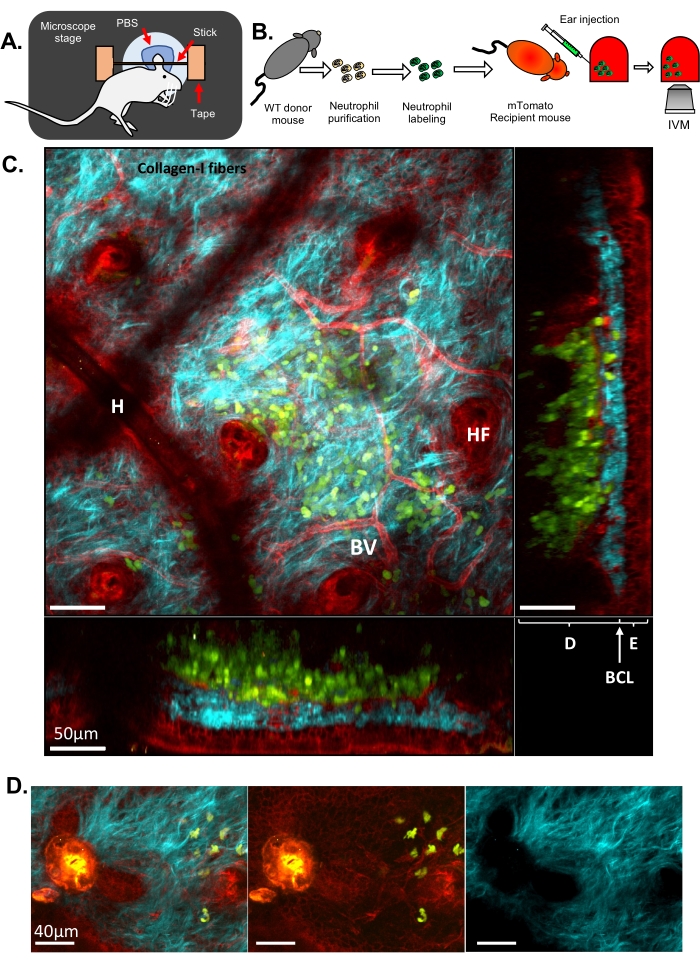
Figura 1: MIV de neutrófilos na pele da orelha do camundongo. (A) Desenho esquemático da configuração da orelha no estágio do microscópio. (B) Fluxograma experimental. (C) Imagem representativa da pele da orelha de um camundongo mTomato injetado com neutrófilos marcados com fluorescência, com diferentes projeções. Folículo piloso (HF), vaso sanguíneo (BV), epiderme (E), derme (D), camada basocelular (BCL) e artefato capilar (devido a um cabelo residual na superfície da pele, H). (D) Imagem representativa da pele do camundongo após uma lesão estéril por laser: canal azul (direita), canais verde e vermelho (meio), imagem mesclada (esquerda). A lesão é visível à esquerda da imagem por uma forte emissão de autofluorescência nos canais verde e vermelho, bem como uma ruptura da ECM observada pela formação de um buraco nas fibras de colágeno-I. Em C e D, Verde: neutrófilos; Vermelho: tecido hospedeiro de camundongo; Ciano: Colágeno-I SHG. Clique aqui para ver uma versão maior desta figura.

Figura 2: Lapso de tempo de migração de neutrófilos mGFP em uma orelha de camundongo WT. (A) Fluxograma experimental. (B) Imagens estáticas representativas do filme 3. (C) Renderização de volume da mesma célula para visualizar a organização 3D da membrana. A área de alta dinâmica da membrana é ilustrada por uma seta (vermelha para retração e azul para protrusão). (D) Visualização aproximada e inclinada do volume celular renderizado. Clique aqui para ver uma versão maior desta figura.

Figura 3: Pipeline de análise para quantificação da dinâmica da membrana coletada usando ISMic. (A) Determinação do contorno celular e repartição dos pontos de contorno (100 pontos de contorno) entre dois quadros consecutivos para neutrófilos mGFP descritos na Figura 2B. (B) Os limites coloridos representam a curvatura da membrana local determinada para cada ponto de limite. (C) A área local muda entre dois quadros consecutivos (atual: azul e próximo: vermelho). As áreas verdes representam os resultados de rastreamento do movimento local da membrana. As setas amarelas indicam a direção geral do deslocamento da membrana. (D) Cimógrafo de curvatura de limite da célula ao longo do tempo. O eixo vertical representa os índices de pontos de contorno onde 1 e 100 representam a parte traseira da célula de acordo com sua direção de migração. (E) Quimógrafo de mudança de área local refletindo a protrusão da membrana (vermelho) e a retração da membrana (azul) da célula ao longo do tempo. Clique aqui para ver uma versão maior desta figura.
Filme 1: Neutrófilos marcados em verde visualizados em uma orelha de camundongo mTomato usando IVM. Vermelho: mTomato tecido de camundongo hospedeiro. Ciano: Colágeno-I SHG; Verde: neutrófilo. Por favor, clique aqui para baixar este filme.
Filme 2: IVM de neutrófilos migrando em uma pele de orelha de camundongo mTomato. Os vídeos são projeções de intensidade máxima de uma pilha de imagens adquirida por ͂27 min com uma taxa de quadros de 5 quadros/s. Vermelho: mTomato tecido de camundongo hospedeiro. Ciano: Colágeno-I SHG; Verde: neutrófilo. Por favor, clique aqui para baixar este filme.
Filme 3: ISMic da remodelação da membrana durante a migração de neutrófilos em uma orelha de camundongo WT. Os vídeos são projeções de intensidade máxima de uma pilha de imagens adquirida por ͂8 min com uma taxa de quadros de 10 quadros/s. Vermelho: mTomato tecido de camundongo hospedeiro. Ciano: Colágeno-I SHG; Verde: neutrófilo mGFP; Verde claro: neutrófilo renderizado. Por favor, clique aqui para baixar este filme.
Discussão
Apesar de décadas de avanços no campo da migração celular e remodelação da membrana, muito poucos estudos empregaram a IVM para visualizar características subcelulares em animais vivos. Os procedimentos descritos neste protocolo fornecem uma ferramenta poderosa para obter novos insights sobre a migração de neutrófilos em animais vivos e, mais especificamente, sobre a remodelação da membrana plasmática durante esse processo. Essa abordagem possibilita investigar a migração de neutrófilos em condições fisiológicas, considerando a complexidade inerente do microambiente tecidual. De fato, o uso de MPM permite a visualização de múltiplas características dentro do tecido hospedeiro usando uma combinação de cepas de camundongos que expressam marcadores fluorescentes selecionados, marcação de tecido exógeno, excitação de fluorescência endógena e sinais gerados por SHG ou THG12,13.
Um problema potencial a ser considerado neste procedimento é o fotodano. Embora o MPM seja geralmente mais seguro do que a microscopia confocal em relação ao fotobranqueamento e fototoxicidade, deve-se ter cuidado ao obter imagens de tecidos vivos34. A fototoxicidade pode prejudicar drasticamente os resultados, criando artefatos de imagem que variam de pequenas manchas brilhantes a áreas maiores de tecido danificado ou inibindo / estimulando uma variedade de vias intracelulares. Para evitar a fototoxicidade, a potência do laser deve ser mantida no mínimo e os controles apropriados devem ser projetados para verificar se as condições fisiológicas são mantidas (por exemplo, medição do fluxo sanguíneo, sondas para estresse oxidativo)35,36. Além disso, nesse procedimento específico, que envolve a pele, as cepas albinas são altamente recomendadas, pois a melanina presente em animais de pêlo escuro é mais sensível à fototoxicidade 36,37,38.
Entre as principais limitações do procedimento estão o sistema de microscópio utilizado e a natureza dos neutrófilos. Embora o uso do MPM aumente significativamente a profundidade da imagem do tecido quando comparado com outras técnicas de microscopia de luz (por exemplo, disco confocal, giratório), a capacidade de visualizar a dinâmica subcelular na orelha é restrita às camadas mais externas do tecido (80-100 μm). Isso se deve ao intenso espalhamento de luz produzido pela espessa camada de ECM, dificultando a investigação da migração nas camadas mais profundas. Outra limitação é o fato de que os neutrófilos têm vida muito curta e não podem ser mantidos em cultura por tempo suficiente para realizar técnicas de edição de genes. Isso pode ser superado pela engenharia de camundongos para produzir neutrófilos sem genes específicos ou abrigando mutações selecionadas, o que obviamente aumenta os custos e a duração da pesquisa.
Os procedimentos descritos aqui, embora projetados para investigar a dinâmica da membrana, podem ser adaptados para abordar qualquer questão biológica celular não apenas em neutrófilos, mas também em outros tipos de células imunes e células migratórias. As informações coletadas por meio de IVM de baixa ampliação sobre comportamentos celulares (por exemplo, fenótipo migratório, velocidade celular e direcionalidade22) podem ser complementadas e correlacionadas com informações mecanicistas adquiridas por meio do ISMic sobre reposicionamento de organelas, secreção de proteínas, endocitose, dinâmica nuclear, dinâmica do cálcio, organização do citoesqueleto e netose. O uso de manipulações farmacológicas e/ou genéticas pode destacar o papel de vias moleculares específicas no processo de interesse, tornando esta uma abordagem única e muito poderosa.
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Esta pesquisa foi apoiada pelo programa de pesquisa interna dos Institutos Nacionais de Saúde, Instituto Nacional do Câncer, Centro de Pesquisa do Câncer.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | USA Scientific | 4036-3204 | |
| 15 mL tubes | Corning | 430766 | |
| 1 mL syringe | Covidien | 8881501400 | |
| 27 G needle | Kendall | 827112 | |
| 27 G winged infusion set | Terumo | SV*27EL | |
| 30x objective | Olympus | UPLSAPO30XS | 1.05 NA, silicon oil immersion |
| 40x objective | Olympus | UPLSAPO40XS | 1.23 NA, silicon oil immersion |
| 60 mm dishes | Falcon | 353002 | |
| 6 mL syringe | Kendall | 8881516937 | |
| Acepromazine (10 mg/mL) | Vet one | 13985-587-50 | |
| ACK lysis buffer | Quality Biological | 118-156-101 | |
| Balance | AND | EK-1200A | |
| BSA | Sigma Aldrich | A9647 | |
| Cell strainer 40 µm | Sigma Aldrich | CLS431750 | |
| Fiji | ImageJ | N/A | Image visualization/analysis software |
| Fluoview Software | Olympus | N/A | Acquisition software |
| FVB mouse strain | Jackson | N/A | FVB background |
| Gas Anesthesia system | Patterson veterinary | 07-8915712 | Link 7 model |
| Green Cell tracker | Thermo | C2925 | Solubilized in cell culture grade DMSO to reach 1 mM concentration (1000x) |
| Hair removal cream | Nair | N/A | |
| HBSS (w/o Ca2+, Mg2+) | Gibco | 14175-095 | |
| HEPES 1 M pH 7.3 | Quality Biological | 118-089-721 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ML | |
| Histopaque 1991 | Sigma Aldrich | 11191-100ML | |
| Imaris | Bitplane | N/A | Image visualization/analysis software |
| Isoflurane | Vet one | 13985-528-40 | |
| Ketamine (100 mg/mL) | Vet one | 13985-584-10 | |
| LyzM-cre x mT/mG | generated in the lab | N/A | C57BL/6J background |
| Manual micromanipulator | WPI | M3301R | |
| MATLAB | MatWorks | N/A | Analysis software |
| mtomato mouse strain | generated in the lab | N/A | mT/mG, FVB background |
| Multiphoton laser | Spectra Physics | Insight DS+ | |
| Multiphoton Microscope | Olympus | MPE-RS | |
| Nanofil 10 µL syringe | WPI | NANOFIL | |
| Nanofil 33 G needle | WPI | NF33BV-2 | |
| Objective heater | Bioptechs | N/A | |
| Objective heater controller | Bioptechs | 150803 | |
| Ophtalmic ointment | Major | NDC 0904-6488-38 | |
| Oxygen concentrator | Caire | VisionAire 5 | |
| PBS (w/o Ca2+, Mg2+) | Quality Biological | 114-058-131 | |
| Saline | Quality Biological | 114-055-101 | |
| Stage heater | Okolab | N/A | |
| Stage heater controller | Okolab | H401-T | |
| Surgical tape | 3M | 1538-1 | Hypoallergenic |
| Syringe driver | Harvard Apparatus | PHD Ultra | |
| Warming Pads | Parkland Scientific | A2789B | |
| Warming Pump | Parkland Scientific | TP-700 | |
| Xylazine (100 mg/mL) | Vet one | 13985-704-10 |
Referências
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2 (4), 2369-2392 (2012).
- Oudin, M. J., Weaver, V. M. Physical and chemical gradients in the tumor microenvironment regulate tumor cell invasion, migration, and metastasis. Cold Spring Harbor Symposia on Quantitative Biology. 81, 189-205 (2016).
- Devreotes, P., Horwitz, A. R. Signaling networks that regulate cell migration. Cold Spring Harbor Perspectives in Biology. 7 (8), 005959 (2015).
- Alexandrova, A. Y., Chikina, A. S., Svitkina, T. M. Actin cytoskeleton in mesenchymal-to-amoeboid transition of cancer cells. International Review of Cell and Molecular Biology. 356, 197-256 (2020).
- Masedunskas, A., et al. Intravital microscopy. Bioarchitecture. 2 (5), 143-157 (2012).
- Wagner, R. . Explanatory panels on physiology and development history 1839. , (1839).
- Yaniv, K., et al. Live imaging of lymphatic development in the zebrafish. Nature Medicine. 12 (6), 711-716 (2006).
- Vinegoni, C., et al. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. Journal of Visualized Experiments. (30), e1510 (2009).
- Sack, F. -. U. Intravital microscopy of pulmonary microcirculation after single lung transplantation in pigs. Transplantation Proceedings. 38 (3), 737-740 (2006).
- Rehberg, M., Krombach, F., Pohl, U., Dietzel, S. Label-free 3D visualization of cellular and tissue structures in intact muscle with second and third harmonic generation microscopy. PloS One. 6 (11), 28237 (2011).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Intravital third harmonic generation microscopy of collective melanoma cell invasion: Principles of interface guidance and microvesicle dynamics. Intravital. 1, 32-43 (2012).
- Poole, J. J. A., Mostaço-Guidolin, L. B. Optical microscopy and the extracellular matrix structure: A review. Cells. 10 (7), 1760 (2021).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Third harmonic generation microscopy of cells and tissue organization. Journal of Cell Science. 129 (2), 245-255 (2016).
- Ebrahim, S., et al. Dynamic polyhedral actomyosin lattices remodel micron-scale curved membranes during exocytosis in live mice. Nature Cell Biology. 21 (8), 933-939 (2019).
- Shitara, A., et al. Cdc42 negatively regulates endocytosis during apical membrane maintenance in live animals. Molecular Biology of the Cell. 30 (3), 324-332 (2019).
- Masedunskas, A., et al. Role for the actomyosin complex in regulated exocytosis revealed by intravital microscopy. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13552-13557 (2011).
- Subramanian, B. C., et al. The LTB4-BLT1 axis regulates actomyosin and β2-integrin dynamics during neutrophil extravasation. The Journal of Cell Biology. 219 (10), 201910215 (2020).
- Yan, S. L. S., Hwang, I. -. Y., Kamenyeva, O., Kehrl, J. H. In vivo F-Actin filament organization during lymphocyte transendothelial and interstitial migration revealed by intravital microscopy. iScience. 16, 283-297 (2019).
- Porat-Shliom, N., et al. In vivo tissue-wide synchronization of mitochondrial metabolic oscillations. Cell Reports. 9 (2), 514-521 (2014).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10515-10520 (2015).
- Calvo-Rodriguez, M., et al. Increased mitochondrial calcium levels associated with neuronal death in a mouse model of Alzheimer's disease. Nature Communications. 11, 2146 (2020).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Li, J. L., et al. Intravital multiphoton imaging of immune responses in the mouse ear skin. Nature Protocols. 7 (2), 221-234 (2012).
- Swamydas, M., Lionakis, M. S. Isolation, purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments:JoVE. (77), e50586 (2013).
- Rose, S., Misharin, A., Perlman, H. A novel Ly6C/Ly6G-based strategy to analyze the mouse splenic myeloid compartment. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (4), 343-350 (2012).
- Lakschevitz, F. S. Identification of neutrophil surface marker changes in health and inflammation using high-throughput screening flow cytometry. Experimental Cell Research. 342 (2), 200-209 (2016).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. Journal of Visualized Experiments:JoVE. (17), e745 (2008).
- . MATLAB - Bio-Formats 6.1.0 documentation Available from: https://docs.openmicroscopy.org/bio-formats/6.1.0/users/matlab/index.html (2022)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9, 62-66 (1979).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179, 298-310 (1996).
- Xu, C., Prince, J. L. Snakes, shapes, and gradient vector flow. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7 (3), 359-369 (1998).
- Driscoll, M. K., et al. Automated image analysis of nuclear shape: what can we learn from a prematurely aged cell. Aging. 4 (2), 119-132 (2012).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Tauer, U. Advantages and risks of multiphoton microscopy in physiology. Experimental Physiology. 87 (6), 709-714 (2002).
- Débarre, D., Olivier, N., Supatto, W., Beaurepaire, E. Mitigating phototoxicity during multiphoton microscopy of live Drosophila embryos in the 1.0-1.2 µm wavelength range. PloS One. 9 (8), 104250 (2014).
- Masedunskas, A., et al. Intravital microscopy: a practical guide on imaging intracellular structures in live animals. Bioarchitecture. 2 (5), 143-157 (2012).
- Ng, L. G., et al. Visualizing the neutrophil response to sterile tissue injury in mouse dermis reveals a three-phase cascade of events. The Journal of Investigative Dermatology. 131 (10), 2058-2068 (2011).
- Wu, X. S., et al. Melanoregulin regulates a shedding mechanism that drives melanosome transfer from melanocytes to keratinocytes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 2101-2109 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados