Method Article
生理条件下での細胞内膜リモデリングを調査するためのマウス皮膚における好中球移動のイメージング
要約
好中球の移動は、化学誘引物質とその細胞外微小環境との相互作用に応答した原形質膜の急速かつ連続的なリモデリングに依存しています。本明細書に記載されるのは、麻酔マウスの耳に注入された好中球における膜リモデリングの動態を調査するための生体内細胞内顕微鏡法に基づく手順である。
要約
免疫細胞の動員と組織機能の研究は、過去20年間にわたって非常に活発な分野でした。好中球は、感染時や組織損傷時に炎症部位に到達し、自然免疫応答に関与する最初の免疫細胞の一つです。これまでに、好中球の遊走は、均一な刺激に基づくさまざまなin vitro実験システム、またはアガロースまたはマイクロ流体チャネルの下での閉じ込められた遊走を使用して、成功裏に視覚化されてきました。しかし、これらのモデルは、好中球が生体内で遭遇する複雑な微小環境を再現するものではありません。生体内細胞内顕微鏡(ISMic)などの多光子顕微鏡(MPM)ベースの技術の開発は、生理学的条件下で細胞内分解能で好中球ダイナミクスを可視化および調査するための独自のツールを提供します。特に、麻酔をかけた生きたマウスの耳は、そのアクセスの容易さと外科的曝露の欠如により、好中球間質性移動をリアルタイムで追跡するための実験的利点を提供します。ISMicは、細胞プロセスと、さらに重要なことに、細胞内プロセスを経時的に3D(4D)で追跡するために必要な光学的解像度、速度、および取得深度を提供します。さらに、間質性微小環境(すなわち、血管、常在細胞、細胞外マトリックス)のマルチモーダルイメージングは、選択した蛍光マーカーを発現するトランスジェニックマウス、蛍光プローブによる外因性標識、組織内因性蛍光、および第2/第3高調波生成シグナルの組み合わせを使用して容易に達成できます。このプロトコルでは、1)マウスの耳への養子移植のための好中球の調製、2)最適な細胞内イメージングのためのさまざまな設定、3)生理学的応答を維持しながら運動アーチファクトを最小限に抑える戦略、4)ISMicを使用して好中球で観察された膜リモデリングの例、および5)in vivoで移動する好中球における膜リモデリングの定量分析のためのワークフローについて説明します。
概要
指向性細胞遊走は、発生、免疫応答、組織修復、腫瘍の開始、進行、播種など、さまざまな生理学的および病理学的プロセスで発生する重要なイベントです1,2。このプロセスは、原形質膜で同族の受容体によって感知され、その後、複雑な細胞内シグナルに変換される特定の細胞外走化性シグナルに依存しています。これらの経路は、細胞骨格の局所的な活性化、膜の輸送とリモデリング、細胞分極3などの一連の応答を通じて細胞移動を活性化します。細胞遊走には、間葉系とアメーバ4の2つの異なるタイプがよく特徴付けられています。間葉系の遊走は比較的遅く(<1 μm/分)、細胞と細胞外マトリックス(ECM)との間の強い接着に依存し、メタロプロテアーゼによって誘発されるマトリックスの分解に依存します。対照的に、アメーバ遊走は、炎症の合図に迅速に反応する免疫細胞の特徴であり、より速く(>10μm/分)、ECMを通過するために弱い接着を利用します。モダリティに関係なく、細胞遊走は、細胞の前縁に突出構造を生成する結果、原形質膜の絶え間ないリモデリングを必要とし、その結果、後部の膜の収縮と緊密に調整される1。
これらの細胞内プロセスの根底にある分子メカニズムを解明するためには、移動する細胞の膜の動態を適切な時間的および空間的分解能で可視化することが基本です。さらに、膜リモデリングは、移動する細胞を取り巻く組織微小環境の特性に強く影響されるため、このプロセスを生きた動物の中の天然組織で直接イメージングすることが重要です。これは、生体内顕微鏡(IVM)5を使用して実現されます。最初のIVMイメージングは~200年前に行われ、白血球の血管外漏出が単純な経光顕微鏡で可視化され6、その後、IVMは主にゼブラフィッシュやショウジョウバエなどの半透明モデル生物に使用されました7,8。過去20年間で、IVMは、マウス、ラット、およびブタなどの大型哺乳類の細胞プロセスを調査するために成功裏に使用されてきました5,9。これは、1)共焦点顕微鏡および多光子(MP)顕微鏡法の大幅な発展と、2)CRISPR-Cas9などの遺伝子編集技術の台頭により、蛍光タグ付きタンパク質やレポーターを発現するためのさまざまな動物モデルの迅速なエンジニアリングを可能にしたために可能になりました。さらに、腫瘍の開始、細胞遊走、免疫応答などのプロセスにおける個々の細胞とその微小環境の可視化は、血管系を標識するための色素の全身導入など、他の形態の外因性標識10,11と、第2高調波発生(SHG)10によるコラーゲンなどの内因性分子の興奮の両方によって可能になった。12および第3高調波発生(THG)11,13による神経線維。最後に、心拍や呼吸による運動アーチファクトを最小限に抑える技術の向上により、生体内細胞内顕微鏡(ISMic)が開発され、研究者は生体内で観察されるのと同様の解像度で、生きた動物でいくつかの細胞内イベントを直接画像化し、調査することができるようになった14,15,16,17 .ISMicの例としては、エキソサイトーシス14,15,16,17およびエンドサイトーシス15における細胞骨格ダイナミクスの調査、細胞遊走17,18における細胞骨格ダイナミックリモデリング17,18、ミトコンドリアの局在化および代謝19,20、脳21におけるカルシウムシグナル伝達の調査が含まれる。
このプロトコルでは、ISMicを使用して生きたマウスの耳の皮膚に好中球が移動する際の細胞膜リモデリングを細胞内分解能で調査するためのさまざまな手順と手順について詳しく説明します。このアプローチは、前述のプロトコル22,23に基づいており、より高い空間的および時間的解像度を達成するために適合されている。
プロトコル
すべての動物実験および手順は、米国国立がん研究所(米国国立衛生研究所、メリーランド州ベセスダ)の動物管理および使用委員会(プロトコルLCMB-031およびLCMB-035)によって承認され、関連するすべての倫理規制に準拠していました。実験には、生後2か月から6か月の雄マウスと雌マウスの両方を使用しました。 mT/mG および野生型(WT)宿主マウスはFVB/NJバックグラウンドにあり、 LyzM-Cre x mTmG マウスはC57BL/6バックグラウンドにあります。
1. 試薬・ツールの材料・調製
- チューブ、ディッシュ、針/シリンジにPBS + 1%BSA(カルシウムとマグネシウムなし)を攪拌しながら一晩コーティングします。
- 動物の作業に使用する表面や道具/器具は、70%エタノールを使用するか、オートクレーブで慎重に清掃してください。
- 好中球の精製には、以下を準備します:3 x 15 mLチューブ、1 x 60 mmディッシュ、1 x 1.5 mLチューブ。10 mM HEPES(pH 7.3)を含むHBSS;赤血球溶解液(ACK);ヒストパケ1077;とHistopaque 1119。
- 好中球注射の場合は、低容量シリンジ 1 個 (10 μL)、33 G 斜め針 1 個、イソフルラン、麻酔液 (ケタミン、キシラジン、アセプロマジンをそれぞれ 80 mg・kg-1、2 mg・kg-1 、4 mg・kg-1 の生理食塩水に溶かします) を準備します。
2. ドナーマウスからの好中球の精製
- ドナーマウスを地域の機関規制に従って安楽死させます。
- 動物から長骨(大腿骨、脛骨、上腕骨)を収集し、骨の完全性を維持し、収集中に骨の頭を切らないように注意を払います24。
- BSAコーティングされた60mmの皿で、筋肉と脂肪組織を取り除きます。骨の頭を切開して骨髄にアクセスし、HBSSを充填したシリンジ(27G針)を使用して骨髄を洗い流し、均質化します。
- 40 μmストレーナーを使用して溶液を15 mL BSAコーティングチューブにろ過し、室温(RT)で400 x g で5分間遠心分離します。
- 上清を吸引し、ペレットを1 mLのACKに再懸濁して30秒間赤血球を溶解し、次に9 mLのHBSSを加えて溶解を停止します。溶液を400 x g でRTで5分間遠心分離します。
- 15 mL BSAコーティングチューブの底部に4 mLの1119 Histopaqueを静かに置き、さらに4 mLの1077 Histopaqueを上部に穏やかに重ねることで、密度ステップグラジエントを調製します。2つのレイヤーが混ざらないように特に注意してください。
- 上清を吸引し、細胞ペレットを2mLのHBSSに再懸濁します。上記で準備したステップグラジエントの上に溶液を穏やかに重ねます。1,000 x g で30分間、加速速度と減速速度をできるだけ低くしてRTで回転します(「ブレーキなし」が望ましい)。
- チューブの上部から、1077 Histopaque 層の半分を静かに吸引します。1077 Histopaque 層の残りの半分と 1119 Histopaque 層の上半分を新しい BSA コーティング チューブに集めます。2つの密度層の間の曇った細胞懸濁液には、主に好中球が含まれています。
- HBSSを加えて最終容量15 mLにし、チューブを反転させて穏やかに混合します。400 x g で5分間室温で遠心します。
- 遠心分離後、細胞ペレットを再懸濁して10 mLのHBSSで洗浄し、室温で400 x g で5分間遠心します。この手順を繰り返してから、ペレットを15 mLのHBSSに再懸濁し、セルカウンターを使用して細胞数を決定します。最後に、細胞を1 mLのHBSSでスピンして再懸濁し、1.5 mLのBSAコーティングチューブに移します。
- 精製後、好中球懸濁液をBSAコーティングチューブ内に保持し、室温のチューブ回転子で30分間穏やかに攪拌し、標識および/または注入を行います。
注:精製が成功すると、マウスあたり10-20 x 106の好中球が95%の純度で得られます。純度は、以前に報告された好中球マーカー(Ly6G+、Ly6C-、Gr1+、およびCD11b+)25,26を用いて、フローサイトメトリーによって評価される。
注:ヒト末梢血およびマウス骨髄からの好中球精製に関するプロトコルは、以前に利用可能でした24,27。
3. 好中球の標識
注:好中球を視覚化するために、骨髄細胞がGFPと融合した膜標的ペプチドを発現する LyzM-Cre mT/mG マウスから好中球を精製しました。さらに、野生型(WT)マウスの精製好中球を in vitroで標識しました。次の手順では、精製した好中球を市販の細胞透過性緑色蛍光色素で標識するために使用される手順を説明しており、他の任意のMPM適合蛍光プローブにも適合させることができます。
- 1.5 mL BSAコーティングチューブ内の好中球懸濁液(WTマウスから精製)に緑色蛍光色素(メーカー推奨濃度、ここでは1 μM)を加えます。チューブローテーター内で穏やかに攪拌しながら、室温で30分間インキュベートします。
- HBSSを用いて3回洗浄し、室温で400 x g で5分間遠心し、ペレットを1 mLのHBSSに再懸濁します。
- BSAコーティングされたチューブ内の好中球懸 ?? 液を、注入手順までRTのチューブ回転子で穏やかに攪拌します。.
注:標識直後に行われる標識好中球の注入が非常に好ましい。ただし、必要に応じて、標識された好中球を標識後さらに10〜15分間攪拌下に置いておくことができますが、 in vivoでの好中球応答の完全性を損なうことはありません。長期間の攪拌(標識後60分以上)は、凝集、好中球死、 およびin vivoでの誤解を招く観察につながります。 - 注入の直前に、細胞ペレットを生理食塩水に再懸濁して、20μLあたり2〜5×106 細胞の密度になるようにします。
4. 好中球注射
注:麻酔は、地元の施設の動物管理および使用委員会のガイドラインに従って実施する必要があります。
- 動物を密閉チャンバーに入れ、酸素濃縮器に接続された校正済みの気化器を使用して3%〜5%イソフルラン(流量2 L /分)を投与します。
- 後足をつまんだときの足の離脱反射をテストすることにより、動物が意識を失っているかどうかを評価します。次に、動物を体温を維持するために保温パッド(37°C)に移します。イソフルラン(1%-2%;流量0.5 L / min)をノーズコーンを通して投与し続けます。.
安全上の注意:有毒なイソフルランへの人員の曝露を制限するために、循環イソフルランを再捕捉するためのフィルタリングユニットを備えたディスペンサーシステムの使用をお勧めします。 - 画像品質を最適化するには、細かいトリマーを使用して耳から毛を取り除きます。この手順は、実験の1日か2日前に行うこともできます。
注:脱毛クリームの使用は、マウスの皮膚の炎症反応を悪化させ、イメージングアーチファクトを導入することが知られているため、お勧めしません。 - 動物を横に置きます。サージカルテープを使用して、耳の端を保持し、ウォーミングパッドに沿って平らにします。耳への損傷を防ぐために、テープをそっと貼り付けます。
- 33G針を装備したシリンジに好中球懸濁液(20μLあたり2-5×106 細胞)を充填し、マイクロマニピュレーターに装着します。
注:加温パッド上の針と耳の間の注入角度は、組織の損傷を最小限に抑え、細胞注入の成功率を高めるために、10°から30°の間でなければなりません。 - 針を(面角を上にして)耳に向かってゆっくりと動かし、ゆっくりと皮膚に穴を開けます。針が皮膚の内側に入ったら、ピストンをゆっくりと押して、2〜3μLの細胞懸濁液を送液します。
注:血管が見える領域は、血管を損傷すると、注射に対する望ましくない複雑な免疫反応やイメージングの問題を引き起こすため、避ける必要があります。 - 耳の2〜3の異なる領域、できれば2〜3mm間隔で注入を繰り返します。細胞懸濁液で耳を「いっぱい」にしないでください。
注:注射は耳の中央で行う必要があります。耳の周辺部は細く、傷みやすいため取り扱いに注意が必要ですが、中央部は太く、血管が大きく、毛包が少なく、より多くの注入量に耐えることができます。 - サージカルテープを慎重にはがし、監督下で動物が意識を取り戻すのを待ちます。イメージングの前に動物を1時間休ませて、組織と細胞を注射手順から回復させます。
5. IVMのための麻酔
注:より深い麻酔は、心拍と呼吸による運動アーチファクトを減らすことにより、画像品質を大幅に向上させます。好中球を注入したマウスには化学麻酔がかけられ、ガスによる麻酔よりも深い鎮静作用が得られます。麻酔は、地元の施設の動物管理および使用委員会のガイドラインに従って実施する必要があります。
- 好中球注射からの回復から1時間後、生理食塩水にキシラジン/ケタミン/アセプロマジンの混合物(それぞれ80 mg・kg-1、2 mg・kg-1、 4 mg・kg-1)を含む皮下注射により動物に麻酔をかけます。.
注:結果の再現性と信頼性を確保するために、麻酔時から実験終了まで、加温ポンプに接続された加熱パッドまたは水循環パッドを使用して動物を温めておく必要があります。 - 1時間を超えて麻酔を維持するには、ケタミン/アセプロマジンの混合物(それぞれ40 mg・kg-1および2 mg・kg-1 )を40分ごとに皮下に注入します。.麻酔をかけたマウスを定期的に監視し、足の離脱反射をテストして意識の兆候がないか確認します。
- また、1時間以上経過する画像検査では、麻酔時の角膜乾燥を防ぐとともに、生理食塩水(1時間あたり200μL)の皮下注射により体の水分補給を維持するために、無菌の非薬物用眼科用軟膏を眼に塗布します。
注:あるいは、デジタル制御の灌流ベースのシステムを使用して、麻酔液の定期的かつスムーズな注入を確保し、および/または液体を供給することもできます。自動シリンジドライバーは、必要な量の麻酔薬を供給するように設定でき、長時間の水分補給を提供します。この目的のために、翼のある注入針を動物の背側皮膚に皮下に挿入し、外科用テープで固定することができる。
6. イメージング
注:ここで説明する動物のセットアップとイメージングパラメータは、異なる蛍光色素からの放出を励起し、同時に収集するための単一のレーザーラインを備えた倒立多光子顕微鏡用に最適化されています。
- 麻酔をかけた動物を顕微鏡ステージに置く前に、顕微鏡の電源がオンになっていて、ステージとレンズの両方が37°Cに予熱されていることを確認してください。 ステージの穴を、加熱されたレンズと位置合わせされたガラスカバースリップ(厚さ#1または1.5)で覆います。
- 動物を慎重にステージに移動します。イメージングが長期間(>1時間)計画されている場合は、眼科用軟膏を塗布し、上記のように翼型注入ベースの ?? 流システムを固定します。.
- カバーガラスの中央に生理食塩水を一滴垂らし、その上に好中球を注入した耳を置きます。カバースリップの中央を横切る滅菌綿棒を使用して耳をそっと平らにし、エアポケットを取り外します。
注:耳とカバースリップの間に生理食塩水(またはPBS)を塗布すると、エアポケットによる光の屈折が減少するため、均一な屈折率と優れた画像品質が保証されます。 - 木の棒(綿棒から取り外したもの)を動物の頭に近い耳の側面にそっと押し付け、テープでロックして耳を固定します(図1A)。
注:固定された木製の棒は、心拍や呼吸による運動アーチファクトを最小限に抑え、画像品質を劇的に向上させます。重要なのは、木の棒は、血流を損なうことなく耳を安定させるのに十分なだけ固定する必要があるということです。 - 顕微鏡の接眼レンズを使用して、関心のある領域を見つけ、多光子取得モードに切り替えます。
- レーザー励起波長を900-930 nmに設定すると、GFP/緑色蛍光色素、mTomato、およびコラーゲン-I(SHG経由 )を同時に取得できます。
- 放出された光を収集するために、検出器に適切なミラーとフィルターの組み合わせを設定します(バンドパスフィルター:青= 410-460 nm、緑= 495-540 nm、赤= 580-640 nm)。
注:注入された好中球は、緑色蛍光色素で標識すると、強い緑色蛍光を示し、耳のより深い部分に注入しても顕微鏡の接眼レンズの下で見ることができます。 - ハードウェア構成に最も適した設定を決定します。遊走細胞を30秒から1分間隔で追跡できる場合でも、細胞内イベントをより速い速度(少なくとも<10秒間隔)で画像化します。以下の例では、従来のIVMとISMicの違いを示すために、2つの異なるイメージングセットアップが示されています。
- 従来のIVMアプローチでは、細胞遊走を追跡し、宿主マウス組織を調査する(図1)場合、30倍レンズと画像サイズ512×512ピクセル(ピクセルサイズ0.83μm)のガルボスキャナーを使用し、ステップサイズ2μmの電動ステージを使用してz軸変位を設定し、30秒ごとに30μmの深さのボリュームをイメージングすることができます。
- ISMicのアプローチでは、高倍率・高分解能で高ダイナミックな膜リモデリングを行う(図2)では、40倍レンズと3倍平均で画像サイズ512×512ピクセル(画素サイズ0.25μm)のレゾナントスキャナーを使用し、ステップサイズ1μmのピエゾでz軸変位を設定します。 4〜5秒ごとに20μmの深さのボリュームのイメージングが可能です。
- 滅菌レーザー損傷を誘発することにより、好中球の移動を引き起こします。励起レーザーを、組織の狭い領域(20μm×20μm)に少なくとも80mW22に達するのに十分な高出力で10秒間集束します。
- レーザー誘発性損傷は、すべてのチャネルに現れる強力な自己蛍光シグナルと、その結果として生じるコラーゲン配列の変化によって特定されます(図1D)。
注:信頼性の高い結果を得るためには、常に血管からできるだけ離れた場所に損傷を誘発する必要があります。破裂すると、組織に放出された血液細胞がイメージング品質に影響を与えるだけでなく、全体的に強力な免疫反応を引き起こします。 - 実験の最後にデータを保存して、さらに分析できるようにします。
- 地元の機関のガイドラインに従って動物を安楽死させます。必要に応じて、組織を採取して固定し、さらに処理することができます。
7. 代表的なデータ分析
注:データは、顕微鏡ソフトウェア、サードパーティソフトウェア、またはカスタマイズされたプログラムのいずれかで視覚化および分析できます。使用される手順とツールは、研究者の特定のニーズによって異なります。ここに示されているのは、移動する好中球の前縁と後部の膜の曲率と局所領域の変化を定量化するワークフローの一例です。
- ImarisまたはFijiでイメージングファイルを開き、好中球の移動を4Dで視覚化し、実験の品質を判断します。
注:ImarisとFijiは、いくつかの顕微鏡ブランドのイメージング形式を読み取ることができます。 - 次の手順で、カスタマイズされた MATLAB コード スクリプトを実行してデータを処理します。選択したイメージングファイルを MATLAB 用の Bio-Formats28 パッケージで読み取ります。3Dボリュームの各フレームをOtsuアルゴリズム29 でセグメント化して、個々のセルを識別する。
- 最小変位基準30に基づいて識別されたオブジェクトを追跡する。
- オブジェクトのアクティブな輪郭と境界を決定します。
- 時間枠内で識別された各オブジェクトの最大投影を生成します。
- MATLAB の関数 bwboundaries をステップ 7.2 で識別された各オブジェクトの最大射影に適用して、100 個の境界点を生成します。
- 動的等高線アルゴリズムで特定された境界点を最適化し、http://www.iacl.ece.jhu.edu/static/gvf/ 経由でダウンロードしたMATLABパッケージの関数を使用して、サブピクセル精度31(図3A)を達成します。
- オブジェクトの境界と、ステップ 7.3 のトラッキングによって決定されたオブジェクトの軌道インデックスを元の画像の最大投影と重ね合わせて、視覚化と手動チェック用の 2D オーバーレイ ムービーの出力を生成します。
- オーバーレイされたムービーで、非セルオブジェクト、接触しているオブジェクト、および境界が不完全なオブジェクトを除外して、移動セルとして識別されたすべてのオブジェクトを手動で選択します。各セルの軌跡のトラッキング インデックス、開始フレーム、終了フレームをスプレッドシートに記録し、MATLAB コード スクリプトによって実装される次の手順の入力として使用します。
- 各フレームから次のフレームまでのセル境界点を、最小変位基準に従って追跡します。MATLAB の 関数 Polyarea を使用して、2 つの連続する時間枠で隣接する境界点によって下線が引かれた面積を計算します (図 3C)。ローカル セル境界がセルから外側に移動する場合は、領域の変更に正の符号を割り当てます。ローカル セルの境界がセルの内側に移動する場合は、領域の変更に負の符号を割り当てます。
- 各フレームの各境界点における局所的な膜の曲率を測定するには、隣接する境界点を円(片側5個、合計11個)32 に適合させる(図3B)。
- MATLAB の imagesc 関数 (図 3D、E) を使用してキモグラフを生成し、細胞内の特徴の経時的な変化を示し、細胞の位置に関連付けます。
結果
ここでは、細胞内分解能と細胞内分解能をそれぞれ提供する従来のIVMとISMicを示すために、2つの異なる結果セットを示します。第1の例では、野生型(WT)マウスから好中球を精製し、細胞質を染色するためにCell Tracker Greenで標識し、原形質膜を標的とする蛍光タンパク質を発現するトランスジェニックマウス(mTomatoマウス、別名mT/mG33、 図1 、 動画1、動画2)に注射した。このレシピエントマウスは、血管、常在細胞、毛包などの耳組織の構造的特徴(図1C および 動画1)をIVMベースのアプローチ(ステップ6.8.1) で 可視化することを可能にしました。SHG(励起の半分の波長で検出) を介して 明らかになったコラーゲン線維は、好中球が注入された真皮の複雑なネットワークに配置されました。毛包(HF)の縁に沿って、上皮細胞(すなわち、ケラチノサイト)の層が観察されました。時折、皮膚の局所的な陥凹をもたらす残留毛からのアーティファクトが視覚化されました(H)。レーザー誘発性の損傷は、すべてのチャネルで検出される強力な自家蛍光とコラーゲン配置の変化により、容易に視覚化できました(図1D)。皮膚の3D構造と注入された好中球の局在化のより完全なビューは、外層から内層までの皮膚のZスタックと3Dボリュームレンダリングを描いた ムービー1で評価できます。タイムラプスイメージングでは、好中球が耳の皮膚をサンプリングし、ECMや宿主組織と相互作用していることが示されました(動画2)。この分解能でイメージングし、30秒ごとにZスタックを取得することで、細胞の追跡や運動性パラメータ(速度や方向性)の測定が可能になりますが、この分解能では膜リモデリングの精密かつ詳細な解析は困難です。
2番目の例では、LyzM-cre mT/mGマウスから精製したmGFP発現好中球をWT動物に注入したISMicアプローチ(ステップ6.8.2)により、膜リモデリングを評価しました(図2A、実験フローチャート)。ISMicプロトコル(動画3、図2Bの静止画)を用いてレーザー損傷を受けた場合、移動中の原形質膜の動的リモデリングが観察され、前縁での膜突起の形成と細胞後部の収縮が明確に可視化されます(図2、動画3)。ムービー3でハイライトされたタイムラプスシーケンスは、ECMとの相互作用の複雑さを明らかにしています。実際、好中球は間質性空間を通って移動し、繊維に沿って移動するか、繊維の間の空間を移動しました。最後に、曲率の変化や細胞の表と裏の面積変化などの定量的な側面を、各時点について定量化しました。図2Bに示した細胞を例にとり、細胞表面の基礎となる100の境界点の同定に基づくアルゴリズムパイプライン(ステップ7参照)を用いて、原形質膜の局所的なダイナミクスを解析しました(図3A)。局所的な曲率の変化(図3B)と原形質膜突起によって下線が引かれた領域(図3C)は、境界点ごとに計算され、キモグラフとして各時間枠で報告されました(図3D、E)。細胞の前面と背面の両方が、細胞の側面よりも高い湾曲を維持します(図3D)。負の領域の変化(収縮、青色の領域)は、正の領域の変化がより目立つ前縁(突起、赤色の領域)よりも、細胞の背面でより顕著になります(図3E)。
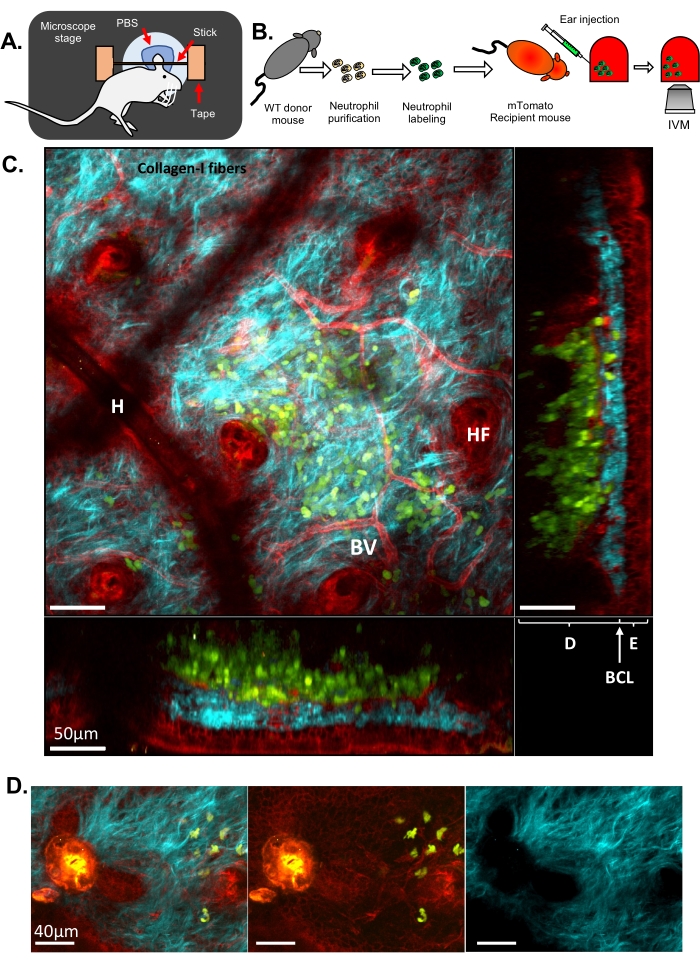
図1:マウスの耳の皮膚における好中球のIVM. (A)顕微鏡ステージ上の耳のセットアップの概略図。(B)実験フローチャート。(C)mTomatoマウスの耳の皮膚に蛍光標識好中球を注入した、異なる投影法の代表的な画像。毛包(HF)、血管(BV)、表皮(E)、真皮(D)、基底細胞層(BCL)、および毛のアーチファクト(皮膚表面の残留毛によるH)。(D)無菌レーザー損傷後のマウス皮膚の代表画像:青チャンネル(右)、緑と赤チャンネル(中央)、合成画像(左)。画像の左側には、緑と赤の両方のチャネルでの強い自家蛍光発光と、コラーゲン-I線維の穴の形成によって観察されるECMの破壊によって損傷が見られます。 C および Dでは、緑:好中球;赤:マウス宿主組織;シアン:コラーゲン-I SHG。 この図の拡大版を表示するには、ここをクリックしてください。

図2:WTマウスの耳の中を移動するmGFP好中球のタイムラプス。 (A)実験フローチャート。(B) 動画3の代表的な静止画です。(C)膜の3D組織を視覚化するための同じ細胞のボリュームレンダリング。膜ダイナミクスが高い領域は矢印で示されています(赤は収縮、青は突出)。(D)レンダリングされたセルボリュームのクローズアップおよび傾斜した視覚化。 この図の拡大版を表示するには、ここをクリックしてください。

図3:ISMicを使用して収集された膜動態の定量化のための解析パイプライン (A) 図2Bに記載されているmGFP好中球の細胞輪郭決定と2つの連続フレーム間の境界点再分配(100境界点)。(B)色付きの境界は、各境界点について決定された局所的な膜曲率を表します。(C)2つの連続するフレーム間のローカルエリアの変化(現在:青、次:赤)。緑色の領域は、局所的な膜運動の追跡結果を表しています。黄色の矢印は、膜の変位の一般的な方向を示しています。(D)時間の経過に伴う細胞の境界曲率キモグラフ。縦軸は境界ポイントのインデックスを表し、1 と 100 は移動方向に従ってセルの後部を表します。(E)細胞の膜突起(赤)と膜収縮(青)を経時的に反映する局所領域変化キモグラフ。 この図の拡大版を表示するには、ここをクリックしてください。
動画1:IVMを用いてmTomatoマウスの耳に可視化された緑色の標識好中球。 赤:mTomato宿主マウス組織。シアン:コラーゲン-I SHG;緑:好中球。 この映画をダウンロードするには、ここをクリックしてください。
動画2:mTomatoマウスの耳の皮膚で移動する好中球のIVM。 ビデオは、5フレーム/秒のフレームレートで27分間に取得した画像スタックの最大強度投影です。赤:mTomato宿主マウス組織。シアン:コラーゲン-I SHG;緑:好中球。 この映画をダウンロードするには、ここをクリックしてください。
動画3:WTマウス耳の好中球遊走中の膜リモデリングのISMic。 ビデオは、10フレーム/秒のフレームレートで8分間に取得した画像スタックの最大強度投影です。赤:mTomato宿主マウス組織。シアン:コラーゲン-I SHG;緑:mGFP好中球;ライトグリーン:好中球をレンダリング。 この映画をダウンロードするには、ここをクリックしてください。
ディスカッション
細胞遊走と膜リモデリングの分野では何十年にもわたる進歩が進んでいますが、生きた動物の細胞内の特徴を視覚化するためにIVMを使用した研究はほとんどありません。このプロトコルに記載されている手順は、生きた動物における好中球の移動、より具体的にはこのプロセス中の原形質膜のリモデリングに関する新たな洞察を得るための強力なツールを提供します。このアプローチにより、組織微小環境の固有の複雑さを考慮した生理学的条件下での好中球の移動を調べることが可能になります。実際、MPMを使用すると、選択した蛍光マーカーを発現するマウス系統、外因性組織標識、内因性蛍光の励起、およびSHGまたはTHGを介して生成されるシグナルの組み合わせを使用して、宿主組織内の複数の特徴を視覚化できます12,13。
この手順で考慮すべき潜在的な問題の1つは、光損傷です。MPMは、光退色および光毒性に関して、一般に共焦点顕微鏡法よりも安全であるが、生きた組織をイメージングする際には注意が必要である34。光毒性は、小さな明るい斑点から損傷した組織のより大きな領域まで、さまざまなイメージングアーチファクトを作成するか、さまざまな細胞内経路を阻害/刺激することにより、結果を大幅に妨げる可能性があります。光毒性を防ぐために、レーザー出力は最小限に抑えるべきであり、生理学的条件が維持されていることを確認するための適切な制御を設計する必要があります(例えば、血流の測定、酸化ストレスのプローブ)35,36。さらに、皮膚を含むこの特定の手順では、ダークコート動物に存在するメラニンが光毒性36,37,38に対してより敏感であるため、アルビノ株が強く推奨されます。
この手順の主な制限の中には、使用される顕微鏡システムと好中球の性質があります。MPMを使用すると、他の光学顕微鏡技術(共焦点、回転ディスクなど)と比較すると、組織イメージングの深さが大幅に増加しますが、耳の細胞内ダイナミクスを視覚化する能力は、組織の最も外側の層(80〜100μm)に制限されます。これは、厚いECM層によって生成される強い光散乱により、より深い層での移動を調査することが困難になるためです。また、好中球は非常に短命で、遺伝子編集技術を行うのに十分な期間、培養物に留まることができないという制約もあります。これは、特定の遺伝子を欠く、または選択された突然変異を持つ好中球を作製するようにマウスを操作することで克服できますが、これはもちろん研究コストと期間を増加させます。
ここで説明する手順は、膜のダイナミクスを調べるように設計されていますが、好中球だけでなく、他の免疫細胞タイプや遊走細胞の細胞生物学的な問題にも対処できるように調整できます。低倍率IVMを通じて細胞の挙動(例えば、移動性表現型、細胞速度、および方向性22)について収集された情報は、オルガネラの再配置、タンパク質分泌、エンドサイトーシス、核ダイナミクス、カルシウムダイナミクス、細胞骨格組織化、およびネトーシスに関するISMicを通じて取得された機構情報と補完し、相関させることができます。薬理学的および/または遺伝子操作の使用は、関心のあるプロセスにおける特定の分子経路の役割を強調することができ、これをユニークで非常に強力なアプローチにします。
開示事項
著者は、競合する金銭的利益を宣言しません。
謝辞
この研究は、国立衛生研究所、国立がん研究所、がん研究センターの学内研究プログラムによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | USA Scientific | 4036-3204 | |
| 15 mL tubes | Corning | 430766 | |
| 1 mL syringe | Covidien | 8881501400 | |
| 27 G needle | Kendall | 827112 | |
| 27 G winged infusion set | Terumo | SV*27EL | |
| 30x objective | Olympus | UPLSAPO30XS | 1.05 NA, silicon oil immersion |
| 40x objective | Olympus | UPLSAPO40XS | 1.23 NA, silicon oil immersion |
| 60 mm dishes | Falcon | 353002 | |
| 6 mL syringe | Kendall | 8881516937 | |
| Acepromazine (10 mg/mL) | Vet one | 13985-587-50 | |
| ACK lysis buffer | Quality Biological | 118-156-101 | |
| Balance | AND | EK-1200A | |
| BSA | Sigma Aldrich | A9647 | |
| Cell strainer 40 µm | Sigma Aldrich | CLS431750 | |
| Fiji | ImageJ | N/A | Image visualization/analysis software |
| Fluoview Software | Olympus | N/A | Acquisition software |
| FVB mouse strain | Jackson | N/A | FVB background |
| Gas Anesthesia system | Patterson veterinary | 07-8915712 | Link 7 model |
| Green Cell tracker | Thermo | C2925 | Solubilized in cell culture grade DMSO to reach 1 mM concentration (1000x) |
| Hair removal cream | Nair | N/A | |
| HBSS (w/o Ca2+, Mg2+) | Gibco | 14175-095 | |
| HEPES 1 M pH 7.3 | Quality Biological | 118-089-721 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ML | |
| Histopaque 1991 | Sigma Aldrich | 11191-100ML | |
| Imaris | Bitplane | N/A | Image visualization/analysis software |
| Isoflurane | Vet one | 13985-528-40 | |
| Ketamine (100 mg/mL) | Vet one | 13985-584-10 | |
| LyzM-cre x mT/mG | generated in the lab | N/A | C57BL/6J background |
| Manual micromanipulator | WPI | M3301R | |
| MATLAB | MatWorks | N/A | Analysis software |
| mtomato mouse strain | generated in the lab | N/A | mT/mG, FVB background |
| Multiphoton laser | Spectra Physics | Insight DS+ | |
| Multiphoton Microscope | Olympus | MPE-RS | |
| Nanofil 10 µL syringe | WPI | NANOFIL | |
| Nanofil 33 G needle | WPI | NF33BV-2 | |
| Objective heater | Bioptechs | N/A | |
| Objective heater controller | Bioptechs | 150803 | |
| Ophtalmic ointment | Major | NDC 0904-6488-38 | |
| Oxygen concentrator | Caire | VisionAire 5 | |
| PBS (w/o Ca2+, Mg2+) | Quality Biological | 114-058-131 | |
| Saline | Quality Biological | 114-055-101 | |
| Stage heater | Okolab | N/A | |
| Stage heater controller | Okolab | H401-T | |
| Surgical tape | 3M | 1538-1 | Hypoallergenic |
| Syringe driver | Harvard Apparatus | PHD Ultra | |
| Warming Pads | Parkland Scientific | A2789B | |
| Warming Pump | Parkland Scientific | TP-700 | |
| Xylazine (100 mg/mL) | Vet one | 13985-704-10 |
参考文献
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2 (4), 2369-2392 (2012).
- Oudin, M. J., Weaver, V. M. Physical and chemical gradients in the tumor microenvironment regulate tumor cell invasion, migration, and metastasis. Cold Spring Harbor Symposia on Quantitative Biology. 81, 189-205 (2016).
- Devreotes, P., Horwitz, A. R. Signaling networks that regulate cell migration. Cold Spring Harbor Perspectives in Biology. 7 (8), 005959 (2015).
- Alexandrova, A. Y., Chikina, A. S., Svitkina, T. M. Actin cytoskeleton in mesenchymal-to-amoeboid transition of cancer cells. International Review of Cell and Molecular Biology. 356, 197-256 (2020).
- Masedunskas, A., et al. Intravital microscopy. Bioarchitecture. 2 (5), 143-157 (2012).
- Wagner, R. . Explanatory panels on physiology and development history 1839. , (1839).
- Yaniv, K., et al. Live imaging of lymphatic development in the zebrafish. Nature Medicine. 12 (6), 711-716 (2006).
- Vinegoni, C., et al. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. Journal of Visualized Experiments. (30), e1510 (2009).
- Sack, F. -. U. Intravital microscopy of pulmonary microcirculation after single lung transplantation in pigs. Transplantation Proceedings. 38 (3), 737-740 (2006).
- Rehberg, M., Krombach, F., Pohl, U., Dietzel, S. Label-free 3D visualization of cellular and tissue structures in intact muscle with second and third harmonic generation microscopy. PloS One. 6 (11), 28237 (2011).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Intravital third harmonic generation microscopy of collective melanoma cell invasion: Principles of interface guidance and microvesicle dynamics. Intravital. 1, 32-43 (2012).
- Poole, J. J. A., Mostaço-Guidolin, L. B. Optical microscopy and the extracellular matrix structure: A review. Cells. 10 (7), 1760 (2021).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Third harmonic generation microscopy of cells and tissue organization. Journal of Cell Science. 129 (2), 245-255 (2016).
- Ebrahim, S., et al. Dynamic polyhedral actomyosin lattices remodel micron-scale curved membranes during exocytosis in live mice. Nature Cell Biology. 21 (8), 933-939 (2019).
- Shitara, A., et al. Cdc42 negatively regulates endocytosis during apical membrane maintenance in live animals. Molecular Biology of the Cell. 30 (3), 324-332 (2019).
- Masedunskas, A., et al. Role for the actomyosin complex in regulated exocytosis revealed by intravital microscopy. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13552-13557 (2011).
- Subramanian, B. C., et al. The LTB4-BLT1 axis regulates actomyosin and β2-integrin dynamics during neutrophil extravasation. The Journal of Cell Biology. 219 (10), 201910215 (2020).
- Yan, S. L. S., Hwang, I. -. Y., Kamenyeva, O., Kehrl, J. H. In vivo F-Actin filament organization during lymphocyte transendothelial and interstitial migration revealed by intravital microscopy. iScience. 16, 283-297 (2019).
- Porat-Shliom, N., et al. In vivo tissue-wide synchronization of mitochondrial metabolic oscillations. Cell Reports. 9 (2), 514-521 (2014).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10515-10520 (2015).
- Calvo-Rodriguez, M., et al. Increased mitochondrial calcium levels associated with neuronal death in a mouse model of Alzheimer's disease. Nature Communications. 11, 2146 (2020).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Li, J. L., et al. Intravital multiphoton imaging of immune responses in the mouse ear skin. Nature Protocols. 7 (2), 221-234 (2012).
- Swamydas, M., Lionakis, M. S. Isolation, purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments:JoVE. (77), e50586 (2013).
- Rose, S., Misharin, A., Perlman, H. A novel Ly6C/Ly6G-based strategy to analyze the mouse splenic myeloid compartment. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (4), 343-350 (2012).
- Lakschevitz, F. S. Identification of neutrophil surface marker changes in health and inflammation using high-throughput screening flow cytometry. Experimental Cell Research. 342 (2), 200-209 (2016).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. Journal of Visualized Experiments:JoVE. (17), e745 (2008).
- . MATLAB - Bio-Formats 6.1.0 documentation Available from: https://docs.openmicroscopy.org/bio-formats/6.1.0/users/matlab/index.html (2022)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9, 62-66 (1979).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179, 298-310 (1996).
- Xu, C., Prince, J. L. Snakes, shapes, and gradient vector flow. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7 (3), 359-369 (1998).
- Driscoll, M. K., et al. Automated image analysis of nuclear shape: what can we learn from a prematurely aged cell. Aging. 4 (2), 119-132 (2012).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Tauer, U. Advantages and risks of multiphoton microscopy in physiology. Experimental Physiology. 87 (6), 709-714 (2002).
- Débarre, D., Olivier, N., Supatto, W., Beaurepaire, E. Mitigating phototoxicity during multiphoton microscopy of live Drosophila embryos in the 1.0-1.2 µm wavelength range. PloS One. 9 (8), 104250 (2014).
- Masedunskas, A., et al. Intravital microscopy: a practical guide on imaging intracellular structures in live animals. Bioarchitecture. 2 (5), 143-157 (2012).
- Ng, L. G., et al. Visualizing the neutrophil response to sterile tissue injury in mouse dermis reveals a three-phase cascade of events. The Journal of Investigative Dermatology. 131 (10), 2058-2068 (2011).
- Wu, X. S., et al. Melanoregulin regulates a shedding mechanism that drives melanosome transfer from melanocytes to keratinocytes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 2101-2109 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved