Method Article
Obtención de imágenes de la migración de neutrófilos en la piel del ratón para investigar la remodelación de la membrana subcelular en condiciones fisiológicas
En este artículo
Resumen
La migración de neutrófilos se basa en la remodelación rápida y continua de la membrana plasmática en respuesta al quimioatrayente y sus interacciones con el microambiente extracelular. En este trabajo se describe un procedimiento basado en Microscopía Subcelular Intravital para investigar la dinámica de la remodelación de la membrana en neutrófilos inyectados en el oído de ratones anestesiados.
Resumen
El estudio del reclutamiento y la función de las células inmunitarias en los tejidos ha sido un campo muy activo en las últimas dos décadas. Los neutrófilos se encuentran entre las primeras células inmunitarias en llegar al sitio de la inflamación y en participar en la respuesta inmunitaria innata durante una infección o daño tisular. Hasta ahora, la migración de neutrófilos se ha visualizado con éxito utilizando varios sistemas experimentales in vitro basados en estimulación uniforme, o migración confinada bajo agarosa o canales microfluídicos. Sin embargo, estos modelos no recapitulan el complejo microambiente que encuentran los neutrófilos in vivo. El desarrollo de técnicas basadas en la microscopía multifotónica (MPM), como la microscopía subcelular intravital (ISMic), ofrece una herramienta única para visualizar e investigar la dinámica de los neutrófilos a resoluciones subcelulares en condiciones fisiológicas. En particular, la oreja de un ratón vivo anestesiado proporciona una ventaja experimental para seguir la migración intersticial de neutrófilos en tiempo real debido a su facilidad de acceso y falta de exposición quirúrgica. ISMic proporciona la resolución óptica, la velocidad y la profundidad de adquisición necesarias para rastrear los procesos celulares y, lo que es más importante, subcelulares en 3D a lo largo del tiempo (4D). Además, la obtención de imágenes multimodales del microambiente intersticial (es decir, vasos sanguíneos, células residentes, matriz extracelular) se puede lograr fácilmente utilizando una combinación de ratones transgénicos que expresan marcadores fluorescentes seleccionados, marcaje exógeno a través de sondas fluorescentes, fluorescencia intrínseca del tejido y señales generadas por el segundo y tercer armónico. Este protocolo describe 1) la preparación de neutrófilos para su transferencia adoptiva al oído del ratón, 2) diferentes configuraciones para la obtención óptima de imágenes subcelulares, 3) estrategias para minimizar los artefactos de movimiento mientras se mantiene una respuesta fisiológica, 4) ejemplos de remodelación de membrana observados en neutrófilos utilizando ISMic, y 5) un flujo de trabajo para el análisis cuantitativo de la remodelación de la membrana en neutrófilos migratorios in vivo.
Introducción
La migración celular dirigida es un evento crítico que ocurre durante diferentes procesos fisiológicos y patológicos, incluyendo el desarrollo, la respuesta inmune, la reparación de tejidos y el inicio, progresión y diseminación tumoral 1,2. Este proceso se basa en señales quimiotácticas extracelulares específicas detectadas por sus receptores afines en la membrana plasmática y luego transducidas en señales intracelulares intrincadas. Estas vías, a su vez, activan la migración celular a través de una serie de respuestas, que incluyen la activación local del citoesqueleto, el tráfico y la remodelación de la membrana y la polarización celular3. Se han caracterizado bien dos tipos distintos de migración celular: mesénquima y ameboide4. La migración mesenquimal es relativamente lenta (<1 μm/min), depende de una fuerte adhesión entre las células y la matriz extracelular (MEC) y depende de la degradación de la matriz inducida por las metaloproteasas. Por el contrario, la migración ameboide, una característica de las células inmunitarias que responden rápidamente a las señales inflamatorias, es más rápida (>10 μm/min) y utiliza adherencias débiles para navegar a través de la MEC. Independientemente de la modalidad, la migración celular requiere una remodelación constante de la membrana plasmática que resulta en la generación de estructuras protrusivas en el borde delantero de las células, que están estrechamente coordinadas con la retracción de la membrana en la parte posterior1.
Para desentrañar los mecanismos moleculares que subyacen a estos procesos subcelulares, es fundamental visualizar la dinámica de las membranas de las células migratorias con una resolución temporal y espacial adecuada. Además, dado que la remodelación de la membrana está fuertemente influenciada por las propiedades del microambiente tisular que rodea a las células migratorias, es crucial obtener imágenes de este proceso directamente en el tejido nativo, dentro de animales vivos. Esto se logra mediante el uso de microscopía intravital (MIV)5. Las primeras imágenes de IVM se realizaron hace ~ 200 años, cuando la extravasación de leucocitos se visualizó utilizando un microscopio simple de transiluminación6 y, posteriormente, la IVM se utilizó principalmente en organismos modelo semitransparentes, como el pez cebra y la Drosophila 7,8. En las últimas dos décadas, la MIV se ha utilizado con éxito para investigar procesos celulares en ratones, ratas y mamíferos más grandes como los cerdos 5,9. Esto fue posible gracias a 1) desarrollos significativos en microscopía confocal y multifotónica (MP) y 2) el aumento de la tecnología de edición de genes como CRISPR-Cas9, que ha permitido la rápida ingeniería de una variedad de modelos animales para expresar proteínas marcadas con fluorescencia y reporteros. Además, la visualización de células individuales y su microambiente durante procesos como la iniciación del tumor, la migración celular y la respuesta inmunitaria ha sido posible gracias a otras formas de marcaje exógeno, como la introducción sistémica de colorantes para marcar la vasculatura10,11, y la excitación de moléculas endógenas, como el colágeno a través de la segunda generación armónica (SHG)10, 12 y fibras nerviosas a través de la Tercera Generación Armónica (THG)11,13. Finalmente, una mejora en las técnicas para minimizar los artefactos de movimiento debidos a los latidos del corazón y la respiración ha llevado al desarrollo de la microscopía subcelular intravital (ISMic), que ha permitido a los investigadores obtener imágenes e investigar varios eventos subcelulares directamente en animales vivos a un nivel de resolución similar a los observados in vitro 14,15,16,17 . Ejemplos de ISMic incluyen la investigación de la dinámica del citoesqueleto durante la exocitosis 14,15,16,17 y la endocitosis 15, la remodelación dinámica del citoesqueleto durante la migración celular17,18, la localización y el metabolismo mitocondrial19,20 y la señalización del calcio en el cerebro21.
Este protocolo detalla los diferentes pasos y procedimientos para investigar la remodelación de la membrana celular a una resolución subcelular durante la migración de neutrófilos en la piel del oído de un ratón vivo utilizando ISMic. Este enfoque se basa en los protocolos previamente descritos22,23 y se adapta para lograr una mayor resolución espacial y temporal.
Protocolo
Todos los experimentos y procedimientos con animales fueron aprobados por el Comité de Cuidado y Uso de Animales del Instituto Nacional del Cáncer (Institutos Nacionales de Salud, Bethesda, MD, EE. UU.) (protocolos LCMB-031 y LCMB-035) y cumplieron con todas las regulaciones éticas relevantes. Para los experimentos se utilizaron ratones machos y hembras de entre 2 y 6 meses de edad. Los ratones huéspedes mT/mG y de tipo salvaje (WT) están en un fondo FVB/NJ, mientras que los ratones LyzM-Cre x mTmG están en un fondo C57BL/6.
1. Materiales y preparación de reactivos y herramientas
- Cubra tubos, platos y agujas/jeringas con PBS + 1% BSA (sin calcio y magnesio) durante la noche bajo agitación.
- Limpie cuidadosamente las superficies y las herramientas/instrumentos que se van a utilizar para el trabajo con animales utilizando etanol al 70% o esterilizándolo en autoclave.
- Para la purificación de neutrófilos, prepare lo siguiente: 3 tubos de 15 ml, 1 plato de 60 mm, 1 tubo de 1,5 ml; HBSS que contiene 10 mM HEPES (pH 7,3); solución de lisis de glóbulos rojos (ACK); Histopaco 1077; e Histopaque 1119.
- Para las inyecciones de neutrófilos, prepare lo siguiente: 1 jeringa de bajo volumen (10 μL), 1 aguja biselada de 33 G, isoflurano y solución anestésica (ketamina, xilacina y acepromazina a 80 mg·kg-1, 2 mg·kg-1 y 4 mg·kg-1, respectivamente, en solución salina).
2. Purificación de neutrófilos a partir de un ratón donante
- Sacrificar al ratón donante de acuerdo con las regulaciones institucionales locales.
- Recoja los huesos largos del animal (fémur, tibia y húmero), prestando atención a la preservación de la integridad ósea y evitando cortar la cabeza de los huesos durante la recolección24.
- En un plato de 60 mm recubierto de BSA, retire los músculos y el tejido graso. Cortar la cabeza de los huesos para acceder a la médula y, a continuación, enjuagar y homogeneizar la médula ósea con una jeringa (aguja de 27 G) llena de HBSS.
- Filtre la solución en un tubo recubierto de BSA de 15 ml con un colador de 40 μm y centrifugue a 400 x g durante 5 min a temperatura ambiente (RT).
- Aspire el sobrenadante, vuelva a suspender el pellet en 1 mL de ACK durante 30 s para lisar los glóbulos rojos y, a continuación, añada 9 mL de HBSS para detener la lisis. Centrifugar la solución a 400 x g durante 5 min en RT.
- Prepare un gradiente de pasos de densidad en un tubo recubierto de BSA de 15 mL colocando suavemente 4 mL de 1119 Histopaque en la parte inferior del tubo y, a continuación, colocando suavemente 4 mL de 1077 Histopaque en la parte superior. Tenga especial cuidado para evitar mezclar las dos capas.
- Aspirar el sobrenadante y resuspender el pellet celular en 2 mL de HBSS. Coloque suavemente la solución en capas sobre el gradiente escalonado preparado anteriormente. Gire a 1.000 x g durante 30 minutos a RT con la velocidad de aceleración y desaceleración más baja posible (se prefiere "sin freno").
- Desde la parte superior del tubo, aspire suavemente la mitad de la capa 1077 Histopaque. Recoja la mitad restante de la capa 1077 Histopaque y la mitad superior de la capa 1119 Histopaque en un tubo nuevo recubierto de BSA. La suspensión celular turbia entre las dos capas de densidad contiene predominantemente neutrófilos.
- Agregue HBSS para alcanzar un volumen final de 15 mL y mezcle suavemente invirtiendo el tubo. Girar a 400 x g durante 5 min a RT.
- Después de la centrifugación, vuelva a suspender y lavar el pellet de celda con 10 mL de HBSS y centrifugue a 400 x g durante 5 min a temperatura ambiente. Repita el procedimiento y, a continuación, vuelva a suspender el pellet en 15 ml de HBSS para determinar el número de células utilizando un contador de células. Por último, centrifugar y resuspender las células en 1 mL de HBSS y transferirlas a un tubo recubierto de BSA de 1,5 mL.
- Después de la purificación, mantenga la suspensión de neutrófilos en el tubo recubierto de BSA bajo agitación suave durante 30 minutos en un rotador de tubo en RT hasta el etiquetado y/o la inyección.
NOTA: Una purificación exitosa produce 10-20 x 106 neutrófilos por ratón con una pureza del 95%. La pureza se evalúa mediante citometría de flujo, utilizando marcadores de neutrófilos previamente descritos (Ly6G+, Ly6C-, Gr1+ y CD11b+)25,26.
NOTA: Los protocolos de purificación de neutrófilos a partir de sangre periférica humana y médula ósea de ratón están disponibles anteriormente24,27.
3. Marcaje de neutrófilos
NOTA: Para visualizar los neutrófilos, se purificaron a partir de ratones LyzM-Cre mT/mG , en los que las células mieloides expresan un péptido dirigido a la membrana fusionado con el GFP. Además, los neutrófilos purificados de ratones de tipo salvaje (WT) se marcaron in vitro. Los siguientes pasos describen el procedimiento utilizado para marcar neutrófilos purificados con un colorante fluorescente verde comercial permeable a las células y se puede adaptar a cualquier otra sonda fluorescente compatible con MPM de elección.
- Agregue el tinte verde fluorescente (concentración recomendada por el fabricante; en este caso, 1 μM) a la suspensión de neutrófilos (purificada a partir de ratón WT) en un tubo de 1,5 mL recubierto de BSA. Incubar durante 30 min en RT bajo agitación suave en un rotador de tubos.
- Lavar tres veces con HBSS, centrifugar a 400 x g durante 5 min a RT y volver a suspender el pellet en 1 mL de HBSS.
- Mantenga la suspensión de neutrófilos en el tubo recubierto de BSA bajo agitación suave en un rotador de tubo en RT hasta el procedimiento de inyección.
NOTA: Es muy preferible la inyección de neutrófilos marcados inmediatamente después del marcado. Sin embargo, si es necesario, los neutrófilos marcados pueden mantenerse en agitación durante 10-15 minutos adicionales después del marcaje sin comprometer la integridad de la respuesta de los neutrófilos in vivo. La agitación a largo plazo (más de 60 minutos después del etiquetado) provocará aglomeraciones, muerte de neutrófilos y observaciones engañosas in vivo. - Justo antes de la inyección, vuelva a suspender el gránulo de células en solución salina para alcanzar una densidad de 2-5 x 106 células por 20 μL.
4. Inyección de neutrófilos
NOTA: La anestesia debe realizarse siguiendo las pautas institucionales del Comité de Cuidado y Uso de Animales locales.
- Colocar al animal en una cámara cerrada y administrar isoflurano al 3%-5% (caudal de 2 L/min) utilizando un vaporizador calibrado conectado a un concentrador de oxígeno.
- Evalúe si el animal está inconsciente probando el reflejo de retirada de la pata al pellizcar la almohadilla de la pata trasera. Luego, transfiera al animal a una almohadilla térmica (37 ° C) para mantener su temperatura corporal. Continuar administrando el isoflurano (1%-2%; caudal de 0,5 L/min) a través de un cono nasal.
NOTA DE SEGURIDAD: Para limitar la exposición del personal al isoflurano tóxico, se recomienda el uso de un sistema dispensador equipado con una unidad de filtrado para recuperar el isoflurano circulante. - Para optimizar la calidad de la imagen, elimine los pelos de la oreja con una recortadora fina. Este procedimiento también se puede realizar uno o dos días antes del experimento.
NOTA: Se desaconseja el uso de crema depilatoria, ya que se sabe que exacerba la respuesta inflamatoria en la piel del ratón e introduce artefactos de imagen. - Coloca al animal de lado. Con cinta quirúrgica, sostenga el borde de la oreja y aplánelo a lo largo de la almohadilla térmica. Aplique suavemente la cinta para evitar cualquier daño en el oído.
- Llene una jeringa equipada con una aguja de 33 G con la suspensión de neutrófilos (2-5 x 106 células por 20 μL) y móntela en un micromanipulador.
NOTA: El ángulo de inyección entre la aguja y la oreja en una almohadilla térmica debe estar entre 10° y 30° para minimizar el daño tisular y aumentar el éxito de la inyección celular. - Mueva suavemente la aguja (con el bisel hacia arriba) hacia la oreja y perfore lentamente la piel. Una vez que la aguja esté dentro de la piel, empuje lentamente el pistón y administre 2-3 μL de suspensión celular.
NOTA: Deben evitarse las áreas con vasos sanguíneos visibles, ya que dañar un vaso sanguíneo da como resultado una respuesta inmunitaria compleja y no deseada a la inyección y problemas con las imágenes. - Repita la inyección en 2-3 áreas diferentes de la oreja, preferiblemente a 2-3 mm de distancia. No "llene en exceso" el oído con la suspensión celular.
NOTA: La inyección debe realizarse en el centro de la oreja. La periferia de la oreja es delgada y debe manipularse con cuidado, ya que puede dañarse fácilmente, mientras que la parte central es más gruesa, contiene vasos sanguíneos más grandes y menos folículos pilosos, y puede soportar mayores volúmenes de inyección. - Retire con cuidado la cinta quirúrgica y deje que el animal recupere la conciencia bajo supervisión. Deje que el animal descanse durante 1 hora antes de tomar imágenes para que el tejido y las células se recuperen del procedimiento de inyección.
5. Anestesia para la IVM
NOTA: Una anestesia más profunda mejora significativamente la calidad de la imagen al disminuir los artefactos de movimiento debidos a los latidos del corazón y la respiración. Los ratones inyectados con neutrófilos se someten a anestesia química, que proporciona una sedación más profunda que la anestesia inducida por gases. La anestesia debe realizarse siguiendo las pautas del Comité de Cuidado y Uso de Animales institucionales locales.
- Una hora después de la recuperación de la inyección de neutrófilos, anestesiar a los animales mediante una inyección subcutánea que contiene una mezcla de xilacina/ketamina/acepromazina (80 mg·kg-1, 2 mg·kg-1 y 4 mg·kg-1, respectivamente) en solución salina.
NOTA: Para garantizar la reproducibilidad y fiabilidad de los resultados, los animales deben mantenerse calientes desde el momento de la anestesia hasta el final del experimento utilizando una almohadilla térmica o una almohadilla de circulación de agua conectada a una bomba de calentamiento. - Para mantener la anestesia más allá de 1 h, inyecte una mezcla de Ketamina/Acepromazina (40 mg·kg-1 y 2 mg·kg-1 respectivamente) por vía subcutánea cada 40 min. Monitoree periódicamente a los ratones anestesiados para detectar signos de conciencia mediante la prueba del reflejo de retirada de las patas.
- Además, para los procedimientos de diagnóstico por imágenes que duran más de 1 hora, aplique un ungüento oftálmico estéril sin medicamentos en los ojos para evitar la sequedad de la córnea durante la anestesia y mantener la hidratación corporal mediante inyecciones subcutáneas de solución salina (200 μL cada hora).
NOTA: Alternativamente, se puede utilizar un sistema basado en perfusión controlado digitalmente para garantizar una inyección periódica y suave de la solución de anestesia y/o proporcionar líquidos. Se puede configurar un controlador de jeringa automatizado para administrar el volumen deseado de anestésico y proporcionar hidratación durante períodos más largos. Para ello, se puede introducir una aguja de infusión alada por vía subcutánea en la piel dorsal del animal y asegurarla con cinta quirúrgica.
6. Imágenes
NOTA: La configuración del animal y los parámetros de imagen descritos aquí están optimizados para un microscopio multifotónico invertido equipado con una sola línea láser para excitar y recoger simultáneamente las emisiones de los diferentes fluoróforos.
- Antes de colocar el animal anestesiado en la platina del microscopio, asegúrese de que el microscopio esté encendido y de que tanto la platina como las lentes estén precalentadas a 37 °C. Cubra el orificio en el escenario con un cubreobjetos de vidrio (grosor # 1 o 1.5) que esté alineado con la lente calentada.
- Mueve al animal al escenario con cuidado. Si se planea tomar imágenes de larga duración (>1 h), aplique ungüento oftálmico y asegure el sistema de perfusión basado en infusión alado como se describió anteriormente.
- Coloque una gota de solución salina en el centro del cubreobjetos y coloque la oreja inyectada con neutrófilos encima. Aplana suavemente la oreja con un bastoncillo de algodón estéril en el centro del cubreobjetos para eliminar las bolsas de aire.
NOTA: La aplicación de solución salina (o PBS) entre el oído y el cubreobjetos reduce la refracción de la luz debido a las bolsas de aire, lo que garantiza un índice de refracción uniforme y una calidad de imagen superior. - Asegure la oreja presionando suavemente un palo de madera (retirado del hisopo de algodón) en el lado de la oreja más cercano a la cabeza del animal y bloqueándolo con cinta adhesiva (Figura 1A).
NOTA: Un palo de madera asegurado minimiza los artefactos de movimiento debidos a los latidos del corazón y la respiración y aumenta drásticamente la calidad de la imagen. Es importante destacar que el palo de madera debe sujetarse lo suficiente para estabilizar el oído sin perjudicar el flujo sanguíneo. - Con el ocular del microscopio, encuentre un área de interés y, a continuación, cambie al modo de adquisición multifotónica.
- Ajuste la longitud de onda de excitación del láser a 900-930 nm para permitir la adquisición simultánea de GFP / colorante fluorescente verde, mTomato y colágeno-I (a través de SHG).
- Establezca un conjunto adecuado de espejos y una combinación de filtros en los detectores para recoger la luz emitida (filtros de paso de banda: Azul = 410-460 nm, Verde = 495-540 nm, Rojo = 580-640 nm).
NOTA: Los neutrófilos inyectados, cuando están marcados con un tinte fluorescente verde, exhiben una fuerte fluorescencia verde que los hace visibles bajo el ocular del microscopio, incluso si se inyectan en partes más profundas del oído. - Determine la configuración más adecuada para la configuración de hardware. Incluso si las células migratorias se pueden rastrear con un intervalo de 30 s a 1 min, las imágenes de los eventos subcelulares se obtienen imágenes con una velocidad más alta (al menos <10 s de intervalo). En el siguiente ejemplo, se presentan dos configuraciones de imágenes diferentes para mostrar la diferencia entre IVM clásica e ISMic.
- En el enfoque clásico de IVM para rastrear la migración celular e investigar el tejido del ratón huésped (Figura 1), se utiliza una lente de 30x y un escáner galvo con un tamaño de imagen de 512 x 512 píxeles (tamaño de píxel de 0,83 μm), y se establece el desplazamiento del eje z utilizando la platina motorizada con un tamaño de paso de 2 μm, lo que permite obtener imágenes de un volumen de profundidad de 30 μm cada 30 s.
- En el enfoque ISMic para la remodelación de membranas altamente dinámicas de imágenes con un aumento y una resolución más altos (Figura 2), use una lente de 40x y un escáner resonante con un promedio de 3x y un tamaño de imagen de 512 x 512 píxeles (tamaño de píxel de 0.25 μm), y establezca el desplazamiento del eje z usando un piezoeléctrico con un tamaño de paso de 1 μm, Permite obtener imágenes de 20 μm de volumen de profundidad cada 4-5 s.
- Desencadena la migración de neutrófilos al inducir una lesión estéril por láser. Enfoque el láser de excitación a una potencia alta suficiente para alcanzar al menos 80 mW22, en un área estrecha del tejido (20 μm x 20 μm) durante 10 s.
- Identificar la lesión inducida por láser por sus fuertes señales autofluorescentes que aparecen en todos los canales y por la alteración resultante de la disposición del colágeno (Figura 1D).
NOTA: Para obtener resultados fiables, la lesión debe inducirse siempre lo más lejos posible de los vasos sanguíneos; Si se rompen, las células sanguíneas liberadas en el tejido afectarán la calidad de las imágenes y darán lugar a una fuerte reacción inmunitaria general. - Guarde los datos al final de la experimentación para análisis posteriores.
- Sacrificar al animal de acuerdo con las directrices institucionales locales. Si es necesario, se puede recolectar tejido para su fijación y posterior procesamiento.
7. Análisis de datos representativos
NOTA: Los datos se pueden visualizar y analizar con el software del microscopio, software de terceros o programas personalizados. El procedimiento y las herramientas utilizadas dependen de las necesidades específicas de los investigadores. Aquí se muestra un ejemplo de un flujo de trabajo para cuantificar la curvatura de la membrana y los cambios en el área local en el borde delantero y la parte trasera de los neutrófilos migratorios.
- Abra los archivos de imagen con Imaris o Fiji para visualizar la migración de los neutrófilos en 4D y determinar la calidad del experimento.
NOTA: Imaris y Fiji pueden leer el formato de imagen de varias marcas de microscopios. - Procese los datos con los siguientes pasos mediante la ejecución de scripts de código de MATLAB personalizados. Lea los archivos de imagen seleccionados con el paquete Bio-Formats28 para MATLAB. Segmente cada fotograma del volumen 3D con el algoritmo Otsu29 para identificar las celdas individuales.
- Realice un seguimiento de los objetos identificados en función del criterio de desplazamiento mínimo30.
- Determine los contornos y límites activos del objeto.
- Genere una proyección máxima para cada objeto identificado en un período de tiempo.
- Aplique la función bwboundaries en MATLAB a la proyección máxima de cada objeto identificado del paso 7.2 para generar 100 puntos de límite.
- Optimice los puntos de contorno identificados con el algoritmo de contorno dinámico para lograr una precisión de subpíxel31 (Figura 3A) utilizando las funciones del paquete de MATLAB descargado a través de http://www.iacl.ece.jhu.edu/static/gvf/.
- Superponga los límites del objeto y el índice de trayectoria del objeto determinado por el seguimiento en el paso 7.3 con la proyección máxima de la imagen original para generar una salida de una película superpuesta en 2D para la visualización y la comprobación manual.
- En la película superpuesta, seleccione manualmente todos los objetos identificados como celdas en migración excluyendo los objetos que no son celdas, los objetos que tocan y los objetos con límites incompletos. Registre los índices de seguimiento, los fotogramas de inicio y fin de cada celda en una hoja de cálculo que se utilizará como entrada para los siguientes pasos implementados por los scripts de código de MATLAB.
- Realice un seguimiento de los puntos de límite de la celda de cada fotograma al siguiente de acuerdo con el criterio de desplazamiento mínimo. Utilice la función Polyarea de MATLAB para calcular el área subrayada por puntos de contorno adyacentes en dos períodos de tiempo consecutivos (Figura 3C). Si el límite de la celda local se mueve hacia afuera de la celda, asigne un signo positivo al cambio de área. Si el límite de la celda local se mueve hacia adentro de la celda, asigne un signo negativo al cambio de área.
- Mida la curvatura local de la membrana en cada punto límite para cada marco ajustando sus puntos límite vecinos a un círculo (5 por lado; total 11)32 (Figura 3B).
- Genere kymographs utilizando la función imagesc en MATLAB (Figuras 3D,E) para mostrar los cambios de las características subcelulares a lo largo del tiempo y relacionarlas con la posición de la celda.
Resultados
Aquí, se presentan dos conjuntos diferentes de resultados para ilustrar la IVM clásica y la ISMic que proporcionan resolución celular y subcelular, respectivamente. En el primer ejemplo, se purificaron neutrófilos de un ratón de tipo salvaje (WT), se marcaron con Cell Tracker Green para teñir el citoplasma y se inyectaron en un ratón transgénico que expresaba una proteína fluorescente dirigida a la membrana plasmática (ratón mTomato, también conocido como mT/mG33, Figura 1 y Película 1 y Película 2). Este ratón receptor permitió la visualización de las características estructurales en el tejido del oído, como los vasos sanguíneos, las células residentes y los folículos pilosos (Figura 1C y Vídeo 1) a través de un enfoque basado en IVM (paso 6.8.1). Las fibras de colágeno, reveladas a través de SHG (detectadas a la mitad de la longitud de onda de la excitación), se dispusieron en una intrincada red en la dermis, donde se inyectaron los neutrófilos. A lo largo del borde de los folículos pilosos (HF), se observó una capa de células epiteliales (es decir, queratinocitos). En ocasiones, se visualizaban artefactos de pelos residuales que daban lugar a una depresión local de la piel (H). Las lesiones inducidas por láser se visualizaron fácilmente debido a su fuerte autofluorescencia detectada en todos los canales y por las alteraciones de la disposición del colágeno (Figura 1D). Una visión más completa de la arquitectura 3D de la piel y la localización de los neutrófilos inyectados se puede apreciar en la Película 1, que retrata una pila Z de la piel desde las capas externas a internas y una representación de volumen en 3D. Las imágenes de lapso de tiempo mostraron a los neutrófilos tomando muestras de la piel del oído e interactuando con la MEC y el tejido del huésped (Película 2). La obtención de imágenes a esta resolución y la adquisición de una pila Z cada 30 s permite realizar el seguimiento de las células y la medición de los parámetros de motilidad (es decir, la velocidad y la direccionalidad), pero un análisis preciso y detallado de la remodelación de la membrana es un desafío a esta resolución.
En el segundo ejemplo, la remodelación de la membrana se evaluó mediante el enfoque ISMic (paso 6.8.2) utilizando neutrófilos que expresan mGFP purificados de ratones LyzM-cre mT/mG e inyectados en animales WT (Figura 2A, diagrama de flujo experimental). Utilizando el protocolo ISMic (Vídeo 3 e imágenes fijas en la Figura 2B) y tras la lesión por láser, se observa una remodelación dinámica de la membrana plasmática durante la migración, y se visualiza claramente la formación de protuberancias de la membrana en el borde delantero y la retracción de la parte posterior de las células (Figura 2 y Vídeo 3). Las secuencias de lapso de tiempo resaltadas en la Película 3 revelan la complejidad de las interacciones con el ECM. De hecho, los neutrófilos migraron a través del espacio intersticial moviéndose a lo largo de las fibras o en los espacios entre ellas. Por último, se cuantificaron aspectos cuantitativos como los cambios en la curvatura y los cambios de área en la parte delantera y trasera de las celdas para cada punto de tiempo. Utilizando la célula descrita en la Figura 2B como ejemplo, se analizó la dinámica local de la membrana plasmática mediante un algoritmo (véase el paso 7) basado en la identificación de 100 puntos límite subyacentes a la superficie celular (Figura 3A). Los cambios en la curvatura local (Figura 3B) y en el área subrayada por las protuberancias de la membrana plasmática (Figura 3C) se calcularon para cada punto límite y se informaron para cada marco de tiempo como quimogramas (Figura 3D, E). Tanto la parte delantera como la trasera de las células mantienen una curvatura más alta que el lateral de las células (Figura 3D); Los cambios en el área negativa (retracciones, regiones azules) son más evidentes en la parte posterior de las células que en el borde de ataque, donde los cambios en el área positiva son más prominentes (protuberancias, regiones rojas) (Figura 3E).
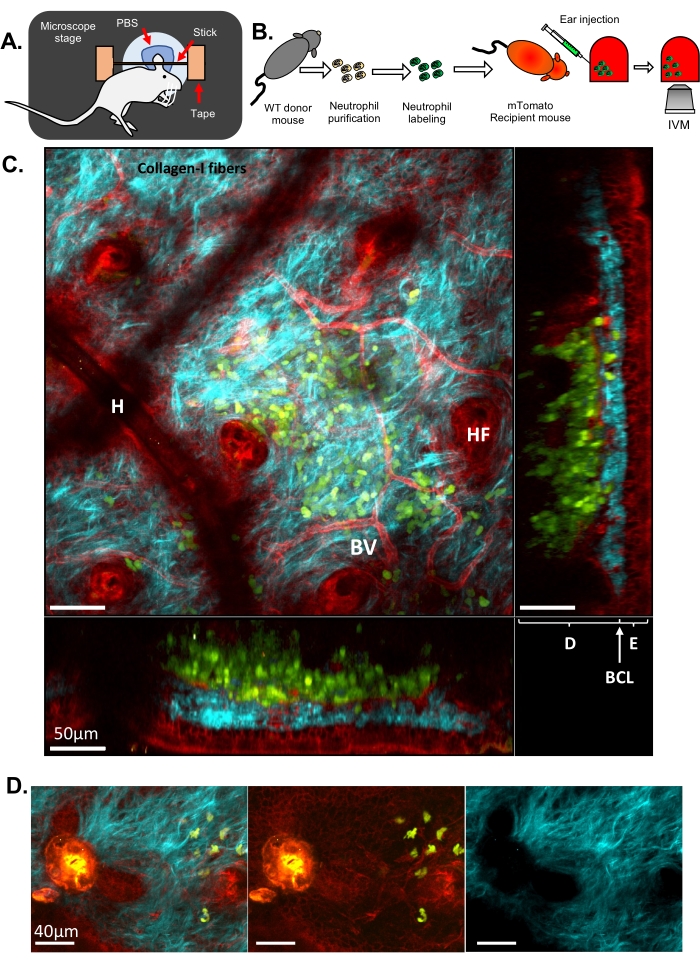
Figura 1: IVM de neutrófilos en la piel del oído del ratón. (A) Dibujo esquemático de la configuración del oído en la platina del microscopio. (B) Diagrama de flujo experimental. (C) Imagen representativa de la piel de la oreja de un ratón mTomato inyectado con neutrófilos marcados con fluorescencia, con diferentes proyecciones. Folículo piloso (HF), vaso sanguíneo (BV), epidermis (E), dermis (D), capa de células basales (BCL) y artefacto capilar (debido a un vello residual en la superficie de la piel, H). (D) Imagen representativa de la piel del ratón después de una lesión por láser estéril: canal azul (derecha), canales verde y rojo (centro), imagen combinada (izquierda). La lesión es visible a la izquierda de la imagen por una fuerte emisión de autofluorescencia en los canales verde y rojo, así como por una interrupción de la MEC observada por la formación de un agujero en las fibras de colágeno-I. En C y D, verde: neutrófilos; Rojo: tejido huésped de ratón; Cian: Colágeno-I SHG. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Lapso de tiempo de la migración de neutrófilos mGFP en el oído de un ratón WT. (A) Diagrama de flujo experimental. (B) Imágenes fijas representativas de la película 3. (C) Representación de volumen de la misma celda para visualizar la organización 3D de la membrana. El área de alta dinámica de la membrana se ilustra con una flecha (roja para la retracción y azul para la protuberancia). (D) Visualización en primer plano e inclinada del volumen de celda renderizado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Canal de análisis para la cuantificación de la dinámica de membrana recopilada mediante ISMic. (A) Determinación del contorno de la célula y repartición de puntos límite (100 puntos límite) entre dos tramas consecutivas para neutrófilos mGFP descritos en la Figura 2B. (B) Los límites coloreados representan la curvatura local de la membrana determinada para cada punto límite. (C) Cambios de área local entre dos fotogramas consecutivos (actual: azul y siguiente: rojo). Las áreas verdes representan los resultados de seguimiento del movimiento local de la membrana. Las flechas amarillas indican la dirección general del desplazamiento de la membrana. (D) Quimógrafo de curvatura del límite de la célula a lo largo del tiempo. El eje vertical representa los índices de puntos límite, donde 1 y 100 representan la parte posterior de la celda según su dirección de migración. (E) Quimógrafo de cambio de área local que refleja la protuberancia de la membrana (rojo) y la retracción de la membrana (azul) de la célula a lo largo del tiempo. Haga clic aquí para ver una versión más grande de esta figura.
Vídeo 1: Neutrófilos marcados en verde visualizados en el oído de un ratón mTomato utilizando IVM. Rojo: mTejido de ratón huésped de tomate. Cian: Colágeno-I SHG; Verde: neutrófilo. Por favor, haga clic aquí para descargar esta película.
Película 2: IVM de neutrófilos migrando en la piel de la oreja de un ratón mTomato. Los vídeos son proyecciones de máxima intensidad de una pila de imágenes adquiridas durante 27 minutos con una velocidad de fotogramas de 5 fotogramas/s. Rojo: mTejido de ratón huésped de tomate. Cian: Colágeno-I SHG; Verde: neutrófilo. Por favor, haga clic aquí para descargar esta película.
Vídeo 3: ISMic de la remodelación de la membrana durante la migración de neutrófilos en un oído de ratón WT. Los vídeos son proyecciones de máxima intensidad de una pila de imágenes adquiridas durante 8 minutos con una velocidad de fotogramas de 10 fotogramas/s. Rojo: mTejido de ratón huésped de tomate. Cian: Colágeno-I SHG; Verde: neutrófilo mGFP; Verde claro: neutrófilo renderizado. Por favor, haga clic aquí para descargar esta película.
Discusión
A pesar de décadas de avances en el campo de la migración celular y la remodelación de la membrana, muy pocos estudios han empleado la MIV para visualizar las características subcelulares en animales vivos. Los procedimientos descritos en este protocolo proporcionan una poderosa herramienta para obtener nuevos conocimientos sobre la migración de neutrófilos en animales vivos y, más específicamente, sobre la remodelación de la membrana plasmática durante este proceso. Este enfoque permite investigar la migración de neutrófilos en condiciones fisiológicas, teniendo en cuenta la complejidad inherente del microambiente tisular. De hecho, el uso de MPM permite la visualización de múltiples características dentro del tejido huésped mediante el uso de una combinación de cepas de ratón que expresan marcadores fluorescentes seleccionados, marcaje de tejido exógeno, excitación de fluorescencia endógena y señales generadas a través de SHG o THG12,13.
Un problema potencial a tener en cuenta en este procedimiento es el fotodaño. A pesar de que la MPM es generalmente más segura que la microscopía confocal con respecto al fotoblanqueo y la fototoxicidad, se debe tener cuidado al obtener imágenes de tejidos vivos34. La fototoxicidad puede obstaculizar drásticamente los resultados mediante la creación de artefactos de imagen que van desde pequeñas motas brillantes hasta áreas más grandes de tejido dañado o la inhibición/estimulación de una variedad de vías intracelulares. Para prevenir la fototoxicidad, la potencia del láser debe mantenerse al mínimo y se deben diseñar los controles adecuados para verificar que se mantengan las condiciones fisiológicas (por ejemplo, medición del flujo sanguíneo, sondas de estrés oxidativo)35,36. Además, en este procedimiento específico, que involucra la piel, las cepas albinas son altamente recomendables, ya que la melanina presente en los animales de pelaje oscuro es más sensible a la fototoxicidad 36,37,38.
Entre las principales limitaciones del procedimiento se encuentran el sistema de microscopio utilizado y la naturaleza de los neutrófilos. Aunque el uso de MPM aumenta significativamente la profundidad de las imágenes de tejido en comparación con otras técnicas de microscopía óptica (por ejemplo, confocal, disco giratorio), la capacidad de visualizar la dinámica subcelular en el oído se restringe a las capas más externas del tejido (80-100 μm). Esto se debe a la intensa dispersión de la luz producida por la gruesa capa de ECM, lo que dificulta la investigación de la migración en las capas más profundas. Otra limitación es el hecho de que los neutrófilos tienen una vida muy corta y no se pueden mantener en cultivo el tiempo suficiente para realizar técnicas de edición de genes. Esto se puede superar mediante la ingeniería de ratones para producir neutrófilos que carecen de genes específicos o que albergan mutaciones seleccionadas, lo que, por supuesto, aumenta los costos y la duración de la investigación.
Los procedimientos descritos aquí, aunque están diseñados para investigar la dinámica de la membrana, se pueden adaptar para abordar cualquier cuestión biológica celular, no solo en neutrófilos, sino también en otros tipos de células inmunitarias y células migratorias. La información recopilada a través de la MIV de bajo aumento sobre los comportamientos celulares (por ejemplo, fenotipo migratorio, velocidad celular y direccionalidad22) se puede complementar y correlacionar con la información mecanicista adquirida a través de ISMic sobre el reposicionamiento de orgánulos, la secreción de proteínas, la endocitosis, la dinámica nuclear, la dinámica del calcio, la organización del citoesqueleto y la netosis. El uso de manipulaciones farmacológicas y/o genéticas puede poner de manifiesto el papel de vías moleculares específicas en el proceso de interés, lo que lo convierte en un enfoque único y muy potente.
Divulgaciones
Los autores declaran no tener intereses financieros contrapuestos.
Agradecimientos
Esta investigación fue apoyada por el programa de investigación intramuros de los Institutos Nacionales de Salud, Instituto Nacional del Cáncer, Centro de Investigación del Cáncer.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | USA Scientific | 4036-3204 | |
| 15 mL tubes | Corning | 430766 | |
| 1 mL syringe | Covidien | 8881501400 | |
| 27 G needle | Kendall | 827112 | |
| 27 G winged infusion set | Terumo | SV*27EL | |
| 30x objective | Olympus | UPLSAPO30XS | 1.05 NA, silicon oil immersion |
| 40x objective | Olympus | UPLSAPO40XS | 1.23 NA, silicon oil immersion |
| 60 mm dishes | Falcon | 353002 | |
| 6 mL syringe | Kendall | 8881516937 | |
| Acepromazine (10 mg/mL) | Vet one | 13985-587-50 | |
| ACK lysis buffer | Quality Biological | 118-156-101 | |
| Balance | AND | EK-1200A | |
| BSA | Sigma Aldrich | A9647 | |
| Cell strainer 40 µm | Sigma Aldrich | CLS431750 | |
| Fiji | ImageJ | N/A | Image visualization/analysis software |
| Fluoview Software | Olympus | N/A | Acquisition software |
| FVB mouse strain | Jackson | N/A | FVB background |
| Gas Anesthesia system | Patterson veterinary | 07-8915712 | Link 7 model |
| Green Cell tracker | Thermo | C2925 | Solubilized in cell culture grade DMSO to reach 1 mM concentration (1000x) |
| Hair removal cream | Nair | N/A | |
| HBSS (w/o Ca2+, Mg2+) | Gibco | 14175-095 | |
| HEPES 1 M pH 7.3 | Quality Biological | 118-089-721 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ML | |
| Histopaque 1991 | Sigma Aldrich | 11191-100ML | |
| Imaris | Bitplane | N/A | Image visualization/analysis software |
| Isoflurane | Vet one | 13985-528-40 | |
| Ketamine (100 mg/mL) | Vet one | 13985-584-10 | |
| LyzM-cre x mT/mG | generated in the lab | N/A | C57BL/6J background |
| Manual micromanipulator | WPI | M3301R | |
| MATLAB | MatWorks | N/A | Analysis software |
| mtomato mouse strain | generated in the lab | N/A | mT/mG, FVB background |
| Multiphoton laser | Spectra Physics | Insight DS+ | |
| Multiphoton Microscope | Olympus | MPE-RS | |
| Nanofil 10 µL syringe | WPI | NANOFIL | |
| Nanofil 33 G needle | WPI | NF33BV-2 | |
| Objective heater | Bioptechs | N/A | |
| Objective heater controller | Bioptechs | 150803 | |
| Ophtalmic ointment | Major | NDC 0904-6488-38 | |
| Oxygen concentrator | Caire | VisionAire 5 | |
| PBS (w/o Ca2+, Mg2+) | Quality Biological | 114-058-131 | |
| Saline | Quality Biological | 114-055-101 | |
| Stage heater | Okolab | N/A | |
| Stage heater controller | Okolab | H401-T | |
| Surgical tape | 3M | 1538-1 | Hypoallergenic |
| Syringe driver | Harvard Apparatus | PHD Ultra | |
| Warming Pads | Parkland Scientific | A2789B | |
| Warming Pump | Parkland Scientific | TP-700 | |
| Xylazine (100 mg/mL) | Vet one | 13985-704-10 |
Referencias
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2 (4), 2369-2392 (2012).
- Oudin, M. J., Weaver, V. M. Physical and chemical gradients in the tumor microenvironment regulate tumor cell invasion, migration, and metastasis. Cold Spring Harbor Symposia on Quantitative Biology. 81, 189-205 (2016).
- Devreotes, P., Horwitz, A. R. Signaling networks that regulate cell migration. Cold Spring Harbor Perspectives in Biology. 7 (8), 005959 (2015).
- Alexandrova, A. Y., Chikina, A. S., Svitkina, T. M. Actin cytoskeleton in mesenchymal-to-amoeboid transition of cancer cells. International Review of Cell and Molecular Biology. 356, 197-256 (2020).
- Masedunskas, A., et al. Intravital microscopy. Bioarchitecture. 2 (5), 143-157 (2012).
- Wagner, R. . Explanatory panels on physiology and development history 1839. , (1839).
- Yaniv, K., et al. Live imaging of lymphatic development in the zebrafish. Nature Medicine. 12 (6), 711-716 (2006).
- Vinegoni, C., et al. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. Journal of Visualized Experiments. (30), e1510 (2009).
- Sack, F. -. U. Intravital microscopy of pulmonary microcirculation after single lung transplantation in pigs. Transplantation Proceedings. 38 (3), 737-740 (2006).
- Rehberg, M., Krombach, F., Pohl, U., Dietzel, S. Label-free 3D visualization of cellular and tissue structures in intact muscle with second and third harmonic generation microscopy. PloS One. 6 (11), 28237 (2011).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Intravital third harmonic generation microscopy of collective melanoma cell invasion: Principles of interface guidance and microvesicle dynamics. Intravital. 1, 32-43 (2012).
- Poole, J. J. A., Mostaço-Guidolin, L. B. Optical microscopy and the extracellular matrix structure: A review. Cells. 10 (7), 1760 (2021).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Third harmonic generation microscopy of cells and tissue organization. Journal of Cell Science. 129 (2), 245-255 (2016).
- Ebrahim, S., et al. Dynamic polyhedral actomyosin lattices remodel micron-scale curved membranes during exocytosis in live mice. Nature Cell Biology. 21 (8), 933-939 (2019).
- Shitara, A., et al. Cdc42 negatively regulates endocytosis during apical membrane maintenance in live animals. Molecular Biology of the Cell. 30 (3), 324-332 (2019).
- Masedunskas, A., et al. Role for the actomyosin complex in regulated exocytosis revealed by intravital microscopy. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13552-13557 (2011).
- Subramanian, B. C., et al. The LTB4-BLT1 axis regulates actomyosin and β2-integrin dynamics during neutrophil extravasation. The Journal of Cell Biology. 219 (10), 201910215 (2020).
- Yan, S. L. S., Hwang, I. -. Y., Kamenyeva, O., Kehrl, J. H. In vivo F-Actin filament organization during lymphocyte transendothelial and interstitial migration revealed by intravital microscopy. iScience. 16, 283-297 (2019).
- Porat-Shliom, N., et al. In vivo tissue-wide synchronization of mitochondrial metabolic oscillations. Cell Reports. 9 (2), 514-521 (2014).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10515-10520 (2015).
- Calvo-Rodriguez, M., et al. Increased mitochondrial calcium levels associated with neuronal death in a mouse model of Alzheimer's disease. Nature Communications. 11, 2146 (2020).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Li, J. L., et al. Intravital multiphoton imaging of immune responses in the mouse ear skin. Nature Protocols. 7 (2), 221-234 (2012).
- Swamydas, M., Lionakis, M. S. Isolation, purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments:JoVE. (77), e50586 (2013).
- Rose, S., Misharin, A., Perlman, H. A novel Ly6C/Ly6G-based strategy to analyze the mouse splenic myeloid compartment. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (4), 343-350 (2012).
- Lakschevitz, F. S. Identification of neutrophil surface marker changes in health and inflammation using high-throughput screening flow cytometry. Experimental Cell Research. 342 (2), 200-209 (2016).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. Journal of Visualized Experiments:JoVE. (17), e745 (2008).
- . MATLAB - Bio-Formats 6.1.0 documentation Available from: https://docs.openmicroscopy.org/bio-formats/6.1.0/users/matlab/index.html (2022)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9, 62-66 (1979).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179, 298-310 (1996).
- Xu, C., Prince, J. L. Snakes, shapes, and gradient vector flow. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7 (3), 359-369 (1998).
- Driscoll, M. K., et al. Automated image analysis of nuclear shape: what can we learn from a prematurely aged cell. Aging. 4 (2), 119-132 (2012).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Tauer, U. Advantages and risks of multiphoton microscopy in physiology. Experimental Physiology. 87 (6), 709-714 (2002).
- Débarre, D., Olivier, N., Supatto, W., Beaurepaire, E. Mitigating phototoxicity during multiphoton microscopy of live Drosophila embryos in the 1.0-1.2 µm wavelength range. PloS One. 9 (8), 104250 (2014).
- Masedunskas, A., et al. Intravital microscopy: a practical guide on imaging intracellular structures in live animals. Bioarchitecture. 2 (5), 143-157 (2012).
- Ng, L. G., et al. Visualizing the neutrophil response to sterile tissue injury in mouse dermis reveals a three-phase cascade of events. The Journal of Investigative Dermatology. 131 (10), 2058-2068 (2011).
- Wu, X. S., et al. Melanoregulin regulates a shedding mechanism that drives melanosome transfer from melanocytes to keratinocytes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 2101-2109 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados