Method Article
생리학적 조건에서 세포하막 리모델링을 조사하기 위해 마우스 피부의 호중구 이동을 이미징합니다.
요약
호중구 이동은 화학 유인 물질 및 세포 외 미세 환경과의 상호 작용에 대한 반응으로 원형질막의 빠르고 지속적인 리모델링에 의존합니다. 본원에서는 마취된 마우스의 귀에 주입된 호중구에서 막 리모델링의 역학을 조사하기 위한 Intravital Subcellular Microscopy에 기초한 절차가 설명됩니다.
초록
조직에서의 면역 세포 모집 및 기능에 대한 연구는 지난 20년 동안 매우 활발한 분야였습니다. 호중구는 염증 부위에 도달하고 감염 또는 조직 손상 시 선천성 면역 반응에 참여하는 첫 번째 면역 세포 중 하나입니다. 지금까지 호중구 이동은 균일한 자극 또는 아가로스 또는 미세유체 채널 하에서의 제한된 이동을 기반으로 하는 다양한 시험관 내 실험 시스템을 사용하여 성공적으로 시각화되었습니다. 그러나 이러한 모델은 호중구가 생체 내에서 만나는 복잡한 미세환경을 재현하지 않습니다. 생체 내 세포 내 현미경(ISMic)과 같은 다광자 현미경(MPM) 기반 기술의 개발은 생리학적 조건에서 세포 내 해상도에서 호중구 역학을 시각화하고 조사할 수 있는 고유한 도구를 제공합니다. 특히, 살아있는 마취된 쥐의 귀는 접근성이 용이하고 외과적 노출이 없기 때문에 호중구 간질 이동을 실시간으로 추적할 수 있는 실험적 이점을 제공합니다. ISMic은 시간이 지남에 따라 세포 및 더 중요하게는 세포 내 과정을 3D(4D)로 추적하는 데 필요한 광학 해상도, 속도 및 획득 깊이를 제공합니다. 또한, 간질 미세환경(즉, 혈관, 상주 세포, 세포외 기질)의 다중 모드 이미징은 선별된 형광 마커를 발현하는 형질전환 마우스, 형광 프로브를 통한 외인성 라벨링, 조직 고유 형광 및 2차/3차 고조파 생성 신호의 조합을 사용하여 쉽게 달성할 수 있습니다. 이 프로토콜은 1) 마우스 귀로의 입양 전달을 위한 호중구 준비, 2) 최적의 세포 내 이미징을 위한 다양한 설정, 3) 생리적 반응을 유지하면서 모션 아티팩트를 최소화하는 전략, 4) ISMic을 사용하여 호중구에서 관찰된 막 리모델링의 예, 5) 생체 내 호중구 이동에서 멤브레인 리모델링의 정량 분석을 위한 워크플로우를 설명합니다.
서문
지시된 세포 이동은 발달, 면역 반응, 조직 복구, 종양 시작, 진행 및 전파를 포함한 다양한 생리학적 및 병리학적 과정에서 발생하는 중요한 사건입니다 1,2. 이 과정은 원형질막에서 동족 수용체가 감지한 다음 복잡한 세포 내 신호로 변환되는 특정 세포외 화학주성 신호에 의존합니다. 이러한 경로는 차례로 세포골격의 국소 활성화, 막 이동 및 리모델링, 세포 분극을 포함한 일련의 반응을 통해 세포 이동을 활성화합니다3. 세포 이동의 두 가지 뚜렷한 유형, 즉 중간엽(mesenchymal)과 아메바이드(amoeboid)가 잘 규명되어 있다4. 중간엽 이동은 상대적으로 느리고(<1μm/min), 세포와 세포외 기질(ECM) 사이의 강력한 접착력에 의존하며, 메탈로프로테아제에 의한 기질 분해에 의존합니다. 대조적으로, 염증 신호에 빠르게 반응하는 면역 세포의 특성인 아메보이드 이동은 더 빠르고(>10μm/min) 약한 접착력을 사용하여 ECM을 탐색합니다. 양상에 관계없이, 세포 이동은 원형질막의 지속적인 리모델링을 필요로 하며, 그 결과 세포의 전방 가장자리에 돌출 구조가 생성되며, 이는 후방1에서 막의 수축과 긴밀하게 조정됩니다.
이러한 sub-cellular process의 기저에 있는 분자 메커니즘을 밝히기 위해서는 이동하는 세포에서 막의 역학을 적절한 시간적, 공간적 해상도로 시각화하는 것이 필수적입니다. 더욱이, 막 리모델링은 이동하는 세포를 둘러싼 조직 미세환경의 특성에 큰 영향을 받기 때문에 이 과정을 살아있는 동물 내의 네이티브 조직에서 직접 이미지화하는 것이 중요합니다. 이는 생체 내 현미경(IVM)을 사용하여 수행됩니다5. 최초의 IVM 이미징은 ~200년 전에 수행되었으며, 이때 간단한 투광 현미경6을 사용하여 백혈구 유출을 시각화했으며 그 후 IVM은 주로 제브라피시 및 초파리 7,8과 같은 반투명 모델 유기체에 사용되었습니다. 지난 20년 동안 IVM은 생쥐, 쥐 및 돼지와 같은 더 큰 포유류의 세포 과정을 조사하는 데 성공적으로 사용되었습니다 5,9. 이는 1) 컨포칼 및 다광자(MP) 현미경의 중요한 발전과 2) CRISPR-Cas9과 같은 유전자 편집 기술의 향상으로 인해 다양한 동물 모델의 신속한 엔지니어링을 통해 형광 태그가 부착된 단백질과 리포터를 발현할 수 있게 되었습니다. 게다가, 종양 시작, 세포 이동 및 면역 반응과 같은 과정 동안 개별 세포 및 그들의 미세환경의 시각화는 혈관 구조10,11을 표지하기 위한 염료의 체계적 도입과 같은 외인성 라벨링의 다른 형태와 SHG(Second Harmonic Generation)10를 통한 콜라겐과 같은 내인성 분자의 여기(excitation)에 의해 가능해졌습니다. 12 및 제 3 고조파 생성 (THG)을 통한 신경 섬유 11,13. 마지막으로, 심장 박동 및 호흡으로 인한 움직임 아티팩트를 최소화하는 기술의 개선으로 생체 내 세포 내 현미경(ISMic)이 개발되었으며, 이를 통해 연구자들은 시험관 내에서 관찰된 것과 유사한 해상도 수준으로 살아있는 동물에서 직접 여러 세포 내 이벤트를 이미지화하고 조사할 수 있게 되었습니다 14,15,16,17 . ISMic의 예로는 exocytosis 14,15,16,17 및 endocytosis15 동안의 세포골격 역학 조사, 세포 이동 중 세포골격 동적 리모델링(17,18), 미토콘드리아 국소화 및 대사(19,20), 뇌의 칼슘 신호전달(21) 등이 있습니다.
이 프로토콜은 ISMic을 사용하여 살아있는 마우스의 귀 피부에서 호중구 이동 중 세포 내 해상도에서 세포막 리모델링을 조사하기 위한 다양한 단계와 절차를 자세히 설명합니다. 이 접근법은 앞서 설명한 프로토콜22,23을 기반으로 하며 더 높은 공간적, 시간적 해상도를 달성하도록 조정됩니다.
프로토콜
모든 동물 실험 및 시술은 미국 국립암연구소(National Institutes of Health, Bethesda, MD, USA) 동물 관리 및 사용 위원회(프로토콜 LCMB-031 및 LCMB-035)의 승인을 받았으며 모든 관련 윤리 규정을 준수했습니다. 2개월에서 6개월 사이의 수컷 및 암컷 마우스를 실험에 사용했습니다. mT/mG 및 야생형(WT) 숙주 마우스는 FVB/NJ 배경에 있는 반면 LyzM-Cre x mTmG 마우스는 C57BL/6 배경에 있습니다.
1. 시약 및 도구의 재료 및 준비
- 튜브, 접시 및 바늘/주사기를 교반 하에 밤새 PBS + 1% BSA(칼슘 및 마그네슘 제외)로 코팅합니다.
- 70% 에탄올을 사용하거나 고압멸균을 사용하여 동물 작업에 사용할 표면과 도구/기구를 조심스럽게 청소하십시오.
- 호중구 정제를 위해 다음을 준비하십시오 : 3 x 15 mL 튜브, 1 x 60 mm 접시, 1 x 1.5 mL 튜브; 10mM HEPES(pH 7.3)를 함유하는 HBSS; 적혈구 용해액(ACK); 히스토파케 1077; 및 히스토파케 1119.
- 호중구 주사의 경우 저용량 주사기(10μL) 1개, 33G 베벨 바늘 1개, 이소플루란 및 마취액(식염수에 각각 80mg·kg-1, 2mg· kg-1, 4mg·kg-1의 케타민, 자일라진, 아세프로마진)을 준비합니다.
2. donor mouse의 호중구 정제
- 현지 기관 규정에 따라 기증 마우스를 안락사시킵니다.
- 동물의 긴 뼈(대퇴골, 경골 및 상완골)를 수집하고 뼈의 무결성을 보존하고 수집 중 뼈의 머리를 자르지 않도록 주의하십시오24.
- BSA 코팅된 60mm 접시에서 근육과 지방 조직을 제거합니다. 골수에 접근하기 위해 뼈의 머리를 자른 다음 HBSS가 채워진 주사기(27G 바늘)를 사용하여 골수를 씻어내고 균질화합니다.
- 40μm 스트레이너를 사용하여 용액을 15mL BSA 코팅 튜브에 여과하고 실온(RT)에서 400xg에서 5분 동안 원심분리합니다.
- 상층액을 흡인하고 펠릿을 1mL의 ACK에 30초 동안 현탁시켜 적혈구를 용해시킨 다음 9mL의 HBSS를 추가하여 용해를 중지합니다. 용액을 400 x g 에서 RT에서 5분 동안 원심분리합니다.
- 튜브 하단에 4mL의 1119 Histopaque를 부드럽게 배치한 다음 상단에 4mL의 1077 Histopaque를 부드럽게 층층하여 15mL BSA 코팅 튜브에 밀도 단계 구배를 준비합니다. 두 층을 혼합하지 않도록 각별히 주의하십시오.
- 상층액을 흡인하고 세포 펠릿을 HBSS 2mL에 재현탁시킵니다. 위에서 준비한 단계 그래디언트 위에 용액을 부드럽게 층을 이룹니다. 가능한 가장 낮은 가속 및 감속 속도로 RT에서 1,000 x g 로 30분 동안 회전합니다("브레이크 없음" 선호).
- 튜브 상단에서 1077 히스토파크 층의 절반을 부드럽게 흡입합니다. 1077 히스토파크층의 나머지 절반과 1119 히스토파크층의 상반부를 새로운 BSA 코팅된 튜브에 모읍니다. 두 밀도 층 사이의 흐린 세포 현탁액에는 주로 호중구가 포함되어 있습니다.
- HBSS를 추가하여 최종 부피인 15mL에 도달하고 튜브를 뒤집어 부드럽게 섞습니다. 실온에서 400 x g 에서 5 분 동안 회전합니다.
- 원심분리 후 세포 펠릿을 10mL의 HBSS로 재현탁 및 세척하고 실온에서 400 x g 에서 5분 동안 회전시킵니다. 절차를 반복한 다음 펠릿을 15mL의 HBSS에 재현탁시켜 세포 카운터를 사용하여 세포 수를 확인합니다. 마지막으로, 1mL의 HBSS에서 세포를 회전 및 재현탁하고 1.5mL BSA 코팅 튜브로 옮깁니다.
- 정제 후, 라벨링 및/또는 주입할 때까지 RT의 튜브 회전기에서 30분 동안 BSA 코팅 튜브의 호중구 현탁액을 부드러운 교반 하에 유지합니다.
참고: 성공적인 정제는 95% 순도의 마우스당 10-20 x 106개의 호중구를 생성합니다. 순도는 이전에 설명한 호중구 마커(Ly6G+, Ly6C-, Gr1+ 및 CD11b+)25,26를 사용하여 유세포 분석을 통해 평가됩니다.
참고: 인간 말초 혈액 및 마우스 골수로부터의 호중구 정제에 대한 프로토콜은이전에 사용 가능했습니다 24,27.
3. 호중구 라벨링
참고: 호중구를 시각화하기 위해 골수성 세포가 GFP와 융합된 막 표적 펩타이드를 발현하는 LyzM-Cre mT/mG 마우스에서 정제했습니다. 또한, 야생형(WT) 마우스에서 정제된 호중구를 시험관 내에서 라벨링하였다. 다음 단계에서는 상용 세포 투과성 녹색 형광 염료로 정제된 호중구를 라벨링하는 데 사용되는 절차를 설명하며, 선택한 다른 MPM 호환 형광 프로브에 적용할 수 있습니다.
- 녹색 형광 염료(제조업체 권장 농도, 여기서는 1μM)를 1.5mL BSA 코팅 튜브의 호중구 현탁액(WT 마우스에서 정제)에 추가합니다. 튜브 로테이터에서 부드러운 교반 하에 RT에서 30분 동안 배양합니다.
- HBSS를 사용하여 3회 세척하고, 400 x g 에서 RT에서 5분 동안 회전하고, 펠릿을 HBSS 1mL에 재현탁시킵니다.
- BSA 코팅된 튜브의 호중구 현탁액을 주입 절차까지 RT의 튜브 회전기에서 부드럽게 교반하면서 유지하십시오.
참고: 라벨링 직후 라벨링된 호중구를 주입하는 것이 매우 선호됩니다. 그러나 필요한 경우 라벨링된 호중구는 in vivo 호중구 반응의 무결성을 손상시키지 않고 라벨링 후 추가로 10-15분 동안 교반 상태로 유지할 수 있습니다. 장기간의 교반(라벨링 후 60분 이상)은 응집, 호중구 사망 및 생체 내 관찰에 대한 오해의 소지가 있는 관찰로 이어질 수 있습니다. - 주입 직전에 세포 펠릿을 식염수에 재현탁시켜 20 μL당 2-5 x 106 세포의 밀도에 도달합니다.
4. 호중구 주사
참고: 마취는 지역 기관 동물 보호 및 사용 위원회 지침에 따라 수행해야 합니다.
- 동물을 밀폐된 챔버에 넣고 산소 발생기에 연결된 보정된 기화기를 사용하여 3%-5% 이소플루란(2L/min의 유속)을 투여합니다.
- 뒷발 패드를 꼬집었을 때 발 후퇴 반사를 테스트하여 동물이 의식을 잃었는지 평가합니다. 그런 다음 동물을 보온 패드(37°C)로 옮겨 체온을 유지합니다. 노즈 콘을 통해 이소플루란(1%-2%, 유속 0.5L/min)을 계속 투여합니다.
안전 참고 사항: 독성 이소플루란에 대한 직원 노출을 제한하려면 필터링 장치가 장착된 디스펜서 시스템을 사용하여 순환 이소플루란을 다시 포집하는 것이 좋습니다. - 이미징 품질을 최적화하려면 미세한 트리머를 사용하여 귀에서 머리카락을 제거하십시오. 이 절차는 실험 하루나 이틀 전에 수행할 수도 있습니다.
참고: 제모 크림의 사용은 쥐 피부의 염증 반응을 악화시키고 이미징 아티팩트를 유발하는 것으로 알려져 있으므로 사용하지 않는 것이 좋습니다. - 동물을 옆으로 눕힙니다. 수술용 테이프를 사용하여 귀 가장자리를 잡고 보온 패드를 따라 평평하게 펴십시오. 귀가 손상되지 않도록 테이프를 부드럽게 붙입니다.
- 33G 바늘이 장착된 주사기에 호중구 현탁액(20μL당 2-5 x 106 세포)을 채우고 마이크로 매니퓰레이터에 장착합니다.
알림: 보온 패드에서 바늘과 귀 사이의 주입 각도는 조직 손상을 최소화하고 세포 주입 성공률을 높이기 위해 10°에서 30° 사이여야 합니다. - 바늘 (비스듬한 상태에서)을 귀 쪽으로 부드럽게 움직여 천천히 피부를 뚫습니다. 바늘이 피부 안쪽에 들어가면 피스톤을 천천히 밀어 2-3 μL의 세포 현탁액을 전달합니다.
알림: 혈관이 보이는 부위는 혈관을 손상시키면 주사에 대한 원치 않는 복잡한 면역 반응과 이미징 문제가 발생하므로 피해야 합니다. - 귀의 2-3 다른 부위, 가급적이면 2-3mm 간격으로 주사를 반복하십시오. 셀 현탁액으로 귀를 "과도하게 채우지" 마십시오.
알림: 주사는 귀 중앙에서 수행해야 합니다. 귀 주변부는 얇아서 손상되기 쉬우므로 주의해서 다루어야 하는 반면, 귀 주변부는 두꺼워서 혈관이 크고 모낭이 적어 많은 주입량을 견딜 수 있습니다. - 수술용 테이프를 조심스럽게 제거하고 동물이 감독 하에 의식을 회복하도록 하십시오. 조직과 세포가 주입 절차에서 회복될 수 있도록 이미징하기 전에 동물을 1시간 동안 쉬게 하십시오.
5. IVM을 위한 마취
참고: 더 깊은 마취는 심장 박동과 호흡으로 인한 움직임 아티팩트를 줄여 이미징 품질을 크게 향상시킵니다. 호중구 주입 쥐는 가스 유도 마취보다 더 깊은 진정을 제공하는 화학 마취를 받습니다. 마취는 지역 기관 동물 보호 및 사용 위원회 지침에 따라 수행해야 합니다.
- 호중구 주사 후 회복 1시간 후, 식염수에 자일라진/케타민/아세프로마진(각각 80mg·kg-1, 2mg·kg-1, 4mg·kg-1)의 혼합물을 함유한 피하 주사로 동물을 마취시킨다.
참고: 결과의 재현성과 신뢰성을 보장하기 위해 마취 시점부터 실험이 끝날 때까지 온난화 펌프에 연결된 가열 패드 또는 물 순환 패드를 사용하여 동물을 따뜻하게 유지해야 합니다. - 마취를 1시간 이상 유지하기 위해 케타민/아세프로마진(각각 40mg·kg-1, 2mg·kg-1 )의 혼합물을 40분마다 피하로 주사합니다. 마취된 쥐를 주기적으로 모니터링하여 발 철수 반사를 테스트하여 의식의 징후를 확인합니다.
- 또한 1시간 이상 지속되는 영상 시술의 경우 마취 중 각막 건조를 방지하고 식염수(시간당 200μL)를 피하 주사하여 신체 수분을 유지하기 위해 멸균 비약물 안과 연고를 눈에 바르십시오.
알림: 또는 디지털 방식으로 제어되는 관류 기반 시스템을 사용하여 마취 용액의 주기적이고 원활한 주입 및/또는 수액 제공을 보장할 수 있습니다. 자동 주사기 드라이버를 설정하여 원하는 양의 마취제를 투여하고 더 오랜 기간 동안 수분을 공급할 수 있습니다. 이를 위해 날개 달린 주입 바늘을 동물의 등쪽 피부에 피하로 삽입하고 수술용 테이프로 고정할 수 있습니다.
6. 이미징
참고: 여기에 설명된 동물 설정 및 이미징 매개변수는 단일 레이저 라인이 장착된 도립 다광자 현미경에 최적화되어 있어 다양한 형광단에서 방출을 여기시키고 동시에 수집합니다.
- 마취된 동물을 현미경 스테이지에 놓기 전에 현미경이 켜져 있고 스테이지와 렌즈가 모두 37°C로 예열되어 있는지 확인하십시오. 가열식 렌즈와 정렬된 유리 커버슬립(두께 #1 또는 1.5)으로 스테이지의 구멍을 덮습니다.
- 동물을 조심스럽게 무대 위로 옮깁니다. 장기간(>1시간) 이미징을 계획하는 경우 위에서 설명한 대로 안과 연고를 바르고 날개 달린 주입 기반 관류 시스템을 고정합니다.
- 커버슬립 중앙에 식염수 한 방울을 떨어뜨리고 호중구가 주입된 귀를 그 위에 놓습니다. 커버슬립 중앙을 가로질러 멸균 면봉을 사용하여 귀를 부드럽게 평평하게 펴서 공기 주머니를 제거합니다.
참고: 귀와 커버슬립 사이에 식염수(또는 PBS)를 적용하면 에어 포켓으로 인한 빛 굴절이 줄어들어 균일한 굴절률과 우수한 이미징 품질을 보장할 수 있습니다. - 나무 막대기(면봉에서 제거)를 동물의 머리에 더 가까운 귀 옆으로 부드럽게 누르고 테이프를 사용하여 잠궈 귀를 고정합니다(그림 1A).
알림: 고정된 나무 스틱은 심장 박동과 호흡으로 인한 움직임 아티팩트를 최소화하고 이미징 품질을 크게 향상시킵니다. 중요한 것은 나무 막대기는 혈류를 방해하지 않고 귀를 안정시킬 수 있을 만큼만 조여야 한다는 것입니다. - 현미경 접안렌즈를 사용하여 관심 영역을 찾은 다음 다광자 획득 모드로 전환합니다.
- 레이저 여기 파장을 900-930nm로 설정하면 GFP/녹색 형광 염료, mTomato 및 콜라겐-I(SHG를 통해 )를 동시에 획득할 수 있습니다.
- 방출된 빛을 수집하기 위해 감지기에 적절한 미러 세트와 필터 조합을 설정합니다(대역 통과 필터: 파란색 = 410-460nm, 녹색 = 495-540nm, 빨간색 = 580-640nm).
참고: 주입된 호중구는 녹색 형광 염료로 라벨링될 때 귀의 더 깊은 부분에 주입되더라도 현미경 접안렌즈 아래에서 볼 수 있는 강한 녹색 형광을 나타냅니다. - 하드웨어 구성에 가장 적합한 설정을 결정합니다. 이동하는 세포를 30초에서 1분 간격으로 추적할 수 있더라도 더 빠른 속도(최소 <10초 간격)로 세포 내 이벤트를 이미징할 수 있습니다. 아래 예에서는 기존 IVM과 ISMic의 차이점을 보여주기 위해 두 가지 이미징 설정을 제시합니다.
- 세포 이동을 추적하고 숙주 쥐 조직을 조사하기 위한 기존 IVM 접근 방식(그림 1)에서는 30x 렌즈와 이미지 크기가 512 x 512 픽셀(픽셀 크기 0.83μm)인 galvo 스캐너를 사용하고 단계 크기가 2 μm인 전동 스테이지를 사용하여 z축 변위를 설정하여 30초마다 30μm 깊이의 부피를 이미징할 수 있습니다.
- 더 높은 배율과 해상도(그림 2)에서 매우 동적인 멤브레인 리모델링을 이미지화하는 ISMic 접근 방식에서는 40x 렌즈와 3x 평균 및 이미지 크기가 512 x 512 픽셀(픽셀 크기 0.25μm)인 공진 스캐너를 사용하고 단계 크기가 1μm인 피에조를 사용하여 z축 변위를 설정합니다. 4-5초마다 20μm 깊이의 이미징이 가능합니다.
- 멸균 레이저 손상을 유도하여 호중구 이동을 유발합니다. 여기 레이저를 최소 80mW22에 도달할 수 있을 만큼 충분한 고출력으로 조직의 좁은 영역(20μm x 20μm)에 10초 동안 집중시킵니다.
- 모든 채널에서 나타나는 강력한 자동 형광 신호와 그에 따른 콜라겐 배열의 변화로 레이저로 인한 부상을 식별합니다(그림 1D).
알림: 신뢰할 수 있는 결과를 얻으려면 항상 혈관에서 가능한 한 멀리 부상을 유발해야 합니다. 파열되면 조직으로 방출되는 혈액 세포는 이미징 품질에 영향을 미칠 뿐만 아니라 전반적인 면역 반응이 강해집니다. - 추가 분석을 위해 실험이 끝날 때 데이터를 저장합니다.
- 현지 기관 지침에 따라 동물을 안락사시킵니다. 필요한 경우 고정 및 추가 처리를 위해 조직을 수집할 수 있습니다.
7. 대표 데이터 분석
알림: 데이터는 현미경 소프트웨어, 타사 소프트웨어 또는 맞춤형 프로그램을 사용하여 시각화하고 분석할 수 있습니다. 사용되는 절차와 도구는 조사관의 특정 요구 사항에 따라 다릅니다. 여기에 표시된 것은 이동하는 호중구의 선행 가장자리와 후면에서 막 곡률과 국소 면적 변화를 정량화하는 워크플로우의 한 예입니다.
- Imaris 또는 Fiji로 이미징 파일을 열어 호중구의 이동을 4D로 시각화하고 실험의 품질을 확인합니다.
참고: Imaris와 Fiji는 여러 현미경 브랜드의 이미징 형식을 읽을 수 있습니다. - 사용자 지정 MATLAB 코드 스크립트를 실행하여 다음 단계에 따라 데이터를 처리합니다. MATLAB용 Bio-Formats28 패키지를 사용하여 선택한 이미징 파일을 읽어 들입니다. 3D 볼륨의 각 프레임을 Otsu 알고리즘29 로 분할하여 개별 셀을 식별합니다.
- 최소 변위 기준30에 따라 식별된 물체를 추적합니다.
- 객체의 활성 윤곽선과 경계를 결정합니다.
- 시간 프레임에서 식별된 각 개체에 대해 최대 투영을 생성합니다.
- MATLAB의 bwboundaries 함수를 7.2단계에서 식별된 각 객체의 max-projection에 적용하여 100개의 경계 점을 생성합니다.
- http://www.iacl.ece.jhu.edu/static/gvf/ 를 통해 다운로드한 MATLAB 패키지의 함수를 사용하여 동적 윤곽 알고리즘으로 식별된 경계점을 최적화하여 서브픽셀 정밀도31(그림 3A)을 달성합니다.
- 7.3 단계의 추적에 의해 결정된 물체의 경계와 물체 궤적 인덱스를 원본 이미지의 최대 투영과 오버레이하여 시각화 및 수동 확인을 위해 2D 오버레이 동영상의 출력을 생성합니다.
- 오버레이된 동영상에서 셀이 아닌 객체, 접촉하는 객체 및 불완전한 경계가 있는 객체를 제외하여 이동하는 것으로 식별된 모든 객체를 수동으로 선택합니다. 각 셀 궤적의 추적 인덱스, 시작 및 끝 프레임을 스프레드 시트에 기록하여 MATLAB 코드 스크립트로 구현된 다음 단계에 대한 입력으로 사용할 수 있습니다.
- 최소 변위 기준에 따라 각 프레임에서 다음 프레임까지 셀 경계점을 추적합니다. MATLAB의 Polyarea 함수를 사용하여 두 개의 연속된 시간 프레임에서 인접한 경계점으로 밑줄이 그어진 면적을 계산합니다(그림 3C). 로컬 셀 경계가 셀에서 바깥쪽으로 이동하는 경우 영역 변경에 양수 부호를 지정합니다. 로컬 셀 경계가 셀 안쪽으로 이동하는 경우 영역 변경에 음수 부호를 지정합니다.
- 인접 경계점을 원(한 변당 5개, 총 11)32 에 맞춰 각 프레임의 각 경계점에서 국부적인 멤브레인 곡률을 측정합니다(그림 3B).
- MATLAB의 imagesc 함수(그림 3D,E)를 사용하여 키모그래프를 생성하여 시간 경과에 따른 세포 내 특징의 변화를 보여주고 세포의 위치와 관련시킵니다.
결과
여기에서는 각각 셀룰러 및 서브셀룰러 분해능을 제공하는 고전적인 IVM 및 ISMic을 설명하기 위해 두 가지 다른 결과 세트가 제시됩니다. 첫 번째 예에서는, 야생형(WT) 마우스에서 호중구를 정제하고, 세포질을 염색하기 위해 Cell Tracker Green으로 라벨링한 다음, 원형질막을 표적으로 하는 형광 단백질을 발현하는 형질전환 마우스(mTomato 마우스, mT/mG33, 그림 1 및 영화 1 및 영화 2)에 주입했습니다. 이 수용 마우스는 IVM 기반 접근 방식(단계 6.8.1)을 통해 혈관, 상주 세포 및 모낭(그림 1C 및 동영상 1)과 같은 귀 조직의 구조적 특징을 시각화할 수 있었습니다. SHG(여기 파장의 절반에서 감지됨)를 통해 드러난 콜라겐 섬유는 호중구가 주입되는 진피의 복잡한 네트워크에 배열되었습니다. 모낭(HF)의 가장자리를 따라 상피 세포층(즉, 각질 형성 세포)이 관찰되었습니다. 때때로, 피부의 국부적 함몰을 초래하는 잔여 모발의 아티팩트가 시각화되었습니다(H). 레이저로 인한 손상은 모든 채널에서 감지되는 강력한 자동 형광과 콜라겐 배열의 변화로 인해 쉽게 시각화되었습니다(그림 1D). 피부의 3D 구조와 주입된 호중구의 위치 파악에 대한 보다 완전한 관점은 외부 레이어에서 내부 레이어까지 피부의 Z 스택과 3D 볼륨 렌더링을 묘사하는 영화 1에서 감상할 수 있습니다. 타임랩스 이미징은 호중구가 귀 피부를 샘플링하고 ECM 및 숙주 조직과 상호 작용하는 것을 보여주었습니다(영화 2). 이 해상도에서 이미징하고 30초마다 Z 스택을 획득하면 세포 추적을 수행하고 운동성 매개변수(즉, 속도 및 방향성)를 측정할 수 있지만 이 해상도에서는 멤브레인 리모델링을 정확하고 상세하게 분석하기가 어렵습니다.
두 번째 예에서는 LyzM-cre mT/mG 마우스에서 정제하고 WT 동물에 주입한 mGFP 발현 호중구를 사용하여 ISMic 접근법(단계 6.8.2)을 통해 멤브레인 리모델링을 평가했습니다(그림 2A, 실험 순서도). ISMic 프로토콜(그림 3 및 그림 2B의 정지 이미지)을 사용하고 레이저 손상 시 이동 중에 원형질막의 동적 리모델링이 관찰되고 앞쪽 가장자리의 막 돌출부 형성과 세포 뒤쪽의 수축이 명확하게 시각화됩니다(그림 2 및 동영상 3). 영화 3에서 강조된 타임랩스 시퀀스는 ECM과의 상호 작용의 복잡성을 보여줍니다. 실제로, 호중구는 섬유를 따라 또는 섬유와 섬유 사이의 공간을 이동하면서 틈새 공간을 통해 이동했습니다. 마지막으로, 곡률의 변화와 세포의 전면과 후면의 면적 변화와 같은 정량적 측면을 각 시점에 대해 정량화했습니다. 그림 2B에 설명된 세포를 예로 들면, 세포 표면 아래에 있는 100개의 경계점 식별을 기반으로 알고리즘 파이프라인(7단계 참조)을 사용하여 원형질막의 국소 역학을 분석했습니다(그림 3A). 국부 곡률(그림 3B)과 원형질막 돌출부에 의해 밑줄이 그어진 영역(그림 3C)의 변화는 각 경계점에 대해 계산되고 각 시간 프레임에 대해 카이모그래프(그림 3D,E)로 보고되었습니다. 셀의 앞면과 뒷면 모두 셀의 측면보다 더 높은 곡률을 유지합니다(그림 3D). 음의 영역 변화(수축, 파란색 영역)는 양의 영역 변화(돌출부, 빨간색 영역)가 더 두드러지는 선행 가장자리보다 셀 뒤쪽에서 더 뚜렷합니다(그림 3E).
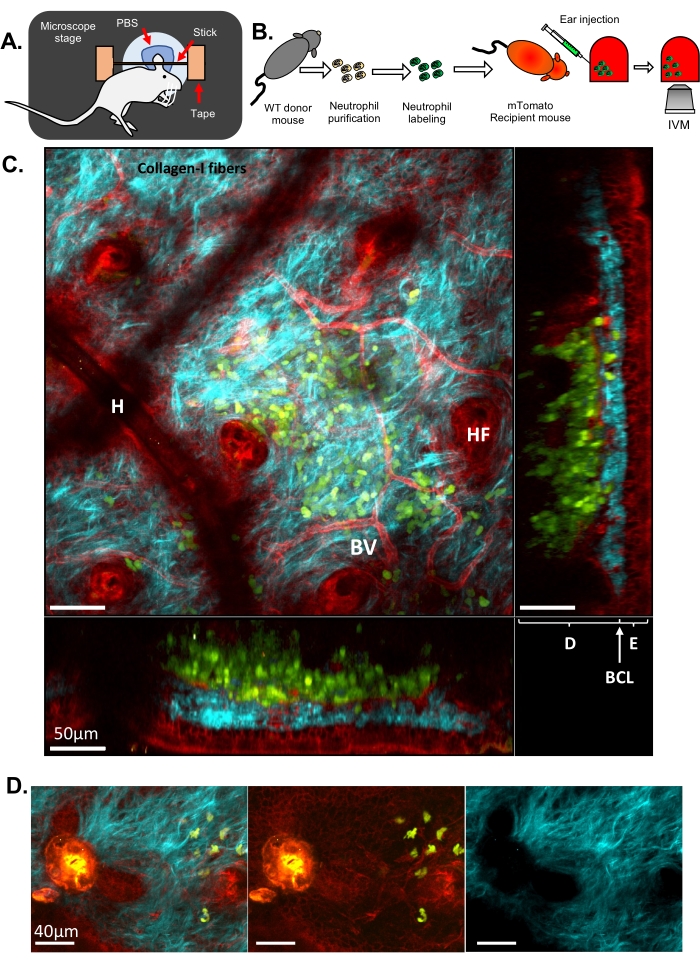
그림 1: 쥐 귀 피부의 호중구 IVM. (A) 현미경 스테이지의 귀 설정의 개략도. (B) 실험 순서도. (C) 형광 표지된 호중구를 주입한 mTomato 마우스의 귀 피부의 대표적인 이미지. 모낭(HF), 혈관(BV), 표피(E), 진피(D), 기저세포층(BCL) 및 모발 인공물(피부 표면의 잔여 모발, H로 인해). (D) 멸균 레이저 손상 후 마우스 피부의 대표 이미지: 파란색 채널(오른쪽), 녹색 및 빨간색 채널(가운데), 병합된 이미지(왼쪽). 녹색 및 적색 채널 모두에서 강력한 자가형광 방출과 콜라겐-I 섬유에 구멍이 형성되어 관찰되는 ECM의 중단으로 인해 이미지 왼쪽에서 부상을 볼 수 있습니다. C 와 D에서 녹색: 호중구; 빨간색: 마우스 숙주 조직; 시안: 콜라겐-I SHG. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: WT 마우스 귀에서 이동하는 mGFP 호중구의 타임랩스. (A) 실험 순서도. (B) 영화 3의 대표 정지 이미지. (C) 멤브레인 3D 조직을 시각화하기 위한 동일한 셀의 부피 렌더링. 높은 멤브레인 역학 영역은 화살표(수축을 나타내는 빨간색, 돌출을 나타내는 파란색)로 표시됩니다. (D) 렌더링된 셀 볼륨의 클로즈업 및 기울어진 시각화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: ISMic을 사용하여 수집된 막 역학의 정량화를 위한 분석 파이프라인. (A) 그림 2B에 설명된 mGFP 호중구에 대한 두 개의 연속적인 프레임 간에 세포 윤곽 측정 및 경계 지점 재분할(100 경계 지점). (B) 색상이 지정된 경계는 모든 경계 점에 대해 결정된 로컬 멤브레인 곡률을 나타냅니다. (C) 두 개의 연속된 프레임 사이의 로컬 영역 변경(현재: 파란색, 다음: 빨간색). 초록색 영역은 로컬 멤브레인 운동의 추적 결과를 나타냅니다. 노란색 화살표는 멤브레인 변위의 일반적인 방향을 나타냅니다. (D) 시간 경과에 따른 셀의 경계 곡률 키모그래프. 세로축은 경계점 인덱스를 나타내며, 여기서 1과 100은 이동 방향에 따른 셀의 뒤쪽을 나타냅니다. (E) 시간 경과에 따른 세포의 막 돌출(빨간색)과 막 수축(파란색)을 반영하는 국소 면적 변화 키모그래프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 1: IVM을 사용하여 mTomato 마우스 귀에서 시각화된 녹색 표지 호중구. 빨간색: mTomato 숙주 쥐 조직. 청록색: 콜라겐-I SHG; 녹색: 호중구. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 2: mTomato 쥐의 귀 피부에서 이동하는 호중구의 IVM. 비디오는 5프레임/초의 프레임 속도로 ͂27분 동안 획득한 이미지 스택의 최대 강도 투영입니다. 빨간색: mTomato 숙주 쥐 조직. 청록색: 콜라겐-I SHG; 녹색: 호중구. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 3: WT 마우스 귀에서 호중구 이동 중 막 리모델링의 ISMic. 비디오는 10프레임/초의 프레임 속도로 ͂8분 동안 획득한 이미지 스택의 최대 강도 투영입니다. 빨간색: mTomato 숙주 쥐 조직. 청록색: 콜라겐-I SHG; 녹색: mGFP 호중구; 연한 녹색: 렌더링된 호중구. 이 영화를 다운로드하려면 여기를 클릭하십시오.
토론
세포 이동 및 막 리모델링 분야에서 수십 년 동안 발전했음에도 불구하고 살아있는 동물의 세포 내 특징을 시각화하기 위해 IVM을 사용한 연구는 거의 없습니다. 이 프로토콜에 설명된 절차는 살아있는 동물의 호중구 이동, 특히 이 과정 중 원형질막 리모델링에 대한 새로운 통찰력을 얻을 수 있는 강력한 도구를 제공합니다. 이 접근법은 조직 미세환경의 고유한 복잡성을 고려하여 생리학적 조건에서 호중구 이동을 조사할 수 있게 합니다. 실제로, MPM을 사용하면 선택된 형광 마커를 발현하는 마우스 균주, 외인성 조직 라벨링, 내인성 형광의 여기 및 SHG 또는 THG12,13을 통해 생성된 신호의 조합을 사용하여 숙주 조직 내의 여러 기능을 시각화할 수 있습니다.
이 절차에서 고려해야 할 한 가지 잠재적인 문제는 광손상입니다. MPM이 일반적으로 광표백 및 광독성과 관련하여 컨포칼 현미경보다 안전하지만, 살아있는 조직을 이미징할 때 주의를 기울여야 한다34. 광독성은 작고 밝은 반점에서 손상된 조직의 더 넓은 영역에 이르기까지 다양한 이미징 아티팩트를 생성하거나 다양한 세포 내 경로를 억제/자극함으로써 결과를 크게 방해할 수 있습니다. 광독성을 방지하기 위해 레이저 출력을 최소한으로 유지해야 하며 생리적 조건(예: 혈류 측정, 산화 스트레스 프로브)이 유지되는지 확인할 수 있도록 적절한 제어를 설계해야 합니다35,36. 더욱이, 피부와 관련된 이 특정 절차에서는 어두운 코팅 동물에 존재하는 멜라닌이 광독성에 더 민감하기 때문에 알비노 균주가 적극 권장됩니다 36,37,38.
이 절차의 주요 제한 사항 중 하나는 사용된 현미경 시스템과 호중구의 특성입니다. MPM을 사용하면 다른 광학 현미경 기술(예: 공초점, 회전 디스크)과 비교할 때 조직 이미징의 깊이가 크게 증가하지만 귀에서 세포 내 역학을 시각화하는 능력은 조직의 가장 바깥층(80-100μm)으로 제한됩니다. 이는 두꺼운 ECM 층에 의해 생성되는 강렬한 광 산란으로 인해 더 깊은 층에서의 이동을 조사하기 어렵기 때문입니다. 또 다른 한계는 호중구는 수명이 매우 짧고 유전자 편집 기술을 수행할 수 있을 만큼 충분히 오래 배양할 수 없다는 사실입니다. 이는 특정 유전자가 없거나 선택된 돌연변이를 품고 있는 호중구를 생산하도록 마우스를 엔지니어링함으로써 극복할 수 있으며, 이는 물론 연구 비용과 기간을 증가시킵니다.
여기에 설명된 절차는 막 역학을 조사하기 위해 고안되었지만, 호중구뿐만 아니라 다른 면역 세포 유형 및 이동 세포의 모든 세포 생물학적 문제를 해결하도록 조정할 수 있습니다. 세포 행동(예: 이동 표현형, 세포 속도 및 방향성22)에 대한 저배율 IVM을 통해 수집된 정보는 세포 기관 재배치, 단백질 분비, 세포내이입, 핵 역학, 칼슘 역학, 세포골격 조직 및 네토시스에 대한 ISMic을 통해 얻은 기계론적 정보와 보완되고 상관될 수 있습니다. 약리학적 및/또는 유전자 조작의 사용은 관심 과정에서 특정 분자 경로의 역할을 강조할 수 있으므로 이는 독특하고 매우 강력한 접근 방식입니다.
공개
저자는 경쟁하는 재정적 이익이 없음을 선언합니다.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health), 국립암연구소(National Cancer Institute), 암연구센터(Center for Cancer Research)의 교내 연구 프로그램의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | USA Scientific | 4036-3204 | |
| 15 mL tubes | Corning | 430766 | |
| 1 mL syringe | Covidien | 8881501400 | |
| 27 G needle | Kendall | 827112 | |
| 27 G winged infusion set | Terumo | SV*27EL | |
| 30x objective | Olympus | UPLSAPO30XS | 1.05 NA, silicon oil immersion |
| 40x objective | Olympus | UPLSAPO40XS | 1.23 NA, silicon oil immersion |
| 60 mm dishes | Falcon | 353002 | |
| 6 mL syringe | Kendall | 8881516937 | |
| Acepromazine (10 mg/mL) | Vet one | 13985-587-50 | |
| ACK lysis buffer | Quality Biological | 118-156-101 | |
| Balance | AND | EK-1200A | |
| BSA | Sigma Aldrich | A9647 | |
| Cell strainer 40 µm | Sigma Aldrich | CLS431750 | |
| Fiji | ImageJ | N/A | Image visualization/analysis software |
| Fluoview Software | Olympus | N/A | Acquisition software |
| FVB mouse strain | Jackson | N/A | FVB background |
| Gas Anesthesia system | Patterson veterinary | 07-8915712 | Link 7 model |
| Green Cell tracker | Thermo | C2925 | Solubilized in cell culture grade DMSO to reach 1 mM concentration (1000x) |
| Hair removal cream | Nair | N/A | |
| HBSS (w/o Ca2+, Mg2+) | Gibco | 14175-095 | |
| HEPES 1 M pH 7.3 | Quality Biological | 118-089-721 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ML | |
| Histopaque 1991 | Sigma Aldrich | 11191-100ML | |
| Imaris | Bitplane | N/A | Image visualization/analysis software |
| Isoflurane | Vet one | 13985-528-40 | |
| Ketamine (100 mg/mL) | Vet one | 13985-584-10 | |
| LyzM-cre x mT/mG | generated in the lab | N/A | C57BL/6J background |
| Manual micromanipulator | WPI | M3301R | |
| MATLAB | MatWorks | N/A | Analysis software |
| mtomato mouse strain | generated in the lab | N/A | mT/mG, FVB background |
| Multiphoton laser | Spectra Physics | Insight DS+ | |
| Multiphoton Microscope | Olympus | MPE-RS | |
| Nanofil 10 µL syringe | WPI | NANOFIL | |
| Nanofil 33 G needle | WPI | NF33BV-2 | |
| Objective heater | Bioptechs | N/A | |
| Objective heater controller | Bioptechs | 150803 | |
| Ophtalmic ointment | Major | NDC 0904-6488-38 | |
| Oxygen concentrator | Caire | VisionAire 5 | |
| PBS (w/o Ca2+, Mg2+) | Quality Biological | 114-058-131 | |
| Saline | Quality Biological | 114-055-101 | |
| Stage heater | Okolab | N/A | |
| Stage heater controller | Okolab | H401-T | |
| Surgical tape | 3M | 1538-1 | Hypoallergenic |
| Syringe driver | Harvard Apparatus | PHD Ultra | |
| Warming Pads | Parkland Scientific | A2789B | |
| Warming Pump | Parkland Scientific | TP-700 | |
| Xylazine (100 mg/mL) | Vet one | 13985-704-10 |
참고문헌
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2 (4), 2369-2392 (2012).
- Oudin, M. J., Weaver, V. M. Physical and chemical gradients in the tumor microenvironment regulate tumor cell invasion, migration, and metastasis. Cold Spring Harbor Symposia on Quantitative Biology. 81, 189-205 (2016).
- Devreotes, P., Horwitz, A. R. Signaling networks that regulate cell migration. Cold Spring Harbor Perspectives in Biology. 7 (8), 005959 (2015).
- Alexandrova, A. Y., Chikina, A. S., Svitkina, T. M. Actin cytoskeleton in mesenchymal-to-amoeboid transition of cancer cells. International Review of Cell and Molecular Biology. 356, 197-256 (2020).
- Masedunskas, A., et al. Intravital microscopy. Bioarchitecture. 2 (5), 143-157 (2012).
- Wagner, R. . Explanatory panels on physiology and development history 1839. , (1839).
- Yaniv, K., et al. Live imaging of lymphatic development in the zebrafish. Nature Medicine. 12 (6), 711-716 (2006).
- Vinegoni, C., et al. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. Journal of Visualized Experiments. (30), e1510 (2009).
- Sack, F. -. U. Intravital microscopy of pulmonary microcirculation after single lung transplantation in pigs. Transplantation Proceedings. 38 (3), 737-740 (2006).
- Rehberg, M., Krombach, F., Pohl, U., Dietzel, S. Label-free 3D visualization of cellular and tissue structures in intact muscle with second and third harmonic generation microscopy. PloS One. 6 (11), 28237 (2011).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Intravital third harmonic generation microscopy of collective melanoma cell invasion: Principles of interface guidance and microvesicle dynamics. Intravital. 1, 32-43 (2012).
- Poole, J. J. A., Mostaço-Guidolin, L. B. Optical microscopy and the extracellular matrix structure: A review. Cells. 10 (7), 1760 (2021).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Third harmonic generation microscopy of cells and tissue organization. Journal of Cell Science. 129 (2), 245-255 (2016).
- Ebrahim, S., et al. Dynamic polyhedral actomyosin lattices remodel micron-scale curved membranes during exocytosis in live mice. Nature Cell Biology. 21 (8), 933-939 (2019).
- Shitara, A., et al. Cdc42 negatively regulates endocytosis during apical membrane maintenance in live animals. Molecular Biology of the Cell. 30 (3), 324-332 (2019).
- Masedunskas, A., et al. Role for the actomyosin complex in regulated exocytosis revealed by intravital microscopy. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13552-13557 (2011).
- Subramanian, B. C., et al. The LTB4-BLT1 axis regulates actomyosin and β2-integrin dynamics during neutrophil extravasation. The Journal of Cell Biology. 219 (10), 201910215 (2020).
- Yan, S. L. S., Hwang, I. -. Y., Kamenyeva, O., Kehrl, J. H. In vivo F-Actin filament organization during lymphocyte transendothelial and interstitial migration revealed by intravital microscopy. iScience. 16, 283-297 (2019).
- Porat-Shliom, N., et al. In vivo tissue-wide synchronization of mitochondrial metabolic oscillations. Cell Reports. 9 (2), 514-521 (2014).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10515-10520 (2015).
- Calvo-Rodriguez, M., et al. Increased mitochondrial calcium levels associated with neuronal death in a mouse model of Alzheimer's disease. Nature Communications. 11, 2146 (2020).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Li, J. L., et al. Intravital multiphoton imaging of immune responses in the mouse ear skin. Nature Protocols. 7 (2), 221-234 (2012).
- Swamydas, M., Lionakis, M. S. Isolation, purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments:JoVE. (77), e50586 (2013).
- Rose, S., Misharin, A., Perlman, H. A novel Ly6C/Ly6G-based strategy to analyze the mouse splenic myeloid compartment. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (4), 343-350 (2012).
- Lakschevitz, F. S. Identification of neutrophil surface marker changes in health and inflammation using high-throughput screening flow cytometry. Experimental Cell Research. 342 (2), 200-209 (2016).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. Journal of Visualized Experiments:JoVE. (17), e745 (2008).
- . MATLAB - Bio-Formats 6.1.0 documentation Available from: https://docs.openmicroscopy.org/bio-formats/6.1.0/users/matlab/index.html (2022)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9, 62-66 (1979).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179, 298-310 (1996).
- Xu, C., Prince, J. L. Snakes, shapes, and gradient vector flow. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7 (3), 359-369 (1998).
- Driscoll, M. K., et al. Automated image analysis of nuclear shape: what can we learn from a prematurely aged cell. Aging. 4 (2), 119-132 (2012).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Tauer, U. Advantages and risks of multiphoton microscopy in physiology. Experimental Physiology. 87 (6), 709-714 (2002).
- Débarre, D., Olivier, N., Supatto, W., Beaurepaire, E. Mitigating phototoxicity during multiphoton microscopy of live Drosophila embryos in the 1.0-1.2 µm wavelength range. PloS One. 9 (8), 104250 (2014).
- Masedunskas, A., et al. Intravital microscopy: a practical guide on imaging intracellular structures in live animals. Bioarchitecture. 2 (5), 143-157 (2012).
- Ng, L. G., et al. Visualizing the neutrophil response to sterile tissue injury in mouse dermis reveals a three-phase cascade of events. The Journal of Investigative Dermatology. 131 (10), 2058-2068 (2011).
- Wu, X. S., et al. Melanoregulin regulates a shedding mechanism that drives melanosome transfer from melanocytes to keratinocytes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 2101-2109 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유