Method Article
Imagerie de la migration des neutrophiles dans la peau de souris pour étudier le remodelage de la membrane subcellulaire dans des conditions physiologiques
Dans cet article
Résumé
La migration des neutrophiles repose sur le remodelage rapide et continu de la membrane plasmique en réponse au chimioattractant et à ses interactions avec le microenvironnement extracellulaire. Il s’agit d’une procédure basée sur la microscopie subcellulaire intravitale pour étudier la dynamique du remodelage membranaire dans les neutrophiles injectés dans l’oreille de souris anesthésiées.
Résumé
L’étude du recrutement et de la fonction des cellules immunitaires dans les tissus a été un domaine très actif au cours des deux dernières décennies. Les neutrophiles sont parmi les premières cellules immunitaires à atteindre le site de l’inflammation et à participer à la réponse immunitaire innée lors d’une infection ou d’une lésion tissulaire. Jusqu’à présent, la migration des neutrophiles a été visualisée avec succès à l’aide de divers systèmes expérimentaux in vitro basés sur une stimulation uniforme, ou une migration confinée sous agarose, ou canaux micro-fluidiques. Cependant, ces modèles ne récapitulent pas le microenvironnement complexe que rencontrent les neutrophiles in vivo. Le développement de techniques basées sur la microscopie multiphotonique (MPM), telles que la microscopie subcellulaire intravitale (ISMic), offre un outil unique pour visualiser et étudier la dynamique des neutrophiles à des résolutions subcellulaires dans des conditions physiologiques. En particulier, l’oreille d’une souris anesthésiée vivante offre un avantage expérimental pour suivre la migration interstitielle des neutrophiles en temps réel en raison de sa facilité d’accès et de l’absence d’exposition chirurgicale. ISMic fournit la résolution optique, la vitesse et la profondeur d’acquisition nécessaires pour suivre les processus cellulaires et, plus important encore, subcellulaires en 3D au fil du temps (4D). De plus, l’imagerie multimodale du microenvironnement interstitiel (c’est-à-dire les vaisseaux sanguins, les cellules résidentes, la matrice extracellulaire) peut être facilement réalisée en utilisant une combinaison de souris transgéniques exprimant des marqueurs fluorescents sélectionnés, un marquage exogène via des sondes fluorescentes, une fluorescence intrinsèque tissulaire et des signaux générés par la seconde/troisième harmonique. Ce protocole décrit 1) la préparation des neutrophiles pour le transfert adoptif dans l’oreille de la souris, 2) différents paramètres pour une imagerie subcellulaire optimale, 3) des stratégies pour minimiser les artefacts de mouvement tout en maintenant une réponse physiologique, 4) des exemples de remodelage membranaire observé dans les neutrophiles à l’aide d’ISMic, et 5) un flux de travail pour l’analyse quantitative du remodelage membranaire dans les neutrophiles en migration in vivo.
Introduction
La migration cellulaire dirigée est un événement critique qui se produit au cours de différents processus physiologiques et pathologiques, notamment le développement, la réponse immunitaire, la réparation des tissus et l’initiation, la progression et la dissémination de la tumeur 1,2. Ce processus repose sur des signaux chimiotactiques extracellulaires spécifiques détectés par leurs récepteurs apparentés au niveau de la membrane plasmique, puis traduits en signaux intracellulaires complexes. Ces voies, à leur tour, activent la migration cellulaire par le biais d’une série de réponses, notamment l’activation locale du cytosquelette, le trafic et le remodelage membranaires, et la polarisation cellulaire3. Deux types distincts de migration cellulaire ont été bien caractérisés : le mésenchymateux et l’amiboïde4. La migration mésenchymateuse est relativement lente (<1 μm/min), repose sur une forte adhésion entre les cellules et la matrice extracellulaire (MEC) et dépend de la dégradation de la matrice induite par les métalloprotéases. En revanche, la migration amiboïde, une caractéristique des cellules immunitaires qui réagissent rapidement aux signaux inflammatoires, est plus rapide (>10 μm/min) et utilise de faibles adhérences pour naviguer dans l’ECM. Quelle que soit la modalité, la migration cellulaire nécessite un remodelage constant de la membrane plasmique, ce qui entraîne la génération de structures protrusives au bord d’attaque des cellules, qui sont étroitement coordonnées avec la rétraction de la membrane à l’arrière1.
Pour démêler les mécanismes moléculaires sous-jacents à ces processus subcellulaires, il est fondamental de visualiser la dynamique des membranes dans les cellules en migration à une résolution temporelle et spatiale appropriée. De plus, le remodelage membranaire étant fortement influencé par les propriétés du microenvironnement tissulaire entourant les cellules migratrices, il est crucial d’imager ce processus directement dans le tissu natif, au sein d’animaux vivants. Ceci est accompli en utilisant la microscopie intravitale (IVM)5. La toute première imagerie IVM a été réalisée il y a ~200 ans, lorsque l’extravasation des leucocytes a été visualisée à l’aide d’un simple microscope trans-illumination6 et par la suite, l’IVM a été utilisée principalement sur des organismes modèles semi-transparents, tels que le poisson zèbre et la drosophile 7,8. Au cours des deux dernières décennies, la MIV a été utilisée avec succès pour étudier les processus cellulaires chez les souris, les rats et les grands mammifères tels que les porcs 5,9. Cela a été rendu possible grâce à 1) des développements significatifs en microscopie confocale et multiphotonique (MP) et 2) à l’essor de la technologie d’édition de gènes telle que CRISPR-Cas9, qui a permis l’ingénierie rapide d’une variété de modèles animaux pour exprimer des protéines et des rapporteurs marqués par fluorescence. En outre, la visualisation des cellules individuelles et de leur microenvironnement au cours de processus tels que l’initiation tumorale, la migration cellulaire et la réponse immunitaire a été rendue possible par d’autres formes de marquages exogènes, telles que l’introduction systémique de colorants pour marquer le systèmevasculaire10,11, et l’excitation de molécules endogènes, telles que le collagène par génération de seconde harmonique (SHG)10, 12 et les fibres nerveuses par génération de troisième harmonique (THG)11,13. Enfin, une amélioration des techniques pour minimiser les artefacts de mouvement dus au rythme cardiaque et à la respiration a conduit au développement de la microscopie subcellulaire intravitale (ISMic), qui a permis aux chercheurs d’imager et d’étudier plusieurs événements subcellulaires directement chez des animaux vivants à un niveau de résolution similaire à ceux observés in vitro 14,15,16,17 . Parmi les exemples d’ISMic, citons l’étude de la dynamique du cytosquelette pendant l’exocytose 14,15,16,17 et l’endocytose15, le remodelage dynamique du cytosquelette pendant la migration cellulaire17,18, la localisation et le métabolisme mitochondriaux19,20 et la signalisation calcique dans le cerveau 21.
Ce protocole détaille les différentes étapes et procédures permettant d’étudier le remodelage de la membrane cellulaire à une résolution subcellulaire lors de la migration des neutrophiles dans la peau de l’oreille d’une souris vivante à l’aide d’ISMic. Cette approche est basée sur les protocoles22,23 décrits précédemment et adaptée pour obtenir une résolution spatiale et temporelle plus élevée.
Protocole
Toutes les expériences et procédures sur les animaux ont été approuvées par le Comité de soin et d’utilisation des animaux du National Cancer Institute (National Institutes of Health, Bethesda, MD, États-Unis) (protocoles LCMB-031 et LCMB-035) et étaient conformes à toutes les réglementations éthiques pertinentes. Des souris mâles et femelles âgées de 2 à 6 mois ont été utilisées pour les expériences. Les souris hôtes mT/mG et de type sauvage (WT) sont en arrière-plan FVB/NJ tandis que les souris LyzM-Cre x mTmG sont en arrière-plan C57BL/6.
1. Matériaux et préparation des réactifs et des outils
- Enduire les tubes, les plats et les aiguilles/seringues avec du PBS + 1% BSA (sans calcium ni magnésium) pendant la nuit sous agitation.
- Nettoyez soigneusement les surfaces et les outils/instruments à utiliser pour le travail des animaux en utilisant de l’éthanol à 70 % ou en autoclavage.
- Pour la purification des neutrophiles, préparez ce qui suit : 3 tubes de 15 ml, 1 plat de 60 mm, 1 tube de 1,5 ml ; HBSS contenant 10 mM d’HEPES (pH 7,3) ; solution de lyse des globules rouges (ACK) ; Histopaque 1077 ; et Histopaque 1119.
- Pour les injections de neutrophiles, préparez ce qui suit : 1 seringue à faible volume (10 μL), 1 aiguille biseautée de 33 G, de l’isoflurane et une solution d’anesthésie (kétamine, xylazine et acépromazine à 80 mg·kg-1, 2 mg·kg-1 et 4 mg·kg-1, respectivement, dans une solution saline).
2. Purification des neutrophiles d’une souris donneuse
- Euthanasier la souris donneuse conformément aux réglementations institutionnelles locales.
- Prélevez les os longs de l’animal (fémur, tibia et humérus), en veillant à préserver l’intégrité des os et en évitant de couper la tête des os lorsdu prélèvement.
- Dans une boîte de 60 mm recouverte d’un BSA, retirez les muscles et les tissus adipeux. Coupez la tête des os pour accéder à la moelle, puis rincez et homogénéisez la moelle osseuse à l’aide d’une seringue (aiguille de 27 G) remplie de HBSS.
- Filtrer la solution dans un tube de 15 mL revêtu d’un BSA à l’aide d’une crépine de 40 μm et la centrifuger à 400 x g pendant 5 min à température ambiante (RT).
- Aspirez le surnageant, remettez la pastille en suspension dans 1 mL d’ACK pendant 30 s pour lyser les globules rouges, puis ajoutez 9 mL de HBSS pour arrêter la lyse. Centrifuger la solution à 400 x g pendant 5 min à RT.
- Préparez un gradient de densité dans un tube de 15 mL revêtu d’un BSA en plaçant délicatement 4 mL de 1119 Histopaque au bas du tube, puis en superposant doucement 4 mL de 1077 Histopaque sur le dessus. Faites très attention à ne pas mélanger les deux couches.
- Aspirer le surnageant et remettre en suspension la pastille cellulaire dans 2 mL de HBSS. Superposez doucement la solution sur le gradient de marche préparé ci-dessus. Tournez à 1 000 x g pendant 30 min à RT avec la vitesse d’accélération et de décélération la plus basse possible (« pas de frein » est préférable).
- À partir du haut du tube, aspirez doucement la moitié de la couche 1077 Histopaque. Récupérez la moitié restante de la couche 1077 Histopaque et la moitié supérieure de la couche 1119 Histopaque dans un tube frais recouvert de BSA. La suspension cellulaire trouble entre les deux couches de densité contient principalement des neutrophiles.
- Ajouter HBSS pour atteindre un volume final de 15 mL et mélanger doucement en inversant le tube. Essorage à 400 x g pendant 5 min à RT.
- Après la centrifugation, remettre en suspension et laver la pastille cellulaire avec 10 mL de HBSS et l’essorer à 400 x g pendant 5 min à température ambiante. Répétez la procédure, puis mettez la pastille en suspension dans 15 mL de HBSS pour déterminer le nombre de cellules à l’aide d’un compteur de cellules. Enfin, faites tourner et remettre en suspension les cellules dans 1 mL de HBSS et transférez-les dans un tube de 1,5 mL revêtu de BSA.
- Après la purification, maintenir la suspension de neutrophiles dans le tube revêtu de BSA sous une légère agitation pendant 30 min sur un rotateur de tube à RT jusqu’au marquage et/ou à l’injection.
REMARQUE : Une purification réussie donne 10-20 x 106 neutrophiles par souris avec une pureté de 95%. La pureté est évaluée par cytométrie en flux, à l’aide de marqueurs neutrophiles décrits précédemment (Ly6G+, Ly6C-, Gr1+ et CD11b+)25,26.
REMARQUE : Des protocoles sur la purification des neutrophiles à partir du sang périphérique humain et de la moelle osseuse de souris sont disponibles précédemment24,27.
3. Marquage des neutrophiles
REMARQUE : Pour visualiser les neutrophiles, ils ont été purifiés à partir de souris LyzM-Cre mT/mG , chez lesquelles les cellules myéloïdes expriment un peptide ciblé sur la membrane fusionné avec la GFP. De plus, des neutrophiles purifiés de souris de type sauvage (WT) ont été marqués in vitro. Les étapes suivantes décrivent la procédure utilisée pour marquer les neutrophiles purifiés avec un colorant fluorescent vert perméable aux cellules commercial et peuvent être adaptées à toute autre sonde fluorescente compatible MPM de votre choix.
- Ajouter le colorant fluorescent vert (concentration recommandée par le fabricant ; ici, 1 μM) à la suspension de neutrophiles (purifiée à partir d’une souris WT) dans un tube de 1,5 mL recouvert de BSA. Incuber pendant 30 min à RT sous une légère agitation dans un rotateur de tube.
- Laver trois fois avec du HBSS, essorer à 400 x g pendant 5 min à RT et remettre la pastille en suspension dans 1 mL de HBSS.
- Maintenir la suspension de neutrophiles dans le tube revêtu de BSA sous une légère agitation dans un rotateur de tube à RT jusqu’à la procédure d’injection.
REMARQUE : L’injection de neutrophiles marqués effectuée juste après le marquage est fortement préférée. Cependant, si nécessaire, les neutrophiles marqués peuvent être maintenus sous agitation pendant 10 à 15 minutes supplémentaires après le marquage sans compromettre l’intégrité de la réponse des neutrophiles in vivo. L’agitation à long terme (plus de 60 minutes après l’étiquetage) entraînera l’agglutination, la mort des neutrophiles et des observations trompeuses in vivo. - Juste avant l’injection, remettre en suspension la pastille cellulaire dans une solution saline pour atteindre une densité de 2-5 x 106 cellules par 20 μL.
4. Injection de neutrophiles
REMARQUE : L’anesthésie doit être effectuée conformément aux directives du comité local de soin et d’utilisation des animaux.
- Placez l’animal dans une chambre fermée et administrez 3 % à 5 % d’isoflurane (débit de 2 L/min) à l’aide d’un vaporisateur calibré relié à un concentrateur d’oxygène.
- Évaluez si l’animal est inconscient en testant le réflexe de retrait de la patte lors du pincement de la patte arrière. Ensuite, transférez l’animal dans un coussin chauffant (37° C) pour maintenir sa température corporelle. Continuer à administrer l’isoflurane (1 % à 2 % ; débit de 0,5 L/min) par un cône nasal.
NOTE DE SÉCURITÉ : Pour limiter l’exposition du personnel à l’isoflurane toxique, il est recommandé d’utiliser un système de distribution équipé d’une unité de filtrage pour récupérer l’isoflurane en circulation. - Pour optimiser la qualité de l’imagerie, retirez les poils de l’oreille à l’aide d’une tondeuse fine. Cette procédure pourrait également être effectuée un jour ou deux avant l’expérience.
REMARQUE : L’utilisation de crème dépilatoire est déconseillée car elle est connue pour exacerber la réponse inflammatoire dans la peau de la souris et introduire des artefacts d’imagerie. - Placez l’animal sur le côté. À l’aide de ruban chirurgical, tenez le bord de l’oreille et aplatissez-le le long du coussin chauffant. Appliquez délicatement le ruban adhésif pour éviter d’endommager l’oreille.
- Remplissez une seringue équipée d’une aiguille de 33 G avec la suspension neutrophile (2-5 x 106 cellules par 20 μL) et montez-la sur un micromanipulateur.
REMARQUE : L’angle d’injection entre l’aiguille et l’oreille sur un coussin chauffant doit être compris entre 10° et 30° pour minimiser les lésions tissulaires et augmenter le succès de l’injection cellulaire. - Déplacez doucement l’aiguille (avec le biseau vers le haut) vers l’oreille et percez lentement la peau. Une fois que l’aiguille est à l’intérieur de la peau, poussez lentement le piston et délivrez 2 à 3 μL de suspension cellulaire.
REMARQUE : Les zones avec des vaisseaux sanguins visibles doivent être évitées car endommager un vaisseau sanguin entraîne une réponse immunitaire indésirable et complexe à l’injection et des problèmes d’imagerie. - Répétez l’injection dans 2-3 zones différentes de l’oreille, de préférence à 2-3 mm de distance. Ne « remplissez » pas l’oreille avec la suspension cellulaire.
REMARQUE : L’injection doit être effectuée au centre de l’oreille. La périphérie de l’oreille est mince et doit être manipulée avec précaution car elle peut être facilement endommagée, tandis que la partie centrale est plus épaisse et contient des vaisseaux sanguins plus gros et moins de follicules pileux, et peut supporter de plus grands volumes d’injection. - Retirez soigneusement le ruban chirurgical et laissez l’animal reprendre conscience sous surveillance. Laissez l’animal se reposer pendant 1 h avant l’imagerie pour permettre aux tissus et aux cellules de récupérer de la procédure d’injection.
5. Anesthésie pour la MIV
REMARQUE : Une anesthésie plus profonde améliore considérablement la qualité de l’imagerie en diminuant les artefacts de mouvement dus au rythme cardiaque et à la respiration. Les souris injectées de neutrophiles sont soumises à une anesthésie chimique, qui fournit une sédation plus profonde que l’anesthésie induite par les gaz. L’anesthésie doit être effectuée conformément aux directives du comité local de protection et d’utilisation des animaux.
- Une heure après la guérison de l’injection de neutrophiles, anesthésier les animaux par une injection sous-cutanée contenant un mélange de xylazine/kétamine/acépromazine (80 mg·kg-1, 2 mg·kg-1 et 4 mg·kg-1, respectivement) dans une solution saline.
REMARQUE : Pour assurer la reproductibilité et la fiabilité des résultats, les animaux doivent être maintenus au chaud depuis le moment de l’anesthésie jusqu’à la fin de l’expérience à l’aide d’un coussin chauffant ou d’un coussin de circulation d’eau relié à une pompe de réchauffement. - Pour maintenir l’anesthésie au-delà de 1 h, injecter un mélange de kétamine/acépromazine (40 mg·kg-1 et 2 mg·kg-1 respectivement) par voie sous-cutanée toutes les 40 min. Surveillez périodiquement les souris anesthésiées pour détecter des signes de conscience en testant le réflexe de retrait de la patte.
- De plus, pour les procédures d’imagerie d’une durée supérieure à 1 h, appliquez une pommade ophtalmique stérile non médicamenteuse sur les yeux pour prévenir le dessèchement de la cornée pendant l’anesthésie et maintenir l’hydratation du corps par des injections sous-cutanées de solution saline (200 μL toutes les heures).
REMARQUE : Alternativement, un système basé sur la perfusion à commande numérique peut être utilisé pour assurer une injection périodique et régulière de la solution d’anesthésie et/ou fournir des liquides. Un pousse-seringue automatisé peut être configuré pour administrer le volume souhaité d’anesthésique et fournir une hydratation pendant de plus longues périodes. À cette fin, une aiguille de perfusion ailée peut être insérée par voie sous-cutanée dans la peau dorsale de l’animal et fixée avec du ruban chirurgical.
6. Imagerie
REMARQUE : La configuration de l’animal et les paramètres d’imagerie décrits ici sont optimisés pour un microscope multiphotonique inversé équipé d’une seule ligne laser pour exciter et collecter simultanément les émissions des différents fluorophores.
- Avant de placer l’animal anesthésié sur la platine du microscope, assurez-vous que le microscope est allumé et que la platine et les lentilles sont préchauffées à 37 °C. Couvrez le trou sur la platine avec une lamelle en verre (épaisseur #1 ou 1,5) alignée avec la lentille chauffée.
- Déplacez l’animal sur la scène avec précaution. Si l’imagerie est prévue pour une longue durée (>1 h), appliquez une pommade ophtalmique et fixez le système de perfusion à ailettes comme décrit ci-dessus.
- Placez une goutte de solution saline au centre de la lamelle et placez l’oreille injectée de neutrophiles par-dessus. Aplatissez doucement l’oreille à l’aide d’un coton-tige stérile au centre de la lamelle pour éliminer les poches d’air.
REMARQUE : L’application de solution saline (ou PBS) entre l’oreille et la lamelle réduit la réfraction de la lumière due aux poches d’air, assurant ainsi un indice de réfraction uniforme et une qualité d’image supérieure. - Fixez l’oreille en appuyant doucement un bâton en bois (retiré du coton-tige) sur le côté de l’oreille le plus près de la tête de l’animal et en le verrouillant à l’aide de ruban adhésif (figure 1A).
REMARQUE : Un bâton en bois sécurisé minimise les artefacts de mouvement dus au rythme cardiaque et à la respiration et augmente considérablement la qualité de l’image. Il est important de noter que le bâton en bois doit être fixé juste assez pour stabiliser l’oreille sans nuire à la circulation sanguine. - À l’aide de l’oculaire du microscope, trouvez une zone d’intérêt, puis passez en mode d’acquisition multiphotonique.
- Réglez la longueur d’onde d’excitation laser sur 900-930 nm pour permettre l’acquisition simultanée du colorant fluorescent GFP/vert, du mTomato ainsi que du collagène-I (via SHG).
- Réglez un ensemble approprié de miroirs et une combinaison de filtres sur les détecteurs pour collecter la lumière émise (filtres passe-bande : Bleu = 410-460 nm, Vert = 495-540 nm, Rouge = 580-640 nm).
REMARQUE : Les neutrophiles injectés, lorsqu’ils sont marqués avec un colorant fluorescent vert, présentent une forte fluorescence verte qui les rend visibles sous l’oculaire du microscope même s’ils sont injectés dans des parties plus profondes de l’oreille. - Déterminez le paramètre le plus approprié à la configuration matérielle. Même si les cellules migratrices peuvent être suivies avec un intervalle de 30 s à 1 min, imagez les événements subcellulaires avec une vitesse plus élevée (intervalle d’au moins <10 s). Dans l’exemple ci-dessous, deux configurations d’imagerie différentes sont présentées pour montrer la différence entre l’IVM classique et l’ISMic.
- Dans l’approche classique de la GIV pour suivre la migration cellulaire et étudier le tissu de la souris hôte (Figure 1), utilisez un objectif 30x et un scanner galvo d’une taille d’image de 512 x 512 pixels (taille de pixel de 0,83 μm), et réglez le déplacement de l’axe z à l’aide de la platine motorisée avec une taille de pas de 2 μm, permettant d’imager un volume de 30 μm de profondeur toutes les 30 s.
- Dans l’approche ISMic pour imager un remodelage membranaire hautement dynamique à un grossissement et une résolution plus élevés (Figure 2), utilisez un objectif 40x et un scanner résonant avec une moyenne 3x et une taille d’image de 512 x 512 pixels (taille de pixel de 0,25 μm), et réglez le déplacement de l’axe z à l’aide d’un piézo avec une taille de pas de 1 μm, permettant l’imagerie d’un volume de 20 μm de profondeur toutes les 4-5 s.
- Déclencher la migration des neutrophiles en induisant une lésion laser stérile. Focaliser le laser d’excitation à une puissance élevée suffisante pour atteindre au moins 80 mW22, sur une zone étroite du tissu (20 μm x 20 μm) pendant 10 s.
- Identifiez la lésion induite par le laser par ses puissants signaux auto-fluorescents apparaissant dans tous les canaux et par l’altération de l’arrangement du collagène qui en résulte (Figure 1D).
REMARQUE : Pour obtenir des résultats fiables, la blessure doit toujours être induite aussi loin que possible des vaisseaux sanguins ; En cas de rupture, les cellules sanguines libérées dans le tissu auront un impact sur la qualité de l’imagerie et entraîneront une forte réaction immunitaire globale. - Enregistrez les données à la fin de l’expérimentation pour des analyses plus approfondies.
- Euthanasier l’animal selon les directives de l’établissement local. Si nécessaire, des tissus peuvent être collectés pour la fixation et le traitement ultérieur.
7. Analyse représentative des données
REMARQUE : Les données peuvent être visualisées et analysées à l’aide du logiciel du microscope, d’un logiciel tiers ou de programmes personnalisés. La procédure et les outils utilisés dépendent des besoins spécifiques des enquêteurs. Voici un exemple de flux de travail pour quantifier la courbure de la membrane et les changements de zone locale sur le bord d’attaque et à l’arrière des neutrophiles en migration.
- Ouvrez les fichiers d’imagerie avec Imaris ou Fiji pour visualiser la migration des neutrophiles en 4D et déterminer la qualité de l’expérience.
REMARQUE : Imaris et Fiji peuvent lire le format d’imagerie de plusieurs marques de microscopes. - Traitez les données en suivant les étapes suivantes en exécutant des scripts de code MATLAB personnalisés. Lisez les fichiers d’imagerie sélectionnés avec le package Bio-Formats28 pour MATLAB. Segmentez chaque image du volume 3D à l’aide de l’algorithme Otsu29 pour identifier les cellules individuelles.
- Suivre les objets identifiés sur la base du critère de déplacement minimum30.
- Déterminez les contours et les limites actifs de l’objet.
- Générez une projection maximale pour chaque objet identifié dans une période donnée.
- Appliquez la fonction bwboundaries dans MATLAB à la projection maximale de chaque objet identifié à partir de l’étape 7.2 pour générer 100 points limites.
- Optimisez les points limites identifiés avec l’algorithme de contour dynamique pour obtenir une précision de31 sous-pixel (Figure 3A) à l’aide des fonctions du package MATLAB téléchargé via http://www.iacl.ece.jhu.edu/static/gvf/.
- Superposez les limites de l’objet et l’indice de trajectoire de l’objet déterminé par le suivi à l’étape 7.3 avec la projection maximale de l’image d’origine pour générer une sortie d’un film superposé 2D à des fins de visualisation et de vérification manuelle.
- Dans la séquence superposée, sélectionnez manuellement tous les objets identifiés comme étant en migration de cellules en excluant les objets hors cellule, les objets en contact et les objets dont les limites sont incomplètes. Enregistrez les indices de suivi, les images de début et de fin de chaque trajectoire de cellule dans une feuille de calcul à utiliser comme entrée pour les étapes suivantes mises en œuvre par les scripts de code MATLAB.
- Suivez les points de limite de cellule de chaque image à la suivante en fonction du critère de déplacement minimum. Utilisez la fonction Polyarea dans MATLAB pour calculer l’aire soulignée par des points limites adjacents en deux périodes consécutives (Figure 3C). Si la limite de la cellule locale se déplace vers l’extérieur de la cellule, attribuez un signe positif au changement de zone. Si la limite de la cellule locale se déplace vers l’intérieur de la cellule, attribuez un signe négatif à la modification de zone.
- Mesurez la courbure locale de la membrane à chaque point limite de chaque image en ajustant ses points limites voisins à un cercle (5 par côté ; total 11)32 (Figure 3B).
- Générez des kymographes à l’aide de la fonction imagesc de MATLAB (Figures 3D,E) pour montrer les changements des caractéristiques subcellulaires au fil du temps et en relation avec la position de la cellule.
Résultats
Ici, deux ensembles de résultats différents sont présentés pour illustrer l’IVM classique et l’ISMic qui fournissent respectivement une résolution cellulaire et subcellulaire. Dans le premier exemple, les neutrophiles ont été purifiés à partir d’une souris de type sauvage (WT), marqués avec Cell Tracker Green pour colorer le cytoplasme, et injectés dans une souris transgénique exprimant une protéine fluorescente ciblant la membrane plasmique (souris mTomato, également connue sous le nom de mT/mG33, Figure 1 et Movie 1 et Movie 2). Cette souris receveuse a permis de visualiser des caractéristiques structurelles dans le tissu de l’oreille telles que les vaisseaux sanguins, les cellules résidentes et les follicules pileux (Figure 1C et Vidéo 1) via une approche basée sur la MIV (étape 6.8.1). Les fibres de collagène, révélées par SHG (détecté à la moitié de la longueur d’onde de l’excitation), ont été disposées en un réseau complexe dans le derme, où les neutrophiles ont été injectés. Le long du bord des follicules pileux (HF), une couche de cellules épithéliales (c’est-à-dire des kératinocytes) a été observée. Parfois, des artefacts provenant de poils résiduels entraînant une dépression locale de la peau ont été visualisés (H). Les lésions induites par le laser ont été facilement visualisées en raison de leur forte auto-fluorescence détectée dans tous les canaux et par les altérations de l’arrangement du collagène (Figure 1D). Une vue plus complète de l’architecture 3D de la peau et de la localisation des neutrophiles injectés peut être appréciée dans la vidéo 1, qui dépeint un empilement Z de la peau des couches externe à interne et un rendu de volume 3D. L’imagerie en accéléré a montré que les neutrophiles échantillonnaient la peau de l’oreille et interagissaient avec l’ECM et le tissu de l’hôte (vidéo 2). L’imagerie à cette résolution et l’acquisition d’une pile Z toutes les 30 s permettent d’effectuer le suivi des cellules et la mesure des paramètres de motilité (c’est-à-dire la vitesse et la directionnalité), mais une analyse précise et détaillée du remodelage de la membrane est difficile à cette résolution.
Dans le deuxième exemple, le remodelage membranaire a été évalué via l’approche ISMic (étape 6.8.2) à l’aide de neutrophiles exprimant mGFP purifiés à partir de souris LyzM-cre mT/mG et injectés dans des animaux WT (Figure 2A, organigramme expérimental). À l’aide du protocole ISMic (vidéo 3 et images fixes de la figure 2B) et lors d’une lésion laser, un remodelage dynamique de la membrane plasmique est observé pendant la migration, et la formation de saillies membranaires sur le bord d’attaque et la rétraction de l’arrière des cellules sont clairement visualisées (figure 2 et vidéo 3). Les séquences en accéléré mises en évidence dans le film 3 révèlent la complexité des interactions avec l’ECM. En effet, les neutrophiles migrent dans l’espace interstitiel en se déplaçant soit le long des fibres, soit dans les espaces entre elles. Enfin, des aspects quantitatifs tels que les changements de courbure et les changements de surface à l’avant et à l’arrière des cellules ont été quantifiés pour chaque point temporel. En utilisant la cellule décrite dans la figure 2B à titre d’exemple, la dynamique locale de la membrane plasmique a été analysée à l’aide d’un pipeline algorithmique (voir étape 7) basé sur l’identification de 100 points limites sous-jacents à la surface de la cellule (Figure 3A). Les changements dans la courbure locale (figure 3B) et dans la zone soulignée par les protubérances de la membrane plasmique (figure 3C) ont été calculés pour chaque point limite et rapportés pour chaque période sous forme de kymographes (figure 3D, E). L’avant et l’arrière des cellules conservent une courbure plus élevée que le côté des cellules (Figure 3D) ; Les changements de zone négatifs (rétractions, régions bleues) sont plus apparents à l’arrière des cellules qu’au bord d’attaque où les changements de zone positifs sont plus importants (protubérances, régions rouges) (Figure 3E).
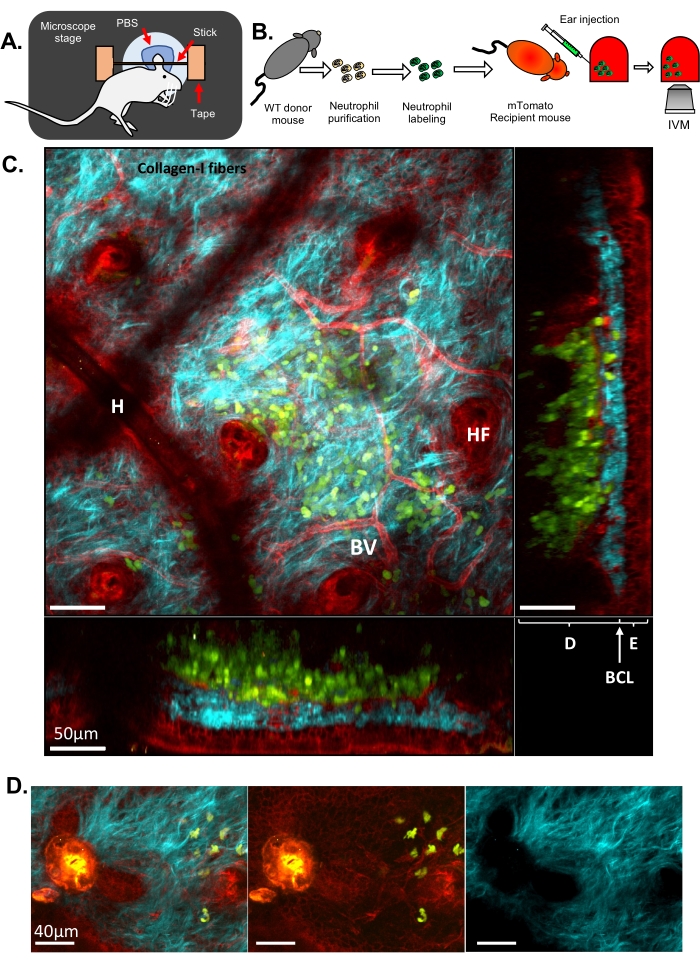
Figure 1 : MIV des neutrophiles dans la peau de l’oreille de souris. (A) Schéma de l’installation de l’oreille sur la platine du microscope. (B) Organigramme expérimental. (C) Image représentative de la peau de l’oreille d’une souris mTomato injectée avec des neutrophiles marqués par fluorescence, avec différentes projections. Follicule pileux (HF), vaisseau sanguin (VB), épiderme (E), derme (D), couche de cellules basales (BCL) et artefact pileux (en raison d’un poil résiduel à la surface de la peau, H). (D) Image représentative de la peau d’une souris après une lésion au laser stérile : canal bleu (à droite), canaux vert et rouge (au milieu), image fusionnée (à gauche). Une lésion est visible à gauche de l’image par une forte émission d’autofluorescence dans les canaux vert et rouge ainsi qu’une perturbation de l’ECM observée par la formation d’un trou dans les fibres de collagène-I. En C et D, en vert : neutrophiles ; Rouge : tissu hôte de la souris ; Cyan : Collagène-I SHG. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Time-lapse de la migration d’un neutrophile mGFP dans l’oreille d’une souris WT. (A) Organigramme expérimental. (B) Images fixes représentatives du film 3. (C) Rendu volumique de la même cellule pour visualiser l’organisation 3D de la membrane. La zone de haute dynamique membranaire est illustrée par une flèche (rouge pour la rétraction et bleue pour la saillie). (D) Visualisation en gros plan et inclinée du volume de la cellule rendue. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Pipeline d’analyse pour la quantification de la dynamique membranaire collecté à l’aide d’ISMic. (A) Détermination du contour cellulaire et répartition des points limites (100 points limites) entre deux trames consécutives pour les neutrophiles mGFP décrits à la figure 2B. (B) Les limites colorées représentent la courbure locale de la membrane déterminée pour chaque point limite. (C) Changements de zone locale entre deux images consécutives (actuelle : bleue, et suivante : rouge). Les zones vertes représentent les résultats de suivi du mouvement local de la membrane. Les flèches jaunes indiquent la direction générale du déplacement de la membrane. (D) Kymographe de la courbure des limites de la cellule au fil du temps. L’axe vertical représente les indices des points limites, où 1 et 100 représentent l’arrière de la cellule en fonction de sa direction de migration. (E) Kymographe de changement d’aire locale reflétant la saillie de la membrane (rouge) et la rétraction de la membrane (bleu) de la cellule au fil du temps. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1 : Visualisation de neutrophiles marqués en vert dans l’oreille d’une souris mTomato à l’aide de la MIV. Rouge : Tissu de souris hôte mTomato. Cyan : Collagène-I SHG ; Vert : neutrophile. Veuillez cliquer ici pour télécharger ce film.
Vidéo 2 : MIV de neutrophiles migrant dans la peau d’une oreille de souris mTomato. Les vidéos sont des projections d’intensité maximale d’une pile d’images acquises pendant 27 minutes avec une fréquence d’images de 5 images/s. Rouge : Tissu de souris hôte mTomato. Cyan : Collagène-I SHG ; Vert : neutrophile. Veuillez cliquer ici pour télécharger ce film.
Vidéo 3 : ISMic du remodelage membranaire lors de la migration des neutrophiles dans une oreille de souris WT. Les vidéos sont des projections d’intensité maximale d’une pile d’images acquises pendant 8 min avec une fréquence d’images de 10 images/s. Rouge : Tissu de souris hôte mTomato. Cyan : Collagène-I SHG ; Vert : mGFP neutrophile ; Vert clair : neutrophiles rendus. Veuillez cliquer ici pour télécharger ce film.
Discussion
Malgré des décennies de progrès dans le domaine de la migration cellulaire et du remodelage membranaire, très peu d’études ont utilisé l’IVM pour visualiser les caractéristiques subcellulaires chez les animaux vivants. Les procédures décrites dans ce protocole constituent un outil puissant pour obtenir de nouvelles connaissances sur la migration des neutrophiles chez les animaux vivants et plus particulièrement sur le remodelage de la membrane plasmique au cours de ce processus. Cette approche permet d’étudier la migration des neutrophiles dans des conditions physiologiques compte tenu de la complexité inhérente au microenvironnement tissulaire. En effet, l’utilisation du MPM permet de visualiser de multiples caractéristiques dans le tissu de l’hôte en utilisant une combinaison de souches de souris exprimant des marqueurs fluorescents sélectionnés, le marquage de tissus exogènes, l’excitation de la fluorescence endogène et les signaux générés par SHG ou THG12,13.
Un problème potentiel à prendre en compte dans cette procédure est les photodommages. Même si la MPM est généralement plus sûre que la microscopie confocale en ce qui concerne le photoblanchiment et la phototoxicité, des précautions doivent être prises lors de l’imagerie des tissus vivants34. La phototoxicité peut considérablement entraver les résultats en créant des artefacts d’imagerie allant de petites taches brillantes à de plus grandes zones de tissus endommagés, soit en inhibant/stimulant une variété de voies intracellulaires. Pour prévenir la phototoxicité, la puissance du laser doit être maintenue au minimum et les contrôles appropriés doivent être conçus pour vérifier que les conditions physiologiques sont maintenues (p. ex., mesure du débit sanguin, sondes de stress oxydatif)35,36. De plus, dans cette procédure spécifique, qui implique la peau, les souches albinos sont fortement recommandées car la mélanine présente chez les animaux à pelage foncé est plus sensible à la phototoxicité 36,37,38.
Parmi les principales limites de la procédure figurent le système de microscope utilisé et la nature des neutrophiles. Bien que l’utilisation du MPM augmente considérablement la profondeur de l’imagerie tissulaire par rapport à d’autres techniques de microscopie optique (par exemple, confocale, disque rotatif), la capacité de visualiser la dynamique subcellulaire dans l’oreille est limitée aux couches les plus externes du tissu (80-100 μm). Cela est dû à la diffusion intense de la lumière produite par l’épaisse couche ECM, ce qui rend difficile l’étude de la migration dans les couches plus profondes. Une autre limitation est le fait que les neutrophiles ont une durée de vie très courte et ne peuvent pas être conservés en culture assez longtemps pour effectuer des techniques d’édition de gènes. Cela peut être surmonté en manipulant des souris pour produire des neutrophiles dépourvus de gènes spécifiques ou hébergeant des mutations sélectionnées, ce qui augmente bien sûr les coûts et la durée de la recherche.
Les procédures décrites ici, bien qu’elles soient conçues pour étudier la dynamique membranaire, peuvent être adaptées pour répondre à toute question de biologie cellulaire, non seulement dans les neutrophiles, mais aussi dans d’autres types de cellules immunitaires et de cellules migratrices. Les informations recueillies par l’IVM à faible grossissement sur les comportements cellulaires (par exemple, le phénotype migratoire, la vitesse cellulaire et la directionnalité22) peuvent être complétées et corrélées avec des informations mécanistes acquises par ISMic sur le repositionnement des organites, la sécrétion de protéines, l’endocytose, la dynamique nucléaire, la dynamique du calcium, l’organisation du cytosquelette et la nétose. L’utilisation de manipulations pharmacologiques et/ou génétiques peut mettre en évidence le rôle de voies moléculaires spécifiques dans le processus d’intérêt, ce qui en fait une approche unique et très puissante.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Cette recherche a été soutenue par le programme de recherche intra-muros des National Institutes of Health, National Cancer Institute, Center for Cancer Research.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | USA Scientific | 4036-3204 | |
| 15 mL tubes | Corning | 430766 | |
| 1 mL syringe | Covidien | 8881501400 | |
| 27 G needle | Kendall | 827112 | |
| 27 G winged infusion set | Terumo | SV*27EL | |
| 30x objective | Olympus | UPLSAPO30XS | 1.05 NA, silicon oil immersion |
| 40x objective | Olympus | UPLSAPO40XS | 1.23 NA, silicon oil immersion |
| 60 mm dishes | Falcon | 353002 | |
| 6 mL syringe | Kendall | 8881516937 | |
| Acepromazine (10 mg/mL) | Vet one | 13985-587-50 | |
| ACK lysis buffer | Quality Biological | 118-156-101 | |
| Balance | AND | EK-1200A | |
| BSA | Sigma Aldrich | A9647 | |
| Cell strainer 40 µm | Sigma Aldrich | CLS431750 | |
| Fiji | ImageJ | N/A | Image visualization/analysis software |
| Fluoview Software | Olympus | N/A | Acquisition software |
| FVB mouse strain | Jackson | N/A | FVB background |
| Gas Anesthesia system | Patterson veterinary | 07-8915712 | Link 7 model |
| Green Cell tracker | Thermo | C2925 | Solubilized in cell culture grade DMSO to reach 1 mM concentration (1000x) |
| Hair removal cream | Nair | N/A | |
| HBSS (w/o Ca2+, Mg2+) | Gibco | 14175-095 | |
| HEPES 1 M pH 7.3 | Quality Biological | 118-089-721 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ML | |
| Histopaque 1991 | Sigma Aldrich | 11191-100ML | |
| Imaris | Bitplane | N/A | Image visualization/analysis software |
| Isoflurane | Vet one | 13985-528-40 | |
| Ketamine (100 mg/mL) | Vet one | 13985-584-10 | |
| LyzM-cre x mT/mG | generated in the lab | N/A | C57BL/6J background |
| Manual micromanipulator | WPI | M3301R | |
| MATLAB | MatWorks | N/A | Analysis software |
| mtomato mouse strain | generated in the lab | N/A | mT/mG, FVB background |
| Multiphoton laser | Spectra Physics | Insight DS+ | |
| Multiphoton Microscope | Olympus | MPE-RS | |
| Nanofil 10 µL syringe | WPI | NANOFIL | |
| Nanofil 33 G needle | WPI | NF33BV-2 | |
| Objective heater | Bioptechs | N/A | |
| Objective heater controller | Bioptechs | 150803 | |
| Ophtalmic ointment | Major | NDC 0904-6488-38 | |
| Oxygen concentrator | Caire | VisionAire 5 | |
| PBS (w/o Ca2+, Mg2+) | Quality Biological | 114-058-131 | |
| Saline | Quality Biological | 114-055-101 | |
| Stage heater | Okolab | N/A | |
| Stage heater controller | Okolab | H401-T | |
| Surgical tape | 3M | 1538-1 | Hypoallergenic |
| Syringe driver | Harvard Apparatus | PHD Ultra | |
| Warming Pads | Parkland Scientific | A2789B | |
| Warming Pump | Parkland Scientific | TP-700 | |
| Xylazine (100 mg/mL) | Vet one | 13985-704-10 |
Références
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2 (4), 2369-2392 (2012).
- Oudin, M. J., Weaver, V. M. Physical and chemical gradients in the tumor microenvironment regulate tumor cell invasion, migration, and metastasis. Cold Spring Harbor Symposia on Quantitative Biology. 81, 189-205 (2016).
- Devreotes, P., Horwitz, A. R. Signaling networks that regulate cell migration. Cold Spring Harbor Perspectives in Biology. 7 (8), 005959 (2015).
- Alexandrova, A. Y., Chikina, A. S., Svitkina, T. M. Actin cytoskeleton in mesenchymal-to-amoeboid transition of cancer cells. International Review of Cell and Molecular Biology. 356, 197-256 (2020).
- Masedunskas, A., et al. Intravital microscopy. Bioarchitecture. 2 (5), 143-157 (2012).
- Wagner, R. . Explanatory panels on physiology and development history 1839. , (1839).
- Yaniv, K., et al. Live imaging of lymphatic development in the zebrafish. Nature Medicine. 12 (6), 711-716 (2006).
- Vinegoni, C., et al. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. Journal of Visualized Experiments. (30), e1510 (2009).
- Sack, F. -. U. Intravital microscopy of pulmonary microcirculation after single lung transplantation in pigs. Transplantation Proceedings. 38 (3), 737-740 (2006).
- Rehberg, M., Krombach, F., Pohl, U., Dietzel, S. Label-free 3D visualization of cellular and tissue structures in intact muscle with second and third harmonic generation microscopy. PloS One. 6 (11), 28237 (2011).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Intravital third harmonic generation microscopy of collective melanoma cell invasion: Principles of interface guidance and microvesicle dynamics. Intravital. 1, 32-43 (2012).
- Poole, J. J. A., Mostaço-Guidolin, L. B. Optical microscopy and the extracellular matrix structure: A review. Cells. 10 (7), 1760 (2021).
- Weigelin, B., Bakker, G. -. J., Friedl, P. Third harmonic generation microscopy of cells and tissue organization. Journal of Cell Science. 129 (2), 245-255 (2016).
- Ebrahim, S., et al. Dynamic polyhedral actomyosin lattices remodel micron-scale curved membranes during exocytosis in live mice. Nature Cell Biology. 21 (8), 933-939 (2019).
- Shitara, A., et al. Cdc42 negatively regulates endocytosis during apical membrane maintenance in live animals. Molecular Biology of the Cell. 30 (3), 324-332 (2019).
- Masedunskas, A., et al. Role for the actomyosin complex in regulated exocytosis revealed by intravital microscopy. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13552-13557 (2011).
- Subramanian, B. C., et al. The LTB4-BLT1 axis regulates actomyosin and β2-integrin dynamics during neutrophil extravasation. The Journal of Cell Biology. 219 (10), 201910215 (2020).
- Yan, S. L. S., Hwang, I. -. Y., Kamenyeva, O., Kehrl, J. H. In vivo F-Actin filament organization during lymphocyte transendothelial and interstitial migration revealed by intravital microscopy. iScience. 16, 283-297 (2019).
- Porat-Shliom, N., et al. In vivo tissue-wide synchronization of mitochondrial metabolic oscillations. Cell Reports. 9 (2), 514-521 (2014).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10515-10520 (2015).
- Calvo-Rodriguez, M., et al. Increased mitochondrial calcium levels associated with neuronal death in a mouse model of Alzheimer's disease. Nature Communications. 11, 2146 (2020).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Li, J. L., et al. Intravital multiphoton imaging of immune responses in the mouse ear skin. Nature Protocols. 7 (2), 221-234 (2012).
- Swamydas, M., Lionakis, M. S. Isolation, purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments:JoVE. (77), e50586 (2013).
- Rose, S., Misharin, A., Perlman, H. A novel Ly6C/Ly6G-based strategy to analyze the mouse splenic myeloid compartment. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (4), 343-350 (2012).
- Lakschevitz, F. S. Identification of neutrophil surface marker changes in health and inflammation using high-throughput screening flow cytometry. Experimental Cell Research. 342 (2), 200-209 (2016).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. Journal of Visualized Experiments:JoVE. (17), e745 (2008).
- . MATLAB - Bio-Formats 6.1.0 documentation Available from: https://docs.openmicroscopy.org/bio-formats/6.1.0/users/matlab/index.html (2022)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9, 62-66 (1979).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179, 298-310 (1996).
- Xu, C., Prince, J. L. Snakes, shapes, and gradient vector flow. IEEE Transactions on Image Processing: A Publication of the IEEE Signal Processing Society. 7 (3), 359-369 (1998).
- Driscoll, M. K., et al. Automated image analysis of nuclear shape: what can we learn from a prematurely aged cell. Aging. 4 (2), 119-132 (2012).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Tauer, U. Advantages and risks of multiphoton microscopy in physiology. Experimental Physiology. 87 (6), 709-714 (2002).
- Débarre, D., Olivier, N., Supatto, W., Beaurepaire, E. Mitigating phototoxicity during multiphoton microscopy of live Drosophila embryos in the 1.0-1.2 µm wavelength range. PloS One. 9 (8), 104250 (2014).
- Masedunskas, A., et al. Intravital microscopy: a practical guide on imaging intracellular structures in live animals. Bioarchitecture. 2 (5), 143-157 (2012).
- Ng, L. G., et al. Visualizing the neutrophil response to sterile tissue injury in mouse dermis reveals a three-phase cascade of events. The Journal of Investigative Dermatology. 131 (10), 2058-2068 (2011).
- Wu, X. S., et al. Melanoregulin regulates a shedding mechanism that drives melanosome transfer from melanocytes to keratinocytes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 2101-2109 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon