Method Article
Limpeza Óptica de Tecidos Vegetais para Imagem de Fluorescência
Neste Artigo
Resumo
Aqui, é descrito um método para tornar os tecidos vegetais transparentes, mantendo a estabilidade das proteínas fluorescentes. Esta técnica facilita a imagem profunda de tecidos vegetais limpos sem seção física.
Resumo
É desafiador observar diretamente a estrutura interna de espécimes vegetais multicamadas e opacos, sem dissecção, sob um microscópio. Além disso, a autofluorescência atribuída à clorofila dificulta a observação de proteínas fluorescentes nas plantas. Por muito tempo, vários reagentes de compensação têm sido usados para tornar as plantas transparentes. No entanto, os reagentes de compensação convencionais diminuem sinais fluorescentes; portanto, não foi possível observar as estruturas celulares e intracelulares com proteínas fluorescentes. Foram desenvolvidos reagentes que podem limpar tecidos vegetais removendo clorofila, mantendo a estabilidade da proteína fluorescente. Um protocolo detalhado é fornecido aqui para a limpeza óptica de tecidos vegetais usando reagentes de compensação, ClearSee (CS) ou ClearSeeAlpha (CSA). A preparação de tecidos vegetais limpos envolve três etapas: fixação, lavagem e limpeza. A fixação é um passo crucial na manutenção das estruturas celulares e estabilidade intracelular de proteínas fluorescentes. O tempo de incubação para limpeza depende do tipo de tecido e espécie. Em Arabidopsis thaliana, o tempo necessário para compensação com CS foi de 4 dias para folhas e raízes, 7 dias para mudas e 1 mês para pistils. CS também exigiu um tempo relativamente curto de 4 dias para tornar transparente as folhas gametofíticas de Physcomitrium patens . Em contraste, pistils no tabaco e torenia produziram pigmento marrom devido à oxidação durante o tratamento de SC. CSA reduziu o pigmento marrom prevenindo a oxidação e poderia tornar o tabaco e torenia pistils transparentes, embora tenha demorado um tempo relativamente longo (1 ou 2 meses). CS e CSA também foram compatíveis com a coloração utilizando corantes químicos, como DAPI (4',6-diamidino-2-fenildole) e Hoechst 33342 para DNA e Calcofluor White, SR2200 e Direct Red 23 para a parede celular. Este método pode ser útil para imagens de plantas inteiras para revelar morfologia intacta, processos de desenvolvimento, interações vegetais-micróbios e infecções por nematoides.
Introdução
A visualização de estruturas celulares e a localização de proteínas em organismos vivos é importante para o esclarecimento de suas funções in vivo. No entanto, como o corpo vivo não é transparente, é desafiador observar a estrutura interna dos organismos vivos sem dissecção. Especialmente, no caso dos tecidos vegetais, que são multicamadas com células de diferentes formas, a incompatibilidade de índice causada por sua estrutura e a presença de pigmentos absorventes de luz é problemática. Por exemplo, as folhas de plantas têm uma estrutura complexa que lhes permite utilizar eficientemente a luz que entra em seus corpos para fotossíntese1, enquanto a estrutura também causa incompatibilidade de índice refrativo, dificultando a observação. No entanto, as folhas têm muitos pigmentos absorventes de luz, como a clorofila, que emitem forte fluorescência vermelha e pigmentos acastanhados são produzidos por oxidação2,3. Esses pigmentos também dificultam observações de microscopia de fluorescência de montagem total nas plantas. Portanto, para observar a estrutura interna das plantas, a descoloração e a fixação por álcool e a desobstrução por meio de hidrato cloral têm sido utilizadas há muito tempo para eliminar o incompatibilidade do índice refrativo e a autofluorescência4,5. Esses métodos convencionais têm sido adotados por muitos anos, mas têm a desvantagem de eliminar a fluorescência das proteínas fluorescentes ao mesmo tempo6,7. Isso é problemático, uma vez que as proteínas fluorescentes tornaram-se indispensáveis na imagem fluorescente atual.
Portanto, clearSee (CS) e ClearSeeAlpha (CSA) foram desenvolvidos como reagentes de compensação óptica para tecidos vegetais. Ambos os reagentes reduzem a autofluorescência da clorofila, mantendo a estabilidade das proteínas fluorescentes7,8. CSA é particularmente útil quando pigmentos marrons são produzidos devido à oxidação tecidual. Utilizando esses reagentes de compensação, é possível observar a estrutura celular e a localização da proteína dentro do corpo da planta sem secção física.
Protocolo
1. Elaboração de soluções de compensação
- Para preparar a solução CS, dissolva 10% (w/v) xilitol, 15% (w/v) desoxicolato de sódio e 25% (w/v) ureia em água destilada em um agitador magnético.
NOTA: O pó de desoxicorado de sódio deve ser pesado em uma câmara de rascunho, pois flutua facilmente no ar. CS pode ser armazenado à temperatura ambiente no escuro por mais de 1 ano. - Para preparar a solução CSA, adicione sulfite de sódio (concentração final de 50 mM) à solução CS obtida acima.
NOTA: Adicione sulfite de sódio à solução CS logo antes do uso à medida que o agente redutor for desativado facilmente.
2. Preparação da solução fixa
- Transfira 40 mL de água esterilizada em um tubo cônico e adicione 2 g de paraformaldeído. Adicione 200 μL de 2 N NaOH para aumentar o pH da solução. Depois de fechar e selar o tubo com parafilm, incubar a 60 °C com inversões ocasionais até que tudo seja dissolvido.
- Depois de resfriar a solução à temperatura ambiente, adicione 5 mL de soro fisiológico tamponado de fosfato de 10x (PBS) para ajustar o pH a 7,4. Adicione água esterilizada para compensar o volume a 50 mL.
NOTA: Uma solução fixativa recém-preparada é preferível. A solução também pode ser armazenada a -30 °C por vários meses.
3. Fixação de amostras
- Mergulhe amostras de plantas na solução fixativa em um microtubo (Figura 1A), garantindo que o volume da solução fixa é mais de cinco vezes o volume amostral.
- Sele o microtubo com um parafilm e faça furos usando uma agulha. Não deixe o tubo aberto devido ao risco de derramamento de amostra durante a descompressão a vácuo.
- Coloque o microtubo em um dessecador e ajuste lentamente o grau de vácuo (~690 mmHg) para que as bolhas apareçam gradualmente a partir das amostras (Figura 1B-C). Desligue a bomba de vácuo depois de evacuar o desiccator. Deixe o microtubo imperturbável por 30 minutos em temperatura ambiente.
- Desabasse o desiccator cuidadosamente para evitar perturbar as amostras. Ligue novamente a bomba de vácuo e desligue-a depois de evacuar o desiccador. Deixe o microtubo imperturbável por 30 minutos em temperatura ambiente.
NOTA: Deve-se tomar cuidado para evitar danos às amostras durante a ventilação do desiccador. A penetração da solução fixativa nas amostras é reforçada por dois tratamentos a vácuo. Outro tratamento a vácuo ajuda a penetrar a solução fixativa em amostras mais grossas. - Abra o desiccator cuidadosamente sem colidir com a solução fixativa no microtubo. Usando uma micropipette, remova a solução fixativa e adicione 1x PBS. Depois de armazenar por 1 min, substitua o PBS antigo pelo novo PBS 1x (Figura 1D).
4. Limpeza
- Depois de remover o PBS, adicione cinco vezes o volume amostral da solução de compensação.
- Sele o microtubo com parafilm e faça furos usando uma agulha. Coloque as amostras no desiccator, evacue como na etapa 3.3 e desligue a bomba de vácuo. Deixe o microtubo imperturbável por 60 minutos em temperatura ambiente.
- Abra o desiccador suavemente. Feche o microtubo com parafilm e armazene-o à temperatura ambiente no escuro para evitar o fotobleaching de proteínas fluorescentes. Inverta o microtubo a cada 1-2 dias para acelerar o processo de compensação.
- Quando a solução de compensação ficar verde, substitua-a por novas soluções de compensação até que a solução permaneça incolor (Figura 1E-H).

Figura 1: Procedimento para tratamento de CS. (A) muda de arabidopsis em solução de 4% PFA (Paraformaldeído). (B) A amostra é colocada em um desiccador. (C) A muda é fixada sob um vácuo. (D) A muda está encharcada na solução PFA após o tratamento a vácuo. (E) Resultantes de 3 dias de limpeza de mudas tratadas com solução. Observe a cor verde da solução de compensação. (F) A solução de compensação é substituída 3 dias após o tratamento. (G) Resultante de 5 dias de limpeza de sementes tratadas com solução. (H) A solução de compensação é substituída 5 dias após o tratamento. Barras de escala: 1 cm (A,C-H) e 5 cm (B). Clique aqui para ver uma versão maior desta figura.
5. Coloração química de corante
- Ao microtubo, adicione Hoechst 33342 (concentração final de 10 μg/mL) para coloração nuclear ou Calcofluor White (concentração final de 1 mg/mL) para coloração da parede celular e espere por 1 h. Depois de remover a solução de corante, lave a amostra com uma solução de compensação fresca por 1h.
NOTA: A coloração e a lavagem durante a noite podem melhorar a penetração de corante fluorescente nos tecidos e reduzir a fluorescência de fundo. Vários corantes fluorescentes são compatíveis com a solução CS como Basic Fuchsin9 (lignina), Auramine O9 (lignina, suberina e cutin), Nile Red9 (suberina), Direct Yellow 969, Direct Red 239 e SR220010,11 (paredes celulares).
6. Observação
- Corte a folha de borracha de silicone com uma lâmina de barbear para preparar uma armação para o espaçador (Figura 2A).
NOTA: Ajuste a espessura da folha de borracha de silício de acordo com a espessura da amostra. Como as amostras tratadas com solução de compensação são macias, elas serão danificadas se estiverem cobertas diretamente com o vidro de cobertura. - Coloque a estrutura de silicone no vidro de cobertura (por exemplo, 25 x 60 mm) (Figura 2B). Coloque as amostras tratadas dentro do quadro e adicione ~100 μL de solução de compensação para remover quaisquer bolhas no quadro. Cubra com outro vidro de cobertura (18 x 18 mm ou 24 x 24 mm) para evitar a evaporação da solução de compensação (Figura 2C).
- Observe as amostras sob um microscópio fluorescente. Após observação, devolva as amostras à solução de compensação colhida em um microtubo e armazene à temperatura ambiente no escuro.

Figura 2: Preparação da amostra para observação microscópica. (A) Corte uma folha de silicone de 0,2 mm de espessura em uma moldura. (B) Coloque a estrutura da folha de silicone no vidro da tampa. (C) Coloque a amostra tratada com solução de compensação (marcada por borda pontilhada) dentro da estrutura e cubra-a com um copo de tampa. Barras de escala: 5 mm. Clique aqui para ver uma versão maior desta figura.
Resultados
CS pode limpar folhas de várias espécies (Figura 3A-H). É difícil para a solução CS penetrar uma folha de arroz porque a superfície da folha é coberta por cera cuticular nesta planta. No entanto, depois de extrair a cera cuticular mergulhando em clorofórmio por 10 s, CS poderia limpar as folhas de arroz (Figura 3H). CS não poderia, no entanto, penetrar folhas chamaecyparis obtusa que são menos permeáveis a CS (Figura 3I,J). Nas folhas de Crisântemo, a pigmentação marrom induzida pela oxidação de polifenóis foi observada nas folhas tratadas com CS (Figura 3K,L). Da mesma forma, o tabaco e a torenia pistils apresentaram pigmentação marrom durante o tratamento de EC (Figura 3M,O). Como o componente sulfito de sódio em CSA previne a oxidação de polifenóis devido ao efeito redutor, csa poderia limpar tabaco e torenia pistils sem qualquer pigmentação marrom (Figura 3N,P).
As figuras 4B mostram que o tratamento de CS reduziu a cor verde pálida da folha Arabidopsis H2B-mClover (campo brilhante) e aumentou a intensidade de fluorescência de H2B-mClover em comparação com a incubação de PBS (Figura 4A). Além das plantas de floração, a CS também é aplicável às plantas de musgo (Figura 4C); após 4 dias de tratamento de CS, a fluorescência de H2B-mRFP foi claramente detectada para todo o gametophore com autofluorescência de clorofila reduzida. Figuras 4D,E mostram imagens de reconstrução 3D do pistil H2B-mClover em Nicotiana benthamiana limpo usando CSA. A profundidade da amostra foi de 440 μm. Como mostra a imagem de projeção de intensidade máxima codificada em profundidade, o CSA permite imagens profundas de tecidos desafiadores, como pistils de tabaco.
CS e CSA também foram compatíveis com coloração de corante fluorescente. A Figura 5 mostra que a CS poderia ser usada simultaneamente para observar a proteína fluorescente (H2B-mClover) e a coloração de corante fluorescente orgânico (Calcofluor White). Após a reconstrução 3D das imagens da pilha z, qualquer seção pode ser observada.

Figura 3: Limpeza óptica de folhas e pistils utilizando soluções de compensação. (A-L) Folhas fixas de várias espécies foram incubadas em PBS (A,C,E,G,I,K) ou CS (B,D,F,H,J,L) por 8 dias e CS (M,O) ou CSA (N,P) por 2 dias. (A,B,O,P) Torenia fournieri, (C,D) Nicotiana tabacum, (E,F) Pepino sativus, (G,H) Oryza sativa, (I,J) Chamaecyparis obtusa, (K,L) Crisântemo morifolium, (M,N) Nicotiana benthamiana. Barras de escala: 1 cm. Clique aqui para ver uma versão maior desta figura.

Figura 4: A imagem de fluorescência dos tecidos tratados com soluções de compensação. (A,B) UBQ10pro::H2B-mClover folhas de Arabidopsis thaliana foram tratadas com PBS (A) ou CS (B) por 3 dias. (C) Os gametophores frondosos de Physcomitrium foram tratados com CS por 4 dias. Os núcleos foram rotulados com H2B-mRFP (verde). O tratamento de CS reduziu a autofluorescência de clorofila (magenta). O sinal H2B-mRFP na região apical foi claramente observado para imagens mescladas de H2B-mRFP e autofluorescência ou campo brilhante. (D,E) O estigma UBQ10pro::H2B-mClover de Nicotiana benthamiana foi tratado no CSA por 1 mês. A projeção de intensidade máxima (D) e a projeção de intensidade máxima (E) codificadas por profundidade foram geradas a partir de imagens de pilha de 88 z em intervalos de 5 μm. Barras de escala: 100 μm. As imagens foram tiradas utilizando-se microscopia de campo largo (A,B), confocal (C) e microscopia de dois fótons (D,E). Clique aqui para ver uma versão maior desta figura.
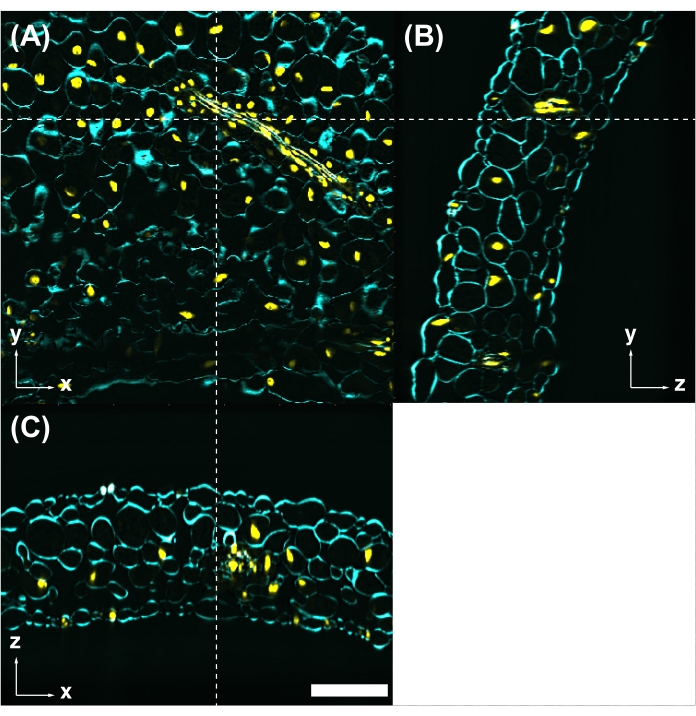
Figura 5: A coloração de corante fluorescente é compatível com CS. (A) Folhas tratadas com CS observadas por microscopia de excitação de dois fótons com excitação de 950 nm. A parede celular está manchada com Calcofluor White (ciano). Os núcleos são rotulados com UBQ10pro::H2B-mClover (amarelo). As imagens yz (B) e xz (C) são seções transversais na posição indicada pelas linhas brancas tracejadas em (A). Barra de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Transparência da desoxicolato de sódio. (A) Cores de vários desoxicolatos de sódio de 15% (listados na Tabela de Materiais). (B) Espectro de fluorescência de cada desoxicolato de sódio de 15% com excitação de 380 nm. Clique aqui para ver uma versão maior desta figura.
Discussão
Este método consiste em fixação, lavagem e limpeza. A fixação é um passo crítico neste protocolo. Se a proteína fluorescente não for observada após a fixação da PFA, ela não será observada após o tratamento com solução de compensação. A penetração da solução PFA em tecidos é crítica, mas o tratamento de alto vácuo não é recomendado porque pode destruir a estrutura celular. As condições de vácuo e os períodos de fixação devem ser otimizados para cada tipo de tecido e espécie. Recomenda-se verificar proteínas fluorescentes mesmo após a fixação. Embora as amostras tenham sido geralmente fixadas por 30-60 min em temperatura ambiente, elas podem ser fixadas a 4 °C por mais tempo (durante a noite ou mais).
Como mostrado na Figura 6A, alguns desoxicorados de sódio tinham uma cor amarelo-pálida quando dissolvidos. Tais soluções de desoxicolato de sódio apresentaram forte autofluorescência na região de 400-600 nm após excitação a 380 nm (Figura 6B). Esta autofluorescência previne a limpeza óptica e a imagem de fluorescência. Os usuários devem verificar a cor da solução de desoxicolato de sódio, pois a qualidade do reagente pode diferir devido à pureza, variação de lot-to-lot, ou outras razões.
As soluções de compensação utilizadas aqui têm altas concentrações de desoxicolato de sódio, o que poderia destruir a estrutura da membrana. O marcador de membrana plasmática (RPS5Apro::tdTomato-LTI6b) foi observado mesmo após o tratamento de CS7. No entanto, pode ser melhor reduzir a concentração de desoxicolato de sódio, dependendo da estrutura e tecido de interesse. De fato, foram obtidas imagens com maior clareza para arabidopsis pistils com CS modificado, em que a concentração de desoxicolato de sódio é reduzida pela metade; no entanto, as concentrações reduzidas de desoxicolato de sódio exigiram tempos prolongados de tratamento (por exemplo, 1 mês para arabidopsis pistils).
CS pode reduzir a autofluorescência vermelha (>610 nm) para remover clorofila em amostras tratadas. No entanto, a autofluorescência de alcance de 500-600 nm (amarelo a laranja) permaneceu mesmo em amostras tratadas com CS7. Acredita-se que essa autofluorescência seja derivada da parede celular e de outros componentes celulares, como o lignina12,13. Portanto, é difícil fazer tecidos, como caules com paredes secundárias desenvolvidas, completamente transparentes pelo tratamento de CS.
Vários reagentes de compensação além dos utilizados aqui foram desenvolvidos para observar proteínas fluorescentes em plantas utilizando microscopia fluorescente14,15,16,17. Em comparação com esses métodos, CS e CSA removem a clorofila e reduzem a autofluorescência, tornando os tecidos vegetais mais transparentes. Recentemente, Sakamoto et al. desenvolveram um método aprimorado, iTOMEI, para fixação, compensação de detergentes e montagem para ajustar o índice refrativo incompatível18. Nas mudas arabidopsis, o iTOMEI limpou o tecido dentro de 26 h.
CS é aplicável a uma ampla gama de espécies vegetais, como Arabidopsis thaliana, Physcomitrium patens7, Chrysanthemum morifolium, Cucumis sativus, Nicotiana benthamiana, Nicotiana tabacum, Torenia fournieri8, Allium ochotense19, Astragalus sinicus20, abacate21, cevada22, Brassica rapa23, Callitriche 24, Eucalipto25, milho26, Marchantia polymorpha27, Monophyllaea glabra28, Orobanche minor29, petúnia30, rice31, Solanum lycopersicum32, soja33, morango34, trigo35 e Wolffiella hyalina36. Para tecidos mais grossos, a CS também pode tornar transparentes as seções vibratome37,38. Esse método permitiu estudos da estrutura celular e padrões de expressão genética em plantas37,38. Além disso, também foram observadas infecções por nematoide20,39, infecções fúngicas e simbiose19,40,41 no interior dos tecidos tratados com ESC. Assim, este método é útil para imagens de tecido inteiros de micro a macroescamas e poderia ajudar a descobrir novas interações entre várias células, tecidos, órgãos e organismos.
Divulgações
ClearSee é comercializado (Fujifilm Wako Pure Chemical Corporation, Japão). A Universidade de Nagoya possui uma patente (JP6601842) sobre o reagente de compensação ClearSee. Kurihara é o inventor da patente. Os autores não declaram interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pela Japan Society for the Promotion of Science (Grant-in-Aid for Scientific Research on Innovative Areas (JP16H06464, JP16H06280 to T.H.), Grant-in-Aid for Scientific Research (B, JP17H03697 a D.K.), Grant-in-Aid for Challenge Exploratory Research (JP18K19331 to D.K.), Grant-in-Aid for Scientific Research on Innovative Areas (JP20H05358 for D.K.)) e a Japan Science and Technology Agency (programa PRESTO (programa PRESTO (JPMJPR15QC to Y.M., JPMJPR18K4 a D.K.)). Os autores agradecem ao Centro de Imagem Ao Vivo do Instituto de Bio-Moléculas Transformadoras (WPI-ITbM) da Universidade de Nagoya por apoiar os estudos microscópicos e a edição (www.editage.com) para edição em língua inglesa.
Materiais
| Name | Company | Catalog Number | Comments |
| Calcofluor White | Sigma-Aldrich | F3543 | Fluorescent Brightener 28; 100 mg/mL in H2O |
| ClearSee | 10% (w/v) xylitol, 15% (w/v) sodium deoxycholate, 25% (w/v) urea | ||
| Cover glass (18×18 No.1) | MATSUNAMI | C018181 | |
| Cover glass (24×24 No.1) | MATSUNAMI | C024241 | |
| Cover glass (25×60 No.1) | MATSUNAMI | C025601 | |
| Desiccator | AS One | 1-5801-11 | |
| Hoechst 33342 | DOJINDO | 346-07951 | 1 mg/mL in H2O |
| Needle | TERUMO | NN-2238S | |
| Parafilm | Bemis | PM-996 | |
| Paraformaldehyde | Nacalai Tesque | 26126-25 | |
| Phosphate buffered saline, pH 7.4 | |||
| Silicone rubber sheet | AS One | 6-9085-12 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | Figure 6_1; Lot PSGYK-QB |
| Sodium deoxycholate | Kishida Chemical | 260-71412 | Figure 6_2; Lot C05543H |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | Figure 6_3; Lot SLBS7362 |
| Sodium deoxycholate | Sigma-Aldrich | 30970 | Figure 6_4; Lot BCBW0612 |
| Sodium deoxycholate | Nacalai Tesque | 10712-96 | Figure 6_5; Lot M5R3403 |
| Sodium deoxycholate | FUJIFILM Wako Pure Chemical | 194-08311 | Figure 6_6; Lot LKL0648 |
| Sodium hydroxide | Nacalai Tesque | 31511-05 | |
| Sodium sulphite | FUJIFILM Wako Pure Chemical | 190-03411 | |
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | BUCHI | V-700 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
Referências
- Vogelmann, T. C. Light within the plant. Photomorphogenesis in Plants. , 491-535 (1994).
- Krause, G. H., Weis, E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology. 42 (1), 313-349 (1991).
- Pourcel, L., Routaboul, J., Cheynier, V., Lepiniec, L., Debeaujon, I. Flavonoid oxidation in plants: from biochemical properties to physiological functions. Trends in Plant Science. 12 (1), 29-36 (2007).
- Lersten, N. R. An annotated bibliography of botanical clearing methods. Iowa State Journal of Science. 41 (4), 481-486 (1967).
- Villani, T. S., Koroch, A. R., Simon, J. E. An improved clearing and mounting solution to replace chloral hydrate in microscopic applications. Applications in Plant Sciences. 1 (5), 1300016(2013).
- Becker, K., Jährling, N., Saghafi, S., Weiler, R., Dodt, H. -U. Chemical clearing and dehydration of GFP expressing mouse brains. PLoS ONE. 7 (3), 33916(2012).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: a rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Tofanelli, R., Vijayan, A., Scholz, S., Schneitz, K. Protocol for rapid clearing and staining of fixed Arabidopsis ovules for improved imaging by confocal laser scanning microscopy. Plant Methods. 15 (1), 120(2019).
- Vijayan, A., et al. A digital 3D reference atlas reveals cellular growth patterns shaping the Arabidopsis ovule. eLife. 10, 1-38 (2021).
- Müller, S. M., Galliardt, H., Schneider, J., George Barisas, B., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 1-20 (2013).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252, 1231-1240 (2015).
- Littlejohn, G. R., Gouveia, J. D., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytologist. 186 (4), 1018-1025 (2010).
- Warner, C. A., et al. An optical clearing technique for plant tissues allowing deep imaging and compatible with fluorescence microscopy. Plant Physiology. 166 (4), 1684-1687 (2014).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLOS ONE. 11 (8), 0161107(2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Research Square. , (2021).
- Tanaka, E., Ono, Y. Whole-leaf fluorescence imaging to visualize in planta fungal structures of Victory onion leaf rust fungus, Uromyces japonicus, and its taxonomic evaluation. Mycoscience. 59 (2), 137-146 (2018).
- Ohtsu, M., et al. Spatiotemporal deep imaging of syncytium induced by the soybean cyst nematode Heterodera glycines. Protoplasma. 254, 2107-2115 (2017).
- Duman, Z., et al. Short de-etiolation increases the rooting of VC801 Avocado rootstock. Plants. 9 (11), 1481(2020).
- Ho, W. W. H., et al. Integrative multi-omics analyses of barley rootzones under salinity stress reveal two distinctive salt tolerance mechanisms. Plant Communications. 1 (3), 100031(2020).
- Arsovski, A. A., et al. BrphyB is critical for rapid recovery to darkness in mature Brassica rapa leaves. bioRxiv. , (2020).
- Doll, Y., Koga, H., Tsukaya, H. The diversity of stomatal development regulation in Callitriche is related to the intrageneric diversity in lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 118 (14), (2021).
- Eliyahu, A., et al. Vegetative propagation of elite Eucalyptus clones as food source for honeybees (Apis mellifera); adventitious roots versus callus formation. Israel Journal of Plant Sciences. 67 (1-2), 83-97 (2020).
- Kelliher, T., et al. MATRILINEAL, a sperm-specific phospholipase, triggers maize haploid induction. Nature. 542, 105-109 (2017).
- Aki, S. S., et al. Cytokinin signaling is essential for organ formation in Marchantia polymorpha. Plant and Cell Physiology. 60 (8), 1842-1854 (2019).
- Kinoshita, A., Koga, H., Tsukaya, H. Expression profiles of ANGUSTIFOLIA3 and SHOOT MERISTEMLESS, key genes for meristematic activity in a one-leaf plant Monophyllaea glabra, revealed by whole-mount in situ hybridization. Frontiers in Plant Science. 11, 1-11 (2020).
- Okazawa, A., et al. Localization of planteose hydrolysis during seed germination of Orobanche minor. bioRxiv. , 448768(2021).
- Chen, M., et al. VAPYRIN attenuates defence by repressing PR gene induction and localized lignin accumulation during arbuscular mycorrhizal symbiosis of Petunia hybrida. New Phytologist. 229 (6), 3481-3496 (2021).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11, 23(2018).
- Alaguero-Cordovilla, A., et al. An auxin-mediated regulatory framework for wound-induced adventitious root formation in tomato shoot explants. Plant, Cell & Environment. 44 (5), 1642-1662 (2021).
- Okuda, A., Matsusaki, M., Masuda, T., Urade, R. Identification and characterization of GmPDIL7, a soybean ER membrane-bound protein disulfide isomerase family protein. The FEBS Journal. 284 (3), 414-428 (2017).
- Kim, D. -R., et al. A mutualistic interaction between Streptomyces bacteria, strawberry plants and pollinating bees. Nature Communications. 10 (1), 4802(2019).
- Wu, J., Mock, H. -P., Giehl, R. F. H., Pitann, B., Mühling, K. H. Silicon decreases cadmium concentrations by modulating root endodermal suberin development in wheat plants. Journal of Hazardous Materials. 364, 581-590 (2019).
- Isoda, M., Oyama, T. Use of a duckweed species, Wolffiella hyalina, for whole-plant observation of physiological behavior at the single-cell level. Plant Biotechnology. 35 (4), 387-391 (2018).
- Ben-Targem, M., Ripper, D., Bayer, M., Ragni, L. Auxin and gibberellin signaling cross-talk promotes hypocotyl xylem expansion and cambium homeostasis. Journal of Experimental Botany. 72 (10), 3647-3660 (2021).
- Shwartz, I., et al. The VIL gene CRAWLING ELEPHANT controls maturation and differentiation in tomato via polycomb silencing. bioRxiv. , (2021).
- Levin, K. A., Tucker, M. R., Strock, C. F., Lynch, J. P., Mather, D. E. Three-dimensional imaging reveals that positions of cyst nematode feeding sites relative to xylem vessels differ between susceptible and resistant wheat. Plant Cell Reports. 40 (2), 393-403 (2021).
- Nouri, E., et al. Phosphate suppression of arbuscular mycorrhizal symbiosis involves gibberellic acid signaling. Plant and Cell Physiology. 62 (6), 959-970 (2021).
- Evangelisti, E., et al. Artificial intelligence enables the identification and quantification of arbuscular mycorrhizal fungi in plant roots. bioRxiv. , 434067(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados