Method Article
التطهير البصري للأنسجة النباتية للتصوير الفلوري
In This Article
Summary
هنا ، يتم وصف طريقة لجعل الأنسجة النباتية شفافة مع الحفاظ على استقرار البروتينات الفلورية. تسهل هذه التقنية التصوير العميق للأنسجة النباتية التي تم تطهيرها دون تقسيم مادي.
Abstract
من الصعب مراقبة البنية الداخلية للعينات النباتية متعددة الطبقات وغير الشفافة مباشرة ، دون تشريح ، تحت المجهر. بالإضافة إلى ذلك ، فإن التألق الذاتي المنسوب إلى الكلوروفيل يعيق ملاحظة البروتينات الفلورية في النباتات. لفترة طويلة ، تم استخدام كواشف إزالة مختلفة لجعل النباتات شفافة. ومع ذلك ، فإن كواشف المقاصة التقليدية تقلل من إشارات الفلورسنت. لذلك ، لم يكن من الممكن مراقبة الهياكل الخلوية وداخل الخلايا مع البروتينات الفلورية. تم تطوير كواشف يمكنها تنظيف الأنسجة النباتية عن طريق إزالة الكلوروفيل مع الحفاظ على استقرار البروتين الفلوري. يتم توفير بروتوكول مفصل هنا للتطهير البصري للأنسجة النباتية باستخدام كواشف التطهير أو ClearSee (CS) أو ClearSeeAlpha (CSA). يتضمن إعداد الأنسجة النباتية التي تم تطهيرها ثلاث خطوات: التثبيت والغسيل والتطهير. التثبيت هو خطوة حاسمة في الحفاظ على الهياكل الخلوية والاستقرار داخل الخلايا للبروتينات الفلورية. يعتمد وقت الحضانة للتطهير على نوع الأنسجة وأنواعها. في Arabidopsis thaliana ، كان الوقت اللازم للتطهير باستخدام CS هو 4 أيام للأوراق والجذور ، و 7 أيام للشتلات ، و 1 شهر للمدقات. تطلب CS أيضا وقتا قصيرا نسبيا قدره 4 أيام لجعل الأوراق الأمشاج من Physcomitrium patens شفافة. في المقابل ، أنتجت المدقات في التبغ والتورينيا صبغة بنية اللون بسبب الأكسدة أثناء معالجة CS. خفضت CSA الصبغة البنية عن طريق منع الأكسدة ويمكن أن تجعل التبغ ومدقات تورينيا شفافة ، على الرغم من أنها استغرقت وقتا طويلا نسبيا (1 أو 2 أشهر). كانت CS و CSA متوافقة أيضا مع التلطيخ باستخدام الأصباغ الكيميائية ، مثل DAPI (4',6-diamidino-2-phenylindole) و Hoechst 33342 للحمض النووي و Calcofluor White ، SR2200 ، و Direct Red 23 لجدار الخلية. يمكن أن تكون هذه الطريقة مفيدة لتصوير النبات بأكمله للكشف عن المورفولوجيا السليمة ، والعمليات التنموية ، والتفاعلات بين النبات والميكروبات ، والتهابات الديدان الخيطية.
Introduction
يعد تصور الهياكل الخلوية وتوطين البروتينات في الكائنات الحية أمرا مهما لتوضيح وظائفها في الجسم الحي. ومع ذلك ، نظرا لأن الجسم الحي ليس شفافا ، فمن الصعب مراقبة البنية الداخلية للكائنات الحية دون تشريح. على وجه الخصوص ، في حالة الأنسجة النباتية ، التي هي متعددة الطبقات مع خلايا ذات أشكال مختلفة ، فإن عدم تطابق المؤشر الناجم عن هيكلها ووجود أصباغ تمتص الضوء يمثل مشكلة. على سبيل المثال، تحتوي أوراق النباتات على بنية معقدة تسمح لها باستخدام الضوء الذي يدخل أجسامها بكفاءة لعملية التمثيل الضوئي1، في حين أن البنية تسبب أيضا عدم تطابق معامل الانكسار، مما يجعل من الصعب ملاحظتها. ومع ذلك ، تحتوي الأوراق على العديد من الأصباغ الممتصة للضوء ، مثل الكلوروفيل ، الذي ينبعث منه تألق أحمر قوي ويتم إنتاج أصباغ بنية اللون عن طريق الأكسدة2,3. هذه الأصباغ تعيق أيضا ملاحظات المجهر الفلوري الكامل في النباتات. لذلك ، لمراقبة البنية الداخلية للنباتات ، تم استخدام إزالة اللون والتثبيت بواسطة الكحول وإزالة الهيدرات باستخدام هيدرات الكلورال لفترة طويلة للقضاء على عدم تطابق مؤشر الانكسار والتألق الذاتي4,5. تم اعتماد هذه الطرق التقليدية لسنوات عديدة ، ولكن لها عيب في القضاء على تألق البروتينات الفلورية في نفس الوقت6,7. هذا يمثل مشكلة لأن البروتينات الفلورية أصبحت لا غنى عنها في التصوير الفلوري الحالي.
لذلك ، تم تطوير ClearSee (CS) و ClearSeeAlpha (CSA) ككواشف مسح بصري للأنسجة النباتية. يقلل كلا الكواشف من التألق الذاتي للكلوروفيل مع الحفاظ على استقرار البروتينات الفلورية7,8. CSA مفيد بشكل خاص عندما يتم إنتاج أصباغ بنية بسبب أكسدة الأنسجة. باستخدام كواشف المقاصة هذه ، من الممكن مراقبة البنية الخلوية وتوطين البروتين داخل جسم النبات دون تقسيم مادي.
Protocol
1. إعداد حلول المقاصة
- لتحضير محلول CS ، قم بإذابة 10٪ (w / v) xylitol ، و 15٪ (w / v) deoxycholate الصوديوم ، و 25٪ (w / v) اليوريا في الماء المقطر على التحريك المغناطيسي.
ملاحظة: يجب وزن مسحوق ديوكسيكولات الصوديوم في غرفة مسودة لأنه يطفو بسهولة في الهواء. يمكن تخزين CS في درجة حرارة الغرفة في الظلام لأكثر من 1 سنة. - لإعداد محلول CSA ، أضف كبريتيت الصوديوم (التركيز النهائي 50 mM) إلى محلول CS الذي تم الحصول عليه أعلاه.
ملاحظة: أضف كبريتيت الصوديوم إلى محلول CS مباشرة قبل الاستخدام حيث يتم إلغاء تنشيط عامل الاختزال بسهولة.
2. إعداد الحل المثبت
- انقل 40 مل من الماء المعقم إلى أنبوب مخروطي وأضف 2 غرام من بارافورمالدهايد. أضف 200 ميكرولتر من 2 N NaOH لزيادة درجة الحموضة في المحلول. بعد إغلاق الأنبوب وختمه باستخدام البارافيلم ، احتضنه عند 60 درجة مئوية مع انعكاسات عرضية حتى يذوب كل شيء.
- بعد تبريد المحلول إلى درجة حرارة الغرفة ، أضف 5 مل من محلول ملحي مخزن بالفوسفات 10x (PBS) لضبط الرقم الهيدروجيني على 7.4. أضف الماء المعقم لتكوين الحجم إلى 50 مل.
ملاحظة: يفضل وجود محلول مثبت طازج. يمكن أيضا تخزين المحلول عند -30 درجة مئوية لعدة أشهر.
3. تثبيت العينات
- اغمر عينات النبات في المحلول المثبت في أنبوب دقيق (الشكل 1A) ، مما يضمن أن حجم المحلول المثبت أكثر من خمسة أضعاف حجم العينة.
- ختم microtube مع parafilm وجعل ثقوب باستخدام إبرة. لا تترك الأنبوب مفتوحا بسبب خطر انسكاب العينة أثناء تخفيف الضغط الفراغي.
- ضع الأنبوب الدقيق في مجفف واضبط ببطء درجة الفراغ (~ 690 مم زئبق) بحيث تظهر الفقاعات تدريجيا من العينات (الشكل 1B-C). أوقف تشغيل مضخة التفريغ بعد إخلاء المجفف. اترك الأنبوب الصغير دون إزعاج لمدة 30 دقيقة في درجة حرارة الغرفة.
- تنفيس المجفف بعناية لمنع إزعاج العينات. قم بتشغيل مضخة التفريغ مرة أخرى وقم بإيقاف تشغيلها بعد إخلاء المجفف. اترك الأنبوب الصغير دون إزعاج لمدة 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: يجب توخي الحذر لمنع تلف العينات أثناء تنفيس المجفف. يتم تعزيز تغلغل المحلول المثبت في العينات من خلال معالجتين للفراغ. مزيد من المعالجة بالتفريغ يساعد على اختراق المحلول المثبت في عينات أكثر سمكا. - افتح المجفف بعناية دون أن تصطدم بالمحلول المثبت في الأنبوب الصغير. باستخدام ماصة دقيقة ، قم بإزالة المحلول المثبت وإضافة 1x PBS. بعد التخزين لمدة دقيقة واحدة ، استبدل PBS القديم ب 1x PBS جديد (الشكل 1D).
4. المقاصة
- بعد إزالة PBS ، أضف خمسة أضعاف حجم عينة محلول المقاصة.
- ختم microtube مع parafilm وجعل ثقوب باستخدام إبرة. ضع العينات في المجفف ، وقم بالإخلاء كما في الخطوة 3.3 ، وأطفئ مضخة التفريغ. اترك الأنبوب الصغير دون إزعاج لمدة 60 دقيقة في درجة حرارة الغرفة.
- افتح المجفف بلطف. أغلق الأنبوب الدقيق مع البارافيلم وخزنه في درجة حرارة الغرفة في الظلام لتجنب التبييض الضوئي للبروتينات الفلورية. عكس الأنبوب الدقيق كل 1-2 أيام لتسريع عملية المقاصة.
- عندما يتحول محلول المقاصة إلى اللون الأخضر، استبدله بحلول مقاصة جديدة حتى يظل المحلول عديم اللون (الشكل 1E-H).

الشكل 1: إجراء علاج CS. (أ) شتلات أرابيدوبسيس في محلول PFA (بارافورمالديهايد) بنسبة 4٪. (ب) توضع العينة في مجفف. (ج) يتم تثبيت الشتلات تحت فراغ. (د) تنقع الشتلات في محلول PFA بعد المعالجة بالتفريغ. (ه) الشتلات المعالجة بمحلول التطهير الناتجة لمدة 3 أيام. لاحظ اللون الأخضر لحل المقاصة. (و) يتم استبدال محلول المقاصة بعد 3 أيام من العلاج. (ز) الشتلات المعالجة بمحلول المقاصة الناتجة لمدة 5 أيام. (ح) يتم استبدال محلول المقاصة بعد 5 أيام من العلاج. قضبان الميزان: 1 سم (A,C-H) و 5 سم (B). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. صبغة الكيميائية تلطيخ
- إلى الأنبوب الدقيق، أضف Hoechst 33342 (التركيز النهائي 10 ميكروغرام/مل) للتلطيخ النووي أو Calcofluor White (التركيز النهائي 1 ملغم/مل) لتلطيخ جدار الخلية وانتظر 1 ساعة. بعد إزالة محلول الصبغة ، اغسل العينة بمحلول تطهير جديد لمدة 1 ساعة.
ملاحظة: يمكن أن يؤدي التلطيخ والغسيل بين عشية وضحاها إلى تحسين تغلغل صبغة الفلورسنت في الأنسجة وتقليل التألق في الخلفية. تتوافق أصباغ الفلورسنت المختلفة مع محلول CS مثل Basic Fuchsin9 (lignin) و Auramine O9 (lignin و suberin و cutin) و Nile Red9 (suberin) و Direct Yellow 969 و Direct Red 239 و SR220010,11 (جدران الخلايا).
6. الملاحظة
- قطع ورقة مطاط السيليكون بشفرة حلاقة لإعداد إطار للفاصل (الشكل 2A).
ملاحظة: اضبط سمك ورقة مطاط السيليكون وفقا لسمك العينة. نظرا لأن العينات المعالجة بمحلول التطهير ناعمة ، فسوف تتلف إذا تم تغطيتها مباشرة بزجاج الغطاء. - ضع إطار السيليكون على زجاج الغطاء (على سبيل المثال، 25 × 60 مم) (الشكل 2B). ضع العينات المعالجة داخل الإطار وأضف ~ 100 ميكرولتر من محلول المقاصة لإزالة أي فقاعات في الإطار. قم بتغطية بزجاج غطاء آخر (18 × 18 مم أو 24 × 24 مم) لمنع تبخر محلول المقاصة (الشكل 2C).
- راقب العينات تحت المجهر الفلوري. بعد الملاحظة ، أعد العينات إلى محلول المقاصة المأخوذ في أنبوب دقيق وخزنها في درجة حرارة الغرفة في الظلام.

الشكل 2: تحضير العينة للمراقبة المجهرية. (أ) قطع ورقة سيليكون بسمك 0.2 مم في إطار. (ب) ضع إطار ورقة السيليكون على زجاج الغلاف. (ج) ضع العينة المعالجة بمحلول إزالة (مميز بحدود منقطة) داخل الإطار وقم بتغطيتها بزجاج غطاء. أشرطة الميزان: 5 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يمكن ل CS مسح أوراق الأنواع المختلفة (الشكل 3A-H). من الصعب على محلول CS اختراق ورقة الأرز لأن سطح الورقة مغطى بالشمع الجلدي في هذا النبات. ومع ذلك ، بعد استخراج الشمع الجلدي عن طريق غمس الكلوروفورم لمدة 10 ثوان ، يمكن ل CS مسح أوراق الأرز (الشكل 3H). ومع ذلك ، لم تتمكن CS من اختراق أوراق Chamaecyparis obtusa الأقل نفاذية ل CS (الشكل 3I ، J). في أوراق الأقحوان ، لوحظ تصبغ بني ناتج عن أكسدة البوليفينول في الأوراق المعالجة ب CS (الشكل 3K ، L). وبالمثل ، أظهر مدقة التبغ والتورينيا تصبغا بنيا أثناء علاج CS (الشكل 3M ، O). وبما أن مكون كبريتيت الصوديوم في CSA يمنع أكسدة البوليفينول بسبب تأثير الاختزال ، يمكن ل CSA إزالة التبغ ومدقات تورينيا دون أي تصبغ بني (الشكل 3N ، P).
ويبين الشكل 4B أن المعالجة بتقنية CS قللت من اللون الأخضر الباهت لورقة أرابيدوبسيس H2B-mClover (المجال الساطع) وعززت شدة التألق في H2B-mClover مقارنة بحضانة PBS (الشكل 4A). بالإضافة إلى النباتات المزهرة ، ينطبق CS أيضا على نباتات الطحالب (الشكل 4C) ؛ بعد 4 أيام من علاج CS ، تم الكشف بوضوح عن تألق H2B-mRFP لكامل gametophore مع انخفاض التألق الذاتي الكلوروفيل. تظهر الأشكال 4D ، E صور إعادة الإعمار ثلاثية الأبعاد لمدقة H2B-mClover في Nicotiana benthamiana التي تم مسحها باستخدام CSA. كان عمق العينة 440 ميكرومتر. وكما تظهر صورة الإسقاط الأقصى للكثافة المشفرة بالعمق، تسمح CSA بالتصوير العميق للأنسجة الصعبة، مثل مدقات التبغ.
كانت CS و CSA متوافقة أيضا مع تلطيخ صبغة الفلورسنت. يوضح الشكل 5 أنه يمكن استخدام CS في وقت واحد لمراقبة البروتين الفلوري (H2B-mClover) وتلطيخ صبغة الفلورسنت العضوية (Calcofluor White). بعد إعادة بناء 3D من صور z-stack ، يمكن ملاحظة أي قسم.

الشكل 3: التطهير البصري للأوراق والمدقات باستخدام محاليل المقاصة. (A-L) تم احتضان الأوراق الثابتة من مختلف الأنواع في PBS (A ، C ، E ، G ، I ، K) أو CS (B ، D ، F ، H ، J ، L) لمدة 8 أيام و CS (M ، O) أو CSA (N ، P) لمدة 2 أيام. (أ، ب، س، ع) تورينيا فورنييري، (C، D) نيكوتيانا تاباكوم، (E، F) كوكوميس ساتيفوس، (G، H) أوريزا ساتيفا، (I، J) شامايسيباريس أوبتوسا، (K، L) أقحوان موريفوليوم، (M، N) نيكوتيانا بينثاميانا. أشرطة المقياس: 1 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: التصوير الفلوري للأنسجة المعالجة بمحاليل التطهير. (A,B) UBQ10pro::H2B-mClover أوراق أرابيدوبسيس ثاليانا عولجت ب PBS (A) أو CS (B) لمدة 3 أيام. (ج) عولجت الأجامج المورقة H2B-mRFP من باتنز Physcomitrium باستخدام CS لمدة 4 أيام. تم تصنيف النوى ب H2B-mRFP (أخضر). قلل علاج CS من التألق الذاتي للكلوروفيل (أرجواني). وقد لوحظت إشارة H2B-mRFP في المنطقة القمية بوضوح لكل من الصور المدمجة ل H2B-mRFP والتألق الذاتي أو المجال الساطع. (دال، هاء) تم علاج وصمة عار UBQ10pro::H2B-mClover من نيكوتيانا بينثاميانا في CSA لمدة شهر واحد. تم إنشاء إسقاط الكثافة القصوى (D) والإسقاط الأقصى للكثافة (E) المشفر بالعمق من 88 صورة مكدسة z على فترات زمنية تبلغ 5 ميكرومتر. قضبان المقياس: 100 ميكرومتر. تم التقاط الصور باستخدام مجهر المجال العريض (A ، B) ، وثنائي البؤرة (C) ، والإثارة ثنائية الفوتون (D ، E). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
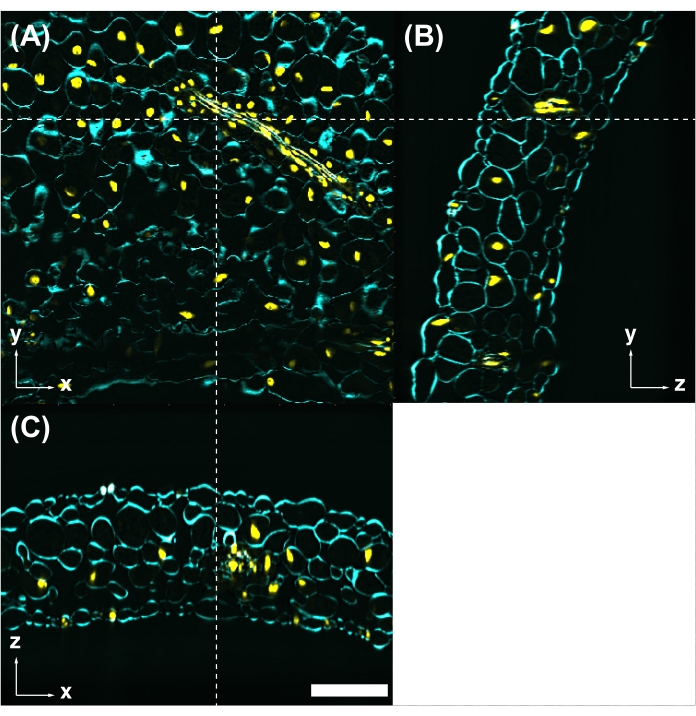
الشكل 5: صبغة الفلورسنت متوافقة مع CS. (أ) الأوراق المعالجة ب CS التي لوحظت بواسطة مجهر الإثارة ثنائي الفوتون مع إثارة 950 نانومتر. جدار الخلية ملطخ بأبيض كالكوفلور (سماوي). يتم تصنيف النوى مع UBQ10pro::H2B-mClover (أصفر). الصور yz (B) و xz (C) هي مقاطع عرضية في الموضع المشار إليه بالخطوط البيضاء المتقطعة في (A). شريط المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: شفافية ديوكسيكولات الصوديوم. (أ) ألوان ديوكسيكولات الصوديوم المختلفة بنسبة 15٪ (مدرجة في جدول المواد). (ب) طيف التألق لكل ديوكسيكولات الصوديوم بنسبة 15٪ مع إثارة 380 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تتكون هذه الطريقة من التثبيت والغسيل والتنظيف. التثبيت هو خطوة حاسمة في هذا البروتوكول. إذا لم يتم ملاحظة البروتين الفلوري بعد تثبيت PFA ، فلن يتم ملاحظته بعد العلاج بمحلول المقاصة. يعد تغلغل محلول PFA في الأنسجة أمرا بالغ الأهمية ، ولكن لا ينصح بالعلاج بالتفريغ العالي لأنه يمكن أن يدمر بنية الخلية. يجب تحسين ظروف الفراغ وفترات التثبيت لكل نوع من الأنسجة والأنواع. يوصى بفحص البروتينات الفلورية حتى بعد التثبيت. على الرغم من أن العينات كانت ثابتة عادة لمدة 30-60 دقيقة في درجة حرارة الغرفة ، إلا أنه يمكن تثبيتها عند 4 درجات مئوية لفترة أطول (بين عشية وضحاها أو أكثر).
كما هو موضح في الشكل 6A ، كان لبعض ديوكسيكولات الصوديوم لون أصفر شاحب عند إذابتها. أظهرت محاليل ديوكسيكولات الصوديوم هذه تألقا ذاتيا قويا في منطقة 400-600 نانومتر بعد الإثارة عند 380 نانومتر (الشكل 6B). يمنع هذا التألق الذاتي التطهير البصري والتصوير الفلوري. يجب على المستخدمين التحقق من لون محلول ديوكسيكولات الصوديوم لأن جودة الكاشف قد تختلف بسبب النقاء أو الاختلاف من الكثير إلى الكثير أو لأسباب أخرى.
تحتوي محاليل المقاصة المستخدمة هنا على تركيزات عالية من ديوكسيكولات الصوديوم ، والتي يمكن أن تدمر بنية الغشاء. لوحظت علامة غشاء البلازما (RPS5Apro::tdTomato-LTI6b) حتى بعد علاج CS7. ومع ذلك ، قد يكون من الأفضل تقليل تركيز ديوكسيكولات الصوديوم ، اعتمادا على البنية والأنسجة ذات الاهتمام. في الواقع ، تم الحصول على صور ذات وضوح محسن لمدقات أرابيدوبسيس مع CS المعدل ، حيث يتم تقليل تركيز ديوكسيكولات الصوديوم بمقدار النصف. ومع ذلك ، فإن انخفاض تركيزات ديوكسيكولات الصوديوم يتطلب أوقات علاج طويلة (على سبيل المثال ، 1 شهر لمدقات أرابيدوبسيس ).
يمكن أن يقلل CS من التألق الذاتي الأحمر (>610 نانومتر) لإزالة الكلوروفيل في العينات المعالجة. ومع ذلك، ظل التألق الذاتي لنطاق 500-600 نانومتر (الأصفر إلى البرتقالي) حتى في العينات المعالجة ب CS7. ويعتقد أن هذا التألق الذاتي مشتق من جدار الخلية والمكونات الخلوية الأخرى، مثل اللجنين12،13. لذلك ، من الصعب جعل الأنسجة ، مثل السيقان ذات الجدران الثانوية المتقدمة ، شفافة تماما عن طريق علاج CS.
تم تطوير العديد من كواشف المقاصة إلى جانب تلك المستخدمة هنا لمراقبة البروتينات الفلورية في النباتات باستخدام المجهر الفلوري 14،15،16،17. بالمقارنة مع هذه الطرق ، يزيل CS و CSA الكلوروفيل ويقللان من التألق الذاتي ، مما يجعل الأنسجة النباتية أكثر شفافية. في الآونة الأخيرة ، طور Sakamoto et al. طريقة محسنة ، iTOMEI ، للتثبيت ، وإزالة المنظفات ، والتركيب لضبط عدم تطابق معامل الانكسار18. في شتلات أرابيدوبسيس ، قام iTOMEI بتطهير الأنسجة في غضون 26 ساعة.
ينطبق CS على مجموعة واسعة من الأنواع النباتية ، مثل Arabidopsis thaliana و Physcomitrium patens7 و Chrysanthemum morifolium و Cucumis sativus و Nicotiana benthamiana و Nicotiana tabacum و Torenia fournieri8 و Allium ochotense19 و Astragalus sinicus20 و avocado21 و barley22 و Brassica rapa23 و Callitriche 24 ، الأوكالبتوس25 ، الذرة 26 ، مارشانتيا متعددة الأشكال 27 ، مونوفيلايا غلابرا 28 ، أوروبانش الصغرى 29 ، البطونية 30 ، الأرز 31 ، سولانوم ليكوبيرسيكوم 32 ، فول الصويا 33 ، الفراولة 34 ، القمح 35 ، وولفييلا هيالينا 36. بالنسبة للأنسجة الأكثر سمكا ، يمكن ل CS أيضا جعل أقسام الاهتزاز شفافة37,38. سمحت هذه الطريقة بإجراء دراسات على البنية الخلوية وأنماط التعبير الجيني في النباتات37,38. علاوة على ذلك ، لوحظت أيضا عدوى الديدان الخيطية20,39 ، والالتهابات الفطرية ، والتكافل 19,40,41 في أعماق الأنسجة المعالجة ب CS. وبالتالي ، فإن هذه الطريقة مفيدة لتصوير الأنسجة الكاملة من المقاييس الدقيقة إلى الكلية ويمكن أن تساعد في اكتشاف تفاعلات جديدة بين مختلف الخلايا والأنسجة والأعضاء والكائنات الحية.
Disclosures
يتم تسويق ClearSee (شركة فوجي فيلم واكو للكيماويات النقية ، اليابان). جامعة ناغويا حاصلة على براءة اختراع (JP6601842) على كاشف المقاصة ClearSee. د. كوريهارا هو مخترع براءات الاختراع. ولا يعلن صاحبا البلاغ عن أي مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل الجمعية اليابانية لتعزيز العلوم (منحة في المعونة للبحث العلمي في المجالات المبتكرة (JP16H06464 ، JP16H06280 إلى T.H.) ، منحة في المعونة للبحث العلمي (B ، JP17H03697 إلى D.K.) ، منحة في المعونة للبحوث الاستكشافية الصعبة (JP18K19331 إلى D.K.) ، منحة في المعونة للبحث العلمي في المجالات المبتكرة (JP20H05358 ل D.K.)) والوكالة اليابانية للعلوم والتكنولوجيا (برنامج PRESTO (JPMJPR15QC إلى Y.M.، JPMJPR18K4 إلى D.K.)). يشكر المؤلفون مركز التصوير الحي في معهد الجزيئات الحيوية التحويلية (WPI-ITbM) بجامعة ناغويا لدعم الدراسات المجهرية والتحرير (www.editage.com) لتحرير اللغة الإنجليزية.
Materials
| Name | Company | Catalog Number | Comments |
| Calcofluor White | Sigma-Aldrich | F3543 | Fluorescent Brightener 28; 100 mg/mL in H2O |
| ClearSee | 10% (w/v) xylitol, 15% (w/v) sodium deoxycholate, 25% (w/v) urea | ||
| Cover glass (18×18 No.1) | MATSUNAMI | C018181 | |
| Cover glass (24×24 No.1) | MATSUNAMI | C024241 | |
| Cover glass (25×60 No.1) | MATSUNAMI | C025601 | |
| Desiccator | AS One | 1-5801-11 | |
| Hoechst 33342 | DOJINDO | 346-07951 | 1 mg/mL in H2O |
| Needle | TERUMO | NN-2238S | |
| Parafilm | Bemis | PM-996 | |
| Paraformaldehyde | Nacalai Tesque | 26126-25 | |
| Phosphate buffered saline, pH 7.4 | |||
| Silicone rubber sheet | AS One | 6-9085-12 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | Figure 6_1; Lot PSGYK-QB |
| Sodium deoxycholate | Kishida Chemical | 260-71412 | Figure 6_2; Lot C05543H |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | Figure 6_3; Lot SLBS7362 |
| Sodium deoxycholate | Sigma-Aldrich | 30970 | Figure 6_4; Lot BCBW0612 |
| Sodium deoxycholate | Nacalai Tesque | 10712-96 | Figure 6_5; Lot M5R3403 |
| Sodium deoxycholate | FUJIFILM Wako Pure Chemical | 194-08311 | Figure 6_6; Lot LKL0648 |
| Sodium hydroxide | Nacalai Tesque | 31511-05 | |
| Sodium sulphite | FUJIFILM Wako Pure Chemical | 190-03411 | |
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | BUCHI | V-700 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
References
- Vogelmann, T. C. Light within the plant. Photomorphogenesis in Plants. , 491-535 (1994).
- Krause, G. H., Weis, E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology. 42 (1), 313-349 (1991).
- Pourcel, L., Routaboul, J., Cheynier, V., Lepiniec, L., Debeaujon, I. Flavonoid oxidation in plants: from biochemical properties to physiological functions. Trends in Plant Science. 12 (1), 29-36 (2007).
- Lersten, N. R. An annotated bibliography of botanical clearing methods. Iowa State Journal of Science. 41 (4), 481-486 (1967).
- Villani, T. S., Koroch, A. R., Simon, J. E. An improved clearing and mounting solution to replace chloral hydrate in microscopic applications. Applications in Plant Sciences. 1 (5), 1300016(2013).
- Becker, K., Jährling, N., Saghafi, S., Weiler, R., Dodt, H. -U. Chemical clearing and dehydration of GFP expressing mouse brains. PLoS ONE. 7 (3), 33916(2012).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: a rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Tofanelli, R., Vijayan, A., Scholz, S., Schneitz, K. Protocol for rapid clearing and staining of fixed Arabidopsis ovules for improved imaging by confocal laser scanning microscopy. Plant Methods. 15 (1), 120(2019).
- Vijayan, A., et al. A digital 3D reference atlas reveals cellular growth patterns shaping the Arabidopsis ovule. eLife. 10, 1-38 (2021).
- Müller, S. M., Galliardt, H., Schneider, J., George Barisas, B., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 1-20 (2013).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252, 1231-1240 (2015).
- Littlejohn, G. R., Gouveia, J. D., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytologist. 186 (4), 1018-1025 (2010).
- Warner, C. A., et al. An optical clearing technique for plant tissues allowing deep imaging and compatible with fluorescence microscopy. Plant Physiology. 166 (4), 1684-1687 (2014).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLOS ONE. 11 (8), 0161107(2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Research Square. , (2021).
- Tanaka, E., Ono, Y. Whole-leaf fluorescence imaging to visualize in planta fungal structures of Victory onion leaf rust fungus, Uromyces japonicus, and its taxonomic evaluation. Mycoscience. 59 (2), 137-146 (2018).
- Ohtsu, M., et al. Spatiotemporal deep imaging of syncytium induced by the soybean cyst nematode Heterodera glycines. Protoplasma. 254, 2107-2115 (2017).
- Duman, Z., et al. Short de-etiolation increases the rooting of VC801 Avocado rootstock. Plants. 9 (11), 1481(2020).
- Ho, W. W. H., et al. Integrative multi-omics analyses of barley rootzones under salinity stress reveal two distinctive salt tolerance mechanisms. Plant Communications. 1 (3), 100031(2020).
- Arsovski, A. A., et al. BrphyB is critical for rapid recovery to darkness in mature Brassica rapa leaves. bioRxiv. , (2020).
- Doll, Y., Koga, H., Tsukaya, H. The diversity of stomatal development regulation in Callitriche is related to the intrageneric diversity in lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 118 (14), (2021).
- Eliyahu, A., et al. Vegetative propagation of elite Eucalyptus clones as food source for honeybees (Apis mellifera); adventitious roots versus callus formation. Israel Journal of Plant Sciences. 67 (1-2), 83-97 (2020).
- Kelliher, T., et al. MATRILINEAL, a sperm-specific phospholipase, triggers maize haploid induction. Nature. 542, 105-109 (2017).
- Aki, S. S., et al. Cytokinin signaling is essential for organ formation in Marchantia polymorpha. Plant and Cell Physiology. 60 (8), 1842-1854 (2019).
- Kinoshita, A., Koga, H., Tsukaya, H. Expression profiles of ANGUSTIFOLIA3 and SHOOT MERISTEMLESS, key genes for meristematic activity in a one-leaf plant Monophyllaea glabra, revealed by whole-mount in situ hybridization. Frontiers in Plant Science. 11, 1-11 (2020).
- Okazawa, A., et al. Localization of planteose hydrolysis during seed germination of Orobanche minor. bioRxiv. , 448768(2021).
- Chen, M., et al. VAPYRIN attenuates defence by repressing PR gene induction and localized lignin accumulation during arbuscular mycorrhizal symbiosis of Petunia hybrida. New Phytologist. 229 (6), 3481-3496 (2021).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11, 23(2018).
- Alaguero-Cordovilla, A., et al. An auxin-mediated regulatory framework for wound-induced adventitious root formation in tomato shoot explants. Plant, Cell & Environment. 44 (5), 1642-1662 (2021).
- Okuda, A., Matsusaki, M., Masuda, T., Urade, R. Identification and characterization of GmPDIL7, a soybean ER membrane-bound protein disulfide isomerase family protein. The FEBS Journal. 284 (3), 414-428 (2017).
- Kim, D. -R., et al. A mutualistic interaction between Streptomyces bacteria, strawberry plants and pollinating bees. Nature Communications. 10 (1), 4802(2019).
- Wu, J., Mock, H. -P., Giehl, R. F. H., Pitann, B., Mühling, K. H. Silicon decreases cadmium concentrations by modulating root endodermal suberin development in wheat plants. Journal of Hazardous Materials. 364, 581-590 (2019).
- Isoda, M., Oyama, T. Use of a duckweed species, Wolffiella hyalina, for whole-plant observation of physiological behavior at the single-cell level. Plant Biotechnology. 35 (4), 387-391 (2018).
- Ben-Targem, M., Ripper, D., Bayer, M., Ragni, L. Auxin and gibberellin signaling cross-talk promotes hypocotyl xylem expansion and cambium homeostasis. Journal of Experimental Botany. 72 (10), 3647-3660 (2021).
- Shwartz, I., et al. The VIL gene CRAWLING ELEPHANT controls maturation and differentiation in tomato via polycomb silencing. bioRxiv. , (2021).
- Levin, K. A., Tucker, M. R., Strock, C. F., Lynch, J. P., Mather, D. E. Three-dimensional imaging reveals that positions of cyst nematode feeding sites relative to xylem vessels differ between susceptible and resistant wheat. Plant Cell Reports. 40 (2), 393-403 (2021).
- Nouri, E., et al. Phosphate suppression of arbuscular mycorrhizal symbiosis involves gibberellic acid signaling. Plant and Cell Physiology. 62 (6), 959-970 (2021).
- Evangelisti, E., et al. Artificial intelligence enables the identification and quantification of arbuscular mycorrhizal fungi in plant roots. bioRxiv. , 434067(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved