Method Article
Nettoyage optique des tissus végétaux pour l’imagerie par fluorescence
Dans cet article
Résumé
Ici, une méthode est décrite pour rendre les tissus végétaux transparents tout en maintenant la stabilité des protéines fluorescentes. Cette technique facilite l’imagerie en profondeur des tissus végétaux nettoyés sans sectionnement physique.
Résumé
Il est difficile d’observer directement la structure interne de spécimens de plantes multicouches et opaques, sans dissection, au microscope. De plus, l’autofluorescence attribuée à la chlorophylle entrave l’observation des protéines fluorescentes chez les plantes. Pendant longtemps, divers réactifs de nettoyage ont été utilisés pour rendre les plantes transparentes. Cependant, les réactifs de nettoyage conventionnels diminuent les signaux fluorescents; par conséquent, il n’a pas été possible d’observer les structures cellulaires et intracellulaires avec des protéines fluorescentes. Des réactifs ont été développés qui peuvent dégager les tissus végétaux en éliminant la chlorophylle tout en maintenant la stabilité des protéines fluorescentes. Un protocole détaillé est fourni ici pour le nettoyage optique des tissus végétaux à l’aide de réactifs de nettoyage, ClearSee (CS) ou ClearSeeAlpha (CSA). La préparation des tissus végétaux nettoyés implique trois étapes: la fixation, le lavage et le nettoyage. La fixation est une étape cruciale dans le maintien des structures cellulaires et de la stabilité intracellulaire des protéines fluorescentes. Le temps d’incubation pour le nettoyage dépend du type de tissu et de l’espèce. Chez Arabidopsis thaliana, le temps nécessaire pour le défrichement avec CS était de 4 jours pour les feuilles et les racines, de 7 jours pour les semis et de 1 mois pour les pistils. CS a également nécessité un temps relativement court de 4 jours pour rendre transparentes les feuilles gamétophytes de Physcomitrium patens . En revanche, les pistils dans le tabac et la torénie ont produit un pigment brun dû à l’oxydation pendant le traitement CS. L’ASC a réduit le pigment brun en empêchant l’oxydation et a pu rendre le tabac et la torénie pistils transparents, bien que cela ait pris un temps relativement long (1 ou 2 mois). CS et CSA étaient également compatibles avec la coloration à l’aide de colorants chimiques, tels que DAPI (4',6-diamidino-2-phénylindole) et Hoechst 33342 pour l’ADN et Calcofluor White, SR2200, et Direct Red 23 pour la paroi cellulaire. Cette méthode peut être utile pour l’imagerie de plantes entières afin de révéler une morphologie intacte, des processus de développement, des interactions plantes-microbes et des infections à nématodes.
Introduction
La visualisation des structures cellulaires et la localisation des protéines dans les organismes vivants sont importantes pour clarifier leurs fonctions in vivo. Cependant, comme le corps vivant n’est pas transparent, il est difficile d’observer la structure interne des organismes vivants sans dissection. En particulier, dans le cas des tissus végétaux, qui sont multicouches avec des cellules de formes différentes, l’inadéquation de l’indice causée par leur structure et la présence de pigments absorbant la lumière est problématique. Par exemple, les feuilles des plantes ont une structure complexe qui leur permet d’utiliser efficacement la lumière qui pénètre dans leur corps pour la photosynthèse1, tandis que la structure provoque également une inadéquation de l’indice de réfraction, ce qui les rend difficiles à observer. Cependant, les feuilles ont de nombreux pigments absorbant la lumière, tels que la chlorophylle, qui émettent une forte fluorescence rouge et les pigments brunâtres sont produits par oxydation2,3. Ces pigments entravent également les observations de microscopie à fluorescence à montage entier chez les plantes. Par conséquent, pour observer la structure interne des plantes, la décoloration et la fixation par l’alcool et l’élimination à l’aide d’hydrate de chloral sont utilisées depuis longtemps pour éliminer l’inadéquation de l’indice de réfraction et l’autofluorescence4,5. Ces méthodes conventionnelles sont adoptées depuis de nombreuses années, mais elles ont l’inconvénient d’éliminer en même temps la fluorescence des protéines fluorescentes6,7. Ceci est problématique car les protéines fluorescentes sont devenues indispensables dans l’imagerie fluorescente actuelle.
Par conséquent, ClearSee (CS) et ClearSeeAlpha (CSA) ont été développés en tant que réactifs de nettoyage optique pour les tissus végétaux. Les deux réactifs réduisent l’autofluorescence de la chlorophylle tout en maintenant la stabilité des protéines fluorescentes7,8. L’ASC est particulièrement utile lorsque des pigments bruns sont produits en raison de l’oxydation des tissus. En utilisant ces réactifs clairsemés, il est possible d’observer la structure cellulaire et la localisation des protéines à l’intérieur du corps de la plante sans sectionnement physique.
Protocole
1. Préparation des solutions de compensation
- Pour préparer la solution de CS, dissoudre 10 % (p/v) de xylitol, 15 % (p/v) de désoxycholate de sodium et 25 % (p/v) d’urée dans de l’eau distillée sur un agitateur magnétique.
REMARQUE: La poudre de désoxycholate de sodium doit être pesée dans une chambre de tirage car elle flotte facilement dans l’air. CS peut être conservé à température ambiante dans l’obscurité pendant plus de 1 an. - Pour préparer la solution d’ASC, ajouter du sulfite de sodium (concentration finale de 50 mM) à la solution de CS obtenue ci-dessus.
REMARQUE: Ajoutez du sulfite de sodium à la solution CS juste avant utilisation car l’agent réducteur est facilement désactivé.
2. Préparation de la solution fixatrice
- Transférer 40 mL d’eau stérilisée dans un tube conique et ajouter 2 g de paraformaldéhyde. Ajouter 200 μL de 2 N NaOH pour augmenter le pH de la solution. Après avoir fermé et scellé le tube avec un parafilm, incuber à 60 °C avec des inversions occasionnelles jusqu’à ce que tout soit dissous.
- Après avoir refroidi la solution à température ambiante, ajouter 5 mL de solution saline tamponnée au phosphate (PBS) pour ajuster le pH à 7,4. Ajouter de l’eau stérilisée pour porter le volume à 50 mL.
REMARQUE: Une solution fixative fraîchement préparée est préférable. La solution peut également être conservée à -30 °C pendant plusieurs mois.
3. Fixation des échantillons
- Immerger les échantillons de plantes dans la solution fixatrice dans un microtube (Figure 1A), en veillant à ce que le volume de la solution fixatrice soit plus de cinq fois supérieur au volume de l’échantillon.
- Scellez le microtube avec un parafilm et faites des trous à l’aide d’une aiguille. Ne laissez pas le tube ouvert en raison d’un risque de déversement d’échantillon pendant la décompression sous vide.
- Placez le microtube dans un dessiccateur et ajustez lentement le degré de vide (~690 mmHg) de sorte que des bulles apparaissent progressivement à partir des échantillons (Figure 1B-C). Éteignez la pompe à vide après avoir évacué le dessiccateur. Laissez le microtube intact pendant 30 minutes à température ambiante.
- Éventilez soigneusement le dessiccateur pour éviter de perturber les échantillons. Rallumez la pompe à vide et éteignez-la après avoir évacué le dessiccateur. Laissez le microtube intact pendant 30 minutes à température ambiante.
REMARQUE: Des précautions doivent être prises pour éviter d’endommager les échantillons lors de la ventilation du dessiccateur. La pénétration de la solution fixatrice dans les échantillons est renforcée par deux traitements sous vide. Un traitement sous vide supplémentaire aide à pénétrer la solution fixatrice dans des échantillons plus épais. - Ouvrez soigneusement le dessiccateur sans heurter la solution fixatrice dans le microtube. À l’aide d’une micropipette, retirez la solution fixative et ajoutez 1x PBS. Après avoir stocké pendant 1 min, remplacez l’ancien PBS par un nouveau PBS 1x (Figure 1D).
4. Compensation
- Après avoir retiré PBS, ajoutez cinq fois le volume d’échantillon de la solution de nettoyage.
- Scellez le microtube avec un parafilm et faites des trous à l’aide d’une aiguille. Placez les échantillons dans le dessiccateur, évacuez comme à l’étape 3.3 et éteignez la pompe à vide. Laissez le microtube intact pendant 60 min à température ambiante.
- Ouvrez doucement le dessiccateur. Fermez le microtube avec un parafilm et conservez-le à température ambiante dans l’obscurité pour éviter le photoblanchiment des protéines fluorescentes. Inverser le microtube tous les 1-2 jours pour accélérer le processus de nettoyage.
- Lorsque la solution de nettoyage devient verte, remplacez-la par de nouvelles solutions de nettoyage jusqu’à ce que la solution reste incolore (Figure 1E-H).

Figure 1: Procédure de traitement du CS. (A) Plantule d’Arabidopsis en solution de PFA (Paraformaldéhyde) à 4 %. (B) L’échantillon est placé dans un dessiccateur. (C) Le semis est fixé sous vide. D) Le semis est trempé dans la solution de PFA après traitement sous vide. (E) Résultat du semis traité en solution de nettoyage de 3 jours. Notez la couleur verte de la solution de nettoyage. (F) La solution de nettoyage est remplacée 3 jours après le traitement. G) Résultat du semis traité en solution de nettoyage pendant 5 jours. (H) La solution de nettoyage est remplacée 5 jours après le traitement. Barres d’échelle: 1 cm (A, C-H) et 5 cm (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Coloration chimique par colorant
- Au microtube, ajouter Hoechst 33342 (concentration finale de 10 μg/mL) pour la coloration nucléaire ou Calcofluor White (concentration finale de 1 mg/mL) pour la coloration de la paroi cellulaire et attendre 1 h. Après avoir retiré la solution de colorant, laver l’échantillon avec une solution éclaircissante fraîche pendant 1 h.
REMARQUE: La coloration et le lavage pendant la nuit peuvent améliorer la pénétration des colorants fluorescents dans les tissus et réduire la fluorescence de fond. Divers colorants fluorescents sont compatibles avec la solution CS tels que Basic Fuchsin9 (lignine), Auramine O9 (lignine, subérine et cutine), Nile Red9 (subérine), Direct Yellow 969, Direct Red 239 et SR220010,11 (parois cellulaires).
6. Observation
- Coupez une feuille de caoutchouc de silicone avec une lame de rasoir pour préparer un cadre pour l’entretoise (Figure 2A).
REMARQUE: Ajustez l’épaisseur de la feuille de caoutchouc de silicium en fonction de l’épaisseur de l’échantillon. Comme les échantillons traités avec une solution de nettoyage sont mous, ils seront endommagés s’ils sont recouverts directement avec le verre de couverture. - Placez le cadre en silicone sur le verre du couvercle (p. ex., 25 x 60 mm) (figure 2B). Placez les échantillons traités dans le cadre et ajoutez environ 100 μL de solution de nettoyage pour éliminer les bulles dans le cadre. Couvrir avec un autre verre de couverture (18 x 18 mm ou 24 x 24 mm) pour éviter l’évaporation de la solution de nettoyage (Figure 2C).
- Observez les échantillons au microscope fluorescent. Après observation, remettre les échantillons à la solution de nettoyage prélevée dans un microtube et les conserver à température ambiante dans l’obscurité.

Figure 2: Préparation de l’échantillon pour l’observation microscopique. (A) Couper une feuille de silicone de 0,2 mm d’épaisseur dans un cadre. (B) Placez le cadre en feuille de silicone sur le verre de couverture. (C) Placer l’échantillon traité avec une solution de déblaiement (marquée par une bordure pointillée) dans le cadre et le recouvrir d’un verre de couverture. Barres d’échelle: 5 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Résultats
CS peut défricher les feuilles de diverses espèces (Figure 3A-H). Il est difficile pour la solution CS de pénétrer dans une feuille de riz car la surface de la feuille est recouverte de cire cuticulaire dans cette plante. Cependant, après avoir extrait la cire cuticulaire en trempant dans du chloroforme pendant 10 s, CS a pu dégager les feuilles de riz (Figure 3H). Le CS n’a toutefois pas pu pénétrer dans les feuilles de Chamaecyparis obtusa qui sont moins perméables au CS (Figure 3I,J). Dans les feuilles de chrysanthème, une pigmentation brune induite par l’oxydation des polyphénols a été observée dans les feuilles traitées au CS (Figure 3K,L). De même, le tabac et la torénie pistils ont montré une pigmentation brune pendant le traitement CS (Figure 3M,O). Comme le composant sulfite de sodium dans l’ASC empêche l’oxydation des polyphénols en raison de l’effet réducteur, l’ASC pourrait éliminer le tabac et la torénie pistils sans aucune pigmentation brune (figure 3N,P).
Les figures 4B montrent que le traitement CS a réduit la couleur vert pâle de la feuille d’Arabidopsis H2B-mClover (champ lumineux) et a augmenté l’intensité de fluorescence de H2B-mClover par rapport à l’incubation PBS (Figure 4A). En plus des plantes à fleurs, le CS s’applique également aux plantes à mousse (figure 4C); après 4 jours de traitement par CS, la fluorescence de H2B-mRFP a été clairement détectée pour l’ensemble du gamétophore avec une autofluorescence réduite de la chlorophylle. Les figures 4D,E montrent des images de reconstruction 3D du pistil H2B-mClover dans Nicotiana benthamiana nettoyé à l’aide de CSA. La profondeur de l’échantillon était de 440 μm. Comme le montre l’image de projection de l’intensité maximale codée en profondeur, l’ASC permet une imagerie en profondeur de tissus difficiles, tels que les pistils de tabac.
CS et CSA étaient également compatibles avec la coloration par colorant fluorescent. La figure 5 montre que le CS pourrait être utilisé simultanément pour observer la protéine fluorescente (H2B-mClover) et la coloration des colorants fluorescents organiques (Calcofluor White). Après la reconstruction 3D à partir des images z-stack, n’importe quelle section pouvait être observée.

Figure 3 : Clairance optique des feuilles et des pistils à l’aide de solutions de défrichage. (A-L) Les feuilles fixes de diverses espèces ont été incubées en PBS (A,C,E,G,I,K) ou CS (B,D,F,H,J,L) pendant 8 jours et CS (M,O) ou CSA (N,P) pendant 2 jours. (A,B,O,P) Torenia fournieri, (C,D) Nicotiana tabacum, (E,F) Cucumis sativus, (G,H) Oryza sativa, (I,J) Chamaecyparis obtusa, (K,L) Chrysanthemum morifolium, (M,N) Nicotiana benthamiana. Barres d’échelle: 1 cm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 4 : Imagerie par fluorescence de tissus traités avec des solutions claires. (A,B) UBQ10pro::H2B-mClover les feuilles d’Arabidopsis thaliana ont été traitées avec du PBS (A) ou du CS (B) pendant 3 jours. (C) Les gamétophores feuillus H2B-mRFP de Physcomitrium patens ont été traités par CS pendant 4 jours. Les noyaux ont été marqués avec H2B-mRFP (vert). Le traitement CS a réduit l’autofluorescence de la chlorophylle (magenta). Le signal H2B-mRFP dans la région apicale a été clairement observé pour les images fusionnées de H2B-mRFP et l’autofluorescence ou le champ lumineux. (D,E) La stigmatisation UBQ10pro::H2B-mClover de Nicotiana benthamiana a été traitée en ASC pendant 1 mois. La projection d’intensité maximale (D) et la projection d’intensité maximale (E) codée en profondeur ont été générées à partir d’images de pile z à des intervalles de 5 μm. Barres d’échelle: 100 μm. Les images ont été prises en utilisant la microscopie à grand champ (A, B), confocale (C) et à excitation à deux photons (D, E). Veuillez cliquer ici pour voir une version agrandie de cette figure.
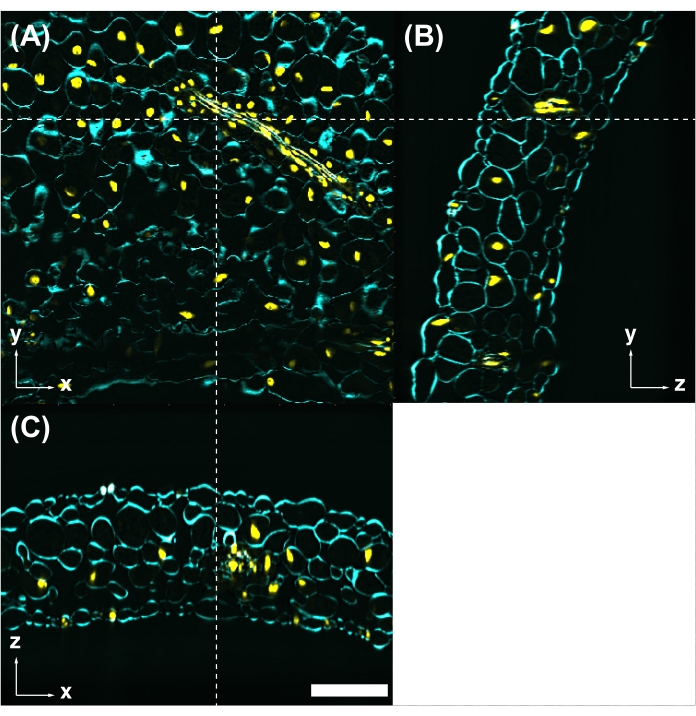
Figure 5 : La coloration par colorant fluorescent est compatible avec le CS. (A) Feuilles traitées CS observées par microscopie à excitation à deux photons avec une excitation de 950 nm. La paroi cellulaire est colorée avec du blanc Calcofluor (cyan). Les noyaux sont marqués avec UBQ10pro::H2B-mClover (jaune). Les images yz (B) et xz (C) sont des coupes transversales à la position indiquée par les lignes pointillées blanches en (A). Barre d’échelle : 100 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.

Figure 6 : Transparence du désoxycholate de sodium. (A) Couleurs de divers désoxycholates de sodium à 15 % (énumérés dans le Tableau des matériaux). (B) Spectre de fluorescence de chaque désoxycholate de sodium à 15 % avec excitation de 380 nm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette méthode consiste en la fixation, le lavage et le nettoyage. La fixation est une étape critique de ce protocole. Si la protéine fluorescente n’est pas observée après la fixation du PFA, elle ne sera pas observée après le traitement avec une solution éclaircissante. La pénétration de la solution de PFA dans les tissus est critique, mais le traitement sous vide poussé n’est pas recommandé car il peut détruire la structure cellulaire. Les conditions de vide et les périodes de fixation doivent être optimisées pour chaque type de tissu et d’espèce. Il est recommandé de vérifier les protéines fluorescentes même après la fixation. Bien que les échantillons aient généralement été fixés pendant 30 à 60 minutes à température ambiante, ils peuvent être fixés à 4 ° C pendant une période plus longue (pendant la nuit ou plus).
Comme le montre la figure 6A, certains désoxycholates de sodium avaient une couleur jaune pâle lorsqu’ils étaient dissous. Ces solutions de désoxycholate de sodium ont montré une forte autofluorescence dans la région 400-600 nm après excitation à 380 nm (Figure 6B). Cette autofluorescence empêche le nettoyage optique et l’imagerie par fluorescence. Les utilisateurs doivent vérifier la couleur de la solution de désoxycholate de sodium, car la qualité du réactif peut différer en raison de la pureté, de la variation d’un lot à l’autre ou d’autres raisons.
Les solutions de nettoyage utilisées ici ont des concentrations élevées de désoxycholate de sodium, ce qui pourrait détruire la structure de la membrane. Le marqueur de la membrane plasmique (RPS5Apro::tdTomato-LTI6b) a été observé même après un traitement par CS7. Cependant, il pourrait être préférable de réduire la concentration de désoxycholate de sodium, en fonction de la structure et du tissu d’intérêt. En effet, des images avec une clarté améliorée ont été obtenues pour Arabidopsis pistils avec CS modifié, dans lequel la concentration de désoxycholate de sodium est réduite de moitié; cependant, des concentrations réduites de désoxycholate de sodium ont nécessité des temps de traitement prolongés (p. ex., 1 mois pour Arabidopsis pistils).
Le CS peut réduire l’autofluorescence rouge (>610 nm) pour éliminer la chlorophylle dans les échantillons traités. Cependant, l’autofluorescence de 500 à 600 nm (jaune à orange) est restée même dans les échantillons traités au CS7. On pense que cette autofluorescence est dérivée de la paroi cellulaire et d’autres composants cellulaires, tels que la lignine12,13. Par conséquent, il est difficile de rendre les tissus, tels que les tiges avec des parois secondaires développées, complètement transparents par traitement CS.
Plusieurs réactifs de nettoyage en plus de ceux utilisés ici ont été développés pour observer les protéines fluorescentes dans les plantes en utilisant la microscopie fluorescente14,15,16,17. Par rapport à ces méthodes, le CS et le CSA éliminent la chlorophylle et réduisent l’autofluorescence, ce qui rend les tissus végétaux plus transparents. Récemment, Sakamoto et al. ont développé une méthode améliorée, iTOMEI, pour la fixation, le nettoyage du détergent et le montage afin d’ajuster l’inadéquation de l’indice de réfraction18. Chez les semis d’Arabidopsis, iTOMEI a nettoyé le tissu en 26 h.
CS est applicable à un large éventail d’espèces végétales, telles que Arabidopsis thaliana, Physcomitrium patens7, Chrysanthemum morifolium, Cucumis sativus, Nicotiana benthamiana, Nicotiana tabacum, Torenia fournieri8, Allium ochotense19, Astragalus sinicus20, avocat21, orge22, Brassica rapa23, Callitriche 24, Eucalyptus25, maïs26, Marchantia polymorpha27, Monophyllaea glabra28, Orobanche minor29, pétunia30, riz31, Solanum lycopersicum32, soja33, fraise34, blé35 et Wolffiella hyalina36. Pour les tissus plus épais, CS peut également rendre les sections vibratomes transparentes37,38. Cette méthode a permis d’étudier la structure cellulaire et les modèles d’expression des gènes chez les plantes37,38. De plus, des infections à nématodes20,39, des infections fongiques et une symbiose19,40,41 ont également été observées profondément à l’intérieur des tissus traités par CS. Ainsi, cette méthode est utile pour l’imagerie des tissus entiers à l’échelle micro à macro et pourrait aider à découvrir de nouvelles interactions entre diverses cellules, tissus, organes et organismes.
Déclarations de divulgation
ClearSee est commercialisé (Fujifilm Wako Pure Chemical Corporation, Japon). L’Université de Nagoya détient un brevet (JP6601842) sur le réactif de compensation ClearSee. D. Kurihara est l’inventeur du brevet. Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Ce travail a été soutenu par la Société japonaise pour la promotion de la science (Subvention pour la recherche scientifique dans des domaines innovants (JP16H06464, JP16H06280 à T.H.), Subvention pour la recherche scientifique (B, JP17H03697 à D.K.), Subvention pour la recherche exploratoire difficile (JP18K19331 à D.K.), Subvention pour la recherche scientifique sur des domaines innovants (JP20H05358 pour D.K.)) et l’Agence japonaise pour la science et la technologie (programme PRESTO (JPMJPR15QC à Y.M., JPMJPR18K4 à D.K.)). Les auteurs remercient le Live Imaging Center de l’Institute of Transformative Bio-Molecules (WPI-ITbM) de l’Université de Nagoya d’avoir soutenu les études microscopiques et l’édition (www.editage.com) pour l’édition en anglais.
matériels
| Name | Company | Catalog Number | Comments |
| Calcofluor White | Sigma-Aldrich | F3543 | Fluorescent Brightener 28; 100 mg/mL in H2O |
| ClearSee | 10% (w/v) xylitol, 15% (w/v) sodium deoxycholate, 25% (w/v) urea | ||
| Cover glass (18×18 No.1) | MATSUNAMI | C018181 | |
| Cover glass (24×24 No.1) | MATSUNAMI | C024241 | |
| Cover glass (25×60 No.1) | MATSUNAMI | C025601 | |
| Desiccator | AS One | 1-5801-11 | |
| Hoechst 33342 | DOJINDO | 346-07951 | 1 mg/mL in H2O |
| Needle | TERUMO | NN-2238S | |
| Parafilm | Bemis | PM-996 | |
| Paraformaldehyde | Nacalai Tesque | 26126-25 | |
| Phosphate buffered saline, pH 7.4 | |||
| Silicone rubber sheet | AS One | 6-9085-12 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | Figure 6_1; Lot PSGYK-QB |
| Sodium deoxycholate | Kishida Chemical | 260-71412 | Figure 6_2; Lot C05543H |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | Figure 6_3; Lot SLBS7362 |
| Sodium deoxycholate | Sigma-Aldrich | 30970 | Figure 6_4; Lot BCBW0612 |
| Sodium deoxycholate | Nacalai Tesque | 10712-96 | Figure 6_5; Lot M5R3403 |
| Sodium deoxycholate | FUJIFILM Wako Pure Chemical | 194-08311 | Figure 6_6; Lot LKL0648 |
| Sodium hydroxide | Nacalai Tesque | 31511-05 | |
| Sodium sulphite | FUJIFILM Wako Pure Chemical | 190-03411 | |
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | BUCHI | V-700 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
Références
- Vogelmann, T. C. Light within the plant. Photomorphogenesis in Plants. , 491-535 (1994).
- Krause, G. H., Weis, E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology. 42 (1), 313-349 (1991).
- Pourcel, L., Routaboul, J., Cheynier, V., Lepiniec, L., Debeaujon, I. Flavonoid oxidation in plants: from biochemical properties to physiological functions. Trends in Plant Science. 12 (1), 29-36 (2007).
- Lersten, N. R. An annotated bibliography of botanical clearing methods. Iowa State Journal of Science. 41 (4), 481-486 (1967).
- Villani, T. S., Koroch, A. R., Simon, J. E. An improved clearing and mounting solution to replace chloral hydrate in microscopic applications. Applications in Plant Sciences. 1 (5), 1300016(2013).
- Becker, K., Jährling, N., Saghafi, S., Weiler, R., Dodt, H. -U. Chemical clearing and dehydration of GFP expressing mouse brains. PLoS ONE. 7 (3), 33916(2012).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: a rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Tofanelli, R., Vijayan, A., Scholz, S., Schneitz, K. Protocol for rapid clearing and staining of fixed Arabidopsis ovules for improved imaging by confocal laser scanning microscopy. Plant Methods. 15 (1), 120(2019).
- Vijayan, A., et al. A digital 3D reference atlas reveals cellular growth patterns shaping the Arabidopsis ovule. eLife. 10, 1-38 (2021).
- Müller, S. M., Galliardt, H., Schneider, J., George Barisas, B., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 1-20 (2013).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252, 1231-1240 (2015).
- Littlejohn, G. R., Gouveia, J. D., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytologist. 186 (4), 1018-1025 (2010).
- Warner, C. A., et al. An optical clearing technique for plant tissues allowing deep imaging and compatible with fluorescence microscopy. Plant Physiology. 166 (4), 1684-1687 (2014).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLOS ONE. 11 (8), 0161107(2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Research Square. , (2021).
- Tanaka, E., Ono, Y. Whole-leaf fluorescence imaging to visualize in planta fungal structures of Victory onion leaf rust fungus, Uromyces japonicus, and its taxonomic evaluation. Mycoscience. 59 (2), 137-146 (2018).
- Ohtsu, M., et al. Spatiotemporal deep imaging of syncytium induced by the soybean cyst nematode Heterodera glycines. Protoplasma. 254, 2107-2115 (2017).
- Duman, Z., et al. Short de-etiolation increases the rooting of VC801 Avocado rootstock. Plants. 9 (11), 1481(2020).
- Ho, W. W. H., et al. Integrative multi-omics analyses of barley rootzones under salinity stress reveal two distinctive salt tolerance mechanisms. Plant Communications. 1 (3), 100031(2020).
- Arsovski, A. A., et al. BrphyB is critical for rapid recovery to darkness in mature Brassica rapa leaves. bioRxiv. , (2020).
- Doll, Y., Koga, H., Tsukaya, H. The diversity of stomatal development regulation in Callitriche is related to the intrageneric diversity in lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 118 (14), (2021).
- Eliyahu, A., et al. Vegetative propagation of elite Eucalyptus clones as food source for honeybees (Apis mellifera); adventitious roots versus callus formation. Israel Journal of Plant Sciences. 67 (1-2), 83-97 (2020).
- Kelliher, T., et al. MATRILINEAL, a sperm-specific phospholipase, triggers maize haploid induction. Nature. 542, 105-109 (2017).
- Aki, S. S., et al. Cytokinin signaling is essential for organ formation in Marchantia polymorpha. Plant and Cell Physiology. 60 (8), 1842-1854 (2019).
- Kinoshita, A., Koga, H., Tsukaya, H. Expression profiles of ANGUSTIFOLIA3 and SHOOT MERISTEMLESS, key genes for meristematic activity in a one-leaf plant Monophyllaea glabra, revealed by whole-mount in situ hybridization. Frontiers in Plant Science. 11, 1-11 (2020).
- Okazawa, A., et al. Localization of planteose hydrolysis during seed germination of Orobanche minor. bioRxiv. , 448768(2021).
- Chen, M., et al. VAPYRIN attenuates defence by repressing PR gene induction and localized lignin accumulation during arbuscular mycorrhizal symbiosis of Petunia hybrida. New Phytologist. 229 (6), 3481-3496 (2021).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11, 23(2018).
- Alaguero-Cordovilla, A., et al. An auxin-mediated regulatory framework for wound-induced adventitious root formation in tomato shoot explants. Plant, Cell & Environment. 44 (5), 1642-1662 (2021).
- Okuda, A., Matsusaki, M., Masuda, T., Urade, R. Identification and characterization of GmPDIL7, a soybean ER membrane-bound protein disulfide isomerase family protein. The FEBS Journal. 284 (3), 414-428 (2017).
- Kim, D. -R., et al. A mutualistic interaction between Streptomyces bacteria, strawberry plants and pollinating bees. Nature Communications. 10 (1), 4802(2019).
- Wu, J., Mock, H. -P., Giehl, R. F. H., Pitann, B., Mühling, K. H. Silicon decreases cadmium concentrations by modulating root endodermal suberin development in wheat plants. Journal of Hazardous Materials. 364, 581-590 (2019).
- Isoda, M., Oyama, T. Use of a duckweed species, Wolffiella hyalina, for whole-plant observation of physiological behavior at the single-cell level. Plant Biotechnology. 35 (4), 387-391 (2018).
- Ben-Targem, M., Ripper, D., Bayer, M., Ragni, L. Auxin and gibberellin signaling cross-talk promotes hypocotyl xylem expansion and cambium homeostasis. Journal of Experimental Botany. 72 (10), 3647-3660 (2021).
- Shwartz, I., et al. The VIL gene CRAWLING ELEPHANT controls maturation and differentiation in tomato via polycomb silencing. bioRxiv. , (2021).
- Levin, K. A., Tucker, M. R., Strock, C. F., Lynch, J. P., Mather, D. E. Three-dimensional imaging reveals that positions of cyst nematode feeding sites relative to xylem vessels differ between susceptible and resistant wheat. Plant Cell Reports. 40 (2), 393-403 (2021).
- Nouri, E., et al. Phosphate suppression of arbuscular mycorrhizal symbiosis involves gibberellic acid signaling. Plant and Cell Physiology. 62 (6), 959-970 (2021).
- Evangelisti, E., et al. Artificial intelligence enables the identification and quantification of arbuscular mycorrhizal fungi in plant roots. bioRxiv. , 434067(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon