Method Article
Clearing ottico dei tessuti vegetali per l'imaging a fluorescenza
In questo articolo
Riepilogo
Qui, viene descritto un metodo per rendere trasparenti i tessuti vegetali mantenendo la stabilità delle proteine fluorescenti. Questa tecnica facilita l'imaging profondo dei tessuti vegetali eliminati senza sezionamento fisico.
Abstract
È difficile osservare direttamente la struttura interna di campioni vegetali multistrato e opachi, senza dissezione, al microscopio. Inoltre, l'autofluorescenza attribuita alla clorofilla ostacola l'osservazione delle proteine fluorescenti nelle piante. Per molto tempo, vari reagenti di compensazione sono stati utilizzati per rendere trasparenti le piante. Tuttavia, i reagenti di compensazione convenzionali diminuiscono i segnali fluorescenti; pertanto, non è stato possibile osservare le strutture cellulari e intracellulari con proteine fluorescenti. Sono stati sviluppati reagenti in grado di eliminare i tessuti vegetali rimuovendo la clorofilla mantenendo la stabilità delle proteine fluorescenti. Qui viene fornito un protocollo dettagliato per la pulizia ottica dei tessuti vegetali utilizzando reagenti di compensazione, ClearSee (CS) o ClearSeeAlpha (CSA). La preparazione dei tessuti vegetali eliminati comporta tre passaggi: fissazione, lavaggio e pulizia. La fissazione è un passo cruciale nel mantenimento delle strutture cellulari e della stabilità intracellulare delle proteine fluorescenti. Il tempo di incubazione per la pulizia dipende dal tipo di tessuto e dalla specie. In Arabidopsis thaliana, il tempo necessario per la pulizia con CS era di 4 giorni per foglie e radici, 7 giorni per piantine e 1 mese per pistilli. CS ha anche richiesto un tempo relativamente breve di 4 giorni per rendere trasparenti le foglie gametofite di Physcomitrium patens . Al contrario, i pistilli nel tabacco e nella torenia producevano pigmento marrone a causa dell'ossidazione durante il trattamento con CS. Il CSA ha ridotto il pigmento marrone prevenendo l'ossidazione e potrebbe rendere trasparenti i pistilli di tabacco e torenia, anche se ci è voluto un tempo relativamente lungo (1 o 2 mesi). CS e CSA erano anche compatibili con la colorazione con coloranti chimici, come DAPI (4',6-diamidino-2-fenilindolo) e Hoechst 33342 per DNA e Calcofluor White, SR2200 e Direct Red 23 per la parete cellulare. Questo metodo può essere utile per l'imaging dell'intera pianta per rivelare morfologia intatta, processi di sviluppo, interazioni pianta-microbo e infezioni da nematodi.
Introduzione
La visualizzazione delle strutture cellulari e la localizzazione delle proteine negli organismi viventi è importante per chiarire le loro funzioni in vivo. Tuttavia, poiché il corpo vivente non è trasparente, è difficile osservare la struttura interna degli organismi viventi senza dissezione. Soprattutto, nel caso di tessuti vegetali, che sono multistrato con cellule di forme diverse, la mancata corrispondenza dell'indice causata dalla loro struttura e dalla presenza di pigmenti che assorbono la luce è problematica. Ad esempio, le foglie delle piante hanno una struttura complessa che consente loro di utilizzare in modo efficiente la luce che entra nei loro corpi per la fotosintesi1, mentre la struttura causa anche una mancata corrispondenza dell'indice di rifrazione, rendendole difficili da osservare. Tuttavia, le foglie hanno molti pigmenti che assorbono la luce, come la clorofilla, che emettono una forte fluorescenza rossa e i pigmenti brunastri sono prodotti dall'ossidazione2,3. Questi pigmenti ostacolano anche le osservazioni al microscopio a fluorescenza a montaggio intero nelle piante. Pertanto, per osservare la struttura interna delle piante, la decolorazione e la fissazione mediante alcool e clearing con idrato di cloralio sono state utilizzate per lungo tempo per eliminare la mancata corrispondenza dell'indice di rifrazione e l'autofluorescenza4,5. Questi metodi convenzionali sono stati adottati per molti anni, ma hanno lo svantaggio di eliminare la fluorescenza delle proteine fluorescenti allo stesso tempo6,7. Ciò è problematico poiché le proteine fluorescenti sono diventate indispensabili nell'attuale imaging fluorescente.
Pertanto, ClearSee (CS) e ClearSeeAlpha (CSA) sono stati sviluppati come reagenti di compensazione ottica per tessuti vegetali. Entrambi i reagenti riducono l'autofluorescenza della clorofilla mantenendo la stabilità delle proteine fluorescenti7,8. Il CSA è particolarmente utile quando i pigmenti marroni sono prodotti a causa dell'ossidazione dei tessuti. Utilizzando questi reagenti di compensazione, è possibile osservare la struttura cellulare e la localizzazione delle proteine all'interno del corpo vegetale senza sezionamento fisico.
Protocollo
1. Preparazione di soluzioni di compensazione
- Per preparare la soluzione di CS, sciogliere il 10% (p/v) di xilitolo, il 15% (p/v) di sodio desossicolato e il 25% (p/v) di urea in acqua distillata su un agitatore magnetico.
NOTA: La polvere di desossicolato di sodio deve essere pesata in una camera di tiraggio in quanto galleggia facilmente nell'aria. CS può essere conservato a temperatura ambiente al buio per più di 1 anno. - Per preparare la soluzione di CSA, aggiungere solfito di sodio (concentrazione finale di 50 mM) alla soluzione di CS ottenuta sopra.
NOTA: Aggiungere solfito di sodio alla soluzione CS subito prima dell'uso poiché l'agente riducente si disattiva facilmente.
2. Preparazione della soluzione fissativa
- Trasferire 40 ml di acqua sterilizzata in un tubo conico e aggiungere 2 g di paraformaldeide. Aggiungere 200 μL di 2 N NaOH per aumentare il pH della soluzione. Dopo aver chiuso e sigillato il tubo con parafilm, incubare a 60 °C con occasionali inversioni fino a quando tutto non si sarà sciolto.
- Dopo aver raffreddato la soluzione a temperatura ambiente, aggiungere 5 mL di 10x soluzione salina tamponata con fosfato (PBS) per regolare il pH a 7,4. Aggiungere acqua sterilizzata per portare il volume a 50 ml.
NOTA: è preferibile una soluzione fissativa appena preparata. La soluzione può anche essere conservata a -30 °C per diversi mesi.
3. Fissazione dei campioni
- Immergere i campioni di piante nella soluzione fissativa in un microtubo (Figura 1A), assicurandosi che il volume della soluzione fissativa sia superiore a cinque volte il volume del campione.
- Sigillare il microtubo con un parafilm e fare dei fori usando un ago. Non lasciare il tubo aperto a causa del rischio di fuoriuscita del campione durante la decompressione sotto vuoto.
- Posizionare il microtubo in un essiccatore e regolare lentamente il grado di vuoto (~690 mmHg) in modo che le bolle appaiano gradualmente dai campioni (Figura 1B-C). Spegnere la pompa per vuoto dopo aver evacuato l'essiccatore. Lasciare il microtubo indisturbato per 30 minuti a temperatura ambiente.
- Sfiatare l'essiccatore con attenzione per evitare di disturbare i campioni. Accendere nuovamente la pompa per vuoto e spegnerla dopo aver evacuato l'essiccatore. Lasciare il microtubo indisturbato per 30 minuti a temperatura ambiente.
NOTA: Bisogna fare attenzione per evitare danni ai campioni durante lo sfiato dell'essiccatore. La penetrazione della soluzione fissativa nei campioni è potenziata da due trattamenti sottovuoto. Un ulteriore trattamento sottovuoto aiuta a penetrare la soluzione fissativa in campioni più spessi. - Aprire l'essiccatore con attenzione senza urtare la soluzione fissativa nel microtubo. Utilizzando una micropipetta, rimuovere la soluzione fissativa e aggiungere 1x PBS. Dopo aver conservato per 1 minuto, sostituire il vecchio PBS con il nuovo PBS 1x (Figura 1D).
4. Compensazione
- Dopo aver rimosso PBS, aggiungere cinque volte il volume del campione della soluzione di compensazione.
- Sigillare il microtubo con parafilm e praticare fori usando un ago. Posizionare i campioni nell'essiccatore, evacuare come al punto 3.3 e spegnere la pompa per vuoto. Lasciare il microtubo indisturbato per 60 minuti a temperatura ambiente.
- Aprire delicatamente l'essiccatore. Chiudere il microtubo con parafilm e conservarlo a temperatura ambiente al buio per evitare il fotosbiancamento delle proteine fluorescenti. Invertire il microtubo ogni 1-2 giorni per accelerare il processo di compensazione.
- Quando la soluzione di compensazione diventa verde, sostituirla con nuove soluzioni di compensazione fino a quando la soluzione rimane incolore (Figura 1E-H).

Figura 1: Procedura per il trattamento con CS. (A) Piantina di Arabidopsis in soluzione di PFA (paraformaldeide) al 4%. (B) Il campione viene posto in un essiccatore. (C) La piantina è fissata sotto vuoto. (D) La piantina viene immersa nella soluzione di PFA dopo il trattamento sotto vuoto. (E) Risultante piantina trattata con soluzione di compensazione di 3 giorni. Nota il colore verde della soluzione di compensazione. (F) La soluzione di compensazione viene sostituita 3 giorni dopo il trattamento. (G) Risultante piantina trattata con soluzione di compensazione di 5 giorni. (H) La soluzione limpida viene sostituita 5 giorni dopo il trattamento. Barre della scala: 1 cm (A, C-H) e 5 cm (B). Fare clic qui per visualizzare una versione più grande di questa figura.
5. Colorazione chimica del colorante
- Al microtubo, aggiungere Hoechst 33342 (concentrazione finale di 10 μg/mL) per la colorazione nucleare o Calcofluor White (concentrazione finale di 1 mg/mL) per la colorazione della parete cellulare e attendere 1 ora. Dopo aver rimosso la soluzione colorante, lavare il campione con una soluzione di compensazione fresca per 1 ora.
NOTA: la colorazione e il lavaggio durante la notte possono migliorare la penetrazione del colorante fluorescente nei tessuti e ridurre la fluorescenza di fondo. Vari coloranti fluorescenti sono compatibili con la soluzione CS come Basic Fuchsin9 (lignina), Auramine O9 (lignina, suberina e cutina), Nile Red9 (suberina), Direct Yellow 969, Direct Red 239 e SR220010,11 (pareti cellulari).
6. Osservazione
- Tagliare un foglio di gomma siliconica con una lama di rasoio per preparare un telaio per il distanziatore (Figura 2A).
NOTA: Regolare lo spessore del foglio di gomma siliconica in base allo spessore del campione. Poiché i campioni trattati con soluzione di compensazione sono morbidi, saranno danneggiati se sono coperti direttamente con il vetro di copertura. - Posizionare il telaio in silicone sul vetro di copertura (ad esempio, 25 x 60 mm) (Figura 2B). Posizionare i campioni trattati all'interno del telaio e aggiungere ~ 100 μL di soluzione di compensazione per rimuovere eventuali bolle nel telaio. Coprire con un altro vetro di copertura (18 x 18 mm o 24 x 24 mm) per evitare l'evaporazione della soluzione di compensazione (Figura 2C).
- Osservare i campioni al microscopio fluorescente. Dopo l'osservazione, riportare i campioni alla soluzione di compensazione prelevati in un microtubo e conservarli a temperatura ambiente al buio.

Figura 2: Preparazione del campione per l'osservazione microscopica. (A) Tagliare un foglio di silicone di 0,2 mm di spessore in un telaio. (B) Mettere il telaio in lamiera di silicone sul vetro di copertura. (C) Posizionare il campione trattato con soluzione di compensazione (contrassegnato da un bordo punteggiato) all'interno del telaio e coprirlo con un vetro di copertura. Barre della scala: 5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
CS può eliminare foglie di varie specie (Figura 3A-H). È difficile per la soluzione CS penetrare in una foglia di riso perché la superficie fogliare è coperta da cera cuticolare in questa pianta. Tuttavia, dopo aver estratto la cera cuticolare immergendola nel cloroformio per 10 s, CS potrebbe eliminare le foglie di riso (Figura 3H). CS non poteva, tuttavia, penetrare le foglie di Chamaecyparis obtusa che sono meno permeabili a CS (Figura 3I,J). Nelle foglie di crisantemo, la pigmentazione marrone indotta dall'ossidazione dei polifenoli è stata osservata nelle foglie trattate con CS (Figura 3K,L). Allo stesso modo, i pistilli di tabacco e torenia hanno mostrato pigmentazione marrone durante il trattamento con CS (Figura 3M,O). Poiché il componente solfito di sodio in CSA previene l'ossidazione dei polifenoli a causa dell'effetto riducente, CSA potrebbe eliminare i pistilli di tabacco e torenia senza alcuna pigmentazione marrone (Figura 3N, P).
Le figure 4B mostrano che il trattamento con CS ha ridotto il colore verde pallido della foglia arabidopsis H2B-mClover (campo luminoso) e ha migliorato l'intensità di fluorescenza di H2B-mClover rispetto all'incubazione PBS (Figura 4A). Oltre alle piante da fiore, CS è applicabile anche alle piante di muschio (Figura 4C); dopo 4 giorni di trattamento con CS, la fluorescenza di H2B-mRFP è stata chiaramente rilevata per l'intero gametoforo con ridotta autofluorescenza della clorofilla. Le figure 4D,E mostrano immagini di ricostruzione 3D del pistillo H2B-mClover in Nicotiana benthamiana cancellato usando CSA. La profondità del campione era di 440 μm. Come mostra l'immagine di proiezione a massima intensità codificata in profondità, CSA consente l'imaging profondo di tessuti difficili, come i pistilli del tabacco.
CS e CSA erano anche compatibili con la colorazione fluorescente del colorante. La Figura 5 mostra che CS potrebbe essere utilizzato contemporaneamente per osservare la proteina fluorescente (H2B-mClover) e la colorazione fluorescente organica (Calcofluor White). Dopo la ricostruzione 3D dalle immagini z-stack, è stato possibile osservare qualsiasi sezione.

Figura 3: Pulizia ottica di foglie e pistilli mediante soluzioni di compensazione. (A-L) Le foglie fisse di varie specie sono state incubate in PBS (A,C,E,G,I,K) o CS (B,D,F,H,J,L) per 8 giorni e CS (M,O) o CSA (N,P) per 2 giorni. (A,B,O,P) Torenia fournieri, (C,D) Nicotiana tabacum, (E,F) Cucumis sativus, (G,H) Oryza sativa, (I,J) Chamaecyparis obtusa, (K,L) Chrysanthemum morifolium, (M,N) Nicotiana benthamiana. Barre della scala: 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Imaging a fluorescenza di tessuti trattati con soluzioni schialleranti. (A,B) UBQ10pro::H2B-mLe foglie di Arabicdopsis thaliana sono state trattate con PBS (A) o CS (B) per 3 giorni. (C) I gametofori frondosi H2B-mRFP di Physcomitrium patens sono stati trattati con CS per 4 giorni. I nuclei sono stati etichettati con H2B-mRFP (verde). Il trattamento CS ha ridotto l'autofluorescenza della clorofilla (magenta). Il segnale H2B-mRFP nella regione apicale è stato chiaramente osservato sia per le immagini unite di H2B-mRFP che per l'autofluorescenza o il campo luminoso. (D,E) Lo stigma UBQ10pro::H2B-mClover di Nicotiana benthamiana è stato trattato in CSA per 1 mese. La proiezione a intensità massima (D) e la proiezione a intensità massima codificata in profondità (E) sono state generate da immagini z-stack a intervalli di 5 μm. Barre di scala: 100 μm. Le immagini sono state scattate utilizzando la microscopia ad ampio campo (A, B), confocale (C) e a eccitazione a due fotoni (D, E). Fare clic qui per visualizzare una versione più grande di questa figura.
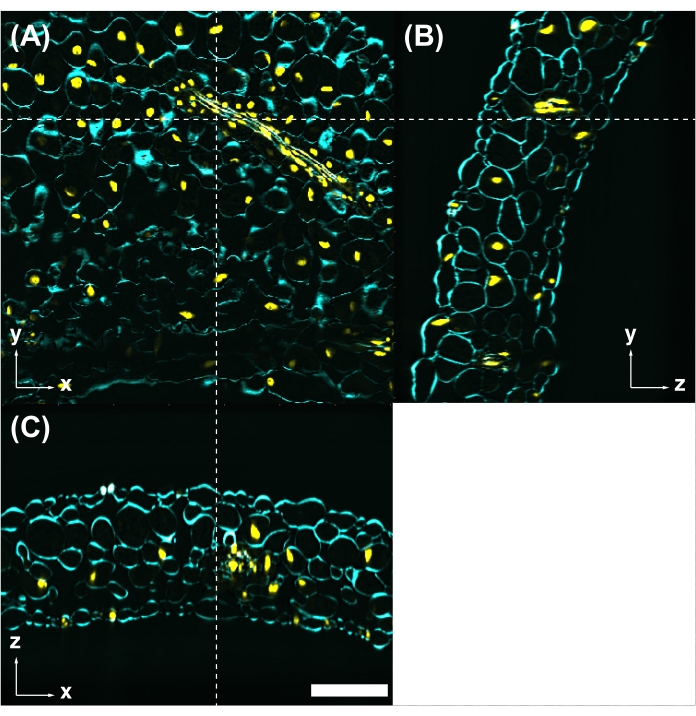
Figura 5: La colorazione fluorescente del colorante è compatibile con CS. (A) Foglie trattate con CS osservate mediante microscopia a eccitazione a due fotoni con eccitazione a 950 nm. La parete cellulare è macchiata con Calcofluor White (ciano). I nuclei sono etichettati con UBQ10pro::H2B-mClover (giallo). Le immagini yz (B) e xz (C) sono sezioni trasversali nella posizione indicata dalle linee tratteggiate bianche in (A). Barra della scala: 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Trasparenza del desossicolato di sodio. (A) Colori di vari desossicolati di sodio al 15% (elencati nella Tabella dei materiali). (B) Spettro di fluorescenza di ciascun desossicolato di sodio al 15% con eccitazione a 380 nm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo metodo consiste in fissazione, lavaggio e pulizia. La fissazione è un passo fondamentale in questo protocollo. Se la proteina fluorescente non viene osservata dopo la fissazione del PFA, non sarà osservata dopo il trattamento con soluzione di compensazione. La penetrazione della soluzione di PFA nei tessuti è fondamentale, ma il trattamento ad alto vuoto non è raccomandato perché può distruggere la struttura cellulare. Le condizioni di vuoto e i periodi di fissazione dovrebbero essere ottimizzati per ogni tipo di tessuto e specie. Si raccomanda di controllare le proteine fluorescenti anche dopo la fissazione. Sebbene i campioni siano stati solitamente fissati per 30-60 minuti a temperatura ambiente, possono essere fissati a 4 ° C per un tempo più lungo (durante la notte o più).
Come mostrato nella Figura 6A, alcuni desossicolati di sodio avevano un colore giallo pallido quando disciolti. Tali soluzioni di desossicolato di sodio hanno mostrato una forte autofluorescenza nella regione 400-600 nm dopo l'eccitazione a 380 nm (Figura 6B). Questa autofluorescenza impedisce la compensazione ottica e l'imaging a fluorescenza. Gli utenti devono controllare il colore della soluzione di desossicolato di sodio in quanto la qualità del reagente potrebbe differire a causa della purezza, della variazione da lotto a lotto o di altri motivi.
Le soluzioni di compensazione utilizzate qui hanno alte concentrazioni di desossicolato di sodio, che potrebbe distruggere la struttura della membrana. Il marcatore della membrana plasmatica (RPS5Apro::tdTomato-LTI6b) è stato osservato anche dopo il trattamento con CS7. Tuttavia, potrebbe essere meglio ridurre la concentrazione di desossicolato di sodio, a seconda della struttura e del tessuto di interesse. Infatti, sono state ottenute immagini con maggiore chiarezza per i pistilli di Arabidopsis con CS modificato, in cui la concentrazione di desossicolato di sodio è ridotta della metà; tuttavia, concentrazioni ridotte di desossicolato di sodio hanno richiesto tempi di trattamento prolungati (ad esempio, 1 mese per Arabidopsis pistils).
CS può ridurre l'autofluorescenza rossa (>610 nm) per rimuovere la clorofilla nei campioni trattati. Tuttavia, l'autofluorescenza dell'intervallo 500-600 nm (dal giallo all'arancione) è rimasta anche nei campioni trattati con CS7. Si pensa che questa autofluorescenza derivi dalla parete cellulare e da altri componenti cellulari, come la lignina12,13. Pertanto, è difficile rendere i tessuti, come gli steli con pareti secondarie sviluppate, completamente trasparenti dal trattamento CS.
Diversi reagenti di compensazione oltre a quelli utilizzati qui sono stati sviluppati per osservare le proteine fluorescenti nelle piante usando la microscopia fluorescente14,15,16,17. Rispetto a questi metodi, CS e CSA rimuovono la clorofilla e riducono l'autofluorescenza, rendendo i tessuti vegetali più trasparenti. Recentemente, Sakamoto et al. hanno sviluppato un metodo migliorato, iTOMEI, per la fissazione, la pulizia del detergente e il montaggio per regolare il disallineamento dell'indice di rifrazione18. Nelle piantine di Arabidopsis, iTOMEI ha eliminato il tessuto entro 26 ore.
CS è applicabile a una vasta gamma di specie vegetali, come Arabidopsis thaliana, Physcomitrium patens7, Chrysanthemum morifolium, Cucumis sativus, Nicotiana benthamiana, Nicotiana tabacum, Torenia fournieri8, Allium ochotense19, Astragalus sinicus20, avocado21, orzo22, Brassica rapa23, Callitriche 24, Eucalipto25, mais26, Marchantia polymorpha27, Monophyllaea glabra28, Orobanche minor29, petunia30, riso31, Solanum lycopersicum32, soia33, fragola34, grano35 e Wolffiella hyalina36. Per i tessuti più spessi, CS può anche rendere trasparenti le sezioni del vibratoma37,38. Questo metodo ha permesso di studiare la struttura cellulare e i modelli di espressione genica nelle piante37,38. Inoltre, infezioni da nematodi20,39, infezioni fungine e simbiosi19,40,41 sono state osservate anche in profondità all'interno dei tessuti trattati con CS. Pertanto, questo metodo è utile per l'imaging di tessuti interi da micro- a macro-scale e potrebbe aiutare a scoprire nuove interazioni tra varie cellule, tessuti, organi e organismi.
Divulgazioni
ClearSee è commercializzato (Fujifilm Wako Pure Chemical Corporation, Giappone). L'Università di Nagoya detiene un brevetto (JP6601842) sul reagente di compensazione ClearSee. D. Kurihara è l'inventore del brevetto. Gli autori non dichiarano interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Japan Society for the Promotion of Science (Grant-in-Aid for Scientific Research on Innovative Areas (JP16H06464, JP16H06280 to T.H.), Grant-in-Aid for Scientific Research (B, JP17H03697 to D.K.), Grant-in-Aid for Challenging Exploratory Research (JP18K19331 to D.K.), Grant-in-Aid for Scientific Research on Innovative Areas (JP20H05358 for D.K.)) e dalla Japan Science and Technology Agency (programma PRESTO (JPMJPR15QC to Y.M., JPMJPR18K4 a D.K.)). Gli autori sono grati al Live Imaging Center presso l'Institute of Transformative Bio-Molecules (WPI-ITbM) dell'Università di Nagoya per aver supportato gli studi microscopici e Editage (www.editage.com) per l'editing in lingua inglese.
Materiali
| Name | Company | Catalog Number | Comments |
| Calcofluor White | Sigma-Aldrich | F3543 | Fluorescent Brightener 28; 100 mg/mL in H2O |
| ClearSee | 10% (w/v) xylitol, 15% (w/v) sodium deoxycholate, 25% (w/v) urea | ||
| Cover glass (18×18 No.1) | MATSUNAMI | C018181 | |
| Cover glass (24×24 No.1) | MATSUNAMI | C024241 | |
| Cover glass (25×60 No.1) | MATSUNAMI | C025601 | |
| Desiccator | AS One | 1-5801-11 | |
| Hoechst 33342 | DOJINDO | 346-07951 | 1 mg/mL in H2O |
| Needle | TERUMO | NN-2238S | |
| Parafilm | Bemis | PM-996 | |
| Paraformaldehyde | Nacalai Tesque | 26126-25 | |
| Phosphate buffered saline, pH 7.4 | |||
| Silicone rubber sheet | AS One | 6-9085-12 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | Figure 6_1; Lot PSGYK-QB |
| Sodium deoxycholate | Kishida Chemical | 260-71412 | Figure 6_2; Lot C05543H |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | Figure 6_3; Lot SLBS7362 |
| Sodium deoxycholate | Sigma-Aldrich | 30970 | Figure 6_4; Lot BCBW0612 |
| Sodium deoxycholate | Nacalai Tesque | 10712-96 | Figure 6_5; Lot M5R3403 |
| Sodium deoxycholate | FUJIFILM Wako Pure Chemical | 194-08311 | Figure 6_6; Lot LKL0648 |
| Sodium hydroxide | Nacalai Tesque | 31511-05 | |
| Sodium sulphite | FUJIFILM Wako Pure Chemical | 190-03411 | |
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | BUCHI | V-700 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
Riferimenti
- Vogelmann, T. C. Light within the plant. Photomorphogenesis in Plants. , 491-535 (1994).
- Krause, G. H., Weis, E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology. 42 (1), 313-349 (1991).
- Pourcel, L., Routaboul, J., Cheynier, V., Lepiniec, L., Debeaujon, I. Flavonoid oxidation in plants: from biochemical properties to physiological functions. Trends in Plant Science. 12 (1), 29-36 (2007).
- Lersten, N. R. An annotated bibliography of botanical clearing methods. Iowa State Journal of Science. 41 (4), 481-486 (1967).
- Villani, T. S., Koroch, A. R., Simon, J. E. An improved clearing and mounting solution to replace chloral hydrate in microscopic applications. Applications in Plant Sciences. 1 (5), 1300016(2013).
- Becker, K., Jährling, N., Saghafi, S., Weiler, R., Dodt, H. -U. Chemical clearing and dehydration of GFP expressing mouse brains. PLoS ONE. 7 (3), 33916(2012).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: a rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
- Ursache, R., Andersen, T. G., Marhavý, P., Geldner, N. A protocol for combining fluorescent proteins with histological stains for diverse cell wall components. The Plant Journal. 93 (2), 399-412 (2018).
- Tofanelli, R., Vijayan, A., Scholz, S., Schneitz, K. Protocol for rapid clearing and staining of fixed Arabidopsis ovules for improved imaging by confocal laser scanning microscopy. Plant Methods. 15 (1), 120(2019).
- Vijayan, A., et al. A digital 3D reference atlas reveals cellular growth patterns shaping the Arabidopsis ovule. eLife. 10, 1-38 (2021).
- Müller, S. M., Galliardt, H., Schneider, J., George Barisas, B., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 1-20 (2013).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252, 1231-1240 (2015).
- Littlejohn, G. R., Gouveia, J. D., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytologist. 186 (4), 1018-1025 (2010).
- Warner, C. A., et al. An optical clearing technique for plant tissues allowing deep imaging and compatible with fluorescence microscopy. Plant Physiology. 166 (4), 1684-1687 (2014).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLOS ONE. 11 (8), 0161107(2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Research Square. , (2021).
- Tanaka, E., Ono, Y. Whole-leaf fluorescence imaging to visualize in planta fungal structures of Victory onion leaf rust fungus, Uromyces japonicus, and its taxonomic evaluation. Mycoscience. 59 (2), 137-146 (2018).
- Ohtsu, M., et al. Spatiotemporal deep imaging of syncytium induced by the soybean cyst nematode Heterodera glycines. Protoplasma. 254, 2107-2115 (2017).
- Duman, Z., et al. Short de-etiolation increases the rooting of VC801 Avocado rootstock. Plants. 9 (11), 1481(2020).
- Ho, W. W. H., et al. Integrative multi-omics analyses of barley rootzones under salinity stress reveal two distinctive salt tolerance mechanisms. Plant Communications. 1 (3), 100031(2020).
- Arsovski, A. A., et al. BrphyB is critical for rapid recovery to darkness in mature Brassica rapa leaves. bioRxiv. , (2020).
- Doll, Y., Koga, H., Tsukaya, H. The diversity of stomatal development regulation in Callitriche is related to the intrageneric diversity in lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 118 (14), (2021).
- Eliyahu, A., et al. Vegetative propagation of elite Eucalyptus clones as food source for honeybees (Apis mellifera); adventitious roots versus callus formation. Israel Journal of Plant Sciences. 67 (1-2), 83-97 (2020).
- Kelliher, T., et al. MATRILINEAL, a sperm-specific phospholipase, triggers maize haploid induction. Nature. 542, 105-109 (2017).
- Aki, S. S., et al. Cytokinin signaling is essential for organ formation in Marchantia polymorpha. Plant and Cell Physiology. 60 (8), 1842-1854 (2019).
- Kinoshita, A., Koga, H., Tsukaya, H. Expression profiles of ANGUSTIFOLIA3 and SHOOT MERISTEMLESS, key genes for meristematic activity in a one-leaf plant Monophyllaea glabra, revealed by whole-mount in situ hybridization. Frontiers in Plant Science. 11, 1-11 (2020).
- Okazawa, A., et al. Localization of planteose hydrolysis during seed germination of Orobanche minor. bioRxiv. , 448768(2021).
- Chen, M., et al. VAPYRIN attenuates defence by repressing PR gene induction and localized lignin accumulation during arbuscular mycorrhizal symbiosis of Petunia hybrida. New Phytologist. 229 (6), 3481-3496 (2021).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11, 23(2018).
- Alaguero-Cordovilla, A., et al. An auxin-mediated regulatory framework for wound-induced adventitious root formation in tomato shoot explants. Plant, Cell & Environment. 44 (5), 1642-1662 (2021).
- Okuda, A., Matsusaki, M., Masuda, T., Urade, R. Identification and characterization of GmPDIL7, a soybean ER membrane-bound protein disulfide isomerase family protein. The FEBS Journal. 284 (3), 414-428 (2017).
- Kim, D. -R., et al. A mutualistic interaction between Streptomyces bacteria, strawberry plants and pollinating bees. Nature Communications. 10 (1), 4802(2019).
- Wu, J., Mock, H. -P., Giehl, R. F. H., Pitann, B., Mühling, K. H. Silicon decreases cadmium concentrations by modulating root endodermal suberin development in wheat plants. Journal of Hazardous Materials. 364, 581-590 (2019).
- Isoda, M., Oyama, T. Use of a duckweed species, Wolffiella hyalina, for whole-plant observation of physiological behavior at the single-cell level. Plant Biotechnology. 35 (4), 387-391 (2018).
- Ben-Targem, M., Ripper, D., Bayer, M., Ragni, L. Auxin and gibberellin signaling cross-talk promotes hypocotyl xylem expansion and cambium homeostasis. Journal of Experimental Botany. 72 (10), 3647-3660 (2021).
- Shwartz, I., et al. The VIL gene CRAWLING ELEPHANT controls maturation and differentiation in tomato via polycomb silencing. bioRxiv. , (2021).
- Levin, K. A., Tucker, M. R., Strock, C. F., Lynch, J. P., Mather, D. E. Three-dimensional imaging reveals that positions of cyst nematode feeding sites relative to xylem vessels differ between susceptible and resistant wheat. Plant Cell Reports. 40 (2), 393-403 (2021).
- Nouri, E., et al. Phosphate suppression of arbuscular mycorrhizal symbiosis involves gibberellic acid signaling. Plant and Cell Physiology. 62 (6), 959-970 (2021).
- Evangelisti, E., et al. Artificial intelligence enables the identification and quantification of arbuscular mycorrhizal fungi in plant roots. bioRxiv. , 434067(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon