Method Article
Usando embrião de frango como ferramenta poderosa na avaliação de cardiotoxi cidades do desenvolvimento
Neste Artigo
Resumo
Embriões de frango, como modelo de desenvolvimento clássico, são usados em nosso laboratório para avaliar cardiotoxicções de desenvolvimento após a exposição a vários contaminantes ambientais. Métodos de exposição e métodos de avaliação morfológica/funcional estabelecidos estão descritos neste manuscrito.
Resumo
Embriões de frango são um modelo clássico em estudos de desenvolvimento. Durante o desenvolvimento de embriões de frango, a janela de tempo do desenvolvimento cardíaco é bem definida, e é relativamente fácil alcançar exposição precisa e oportuna através de múltiplos métodos. Além disso, o processo de desenvolvimento cardíaco em embriões de frango é semelhante aos mamíferos, resultando também em um coração de quatro câmaras, tornando-se um modelo alternativo valioso na avaliação das cardiotoxicções de desenvolvimento. Em nosso laboratório, o modelo de embrião de frango é rotineiramente utilizado na avaliação de cardiotoxicções de desenvolvimento após exposição a diversos poluentes ambientais, incluindo substâncias per e polifluoroalquila (PFAS), material particulado (PMs), escape diesel (DE) e nanoestá materiais. O tempo de exposição pode ser livremente selecionado com base na necessidade, desde o início do desenvolvimento (dia embrionário 0, ED0) até o dia anterior ao eclosão. Os principais métodos de exposição incluem injeção de células de ar, microinjeção direta e inalação de células de ar (originalmente desenvolvidas em nosso laboratório), e os pontos finais disponíveis atualmente incluem função cardíaca (eletrocardiografia), morfologia (avaliações histológicas) e avaliações biológicas moleculares (imunohistoquímica, qRT-PCR, mancha ocidental, etc.). É claro que o modelo de embrião de frango tem suas próprias limitações, como a disponibilidade limitada de anticorpos. No entanto, com mais laboratórios começando a utilizar esse modelo, ele pode ser usado para fazer contribuições significativas para o estudo das cardiotoxicções do desenvolvimento.
Introdução
O embrião de frango é um modelo clássico de desenvolvimento, que tem sido usado por mais de duzentos anos1. O modelo de embrião de frango tem várias vantagens em relação aos modelos tradicionais. Em primeiro lugar, já há mais de 70 anos, o desenvolvimento normal do embrião de frango havia sido ilustrado muito claramente no guia de estadiamento hamburger-hamilton2, no qual foram definidos um total de 46 estágios durante o desenvolvimento de embriões de frango com tempo preciso e características morfológicas, facilitando detecções de desenvolvimento anormal. Além disso, o modelo de embrião de frango tem outras características, como ser relativamente de baixo custo e redundante em quantidade, controles relativamente precisos de dose de exposição, um sistema independente e fechado dentro da concha e fácil manipulação do embrião em desenvolvimento, o que garante seu potencial de ser usado como um poderoso modelo de avaliação toxicológica.
Na cardiotoxicidade, o embrião de frango apresenta um coração de quatro câmaras, semelhante aos corações de mamíferos, mas com paredes mais grossas, permitindo avaliações morfológicas mais fáceis. Além disso, o embrião de frango permite a exposição à inalação de desenvolvimento, o que não é possível em modelos de mamíferos: durante o estágio posterior de desenvolvimento, o embrião de frango passará da respiração interna para a respiração externa (obtendo oxigênio através do pulmão); Este último requer que o embrião penetre a membrana celular de ar com o bico, e começa a respirar ar3, tornando a célula de ar uma mini-câmara de inalação. Utilizando esse fenômeno, os efeitos toxicológicos dos contaminantes gasosos no coração (e em outros órgãos) podem ser avaliados sem a necessidade de instrumentos dedicados de câmara de inalação.
Neste manuscrito, são descritos vários métodos de avaliação de exposição/ponto final, todos os quais servem para tornar o embrião de frango uma ferramenta poderosa na avaliação da cardiotoxicidade do desenvolvimento após a exposição a contaminantes ambientais.
Protocolo
Todos os procedimentos descritos foram aprovados pelo Comitê Institucional de Atenção e Uso de Animais (IACUC) da Universidade de Qingdao. Em nosso laboratório, os ovos foram incubados em duas incubadoras. Os ovos eram mantidos eretos na incubadora e colocados aleatoriamente nas prateleiras. As condições de incubação dos ovos foram as seguintes: a temperatura de incubação começou em 37,9 °C, e gradualmente diminuiu para 37,1 °C à medida que a incubação prosseguia; a umidade começou em 50% e aumentou gradualmente para 70%.
1. Métodos de exposição
NOTA: A exposição de contaminantes ambientais a embriões de frango pode ser alcançada de várias formas. Nesta seção, três métodos usados rotineiramente são descritos em detalhes.
- Injeção de célula de ar(Figura 1)
NOTA: Este é o método de exposição clássica aos embriões de frango4,5,6, adequado para uma ampla gama de materiais, podendo ser realizado em uma janela de tempo muito ampla, desde o início do desenvolvimento (dia zero embrionário, ED0) até o dia anterior ao hatch (ED20). O óleo de girassol é usado como veículo. Estudos anteriores mostraram que não foram observadas alterações significativas na mortalidade, incubabilidade ou peso corporal entre embriões não tratados e embriões injetados com óleo de girassol7.- Prepare os seguintes reagentes/ferramentas necessários: 75% de etanol, papel de tecido, sonda metálica (pode substituir com qualquer agulha de metal afiada/vara/awl), parafina derretida, escova, solução de iodeto povidone, pipeta, pontas de pipeta, lâmpada de candling, mistura de dosagem. Prepare a mistura de dosagem com óleo de girassol (recomendado)4. Para utilizar outros diluentes, realize o controle do veículo (versus embriões não tratados).
- Limpe a superfície dos ovos com solução de iodeto povidone (solução de iodeto povidone 1:5 diluída comercialmente com água deionizada) e enxuga a casca de ovo com papel de tecido sem esfregar. Esfregar quebrará a camada protetora que reveste o lado de fora da concha.
- Desça os ovos em uma sala escura e marque a célula de ar com lápis. Exclua ovos com rachaduras na casca. Exclua ovos com células de ar ao lado em vez de ponta sem cortes, pois são altamente improváveis de chocar normalmente.
- Higienize a área da célula aérea com 75% de etanol, e depois faça um pequeno buraco no centro da área da célula aérea com a sonda metálica. Não enfie a sonda profundamente na célula de ar ou a membrana interna pode ser danificada, em vez disso, apenas quebre a casca com a ponta da sonda. Se o orifício não for grande o suficiente para caber em uma ponta fina de pipeta, quebre a casca novamente nas proximidades do orifício existente, até que o orifício seja grande o suficiente para permitir a inserção de 10 μL de ponta de pipeta.
- Vortex a mistura de dosagem vigorosamente, e imediatamente desenhar solução para ponta de pipeta. O volume de injeção recomendado é de 1 μL por 10 gramas de ovo (por exemplo, 5 μL de volume de injeção para um ovo de 50 gramas), pois volumes de injeção maiores podem criar condições hipóxiis ou anoxilicas para o embrião em desenvolvimento. Calcule a concentração da solução de dosagem para a dose de mg/ovo kg desejada.
- Insira a ponta da pipeta no orifício, com a ponta tocando a membrana interna. Ejete lentamente a mistura de dosagem, segure por pelo menos dez segundos (deixe que o óleo viscoso seja totalmente dispensado) e, em seguida, remova a ponta.
- Sele o buraco com um pincel e uma gota de parafina derretida. Tenha cuidado para não pingar parafina derretida na membrana interna.
- Uma vez selado, coloque os ovos na incubadora até atingirem o estágio embrionário desejado. No desenvolvimento de embriões já em desenvolvimento, realize todo o processo o mais rápido possível para evitar a perda potencial de embriões devido às baixas temperaturas ambientais.
- Microinjeção (Figura 2)
NOTA: Este é um método de exposição mais direto, resultando em exposição definitiva à substância de interesse, e especialmente adequado para compostos com curta duração de ação (por exemplo, lentivírus), uma vez que a injeção clássica de células de ar requer tempo para os compostos penetrarem na membrana interna. Este método também pode ser tentado se resultados satisfatórios não serão alcançados pela injeção de células de ar. Este método é mais adequado para embriões precoces (até ED2), mas também pode ser realizado em embriões mais antigos (com maior risco de perda de embriões).- Preparar os seguintes reagentes/ferramentas necessárias: 75% de etanol, solução de iodeto povidone, micro-injetor (5 μL), sonda metálica (pode substituir com qualquer agulha/vara/awl metálico afiada deve funcionar), fórceps finos, fita. Prepare a mistura de dosagem com soro fisiológico estéril, que também serve como um controle de injeção sem afetar significativamente a escotilhabilidade. Certifique-se de que a esterilidade do soro fisiológico, uma vez que uma injeção contaminada aumentará drasticamente a mortalidade.
- Limpe os ovos conforme descrito em 1.1.2.
- Vela os ovos como descrito em 1.1.3.
- Higienize a área da célula aérea com 75% de etanol, e depois faça um pequeno buraco no centro da área da célula aérea com a sonda metálica. Não enfie a sonda profundamente na célula de ar ou a membrana interna pode ser danificada, em vez disso, apenas quebre a casca com a ponta da sonda. Em seguida, use os fórceps finos para ampliar cuidadosamente o orifício até que o diâmetro seja de aproximadamente 2 mm, permitindo a confirmação visual da membrana interna.
- Carregue a solução em microinjetor (volume máximo de injeção: 0,5 μL/10 g de ovo. (por exemplo, 2,5 μL para um ovo de 50 g) e insira cuidadosamente a agulha através do orifício na membrana interna por aproximadamente 2-3 mm. Dispense suavemente a solução e remova a agulha. Mantenha a agulha o mais perpendicular possível à membrana.
- Sele o buraco com um pequeno pedaço de fita. Cubra completamente o orifício para evitar a desidratação e a morte do embrião durante a incubação subsequente. No entanto, evite pedaços de fita que são muito grandes para prevenir a hipóxia.
- Uma vez selado, coloque os ovos na incubadora até atingirem o estágio embrionário desejado. No desenvolvimento de embriões já em desenvolvimento, realize todo o processo o mais rápido possível para evitar a perda potencial de embriões devido à baixa temperatura ambiental.
- Inalação de células de ar(Figura 3)
NOTA: Este é um novo método de inalação aproveitando a célula de ar, a partir da qual o embrião de frango em estágio final começará a respirar ar. É adequado para exposições de gás ou aerossol e pode alcançar exposições de inalação muito precoce, e encher os pulmões com o gás/aerossol alvo quando eles abrem pela primeira vez na vida.- Preparar os seguintes reagentes/ferramentas necessários: Saco de amostragem (saco PVF, para armazenamento de amostra de gás/aerossol antes da exposição), agulha de cateter, seringa, sonda metálica (pode substituir com qualquer agulha de metal afiada/ vara/awl deve funcionar), fita, capô de fumaça.
- Limpe os ovos conforme descrito em 1.1.2 e vire-os conforme descrito em 1.1.3 (não é necessário marcar células de ar antes da incubação), e depois incubar ovos sem tratamento até ED17.
- Vire os ovos em ED17 para marcar a área da célula de ar.
- Em ED18, retire um ovo da incubadora, higienize a área da célula aérea com 75% de etanol e, em seguida, faça cuidadosamente dois pequenos furos em dois lados da célula de ar. Uma é para injeção de gás/aerossol, a outra é para expelir ar. Controle cuidadosamente o tamanho dos orifícios para que o tamanho do orifício de injeção seja suficiente para que a agulha do cateter seja inserida, enquanto o diâmetro do orifício de expelir é um pouco maior (aproximadamente 1 mm).
- Injete suavemente 10 mL de gás/aerossol alvo do orifício de injeção com uma seringa presa à agulha do cateter. Injete ar para um grupo de controle de inalação, que não deve ter diferenças significativas para um grupo de controle negativo8. Aplique pressão contra a agulha do cateter (com a quantidade adequada de pressão que a agulha elástica pode ser empurrada contra a casca) para minimizar o vazamento do orifício de injeção. Sele os dois orifícios imediatamente com fita adesiva e devolva o ovo à incubadora.
NOTA: Este procedimento deve ser realizado em um capô de fumaça para evitar a inalação de gás/aerossol pelo operador. - Repita o procedimento descrito após uma hora para garantir que toda a célula de ar esteja cheia de gás/aerossol alvo (opcional).
- Repita novamente o procedimento descrito em ED19 (opcional). Repetir a exposição ajuda a garantir uma exposição consistente até a escotilha. Regisso tempo de eclosão para uma estimativa aproximada da duração da exposição.
- Uma vez realizadas exposições desejadas e seladas, coloque os ovos na incubadora para eclodir. Minimize o tempo que o ovo passa fora da incubadora para evitar a morte por baixa temperatura ambiental.
2. Métodos de avaliação de ponto final
NOTA: Após a exposição de contaminantes de interesse ao embrião em desenvolvimento, vários parâmetros de toxicidade podem ser avaliados, incluindo a cardiotoxicidade. Nesta seção, dois métodos específicos frequentemente utilizados são descritos em detalhes.
- Eletrocardiografia (Figura 4)
NOTA: É impossível fazer eletrocardiografia não invasiva em galinhas filhotes devido à presença de penas. Assim, a implantação subcutânea de eletrodos é essencial, exigindo anestesia. A dose utilizada no laboratório é de 33 mg/kg pentobarbital via injeção intraperitoneal (algumas galinhas podem exigir até 50% de aumento de dose). Este método resultará em eletrocardiografia estável em mais de 90% dos animais, permitindo a análise da frequência cardíaca.- Preparar os seguintes reagentes/ferramentas necessários: solução pentobarbital de 1% (10 mg/mL) em solução salina, seringa, equilíbrio elétrico, aquecedor (se necessário), um instrumento de eletrocardiografia anexado (por exemplo, BL-420E+) com eletrodos de agulha metálica de dois canais.
- Pesar as galinhas com um equilíbrio e calcular o volume necessário de solução pentobarbital e injetar as galinhas. Para um frango que pesa 30 g, é necessário 0,1 mL de solução pentobarbital. Certifique-se de que a injeção é feita no lado lateral do abdômen, pois a gema está localizada no meio e a injeção pode não ser eficaz.
- Espere até que as galinhas injetadas sejam anestesiadas (segure o frango na mão, se o pescoço não tiver tensão e a cabeça puder ser balançada livremente, a anestesia é suficiente). Coloque as galinhas na mesa de operação (aquecedores são necessários se a temperatura ambiente estiver abaixo de 20 °C).
- Insira dois eletrodos de agulha de dois lados do abdômen, subcutâneamente. Certifique-se de que as agulhas não entram na cavidade abdominal levantando um pouco a pele e inserindo agulha a partir daí. Uma vez inserida, empurre cuidadosamente a agulha para a frente até atingir o lado da cavidade torácica. Certifique-se de que a agulha não vá fundo no corpo ou se retire da pele.
- Faça as medições com o instrumento de eletrocardiografia. Outros instrumentos semelhantes capazes de eletrocardiografia podem ser usados.
- Se as galinhas forem sacrificadas, realize a eutanásia após a eletrocardiografia, pois já estão sob anestesia. Se as galinhas sobreviverem, coloque-as de volta em suas gaiolas e aqueçam até acordar. Devolvê-los à incubadora é outra opção.
- Histomorfometria (Figura 5)
NOTA: Um método específico é desenvolvido para avaliar a espessura da parede ventricular direita em seções transversais do coração. A avaliação morfológica da dimensão do ventrículo direito via ecocardiografia não é 100% precisa devido à forma irregular do ventrículo direito, e este método pode servir como um bom suplemento nas avaliações morfológicas para o ventrículo direito.- Preparar os seguintes reagentes/ferramentas necessárias: 4% de formaldeído tamponado fosfato, lâmina afiada, soro fisco tamponado fosfato, papel toalha, equilíbrio elétrico, tesoura pequena, agentes de processamento histológico geral (etanol classificado, xileno, parafina).
- Uma vez que os animais são sacrificados, use água para molhar as penas. Isto é para minimizar a contaminação potencial devido às penas voadoras ao abrir o peito.
- Abra a cavidade torácica cuidadosamente sem danificar o coração. Use uma tesoura pequena para cortar a vasculatura e remover suavemente o coração da cavidade torácica. Deixe uma pequena peça (aproximadamente 1-2 mm) de vasculatura presa ao coração, pois isso pode ser conveniente para o manuseio subsequente do coração sem danificar o coração.
- Uma vez removido, enxágue o coração em soro fisiológico tamponado de fosfato frio para remover o sangue e relaxar o músculo. Em seguida, mesque o coração em papel toalha antes de pesar para uma leitura precisa do peso. Coloque o coração em 10x de volume fixador (4% de formaldeído tamponado fosfato) por 24 horas em temperatura ambiente. Os tecidos fixos podem ser posteriormente processados em blocos de parafina, ou devem ser armazenados a 4 °C por anos (não recomendado se a imunohistoquímica for planejada).
- Antes de incorporar, corte os tecidos com aproximadamente 60% de comprimento do coração contando a partir do ápice (Figura 5A),para facilitar o processamento subsequente. Recomenda-se uma lâmina de microtome para um corte limpo rápido e vertical. Para galinhas com mais de um dia, faça outro corte a aproximadamente 25-30% de comprimento do ápice para uma penetração mais fácil de parafina e para permitir que o tecido se encaixe em de tecido.
- Processe os tecidos com as seguintes condições (ajuste conforme necessário): 70% de etanol para 1h, 80% de etanol para 1h, 95% de etanol para 1 h x2, 100% etanol para 30 min x2, xileno por 5 min x2, parafina (ponto de fusão 52-54 °C) para 1,5 h, parafina (ponto de fusão 62-64 °C) por 1 h, e depois incorporar os tecidos em uma mistura de 3:1 de parafina (ponto de fusão 62-64 °C) e parafina (ponto de fusão 52-54 °C).
- Seção o tecido com 6 μm de espessura. Mantenha cuidadosamente posições relativas idênticas das seções transversais, confirmando a presença e o tamanho de um marco anatômico (trabecula septomarginal) no ventrículo direito. Confirme um marco com comprimento moderado em cada seção(Figura 5B, seta).
- Faça duas réguas eletrônicas com programador logo: A régua 1 é uma linha reta com linhas de medida de 7 raios anexadas ao ponto médio, com 22,5° entre duas linhas de medida adjacentes. Régua 2 é apenas duas linhas perpendiculares em uma forma T(Figura 5B).
- Medir com dois programas de software: Adobe Photoshop e ImageJ.
- No Photoshop, redimensione a régua 1 (NO remodelagem) para colocar as duas extremidades da régua nas duas extremidades da parede ventricular direita livre, de modo que as sete linhas de medida na régua 1 atenderão cada uma a parede ventricular direita interna. Em seguida, use a régua 2 para fazer medições perpendiculares da parede ventricular interna para externa(Figura 5B).
- Use ImageJ para fazer as sete medidas para cada coração.
- Dependendo das necessidades específicas, analise as sete medidas ou média para uma espessura de parede ventricular direita representativa. Normalize para todo o peso cardíaco para mudanças específicas de espessura da parede ventricular.
Resultados
Resultados de exposição
Injeção de células de ar
A injeção de células de ar pode efetivamente expor o desenvolvimento de embriões de frango a vários agentes, que podem ser posteriormente detectados nas amostras coletadas (soro, tecido, etc.) de embriões/galinhas filhotes. Aqui está um exemplo, no qual o ácido perfluorooctanóico (PFOA) foi injetado por células de ar, e as concentrações de PFOA sérico foram então determinadas com espectrometria de massa líquida ultra-performance. As concentrações de soro corresponderam às doses injetadas, indicando a eficácia deste procedimento(Figura 6).
Microinjection
A microinjeção pode expor os embriões em desenvolvimento a agentes que podem não penetrar efetivamente na membrana interna, ou com uma curta duração de ação, como o lentivírus. Aqui está um exemplo, no qual o lentivírus foi injetado no segundo dia embrionário com este método e, em seguida, foi observada fluorescência verde significativa no coração dos embriões do dia 15, indicando a eficácia da transfecção de lentivírus(Figura 7).
Infusão de células de ar
A infusão de células de ar é um novo método, que pode funcionar muito bem para uma pequena quantidade de exposição à inalação de gás/aerossol durante o estágio de iniciação da respiração externa. Aqui está um exemplo, no qual o escapamento diesel foi infundido em células de ar nos dias 18 e 19 embrionários, resultando em alterações fibrosas significativas nos tecidos cardíacos e pulmonares(Figura 8).
Resultados da avaliação do ponto final
Resultados da eletrocardiografia
Devido à limitação de dois eletrodos, apenas 3 canais de eletrocardiografia podem ser mostrados. Mas são suficientes para distinguir ondas r, assim podem ser usadas para avaliações funcionais. Em um exemplo da vida real, a eletrocardiografia de frangos expostos ao escapamento diesel indicou um intervalo R-R significativamente encurtado, indicando alterações funcionais(Figura 9).
Resultados histopatologia
Nosso método de avaliação da espessura da parede ventricular direita foi utilizado com sucesso em diversos estudos5,7,8,9,10,11,12. Em um de nossos estudos anteriores, a exposição ao escapamento diesel resultou em espessa parede ventricular direita(Figura 10).

Figura 1: Demonstração da injeção de células de ar. Um óvulo fértil não desenvolvido é mostrado na imagem, mas embriões em todos os estágios diferentes podem ser expostos com este método. Clique aqui para ver uma versão maior desta figura.

Figura 2: Demonstração de microinjeção. Um embrião precoce é mostrado na imagem, que é o ponto de tempo de exposição preferido para este método, mas outros pontos de tempo também podem ser experimentados. Clique aqui para ver uma versão maior desta figura.

Figura 3: Demonstração da infusão de células de ar. Um embrião em estágio final submetido a pipping interno é mostrado na imagem, que é o ponto de tempo de exposição preferido para este método. Quatro etapas da operação foram mostradas. 1: Embrião intacto. 2: Dois buracos foram feitos. 3: A infusão está sendo realizada. O saco de amostragem PVF também é mostrado no canto inferior esquerdo. 4: A infusão está terminada, orifícios selados com fita adesiva. Clique aqui para ver uma versão maior desta figura.

Figura 4: Demonstração da eletrocardiografia. O painel superior esquerdo mostrou como um frango filhote foi anestesiado e submetido à medição da eletrocardiografia. O painel superior direito mostra o instrumento de eletrocardiografia com os eletrodos ligados. O painel inferior mostra uma eletrocardiografia representativa adquirida das galinhas. Clique aqui para ver uma versão maior desta figura.

Figura 5: Demonstração da avaliação histopatológica da espessura da parede ventricular direita (hematoxilina e manchas de eosina). (B) Demonstração da medição da espessura da parede ventricular direita. As barras de escala representam 1000 μm. Círculos azuis demonstram os sete pontos de medição na parede ventricular direita interna. O círculo vermelho demonstra um ponto de medição na parede ventricular direita externa. A seta demonstra o marco anatômico para a posição transversal apropriada. Este número foi modificado de Jiang et al. Toxicologia. 293 (1-3), 97-106 (2012)7. Clique aqui para ver uma versão maior desta figura.
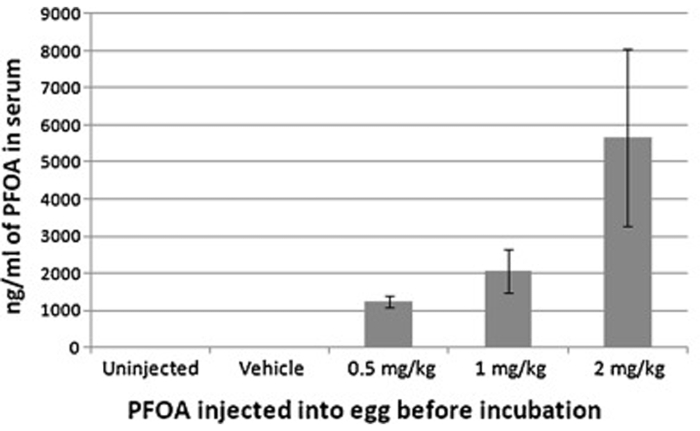
Figura 6: Concentração súmica de ácido perfluorooctanóico de galinhas incubadoras após injeção de células de ar com 0, 0,5, 1 ou 2 mg/ovo kg de ácido perfluorooctanóico antes da incubação. As concentrações de soro resultantes corresponderam às doses injetadas, indicando a eficácia da injeção celular. Este número foi modificado de Jiang et al. Toxicologia. 293 (1-3), 97-106 (2012)7. Clique aqui para ver uma versão maior desta figura.

Figura 7: Demonstração da eficácia da transfecção de lentivírus após exposição à microinjeção (Observação direta após crio-secção). Os painéis esquerdos mostraram imagens de campo leve, enquanto os painéis direito mostraram fluorescência verde para as mesmas seções teciduais. Dia embrionário dois embriões de frango foram injetados com lentivírus ou controle, e então incubados até o dia 15. Os corações foram congelados e visualizados diretamente sob microscópio fluorescente. (A) Grupo de controle, pouca fluorescência verde estava presente. (B) Grupo exposto ao lentivírus, foi observada fluorescência verde significativa, indicando a eficácia da transfecção de lentivírus após microinjeção. As barras de escala representam 125 μm. Este número foi modificado a partir de Zhao et al. Toxicologia Ambiental e Farmacologia. 56, 136-144 (2017)11. Clique aqui para ver uma versão maior desta figura.

Figura 8: Demonstração da eficácia da infusão de células aéreas. Embriões de frango foram infundidos com exaustão diesel nos dias 18 e 19, e então as galinhas chocadas foram mantidas por 0, 1 ou 2 semanas e depois sacrificadas. Os tecidos cardíacos foram avaliados com coloração de Masson Trichrome para lesões fibrosas. As setas mostraram as lesões fibrosas (coloração azul). *: estatisticamente diferente do controle (P<0,05 da análise de variância e testes de diferença menos significativos). As barras de escala representam 150 μm. Este número foi modificado a partir de Jiang et al. Environmental Pollution. 264, 114718 (2020)8. Clique aqui para ver uma versão maior desta figura.

Figura 9: Demonstração da eficácia da eletrocardiografia. Os embriões de frango foram infundidos com exaustão diesel nos dias 18 e 19, e então as galinhas eclodidas foram mantidas por 0, 1 ou 2 semanas e, em seguida, a eletrocardiografia foi realizada. Intervalos R-R significativamente encurtados foram observados nas galinhas expostas ao escapamento diesel via infusão de células de ar, indicando a eficácia do método. *: estatisticamente diferente do controle (P<0,05 da análise de variância e testes de diferença menos significativos). Este número foi modificado a partir de Jiang et al. Environmental Pollution. 264, 114718 (20208). Clique aqui para ver uma versão maior desta figura.
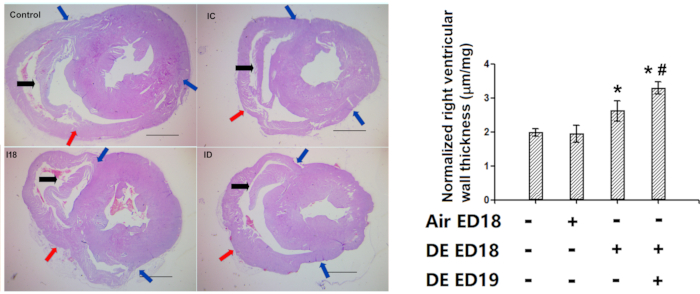
Figura 10: Demonstração da eficácia da medição da espessura da parede ventricular direita (hemaoxilalina e coloração de eosina). Os embriões de frango foram infundidos com exaustão diesel nos dias 18 e 19, e então as galinhas eclodidas foram mantidas por 1 semana, e então foi realizada avaliação histológica da espessura da parede ventricular direita. A: Fotos representativas das seções transversais do coração. Note a presença de marcador anatômico em todos os ventrículos certos (Em galinhas mais velhas, o marcador tende a ser um pouco mais longo na posição desejada, o que não afeta a precisão das medidas). B: Quantificação da espessura da parede ventricular direita, que foram primeiro convertidas em comprimento real com slides padrão, e depois normalizadas com peso cardíaco inteiro, portanto, foram representadas na forma de um/ug. Setas azuis: duas extremidades da parede ventricular direita livre. Setas vermelhas: os pontos do meio da parede ventricular direita. Flechas pretas: marcador anatômico. *: estatisticamente diferente do controle (P<0,05 da análise de variância e testes de diferença menos significativos). As barras de escala representam 1000 μm. Este número foi modificado a partir de Jiang et al. Environmental Pollution. 264, 114718 (2020)8. Clique aqui para ver uma versão maior desta figura.
Discussão
O embrião de frango é um modelo clássico em estudos de desenvolvimento há 200 anos1. Nossos métodos apresentados neste manuscrito têm sido utilizados na avaliação de diversos contaminantes ambientais, incluindo ácido perfluorooctanóico, material particulado e escapamento diesel com sucesso5,7,8,9,10,11,12. Com esses métodos, a cardiotoxicidade do desenvolvimento foi indicada de forma econômica e clara. Além disso, não é difícil expor embriões de frango com outros compostos de interesse e avaliar a cardiotoxicidade potencial do desenvolvimento.
O método de injeção de células de ar é um método clássico usado anteriormente em muitos estudos13,14,15, o que é conveniente e eficaz. Em comparação com outros métodos de exposição ao desenvolvimento, como os modelos de roedores16,17,18,apresenta exposição direta a um sistema fechado, o que reduz consideravelmente as variabilidades devido aos efeitos maternos e à excreção variada. A microinjeção é um aprimoramento do método de injeção de células de ar, garantindo exposição definitiva sobre ou nas proximidades do desenvolvimento de embriões precoces, que podem alcançar efeitos semelhantes aos injeções do útero nos modelos de roedores19,20. Comparando-se com as injeções do útero, nosso método permite a confirmação visual da injeção com passos de manipulação relativamente fáceis, e a injeção precisa é facilmente alcançada controlando o peso do ovo, o que não é possível na injeção no útero, onde a quantidade real e o peso dos embriões não são facilmente adquiridos. O método de infusão é principalmente para avaliação de agentes inalados no sistema pulmonar, mas cardiotoxicidade e toxicidade pulmonar muitas vezes co-ocorrem. Este método aproveita a célula de ar, na qual uma pequena quantidade de gás ou aerossol são infundidos, permitindo a inalação contínua de gás/aerossol sem a necessidade de câmaras de inalação específicas. Os modelos de roedores de contrapartida precisam usar quantidades relativamente grandes de gás/aerossol e grandes instrumentos de inalação caros21,22.
Os dois pontos finais testados rotineiramente em nosso laboratório, eletrocardiografia e avaliação histomorfométrica da espessura da parede ventricular direita, representam alterações funcionais e morfológicas após exposição toxicológica, respectivamente. A avaliação da espessura da parede ventricular direita tem vantagens específicas em obter uma compreensão abrangente da parede ventricular direita, uma vez que a avaliação tradicional baseada em ecocardiografia no ventrículo direito é geralmente desafiadora e não muito precisa, devido à forma crescente assimétrica e complexa do ventrículo direito23. Nosso método pode ajudar a superar essa imprecisão, suplementando com informações adicionais sobre a espessura da parede ventricular direita em uma posição representativa. Atualmente é tudo manual, no futuro, as medições podem ser feitas automaticamente e o número de pontos de medição pode ser aumentado consideravelmente, melhorando ainda mais a precisão deste método.
Modelos de desenvolvimento baseados em embriões de frango têm várias vantagens em estudos toxicológicos, como a capacidade de fornecer uma dose de exposição relativamente precisa, um sistema de exposição independente dentro da concha e fácil manipulação do embrião em desenvolvimento. Com relação à cardiotoxicidade, as galinhas têm corações relativamente grandes e paredes ventriculares grossas, permitindo avaliações histomorfómétricas fáceis. Existem algumas deficiências, como a disponibilidade de anticorpos/primers e requisitos extras de espaço em gaiolas comparando com roedores se criar galinhas após a escotilha. No entanto, o embrião de frango ainda é um bom modelo toxicológico alternativo a ser utilizado para possíveis avaliações de cardiotoxicidade do desenvolvimento.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciência Natural da China (Grant No. 91643203, 91543208, 81502835).
Materiais
| Name | Company | Catalog Number | Comments |
| 4% phosphate buffered formaldehydefixative | Biosharp, Hefei, China | REF: BL539A | |
| 75% ethanol | Guoyao,Shanghai,China | CAS:64-17-5 | |
| Biosignaling monitor BL-420E+ | Taimeng, Chengdu, China | BL-420E+ | |
| Candling lamp | Zhenwei, Dezhou, China | WZ-001 | |
| Disposable syringe | Zhiyu, Jiangsu, China | ||
| Egg incubator | Keyu,Dezhou, China | KFX | |
| Electrical balance | OHAUS, Shanghai, China | AR 224CN | |
| Electro-thermal incubator | Shenxian, Shanghai, China | DHP-9022 | |
| Ethanol absolute | Guoyao,Shanghai,China | CAS:64-17-5 | |
| Fertile chicken egg | Jianuo, Jining, China | ||
| Hematoxylin and Eosin Staining Kit | Beyotime, Bejing, China | C0105 | |
| Histology paraffin | Aladdin, Shanghai, China | P100928-500g | Melt point 52~54°C |
| Histology paraffin | Aladdin, Shanghai, China | P100936-500g | Melt point 62~64°C |
| IV catheter | KDL, Zhejiang, China | The catheters have to be soft, plastic ones. | |
| Lentivirus | Genechem, Shanghai, China | The lentivirus were individually designed/synthesized by Genechem. | |
| Masson's trichrome staining kit | Solarbio, Beijing, China | G1340 | |
| Metal probe | Jinuotai, Beijing, China | ||
| Microinjector (5 uL) | Anting,Shanghai, China | ||
| Microscope | CAIKON, Shanghai, China | XSP-500 | |
| Microtome | Leica, Germany | HistoCore BIOCUT | |
| Microtome blade | Leica,Germany | Leica 819 | |
| Pentobarbitual sodium | Yitai Technology Co. Ltd., Wuhan, China | CAS: 57-33-0 | |
| Pipetter(10ul) | Sartorius, Germany | ||
| Povidone iodide | Longyuquan, Taian, China | ||
| Scissor | Anqisheng,Suzhou, China | ||
| Sterile saline | Kelun,Chengdu, China | ||
| Sunflower oil | Mighty Jiage, Jiangsu, China | Any commerical sunflower oil for human consumption should work | |
| Tape | M&G, Shanghai, China | ||
| Tedlar PVF Bag (5L) | Delin, Dalian, China | ||
| Vortex mixer | SCILOGEX, Rocky Hill, CT, US | MX-F | |
| Xylene | Guoyao,Shanghai,China | CAS:1330-20-7 |
Referências
- Kain, K. H., et al. The chick embryo as an expanding experimental model for cancer and cardiovascular research. Developmental Dynamics. 243 (2), 216-228 (2014).
- Menna, T. M., Mortola, J. P. Effects of posture on the respiratory mechanics of the chick embryo. Journal of Experimental Zoology. 293 (5), 450-455 (2002).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Yamamoto, F. Y., Neto, F. F., Freitas, P. F., Oliveira Ribeiro, C. A., Ortolani-Machado, C. F. Cadmium effects on early development of chick embryos. Environmental Toxicology and Pharmacology. 34 (2), 548-555 (2012).
- Lv, N., et al. The roles of bone morphogenetic protein 2 in perfluorooctanoic acid induced developmental cardiotoxicity and l-carnitine mediated protection. Toxicology and Applied Pharmacology. 352, 68-76 (2018).
- Kmecick, M., Vieira da Costa, M. C., Oliveria Ribeiro, C. A., Ortolani-Machado, C. F. Morphological evidence of neurotoxic effects in chicken embryos after exposure to perfluorooctanoic acid (PFOA) and inorganic cadmium. Toxicology. 4227, 152286(2019).
- Jiang, Q., Lust, R. M., Strynar, M. J., Dagnino, S., DeWitt, J. C. Perflurooctanoic acid induces developmental cardiotoxicity in chicken embryos and hatchlings. Toxicology. 293 (1-3), 97-106 (2012).
- Jiang, Q., et al. In ovo very early-in-life exposure to diesel exhaust induced cardiopulmonary toxicity in a hatchling chick model. Environmental Pollution. 264, 114718(2020).
- Jiang, Q., Lust, R. M., DeWitt, J. C. Perfluorooctanoic acid induced-developmental cardiotoxicity: are peroxisome proliferator activated receptor alpha (PPARalpha) and bone morphorgenic protein 2 (BMP2) pathways involved. Journal of Toxicology and Environmental Health, Part A. 76 (11), 635-650 (2013).
- Jiang, Q., et al. Changes in the levels of l-carnitine, acetyl-l-carnitine and propionyl-l-carnitine are involved in perfluorooctanoic acid induced developmental cardiotoxicity in chicken embryo. Environmental Toxicology and Pharmacology. 48, 116-124 (2016).
- Zhao, M., et al. The role of PPAR alpha in perfluorooctanoic acid induced developmental cardiotoxicity and l-carnitine mediated protection-Results of in ovo gene silencing. Environmental Toxicology and Pharmacology. 56, 136-144 (2017).
- Jiang, Q., et al. Particulate Matter 2.5 Induced Developmental Cardiotoxicity in Chicken Embryo and Hatchling. Front Pharmacol. 11, 841(2020).
- Molina, E. D., et al. Effects of air cell injection of perfluorooctane sulfonate before incubation on development of the white leghorn chicken (Gallus domesticus) embryo. Environmental Toxicology and Chemistry. 25 (1), 227-232 (2006).
- Crump, D., Chiu, S., Williams, K. L. Bis-(3-allyl-4-hydroxyphenyl) sulfone decreases embryonic viability and alters hepatic mRNA expression at two distinct developmental stages in chicken embryos exposed via egg injection. Environmental Toxicology and Chemistry. 37 (2), 530-537 (2018).
- Franci, C. D., et al. Potency of polycyclic aromatic hydrocarbons in chicken and Japanese quail embryos. Environmental Toxicology and Chemistry. 37 (6), 1556-1564 (2018).
- Rand, M. D., et al. Developmental exposure to methylmercury and resultant muscle mercury accumulation and adult motor deficits in mice. Neurotoxicology. 81, 1-10 (2020).
- Tanaka, T., Suzuki, T., Inomata, A., Moriyasu, T. Combined effects of maternal exposure to fungicides on behavioral development in F1 -generation mice: 2. Fixed-dose study of thiabendazole. Birth Defects Research. , (2020).
- Kofman, O., Lan, A., Raykin, E., Zega, K., Brodski, C. Developmental and social deficits and enhanced sensitivity to prenatal chlorpyrifos in PON1-/- mouse pups and adults. PLoS One. 15 (9), 0239738(2020).
- Kischel, A., Audouard, C., Fawal, M. A., Davy, A. Ephrin-B2 paces neuronal production in the developing neocortex. BMC Developmental Biology. 20 (1), 12(2020).
- Okolo, F., Zhang, G., Rhodes, J., Gittes, G. K., Potoka, D. A. Intra-Amniotic Sildenafil Treatment Promotes Lung Growth and Attenuates Vascular Remodeling in an Experimental Model of Congenital Diaphragmatic Hernia. Fetal Diagnosis and Therapy. , 1-13 (2020).
- Vyslouzil, J., et al. Subchronic continuous inhalation exposure to zinc oxide nanoparticles induces pulmonary cell response in mice. Journal of Trace Elements in Medicine and Biology. 61, 126511(2020).
- Wahle, T., et al. Evaluation of neurological effects of cerium dioxide nanoparticles doped with different amounts of zirconium following inhalation exposure in mouse models of Alzheimer's and vascular disease. Neurochemistry International. 138, 104755(2020).
- Tanabe, K. Three-Dimensional Echocardiography- Role in Clinical Practice and Future Directions. Circ J. 84 (7), 1047-1054 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
ISSN 2578-2746
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.
