Method Article
Utilizzo dell'embrione di pollo come potente strumento nella valutazione delle cardiotossicità dello sviluppo
In questo articolo
Riepilogo
Gli embrioni di pollo, come modello di sviluppo classico, vengono utilizzati nel nostro laboratorio per valutare le cardiotossicità dello sviluppo a seguito dell'esposizione a vari contaminanti ambientali. I metodi di esposizione e i metodi di valutazione morfologica/funzionale stabiliti sono descritti in questo manoscritto.
Abstract
Gli embrioni di pollo sono un modello classico negli studi sullo sviluppo. Durante lo sviluppo degli embrioni di pollo, la finestra temporale dello sviluppo del cuore è ben definita ed è relativamente facile ottenere un'esposizione precisa e tempestiva attraverso più metodi. Inoltre, il processo di sviluppo cardiaco negli embrioni di pollo è simile ai mammiferi, risultando anche in un cuore a quattro camere, rendendolo un valido modello alternativo nella valutazione delle cardiotossicità dello sviluppo. Nel nostro laboratorio, il modello dell'embrione di pollo viene utilizzato abitualmente nella valutazione delle cardiotossicità dello sviluppo a seguito dell'esposizione a vari inquinanti ambientali, tra cui sostanze per- e polifluoroalchiliche (PFAS), particolato (PM), gas di scarico diesel (DE) e nano materiali. Il tempo di esposizione può essere liberamente selezionato in base alle necessità, dall'inizio dello sviluppo (giorno embrionale 0, ED0) fino al giorno prima della schiusa. I principali metodi di esposizione includono l'iniezione di cellule aeree, la microiniezione diretta e l'inalazione di cellule aeree (originariamente sviluppate nel nostro laboratorio), e gli endpoint attualmente disponibili includono la funzione cardiaca (elettrocardiografia), la morfologia (valutazioni istologiche) e le valutazioni biologiche molecolari (immunoistochimica, qRT-PCR, western blotting, ecc.). Naturalmente, il modello di embrione di pollo ha i suoi limiti, come la limitata disponibilità di anticorpi. Tuttavia, con più laboratori che iniziano a utilizzare questo modello, può essere utilizzato per dare contributi significativi allo studio delle cardiotossicità dello sviluppo.
Introduzione
L'embrione di pollo è un modello di sviluppo classico, che è stato utilizzato per oltre duecento anni1. Il modello di embrione di pollo ha vari vantaggi rispetto ai modelli tradizionali. Prima di tutto, già oltre 70 anni fa, il normale sviluppo dell'embrione di pollo era stato illustrato molto chiaramente nella guida alla stadiazione Hamburger-Hamilton2, in cui un totale di 46 fasi durante lo sviluppo dell'embrione di pollo sono state definite con precise caratteristiche temporali e morfologiche, facilitando il rilevamento di uno sviluppo anormale. Inoltre, il modello di embrione di pollo ha altre caratteristiche come l'essere relativamente a basso costo e ridondante in quantità, controlli relativamente accurati della dose di esposizione, un sistema indipendente e chiuso all'interno del guscio e una facile manipolazione dell'embrione in via di sviluppo, il che garantisce il suo potenziale per essere utilizzato come un potente modello di valutazione tossicologica.
In cardiotossicità, l'embrione di pollo presenta un cuore a quattro camere, simile ai cuori dei mammiferi ma con pareti più spesse, consentendo valutazioni morfologiche più facili. Inoltre, l'embrione di pollo consente l'esposizione per inalazione dello sviluppo, che non è possibile nei modelli di mammiferi: durante la fase successiva dello sviluppo, l'embrione di pollo passerà dalla respirazione interna alla respirazione esterna (ottenendo ossigeno attraverso il polmone); quest'ultimo richiede che l'embrione penetri nella membrana cellulare dell'aria con il becco e inizi a respirare aria3, rendendo la cellula aerea una mini-camera di inalazione. Utilizzando questo fenomeno, gli effetti tossicologici dei contaminanti gassosi sul cuore (e su altri organi) possono essere valutati senza la necessità di strumenti dedicati alla camera di inalazione.
In questo manoscritto sono descritti diversi metodi di valutazione dell'esposizione / endpoint, che servono a rendere l'embrione di pollo un potente strumento nella valutazione della cardiotossicità dello sviluppo a seguito dell'esposizione a contaminanti ambientali.
Protocollo
Tutte le procedure descritte sono state approvate dall'Institutional Animal Care and Use Committee (IACUC) dell'Università di Qingdao. Nel nostro laboratorio, le uova sono state incubate in due incubatrici. Le uova sono state tenute in posizione verticale nell'incubatrice e posizionate casualmente sugli scaffali. Le condizioni di incubazione per le uova erano le seguenti: la temperatura di incubazione è iniziata a 37,9 °C e gradualmente è diminuita a 37,1 °C man mano che procedeva l'incubazione; l'umidità è iniziata al 50% e gradualmente è aumentata fino al 70%.
1. Metodi di esposizione
NOTA: L'esposizione di contaminanti ambientali agli embrioni di pollo può essere ottenuta in diversi modi. In questa sezione vengono descritti in dettaglio tre metodi utilizzati di routine.
- Iniezione di cellule d'aria (Figura 1)
NOTA: Questo è il metodo classico di esposizione agli embrioni di pollo4,5,6,adatto a una vasta gamma di materiali, e può essere eseguito in una finestra temporale molto ampia, dall'inizio dello sviluppo (giorno embrionale zero, ED0) fino al giorno prima della schiusa (ED20). L'olio di girasole viene utilizzato come veicolo. Studi precedenti hanno dimostrato che non sono stati osservati cambiamenti significativi nella mortalità, nella schiudibilità o nel peso corporeo tra embrioni non trattati ed embrioni iniettati con olio di girasole7.- Preparare i seguenti reagenti / strumenti necessari: etanolo al 75%, carta velina, sonda metallica (può sostituire con qualsiasi ago / bastone / punteruolo in metallo affilato), paraffina fusa, pennello, soluzione di ioduro di povidone, pipetta, punte per pipette, lampada di candling, miscela dosante. Preparare la miscela dosante con olio di semi di girasole (consigliato)4. Per utilizzare altri diluenti, eseguire il controllo del veicolo (rispetto agli embrioni non trattati).
- Pulire la superficie delle uova con la soluzione di ioduro di povidone (soluzione di ioduro di povidone disponibile in commercio 1:5 diluita con acqua deionizzata) e asciugare il guscio d'uovo con carta velina senza strofinare. Lo scrubbing romperà lo strato protettivo che ricopre l'esterno del guscio.
- Candela le uova in una stanza buia e segna la cella d'aria con la matita. Escludere le uova con crepe sul guscio. Escludere le uova con celle d'aria sul lato invece della punta smussata, poiché è altamente improbabile che si schiudano normalmente.
- Disinfettare l'area della cella d'aria con etanolo al 75% e quindi praticare un piccolo foro al centro dell'area della cella d'aria con la sonda metallica. Non infilare la sonda in profondità nella cella d'aria o la membrana interna potrebbe essere danneggiata, invece, rompere solo il guscio con la punta della sonda. Se il foro non è abbastanza grande da adattarsi a una punta di pipetta fine, rompere nuovamente il guscio in prossimità del foro esistente, fino a quando il foro non è abbastanza grande da consentire l'inserimento della punta della pipetta da 10 μL.
- Vorticosamente la miscela dosante vigorosamente e aspira immediatamente la soluzione sulla punta della pipetta. Il volume di iniezione raccomandato è di 1 μL per 10 grammi di uovo (ad esempio, 5 μL di volume di iniezione per un uovo da 50 grammi) poiché volumi di iniezione maggiori possono creare condizioni ipossiche o anosseche per l'embrione in via di sviluppo. Calcolare la concentrazione della soluzione dosatrice per la dose desiderata di mg/kg di uovo.
- Inserire la punta della pipetta nel foro, con la punta che tocca la membrana interna. Espellere lentamente la miscela dosatrice, tenere premuto per almeno dieci secondi (lasciare che l'olio viscoso sia completamente erogato), quindi rimuovere la punta.
- Sigillare il foro con un pennello e una goccia di paraffina fusa. Fare attenzione a non gocciolare paraffina fusa sulla membrana interna.
- Una volta sigillate, mettere le uova nell'incubatrice fino a raggiungere lo stadio embrionale desiderato. Sugli embrioni già in via di sviluppo, eseguire l'intero processo il prima possibile per prevenire la potenziale perdita di embrioni a causa delle basse temperature ambientali.
- Microiniezione (Figura 2)
NOTA: Questo è un metodo di esposizione più diretto, con conseguente esposizione definitiva alla sostanza di interesse, e particolarmente adatto per composti con una breve durata d'azione (ad esempio, lentivirus), poiché l'iniezione classica di cellule aeree richiede tempo affinché i composti penetrino nella membrana interna. Questo metodo può anche essere provato se non è possibile ottenere risultati soddisfacenti con l'iniezione di cellule aeree. Questo metodo è più adatto per gli embrioni precoci (fino a ED2), ma può anche essere eseguito su embrioni più anziani (con maggiore rischio di perdita di embrioni).- Preparare i seguenti reagenti / strumenti necessari: etanolo al 75%, soluzione di ioduro di povidone, microiniettore (5 μL), sonda metallica (può sostituire con qualsiasi ago / bastone / punteruolo metallico affilato dovrebbe funzionare), pinna fine, nastro. Preparare la miscela dosante con soluzione salina sterile, che funge anche da controllo dell'iniezione senza influire in modo significativo sulla schiudibilità. Garantire la sterilità della soluzione salina, poiché un'iniezione contaminata aumenterà drasticamente la mortalità.
- Pulire le uova come descritto al 1.1.2.
- Candele le uova come descritto al 1.1.3.
- Disinfettare l'area della cella d'aria con etanolo al 75% e quindi praticare un piccolo foro al centro dell'area della cella d'aria con la sonda metallica. Non infilare la sonda in profondità nella cella d'aria o la membrana interna potrebbe essere danneggiata, invece, rompere solo il guscio con la punta della sonda. Quindi utilizzare la pinica fine per allargare con cura il foro fino a quando il diametro è di circa 2 mm, consentendo la conferma visiva della membrana interna.
- Caricare la soluzione nel microiniettore (volume massimo di iniezione: 0,5 μL/10 g di uovo. (ad esempio, 2,5 μL per un uovo da 50 g) e inserire con attenzione l'ago attraverso il foro nella membrana interna per circa 2-3 mm. Erogare delicatamente la soluzione e rimuovere l'ago. Tenere l'ago il più perpendicolare possibile alla membrana.
- Sigillare il foro con un piccolo pezzo di nastro. Coprire completamente il foro per prevenire la disidratazione e la morte dell'embrione durante la successiva incubazione. Tuttavia, evitare pezzi di nastro troppo grandi per prevenire l'ipossia.
- Una volta sigillate, mettere le uova nell'incubatrice fino a raggiungere lo stadio embrionale desiderato. Sugli embrioni già in via di sviluppo, eseguire l'intero processo il prima possibile per prevenire la potenziale perdita di embrioni a causa della bassa temperatura ambientale.
- Inalazione di cellule d'aria (Figura 3)
NOTA: Questo è un nuovo metodo di inalazione che sfrutta la cellula aerea, da cui l'embrione di pollo in fase avanzata inizierà a respirare aria. È adatto per esposizioni a gas o aerosol e può ottenere esposizioni per inalazione molto precoci nella vita e riempire i polmoni con il gas / aerosol target quando si aprono per la prima volta nella vita.- Preparare i seguenti reagenti / strumenti necessari: sacchetto di campionamento (sacchetto PVF, per la conservazione del campione di gas / aerosol prima dell'esposizione), ago del catetere, siringa, sonda metallica (può sostituire con qualsiasi ago / bastone / punteruolo metallico affilato dovrebbe funzionare), nastro, cappa aspirante.
- Pulire le uova come descritto al punto 1.1.2 e candele come descritto al punto 1.1.3 (non è necessario contrassegnare le cellule d'aria prima dell'incubazione), quindi incubare le uova senza trattamento fino a ED17.
- Candela le uova a ED17 per contrassegnare l'area della cella d'aria.
- A ED18, eseggia un uovo dall'incubatrice, disinfetta l'area della cella d'aria con il 75% di etanolo e quindi pratica con attenzione due piccoli fori su due lati della cella d'aria. Uno è per l'iniezione di gas / aerosol, l'altro è per l'espulsione di aria. Controllare attentamente la dimensione dei fori in modo che la dimensione del foro di iniezione sia appena sufficiente per l'inserimento dell'ago del catetere, mentre il diametro del foro di espulsione è un po 'più grande (circa 1 mm).
- Iniettare delicatamente 10 mL di gas/aerosol bersaglio dal foro di iniezione con una siringa attaccata all'ago del catetere. Iniettare aria per un gruppo di controllo per inalazione, che non dovrebbe avere differenze significative rispetto a un gruppo di controllo negativo8. Applicare una pressione contro l'ago del catetere (con una quantità appropriata di pressione l'ago elastico può essere spinto contro il guscio) per ridurre al minimo la perdita dal foro di iniezione. Sigillare entrambi i fori immediatamente con del nastro adesivo e riportare l'uovo all'incubatrice.
NOTA: Questa procedura deve essere eseguita in una cappa aspirante per impedire l'inalazione di gas/aerosol da parte dell'operatore. - Ripetere la procedura descritta dopo un'ora per assicurarsi ulteriormente che l'intera cella d'aria sia riempita con gas/aerosol target (opzionale).
- Ripetere nuovamente la procedura descritta in ED19 (facoltativo). Ripetere l'esposizione aiuta a garantire un'esposizione costante fino alla schiusa. Registrare il tempo di schiusa per una stima approssimativa della durata dell'esposizione.
- Una volta che le esposizioni desiderate sono state eseguite e sigillate, posizionare le uova nell'incubatrice per la schiusa. Ridurre al minimo il tempo che l'uovo trascorre al di fuori dell'incubatrice per evitare la morte a causa della bassa temperatura ambientale.
2. Metodi di valutazione degli endpoint
NOTA: A seguito dell'esposizione di contaminanti di interesse all'embrione in via di sviluppo, possono essere valutati diversi parametri di tossicità, tra cui la cardiotossicità. In questa sezione vengono descritti in dettaglio due metodi specifici utilizzati di frequente.
- Elettrocardiografia (Figura 4)
NOTA: È impossibile eseguire l'elettrocardiografia non invasiva nei polli da cova a causa della presenza di piume. Pertanto, l'impianto sottocutaneo di elettrodi è essenziale, richiedendo anestesia. La dose utilizzata in laboratorio è di 33 mg/kg di pentobarbital tramite iniezione intraperitoneale (alcuni polli possono richiedere un aumento della dose fino al 50%). Questo metodo si tradurrà in un'elettrocardiografia stabile in oltre il 90% degli animali, consentendo l'analisi della frequenza cardiaca.- Preparare i seguenti reagenti/strumenti necessari: soluzione di pentobarbital all'1% (10 mg/ml) in soluzione salina, siringa, bilancio elettrico, riscaldatore (se necessario), uno strumento di elettrocardiografia collegato (ad esempio, BL-420E+) con elettrodi metallici ad ago a due canali.
- Pesare i polli con una bilancia e calcolare il volume necessario di soluzione di pentobarbital e iniettare i polli. Per un pollo che pesa 30 g, sono necessari 0,1 ml di soluzione di pentobarbital. Assicurarsi che l'iniezione venga eseguita sul lato laterale dell'addome, poiché il tuorlo si trova al centro e l'iniezione potrebbe non essere efficace.
- Attendere che i polli iniettati siano anestetizzati (tenere il pollo in mano, se il collo non ha tensione e la testa può essere ruotata liberamente, l'anestesia è sufficiente). Posizionare i polli sul tavolo operatorio (i riscaldatori sono necessari se la temperatura ambiente è inferiore a 20 °C).
- Inserire due elettrodi ad ago da due lati dell'addome, per via sottocutanea. Assicurarsi che gli aghi non entrino nella cavità addominale sollevando un po 'la pelle e inserendo l'ago da lì. Una volta inserito, spingere con attenzione l'ago in avanti fino a raggiungere il lato della cavità toracica. Assicurarsi che l'ago non vada in profondità nel corpo o scuota dalla pelle.
- Effettuare le misurazioni con lo strumento di elettrocardiografia. Possono essere utilizzati altri strumenti simili in grado di elettrocardiografia.
- Se i polli devono essere sacrificati, eseguire l'eutanasia dopo l'elettrocardiografia poiché sono già in anestesia. Se i polli devono sopravvivere, rimetterli nelle loro gabbie e riscaldarli fino al risveglio. Restituirli all'incubatore è un'altra opzione.
- Istomorfometria (Figura 5)
NOTA: Viene sviluppato un metodo specifico per valutare lo spessore della parete ventricolare destra nelle sezioni trasversali del cuore. La valutazione morfologica della dimensione del ventricolo destro tramite ecocardiografia non è accurata al 100% a causa della forma irregolare del ventricolo destro e questo metodo può servire come un buon supplemento nelle valutazioni morfologiche per il ventricolo destro.- Preparare i seguenti reagenti/strumenti necessari: formaldeide tamponata con fosfato al 4%, lama affilata, soluzione salina tamponata con fosfato, carta assorbente, bilancio elettrico, piccole forbici, agenti di lavorazione istologica generale (etanolo graduato, xilene, paraffina).
- Una volta che gli animali vengono sacrificati, usa l'acqua per bagnare le piume. Questo per ridurre al minimo la potenziale contaminazione dovuta alle piume volanti durante l'apertura del torace.
- Aprire la cavità toracica con attenzione senza danneggiare il cuore. Utilizzare piccole forbici per tagliare la vascolarizzazione e rimuovere delicatamente il cuore dalla cavità toracica. Lasciare un piccolo pezzo (circa 1-2 mm) di vascolarizzazione attaccato al cuore in quanto ciò può essere conveniente per la successiva manipolazione del cuore senza danneggiare il cuore.
- Una volta rimosso, sciacquare il cuore in soluzione salina tamponata con fosfato freddo per rimuovere il sangue e rilassare il muscolo. Quindi immergere il cuore su carta assorbente prima di pesare per una lettura accurata del peso. Mettere il cuore in un fissativo di volume 10x (formaldeide tamponata con fosfato al 4%) per 24 ore a temperatura ambiente. I tessuti fissi possono essere successivamente trasformati in blocchi di paraffina o conservati a 4 °C per anni (non raccomandato se è prevista l'immunoistochimica).
- Prima di incorporare, tagliare i tessuti a circa il 60% di lunghezza del conteggio del cuore dall'apice (Figura 5A), per facilitare la successiva elaborazione. Una lama microtomatica è consigliata per un taglio pulito rapido e verticale. Per i polli di età superiore a un giorno, effettuare un altro taglio a circa il 25-30% di lunghezza dall'apice per facilitare la penetrazione della paraffina e per consentire al tessuto di adattarsi alle cassette di tessuto.
- Elaborare i tessuti con le seguenti condizioni (regolare secondo necessità): 70% di etanolo per 1 ora, 80% di etanolo per 1 ora, 95% di etanolo per 1 ora x2, 100% di etanolo per 30 min x2, xilene per 5 min x2, paraffina (punto di fusione 52-54 °C) per 1,5 h, paraffina (punto di fusione 62-64 °C) per 1 ora, quindi incorporare i tessuti in una miscela 3:1 di paraffina (punto di fusione 62-64 °C) e paraffina (punto di fusione 52-54 °C).
- Seziona il tessuto a 6 μm di spessore. Mantenere con attenzione posizioni relative identiche delle sezioni trasversali confermando la presenza e le dimensioni di un punto di riferimento anatomico (trabecola settomarginale) nel ventricolo destro. Confermare un punto di riferimento con lunghezza moderata su ogni sezione (Figura 5B, freccia).
- Crea due righelli elettronici con programmatore Logo: il righello 1 è una linea retta con 7 linee di misura del raggio attaccate al punto centrale, con 22,5 ° tra due linee di misura adiacenti. Il righello 2 è solo due linee perpendicolari a forma di T (Figura 5B).
- Misura con due programmi software: Adobe Photoshop e ImageJ.
- In Photoshop, ridimensionate il righello 1 (NO rimodellamento) per posizionare le due estremità del righello sulle due estremità della parete ventricolare destra libera, in modo che le sette linee di misura sul righello 1 incontrino ciascuna la parete ventricolare destra interna. Quindi utilizzare il righello 2 per effettuare misurazioni perpendicolari dalla parete ventricolare interna a quella esterna (Figura 5B).
- Usa ImageJ per effettuare le sette misurazioni per ogni cuore.
- A seconda delle esigenze specifiche, analizzare le sette misurazioni o la media per uno spessore rappresentativo della parete ventricolare destra. Normalizzarsi a peso cardiaco intero per specifici cambiamenti di spessore della parete ventricolare.
Risultati
Risultati dell'esposizione
Iniezione di celle d'aria
L'iniezione di cellule aeree può esporre efficacemente lo sviluppo di embrioni di pollo a vari agenti, che possono essere successivamente rilevati nei campioni raccolti (siero, tessuto, ecc.) di embrioni / polli da cova. Ecco un esempio, in cui l'acido perfluoroottonico (PFOA) è stato iniettato da cellule d'aria e le concentrazioni sieriche di PFOA sono state quindi determinate con cromatografia liquida ad alte prestazioni-spettrometria di massa. Le concentrazioni sieriche corrispondevano alle dosi iniettate, indicando l'efficacia di questa procedura (Figura 6).
Microiniezione
La microiniezione può esporre gli embrioni in via di sviluppo ad agenti che potrebbero non penetrare efficacemente nella membrana interna o con una breve durata d'azione, come il lentivirus. Ecco un esempio, in cui il lentivirus è stato iniettato al secondo giorno embrionale con questo metodo e quindi è stata osservata una significativa fluorescenza verde nel cuore degli embrioni embrionali del giorno 15, indicando l'efficacia della trasfezione del lentivirus (Figura 7).
Infusione di cellule d'aria
L'infusione di cellule aeree è un metodo nuovo, che può funzionare molto bene per piccole quantità di esposizione per inalazione di gas / aerosol durante la fase iniziale della respirazione esterna. Ecco un esempio, in cui lo scarico diesel è stato infuso nelle cellule dell'aria nei giorni embrionali 18 e 19, con conseguenti significativi cambiamenti fibrotici nei tessuti cardiaci e polmonari (Figura 8).
Risultati della valutazione degli endpoint
Risultati elettrocardiografia
A causa della limitazione di due elettrodi, possono essere mostrati solo 3 canali di elettrocardiografia. Ma sono sufficienti per distinguere le onde r, quindi possono essere utilizzate per valutazioni funzionali. In un esempio di vita reale, l'elettrocardiografia dei polli esposti ai gas di scarico diesel ha indicato un intervallo R-R significativamente ridotto, indicando cambiamenti funzionali (Figura 9).
Risultati istopatologici
Il nostro metodo di valutazione dello spessore della parete ventricolare destra è stato utilizzato con successo in diversi studi5,7,8,9,10,11,12. In uno dei nostri studi precedenti, l'esposizione ai gas di scarico diesel ha provocato un ispessimento della parete ventricolare destra (Figura 10).

Figura 1: Dimostrazione dell'iniezione di cellule d'aria. Un uovo fertile non sviluppato è mostrato nella foto, ma gli embrioni in tutte le diverse fasi possono essere esposti con questo metodo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Dimostrazione di microiniezione. Un embrione precoce è mostrato nell'immagine, che è il punto di tempo di esposizione preferito per questo metodo, ma possono anche essere provati altri punti temporali. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Dimostrazione dell'infusione di cellule pneumatiche. Un embrione in fase avanzata sottoposto a pipping interno è mostrato nell'immagine, che è il punto di tempo di esposizione preferito per questo metodo. Sono state mostrate quattro fasi dell'operazione. 1: Embrione intatto. 2: Sono stati fatti due fori. 3: L'infusione viene eseguita. Il sacchetto di campionamento PVF è mostrato anche in basso a sinistra. 4: L'infusione è finita, i fori sigillati con del nastro adesivo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Dimostrazione di elettrocardiografia. Il pannello in alto a sinistra ha mostrato come un pollo da cova è stato anestetizzato e sottoposto a misurazione elettrocardiografica. Il pannello in alto a destra mostra lo strumento di elettrocardiografia con gli elettrodi collegati. Il pannello inferiore mostra un'elettrocardiografia rappresentativa acquisita dai polli. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Dimostrazione della valutazione istopatologica dello spessore della parete ventricolare destra (colorazione di ematossilina ed eosina). (A) Dimostrazione della posizione di taglio dei cuori di pollo prima dell'incorporamento. (B) Dimostrazione della giusta misurazione dello spessore della parete ventricolare. Le barre di scala rappresentano 1000 μm. I cerchi blu mostrano i sette punti di misurazione sulla parete ventricolare interna destra. Il cerchio rosso mostra un punto di misurazione sulla parete ventricolare esterna destra. Arrow mostra il punto di riferimento anatomico per la posizione appropriata della sezione trasversale. Questa cifra è stata modificata da Jiang et al. Tossicologia. 293 (1-3), 97-106 (2012)7. Fare clic qui per visualizzare una versione più grande di questa figura.
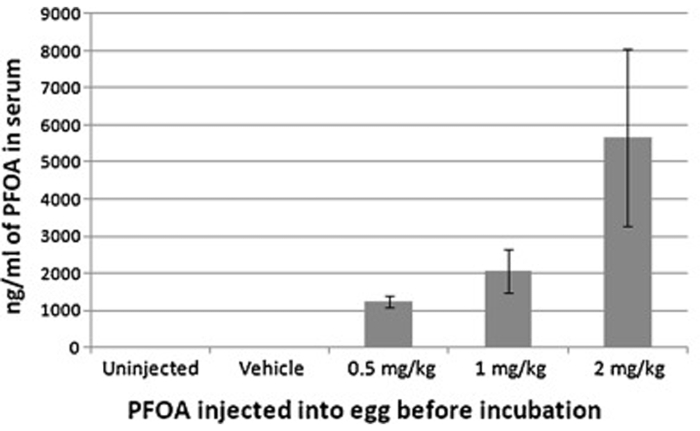
Figura 6: Concentrazione sierica di acido perfluoroottanolo da polli da cova dopo iniezione di cellule pneumatiche con 0, 0,5, 1 o 2 mg/uovo kg di acido perfluoroottanoico prima dell'incubazione. Le concentrazioni sieriche risultanti corrispondevano alle dosi iniettate, indicando l'efficacia dell'iniezione di cellule dell'aria. Questa cifra è stata modificata da Jiang et al. Tossicologia. 293 (1-3), 97-106 (2012)7. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Dimostrazione dell'efficacia della trasfezione da lentivirus dopo l'esposizione alla microiniezione (osservazione diretta dopo crio-sezionamento). I pannelli di sinistra mostravano immagini di campi luminosi, mentre i pannelli di destra mostravano fluorescenza verde per le stesse sezioni di tessuto. Gli embrioni embrionali di pollo del secondo giorno sono stati iniettati con lentivirus o controllo, e poi incubati fino al giorno embrionale 15. I cuori erano congelati e visualizzati direttamente al microscopio fluorescente. (A) Gruppo di controllo, era presente poca fluorescenza verde. (B) Gruppo esposto a lentivirus, è stata osservata una significativa fluorescenza verde, che indica l'efficacia della trasfezione da lentivirus dopo microiniezione. Le barre di scala rappresentano 125 μm. Questa cifra è stata modificata da Zhao et al. Tossicologia ambientale e farmacologia. 56, 136-144 (2017)11. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Dimostrazione dell'efficacia dell'infusione di cellule pneumatiche. Gli embrioni di pollo sono stati infusi con gas di scarico diesel ai giorni embrionali 18 e 19, e poi i polli schiusi sono stati tenuti per 0, 1 o 2 settimane e poi sacrificati. I tessuti cardiaci sono stati valutati con la colorazione Masson Trichrome per le lesioni fibrotiche. Le frecce hanno mostrato le lesioni fibrotiche (colorazione blu). *: statisticamente diverso dal controllo (P<0,05 dall'analisi della varianza e test di differenza meno significativi). Le barre di scala rappresentano 150 μm. Questa cifra è stata modificata da Jiang et al. Inquinamento ambientale. 264, 114718 (2020)8. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9: Dimostrazione dell'efficacia dell'elettrocardiografia. Gli embrioni di pollo sono stati infusi con gas di scarico diesel ai giorni embrionali 18 e 19, quindi i polli schiusi sono stati tenuti per 0, 1 o 2 settimane e quindi è stata eseguita l'elettrocardiografia. Intervalli R-R significativamente ridotti sono stati osservati nei polli esposti allo scarico diesel tramite infusione di celle d'aria, indicando l'efficacia del metodo. *: statisticamente diverso dal controllo (P<0,05 dall'analisi della varianza e test di differenza meno significativi). Questa cifra è stata modificata da Jiang et al. Inquinamento ambientale. 264, 114718 (20208. Fare clic qui per visualizzare una versione più grande di questa figura.
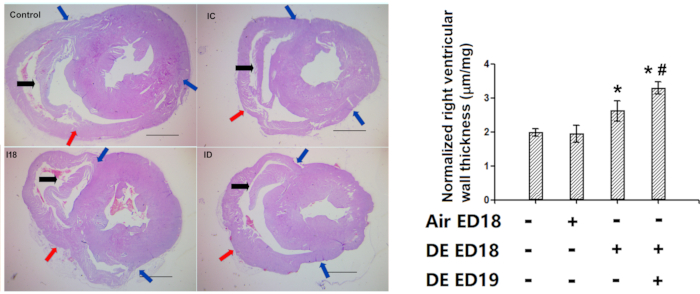
Figura 10: Dimostrazione dell'efficacia della misurazione dello spessore della parete ventricolare destra (colorazione di ematossilina ed eosina). Gli embrioni di pollo sono stati infusi con gas di scarico diesel ai giorni embrionali 18 e 19, quindi i polli schiusi sono stati tenuti per 1 settimana, quindi è stata eseguita la valutazione istologica dello spessore della parete ventricolare destra. R: Immagini rappresentative delle sezioni trasversali del cuore. Si noti la presenza di marcatori anatomici in tutti i ventricoli giusti (nei polli più anziani, il marcatore tende ad essere un po 'più lungo nella posizione desiderata, il che non influisce sull'accuratezza delle misurazioni). B: Quantificazione dello spessore della parete ventricolare destra, che è stata prima convertita in lunghezza effettiva con vetrini standard, e poi normalizzata con peso a cuore intero, quindi sono stati rappresentati sotto forma di um / ug. Frecce blu: due estremità della parete ventricolare destra libera. Frecce rosse: i punti centrali della parete ventricolare destra. Frecce nere: marcatore anatomico. *: statisticamente diverso dal controllo (P<0,05 dall'analisi della varianza e test di differenza meno significativi). Le barre di scala rappresentano 1000 μm. Questa cifra è stata modificata da Jiang et al. Inquinamento ambientale. 264, 114718 (2020)8. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
L'embrione di pollo è stato un modello classico negli studi sullo sviluppo per 200 anni1. I nostri metodi presentati in questo manoscritto sono stati utilizzati nella valutazione di diversi contaminanti ambientali, tra cui acido perfluoroottanoico, particolato e gas di scarico diesel con successo5,7,8,9,10,11,12. Con questi metodi, la cardiotossicità dello sviluppo è stata indicata in modo economico e chiaro. Inoltre, non è difficile esporre embrioni di pollo con altri composti di interesse e valutare la potenziale cardiotossicità dello sviluppo.
Il metodo di iniezione di cellule aeree è un metodo classico utilizzato in precedenza in molti studi13,14,15,che è conveniente ed efficace. Rispetto ad altri metodi di esposizione allo sviluppo, come i modellidi roditori 16,17,18,presenta un'esposizione diretta in un sistema chiuso, che riduce notevolmente le variabilità dovute agli effetti materni e all'escrezione varia. La microiniezione è un miglioramento del metodo di iniezione delle cellule aeree, che garantisce l'esposizione definitiva su o in prossimità dello sviluppo dell'embrione precoce, che può ottenere effetti simili a quelli delle iniezioni in utero nei modellidi roditori 19,20. Rispetto alle iniezioni in utero, il nostro metodo consente la conferma visiva dell'iniezione con passaggi di manipolazione relativamente facili e l'iniezione accurata è facilmente raggiungibile controllando il peso dell'uovo, che non è possibile nell'iniezione in utero, dove la quantità e il peso effettivi degli embrioni non sono facilmente acquisibili. Il metodo di infusione è principalmente per la valutazione degli agenti inalati sul sistema polmonare, ma la cardiotossicità e la tossicità polmonare spesso coesistono. Questo metodo sfrutta la cella d'aria, in cui viene infusa una piccola quantità di gas o aerosol, consentendo l'inalazione continua di gas/aerosol senza la necessità di specifiche camere di inalazione. I modelli di roditori di controparte devono utilizzare quantità relativamente grandi di gas / aerosol e strumenti di inalazione grandi e costosi21,22.
I due endpoint testati di routine nel nostro laboratorio, l'elettrocardiografia e la valutazione istomorfometrica dello spessore della parete ventricolare destra, rappresentano rispettivamente i cambiamenti funzionali e morfologici a seguito dell'esposizione a sostanze tossiche. La valutazione dello spessore della parete ventricolare destra ha vantaggi specifici nell'ottenere una comprensione completa della parete ventricolare destra, poiché la tradizionale valutazione basata sull'ecocardiografia sul ventricolo destro è solitamente impegnativa e non molto accurata, a causa della forma asimmetrica e complessa a mezzaluna del ventricolo destro23. Il nostro metodo può aiutare a superare questa imprecisione integrando con ulteriori informazioni sullo spessore della parete ventricolare destra in una posizione rappresentativa. Attualmente è tutto manuale, in futuro le misurazioni potranno essere effettuate automaticamente e il numero di punti di misura potrà essere aumentato notevolmente, migliorando ulteriormente l'accuratezza di questo metodo.
I modelli di sviluppo basati sull'embrione di pollo presentano diversi vantaggi negli studi tossicologici, come la capacità di fornire una dose di esposizione relativamente accurata, un sistema di esposizione indipendente all'interno del guscio e una facile manipolazione dell'embrione in via di sviluppo. Per quanto riguarda la cardiotossicità, i polli hanno cuori relativamente grandi e pareti ventricolari spesse, consentendo facili valutazioni istomorfometriche. Ci sono alcune carenze, come la disponibilità di anticorpi / primer e requisiti di spazio extra per le gabbie rispetto ai roditori se allevano polli dopo la schiusa. Tuttavia, l'embrione di pollo è ancora un buon modello tossicologico alternativo da utilizzare per potenziali valutazioni cardiotossiche per lo sviluppo.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (Grant No. 91643203, 91543208, 81502835).
Materiali
| Name | Company | Catalog Number | Comments |
| 4% phosphate buffered formaldehydefixative | Biosharp, Hefei, China | REF: BL539A | |
| 75% ethanol | Guoyao,Shanghai,China | CAS:64-17-5 | |
| Biosignaling monitor BL-420E+ | Taimeng, Chengdu, China | BL-420E+ | |
| Candling lamp | Zhenwei, Dezhou, China | WZ-001 | |
| Disposable syringe | Zhiyu, Jiangsu, China | ||
| Egg incubator | Keyu,Dezhou, China | KFX | |
| Electrical balance | OHAUS, Shanghai, China | AR 224CN | |
| Electro-thermal incubator | Shenxian, Shanghai, China | DHP-9022 | |
| Ethanol absolute | Guoyao,Shanghai,China | CAS:64-17-5 | |
| Fertile chicken egg | Jianuo, Jining, China | ||
| Hematoxylin and Eosin Staining Kit | Beyotime, Bejing, China | C0105 | |
| Histology paraffin | Aladdin, Shanghai, China | P100928-500g | Melt point 52~54°C |
| Histology paraffin | Aladdin, Shanghai, China | P100936-500g | Melt point 62~64°C |
| IV catheter | KDL, Zhejiang, China | The catheters have to be soft, plastic ones. | |
| Lentivirus | Genechem, Shanghai, China | The lentivirus were individually designed/synthesized by Genechem. | |
| Masson's trichrome staining kit | Solarbio, Beijing, China | G1340 | |
| Metal probe | Jinuotai, Beijing, China | ||
| Microinjector (5 uL) | Anting,Shanghai, China | ||
| Microscope | CAIKON, Shanghai, China | XSP-500 | |
| Microtome | Leica, Germany | HistoCore BIOCUT | |
| Microtome blade | Leica,Germany | Leica 819 | |
| Pentobarbitual sodium | Yitai Technology Co. Ltd., Wuhan, China | CAS: 57-33-0 | |
| Pipetter(10ul) | Sartorius, Germany | ||
| Povidone iodide | Longyuquan, Taian, China | ||
| Scissor | Anqisheng,Suzhou, China | ||
| Sterile saline | Kelun,Chengdu, China | ||
| Sunflower oil | Mighty Jiage, Jiangsu, China | Any commerical sunflower oil for human consumption should work | |
| Tape | M&G, Shanghai, China | ||
| Tedlar PVF Bag (5L) | Delin, Dalian, China | ||
| Vortex mixer | SCILOGEX, Rocky Hill, CT, US | MX-F | |
| Xylene | Guoyao,Shanghai,China | CAS:1330-20-7 |
Riferimenti
- Kain, K. H., et al. The chick embryo as an expanding experimental model for cancer and cardiovascular research. Developmental Dynamics. 243 (2), 216-228 (2014).
- Menna, T. M., Mortola, J. P. Effects of posture on the respiratory mechanics of the chick embryo. Journal of Experimental Zoology. 293 (5), 450-455 (2002).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Yamamoto, F. Y., Neto, F. F., Freitas, P. F., Oliveira Ribeiro, C. A., Ortolani-Machado, C. F. Cadmium effects on early development of chick embryos. Environmental Toxicology and Pharmacology. 34 (2), 548-555 (2012).
- Lv, N., et al. The roles of bone morphogenetic protein 2 in perfluorooctanoic acid induced developmental cardiotoxicity and l-carnitine mediated protection. Toxicology and Applied Pharmacology. 352, 68-76 (2018).
- Kmecick, M., Vieira da Costa, M. C., Oliveria Ribeiro, C. A., Ortolani-Machado, C. F. Morphological evidence of neurotoxic effects in chicken embryos after exposure to perfluorooctanoic acid (PFOA) and inorganic cadmium. Toxicology. 4227, 152286(2019).
- Jiang, Q., Lust, R. M., Strynar, M. J., Dagnino, S., DeWitt, J. C. Perflurooctanoic acid induces developmental cardiotoxicity in chicken embryos and hatchlings. Toxicology. 293 (1-3), 97-106 (2012).
- Jiang, Q., et al. In ovo very early-in-life exposure to diesel exhaust induced cardiopulmonary toxicity in a hatchling chick model. Environmental Pollution. 264, 114718(2020).
- Jiang, Q., Lust, R. M., DeWitt, J. C. Perfluorooctanoic acid induced-developmental cardiotoxicity: are peroxisome proliferator activated receptor alpha (PPARalpha) and bone morphorgenic protein 2 (BMP2) pathways involved. Journal of Toxicology and Environmental Health, Part A. 76 (11), 635-650 (2013).
- Jiang, Q., et al. Changes in the levels of l-carnitine, acetyl-l-carnitine and propionyl-l-carnitine are involved in perfluorooctanoic acid induced developmental cardiotoxicity in chicken embryo. Environmental Toxicology and Pharmacology. 48, 116-124 (2016).
- Zhao, M., et al. The role of PPAR alpha in perfluorooctanoic acid induced developmental cardiotoxicity and l-carnitine mediated protection-Results of in ovo gene silencing. Environmental Toxicology and Pharmacology. 56, 136-144 (2017).
- Jiang, Q., et al. Particulate Matter 2.5 Induced Developmental Cardiotoxicity in Chicken Embryo and Hatchling. Front Pharmacol. 11, 841(2020).
- Molina, E. D., et al. Effects of air cell injection of perfluorooctane sulfonate before incubation on development of the white leghorn chicken (Gallus domesticus) embryo. Environmental Toxicology and Chemistry. 25 (1), 227-232 (2006).
- Crump, D., Chiu, S., Williams, K. L. Bis-(3-allyl-4-hydroxyphenyl) sulfone decreases embryonic viability and alters hepatic mRNA expression at two distinct developmental stages in chicken embryos exposed via egg injection. Environmental Toxicology and Chemistry. 37 (2), 530-537 (2018).
- Franci, C. D., et al. Potency of polycyclic aromatic hydrocarbons in chicken and Japanese quail embryos. Environmental Toxicology and Chemistry. 37 (6), 1556-1564 (2018).
- Rand, M. D., et al. Developmental exposure to methylmercury and resultant muscle mercury accumulation and adult motor deficits in mice. Neurotoxicology. 81, 1-10 (2020).
- Tanaka, T., Suzuki, T., Inomata, A., Moriyasu, T. Combined effects of maternal exposure to fungicides on behavioral development in F1 -generation mice: 2. Fixed-dose study of thiabendazole. Birth Defects Research. , (2020).
- Kofman, O., Lan, A., Raykin, E., Zega, K., Brodski, C. Developmental and social deficits and enhanced sensitivity to prenatal chlorpyrifos in PON1-/- mouse pups and adults. PLoS One. 15 (9), 0239738(2020).
- Kischel, A., Audouard, C., Fawal, M. A., Davy, A. Ephrin-B2 paces neuronal production in the developing neocortex. BMC Developmental Biology. 20 (1), 12(2020).
- Okolo, F., Zhang, G., Rhodes, J., Gittes, G. K., Potoka, D. A. Intra-Amniotic Sildenafil Treatment Promotes Lung Growth and Attenuates Vascular Remodeling in an Experimental Model of Congenital Diaphragmatic Hernia. Fetal Diagnosis and Therapy. , 1-13 (2020).
- Vyslouzil, J., et al. Subchronic continuous inhalation exposure to zinc oxide nanoparticles induces pulmonary cell response in mice. Journal of Trace Elements in Medicine and Biology. 61, 126511(2020).
- Wahle, T., et al. Evaluation of neurological effects of cerium dioxide nanoparticles doped with different amounts of zirconium following inhalation exposure in mouse models of Alzheimer's and vascular disease. Neurochemistry International. 138, 104755(2020).
- Tanabe, K. Three-Dimensional Echocardiography- Role in Clinical Practice and Future Directions. Circ J. 84 (7), 1047-1054 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon