Method Article
Uso del embrión de pollo como una herramienta poderosa en la evaluación de cardiotoxicidades del desarrollo
En este artículo
Resumen
Los embriones de pollo, como modelo de desarrollo clásico, se utilizan en nuestro laboratorio para evaluar las cardiotoxicidades del desarrollo después de la exposición a diversos contaminantes ambientales. Los métodos de exposición y los métodos de evaluación morfológica/funcional establecidos se describen en este manuscrito.
Resumen
Los embriones de pollo son un modelo clásico en los estudios de desarrollo. Durante el desarrollo de embriones de pollo, la ventana de tiempo del desarrollo del corazón está bien definida, y es relativamente fácil lograr una exposición precisa y oportuna a través de múltiples métodos. Además, el proceso de desarrollo del corazón en embriones de pollo es similar al de los mamíferos, lo que también resulta en un corazón de cuatro cámaras, lo que lo convierte en un modelo alternativo valioso en la evaluación de cardiotoxicidades del desarrollo. En nuestro laboratorio, el modelo de embrión de pollo se utiliza rutinariamente en la evaluación de cardiotoxicidades del desarrollo después de la exposición a diversos contaminantes ambientales, incluidas las sustancias perfluoroalquiladas y polifluoroalquiladas (PFAS), las partículas (PM), el escape de diesel (DE) y los nanomateriales. El tiempo de exposición se puede seleccionar libremente en función de la necesidad, desde el comienzo del desarrollo (día embrionario 0, ED0) hasta el día anterior a la eclosión. Los principales métodos de exposición incluyen la inyección de células de aire, microinyección directa e inhalación de células de aire (desarrollada originalmente en nuestro laboratorio), y los puntos finales actualmente disponibles incluyen la función cardíaca (electrocardiografía), la morfología (evaluaciones histológicas) y las evaluaciones biológicas moleculares (inmunohistoquímica, qRT-PCR, western blotting, etc.). Por supuesto, el modelo de embrión de pollo tiene sus propias limitaciones, como la disponibilidad limitada de anticuerpos. Sin embargo, con más laboratorios que comienzan a utilizar este modelo, se puede utilizar para hacer contribuciones significativas al estudio de las cardiotoxicidades del desarrollo.
Introducción
El embrión de pollo es un modelo de desarrollo clásico, que se ha utilizado durante más de doscientos años1. El modelo de embrión de pollo tiene varias ventajas en comparación con los modelos tradicionales. En primer lugar, ya hace más de 70 años, el desarrollo normal del embrión de pollo se había ilustrado muy claramente en la guía de estadificación Hamburger-Hamilton2,en la que se definieron un total de 46 etapas durante el desarrollo embrionario de pollo con tiempo preciso y características morfológicas, facilitando la detección de desarrollo anormal. Además, el modelo de embrión de pollo tiene otras características, como ser relativamente de bajo costo y redundante en cantidad, controles de dosis de exposición relativamente precisos, un sistema independiente y cerrado dentro de la cáscara y una fácil manipulación del embrión en desarrollo, todo lo cual garantiza su potencial para ser utilizado como un poderoso modelo de evaluación toxicológica.
En cardiotoxicidad, el embrión de pollo presenta un corazón de cuatro cámaras, similar a los corazones de mamíferos pero con paredes más gruesas, lo que permite evaluaciones morfológicas más fáciles. Además, el embrión de pollo permite la exposición por inhalación del desarrollo, lo que no es posible en modelos de mamíferos: durante la etapa posterior del desarrollo, el embrión de pollo pasará de la respiración interna a la respiración externa (obteniendo oxígeno a través del pulmón); este último requiere que el embrión penetre en la membrana de la célula de aire con el pico, y comience a respirar aire3,haciendo de la célula de aire una mini cámara de inhalación. Utilizando este fenómeno, los efectos toxicológicos de los contaminantes gaseosos en el corazón (y otros órganos) pueden evaluarse sin la necesidad de instrumentos de cámara de inhalación dedicados.
En este manuscrito, se describen varios métodos de evaluación de la exposición / punto final, todos los cuales sirven para hacer del embrión de pollo una herramienta poderosa en la evaluación de la cardiotoxicidad del desarrollo después de la exposición a contaminantes ambientales.
Protocolo
Todos los procedimientos descritos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Qingdao. En nuestro laboratorio, los huevos se incubaron en dos incubadoras. Los huevos se mantuvieron erguidos en la incubadora y se colocaron al azar en los estantes. Las condiciones de incubación de los huevos fueron las siguientes: la temperatura de incubación comenzó a 37,9 °C y disminuyó gradualmente a 37,1 °C a medida que avanzaba la incubación; la humedad comenzó en el 50% y aumentó gradualmente al 70%.
1. Métodos de exposición
NOTA: La exposición de contaminantes ambientales a embriones de pollo se puede lograr de varias maneras. En esta sección, se describen en detalle tres métodos utilizados habitualmente.
- Inyección de células de aire (Figura 1)
NOTA: Este es el método clásico de exposición a embriones de pollo4,5,6,adecuado para una amplia gama de materiales, y puede realizarse en una ventana de tiempo muy amplia, desde el comienzo del desarrollo (día cero embrionario, ED0) hasta el día anterior a la eclosión (ED20). El aceite de girasol se utiliza como vehículo. Estudios previos han demostrado que no se han observado cambios significativos en la mortalidad, la incubabilidad o el peso corporal entre embriones no tratados y embriones inyectados con aceite de girasol7.- Prepare los siguientes reactivos / herramientas necesarios: etanol al 75%, papel de seda, sonda de metal (puede sustituir con cualquier aguja / palo / punzón de metal afilado), parafina fundida, cepillo, solución de yoduro de povidona, pipeta, puntas de pipeta, lámpara de candling, mezcla de dosificación. Preparar la mezcla dosificadora con aceite de girasol (recomendado)4. Para usar otros diluyentes, realice el control del vehículo (versus embriones no tratados).
- Limpie la superficie de los huevos con solución de yoduro de povidona (solución de yoduro de povidona 1:5 disponible en el comercio diluida con agua desionizada) y seque la cáscara del huevo con papel de seda sin fregar. El fregado romperá la capa protectora que cubre el exterior de la cáscara.
- Vela los huevos en una habitación oscura y marca la celda de aire con lápiz. Excluya los huevos con grietas en la cáscara. Excluya los huevos con células de aire en el costado en lugar de la punta roma, ya que es muy poco probable que eclosionen normalmente.
- Desinfecte el área de la celda de aire con etanol al 75% y luego perfore un pequeño orificio en el centro del área de la celda de aire con la sonda de metal. No pegue la sonda profundamente en la celda de aire o la membrana interna puede dañarse, en su lugar, solo rompa la carcasa con la punta de la sonda. Si el orificio no es lo suficientemente grande como para caber en una punta de pipeta fina, rompa la carcasa nuevamente en las cercanías del orificio existente, hasta que el orificio sea lo suficientemente grande como para permitir la inserción de la punta de pipeta de 10 μL.
- Vórtice la mezcla dosificadora vigorosamente e inmediatamente extraiga la solución a la punta de la pipeta. El volumen de inyección recomendado es de 1 μL por 10 gramos de huevo (por ejemplo, 5 μL de volumen de inyección para un óvulo de 50 gramos), ya que los volúmenes de inyección más grandes pueden crear condiciones hipóxicas o anóxicas para el embrión en desarrollo. Calcule la concentración de la solución dosificadora para la dosis deseada de mg/huevo kg.
- Inserte la punta de la pipeta en el orificio, con la punta tocando la membrana interna. Expulse lentamente la mezcla dosificadora, mantenga durante al menos diez segundos (permita que el aceite viscoso se dispense por completo) y luego retire la punta.
- Selle el orificio con un cepillo y una gota de parafina derretida. Tenga cuidado de no gotear parafina derretida por goteo sobre la membrana interna.
- Una vez sellados, coloque los huevos en la incubadora hasta que alcancen la etapa embrionaria deseada. En embriones ya en desarrollo, realice todo el proceso lo antes posible para prevenir la posible pérdida de embriones debido a las bajas temperaturas ambientales.
- Microinyección (Figura 2)
NOTA: Este es un método de exposición más directo, que resulta en una exposición definitiva a la sustancia de interés, y especialmente adecuado para compuestos con una corta duración de acción (por ejemplo, lentivirus), ya que la inyección clásica de células de aire requiere tiempo para que los compuestos penetren en la membrana interna. Este método también se puede probar si no se pueden lograr resultados satisfactorios mediante la inyección de células de aire. Este método es más adecuado para embriones tempranos (hasta ED2), pero también se puede realizar en embriones más viejos (con mayor riesgo de pérdida de embriones).- Prepare los siguientes reactivos / herramientas necesarios: etanol al 75%, solución de yoduro de povidona, microinyectores (5 μL), sonda de metal (puede sustituir con cualquier aguja / palo / punzón de metal afilado debe funcionar), fórceps finos, cinta. Prepare la mezcla dosificadora con solución salina estéril, que también sirve como control de inyección sin afectar significativamente la incubabilidad. Asegúrese de la esterilidad de la solución salina, ya que una inyección contaminada aumentará drásticamente la mortalidad.
- Limpie los huevos como se describe en el 1.1.2.
- Vela los huevos como se describe en 1.1.3.
- Desinfecte el área de la celda de aire con etanol al 75% y luego perfore un pequeño orificio en el centro del área de la celda de aire con la sonda de metal. No pegue la sonda profundamente en la celda de aire o la membrana interna puede dañarse, en su lugar, solo rompa la carcasa con la punta de la sonda. Luego use las fórceps finas para agrandar cuidadosamente el orificio hasta que el diámetro sea de aproximadamente 2 mm, lo que permite la confirmación visual de la membrana interna.
- Cargue la solución en el microinyector (volumen máximo de inyección: 0,5 μL/10 g de huevo. (por ejemplo, 2,5 μL para un huevo de 50 g) e inserte cuidadosamente la aguja a través del orificio en la membrana interna durante aproximadamente 2-3 mm. Dispense suavemente la solución y retire la aguja. Mantenga la aguja lo más perpendicular posible a la membrana.
- Selle el orificio con un pequeño trozo de cinta. Cubra completamente el orificio para evitar la deshidratación embrionaria y la muerte durante la incubación posterior. Sin embargo, evite los trozos de cinta que son demasiado grandes para prevenir la hipoxia.
- Una vez sellados, coloque los huevos en la incubadora hasta que alcancen la etapa embrionaria deseada. En embriones ya en desarrollo, realice todo el proceso lo antes posible para evitar la posible pérdida de embriones debido a la baja temperatura ambiental.
- Inhalación de células de aire (Figura 3)
NOTA: Este es un nuevo método de inhalación que aprovecha la célula de aire, a partir de la cual el embrión de pollo en etapa tardía comenzará a respirar aire. Es adecuado para exposiciones a gases o aerosoles y puede lograr exposiciones por inhalación muy tempranas en la vida, y llenar los pulmones con el gas / aerosol objetivo cuando se abren por primera vez en la vida.- Prepare los siguientes reactivos / herramientas necesarios: Bolsa de muestreo (bolsa de PVF, para el almacenamiento de la muestra de gas / aerosol antes de la exposición), aguja del catéter, jeringa, sonda de metal (puede sustituir con cualquier aguja / palo / punzón de metal afilado debe funcionar), cinta, campana de humos.
- Limpie los huevos como se describe en 1.1.2 y luego infórmate como se describe en 1.1.3 (no es necesario marcar la celda de aire antes de la incubación), y luego incube los huevos sin tratamiento hasta ED17.
- Vela los huevos en ED17 para marcar el área de la celda de aire.
- En ED18, saque un huevo de la incubadora, desinfecte el área de la celda de aire con etanol al 75% y luego perfore cuidadosamente dos pequeños orificios en dos lados de la celda de aire. Uno es para la inyección de gas / aerosol, el otro es para la expulsión de aire. Controle cuidadosamente el tamaño de los orificios para que el tamaño del orificio de inyección sea suficiente para que se inserte la aguja del catéter, mientras que el diámetro del orificio de expulsión es un poco mayor (aproximadamente 1 mm).
- Inyecte suavemente 10 ml de gas/aerosol objetivo desde el orificio de inyección con una jeringa conectada a la aguja del catéter. Inyectar aire para un grupo de control de inhalación, que no debe tener diferencias significativas con respecto a un grupo de control negativo8. Aplique presión contra la aguja del catéter (con la cantidad adecuada de presión, la aguja elástica se puede empujar contra la carcasa) para minimizar la fuga del orificio de inyección. Selle ambos orificios inmediatamente con cinta adhesiva después y devuelva el huevo a la incubadora.
NOTA: Este procedimiento debe realizarse en una campana extractora de humos para evitar la inhalación de gas/aerosol por parte del operador. - Repita el procedimiento descrito después de una hora para asegurarse de que toda la celda de aire esté llena de gas / aerosol objetivo (opcional).
- Repita de nuevo el procedimiento descrito en ED19 (opcional). Repetir la exposición ayuda a garantizar una exposición constante hasta la eclosión. Registre el tiempo de eclosión para obtener una estimación aproximada de la duración de la exposición.
- Una vez que se hayan realizado y sellado las exposiciones deseadas, coloque los huevos en la incubadora para la eclosión. Minimice el tiempo que el huevo pasa fuera de la incubadora para evitar la muerte por baja temperatura ambiental.
2. Métodos de evaluación de endpoints
NOTA: Después de la exposición de contaminantes de interés para el embrión en desarrollo, se pueden evaluar varios parámetros de toxicidad, incluida la cardiotoxicidad. En esta sección, se describen en detalle dos métodos específicos de uso frecuente.
- Electrocardiografía (Figura 4)
NOTA: Es imposible hacer electrocardiografía no invasiva en pollos recién nacidos debido a la presencia de plumas. Por lo tanto, la implantación subcutánea de electrodos es esencial, requiriendo anestesia. La dosis utilizada en el laboratorio es de 33 mg/kg de pentobarbital mediante inyección intraperitoneal (algunos pollos pueden requerir hasta un aumento de la dosis del 50%). Este método dará como resultado una electrocardiografía estable en más del 90% de los animales, lo que permitirá el análisis de la frecuencia cardíaca.- Prepare los siguientes reactivos/herramientas necesarios: solución de pentobarbital al 1% (10 mg/ml) en solución salina, jeringa, balanza eléctrica, calentador (si es necesario), un instrumento de electrocardiografía conectado (por ejemplo, BL-420E+) con electrodos de aguja metálica de dos canales.
- Pese los pollos con una balanza y calcule el volumen necesario de solución de pentobarbital e inyecte a los pollos. Para un pollo que pesa 30 g, se necesitan 0,1 ml de solución de pentobarbital. Asegúrese de que la inyección se realice en el lado lateral del abdomen, ya que la yema se encuentra en el medio y la inyección puede no ser efectiva.
- Espere hasta que los pollos inyectados sean anestesiados (sostenga el pollo en la mano, si el cuello no tiene tensión y la cabeza se puede balancearse libremente, la anestesia es suficiente). Coloque los pollos en la mesa de operaciones (los calentadores son necesarios si la temperatura ambiente es inferior a 20 ° C).
- Inserte dos electrodos de aguja de dos lados del abdomen, por vía subcutánea. Asegúrese de que las agujas no entren en la cavidad abdominal levantando un poco la piel e insertando la aguja desde allí. Una vez insertada, empuje con cuidado la aguja hacia adelante hasta que llegue al lado de la cavidad torácica. Asegúrese de que la aguja no se adende profundamente en el cuerpo ni sobresalgan de la piel.
- Realice las mediciones con el instrumento de electrocardiografía. Se pueden utilizar otros instrumentos similares capaces de electrocardiografía.
- Si los pollos van a ser sacrificados, realice la eutanasia después de la electrocardiografía ya que ya están bajo anestesia. Si los pollos van a sobrevivir, colóquelos de nuevo en sus jaulas y caliéntelos hasta que se despierte. Devolverlos a la incubadora es otra opción.
- Histomorfometría (Figura 5)
NOTA: Se desarrolla un método específico para evaluar el grosor de la pared ventricular derecha en secciones transversales del corazón. La evaluación morfológica de la dimensión del ventrículo derecho a través de la ecocardiografía no es 100% precisa debido a la forma irregular del ventrículo derecho, y este método puede servir como un buen suplemento en las evaluaciones morfológicas para el ventrículo derecho.- Prepare los siguientes reactivos / herramientas necesarios: formaldehído tamponado con fosfato al 4%, cuchilla afilada, solución salina tamponada con fosfato, toalla de papel, balanza eléctrica, tijeras pequeñas, agentes de procesamiento histológico general (etanol graduado, xileno, parafina).
- Una vez sacrificados los animales, use agua para mojar las plumas. Esto es para minimizar la contaminación potencial debido a las plumas voladoras mientras se abre el pecho.
- Abra la cavidad torácica con cuidado sin dañar el corazón. Use tijeras pequeñas para cortar la vasculatura y retire suavemente el corazón de la cavidad torácica. Deje una pequeña pieza (aproximadamente 1-2 mm) de vasculatura unida al corazón, ya que esto puede ser conveniente para el manejo posterior del corazón sin dañar el corazón.
- Una vez retirado, enjuague el corazón con solución salina tamponada con fosfato frío para eliminar la sangre y relajar el músculo. Luego seque el corazón en una toalla de papel antes de pesar para una lectura precisa del peso. Coloque el corazón en un fijador de volumen 10x (formaldehído tamponado con fosfato al 4%) durante 24 horas a temperatura ambiente. Los tejidos fijos pueden procesarse posteriormente en bloques de parafina, o almacenarse a 4 °C durante años (no se recomienda si se planea la inmunohistoquímica).
- Antes de incrustar, corte los tejidos a aproximadamente el 60% de la longitud del corazón contando desde el ápice(Figura 5A),para facilitar el procesamiento posterior. Se recomienda una cuchilla de microtomo para un corte limpio rápido y vertical. Para pollos mayores de un día, haga otro corte a aproximadamente 25-30% de longitud desde el ápice para facilitar la penetración de la parafina y permitir que el tejido quepa en casetes de tejido.
- Procese los tejidos con las siguientes condiciones (ajuste según sea necesario): 70% de etanol durante 1 h, 80% de etanol durante 1 h, 95% de etanol durante 1 h x2, 100% de etanol durante 30 min x2, xileno durante 5 min x2, parafina (punto de fusión 52-54 °C) durante 1,5 h, parafina (punto de fusión 62-64 °C) durante 1 h, y luego incrute los tejidos en una mezcla 3:1 de parafina (punto de fusión 62-64 °C) y parafina (punto de fusión 52-54 °C).
- Seccione el tejido a 6 μm de espesor. Mantenga cuidadosamente posiciones relativas idénticas de las secciones transversales confirmando la presencia y el tamaño de un punto de referencia anatómico (trabécula septomarginal) en el ventrículo derecho. Confirme un punto de referencia con una longitud moderada en cada sección(Figura 5B,flecha).
- Haga dos reglas electrónicas con el programador Logo: La regla 1 es una línea recta con 7 líneas de medida de radio unidas al punto medio, con 22.5 ° entre dos líneas de medida adyacentes. La regla 2 es sólo dos líneas perpendiculares en forma de T (Figura 5B).
- Mide con dos programas de software: Adobe Photoshop e ImageJ.
- En Photoshop, redimensione la regla 1 (SIN remodelación) para colocar los dos extremos de la regla en los dos extremos de la pared ventricular derecha libre, de modo que las siete líneas de medida de la regla 1 se encuentren cada una con la pared ventricular derecha interna. Luego use la regla 2 para hacer mediciones perpendiculares desde la pared ventricular interna hasta la externa(Figura 5B).
- Utilice ImageJ para realizar las siete mediciones de cada corazón.
- Dependiendo de las necesidades específicas, analice las siete mediciones o el promedio de un grosor representativo de la pared ventricular derecha. Normalice el peso de todo el corazón para cambios específicos en el grosor de la pared ventricular.
Resultados
Resultados de exposición
Inyección de células de aire
La inyección de células de aire puede exponer eficazmente los embriones de pollo en desarrollo a varios agentes, que pueden detectarse posteriormente en las muestras recolectadas (suero, tejido, etc.) de embriones / pollos recién nacidos. Aquí hay un ejemplo, en el que se inyectó ácido perfluorooctanoico (PFOA) con células de aire, y luego se determinaron las concentraciones séricas de PFOA con cromatografía líquida de ultra rendimiento-espectrometría de masas. Las concentraciones séricas se correspondieron con las dosis inyectadas, lo que indica la efectividad de este procedimiento (Figura 6).
Microinyección
La microinyección puede exponer a los embriones en desarrollo a agentes que pueden no penetrar eficazmente en la membrana interna, o con una corta duración de acción, como el lentivirus. Aquí hay un ejemplo, en el que se inyectó lentivirus en el segundo día embrionario con este método y luego se observó una fluorescencia verde significativa en el corazón de embriones embrionarios del día 15, lo que indica la efectividad de la transfección por lentivirus(Figura 7).
Infusión de células de aire
La infusión de células de aire es un método novedoso, que puede funcionar muy bien para una pequeña cantidad de exposición a la inhalación de gas / aerosol durante la etapa de inicio de la respiración externa. Aquí hay un ejemplo, en el que el escape de diesel se infundió en la célula de aire en los días embrionarios 18 y 19, lo que resultó en cambios fibróticos significativos en los tejidos cardíacos y pulmonares(Figura 8).
Resultados de la evaluación de endpoints
Resultados de la electrocardiografía
Debido a la limitación de dos electrodos, solo se pueden mostrar 3 canales de electrocardiografía. Pero son suficientes para distinguir las ondas r, por lo que pueden usarse para evaluaciones funcionales. En un ejemplo de la vida real, la electrocardiografía de pollos expuestos al escape de diesel indicó un intervalo R-R significativamente acortado, lo que indica cambios funcionales (Figura 9).
Resultados histopatología
Nuestro método de evaluación del grosor de la pared ventricular derecha se utilizó con éxito en varios estudios5,7,8,9,10,11,12. En uno de nuestros estudios previos, la exposición al escape de diesel resultó en un engrosamiento de la pared ventricular derecha(Figura 10).

Figura 1: Demostración de la inyección de células de aire. Un óvulo fértil no desarrollado se muestra en la imagen, pero los embriones en todas las diferentes etapas pueden ser expuestos con este método. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Demostración de microinyección. En la imagen se muestra un embrión temprano, que es el punto de tiempo de exposición preferido para este método, pero también se pueden probar otros puntos de tiempo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Demostración de la infusión de células de aire. En la imagen se muestra un embrión en etapa tardía sometido a pipping interno, que es el punto de tiempo de exposición preferido para este método. Se mostraron cuatro etapas de la operación. 1: Embrión intacto. 2: Se han hecho dos agujeros. 3: Se está realizando la infusión. La bolsa de muestreo de PVF también se muestra en la parte inferior izquierda. 4: La infusión está terminada, los orificios sellados con cinta. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Demostración de electrocardiografía. El panel superior izquierdo mostró cómo un pollo recién nacido fue anestesiado y sometido a medición electrocardiográfica. El panel superior derecho muestra el instrumento de electrocardiografía con los electrodos conectados. El panel inferior muestra una electrocardiografía representativa adquirida de los pollos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Demostración de la evaluación histopatológica del grosor de la pared ventricular derecha (tinción de hematoxilina y eosina). (A) Demostración de la posición de corte de los corazones de pollo antes de la incrustación. (B) Demostración de la medición del grosor de la pared ventricular derecha. Las barras de escala representan 1000 μm. Los círculos azules muestran los siete puntos de medición en la pared ventricular derecha interna. El círculo rojo muestra un punto de medición en la pared externa del ventrículo derecho. La flecha muestra el punto de referencia anatómico para la posición de sección transversal adecuada. Esta figura ha sido modificada de Jiang et al. Toxicología. 293 (1-3), 97-106 (2012)7. Haga clic aquí para ver una versión más grande de esta figura.
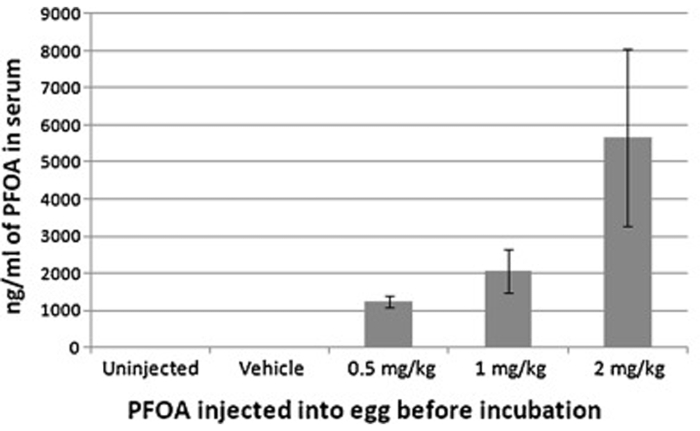
Figura 6: Concentración sérica de ácido perfluorooctanoico de pollos recién nacidos después de la inyección de células de aire con 0, 0,5, 1 o 2 mg/huevo kg de ácido perfluorooctanoico antes de la incubación. Las concentraciones séricas resultantes se correspondieron con las dosis inyectadas, lo que indica la efectividad de la inyección de células de aire. Esta figura ha sido modificada de Jiang et al. Toxicología. 293 (1-3), 97-106 (2012)7. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Demostración de la eficacia de la transfección por lentivirus después de la exposición a microinyección (Observación directa después de la criocescción). Los paneles izquierdos mostraron imágenes de campo de luz, mientras que los paneles derechos mostraron fluorescencia verde para las mismas secciones de tejido. Los embrionarios del día dos embrionarios fueron inyectados con lentivirus o control, y luego incubados hasta el día embrionario 15. Los corazones fueron seccionados congelados y visualizados directamente bajo microscopio fluorescente. (A) Grupo de control, poca fluorescencia verde estaba presente. (B) Grupo expuesto a lentivirus, se observó fluorescencia verde significativa, lo que indica la efectividad de la transfección por lentivirus después de la microinyección. Las barras de escala representan 125 μm. Esta figura ha sido modificada de Zhao et al. Toxicología Ambiental y Farmacología. 56, 136-144 (2017)11. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Demostración de la eficacia de la infusión de células de aire. Los embriones de pollo se infundieron con gases de escape de diesel en los días embrionarios 18 y 19, y luego los pollos eclosionados se mantuvieron durante 0, 1 o 2 semanas y luego se sacrificaron. Los tejidos cardíacos se evaluaron con tinción de Masson Trichrome para lesiones fibróticas. Las flechas mostraron las lesiones fibróticas (tinción azul). *: estadísticamente diferente del control (P<0,05 del análisis de varianza y las pruebas de diferencia menos significativa). Las barras de escala representan 150 μm. Esta cifra ha sido modificada de Jiang et al. Contaminación ambiental. 264, 114718 (2020)8. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Demostración de la eficacia de la electrocardiografía. Los embriones de pollo se infundieron con gases de escape de diesel en los días embrionarios 18 y 19, y luego los pollos eclosionados se mantuvieron durante 0, 1 o 2 semanas y luego se realizó electrocardiografía. Se observaron intervalos R-R significativamente más cortos en los pollos expuestos al escape de diesel a través de la infusión de células de aire, lo que indica la efectividad del método. *: estadísticamente diferente del control (P<0,05 del análisis de varianza y las pruebas de diferencia menos significativa). Esta cifra ha sido modificada de Jiang et al. Contaminación ambiental. 264, 114718 (20208. Haga clic aquí para ver una versión más grande de esta figura.
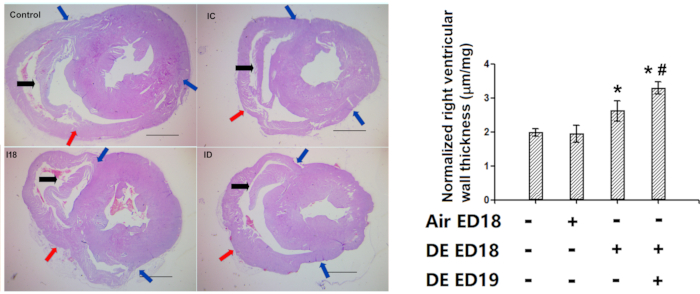
Figura 10: Demostración de la eficacia de la medición del grosor de la pared ventricular derecha (tinción de hematoxilina y eosina). Los embriones de pollo se infundieron con gases de escape diesel en los días embrionarios 18 y 19, y luego los pollos eclosionados se mantuvieron durante 1 semana, y luego se realizó una evaluación histológica del grosor de la pared ventricular derecha. R: Imágenes representativas de las secciones transversales del corazón. Tenga en cuenta la presencia de marcador anatómico en todos los ventrículos derechos (en pollos más viejos, el marcador tiende a ser un poco más largo en la posición deseada, lo que no afecta la precisión de las mediciones). B: Cuantificación del grosor de la pared ventricular derecha, que primero se convirtió a la longitud real con diapositivas estándar, y luego se normalizó con el peso de todo el corazón, por lo que se representaron en forma de um / ug. Flechas azules: dos extremos de la pared ventricular derecha libre. Flechas rojas: los puntos medios de la pared ventricular derecha. Flechas negras: marcador anatómico. *: estadísticamente diferente del control (P<0,05 del análisis de varianza y las pruebas de diferencia menos significativa). Las barras de escala representan 1000 μm. Esta cifra ha sido modificada de Jiang et al. Contaminación ambiental. 264, 114718 (2020)8. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El embrión de pollo ha sido un modelo clásico en estudios de desarrollo durante 200 años1. Nuestros métodos presentados en este manuscrito se han utilizado en la evaluación de varios contaminantes ambientales, incluyendo ácido perfluorooctanoico, material particulado y escape de diesel con éxito5,7,8,9,10,11,12. Con estos métodos, la cardiotoxicidad del desarrollo se indicó de manera rentable y clara. Además, no es difícil exponer embriones de pollo con otros compuestos de interés y evaluar la potencial cardiotoxicidad del desarrollo.
El método de inyección de células de aire es un método clásico utilizado anteriormente en muchos estudios13,14,15,que es conveniente y efectivo. En comparación con otros métodos de exposición al desarrollo, como los modelos de roedores16,17,18,presenta exposición directa en un sistema cerrado, lo que reduce en gran medida las variabilidades debido a los efectos maternos y la excreción variada. La microinyección es una mejora del método de inyección de células de aire, asegurando la exposición definitiva sobre o en las proximidades del embrión temprano en desarrollo, que puede lograr efectos similares a los de las inyecciones en el útero en roedores modelos19,20. En comparación con las inyecciones en el útero, nuestro método permite la confirmación visual de la inyección con pasos de manipulación relativamente fáciles, y la inyección precisa se logra fácilmente controlando el peso del óvulo, lo que no es posible en la inyección en el útero, donde la cantidad y el peso reales de los embriones no se adquieren fácilmente. El método de infusión es principalmente para la evaluación de agentes inhalados en el sistema pulmonar, pero la cardiotoxicidad y la toxicidad pulmonar a menudo coexisten. Este método aprovecha la celda de aire, en la que se infunde una pequeña cantidad de gas o aerosol, lo que permite la inhalación continua de gas / aerosol sin la necesidad de cámaras de inhalación específicas. Los modelos de roedores homólogos necesitan usar cantidades relativamente grandes de gas / aerosol e instrumentos de inhalación grandes y costosos21,22.
Los dos criterios de valoración probados rutinariamente en nuestro laboratorio, la electrocardiografía y la evaluación histomorfométrica del grosor de la pared ventricular derecha, representan cambios funcionales y morfológicos después de la exposición a tóxicos, respectivamente. La evaluación del grosor de la pared ventricular derecha tiene ventajas específicas para obtener una comprensión integral de la pared ventricular derecha, ya que la evaluación tradicional basada en ecocardiografía en el ventrículo derecho suele ser desafiante y poco precisa, debido a la forma asimétrica y compleja de la media luna del ventrículo derecho23. Nuestro método puede ayudar a superar esta inexactitud complementando con información adicional sobre el grosor de la pared ventricular derecha en una posición representativa. Actualmente todo es manual, en el futuro, las mediciones se pueden realizar automáticamente y el número de puntos de medición se puede aumentar considerablemente, mejorando aún más la precisión de este método.
Los modelos de desarrollo basados en embriones de pollo tienen varias ventajas en los estudios toxicológicos, como la capacidad de administrar una dosis de exposición relativamente precisa, un sistema de exposición independiente dentro de la cáscara y una fácil manipulación del embrión en desarrollo. Con respecto a la cardiotoxicidad, los pollos tienen corazones relativamente grandes y paredes ventriculares gruesas, lo que permite evaluaciones histomorfométricas fáciles. Hay algunas deficiencias, como la disponibilidad de anticuerpos / cebadores y los requisitos de espacio adicional de la jaula en comparación con los roedores si crían pollos después de la eclosión. Sin embargo, el embrión de pollo sigue siendo un buen modelo toxicológico alternativo para ser utilizado para posibles evaluaciones de cardiotoxicidad del desarrollo.
Divulgaciones
Los autores declaran no tener conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (Subvención No. 91643203, 91543208, 81502835).
Materiales
| Name | Company | Catalog Number | Comments |
| 4% phosphate buffered formaldehydefixative | Biosharp, Hefei, China | REF: BL539A | |
| 75% ethanol | Guoyao,Shanghai,China | CAS:64-17-5 | |
| Biosignaling monitor BL-420E+ | Taimeng, Chengdu, China | BL-420E+ | |
| Candling lamp | Zhenwei, Dezhou, China | WZ-001 | |
| Disposable syringe | Zhiyu, Jiangsu, China | ||
| Egg incubator | Keyu,Dezhou, China | KFX | |
| Electrical balance | OHAUS, Shanghai, China | AR 224CN | |
| Electro-thermal incubator | Shenxian, Shanghai, China | DHP-9022 | |
| Ethanol absolute | Guoyao,Shanghai,China | CAS:64-17-5 | |
| Fertile chicken egg | Jianuo, Jining, China | ||
| Hematoxylin and Eosin Staining Kit | Beyotime, Bejing, China | C0105 | |
| Histology paraffin | Aladdin, Shanghai, China | P100928-500g | Melt point 52~54°C |
| Histology paraffin | Aladdin, Shanghai, China | P100936-500g | Melt point 62~64°C |
| IV catheter | KDL, Zhejiang, China | The catheters have to be soft, plastic ones. | |
| Lentivirus | Genechem, Shanghai, China | The lentivirus were individually designed/synthesized by Genechem. | |
| Masson's trichrome staining kit | Solarbio, Beijing, China | G1340 | |
| Metal probe | Jinuotai, Beijing, China | ||
| Microinjector (5 uL) | Anting,Shanghai, China | ||
| Microscope | CAIKON, Shanghai, China | XSP-500 | |
| Microtome | Leica, Germany | HistoCore BIOCUT | |
| Microtome blade | Leica,Germany | Leica 819 | |
| Pentobarbitual sodium | Yitai Technology Co. Ltd., Wuhan, China | CAS: 57-33-0 | |
| Pipetter(10ul) | Sartorius, Germany | ||
| Povidone iodide | Longyuquan, Taian, China | ||
| Scissor | Anqisheng,Suzhou, China | ||
| Sterile saline | Kelun,Chengdu, China | ||
| Sunflower oil | Mighty Jiage, Jiangsu, China | Any commerical sunflower oil for human consumption should work | |
| Tape | M&G, Shanghai, China | ||
| Tedlar PVF Bag (5L) | Delin, Dalian, China | ||
| Vortex mixer | SCILOGEX, Rocky Hill, CT, US | MX-F | |
| Xylene | Guoyao,Shanghai,China | CAS:1330-20-7 |
Referencias
- Kain, K. H., et al. The chick embryo as an expanding experimental model for cancer and cardiovascular research. Developmental Dynamics. 243 (2), 216-228 (2014).
- Menna, T. M., Mortola, J. P. Effects of posture on the respiratory mechanics of the chick embryo. Journal of Experimental Zoology. 293 (5), 450-455 (2002).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Yamamoto, F. Y., Neto, F. F., Freitas, P. F., Oliveira Ribeiro, C. A., Ortolani-Machado, C. F. Cadmium effects on early development of chick embryos. Environmental Toxicology and Pharmacology. 34 (2), 548-555 (2012).
- Lv, N., et al. The roles of bone morphogenetic protein 2 in perfluorooctanoic acid induced developmental cardiotoxicity and l-carnitine mediated protection. Toxicology and Applied Pharmacology. 352, 68-76 (2018).
- Kmecick, M., Vieira da Costa, M. C., Oliveria Ribeiro, C. A., Ortolani-Machado, C. F. Morphological evidence of neurotoxic effects in chicken embryos after exposure to perfluorooctanoic acid (PFOA) and inorganic cadmium. Toxicology. 4227, 152286 (2019).
- Jiang, Q., Lust, R. M., Strynar, M. J., Dagnino, S., DeWitt, J. C. Perflurooctanoic acid induces developmental cardiotoxicity in chicken embryos and hatchlings. Toxicology. 293 (1-3), 97-106 (2012).
- Jiang, Q., et al. In ovo very early-in-life exposure to diesel exhaust induced cardiopulmonary toxicity in a hatchling chick model. Environmental Pollution. 264, 114718 (2020).
- Jiang, Q., Lust, R. M., DeWitt, J. C. Perfluorooctanoic acid induced-developmental cardiotoxicity: are peroxisome proliferator activated receptor alpha (PPARalpha) and bone morphorgenic protein 2 (BMP2) pathways involved. Journal of Toxicology and Environmental Health, Part A. 76 (11), 635-650 (2013).
- Jiang, Q., et al. Changes in the levels of l-carnitine, acetyl-l-carnitine and propionyl-l-carnitine are involved in perfluorooctanoic acid induced developmental cardiotoxicity in chicken embryo. Environmental Toxicology and Pharmacology. 48, 116-124 (2016).
- Zhao, M., et al. The role of PPAR alpha in perfluorooctanoic acid induced developmental cardiotoxicity and l-carnitine mediated protection-Results of in ovo gene silencing. Environmental Toxicology and Pharmacology. 56, 136-144 (2017).
- Jiang, Q., et al. Particulate Matter 2.5 Induced Developmental Cardiotoxicity in Chicken Embryo and Hatchling. Front Pharmacol. 11, 841 (2020).
- Molina, E. D., et al. Effects of air cell injection of perfluorooctane sulfonate before incubation on development of the white leghorn chicken (Gallus domesticus) embryo. Environmental Toxicology and Chemistry. 25 (1), 227-232 (2006).
- Crump, D., Chiu, S., Williams, K. L. Bis-(3-allyl-4-hydroxyphenyl) sulfone decreases embryonic viability and alters hepatic mRNA expression at two distinct developmental stages in chicken embryos exposed via egg injection. Environmental Toxicology and Chemistry. 37 (2), 530-537 (2018).
- Franci, C. D., et al. Potency of polycyclic aromatic hydrocarbons in chicken and Japanese quail embryos. Environmental Toxicology and Chemistry. 37 (6), 1556-1564 (2018).
- Rand, M. D., et al. Developmental exposure to methylmercury and resultant muscle mercury accumulation and adult motor deficits in mice. Neurotoxicology. 81, 1-10 (2020).
- Tanaka, T., Suzuki, T., Inomata, A., Moriyasu, T. Combined effects of maternal exposure to fungicides on behavioral development in F1 -generation mice: 2. Fixed-dose study of thiabendazole. Birth Defects Research. , (2020).
- Kofman, O., Lan, A., Raykin, E., Zega, K., Brodski, C. Developmental and social deficits and enhanced sensitivity to prenatal chlorpyrifos in PON1-/- mouse pups and adults. PLoS One. 15 (9), 0239738 (2020).
- Kischel, A., Audouard, C., Fawal, M. A., Davy, A. Ephrin-B2 paces neuronal production in the developing neocortex. BMC Developmental Biology. 20 (1), 12 (2020).
- Okolo, F., Zhang, G., Rhodes, J., Gittes, G. K., Potoka, D. A. Intra-Amniotic Sildenafil Treatment Promotes Lung Growth and Attenuates Vascular Remodeling in an Experimental Model of Congenital Diaphragmatic Hernia. Fetal Diagnosis and Therapy. , 1-13 (2020).
- Vyslouzil, J., et al. Subchronic continuous inhalation exposure to zinc oxide nanoparticles induces pulmonary cell response in mice. Journal of Trace Elements in Medicine and Biology. 61, 126511 (2020).
- Wahle, T., et al. Evaluation of neurological effects of cerium dioxide nanoparticles doped with different amounts of zirconium following inhalation exposure in mouse models of Alzheimer's and vascular disease. Neurochemistry International. 138, 104755 (2020).
- Tanabe, K. Three-Dimensional Echocardiography- Role in Clinical Practice and Future Directions. Circ J. 84 (7), 1047-1054 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados