Method Article
Imagem do pacote de esterecilia com resolução de nanoescala em células capilares auditivas de mamíferos vivos
Neste Artigo
Resumo
Aqui apresentamos um protocolo para a Microscopia de Condução de Íons da Sonda Hopping (HPICM), uma técnica de sonda de varredura sem contato que permite imagens nanoescala de feixes de estereócilia em células ciliadas auditivas vivas.
Resumo
As células ciliadas internas detectam deslocamentos induzidos pelo som e transduzem esses estímulos em sinais elétricos em um feixe de cabelo que consiste em estereócilias que são dispostas em fileiras de altura crescente. Quando estereócilia é desviada, elas puxam em minúsculas (~5 nm de diâmetro) elos de ponta extracelular interligando esterecilia, que transmitem forças para os canais de transdução mecanosensíveis. Embora a mecanotransdução tenha sido estudada em células ciliadas vivas há décadas, os detalhes ultraestruturais funcionalmente importantes do maquinário de mecanotransdução nas pontas da estereocilia (como dinâmica de ligação de ponta ou remodelação de estereócilia dependente de transdução) ainda podem ser estudados apenas em células mortas com microscopia eletrônica. Teoricamente, técnicas de sonda de varredura, como microscopia de força atômica, têm resolução suficiente para visualizar a superfície da estereócilia. No entanto, independente do modo de imagem, mesmo o menor contato da sonda de microscopia de força atômica com o feixe de estereócilia geralmente danifica o feixe. Aqui apresentamos um protocolo detalhado para a microscopia de condução de íons de ânhão de ânion de salto (HPICM) de células ciliadas auditivas de roedores vivos. Esta técnica de sonda de varredura sem contato permite imagens de lapso de tempo da superfície de células vivas com uma topografia complexa, como células ciliar, com resolução de nanômetros únicos e sem fazer contato físico com a amostra. O HPICM usa uma corrente elétrica que passa através da nanopipette de vidro para detectar a superfície celular nas proximidades da pipeta, enquanto um sistema piezoelétrico de posicionamento 3D escaneia a superfície e gera sua imagem. Com o HPICM, conseguimos imaginar feixes de estereocilia e os links interligando esterecilia em células ciliadas auditivas ao vivo por várias horas sem danos perceptíveis. Prevemos que o uso do HPICM permitirá a exploração direta de mudanças ultraestruturais na estereócilia das células ciliadas vivas para melhor compreensão de sua função.
Introdução
Apesar do fato de que os feixes de estereocilia nas células ciliadas auditivas são grandes o suficiente para serem visualizados por microscopia óptica e desviados em células vivas em um experimento de grampo de remendo, os componentes estruturais essenciais da máquina de transdução, como as ligações de ponta, poderiam ser visualizados apenas com a microscopia eletrônica em células mortas. Nas células ciliadas auditivas dos mamíferos, o maquinário de transdução está localizado nas extremidades inferiores das pontas, ou seja, nas pontas da linha mais curta esterecilia1 e regulado localmente através da sinalização nas pontas da estereócilia2,3. No entanto, imagens livres de rótulos das estruturas superficiais neste local em células ciliadas vivas não são possíveis devido aos pequenos tamanhos de estereócilia.
A cóclea dos mamíferos tem dois tipos de células sensoriais auditivas: células ciliares internas e externas. Nas células ciliadas internas, estereócilias são mais longas e grossas em comparação com as das células ciliadas externas4. A primeira e segunda fileira de estereócilia têm um diâmetro de 300-500 nm em células ciliadas internas de rato ou rato. Devido à difração da luz, a resolução máxima alcançável com uma microscopia óptica sem rótulos é de aproximadamente 200 nm. Assim, a visualização de estereócilias individuais dentro da primeira e segunda fileiras do feixe de células ciliadas internas é relativamente fácil com microscopia óptica. Em contraste, estereócilias de linha mais curtas nas células ciliadas internas e todos os estereocilias das células ciliadas externas têm diâmetros em torno de 100-200 nm e não podem ser visualizados com microscopia óptica5. Apesar dos recentes progressos em imagens de super resolução, essa limitação fundamental persiste em qualquer imagem óptica livre de rótulos. Todas as técnicas de super-resolução disponíveis comercialmente atuais requerem algum tipo de moléculas fluorescentes6,o que limita suas aplicações. Além das limitações devido à necessidade de moléculas marcadas fluorescentes específicas, a exposição à intensa irradiação de luz tem sido demonstrada para induzir danos celulares e pode influenciar os processos celulares, o que é uma grande desvantagem ao estudar células vivas7.
Nosso conhecimento atual dos detalhes ultraestruturais dos feixes de esterecicia de células ciliares tem sido obtido principalmente com várias técnicas de microscopia eletrônica (EM), como microscopia eletrônica de varredura (SEM), microscopia eletrônica de transmissão (TEM), em11 , fratura congelante, e recentemente com técnicas 3D como seção serial com feixe de íons focado ou tomografia crio-EM8,9,10, 11,12, 13,13 ,13, 14,15,16. Infelizmente, todas essas técnicas EM requerem química ou criofixação da amostra. Dependendo da escala de tempo dos fenômenos, essa exigência torna impossível ou muito trabalhoso um estudo dos processos dinâmicos nas pontas da estereócilia, seja impossível ou muito trabalhoso.
Esforços limitados foram feitos para a imagem de feixes de cabelo de células ciliar vivas com microscopia de força atômica (AFM)17,18. Uma vez que a AFM opera em soluções fisiológicas, poderia, em teoria, visualizar mudanças dinâmicas nos feixes de estereócilia de células ciliadas vivas ao longo do tempo. O problema está nos princípios da AFM de alta resolução, o que implica certo contato físico entre a sonda AFM e a amostra, mesmo no modo menos prejudicial de "tocar"19. Quando a sonda AFM encontra um estereócil, geralmente se depara com ele, danificando a estrutura do feixe de cabelo. Como resultado, essa técnica não é adequada para visualizar células ciliar vivas, ou mesmo fixas, feixes de célulasciliares 17,18. O problema pode ser parcialmente aliviado usando uma grande sonda AFM em forma de bola que impõe apenas forças hidrodinâmicas à superfície da amostra20. No entanto, embora tal sonda seja idealmente adequada para testar propriedades mecânicas da amostra21,ela fornece apenas uma resolução de sub micrômetro ao fotografar o órgão de Corti22 e ainda se aplica à amostra uma força que pode ser substancial para os feixes de estereócilia altamente sensíveis.
A microscopia de condução de íons de varredura (SICM) é uma versão da microscopia da sonda de varredura que usa uma sonda pipeta de vidro preenchida com uma solução condutora23. O SICM detecta a superfície quando a pipeta se aproxima da célula e a corrente elétrica através da pipeta diminui. Uma vez que isso está acontecendo bem antes de tocar a célula, o SICM é ideal para imagens não contato de células vivas na solução fisiológica24. A melhor resolução do SICM está na ordem dos nanômetros únicos, o que permite resolver complexos proteicos individuais na membrana plasmática de uma célula viva25. No entanto, semelhante a outras técnicas de sonda de digitalização, o SICM é capaz de imagem apenas superfícies relativamente planas. Superamos essa limitação inventando microscópio de condução de íons de ânhão de ânion de guinada (HPICM)26, no qual a nanopipette se aproxima da amostra em cada ponto de imagem(Figura 1A). Usando hpicm, conseguimos imaginar feixes de estereocilia em células ciliadas auditivas vivas com resolução nanoescala27.
Outra vantagem fundamental dessa técnica é que o HPICM não é apenas uma ferramenta de imagem. Em contraste com outras técnicas de sonda de varredura, a sonda HPICM/SICM é um eletrodo amplamente utilizado na fisiologia celular para gravações elétricas e entrega local de vários estímulos. A atividade do canal de íons geralmente não interfere com a imagem HPICM, porque a corrente total através da sonda HPICM é várias ordens de magnitude maior do que a corrente extracelular gerada pelos maiores canais deíons 25. No entanto, o HPICM permite um posicionamento preciso da nanopipette sobre uma estrutura de interesse e posterior gravação de grampo de remendo de um canal único a partir desta estrutura28. Foi assim que obtivemos as primeiras gravações preliminares de atividade de canal único nas pontas da estereócilia da célula ciliada29. Vale ressaltar que mesmo uma grande corrente através da nanopipette não pode produzir mudanças significativas do potencial através da membrana plasmática devido ao enorme desvio elétrico do meio extracelular. No entanto, canais de íons individuais podem ser ativados mecanicamente pelo fluxo de líquido através da nanopipette30 ou quimicamente por aplicação local de um agonista31.
No HPICM, a imagem é gerada quando uma nanopipette sequencialmente se aproxima da amostra em um ponto, se retrai e, em seguida, se move na direção lateral para repetir a abordagem(Figura 1A). Um amplificador de remendo aplica constantemente tensão a um fio AgCl na pipeta (Figura 1B) para gerar uma corrente de ~1 nA na solução de banho. O valor dessa corrente quando a pipeta está longe da superfície da célula é determinado como uma corrente de referência (Iref, Figura 1C). Em seguida, a pipeta se move no eixo Z para se aproximar da amostra até que a corrente seja reduzida por uma quantidade predefinida pelo usuário (setpoint), geralmente 0,2%-1% do Iref (Figura 1C, traço superior). O sistema então economiza valor Z neste momento como a altura da amostra, juntamente com coordenadas X e Y deste ponto de imagem. Em seguida, a pipeta é retraída para longe da superfície(Figura 1C, traço inferior) a uma velocidade definida pelo usuário, geralmente 700-900 nm/ms. Após a retração, a pipeta (ou, no nosso caso, a amostra - ver Figura 1B) é movida lateralmente para o próximo ponto de imagem, um novo valor atual de referência é obtido, e a pipeta se aproxima mais uma vez da amostra, repetindo o processo. O movimento X-Y da pipeta é preferido em uma configuração de microscópio vertical que é normalmente usada para gravações das correntes de mecanotransdução das células ciliares. Nesta configuração, a sonda HPICM se aproxima dos feixes de células ciliares não do topo, mas de um ângulo32. No entanto, a melhor resolução da imagem HPICM é alcançada em uma configuração de microscópio invertido (Figura 1A,B), onde o movimento da amostra nas direções X-Y é desacoplado do movimento Z da nanopipette, eliminando assim potenciais artefatos mecânicos.
Usando hpicm, obtivemos imagens topográficas de feixes de esterecilia de células ciliadas internas e externas de ratos, e até visualizamos as ligações entre os estereocilias que têm cerca de 5 nm de diâmetro26,27. O sucesso da imagem do feixe de células ciliares com essa técnica conta com vários fatores. Primeiro, o ruído (variância) da corrente de nanopipette deve ser o menor possível para permitir o menor ponto de configuração possível para imagens HPICM. Um ponto de setpoint baixo permite que a sonda HPICM "sinta" a superfície estereócilia a uma distância maior e em qualquer ângulo para a abordagem da sonda e, surpreendentemente, melhora a resolução X-Y da imagem HPICM (ver Discussão). Em segundo lugar, as vibrações e derivas no sistema devem ser reduzidas para menos de 10 nm, uma vez que contribuem diretamente para os artefatos de imagem. Finalmente, mesmo que a sonda HPICM e o estágio da amostra sejam movidos em eixos Z e X-Y pelos atuadores piezo controlados por feedback calibrado que têm uma precisão de um único nanômetro ou melhor, o diâmetro da ponta de nanopipette determina a propagação da corrente (volume de sensoriamento) e, portanto, a resolução(Figura 1A). Portanto, antes de imaginar células ciliar vivas, é vital puxar as pipetas adequadas, alcançar a resolução desejada com amostras de calibração e obter baixo ruído no sistema de gravação.
Há pelo menos algumas décadas, a técnica sicm não está disponível comercialmente e vem sendo desenvolvida por poucos laboratórios no mundo com o laboratório líder do Prof. Korchev no Imperial College (Reino Unido). Recentemente, vários sistemas SICM tornaram-se comercialmente disponíveis (ver Tabela de Materiais), todos baseados nos princípios originais do HPICM. No entanto, os feixes de esterecilia de imagem nas células ciliadas exigem várias modificações personalizadas que são tecnicamente desafiadoras (ou até mesmo impossíveis) nos sistemas fechados "prontos para ir". Portanto, é necessária alguma integração de componentes. Uma vez que a configuração HPICM representa uma plataforma de fixação com requisitos mais rigorosos de vibração e deriva e um movimento piezo-driven da sonda HPICM e da amostra (Figura 1D), essa integração é relativamente fácil para qualquer pesquisador, que é proficiente em fixação de patches. No entanto, um cientista sem experiência adequada definitivamente precisaria de algum treinamento em eletrofisiologia primeiro. Apesar dos desafios restantes, como o aumento da velocidade da imagem (ver Discussão),temos sido capazes de imaginar feixes de esterecilia em células ciliadas vivas com resolução de nanoescala sem danificá-las.
Este artigo apresenta um protocolo detalhado para realizar imagens hpicm bem sucedidas dos pacotes de células capilares auditivas ao vivo em jovens explants cocleares pós-natal ou rato usando nosso sistema personalizado. Os componentes integrados estão listados na Tabela de Materiais. O artigo também descreve problemas comuns que podem ser encontrados e como solucioná-los.
Protocolo
O estudo foi realizado de acordo com as recomendações do Guia de Cuidado e Uso de Animais laboratoriais dos Institutos Nacionais de Saúde. Todos os procedimentos animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade de Kentucky (protocolo 00903M2005).
1. Fabricação e teste dos nanopipettos
- Crie um programa no puxador de micropipette para obter pipetas com uma resistência entre 200 e 400 MΩ, que corresponde a diâmetros de ponta interna de aproximadamente 50-70 nm. Os parâmetros dependerão do puxador de micropipette. Para obter pipetas curtas com pontas finas não flexíveis, verifique no manual operacional do puxador.
- Use capilares de vidro borossilicato com diâmetros externos/internos de 1/0,58 mm e um filamento interno para facilitar o enchimento. O comprimento da pipeta é crucial porque determina a frequência da ressonância mecânica lateral da pipeta. Quanto mais longa é a pipeta, menor é a frequência ressonante e mais difícil é evitar essa ressonância.
NOTA: O usuário deve tentar fabricar a pipeta mais curta que o titular pode aceitar. O comprimento dos nanopipettos neste experimento é geralmente de 15-25 mm(Figura 2A). - Encha a nanopipette até o ponto médio(Figura 2A) com uma solução de banho, seja o L-15 da Leibovitz ou com a Solução de Sal Balanceado (HBSS) da Hank's Balanced( HBSS) complementada com 20 mM D-glicose (para ajustar a osmolaridade). Para evitar artefatos potenciais, use a mesma solução que será usada no banho para gravações.
- Usando um microscópio óptico com uma ampliação de 10x, verifique se há bolhas na ponta da pipeta(Figura 2B). As bolhas impediriam o fluxo da corrente. É mais difícil remover bolhas nas pipetas que foram puxadas várias horas antes do experimento. Portanto, recomenda-se puxar novas pipetas a cada experimento.
- Uma vez que a pipeta esteja livre de bolhas, monte-a no porta-pipetas HPICM(Figura 2C).
- Coloque a amostra (padrão de tecido ou calibração) na câmara personalizada e adicione 4 mL da solução de banho acima mencionada.
- Coloque a câmara personalizada no estágio HPICM e introduza o eletrodo de terra na solução.
- Certifique-se de que a tensão que está sendo aplicada à pipeta pelo amplificador de grampo de remendo é zero.
- Mova a pipeta em Z até tocar o líquido.
- Defina o deslocamento do amplificador para zero e, em seguida, adicione +100 mV para verificar a corrente da pipeta.
- Calcule a resistência e o diâmetro da pipeta, com base na lei de Ohm:
R = V/I
onde R é a resistência (MOhm), V é a tensão aplicada ao nanopipette (mV) e eu sou a corrente que flui através da nanopipette (nA).- Calcule o diâmetro interno da pipeta conforme descrito em outros lugares de acordo com a fórmula12a seguir :
Dicade ID = 1000/ √R
NOTA: O valor ideal de resistência é entre 200 e 400 MΩ. Pipetas com resistência superior a 400 MΩ podem levar a uma corrente instável devido ao seu pequeno tamanho (< diâmetro interno de 50 nm). Pelo contrário, pipetas com resistências menores que 200 MΩ são muito grandes (> diâmetro interno de 70 nm) e não resolveriam pequenas características. Recomenda-se iniciar a imagem com as pipetas de resistência de 200 MΩ, pois são mais fáceis de fabricar e tendem a fornecer menos ruído elétrico.
- Calcule o diâmetro interno da pipeta conforme descrito em outros lugares de acordo com a fórmula12a seguir :
2. Minimizando derivas e vibrações de amostras
NOTA: Para diminuir o ruído mecânico no sistema durante a imagem, monte as amostras nas câmaras personalizadas que utilizam lâminas de vidro grossas (~1,2 mm):
- Remova a porção de vidro de um prato de fundo de vidro de 50 mm, deixando as paredes de plástico intactas.
- Cole a porção plástica do prato de cultura celular em cima do escorregador de vidro grosso com cola de silicone.
- Monte a amostra de calibração no meio da câmara (em cima do escorregador de vidro) usando cola de silício ou fita dupla face fina.
- Segure firmemente a câmara no estágio HPICM usando fita dupla face.
- Durante a imagem, feche a gaiola de Faraday e cubra-a com um cobertor para minimizar a interferência elétrica e a deriva térmica, correspondentemente.
3.Testando a resolução com padrões de calibração AFM
NOTA: É fortemente recomendado a imagem padrões AFM (ver Tabela de Materiais) antes de imagens de células vivas, a fim de solucionar problemas o sistema e testar sua resolução nos eixos X-Z-Y. Os padrões de calibração possuem pilares de dióxido de silício e orifícios de diferentes formas, mas alturas/profundidades fixas (ou seja, 20 ou 100 nm) em um chip de silício de 5 x 5 mm. A partir do padrão de calibração de 100 nm é recomendado, para garantir que a resolução Z esteja abaixo de 100 nm. Depois de alcançar uma imagem bem sucedida de alta resolução dos pilares ou orifícios nesta amostra de calibração(Figura 3A),mova-se para o padrão de 20 nm. Se a imagem deste último padrão for bem sucedida(Figura 3B),a resolução no eixo Z é garantida a ser inferior a 20 nm e apropriada para a imagem dos feixes de esterecilia da célula ciliar12. As etapas a seguir são usadas para a imagem de ambos os padrões de calibração.
- Conecte o padrão de calibração à câmara com cola de silicone.
- Adicione 4 mL de HBSS à câmara para cobrir a amostra de calibração. Em seguida, fixe a câmara no estágio XY da configuração HPICM usando fita dupla face.
- Fixar o suporte magnético do eletrodo moído até o estágio próximo à câmara e imergir o eletrodo na solução de banho(Figura 1B).
- Monte a nanopipette no suporte, mergulhe-a na solução de banho e coloque sua corrente para ~1 nA seguindo os passos descritos na Seção 1.
- Posicione a nanopipette aproximadamente acima do centro do padrão de calibração usando um manipulador de grampos de curso. A inspeção visual geralmente é suficiente para este posicionamento, uma vez que a área coberta por estruturas de dióxido de silício é relativamente grande (1 x 1 mm). Em contraste com o órgão de explants corti (veja abaixo), o padrão de calibração não é transparente e, portanto, um posicionamento mais preciso guiado por imagem óptica não é possível para esta amostra.
- Aumente o ponto de configuração enquanto monitora o sinal do sensor do atuador Z piezo em um osciloscópio em tempo real. Após estabelecer um ciclo de aproximação Z estável e repetitivo (como na Figura 1C, inferior), diminua o ponto de configuração para o valor que está um pouco acima do ponto de instabilidade. Este procedimento garantiria o ponto de configuração ideal para esta nanopipette em particular.
- Mova a pipeta para baixo a uma velocidade de ~5 μm/s com um micromanipulador de grampo de remendo até chegar à amostra. Neste momento, o nível inferior do sinal de posicionamento Z em tempo real(Figura 1C) aumentará, indicando que a nanopipette é retirada devido à "detecção" da superfície da amostra. Qualquer movimento adicional da nanopipette resultará em uma mudança ainda mais positiva do sinal de posicionamento Z.
NOTA: Tenha cuidado para não exceder o limite superior do movimento do atuador Z piezo. - Iniciar a imagem em baixa resolução (ver Tabela 1). Devido à montagem desigual do padrão AFM, o ponto mais alto da área de interesse pode ser desconhecido. Por isso, defina a amplitude da retração da pipeta (amplitude de lúpulo) para pelo menos 200-500 nm.
- Uma vez identificado o ponto mais alto da amostra na área de imagem, diminua a amplitude do lúpulo. Uma amplitude de lúpulo menor permite uma varredura mais rápida, que é preferida para imagens de alta resolução devido aos efeitos diminuídos das derivas e à diminuição da vibração.
- Antes de mover a pipeta para um novo local X-Y, retraia-a cerca de 200 μm no eixo Z para evitar colisões indesejadas com a amostra.
NOTA: Nos casos em que a nanopipette não está alinhada com o centro do padrão de calibração, é possível que a varredura comece apenas fora da área de características da superfície. - Após a área de interesse ser encontrada, inicie a imagem em uma resolução mais elevada (ver Tabela 1).
4. Fazer câmaras personalizadas para proteger as explantas cocleares
NOTA: Monte as explantes cocleares nas câmaras com sistemas de fixação personalizados que utilizam pipetas de vidro flexíveis (etapa 4.1) (Figura 4A) ou fio dental (passo 4.2) (Figura 4B). A câmara de pipeta de vidro poderia ser esterilizada e usada para os órgãos cultivados de Corti, enquanto a câmara de fio dental fornece uma fixação mais segura da amostra e um controle sobre a orientação do feixe de estereócilia durante a montagem. Essas câmaras personalizadas precisam ser preparadas com antecedência, mas podem ser limpas e reutilizadas em várias sessões de imagem.
- Faça uma câmara usando pipetas de vidro flexíveis
- Puxe duas fibras de vidro finas e flexíveis de capilares de vidro usando um puxador de pipeta. Nossas fibras de vidro puxadas normalmente medem de 1 a 2 cm de comprimento e são bastante flexíveis.
- Coloque uma pequena gota do elastômero de silicone em cima de uma mancha de vidro. Use tampas de 2 cm de diâmetro.
- Coloque as extremidades de duas fibras de vidro na gota de silicone e organize as fibras para ter um pequeno grau de separação entre elas(Figura 4A).
- Coloque a tampa em uma placa quente para curar rapidamente o elastômero (1 a 3 min).
- Cole a tampa no fundo de vidro da câmara descrita na Seção 2 usando uma pequena quantidade (1-3 μL) de elastômero de silicone e permitindo que ele cure durante a noite.
- Fazendo uma câmara usando fio dental:
- Remova a porção de vidro de um prato de 50 mm de fundo de vidro, deixando as paredes de plástico intactas. Em seguida, cole a porção plástica do prato de cultura celular em cima de um slide de vidro de 1,2 mm de espessura com cola de silício.
- Monte uma tampa plástica (6,5 x 6,5 mm) com a mesma cola no centro da câmara. Em seguida, repita o processo com outra mancha de cobertura em cima da anterior.
- Monte dois pequenos fios de tungstênio ou banhados a ouro (12 mm de comprimento e ~0,5 mm de diâmetro) com cola de silício, cada um em lados opostos dos slides da tampa. Cole-os o suficiente (> 10-15 mm) dos slides da tampa(Figura 4B).
- Separe dois fios de fio dental e coloque-os em cima dos slides da tampa e fixe-os nos fios fazendo um nó. Deixe uma pequena distância entre ambos os fios(Figura 4B, setas curtas).
- Limpe as câmaras depois de cada uso
- Remova suavemente o tecido da câmara usando pinças finas e raspe levemente todos os resíduos de tecido deixados para trás.
- Enxágüe a câmara primeiro com 70% de etanol e depois com água destilada.
- Repita o ciclo de lavagem, se necessário.
- Coloque a câmara de cabeça para baixo em um papel filtro para deixá-la secar até o próximo experimento. As câmaras não precisam ser esterilizadas, a menos que acultura do órgão de Corti seja planejada após a imagem.
5. Dissecando o órgão de roedores de Corti
- Realizar dissecção das jovens explanagens cocleares pós-natal, conforme descrito em detalhes em outros lugares13.
- Para a imagem HPICM, dissecar o órgão de Corti de camundongos entre os dias pós-natal 3 e 6 (P3-6), e de ratos entre os dias pós-natal 3 e 8 (P3-8).
NOTA: As células ciliar mais antigas são mais suscetíveis aos danos durante a dissecção e, portanto, não podem ser usadas para imagens de HPICM de lapso de tempo de horas. - Não se esqueça de remover a membrana tectorial antes da imagem HPICM.
- Imediatamente após a dissecação, proteja o tecido em uma das câmaras descritas na Seção 4, colocando-o sob as pipetas de vidro flexíveis ou sob os dois fios de fio dental(Figura 4). Preencha essas câmaras com 4 mL da solução de banho de temperatura ambiente (para minimizar a formação de bolhas).
6. Imagem das células ciliar auditivas
- Monte a câmara com um órgão recém-isolado de Corti no estágio X-Y piezo usando fita dupla face e certifique-se de que ela está firmemente protegida para minimizar a deriva da câmara em eixos X e Y(Figura 1B).
- Siga os passos da Seção 1 para colocar uma nova nanopipette e verifique se há resistência correta à pipeta.
- Usando o micromanípulador de grampo de remendo, posicione a nanopipette sobre a região da célula ciliada, observando o órgão da explanta de Corti em um microscópio invertido.
- Verifique se o sistema está estável com um setpoint de 0,5% ou menor, registrando o sinal de posicionamento atual e Z em tempo real no osciloscópio (como na Figura 1C). Se o sinal Z não estiver estável, tente diminuir a frequência de corte do filtro de baixa passagem do amplificador de grampo de remendo. No entanto, não pode ser menor do que o tempo de resposta do atuador Z piezo (para evitar colisão de pipeta com a amostra devido a leituras atuais atrasadas).
NOTA: Na prática, a configuração de 5 kHz deste filtro é considerada ótima. É melhor substituir a nanopipette, se o sinal Z ainda estiver instável. - Uma vez alcançado um registro estável, determine o setpoint ideal e aproxime-se da amostra com pipeta HPICM conforme descrito nas etapas 3.6-3.7 acima.
- Primeiro, realize imagens de baixa resolução (ver Tabela 1), usando uma amplitude de lúpulo de pelo menos 6 a 8 μm. Para imaginar estruturas altas, como os feixes de esterecilia da célula ciliada, certifique-se de que a amplitude do lúpulo é suficiente para evitar colisão com essas estruturas.
NOTA: Se a amplitude do lúpulo não for suficiente, a pipeta não será capaz de saltar sobre um estereócil e haverá uma colisão iminente. A colisão da sonda HPICM com um estereócilia pode danificar o feixe de cabelo. Portanto, nos casos em que a altura do feixe de estereócilia é incerta, use uma amplitude de lúpulo maior. - Familiarize-se com a topografia do órgão de Corti, realizando e/ou estudando imagens obtidas com microscopia eletrônica de varredura(Figura 5).
NOTA: Se a imagem HPICM for uniforme com alturas menores que 1 μm em cada ponto de imagem, a pipeta provavelmente está escaneando o fundo do vidro e não o tecido. Alternativamente, a pipeta pode "pousar" em uma região diferente da explanta coclear, longe das células ciliares. - Se a pipeta precisar ser movida para um novo local X-Y, retraia-a cerca de 500 nm para evitar colisões com quaisquer características altas dentro do tecido. Repita imagens HPICM de baixa resolução até que a região de interesse com as células ciliares seja encontrada.
- Após a região de interesse ser encontrada, comece a fotografar em uma resolução mais elevada (ver Tabela 1). Tente gastar menos de 15 minutos ao imaginar um pacote de cabelo inteiro.
NOTA: Os feixes de células ciliadas no tecido vivo ainda não estão parados, mas podem mudar sua orientação, por exemplo, devido a mudanças de forma nas células de suporte subjacentes. Portanto, as imagens podem exibir artefatos de movimento se a aquisição da imagem for muito lenta. - Mais uma vez, determine as características mais altas nas imagens de baixa resolução antes da diminuição da amplitude do lúpulo para imagens de alta resolução. Para uma região de interesse que cobre todo o feixe de células ciliares, reduza a amplitude do lúpulo para 4-5 μm, enquanto para uma região relativamente pequena e "plana" dentro do feixe (por exemplo, 2 x 2 μm) reduza ainda mais a amplitude do lúpulo, para menos de 1 μm, aumentando assim a velocidade e a resolução da imagem.
7. Processamento de imagens
NOTA: Artefatos de imagem são comuns em imagens HPICM. Alguns deles podem ser corrigidos por parâmetros de aquisição de imagens, enquanto outros exigem pós-processamento, seja com um visualizador SICM especializado ou com programas mais gerais de processamento de dados, como ImageJ ou MatLab. Aqui descrevemos os artefatos mais comuns e como os consertamos com o visualizador SICM.
- Executar correção de inclinação
NOTA: Não é óbvio para um iniciante, mas o olho humano não pode resolver características de tamanho sub-micrômetro na superfície de uma célula, se a área de imagem tiver uma inclinação geral de tamanho igual ou maior(Figura 3A,B, esquerda). Portanto, é necessário determinar a inclinação média de uma área imagem (montagem de dados de imagem HPICM 3D em um único plano) e subtrai-lo da imagem HPICM(Figura 3A,B,meio).- Clique em Abrir para abrir uma imagem com o visualizador SICM.
- Selecione a guia Correção de imagem.
- Selecione a guia Inclinação correta.
- Pressione o botão Inclinação correta para uma correção automática de inclinação.
- Executar alinhamento de linha
NOTA: Como mencionado anteriormente, derivas mecânicas e/ou térmicas, bem como artefatos de movimento celular representam um problema significativo na imagem HPICM. Uma pequena deriva com uma velocidade inferior a um micrômetro por minuto geralmente não é perceptível em uma configuração regular de grampo de remendo. No entanto, poderia produzir artefatos de várias dezenas de nanômetros em imagens HPICM, que é significativamente maior do que a resolução de HPICM. Portanto, não é incomum encontrar saltos repentinos no eixo Z entre duas linhas de varredura HPICM vizinhas durante a imagem. Isso pode ser corrigido analisando diferenças entre os valores Z de partida (e/ou final) nessas linhas de varredura vizinhas.- Clique em Abrir para abrir uma imagem com o visualizador SICM.
- Selecione a guia Correção de imagem.
- Selecione a guia Inclinação correta.
- Escolha a largura das linhas a serem alinhadas. Pressione o botão ButtonDestripeLineFit para uma correção automatizada do alinhamento da linha.
- Realizar redução de ruído
NOTA: Ao obter imagens com HPICM, pequenas flutuações na corrente de nanopipette podem levar à nanopipette parar longe da superfície da amostra, especialmente com baixos setpoints. Resulta na aparência de pequenos pontos brancos na imagem. Para corrigir este artefato de imagem, é necessário identificar os pontos de imagem com o valor Z significativamente maior do que o dos vizinhos e substituir esse valor por uma média dos vizinhos. Isso é feito por um filtro mediano ajustável.- Clique em Abrir para abrir uma imagem com o visualizador SICM.
- Selecione a guia Processamento de imagens.
- Selecione a guia de redução de ruído.
- Defina o filtro Limiar (μm) para que os pixels sejam removidos.
Resultados
O protocolo apresentado neste artigo pode ser usado para visualizar qualquer célula viva com topografia complexa. Seguindo essas etapas, obtém rotineiramente imagens de feixes de células ciliar auditivas de ratos vivos(Figura 6B,D). Apesar de ter resolução X-Y mais baixa quando comparadas às imagens SEM, nossas imagens HPICM podem resolver com sucesso as diferentes linhas de estereócilia, a forma das pontas estereócilias e até mesmo as pequenas ligações (~5 nm de diâmetro) conectando esterecilia adjacente(Figura 6F). Além disso, as imagens HPICM têm informações em 3D que as imagens SEM não possuem. Dada a natureza não-contato deste tipo de técnica de imagem, também pudemos realizar imagens de HPICM de lapso de tempo contínuo do mesmo feixe de células ciliares por várias horas (ou seja, 5-6 h regularmente) sem danificar a coesão do feixe(Figura 7). Assim, o HPICM apresenta um grande potencial para o estudo de mudanças estruturais dinâmicas dos feixes de células ciliados ao longo do tempo.
Embora forneçamos várias faixas para tamanho de pipeta, setpoint atual, parâmetros de baixa e alta resolução e amplitudes de lúpulo, cada usuário pode precisar otimizar ligeiramente suas configurações para obter imagens hpicm bem sucedidas de pacotes de células ciliar vivas. Setpoints menores produzem imagens de melhor qualidade. No entanto, com um setpoint muito baixo, o sistema pode interpretar pequenas flutuações na corrente como encontrando a superfície celular e isso levará ao ruído "ponto branco" na imagem(Figura 8A). Da mesma forma, grandes amplitudes de lúpulo podem aumentar a ressonância lateral da pipeta e também produzir pixels barulhentos(Figura 8B). Em contraste, se a amplitude do lúpulo for muito pequena ou o setpoint for muito alto, a nanopipette pode colidir com a amostra e levar a artefatos de imagem ou até mesmo danificar o feixe de cabelo(Figura 8C,D). Recomendamos a realização da imagem em menor resolução, ao mesmo tempo em que ajustamos todos esses parâmetros para minimizar os danos à amostra ou à nanopipette.

Figura 1: Princípios da microscopia de condução de íons de ânion de ânion de salto (HPICM). (A) Uma corrente elétrica que passa pela nanopipette gera um "volume de sensoriamento" na ponta da pipeta. Para estruturas complexas de imagem como os feixes de esterecilia da célula ciliada, a pipeta se aproxima em direção à superfície celular de cima e se retrai após detectar a superfície. Após um movimento lateral em cada passo, a pipeta continua a "saltar" acima da amostra gerando a imagem da célula. Observe que a amplitude do lúpulo deve ser suficiente para que a pipeta "suba" a um estereócilium. A amplitude do lúpulo ilustrado funcionaria para a varredura da esquerda para a direita (do menor ao estereócil mais alto, indicado por uma seta). No entanto, é muito pequeno para a varredura da direita para a esquerda quando a pipeta encontra o estereócilo mais alto primeiro. (B) Configuração experimental. Uma câmara personalizada com o órgão da explanta Corti é montada em um estágio de nanoposicionamento XY com abertura para observação óptica de microscopia. A nanopipette é movida por um atuador separado de Z piezo ultrarrápido. Para posicionar a nanopipette sobre a região de interesse, o atuador Z é montado em um micromanipulador convencional (não mostrado) juntamente com o cabelamentodo amplificador de remendo. O eletrodo moído é montado em um suporte magnético e inserido no banho. (C) Gravações representativas da corrente da pipeta (traçosuperior) e posição Z da pipeta (traço inferior) durante a imagem. Quando a pipeta está longe da superfície celular, o valor de referência da corrente que passa pela pipeta é determinado(euref). Em seguida, a pipeta é movida em direção à amostra (abordagem). Quando o "volume de sensoriamento" encontra a superfície da célula, a corrente da pipeta começa a diminuir. O comando de retirada é emitido quando a redução atual atinge um setpoint, que normalmente é de 0,2% - 1% do Iref. (D) Esquemas do equipamento que precisam ser adicionados a uma configuração convencional de grampo de remendo para imagens HPICM. Um amplificador dedicado de grampo de remendo registra a corrente de nanopipette (I) que é usada pelo controlador SICM no modo HPICM para gerar sinais de comando para eixos X, Ye Z. O amplificador de instrumentação fornece filtragem offset, dimensionamento e low pass para esses sinais, se necessário. Infelizmente, os sinais X/Y/Z do controlador não podem ser aplicados diretamente aos atuadores piezo devido a grandes erros causados por histerese e arrepios inerentes à cerâmica piezo. Portanto, cada atuador piezo (estágiode tradução ) tem um sensor de movimento embutido que envia sinal de feedback para o controlador de derivativo integral-proporcional (PID) que pré-molda o sinal de comando para corrigir esses erros. Observe que os eixos X e Y relativamente lentos poderiam usar controladores PID que são construídos no amplificador piezo,enquanto um eixo Z mais rápido requer um controlador PIDrápido dedicado. Clique aqui para ver uma versão maior desta figura.

Figura 2: Fabricação e enchimento de nanopipette. (A) Uma nanopipette de aproximadamente 2 cm de comprimento preenchida com a solução intrapipette (HBSS). (B) Uma imagem da bolha (seta) que normalmente é formada após o enchimento da pipeta. A bolha geralmente se afasta em poucos minutos da iluminação do microscópio (um microscópio digital LCD a 10x). (C) Uma nanopipette montada na cabeça sicm. A seta aponta para o eletrodo agcl dentro da pipeta. Observe que o porta-pipetas é pintado de prata e aterrado para minimizar a captação elétrica radiativa do atuador Z piezo. Clique aqui para ver uma versão maior desta figura.
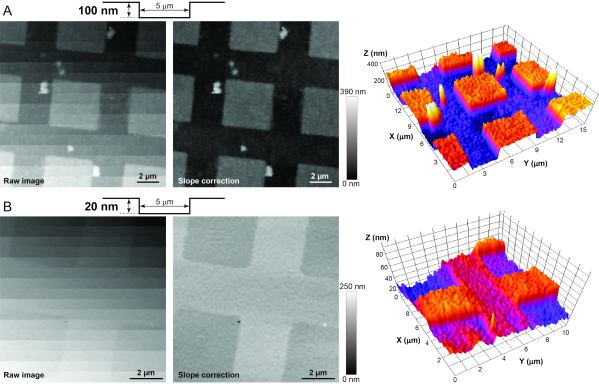
Figura 3: Imagem das normas de calibração AFM para determinar a estabilidade adequada, isolamento de vibração e ruído elétrico no sistema. (A) Imagens brutas (esquerda), pós-processadas (média) e 3D (direita) do padrão de calibração HS-100MG. O perfil de superfície do padrão é mostrado esquematicamente na parte superior. Uma vez que o padrão nunca está perfeitamente alinhado perpendicular à nanopipette, a correção de inclinação pós-processamento é necessária para revelar pequenas características verticais da amostra. (B) Imagens brutas semelhantes (esquerda), pós-processadas (média) e 3D (direita) do padrão de calibração HS-20MG que tem recuos menores de 20 nm. Observe que a escala de cinza de um pixel em uma imagem HPICM indica a altura da amostra naquele momento. Clique aqui para ver uma versão maior desta figura.
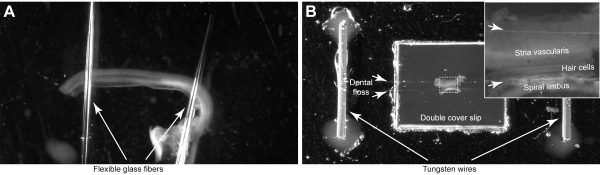
Figura 4: Montagem do órgão da explante corti. (A) A explanta é mantida por duas pipetas de vidro que são coladas à placa de Petri de fundo de vidro. (B) A explanta é fixada por dois fios de fio dental (setas curtas) em uma câmara de imagem personalizada. Inset mostra imagem ampliada do órgão de Corti. Clique aqui para ver uma versão maior desta figura.
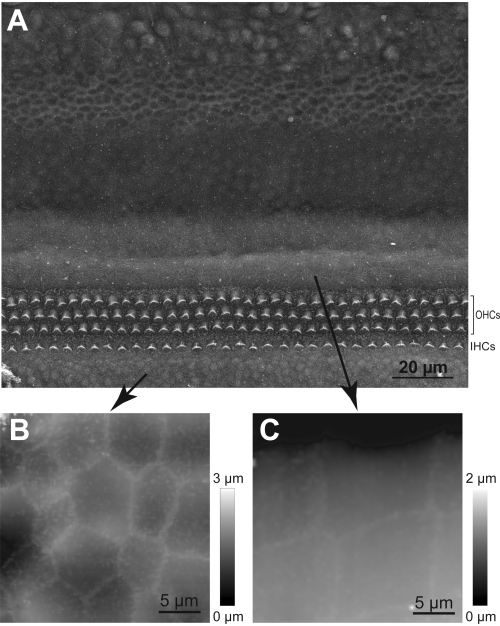
Figura 5: Navegação da sonda HPICM para a região da célula ciliar. (A) Imagem SEM da explanta coclear mostrando linhas de células ciliar internas (IHCs) e externas (OHCs) e tipos distintos de células de suporte. (B) Imagem representativa HPICM das células no órgão de Kolliker. (C) Uma imagem HPICM das células de Hensen. Observe que esses dois tipos de células de suporte têm formas muito distintas, o que ajuda a determinar se a sonda HPICM pousou em uma área que seja radial ou periférica para as células ciliadas. Clique aqui para ver uma versão maior desta figura.
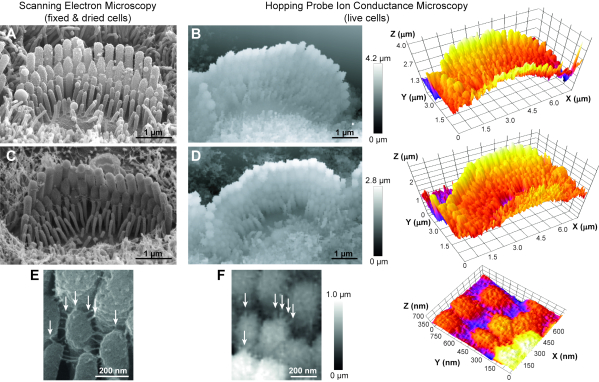
Figura 6: Comparação entre microscopia eletrônica de varredura (SEM) e microscopia de condução de íons de ânus (HPICM) de feixes de estereocilia em células ciliadas jovens de roedores pós-natal. (A,C) As imagens SEM fornecem resolução subnímia dos detalhes da superfície, mas nas células que são fixas e encolhidas devido à secagem de pontos críticos. Além disso, as imagens SEM não permitem análise 3D. (B,D) As imagens HPICM (esquerda) têm uma resolução pior (~5-10 nm), mas são obtidas em células vivas, permitem imagens de lapso de tempo e carregam informações sobre alturas exatas, o que permite reconstrução e medições 3D (à direita). (E,F) As ligações extracelulares entre estereócilias são evidentes tanto nas imagens SEM (E) quanto em HPICM(F)(setas). Idades celulares: A, postnatal dia 5 (P5) mouse; B, rato P6; C, rato P8; D, rato P5; E, rato P7; e F, rato P5. Em todas as imagens HPICM, a escala de cinza de um pixel indica a altura da amostra naquele momento. Clique aqui para ver uma versão maior desta figura.

Figura 7: Tempo contínuo de imagem HPICM de esterecilia. (A) Uma visão geral de um feixe de células ciliadas internas do rato P5 mostrando esterecilia de linha mais curta distinta. (B) Imagem de lapso de tempo da região de interesse indicada em (A) ao longo de seis horas. Note que, em contraste com um típico experimento de campo de remendo, as células ciliares não mostram sinais de deterioração por várias horas in vitro. Isso se deve à dissecção cuidadosa e à ausência de distúrbios mecânicos na célula. Clique aqui para ver uma versão maior desta figura.

Figura 8: Artefatos comuns durante a imagem com HPICM. (A) Efeito de um setpoint muito baixo. Imagens HPICM de baixa resolução dos mesmos feixes de células ciliadas internas vivas em camundongos P3 adquiridos com setpoint 0,05% (esquerda) e 0,07% (direita). Observe um ruído de ponto branco que desaparece com ponto mais alto. (B) Efeito de uma amplitude de salto muito alta. O ruído do ponto branco também aparece em uma imagem HPICM de um feixe de células ciliadas interiores de rato P7 obtido com uma grande amplitude de lúpulo de 5,8 μm (esquerda). Este ruído desaparece quando o mesmo feixe é imageado com a amplitude de lúpulo de 3,4 μm (direita) devido à diminuição das vibrações no sistema. (C) Amplitude de lúpulo muito baixa resulta na colisão da sonda HPICM para a estereócilia e arrastando-as (setas no painel esquerdo). Aumentar a amplitude do lúpulo apenas o suficiente para "escalar" estereócilia elimina este artefato (à direita), mas também pode aumentar o tempo de imagem, resultando em uma deriva perceptível (linhas verticais no painel direito). Esterecilia feixe de uma célula ciliada exterior viva de rato P7. (D) O ponto de setpoint muito alto causa uma forma quadrada de pontas estereócilias (setas) em uma imagem HPICM (esquerda), novamente devido à colisão da nanopipette ao estereocilia. A diminuição do setpoint (com diminuição simultânea da amplitude de esperança para eliminar o ruído branco) melhora a imagem (direita). Esterecilia feixe de uma célula ciliada interior viva de rato P6. Clique aqui para ver uma versão maior desta figura.
| Resolução | Área de imagem (μm) | Resolução Lateral (nm) | Tempo por imagem (minutos) |
| Baixo | 20×20 | ≥300 | ≤20 |
| Baixo | 10×10 | ≥156 | ≤15 |
| Baixo | 5×5 | ≥75 | ≤4 |
| Alto | 20×20 | ≤200 | ≤20 |
| Alto | 10×10 | ≤110 | ≤15 |
| Alto | 5×5 | ≤55 | ≤4 |
Tabela 1: Tempos típicos de imagem HPICM dependendo do tamanho da área de imagem e da resolução de digitalização.
Discussão
Para obter imagens HPICM bem-sucedidas, os usuários precisam estabelecer um sistema de baixa ruído e baixa vibração e fabricar pipetas apropriadas. Recomendamos fortemente o uso de padrões de calibração AFM para testar a estabilidade do sistema antes de tentar realizar qualquer imagem de célula viva. Uma vez que a resolução do sistema é testada, os usuários podem considerar o órgão fixo de imagem das amostras de Corti para se familiarizar com as configurações de imagem antes de tentar qualquer imagem de célula viva.
O setpoint ideal para imagem varia entre diferentes pipetas, dependendo da forma individual de suas pontas (que é desconhecida até examinada por microscopia eletrônica) e na quantidade de sujeira presa à ponta, que também é imprevisível. Nanopipettos com um setpoint ideal superior a 0,7% devem ser descartados.
Durante a imagem de células vivas, a quantidade de poeira e detritos na solução extracelular aumenta com o tempo. Todas essas partículas podem acabar na ponta da pipeta, causando uma redução na correnteza e impossibilitando continuar escaneando o tecido - a imagem ficará completamente branca, pois o feedback vai "pensar" que a nanopipette está sempre nas proximidades da amostra. Se isso acontecer, recomenda-se retirar a pipeta no eixo Z daquela área do tecido. Essa retração poderia limpar a "sujeira". Se a pipeta ainda estiver suja, é necessário trocar a pipeta e passar para uma área diferente da amostra. Em seguida, o usuário pode continuar a escanear o tecido.
A partir de hoje, a limitação mais essencial do HPICM é a quantidade de tempo necessária para tirar uma imagem em alta resolução enquanto trabalha com amostras com topografia complexa. Dependendo da resolução desejada, as imagens podem levar até meia hora ou mais. Em imagens adquiridas por mais de quinze minutos, a deriva pode se tornar evidente e estruturas específicas podem ser deslocadas e mais difíceis de distinguir. Isso está acontecendo porque as células vivas estão constantemente se movendo ou mudando sua forma ao longo do tempo. Para visualizar eventos moleculares e mudanças nas estruturas das células ao longo do tempo, são necessários novos desenvolvimentos para otimizar a resolução temporal do HPICM11.
O ruído da corrente nanopipette representa outra limitação porque define o ponto de setpoint mínimo praticamente alcançável. A corrente gerada pela nanopipette na solução atenua rapidamente (inversa proporcional à distância cúbica da ponta da pipeta), estabelecendo assim um "volume de sensoriamento", além do qual a nanopipette não pode "sentir" a superfície. Desenvolvemos anteriormente um modelo deste fenômeno e mostramos que a resolução lateral da sonda SICM é determinada pela seção transversal deste "volume de sensoriamento" com a superfície celular, que poderia ser extremamente pequena em setpoints baixos25. Isso é particularmente importante para a imagem de ligações de ponta de células ciliares que têm um diâmetro de ~5 nm12,33. À primeira vista, as pipetas com menor diâmetro interno resultariam em melhor resolução de imagens HPICM. Isso é realmente verdade para pipetas relativamente grandes (>50 nm). No entanto, a diminuição do diâmetro interno da nanopipette abaixo de ~50 nm resulta em um aumento desproporcionalmente grande do ruído da pipeta e, portanto, a perda de resolução em pontos baixos que são essenciais para os feixes de estereocilia de imagem. A partir de hoje, não sabemos como resolver esse problema e estamos trabalhando para encontrar a solução adequada.
Em resumo, este artigo apresenta um protocolo detalhado para a visualização de feixes de estereócilia em células ciliadas auditivas de mamíferos vivos com HPICM. As maiores vantagens do HPICM são: i) sua capacidade de visualizar estruturas nanoescala sem rótulos na superfície das células vivas sem tocá-las; e ii) sondar a função dessas estruturas com gravações de grampos de remendo e/ou entrega local de nanoescala de estímulos mecânicos ou químicos. Pelo que sabemos, essas vantagens são exclusivas do HPICM. Claro, há algumas desvantagens. Em primeiro lugar, devido às limitações na altura das estruturas a serem imagens, o HPICM pode não ser adequado para imagens de estruturas extremamente altas, como feixes de estereocilia das células ciliadas vestibulares na ampola de mamíferos. Em segundo lugar, o HPICM ainda está em desenvolvimento e mais melhorias na velocidade e resolução de imagens são necessárias. No entanto, os princípios físicos do HPICM e nossa própria experiência sugerem que é possível. Acreditamos que o HPICM fornecerá dados únicos sobre a função de complexos proteicos individuais na superfície da estereócilia.
Divulgações
Os autores não têm interesses concorrentes.
Agradecimentos
Agradecemos ao Prof. Yuri Korchev (Imperial College, Reino Unido) pelo apoio e aconselhamento a longo prazo em todas as etapas do projeto. Agradecemos também aos Drs. Pavel Novak e Andrew Shevchuk (Imperial College, Reino Unido), bem como ao Oleg Belov (National Research Centre for Audiology, Rússia) por sua ajuda no desenvolvimento de software. O estudo foi apoiado pelo NIDCD/NIH (R01 DC008861 e R01 DC014658 a G.I.F.).
Materiais
| Name | Company | Catalog Number | Comments |
| Analog oscilloscope | B&K Precision | 2160C | Analog oscilloscope for real-time monitoring of nanopipette current and Z-axis approach |
| AFM calibration standards | TED PELLA Inc | HS-100MG; HS-20MG | These 100 and 20 nm calibration standards are used to test the performance of HPICM system |
| Benchtop vibration Isolator | AMETEK/TMC | Everstill K-400 | Active vibration isolation |
| Borosilicate glass capillaries | World Precision Instruments (WPI) | 1B100F-4 | Borosilicate glass capillaries for the nanopipettes |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | To be added to the bath solution to adjust osmolarity |
| Digitizer | National Instruments Corporation | PCI-6221 | Multi-channel input/output digitizer |
| Fast analog Proportional-Integral-Derivative (PID) control for Z movement | Standford Research Systems | SIM900, SIM960, SIM980 | Instrumentation modules integrated in an external PID controller for Z movement. It requires a fast response that is usually not implemented in commercial piezo amplifiers. |
| Faraday cage | AMETEK/TMC | Type II | Required to shield electromagnetic interference |
| Glass bottom dish | World Precision Instruments (WPI) | FD5040-100 | Used as the dish for the chamber for the tissue |
| Hanks' Balanced Salt Solution (HBSS) | Gibco, Thermo Fisher Scientific | 14025092 | Extracellular (bath) solution |
| Instrumentation amplifier | Brownlee Precision | Model 440 | Instrumentation amplifier provides required offsets, filtering, and secondary magnification or attenuation |
| Laser-based micropipette puller | Sutter Instrument | P-2000/G | Micropipette puller to fabricate the nanopipettes. Laser is needed for sharp quartz pipettes. |
| Lebovitz's L-15, without phenol red | Gibco, Thermo Fisher Scientific | 21083027 | Extracellular (bath) solution |
| Micromanipulator | Scientifica | PatchStar | Used for "course" positioning of the Z piezo actuator |
| Microscope | Nikon | Eclipse TS100 | Inverted optical microscope |
| Patch amplifier | Molecular Devices | Axopatch 200B | The patch clamp amplifier measures the current through the nanopipette |
| Piezo amplifier (XY axes) | Physik Instrumente (PI) | E-500.00, E-505.00, E-509.C2A | Amplification and PID control for XY piezo translation stage |
| Piezo amplifier (Z axis) | Piezosystem jena | ENT 400 & 800 | Custom amplifier consisting of ENT 400 power supply and two ENT 800 amplifiers in parallel to achieve max current of 1.6 nA |
| Plastic Coverslips | TED PELLA Inc | 26028 | Used in the fabrication of the chambers for the tissue |
| SICM controller & software* | Ionscope, UK (ionscope.com) | N/A | Custom controller based on SBC6711 digital signal processing board from Innovative Integration Ltd |
| Silicone elastomer (Sylgard) | World Precision Instruments (WPI) | SYLG184 | Used to attach the flexible glass fibers to the chamber for the tissue |
| Silicon glue | The Dow Chemical Company | 734 | Used to glue the different parts of the chamber for the tissue |
| Tungsten rod | A-M Systems | 717500 | Used for holding the dental floss strands in the chamber for the tissue |
| XY piezo nanopositioner | Physik Instrumente (PI) | P-733.2DD | XY translation stage with capacitive sensors |
| Z piezo nanopositioner | Piezosystem jena | RA 12/24 SG | Ring piezoactuator with a strain gage sensor |
| *Ionscope does not sell separate SICM controllers anymore. There are few other commercial systems: NX12-Bio and NX10 SICM, | |||
| Park Systems, Korea and SICM modules from ICAPPIC Limited, UK (icappic.com). All these systems are based on the original | |||
| HPICM principles. However, imaging stereocilia bundles in the hair cells requires several custom modifications that are technically | |||
| challenging (or even impossible) in the closed “ready-to-go” systems such as Ionscope or NX12-Bio/NX10. Currently, there is only one | |||
| modular system (ICAPPIC) that has the flexibility to suit any SICM/HPICM experiment but requires some component integration. |
Referências
- Beurg, M., Fettiplace, R., Nam, J. H., Ricci, A. J. Localization of inner hair cell mechanotransducer channels using high-speed calcium imaging. Nature Neuroscience. 12 (5), 553-558 (2009).
- Effertz, T., Becker, L., Peng, A. W., Ricci, A. J. Phosphoinositol-4,5-bisphosphate regulates auditory hair-cell mechanotransduction-channel pore properties and fast adaptation. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 37 (48), 11632-11646 (2017).
- Peng, A. W., Gnanasambandam, R., Sachs, F., Ricci, A. J. Adaptation independent modulation of auditory hair cell mechanotransduction channel open probability implicates a role for the lipid bilayer. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 36 (10), 2945-2956 (2016).
- Engström, H., Engström, B. Structure of the hairs on cochlear sensory cells. Hearing research. 1 (1), 49-66 (1978).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Wäldchen, S., Lehmann, J., Klein, T., van de Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348(2015).
- Pickles, J. O., Comis, S. D., Osborne, M. P. Cross-links between stereocilia in the guinea pig organ of Corti, and their possible relation to sensory transduction. Hearing Research. 15 (2), 103-112 (1984).
- Furness, D. N., Hackney, C. M. Cross-links between stereocilia in the guinea pig cochlea. Hearing Research. 18 (2), 177-188 (1985).
- Jacobs, R. A., Hudspeth, A. J. Ultrastructural correlates of mechanoelectrical transduction in hair cells of the bullfrog’s internal ear. Cold Spring Harbor Symposia on Quantitative Biology. 55, 547-561 (1990).
- Goodyear, R. J., Marcotti, W., Kros, C. J., Richardson, G. P. Development and properties of stereociliary link types in hair cells of the mouse cochlea. The Journal of Comparative Neurology. 485 (1), 75-85 (2005).
- Kachar, B., Parakkal, M., Kurc, M., Zhao, Y., Gillespie, P. G. High-resolution structure of hair-cell tip links. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13336-13341 (2000).
- Vélez-Ortega, A. C., Freeman, M. J., Indzhykulian, A. A., Grossheim, J. M., Frolenkov, G. I. Mechanotransduction current is essential for stability of the transducing stereocilia in mammalian auditory hair cells. eLife. 6, 1-22 (2017).
- Ivanchenko, M. V., et al. Serial scanning electron microscopy of anti-PKHD1L1 immuno-gold labeled mouse hair cell stereocilia bundles. Scientific Data. 7 (1), 182(2020).
- Hadi, S., Alexander, A. J., Vélez-Ortega, A. C., Frolenkov, G. I. Myosin-XVa controls both staircase architecture and diameter gradation of stereocilia rows in the auditory hair cell bundles. Journal of the Association for Research in Otolaryngology JARO. 21 (2), 121-135 (2020).
- Metlagel, Z., et al. Electron cryo-tomography of vestibular hair-cell stereocilia. Journal of Structural Biology. 206 (2), 149-155 (2019).
- Langer, M. G., et al. Mechanical stimulation of individual stereocilia of living cochlear hair cells by atomic force microscopy. Ultramicroscopy. 82 (1-4), 269-278 (2000).
- Dufrêne, Y. F. Towards nanomicrobiology using atomic force microscopy. Nature Reviews Microbiology. 6 (9), 674-680 (2008).
- Putman, C. A., van der Werf, K. O., de Grooth, B. G., van Hulst, N. F., Greve, J. Viscoelasticity of living cells allows high resolution imaging by tapping mode atomic force microscopy. Biophysical journal. 67 (4), 1749-1753 (1994).
- Gavara, N., Chadwick, R. S. Noncontact microrheology at acoustic frequencies using frequency-modulated atomic force microscopy. Nature Methods. 7 (8), 650-654 (2010).
- Cartagena-Rivera, A. X., Van Itallie, C. M., Anderson, J. M., Chadwick, R. S. Apical surface supracellular mechanical properties in polarized epithelium using noninvasive acoustic force spectroscopy. Nature Communications. 8 (1), 1030(2017).
- Katsuno, T., et al. TRIOBP-5 sculpts stereocilia rootlets and stiffens supporting cells enabling hearing. JCI Insight. 4 (12), (2019).
- Hansma, P. K., Drake, B., Marti, O., Gould, S. A., Prater, C. B. The scanning ion-conductance microscope. Science. 243 (4891), 641-643 (1989).
- Korchev, Y. E., et al. Specialized scanning ion-conductance microscope for imaging of living cells. Journal of Microscopy. 188 (Pt 1), 17-23 (1997).
- Shevchuk, A. I., et al. Imaging proteins in membranes of living cells by high-resolution scanning ion conductance microscopy. Angewandte Chemie (International ed in English. 45 (14), 2212-2216 (2006).
- Novak, P., et al. Nanoscale live-cell imaging using hopping probe ion conductance microscopy. Nature Methods. 6 (4), 279-281 (2009).
- Vélez-Ortega, A. C., Frolenkov, G. I. Visualization of live cochlear stereocilia at a nanoscale resolution using hopping probe ion conductance microscopy. Methods in Molecular Biology. 1427, 203-221 (2016).
- Gu, Y., et al. High-resolution scanning patch-clamp: new insights into cell function. FASEB Journal Official Publication of the Federation of American Societies for Experimental Biology. 16 (7), 748-750 (2002).
- Frolenkov, G. I., et al. Single-channel recordings from the apical surface of outer hair cells with a scanning ion conductance probe. Association for Research in Otolaryngology. Abs. 444, (2004).
- Sánchez, D., et al. Noncontact measurement of the local mechanical properties of living cells using pressure applied via a pipette. Biophysical Journal. 95 (6), 3017-3027 (2008).
- Korchev, Y. E., Negulyaev, Y. A., Edwards, C. R., Vodyanoy, I., Lab, M. J. Functional localization of single active ion channels on the surface of a living cell. Nature Cell Biology. 2 (9), 616-619 (2000).
- Shevchuk, A., et al. Angular approach scanning ion conductance microscopy. Biophysical Journal. 110 (10), 2252-2265 (2016).
- Furness, D. N., Katori, Y., Nirmal Kumar, B., Hackney, C. M. The dimensions and structural attachments of tip links in mammalian cochlear hair cells and the effects of exposure to different levels of extracellular calcium. Neuroscience. 154 (1), 10-21 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados