Method Article
Imagerie de faisceaux stéréocilaires avec résolution à l’échelle nanométrique dans des cellules ciliées auditives de mammifères vivants
Dans cet article
Résumé
Nous présentons ici un protocole pour la microscopie à conductance ionique à sonde sautillante (HPICM), une technique de sonde à balayage sans contact qui permet l’imagerie à l’échelle nanométrique des faisceaux de stéréocils dans les cellules ciliées auditives vivantes.
Résumé
Les cellules ciliées de l’oreille interne détectent les déplacements induits par le son et transduisent ces stimuli en signaux électriques dans un faisceau de cheveux constitué de stéréocils disposés en rangées de hauteur croissante. Lorsque les stéréocils sont déviés, ils tirent sur de minuscules liens extracellulaires (~ 5 nm de diamètre) interconnectant les stéréocils, qui transmettent des forces aux canaux de transduction mécanosensibles. Bien que la mécanotransduction ait été étudiée dans les cellules ciliées vivantes pendant des décennies, les détails ultrastructuraux fonctionnellement importants de la machinerie de mécanotransduction aux extrémités des stéréocils (tels que la dynamique des liens de pointe ou le remodelage des stéréocils dépendant de la transduction) ne peuvent encore être étudiés que dans les cellules mortes avec microscopie électronique. Théoriquement, les techniques de sonde à balayage, telles que la microscopie à force atomique, ont une résolution suffisante pour visualiser la surface des stéréocils. Cependant, indépendamment du mode d’imagerie, même le moindre contact de la sonde de microscopie à force atomique avec le faisceau stéréocileux endommage généralement le faisceau. Nous présentons ici un protocole détaillé pour l’imagerie par microscopie à conductance ionique à sonde sautillante (HPICM) de cellules ciliées auditives de rongeurs vivants. Cette technique de sonde à balayage sans contact permet l’imagerie en accéléré de la surface de cellules vivantes avec une topographie complexe, comme les cellules ciliées, avec une résolution d’un nanomètre et sans entrer en contact physique avec l’échantillon. Le HPICM utilise un courant électrique traversant la nanopipette en verre pour détecter la surface de la cellule à proximité de la pipette, tandis qu’un système piézoélectrique de positionnement 3D scanne la surface et génère son image. Avec HPICM, nous avons pu imager des faisceaux de stéréocils et les liens interconnectant les stéréocils dans des cellules ciliées auditives en direct pendant plusieurs heures sans dommages notables. Nous prévoyons que l’utilisation de l’IHMHP permettra d’explorer directement les changements ultrastructurels dans les stéréocils des cellules ciliées vivantes pour mieux comprendre leur fonction.
Introduction
Malgré le fait que les faisceaux de stéréocils dans les cellules ciliées auditives sont assez grands pour être visualisés par microscopie optique et déviés dans des cellules vivantes dans une expérience de pince à patch, les composants structurels essentiels de la machinerie de transduction tels que les liens de pointe ne pourraient être imagés qu’avec la microscopie électronique dans les cellules mortes. Dans les cellules ciliées auditives des mammifères, la machine de transduction est située aux extrémités inférieures des maillons de la pointe, c’est-à-dire à l’extrémité des stéréocils de la rangée plus courte1 et régulée localement par la signalisation aux extrémités des stéréocils2,3. Pourtant, l’imagerie sans étiquette des structures de surface à cet endroit dans les cellules ciliées vivantes n’est pas possible en raison de la petite taille des stéréocils.
La cochlée de mammifère a deux types de cellules sensorielles auditives: les cellules ciliées internes et externes. Dans les cellules ciliées internes, les stéréocils sont plus longs et plus épais que ceux des cellules ciliées externes4. La première et la deuxième rangée de stéréocils ont un diamètre de 300 à 500 nm dans les cellules ciliées internes de souris ou de rats. En raison de la diffraction de la lumière, la résolution maximale réalisable avec une microscopie optique sans étiquette est d’environ 200 nm. Par conséquent, la visualisation des stéréocils individuels dans les première et deuxième rangées du faisceau interne de cellules ciliées est relativement facile avec la microscopie optique. En revanche, les stéréocils de rangée plus courte dans les cellules ciliées internes et tous les stéréocils des cellules ciliées externes ont des diamètres d’environ 100-200 nm et ne peuvent pas être visualisés avec la microscopie optique5. Malgré les progrès récents de l’imagerie à super-résolution, cette limitation fondamentale persiste dans toute imagerie optique sans étiquette. Toutes les techniques de super-résolution actuellement disponibles dans le commerce nécessitent une sorte de molécules fluorescentes6, ce qui limite leurs applications. En plus des limitations dues à la nécessité de molécules spécifiques marquées par fluorescence, il a été démontré que l’exposition à une irradiation lumineuse intense induit des dommages cellulaires et pourrait influencer les processus cellulaires, ce qui est un grand inconvénient lors de l’étude des cellules vivantes7.
Notre connaissance actuelle des détails ultrastructuraux des faisceaux stéréocils des cellules ciliées a été obtenue principalement avec diverses techniques de microscopie électronique (EM), telles que la microscopie électronique à balayage (MEB), la microscopie électronique à transmission (TEM), l’EM par congélation-fracture, et récemment avec des techniques 3D telles que la section en série avec faisceau d’ions focalisés ou la cryo-TOMOGRAPHIE EM8,9,10,11,12,13, 14,15,16. Malheureusement, toutes ces techniques EM nécessitent une fixation chimique ou cryofixation de l’échantillon. Selon l’échelle de temps des phénomènes, cette exigence rend impossible ou très laborieuse l’étude des processus dynamiques aux extrémités des stéréocils.
Des efforts limités ont été faits pour imager des faisceaux de cheveux de cellules ciliées vivantes avec la microscopie à force atomique (AFM)17,18. Étant donné que l’AFM fonctionne dans des solutions physiologiques, il pourrait, en théorie, visualiser les changements dynamiques dans les faisceaux stéréocilaires des cellules ciliées vivantes au fil du temps. Le problème réside dans les principes de l’AFM haute résolution, qui implique un certain contact physique entre la sonde AFM et l’échantillon, même en mode « tapping » le moins dommageable19. Lorsque la sonde AFM rencontre un stéréocilium, elle s’écrase généralement contre lui, endommageant la structure du faisceau de cheveux. En conséquence, cette technique ne convient pas à la visualisation de faisceaux de cellules ciliées vivantes, voire fixes,17,18. Le problème peut être partiellement atténué en utilisant une grande sonde AFM en forme de boule qui n’impose que des forces hydrodynamiques à la surface de l’échantillon20. Cependant, même si une telle sonde est idéale pour tester les propriétés mécaniques de l’échantillon21,elle ne fournit qu’une résolution inférieure au micromètre lors de l’imagerie de l’organe de Corti22 et applique toujours à l’échantillon une force qui peut être substantielle pour les faisceaux stéréocilaires très sensibles.
La microscopie à conductance ionique à balayage (SICM) est une version de la microscopie à sonde à balayage qui utilise une sonde à pipette en verre remplie d’une solution conductrice23. SICM détecte la surface lorsque la pipette s’approche de la cellule et que le courant électrique à travers la pipette diminue. Comme cela se produit bien avant de toucher la cellule, le SICM est idéal pour l’imagerie sans contact de cellules vivantes en solution physiologique24. La meilleure résolution du SICM est de l’ordre de nanomètres simples, ce qui permet de résoudre des complexes protéiques individuels au niveau de la membrane plasmique d’une cellule vivante25. Cependant, à l’instar d’autres techniques de sonde de balayage, siCM est capable d’imager uniquement des surfaces relativement planes. Nous avons surmonté cette limitation en inventant le microscope à conductance ionique à sonde sautillante (HPICM)26, dans lequel la nanopipette s’approche de l’échantillon à chaque point d’imagerie(Figure 1A). En utilisant HPICM, nous avons pu imager des faisceaux de stéréocils dans des cellules ciliées auditives vivantes avec une résolution à l’échelle nanométrique27.
Un autre avantage fondamental de cette technique est que HPICM n’est pas seulement un outil d’imagerie. Contrairement à d’autres techniques de sonde à balayage, la sonde HPICM/SICM est une électrode largement utilisée en physiologie cellulaire pour les enregistrements électriques et la livraison locale de divers stimuli. L’activité des canaux ioniques n’interfère généralement pas avec l’imagerie HPICM, car le courant total à travers la sonde HPICM est de plusieurs ordres de grandeur supérieur au courant extracellulaire généré par les plus grands canaux ioniques25. Cependant, HPICM permet un positionnement précis de la nanopipette sur une structure d’intérêt et un enregistrement ultérieur à patch-pince monocanal à partir de cette structure28. C’est ainsi que nous avons obtenu les premiers enregistrements préliminaires de l’activité monocanal aux extrémités des stéréocils externes des cellulesciliées 29. Il convient de mentionner que même un courant important à travers la nanopipette ne peut pas produire de changements significatifs du potentiel à travers la membrane plasmique en raison de l’énorme shunt électrique du milieu extracellulaire. Cependant, les canaux ioniques individuels peuvent être activés mécaniquement par écoulement de liquide à travers la nanopipette30 ou chimiquement par application locale d’un agoniste31.
Dans HPICM, l’image est générée lorsqu’une nanopipette s’approche séquentiellement de l’échantillon en un point, se rétracte, puis se déplace dans la direction latérale pour répéter l’approche(Figure 1A). Un amplificateur à pince de raccordement applique constamment une tension à un fil AgCl dans la pipette(Figure 1B)pour générer un courant d’environ 1 nA dans la solution de bain. La valeur de ce courant lorsque la pipette est éloignée de la surface de la cellule est déterminée comme un courant de référence (Iréf, Figure 1C). Ensuite, la pipette se déplace dans l’axe Z pour s’approcher de l’échantillon jusqu’à ce que le courant soit réduit d’une quantité prédéfinie par l’utilisateur (point de consigne), généralement 0,2%-1% de la référence I (Figure 1C,trace supérieure). Le système enregistre ensuite la valeur Z à ce moment comme la hauteur de l’échantillon, ainsi que les coordonnées X et Y de ce point d’imagerie. Ensuite, la pipette est rétractée loin de la surface(Figure 1C,trace inférieure) à une vitesse définie par l’utilisateur, généralement de 700 à 900 nm/ms. Après la rétraction, la pipette (ou, dans notre cas, l’échantillon - voir figure 1B) est déplacée latéralement vers le point d’imagerie suivant, une nouvelle valeur de courant de référence est obtenue et la pipette s’approche à nouveau de l’échantillon, répétant le processus. Le mouvement X-Y de la pipette est préféré dans une configuration de microscope vertical qui est généralement utilisée pour les enregistrements des courants de mécanotransduction des cellules ciliées. Dans ce contexte, la sonde HPICM s’approche des faisceaux de cellules ciliées non pas par le haut mais à un anglede 32. Cependant, la meilleure résolution de l’imagerie HPICM est obtenue dans une configuration de microscope inversé(Figure 1A,B),où le mouvement de l’échantillon dans les directions X-Y est découplé du mouvement Z de la nanopipette, éliminant ainsi les artefacts mécaniques potentiels.
En utilisant HPICM, nous avons obtenu des images topographiques de faisceaux de stéréocils de cellules ciliées internes et externes de souris et de rats, et avons même visualisé les liens entre les stéréocils d’environ 5 nm de diamètre26,27. Le succès de l’imagerie des faisceaux de cellules ciliées avec cette technique repose sur plusieurs facteurs. Tout d’abord, le bruit (variance) du courant de la nanopipette doit être aussi faible que possible pour permettre le point de consigne le plus bas possible pour l’imagerie HPICM. Un point de consigne bas permet à la sonde HPICM de « détecter » la surface des stéréocils à une plus grande distance et à n’importe quel angle par rapport à l’approche de la sonde et, étonnamment, améliore la résolution X-Y de l’imagerie HPICM (voir Discussion). Deuxièmement, les vibrations et les dérives dans le système doivent être réduites à moins de 10 nm, car elles contribuent directement aux artefacts d’imagerie. Enfin, même si la sonde HPICM et l’étage de l’échantillon sont déplacés dans les axes Z et X-Y par les actionneurs piézoélectriques calibrés à rétroaction qui ont une précision d’un seul nanomètre ou mieux, le diamètre de la pointe de la nanopipette détermine la propagation du courant (volume de détection) et donc la résolution(Figure 1A). Par conséquent, avant d’imager des cellules ciliées vivantes, il est essentiel de tirer les pipettes adéquates, d’atteindre la résolution souhaitée avec des échantillons d’étalonnage et d’obtenir un faible bruit dans le système d’enregistrement.
Depuis au moins deux décennies, la technique SICM n’est pas disponible dans le commerce et elle n’a été développée que par quelques laboratoires dans le monde avec le laboratoire leader du professeur Korchev à l’Imperial College (Royaume-Uni). Récemment, plusieurs systèmes SICM sont devenus disponibles dans le commerce (voir Tableau des matériaux),qui sont tous basés sur les principes originaux de l’IAHP. Cependant, l’imagerie des faisceaux de stéréocils dans les cellules ciliées nécessite plusieurs modifications personnalisées qui sont techniquement difficiles (voire impossibles) dans les systèmes fermés « prêts à l’emploi ». Par conséquent, une certaine intégration des composants est nécessaire. Étant donné que la configuration HPICM représente un banc de serrage avec des exigences de vibration et de dérive plus strictes et un mouvement piézo-entraîné de la sonde HPICM et de l’échantillon(Figure 1D), cetteintégration est relativement facile pour tout chercheur, qui maîtrise le serrage de patch. Cependant, un scientifique sans formation appropriée aurait certainement besoin d’une formation en électrophysiologie d’abord. Malgré les défis restants tels que l’augmentation de la vitesse d’imagerie (voir Discussion),nous avons été en mesure d’imager des faisceaux de stéréocils dans des cellules ciliées vivantes avec une résolution à l’échelle nanométrique sans les endommager.
Cet article présente un protocole détaillé pour effectuer avec succès l’imagerie HPICM des faisceaux de cellules ciliées auditives vivantes dans les explants cochléaires de jeunes rats ou souris postnatals à l’aide de notre système personnalisé. Les composants intégrés sont répertoriés dans la table des matériaux. Le document décrit également les problèmes courants qui peuvent être rencontrés et comment les résoudre.
Protocole
L’étude a été réalisée conformément aux recommandations du Guide pour le soin et l’utilisation des animaux de laboratoire des National Institutes of Health. Toutes les procédures animales ont été approuvées par l’Institutional Animal Care and Use Committee (IACUC) de l’Université du Kentucky (protocole 00903M2005).
1. Fabrication et test des nanopipettes
- Créer un programme dans l’extracteur de micropipette pour obtenir des pipettes avec une résistance comprise entre 200 et 400 MΩ, ce qui correspond à des diamètres de pointe intérieurs d’environ 50-70 nm. Les paramètres dépendront de l’extracteur de micropipette. Pour obtenir des pipettes courtes avec des pointes fines non flexibles, consultez le manuel d’utilisation du extracteur.
- Utilisez des capillaires en verre borosilicate d’un diamètre extérieur/intérieur de 1/0,58 mm et un filament intérieur pour faciliter le remplissage. La longueur de la pipette est cruciale car elle détermine la fréquence de la résonance mécanique latérale de la pipette. Plus la pipette est longue, plus la fréquence de résonance est basse et plus il est difficile d’éviter cette résonance.
REMARQUE: L’utilisateur doit essayer de fabriquer la pipette la plus courte que le support puisse accepter. La longueur des nanopipettes dans cette expérience est généralement de 15-25 mm(Figure 2A). - Remplissez la nanopipette jusqu’à son point médian(Figure 2A)avec une solution de bain, soit la L-15 de Leibovitz, soit avec la solution saline équilibrée (HBSS) de Hank complétée par 20 mM de D-glucose (pour ajuster l’osmolarité). Pour éviter les artefacts potentiels, utilisez la même solution que celle qui sera utilisée dans le bain pour les enregistrements.
- À l’aide d’un microscope optique avec un grossissement de 10x, vérifiez la présence de bulles à l’extrémité de la pipette(Figure 2B). Les bulles empêcheraient le flux de courant. Il est plus difficile d’enlever les bulles dans les pipettes qui ont été tirées plusieurs heures avant l’expérience. Par conséquent, il est recommandé de tirer de nouvelles pipettes à chaque expérience.
- Une fois la pipette exempte de bulles, montez-la dans le porte-pipette HPICM (Figure 2C).
- Placez l’échantillon (tissu ou étalon d’étalonnage) sur la chambre construite sur mesure et ajoutez 4 mL de la solution de bain mentionnée ci-dessus.
- Placez la chambre sur mesure sur l’étage HPICM et introduisez l’électrode de terre dans la solution.
- Assurez-vous que la tension appliquée à la pipette par l’amplificateur à pince de patch est nulle.
- Déplacez la pipette en Z jusqu’à ce qu’elle touche le liquide.
- Réglez le décalage de l’amplificateur sur zéro, puis ajoutez +100 mV pour vérifier le courant de la pipette.
- Calculer la résistance et le diamètre de la pipette, en fonction de la loi d’Ohm :
R = V/I
où R est la résistance (MOhm), V est la tension appliquée à la nanopipette (mV) et I est le courant circulant à travers la nanopipette (nA).- Calculer le diamètre intérieur de la pipette tel que décrit ailleurs selon la formule12suivante :
Conseil d’identification = 1000/ √R
REMARQUE: La valeur de résistance idéale est comprise entre 200 et 400 MΩ. Les pipettes avec une résistance supérieure à 400 MΩ peuvent conduire à un courant instable en raison de leur petite taille (< diamètre intérieur de 50 nm). Au contraire, les pipettes avec des résistances inférieures à 200 MΩ sont trop grandes (> 70 nm de diamètre intérieur) et ne résoudraient pas les petites caractéristiques. Il est recommandé de commencer l’imagerie avec les pipettes de résistance de 200 MΩ, car elles sont plus faciles à fabriquer et ont tendance à fournir moins de bruit électrique.
- Calculer le diamètre intérieur de la pipette tel que décrit ailleurs selon la formule12suivante :
2. Minimiser les dérives et les vibrations des échantillons
REMARQUE: Pour réduire le bruit mécanique dans le système pendant l’imagerie, montez les échantillons sur les chambres construites sur mesure qui utilisent des lames de verre épaisses (~ 1,2 mm):
- Retirez la partie en verre d’un plat à fond de verre de 50 mm, en laissant les parois en plastique intactes.
- Collez la partie en plastique du plat de culture cellulaire sur le dessus de l’épaisse lame de verre avec de la colle de silicium.
- Montez l’échantillon d’étalonnage au milieu de la chambre (sur le dessus de la lame de verre) à l’aide de colle de silicium ou de ruban adhésif double face mince.
- Fixez fermement la chambre sur la scène HPICM à l’aide de ruban adhésif double face.
- Pendant l’imagerie, fermez la cage de Faraday et recouvrez-la d’une couverture pour minimiser les interférences électriques et la dérive thermique, en conséquence.
3.Tester la résolution avec les étalons d’étalonnage AFM
REMARQUE: Il est fortement recommandé d’imager les normes AFM (voir Tableau des matériaux) avant d’imager des cellules vivantes afin de dépanner le système et de tester sa résolution dans les axes X-Z-Y. Les étalons d’étalonnage ont des piliers et des trous en dioxyde de silicium de différentes formes, mais des hauteurs / profondeurs fixes (c’est-à-dire 20 ou 100 nm) sur une puce de silicium de 5 x 5 mm. Il est recommandé de commencer par l’étalon d’étalonnage 100 nm pour garantir que la résolution Z est inférieure à 100 nm. Après avoir obtenu une image haute résolution réussie des piliers ou des trous de cet échantillon d’étalonnage(Figure 3A),passez à la norme 20 nm. Si l’imagerie de cette dernière norme est réussie(Figure 3B),la résolution dans l’axe Z est garantie inférieure à 20 nm et appropriée pour l’imagerie des faisceaux stéréocilaux de la cellule ciliée12. Les étapes suivantes sont utilisées pour imager les deux étalons d’étalonnage.
- Fixez l’étalon d’étalonnage à la chambre avec de la colle au silicium.
- Ajouter 4 mL de HBSS à la chambre pour couvrir l’échantillon d’étalonnage. Ensuite, fixez la chambre à l’étage XY de la configuration HPICM à l’aide de ruban adhésif double face.
- Fixez le support magnétique de l’électrode de terre à l’étage près de la chambre et immergez l’électrode dans la solution de bain(Figure 1B).
- Montez la nanopipette dans le support, immergez-la dans la solution de bain et réglez son courant sur ~1 nA en suivant les étapes décrites à la section 1.
- Placez la nanopipette approximativement au-dessus du centre de l’étalon d’étalonnage à l’aide d’un manipulateur de patch-clamp de cours. L’inspection visuelle est généralement suffisante pour ce positionnement, car la zone couverte par des structures de dioxyde de silicium est relativement grande (1 x 1 mm). Contrairement à l’organe des explants de Corti (voir ci-dessous), l’étalon d’étalonnage n’est pas transparent et, par conséquent, un positionnement plus précis guidé par imagerie optique n’est pas possible pour cet échantillon.
- Augmentez le point de consigne tout en surveillant le signal du capteur de l’actionneur piézoélectrique Z sur un oscilloscope en temps réel. Après avoir établi un cycle d’approche Z reproductible stable (comme dans la Figure 1C, en bas), diminuez le point de consigne à la valeur qui se trouve juste au-dessus du point d’instabilité. Cette procédure garantirait le point de consigne optimal pour cette nanopipette particulière.
- Déplacez la pipette vers le bas à une vitesse d’environ 5 μm/s à l’aide d’un micromanipulateur à pince de patch jusqu’à ce qu’elle atteigne l’échantillon. À ce moment, le niveau inférieur du signal de positionnement Z en temps réel(Figure 1C)augmentera, indiquant que la nanopipette est retirée en raison de la « détection » de la surface de l’échantillon. Tout mouvement ultérieur de la nanopipette entraînera un nouveau déplacement positif du signal de positionnement Z.
REMARQUE: Veillez à ne pas dépasser la limite supérieure du mouvement de l’actionneur piézoélectrique Z. - Démarrez l’imagerie à basse résolution (voir tableau 1). En raison du montage inégal de la norme AFM, le point le plus élevé de la zone d’intérêt peut être inconnu. Par conséquent, réglez l’amplitude de la rétraction de la pipette (amplitude du saut) à au moins 200-500 nm.
- Une fois que le point le plus élevé de l’échantillon dans la zone d’imagerie est identifié, diminuez l’amplitude du saut. Une amplitude de saut plus petite permet un balayage plus rapide, ce qui est préférable pour l’imagerie haute résolution en raison de la diminution des effets des dérives et de la diminution des vibrations.
- Avant de déplacer la pipette vers un nouvel emplacement X-Y, rétractez-la d’environ 200 μm dans l’axe Z pour éviter toute collision indésirable avec l’échantillon.
REMARQUE: Dans les cas où la nanopipette n’est pas alignée avec le centre de l’étalon d’étalonnage, il est possible que le balayage commence juste à côté de la zone des caractéristiques de surface. - Une fois la zone d’intérêt trouvée, commencez à imager à une résolution plus élevée (voir tableau 1).
4. Fabrication de chambres sur mesure pour sécuriser les explants cochléaires
REMARQUE: Montez les explants cochléaires dans les chambres avec des systèmes de serrage sur mesure qui utilisent soit des pipettes en verre flexible (étape 4.1)(Figure 4A) ou de la soie dentaire (étape 4.2) (Figure 4B). La chambre de pipette en verre pourrait être stérilisée et utilisée pour les organes cultivés de Corti, tandis que la chambre de soie dentaire offre une tenue plus sûre de l’échantillon et un contrôle de l’orientation du faisceau stéréocileux pendant le montage. Ces chambres construites sur mesure doivent être préparées à l’avance, mais elles peuvent être nettoyées et réutilisées lors de plusieurs séances d’imagerie.
- Fabriquer une chambre à l’aide de pipettes en verre flexible
- Tirez deux fibres de verre minces et flexibles des capillaires en verre à l’aide d’un extracteur de pipette. Nos fibres de verre tirées mesurent généralement de 1 à 2 cm de long et sont assez flexibles.
- Placez une petite goutte de l’élastomère de silicone sur un couvercle en verre. Utilisez des couvercles de 2 cm de diamètre.
- Placez les extrémités de deux fibres de verre sur la goutte de silicone et disposez les fibres pour avoir un petit degré de séparation entre elles (Figure 4A).
- Placez le couvercle sur une plaque chauffante pour durcir rapidement l’élastomère (1 à 3 min).
- Collez le couvercle sur le fond en verre de la chambre décrite à la section 2 en utilisant une petite quantité (1-3 μL) d’élastomère de silicone et en lui permettant de durcir pendant la nuit.
- Fabrication d’une chambre à l’aide de fil dentaire:
- Retirez la partie en verre d’un plat à fond de verre de 50 mm, en laissant les parois en plastique intactes. Ensuite, collez la partie en plastique de la boîte de culture cellulaire sur une lame de verre de 1,2 mm d’épaisseur avec de la colle de silicium.
- Montez un couvercle en plastique (6,5 x 6,5 mm) avec la même colle au centre de la chambre. Répétez ensuite le processus avec un autre couvercle au-dessus du précédent.
- Montez deux petits fils en tungstène ou plaqués or (12 mm de longueur et ~ 0,5 mm de diamètre) avec de la colle de silicium, chacun sur les côtés opposés des glissières de couverture. Collez-les assez loin (> 10-15 mm) des glissières de couverture (Figure 4B).
- Séparez deux brins de soie dentaire et placez-les sur les glissières de couverture et fixez-les aux fils en faisant un nœud. Laissez un petit espace entre les deux brins(Figure 4B,flèches courtes).
- Nettoyez les chambres après chaque utilisation
- Retirez doucement le tissu de la chambre à l’aide d’une pince à épiler fine et grattez légèrement les résidus de tissu laissés derrière.
- Rincez d’abord la chambre avec de l’éthanol à 70%, puis avec de l’eau distillée.
- Répétez le cycle de rinçage si nécessaire.
- Placez la chambre à l’envers sur un papier filtre pour la laisser sécher jusqu’à la prochaine expérience. Les chambres n’ont pas besoin d’être stérilisées, sauf si la culture de l’organe de Corti est prévue après l’imagerie.
5. Disséquer l’organe rongeur de Corti
- Effectuer une dissection des jeunes explants cochléaires postnatals comme décrit en détailailleurs 13.
- Pour l’imagerie HPICM, disséquez l’organe de Corti de souris entre les jours postnatals 3 et 6 (P3-6), et de rats entre les jours postnatals 3 et 8 (P3-8).
REMARQUE: Les cellules ciliées plus anciennes sont plus sensibles aux dommages pendant la dissection et, par conséquent, ne peuvent pas être utilisées pour l’imagerie HPICM en accéléré de plusieurs heures. - N’oubliez pas de retirer la membrane tectoriale avant l’imagerie HPICM.
- Immédiatement après la dissection, fixer le tissu dans l’une des chambres décrites à la section 4, soit en le plaçant sous les pipettes en verre souple, soit sous les deux brins de soie dentaire (Figure 4). Pré-remplissez ces chambres avec 4 mL de la solution de bain à température ambiante (pour minimiser la formation de bulles).
6. Imagerie des cellules ciliées auditives
- Montez la chambre avec un orgue corti fraîchement isolé sur l’étage piézoélectrique X-Y à l’aide de ruban adhésif double face et assurez-vous qu’elle est fermement fixée pour minimiser la dérive de la chambre dans les axes X et Y(Figure 1B).
- Suivez les étapes de la section 1 pour placer une nouvelle nanopipette et vérifier la résistance correcte de la pipette.
- À l’aide d’un micromanipulateur à pince patch, positionnez la nanopipette sur la région des cellules ciliées, tout en observant l’organe de l’explantation de Corti dans un microscope inversé.
- Vérifiez si le système est stable avec un point de consigne de 0,5 % ou moins en enregistrant le courant en temps réel et le signal de positionnement Z sur l’oscilloscope (comme dans la Figure 1C). Si le signal Z n’est pas stable, essayez de diminuer la fréquence de coupure du filtre passe-bas de l’amplificateur à pince patch. Cependant, il ne peut pas être inférieur au temps de réponse de l’actionneur piézoélectrique Z (pour éviter la collision de la pipette avec l’échantillon en raison de lectures de courant retardées).
REMARQUE: En pratique, le réglage de 5 kHz de ce filtre s’avère optimal. Il est préférable de remplacer la nanopipette, si le signal Z est encore instable. - Une fois qu’un enregistrement stable est obtenu, déterminez le point de consigne optimal et approchez l’échantillon avec la pipette HPICM comme décrit dans les étapes 3.6-3.7 ci-dessus.
- Tout d’abord, effectuez une imagerie à basse résolution (voir tableau 1),en utilisant une amplitude de saut d’au moins 6 à 8 μm. Pour imager des structures hautes telles que les faisceaux de stéréocils de cellules ciliées, assurez-vous que l’amplitude du saut est suffisante pour éviter toute collision avec ces structures.
REMARQUE: Si l’amplitude du saut n’est pas suffisante, la pipette ne pourra pas sauter par-dessus un stéréocilium et il y aura une collision imminente. La collision de la sonde HPICM avec un stéréocilium peut endommager le faisceau de cheveux. Par conséquent, dans les cas où la hauteur du faisceau stéréocilal est incertaine, utilisez une amplitude de saut plus grande. - Familiarisez-vous avec la topographie de l’organe de Corti en effectuant et/ou en étudiant d’abord des images obtenues par microscopie électronique à balayage(Figure 5).
REMARQUE: Si l’image HPICM est uniforme avec des hauteurs inférieures à 1 μm dans chaque point d’imagerie, la pipette scanne probablement le fond du verre et non le tissu. Alternativement, la pipette peut « atterrir » sur une région différente de l’explante cochléaire, loin des cellules ciliées. - Si la pipette doit être déplacée vers un nouvel emplacement X-Y, rétractez-la d’environ 500 nm pour éviter les collisions avec des caractéristiques hautes dans le tissu. Répétez l’imagerie HPICM à basse résolution jusqu’à ce que la région d’intérêt avec les cellules ciliées soit trouvée.
- Une fois la région d’intérêt trouvée, commencez l’imagerie à une résolution plus élevée (voir tableau 1). Essayez de passer moins de 15 minutes lors de l’imagerie d’un faisceau de cheveux entier.
REMARQUE: Les faisceaux de cellules ciliées dans le tissu vivant ne sont pas immobiles, mais peuvent changer d’orientation, par exemple, en raison de changements de forme dans les cellules de soutien sous-jacentes. Par conséquent, les images peuvent présenter des artefacts de mouvement si l’acquisition de l’image est trop lente. - Encore une fois, déterminez les caractéristiques les plus hautes dans les images basse résolution avant de diminuer l’amplitude du saut pour l’imagerie haute résolution. Pour une région d’intérêt couvrant l’ensemble du faisceau de cellules ciliées, réduisez l’amplitude du houblon à 4-5 μm, tandis que pour une région relativement petite et « plate » à l’intérieur du faisceau (par exemple, 2 x 2 μm), réduisez encore plus l’amplitude du houblon, jusqu’à moins de 1 μm, augmentant ainsi la vitesse et la résolution de l’imagerie.
7. Traitement d’image
REMARQUE : Les artefacts d’imagerie sont courants dans l’imagerie HPICM. Certains d’entre eux peuvent être corrigés par des paramètres d’acquisition d’image, tandis que d’autres nécessitent un post-traitement soit avec une visionneuse SICM spécialisée, soit avec des programmes de traitement de données plus généraux comme ImageJ ou MatLab. Nous décrivons ici les artefacts les plus courants et comment nous les réparons avec la visionneuse SICM.
- Effectuer une correction de pente
REMARQUE: Ce n’est pas évident pour un débutant, mais l’œil humain ne peut pas résoudre les caractéristiques de taille inférieure au micromètre à la surface d’une cellule, si la zone d’imagerie a une pente globale de taille égale ou supérieure(Figure 3A,B, gauche). Par conséquent, il est nécessaire de déterminer la pente moyenne d’une zone imagée (en ajustant les données d’image HPICM 3D sur un seul plan) et de la soustraire de l’image HPICM(Figure 3A,B, milieu).- Cliquez sur Ouvrir pour ouvrir une image avec la visionneuse SICM.
- Sélectionnez l’onglet Correction d’image.
- Sélectionnez l’onglet Pente correcte.
- Appuyez sur le bouton Pente correcte pour une correction automatisée de la pente.
- Effectuer l’alignement des lignes
REMARQUE: Comme mentionné précédemment, les dérives mécaniques et / ou thermiques ainsi que les artefacts de mouvement cellulaire représentent un problème important dans l’imagerie HPICM. Une petite dérive avec une vitesse inférieure à un micromètre par minute n’est généralement pas perceptible dans une configuration de pince de patch régulière. Pourtant, il pourrait produire des artefacts de plusieurs dizaines de nanomètres en imagerie HPICM, ce qui est nettement plus grand que la résolution de HPICM. Par conséquent, il n’est pas rare de rencontrer des sauts soudains dans l’axe Z entre deux lignes de balayage HPICM voisines pendant l’imagerie. Cela pourrait être corrigé en analysant les différences entre les valeurs Z de début (et/ou de fin) dans ces lignes de balayage voisines.- Cliquez sur Ouvrir pour ouvrir une image avec la visionneuse SICM.
- Sélectionnez l’onglet Correction d’image.
- Sélectionnez l’onglet Pente correcte.
- Choisissez la largeur des lignes à aligner. Appuyez sur le bouton ButtonDestripeLineFit pour une correction automatisée de l’alignement des lignes.
- Effectuer une réduction du bruit
REMARQUE: Lors de l’obtention d’images avec HPICM, de petites fluctuations dans le courant de la nanopipette peuvent entraîner l’arrêt de la nanopipette loin de la surface de l’échantillon, en particulier avec de faibles points de consigne. Il en résulte l’apparition de petits points blancs dans l’image. Afin de corriger cet artefact d’imagerie, il est nécessaire d’identifier les points d’imagerie avec la valeur Z significativement plus grande que celle des voisins et de remplacer cette valeur par une moyenne des voisins. Cela se fait par un filtre médian réglable.- Cliquez sur Ouvrir pour ouvrir une image avec la visionneuse SICM.
- Sélectionnez l’onglet Traitement d’image.
- Sélectionnez l’onglet Réduction du bruit.
- Définissez le filtre Seuil (μm) pour les pixels à supprimer.
Résultats
Le protocole présenté dans cet article peut être utilisé pour visualiser toutes les cellules vivantes avec une topographie complexe. En suivant ces étapes, nous obtenons régulièrement des images de faisceaux de cellules ciliées auditives de rats vivants (Figure 6B, D). Bien qu’ayant une résolution X-Y inférieure à celle des images SEM, nos images HPICM peuvent résoudre avec succès les différentes rangées de stéréocils, la forme des extrémités des stéréocils et même les petites liaisons (~ 5 nm de diamètre) reliant les stéréocils adjacents(Figure 6F). De plus, les images HPICM contiennent des informations en 3D qui manquent aux images SEM. Compte tenu de la nature sans contact de ce type de technique d’imagerie, nous avons également pu effectuer une imagerie HPICM en accéléré continu du même faisceau de cellules ciliées pendant plusieurs heures (c’est-à-dire 5 à 6 h régulièrement) sans endommager la cohésion du faisceau(Figure 7). Ainsi, HPICM présente un grand potentiel pour l’étude des changements structurels dynamiques des faisceaux de cellules ciliées au fil du temps.
Bien que nous fournissions plusieurs gammes pour la taille de la pipette, le point de consigne actuel, les paramètres basse et haute résolution et les amplitudes de saut, chaque utilisateur peut avoir besoin d’optimiser légèrement ses paramètres pour obtenir des images HPICM réussies de faisceaux de cellules ciliées vivantes. Des points de consigne plus petits produisent des images de meilleure qualité. Cependant, avec un point de consigne très bas, le système peut interpréter de petites fluctuations du courant comme rencontrant la surface de la cellule, ce qui entraînera le bruit du « point blanc » dans l’image(Figure 8A). De même, de grandes amplitudes de saut peuvent augmenter la résonance latérale de la pipette et produire également des pixelsbruyants (Figure 8B). En revanche, si l’amplitude du saut est trop faible ou si le point de consigne est trop élevé, la nanopipette peut entrer en collision avec l’échantillon et conduire à des artefacts d’imagerie ou même endommager le faisceau de cheveux(Figure 8C,D). Nous vous recommandons d’effectuer l’imagerie à une résolution inférieure tout en ajustant tous ces paramètres afin de minimiser les dommages à l’échantillon ou à la nanopipette.

Figure 1 : Principes de la microscopie à conductance ionique à sonde sautillante (HPICM). (A) Un courant électrique traversant la nanopipette génère un « volume de détection » à l’extrémité de la pipette. Pour imager des structures complexes comme les faisceaux de stéréocils des cellules ciliées, la pipette s’approche de la surface cellulaire par le haut et se rétracte après avoir détecté la surface. Après un mouvement latéral à chaque étape, la pipette continue de « sauter » au-dessus de l’échantillon générant l’image de la cellule. Notez que l’amplitude du houblon doit être suffisante pour que la pipette « grimpe » jusqu’à un stéréocilium. L’amplitude de saut illustrée fonctionnerait pour le balayage de gauche à droite (du plus petit au plus haut stéréocilium, indiqué par une flèche). Cependant, il est trop petit pour un balayage de droite à gauche lorsque la pipette rencontre d’abord le stéréocilium le plus haut. (B) Installation expérimentale. Une chambre sur mesure avec l’organe de l’explante de Corti est montée sur une scène de nanopositionnement XY avec une ouverture pour l’observation de la microscopie optique. La nanopipette est déplacée par un actionneur piézoélectrique Z ultra-rapide séparé. Pour positionner la nanopipette sur la région d’intérêt, l’actionneur Z est monté sur un micromanipulateur conventionnel (non représenté) avec la tête de l’amplificateurà pince de patch. L’électrode de terre est montée sur un support magnétique et insérée dans le bain. (C) Enregistrements représentatifs du courant de la pipette (tracesupérieure) et de la position Z de la pipette (trace inférieure) pendant l’imagerie. Lorsque la pipette est éloignée de la surface de la cellule, la valeur de référence du courant traversant la pipette est déterminée (Iref). Ensuite, la pipette est déplacée vers l’échantillon (approche). Lorsque le « volume de détection » rencontre la surface de la cellule, le courant de la pipette commence à diminuer. La commande de retrait est émise lorsque la diminution actuelle atteint un point de consigne, qui est généralement de 0,2% à 1% de Iref. (D) Schémas de l’équipement qui doit être ajouté à une configuration de pince de raccordement conventionnelle pour l’imagerie HPICM. Un amplificateur de pince de patch dédié enregistre le courant de nanopipette (I) utilisé par le contrôleur SICM en mode HPICM pour générer des signaux de commande vers les axes X, Yet Z. L’amplificateur d’instrumentation fournit un décalage, une mise à l’échelle et un filtrage passe-bas à ces signaux, si nécessaire. Malheureusement, les signaux X / Y / Z du contrôleur ne peuvent pas être appliqués directement aux actionneurs piézoélectriques en raison d’erreurs importantes causées par l’hystérésis et le fluage inhérents à la céramique piézoélectrique. Par conséquent, chaque actionneur piézoélectrique (étage de traduction)dispose d’un capteur de mouvement intégré qui envoie un signal de rétroaction au contrôleur PID (Proportional-Integral-Derivative) qui préforme le signal de commande pour corriger ces erreurs. Notez que les axes X et Y relativement lents pourraient utiliser des contrôleurs PID intégrés dans l’amplificateur piézoélectrique,tandis qu’un axe Z plus rapide nécessite un contrôleur PIDrapide dédié. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Fabrication et remplissage de nanopipettes. (A) Nanopipette d’environ 2 cm de long remplie de la solution intrapipette (HBSS). (B) Image de la bulle (flèche) qui se forme généralement après le remplissage de la pipette. La bulle s’éloigne généralement quelques minutes après l’illumination du microscope (un microscope numérique LCD à 10x). (C) Une nanopipette montée dans la tête du SICM. La flèche pointe vers l’électrode AgCl à l’intérieur de la pipette. Notez que le porte-pipette est peint en argent et mis à la terre pour minimiser la captation électrique radiative de l’actionneur piézoélectrique Z. Veuillez cliquer ici pour voir une version agrandie de cette figure.
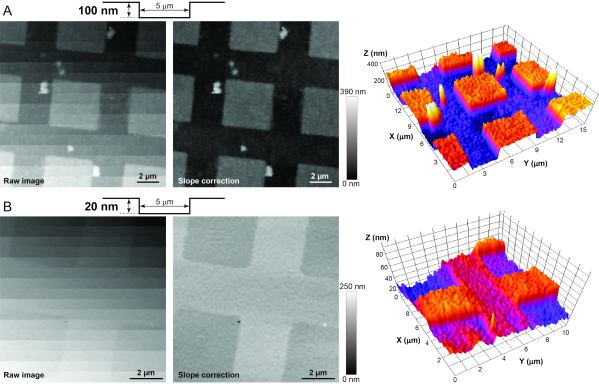
Figure 3 : Imagerie des étalons d’étalonnage AFM pour déterminer la stabilité adéquate, l’isolation des vibrations et le bruit électrique dans le système. (A) Images brutes (à gauche), post-traitées (au milieu) et 3D (à droite) de la norme d’étalonnage HS-100MG. Le profil de surface de la norme est représenté schématiquement en haut. Comme l’étalon n’est jamais parfaitement aligné perpendiculairement à la nanopipette, la correction de pente de post-traitement est nécessaire pour révéler de petites caractéristiques verticales de l’échantillon. (B) Images brutes (à gauche), post-traitées (au milieu) et 3D (à droite) similaires de l’étalon d’étalonnage HS-20MG qui présente des indentations plus petites et profondes de 20 nm. Notez que les niveaux de gris d’un pixel dans une image HPICM indiquent la hauteur de l’échantillon à ce point. Veuillez cliquer ici pour voir une version agrandie de cette figure.
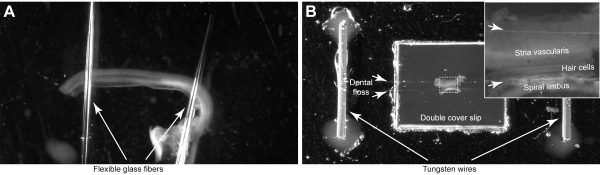
Figure 4 : Montage de l’organe de l’explantation de Corti. (A) L’explante est maintenue par deux pipettes en verre qui sont collées à la boîte de Petri à fond de verre. (B) L’explante est fixée par deux brins de soie dentaire (flèches courtes) dans une chambre d’imagerie sur mesure. L’encart montre l’image agrandie de l’orgue de Corti. Veuillez cliquer ici pour voir une version agrandie de cette figure.
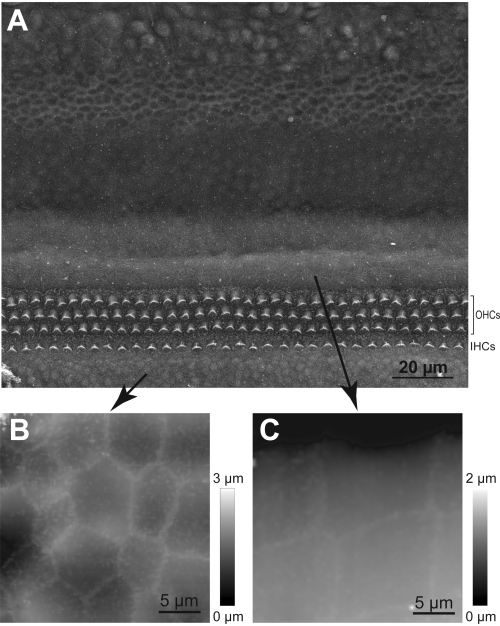
Figure 5 : Navigation de la sonde HPICM vers la région des cellules ciliées. (A) Image SEM de l’explant cochléaire montrant des rangées de cellules ciliées internes (IHC) et externes (OHC) et des types distincts de cellules de soutien. (B) Image HPICM représentative des cellules de l’organe de Kolliker. (C) Image HPICM des cellules de Hensen. Notez que ces deux types de cellules de soutien ont des formes très distinctes, ce qui permet de déterminer si la sonde HPICM a atterri dans une zone radiale ou périphérique aux cellules ciliées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
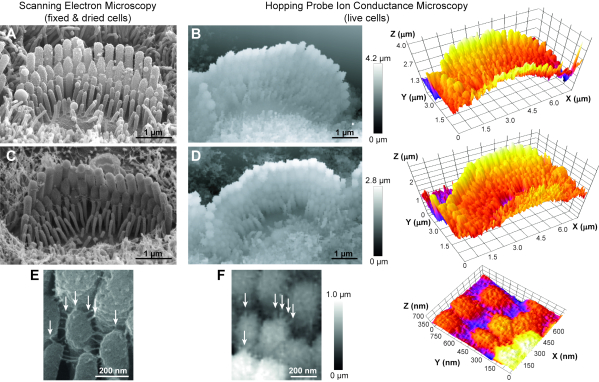
Figure 6 : Comparaison entre la microscopie électronique à balayage (MEB) et la microscopie à conductance ionique à sonde sautillante (HPICM) des faisceaux de stéréocils dans les jeunes cellules ciliées internes de rongeurs postnatals. (A,C) Les images SEM fournissent une résolution inférieure au nanomètre des détails de la surface, mais dans les cellules qui sont fixes et rétrécies en raison du séchage des points critiques. De plus, les images SEM ne permettent pas l’analyse 3D. (B,D) Les images HPICM (à gauche) ont une résolution pire (~ 5-10 nm), mais elles sont obtenues dans des cellules vivantes, permettent l’imagerie en accéléré et transportent des informations sur les hauteurs exactes, ce qui permet la reconstruction et les mesures 3D (à droite). (E,F) Les liens extracellulaires entre les stéréocils sont évidents dans les images SEM (E) et HPICM (F) (flèches). Âge des cellules : A, souris postnatale jour 5 (P5); B, P6 rat; Souris C, P8; D, P5 rat; E, souris P7; et F, P5 rat. Dans toutes les images HPICM, les niveaux de gris d’un pixel indiquent la hauteur de l’échantillon à ce point. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Imagerie HPICM en accéléré continu du faisceau de stéréocils. (A) Un aperçu d’un faisceau interne de cellules ciliées d’un rat P5 montrant des stéréocils distincts à rangée plus courte. (B) Imagerie en accéléré de la région d’intérêt indiquée en (A) pendant six heures. Notez que, contrairement à une expérience typique de camp de patch, les cellules ciliées ne montrent aucun signe de détérioration pendant plusieurs heures in vitro. Cela est dû à une dissection minutieuse et à l’absence de toute perturbation mécanique de la cellule. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Artefacts courants lors de l’imagerie avec HPICM. (A) Effet d’un point de consigne trop bas. Images HPICM basse résolution des mêmes faisceaux de cellules ciliées internes vivantes chez des souris P3 acquises avec un point de consigne de 0,05% (à gauche) et de 0,07% (à droite). Remarquez un bruit de point blanc qui disparaît avec un point de consigne plus élevé. (B) Effet d’une amplitude de saut trop élevée. Le bruit des points blancs apparaît également dans une image HPICM d’un faisceau interne de cellules ciliées de rat P7 obtenu avec une grande amplitude de saut de 5,8 μm (à gauche). Ce bruit disparaît lorsque le même faisceau est imagé avec une amplitude de saut de 3,4 μm (à droite) en raison de la diminution des vibrations dans le système. (C) Une amplitude de saut trop faible entraîne la collision de la sonde HPICM avec les stéréocils et leur glissement (flèches sur le panneau de gauche). Augmenter l’amplitude du saut juste assez pour « grimper » sur les stéréocils élimine cet artefact (à droite) mais peut également augmenter le temps d’imagerie, entraînant une dérive notable (lignes verticales dans le panneau de droite). Faisceau stéréocililiaire d’une cellule ciliée externe vivante de rat P7. (D) Un point de consigne trop élevé provoque une forme carrée des pointes de stéréocils (flèches) dans une image HPICM (à gauche), encore une fois en raison de la collision de la nanopipette avec les stéréocils. La diminution du point de consigne (avec diminution simultanée de l’amplitude de l’espoir pour éliminer le bruit blanc) améliore l’imagerie (à droite). Faisceau stéréocililiaire d’une cellule ciliée interne vivante de rat P6. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Résolution | Zone de l’image (μm) | Résolution latérale (nm) | Temps par image (minutes) |
| Bas | 20×20 | ≥300 | ≤20 |
| Bas | 10×10 | ≥156 | ≤15 |
| Bas | 5×5 | ≥75 | ≤4 |
| Haut | 20×20 | ≤200 | ≤20 |
| Haut | 10×10 | ≤110 | ≤15 |
| Haut | 5×5 | ≤55 | ≤4 |
Tableau 1 : Heures typiques de l’imagerie HPICM en fonction de la taille de la zone d’imagerie et de la résolution de numérisation.
Discussion
Pour obtenir des images HPICM réussies, les utilisateurs doivent établir un système à faible bruit et à faible vibration et fabriquer des pipettes appropriées. Nous recommandons fortement l’utilisation d’étalons d’étalonnage AFM pour tester la stabilité du système avant d’essayer d’effectuer une imagerie de cellules vivantes. Une fois la résolution du système testée, les utilisateurs peuvent envisager d’imager un organe fixe d’échantillons Corti pour se familiariser avec les paramètres d’imagerie avant de tenter toute imagerie de cellules vivantes.
Le point de consigne optimal pour l’imagerie varie entre les différentes pipettes, en fonction de la forme individuelle de leurs pointes (inconnue jusqu’à examen par microscopie électronique) et de la quantité de saleté attachée à la pointe, qui est également imprévisible. Les nanopipettes dont le point de consigne optimal est supérieur à 0,7 % doivent être jetées.
Lors de l’imagerie des cellules vivantes, la quantité de poussière et de débris dans la solution extracellulaire augmente avec le temps. Toutes ces particules peuvent se retrouver à l’extrémité de la pipette, provoquant une réduction du courant et rendant impossible de continuer à scanner le tissu - l’image deviendra complètement blanche puisque la rétroaction « pensera » que la nanopipette est toujours à proximité de l’échantillon. Si cela se produit, il est recommandé de rétracter la pipette dans l’axe Z de cette zone du tissu. Cette rétractation pourrait effacer la « saleté ». Si la pipette est encore sale, il est nécessaire de changer la pipette et de la déplacer vers une autre zone de l’échantillon. Ensuite, l’utilisateur peut continuer à scanner le tissu.
À ce jour, la limitation la plus essentielle du HPICM est le temps nécessaire pour prendre une image en haute résolution tout en travaillant avec des échantillons à la topographie complexe. Selon la résolution souhaitée, les images peuvent prendre jusqu’à une demi-heure ou plus. Dans les images acquises pendant plus de quinze minutes, la dérive peut devenir évidente et des structures spécifiques peuvent être décalées et plus difficiles à distinguer. Cela se produit parce que les cellules vivantes se déplacent constamment ou changent de forme au fil du temps. Pour visualiser les événements moléculaires et les changements dans les structures des cellules au fil du temps, d’autres développements sont nécessaires pour optimiser la résolution temporelle du HPICM11.
Le bruit du courant de la nanopipette représente une autre limitation car il définit le point de consigne minimal pratiquement réalisable. Le courant généré par la nanopipette dans la solution s’atténue rapidement (inversement proportionnel à la distance cubique de la pointe de la pipette), établissant ainsi un « volume de détection », au-delà duquel la nanopipette ne peut pas « sentir » la surface. Nous avons précédemment développé un modèle de ce phénomène et montré que la résolution latérale de la sonde SICM est déterminée par la section transversale de ce « volume de détection » avec la surface de la cellule, qui pourrait être extrêmement faible à des points de consigne bas25. Ceci est particulièrement important pour l’imagerie des liens de pointe des cellules ciliées qui ont un diamètre de ~ 5 nm12,33. Au premier coup d’œil, les pipettes de plus petit diamètre intérieur se traduiraient par une meilleure résolution de l’imagerie HPICM. C’est en effet vrai pour les pipettes relativement grandes (>50 nm). Cependant, la diminution du diamètre intérieur de la nanopipette en dessous de ~50 nm entraîne une augmentation disproportionnée du bruit de la pipette et, par conséquent, la perte de résolution à des points de consigne bas qui sont essentiels pour l’imagerie des faisceaux de stéréocils. À ce jour, nous ne savons pas comment résoudre ce problème et nous travaillons à trouver la bonne solution.
En résumé, cet article présente un protocole détaillé pour la visualisation des faisceaux de stéréocils dans les cellules ciliées auditives de mammifères vivants avec HPICM. Les plus grands avantages du HPICM sont: i) sa capacité à visualiser des structures nanométriques sans étiquette à la surface des cellules vivantes sans les toucher; et ii) sonder la fonction de ces structures avec des enregistrements de pinces de patch et/ou l’administration locale à l’échelle nanométrique de stimuli mécaniques ou chimiques. À notre connaissance, ces avantages sont uniques à HPICM. Bien sûr, il y a quelques inconvénients. Tout d’abord, en raison des limites de hauteur des structures à imager, l’IHMH peut ne pas convenir à l’imagerie de structures extrêmement hautes, telles que les faisceaux de stéréocils des cellules ciliées vestibulaires dans les ampoules des mammifères. Deuxièmement, HPICM est encore en développement et d’autres améliorations de la vitesse et de la résolution de l’imagerie sont nécessaires. Cependant, les principes physiques de HPICM et notre propre expérience suggèrent que c’est possible. Nous pensons que HPICM fournira des données uniques sur la fonction des complexes protéiques individuels à la surface des stéréocils.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts concurrents.
Remerciements
Nous remercions le professeur Yuri Korchev (Imperial College, Royaume-Uni) pour son soutien et ses conseils à long terme à toutes les étapes du projet. Nous remercions également les Drs Pavel Novak et Andrew Shevchuk (Imperial College, Royaume-Uni) ainsi que Oleg Belov (Centre national de recherche en audiologie, Russie) pour leur aide dans le développement de logiciels. L’étude a été soutenue par NIDCD/NIH (R01 DC008861 et R01 DC014658 à G.I.F.).
matériels
| Name | Company | Catalog Number | Comments |
| Analog oscilloscope | B&K Precision | 2160C | Analog oscilloscope for real-time monitoring of nanopipette current and Z-axis approach |
| AFM calibration standards | TED PELLA Inc | HS-100MG; HS-20MG | These 100 and 20 nm calibration standards are used to test the performance of HPICM system |
| Benchtop vibration Isolator | AMETEK/TMC | Everstill K-400 | Active vibration isolation |
| Borosilicate glass capillaries | World Precision Instruments (WPI) | 1B100F-4 | Borosilicate glass capillaries for the nanopipettes |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | To be added to the bath solution to adjust osmolarity |
| Digitizer | National Instruments Corporation | PCI-6221 | Multi-channel input/output digitizer |
| Fast analog Proportional-Integral-Derivative (PID) control for Z movement | Standford Research Systems | SIM900, SIM960, SIM980 | Instrumentation modules integrated in an external PID controller for Z movement. It requires a fast response that is usually not implemented in commercial piezo amplifiers. |
| Faraday cage | AMETEK/TMC | Type II | Required to shield electromagnetic interference |
| Glass bottom dish | World Precision Instruments (WPI) | FD5040-100 | Used as the dish for the chamber for the tissue |
| Hanks' Balanced Salt Solution (HBSS) | Gibco, Thermo Fisher Scientific | 14025092 | Extracellular (bath) solution |
| Instrumentation amplifier | Brownlee Precision | Model 440 | Instrumentation amplifier provides required offsets, filtering, and secondary magnification or attenuation |
| Laser-based micropipette puller | Sutter Instrument | P-2000/G | Micropipette puller to fabricate the nanopipettes. Laser is needed for sharp quartz pipettes. |
| Lebovitz's L-15, without phenol red | Gibco, Thermo Fisher Scientific | 21083027 | Extracellular (bath) solution |
| Micromanipulator | Scientifica | PatchStar | Used for "course" positioning of the Z piezo actuator |
| Microscope | Nikon | Eclipse TS100 | Inverted optical microscope |
| Patch amplifier | Molecular Devices | Axopatch 200B | The patch clamp amplifier measures the current through the nanopipette |
| Piezo amplifier (XY axes) | Physik Instrumente (PI) | E-500.00, E-505.00, E-509.C2A | Amplification and PID control for XY piezo translation stage |
| Piezo amplifier (Z axis) | Piezosystem jena | ENT 400 & 800 | Custom amplifier consisting of ENT 400 power supply and two ENT 800 amplifiers in parallel to achieve max current of 1.6 nA |
| Plastic Coverslips | TED PELLA Inc | 26028 | Used in the fabrication of the chambers for the tissue |
| SICM controller & software* | Ionscope, UK (ionscope.com) | N/A | Custom controller based on SBC6711 digital signal processing board from Innovative Integration Ltd |
| Silicone elastomer (Sylgard) | World Precision Instruments (WPI) | SYLG184 | Used to attach the flexible glass fibers to the chamber for the tissue |
| Silicon glue | The Dow Chemical Company | 734 | Used to glue the different parts of the chamber for the tissue |
| Tungsten rod | A-M Systems | 717500 | Used for holding the dental floss strands in the chamber for the tissue |
| XY piezo nanopositioner | Physik Instrumente (PI) | P-733.2DD | XY translation stage with capacitive sensors |
| Z piezo nanopositioner | Piezosystem jena | RA 12/24 SG | Ring piezoactuator with a strain gage sensor |
| *Ionscope does not sell separate SICM controllers anymore. There are few other commercial systems: NX12-Bio and NX10 SICM, | |||
| Park Systems, Korea and SICM modules from ICAPPIC Limited, UK (icappic.com). All these systems are based on the original | |||
| HPICM principles. However, imaging stereocilia bundles in the hair cells requires several custom modifications that are technically | |||
| challenging (or even impossible) in the closed “ready-to-go” systems such as Ionscope or NX12-Bio/NX10. Currently, there is only one | |||
| modular system (ICAPPIC) that has the flexibility to suit any SICM/HPICM experiment but requires some component integration. |
Références
- Beurg, M., Fettiplace, R., Nam, J. H., Ricci, A. J. Localization of inner hair cell mechanotransducer channels using high-speed calcium imaging. Nature Neuroscience. 12 (5), 553-558 (2009).
- Effertz, T., Becker, L., Peng, A. W., Ricci, A. J. Phosphoinositol-4,5-bisphosphate regulates auditory hair-cell mechanotransduction-channel pore properties and fast adaptation. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 37 (48), 11632-11646 (2017).
- Peng, A. W., Gnanasambandam, R., Sachs, F., Ricci, A. J. Adaptation independent modulation of auditory hair cell mechanotransduction channel open probability implicates a role for the lipid bilayer. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 36 (10), 2945-2956 (2016).
- Engström, H., Engström, B. Structure of the hairs on cochlear sensory cells. Hearing research. 1 (1), 49-66 (1978).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Wäldchen, S., Lehmann, J., Klein, T., van de Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348(2015).
- Pickles, J. O., Comis, S. D., Osborne, M. P. Cross-links between stereocilia in the guinea pig organ of Corti, and their possible relation to sensory transduction. Hearing Research. 15 (2), 103-112 (1984).
- Furness, D. N., Hackney, C. M. Cross-links between stereocilia in the guinea pig cochlea. Hearing Research. 18 (2), 177-188 (1985).
- Jacobs, R. A., Hudspeth, A. J. Ultrastructural correlates of mechanoelectrical transduction in hair cells of the bullfrog’s internal ear. Cold Spring Harbor Symposia on Quantitative Biology. 55, 547-561 (1990).
- Goodyear, R. J., Marcotti, W., Kros, C. J., Richardson, G. P. Development and properties of stereociliary link types in hair cells of the mouse cochlea. The Journal of Comparative Neurology. 485 (1), 75-85 (2005).
- Kachar, B., Parakkal, M., Kurc, M., Zhao, Y., Gillespie, P. G. High-resolution structure of hair-cell tip links. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13336-13341 (2000).
- Vélez-Ortega, A. C., Freeman, M. J., Indzhykulian, A. A., Grossheim, J. M., Frolenkov, G. I. Mechanotransduction current is essential for stability of the transducing stereocilia in mammalian auditory hair cells. eLife. 6, 1-22 (2017).
- Ivanchenko, M. V., et al. Serial scanning electron microscopy of anti-PKHD1L1 immuno-gold labeled mouse hair cell stereocilia bundles. Scientific Data. 7 (1), 182(2020).
- Hadi, S., Alexander, A. J., Vélez-Ortega, A. C., Frolenkov, G. I. Myosin-XVa controls both staircase architecture and diameter gradation of stereocilia rows in the auditory hair cell bundles. Journal of the Association for Research in Otolaryngology JARO. 21 (2), 121-135 (2020).
- Metlagel, Z., et al. Electron cryo-tomography of vestibular hair-cell stereocilia. Journal of Structural Biology. 206 (2), 149-155 (2019).
- Langer, M. G., et al. Mechanical stimulation of individual stereocilia of living cochlear hair cells by atomic force microscopy. Ultramicroscopy. 82 (1-4), 269-278 (2000).
- Dufrêne, Y. F. Towards nanomicrobiology using atomic force microscopy. Nature Reviews Microbiology. 6 (9), 674-680 (2008).
- Putman, C. A., van der Werf, K. O., de Grooth, B. G., van Hulst, N. F., Greve, J. Viscoelasticity of living cells allows high resolution imaging by tapping mode atomic force microscopy. Biophysical journal. 67 (4), 1749-1753 (1994).
- Gavara, N., Chadwick, R. S. Noncontact microrheology at acoustic frequencies using frequency-modulated atomic force microscopy. Nature Methods. 7 (8), 650-654 (2010).
- Cartagena-Rivera, A. X., Van Itallie, C. M., Anderson, J. M., Chadwick, R. S. Apical surface supracellular mechanical properties in polarized epithelium using noninvasive acoustic force spectroscopy. Nature Communications. 8 (1), 1030(2017).
- Katsuno, T., et al. TRIOBP-5 sculpts stereocilia rootlets and stiffens supporting cells enabling hearing. JCI Insight. 4 (12), (2019).
- Hansma, P. K., Drake, B., Marti, O., Gould, S. A., Prater, C. B. The scanning ion-conductance microscope. Science. 243 (4891), 641-643 (1989).
- Korchev, Y. E., et al. Specialized scanning ion-conductance microscope for imaging of living cells. Journal of Microscopy. 188 (Pt 1), 17-23 (1997).
- Shevchuk, A. I., et al. Imaging proteins in membranes of living cells by high-resolution scanning ion conductance microscopy. Angewandte Chemie (International ed in English. 45 (14), 2212-2216 (2006).
- Novak, P., et al. Nanoscale live-cell imaging using hopping probe ion conductance microscopy. Nature Methods. 6 (4), 279-281 (2009).
- Vélez-Ortega, A. C., Frolenkov, G. I. Visualization of live cochlear stereocilia at a nanoscale resolution using hopping probe ion conductance microscopy. Methods in Molecular Biology. 1427, 203-221 (2016).
- Gu, Y., et al. High-resolution scanning patch-clamp: new insights into cell function. FASEB Journal Official Publication of the Federation of American Societies for Experimental Biology. 16 (7), 748-750 (2002).
- Frolenkov, G. I., et al. Single-channel recordings from the apical surface of outer hair cells with a scanning ion conductance probe. Association for Research in Otolaryngology. Abs. 444, (2004).
- Sánchez, D., et al. Noncontact measurement of the local mechanical properties of living cells using pressure applied via a pipette. Biophysical Journal. 95 (6), 3017-3027 (2008).
- Korchev, Y. E., Negulyaev, Y. A., Edwards, C. R., Vodyanoy, I., Lab, M. J. Functional localization of single active ion channels on the surface of a living cell. Nature Cell Biology. 2 (9), 616-619 (2000).
- Shevchuk, A., et al. Angular approach scanning ion conductance microscopy. Biophysical Journal. 110 (10), 2252-2265 (2016).
- Furness, D. N., Katori, Y., Nirmal Kumar, B., Hackney, C. M. The dimensions and structural attachments of tip links in mammalian cochlear hair cells and the effects of exposure to different levels of extracellular calcium. Neuroscience. 154 (1), 10-21 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon