Method Article
Imágenes de paquetes de estereocilios con resolución a nanoescala en células ciliadas auditivas de mamíferos vivos
En este artículo
Resumen
Aquí presentamos un protocolo para la Microscopía de Conductancia Iónica de Sonda de Salto (HPICM), una técnica de sonda de escaneo sin contacto que permite obtener imágenes a nanoescala de haces de estereocilios en células ciliadas auditivas vivas.
Resumen
Las células ciliadas del oído interno detectan los desplazamientos inducidos por el sonido y transducen estos estímulos en señales eléctricas en un haz de cabello que consiste en estereocilios que están dispuestos en filas de altura creciente. Cuando los estereocilios se desvían, tiran de pequeños enlaces de punta extracelular (~ 5 nm de diámetro) que interconectan estereocilios, que transmiten fuerzas a los canales de transducción mecanosensibles. Aunque la mecanotransducción se ha estudiado en células ciliadas vivas durante décadas, los detalles ultraestructurales funcionalmente importantes de la maquinaria de mecanotransducción en las puntas de los estereocilios (como la dinámica del enlace de la punta o la remodelación de los estereocilios dependientes de la transducción) aún se pueden estudiar solo en células muertas con microscopía electrónica. Teóricamente, las técnicas de sonda de barrido, como la microscopía de fuerza atómica, tienen suficiente resolución para visualizar la superficie de los estereocilios. Sin embargo, independientemente del modo de imagen, incluso el más mínimo contacto de la sonda de microscopía de fuerza atómica con el haz de estereocilios generalmente daña el haz. Aquí presentamos un protocolo detallado para la microscopía de conductancia iónica de sonda de salto (HPICM) de imágenes de células ciliadas auditivas de roedores vivos. Esta técnica de sonda de escaneo sin contacto permite obtener imágenes de lapso de tiempo de la superficie de células vivas con una topografía compleja, como las células ciliadas, con una resolución de nanómetros únicos y sin hacer contacto físico con la muestra. El HPICM utiliza una corriente eléctrica que pasa a través de la nanopipeta de vidrio para detectar la superficie de la célula en las proximidades de la pipeta, mientras que un sistema piezoeléctrico de posicionamiento 3D escanea la superficie y genera su imagen. Con HPICM, pudimos obtener imágenes de paquetes de estereocilios y los enlaces que interconectan estereocilios en células ciliadas auditivas vivas durante varias horas sin daños notables. Anticipamos que el uso de HPICM permitirá la exploración directa de los cambios ultraestructurales en los estereocilios de las células ciliadas vivas para una mejor comprensión de su función.
Introducción
A pesar del hecho de que los haces de estereocilios en las células ciliadas auditivas son lo suficientemente grandes como para ser visualizados por microscopía óptica y desviados en células vivas en un experimento de pinza de parche, los componentes estructurales esenciales de la maquinaria de transducción, como los enlaces de punta, solo se pueden visualizar con la microscopía electrónica en células muertas. En las células ciliadas auditivas de mamíferos, la maquinaria de transducción se encuentra en los extremos inferiores de los enlaces de punta, es decir, en las puntas de los estereocilios de fila más corta1 y se regula localmente a través de la señalización en las puntas de los estereocilios2,3. Sin embargo, las imágenes sin etiquetas de las estructuras superficiales en esta ubicación en las células ciliadas vivas no son posibles debido a los pequeños tamaños de los estereocilios.
La cóclea de mamífero tiene dos tipos de células sensoriales auditivas: células ciliadas internas y externas. En las células ciliadas internas, los estereocilios son más largos y gruesos en comparación con los de las células ciliadas externas4. La primera y segunda fila de estereocilios tienen un diámetro de 300-500 nm en las células ciliadas internas de ratón o rata. Debido a la difracción de la luz, la resolución máxima alcanzable con una microscopía óptica sin etiqueta es de aproximadamente 200 nm. Por lo tanto, la visualización de estereocilios individuales dentro de la primera y segunda fila del haz interno de células ciliadas es relativamente fácil con la microscopía óptica. En contraste, los estereocilios de fila más cortos en las células ciliadas internas y todos los estereocilios de las células ciliadas externas tienen diámetros de alrededor de 100-200 nm y no se pueden visualizar con microscopía óptica5. A pesar del progreso reciente en imágenes de superresolución, esta limitación fundamental persiste en cualquier imagen óptica sin etiquetas. Todas las técnicas actuales de superresolución disponibles comercialmente requieren algún tipo de moléculas fluorescentes6,lo que limita sus aplicaciones. Además de las limitaciones debidas a la necesidad de moléculas específicas marcadas con fluorescencia, se ha demostrado que la exposición a la irradiación de luz intensa induce daño celular y podría influir en los procesos celulares, lo cual es una gran desventaja cuando se estudian células vivas7.
Nuestro conocimiento actual de los detalles ultraestructurales de los haces de estereocilios de células ciliadas se ha obtenido principalmente con diversas técnicas de microscopía electrónica (EM), como la microscopía electrónica de barrido (SEM), la microscopía electrónica de transmisión (TEM), la em de congelación-fractura, y recientemente con técnicas 3D como la sección en serie con haz de iones enfocado o la tomografía crio-EM8,9,10, 11,12,13, 14,15,16. Desafortunadamente, todas estas técnicas EM requieren la criofijación química o criofija de la muestra. Dependiendo de la escala de tiempo de los fenómenos, este requisito hace que un estudio de los procesos dinámicos en las puntas de los estereocilios sea imposible o muy laborioso.
Se han realizado esfuerzos limitados para obtener imágenes de haces de cabello de células ciliadas vivas con microscopía de fuerza atómica (AFM)17,18. Dado que la AFM opera en soluciones fisiológicas, podría, en teoría, visualizar cambios dinámicos en los haces de estereocilios de las células ciliadas vivas a lo largo del tiempo. El problema radica en los principios de la AFM de alta resolución, que implica cierto contacto físico entre la sonda AFM y la muestra, incluso en el modo de "tapping" menos dañino19. Cuando la sonda AFM se encuentra con un estereocilio, generalmente se estrella contra él, dañando la estructura del haz de cabello. Como resultado, esta técnica no es adecuada para visualizar paquetes de células ciliadas en vivo, o incluso fijos,17,18. El problema puede aliviarse parcialmente mediante el uso de una gran sonda AFM en forma de bola que impone solo fuerzas hidrodinámicas a la superficie de la muestra20. Sin embargo, a pesar de que dicha sonda es ideal para probar las propiedades mecánicas de la muestra21,proporciona solo una resolución submicrométrica cuando se obtienen imágenes del órgano de Corti22 y aún aplica a la muestra una fuerza que puede ser sustancial para los haces de estereocilios altamente sensibles.
La microscopía de conductancia iónica de barrido (SICM) es una versión de la microscopía de sonda de barrido que utiliza una sonda de pipeta de vidrio llena de una solución conductora23. SICM detecta la superficie cuando la pipeta se acerca a la celda y la corriente eléctrica a través de la pipeta disminuye. Dado que esto está sucediendo mucho antes de tocar la célula, el SICM es ideal para imágenes sin contacto de células vivas en solución fisiológica24. La mejor resolución de SICM es del orden de nanómetros individuales, lo que permite resolver complejos proteicos individuales en la membrana plasmática de una célula viva25. Sin embargo, al igual que otras técnicas de sonda de escaneo, SICM es capaz de obtener imágenes solo de superficies relativamente planas. Superamos esta limitación inventando el microscopio de conductancia iónica de sonda de salto (HPICM)26,en el que la nanopipeta se acerca a la muestra en cada punto de imagen(Figura 1A). Usando HPICM, pudimos obtener imágenes de haces de estereocilios en células ciliadas auditivas vivas con resolución a nanoescala27.
Otra ventaja fundamental de esta técnica es que HPICM no es solo una herramienta de imagen. A diferencia de otras técnicas de sonda de barrido, la sonda HPICM/SICM es un electrodo ampliamente utilizado en la fisiología celular para registros eléctricos y entrega local de diversos estímulos. La actividad del canal iónico no suele interferir con las imágenes HPICM, porque la corriente total a través de la sonda HPICM es varios órdenes de magnitud mayor que la corriente extracelular generada por los canales iónicos más grandes25. Sin embargo, HPICM permite el posicionamiento preciso de la nanopipeta sobre una estructura de interés y el posterior registro de patch-clamp de un solo canal a partir de esta estructura28. Es así como obtuvimos las primeras grabaciones preliminares de la actividad de un solo canal en las puntas de los estereocilios de células ciliadas externas29. Vale la pena mencionar que incluso una gran corriente a través de la nanopipeta no puede producir cambios significativos del potencial a través de la membrana plasmática debido a la enorme derivación eléctrica del medio extracelular. Sin embargo, los canales iónicos individuales pueden activarse mecánicamente por flujo de líquido a través de la nanopipeta30 o químicamente por aplicación local de un agonista31.
En HPICM, la imagen se genera cuando una nanopipeta se acerca secuencialmente a la muestra en un punto, se retrae y luego se mueve en dirección lateral para repetir el enfoque(Figura 1A). Un amplificador de abrazadera de parche aplica constantemente voltaje a un cable AgCl en la pipeta(Figura 1B)para generar una corriente de ~ 1 nA en la solución de baño. El valor de esta corriente cuando la pipeta está lejos de la superficie de la celda se determina como una corriente de referencia (Iref, Figura 1C). Luego, la pipeta se mueve en el eje Z para acercarse a la muestra hasta que la corriente se reduce en una cantidad predefinida por el usuario (punto de consigna), generalmente 0.2% -1% de la referencia I (Figura 1C,traza superior). A continuación, el sistema guarda el valor Z en este momento como la altura de la muestra, junto con las coordenadas X e Y de este punto de imagen. Luego, la pipeta se retrae lejos de la superficie(Figura 1C,traza inferior) a una velocidad definida por el usuario, generalmente 700-900 nm / ms. Después de la retracción, la pipeta (o, en nuestro caso, la muestra - ver Figura 1B)se mueve lateralmente al siguiente punto de imagen, se obtiene un nuevo valor de corriente de referencia y la pipeta una vez más se acerca a la muestra, repitiendo el proceso. El movimiento X-Y de la pipeta se prefiere en una configuración de microscopio vertical que se utiliza normalmente para las grabaciones de las corrientes de mecanotransducción de células ciliadas. En este entorno, la sonda HPICM se acerca a los haces de células ciliadas no desde la parte superior, sino en un ángulo32. Sin embargo, la mejor resolución de las imágenes HPICM se logra en una configuración de microscopio invertido(Figura 1A,B),donde el movimiento de la muestra en direcciones X-Y se desacopla del movimiento Z de la nanopipeta, eliminando así los posibles artefactos mecánicos.
Usando HPICM, obtuvimos imágenes topográficas de haces de estereocilios de células ciliadas internas y externas de ratones y ratas, e incluso visualizamos los enlaces entre los estereocilios que tienen aproximadamente 5 nm de diámetro26,27. El éxito de las imágenes de paquetes de células ciliadas con esta técnica se basa en varios factores. En primer lugar, el ruido (varianza) de la corriente de nanopipeta debe ser lo más pequeño posible para permitir el punto de ajuste más bajo posible para las imágenes HPICM. Un punto de consigna bajo permite a la sonda HPICM "detectar" la superficie de los estereocilios a una distancia mayor y en cualquier ángulo con respecto al enfoque de la sonda y, sorprendentemente, mejora la resolución X-Y de las imágenes HPICM (consulte discusión). En segundo lugar, las vibraciones y derivas en el sistema deben reducirse a menos de 10 nm, ya que contribuyen directamente a los artefactos de imagen. Finalmente, a pesar de que la sonda HPICM y la etapa de muestra se mueven en ejes Z y X-Y por los actuadores piezoeléctricos calibrados controlados por retroalimentación que tienen una precisión de un solo nanómetro o mejor, el diámetro de la punta de la nanopipeta determina la propagación de la corriente (volumen de detección) y, por lo tanto, la resolución (Figura 1A). Por lo tanto, antes de obtener imágenes de células ciliadas vivas, es vital tirar de las pipetas adecuadas, alcanzar la resolución deseada con muestras de calibración y lograr un bajo nivel de ruido en el sistema de grabación.
Durante al menos un par de décadas, la técnica SICM no ha estado disponible comercialmente y ha sido desarrollada por solo unos pocos laboratorios en el mundo con el laboratorio líder del Prof. Korchev en el Imperial College (Reino Unido). Recientemente, varios sistemas SICM se pusieron a disposición comercial (ver Tabla de Materiales),todos los cuales se basan en los principios originales de HPICM. Sin embargo, los paquetes de estereocilios de imágenes en las células ciliadas requieren varias modificaciones personalizadas que son técnicamente desafiantes (o incluso imposibles) en los sistemas cerrados "listos para usar". Por lo tanto, se necesita cierta integración de componentes. Dado que la configuración de HPICM representa una plataforma de abrazadera de parche con requisitos de vibración y deriva más estrictos y un movimiento piezoeléctrico de la sonda HPICM y la muestra(Figura 1D),esta integración es relativamente fácil para cualquier investigador, que sea competente en el pinzamiento de parches. Sin embargo, un científico sin la formación adecuada definitivamente necesitaría algo de capacitación en electrofisiología primero. A pesar de los desafíos restantes, como el aumento de la velocidad de las imágenes (ver Discusión),hemos podido obtener imágenes de haces de estereocilios en células ciliadas vivas con resolución a nanoescala sin dañarlas.
Este artículo presenta un protocolo detallado para realizar imágenes HPICM exitosas de los haces de células ciliadas auditivas vivas en explantes cocleares de ratas o ratones jóvenes postnatales utilizando nuestro sistema personalizado. Los componentes integrados se enumeran en la Tabla de Materiales. El documento también describe los problemas comunes que se pueden encontrar y cómo solucionarlos.
Protocolo
El estudio se realizó de acuerdo con las recomendaciones de la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud. Todos los procedimientos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Kentucky (protocolo 00903M2005).
1. Fabricación y prueba de las nanopipetas
- Crear un programa en el extractor de micropipetas para obtener pipetas con una resistencia entre 200 y 400 MΩ, que corresponde a diámetros de punta interna de aproximadamente 50-70 nm. Los parámetros dependerán del extractor de micropipetas. Para obtener pipetas cortas con puntas finas no flexibles, consulte el manual de funcionamiento del extractor.
- Utilice capilares de vidrio de borosilicato con diámetros externos/internos de 1/0,58 mm y un filamento interior para facilitar el llenado. La longitud de la pipeta es crucial porque determina la frecuencia de la resonancia mecánica lateral de la pipeta. Cuanto más larga es la pipeta, menor es la frecuencia de resonancia y más difícil es evitar esta resonancia.
NOTA: El usuario debe intentar fabricar la pipeta más corta que el soporte pueda aceptar. La longitud de las nanopipetas en este experimento suele ser de 15-25 mm(Figura 2A). - Llene la nanopipeta hasta su punto medio(Figura 2A)con una solución de baño, ya sea L-15 de Leibovitz o con la Solución de Sal Equilibrada de Hank (HBSS) suplementada con 20 mM de D-glucosa (para ajustar la osmolaridad). Para evitar posibles artefactos, use la misma solución que se utilizará en el baño para las grabaciones.
- Usando un microscopio óptico con un aumento de 10x, verifique si hay burbujas en la punta de la pipeta(Figura 2B). Las burbujas impedirían el flujo de corriente. Es más difícil eliminar las burbujas en las pipetas que se han tirado varias horas antes del experimento. Por lo tanto, se recomienda tirar de nuevas pipetas con cada experimento.
- Una vez que la pipeta esté libre de burbujas, móntela en el soporte de pipeta HPICM(Figura 2C).
- Coloque la muestra (tejido o estándar de calibración) en la cámara personalizada y agregue 4 ml de la solución de baño mencionada anteriormente.
- Coloque la cámara personalizada en el escenario HPICM e introduzca el electrodo de tierra en la solución.
- Asegúrese de que el voltaje que se aplica a la pipeta por el amplificador de abrazadera de parche es cero.
- Mueva la pipeta en Z hasta que toque el líquido.
- Ajuste el desplazamiento del amplificador a cero y luego agregue +100 mV para verificar la corriente de la pipeta.
- Calcule la resistencia y el diámetro de la pipeta, basándose en la ley de Ohm:
R = V/I
donde R es la resistencia (MOhm), V es el voltaje aplicado a la nanopipeta (mV) e I es la corriente que fluye a través de la nanopipeta (nA).- Calcule el diámetro interior de la pipeta como se describe en otra parte de acuerdo con la siguiente fórmula12:
ID Tip = 1000/ √R
NOTA: El valor de resistencia ideal está entre 200 y 400 MΩ. Las pipetas con una resistencia superior a 400 MΩ pueden conducir a una corriente inestable debido a su pequeño tamaño (< diámetro interior de 50 nm). Por el contrario, las pipetas con resistencias inferiores a 200 MΩ son demasiado grandes (> diámetro interior de 70 nm) y no resolverían pequeñas características. Se recomienda comenzar a tomar imágenes con las pipetas de resistencia de 200 MΩ, ya que son más fáciles de fabricar y tienden a proporcionar menos ruido eléctrico.
- Calcule el diámetro interior de la pipeta como se describe en otra parte de acuerdo con la siguiente fórmula12:
2. Minimizar las derivas y vibraciones de la muestra
NOTA: Para disminuir el ruido mecánico en el sistema durante la toma de imágenes, monte las muestras en las cámaras personalizadas que utilizan portaobjetos de vidrio grueso (~ 1,2 mm):
- Retire la porción de vidrio de un plato con fondo de vidrio de 50 mm, dejando intactas las paredes de plástico.
- Pegue la porción de plástico del plato de cultivo celular en la parte superior del portaobjetos de vidrio grueso con pegamento de silicio.
- Monte la muestra de calibración en el centro de la cámara (en la parte superior de la diapositiva de vidrio) utilizando pegamento de silicio o cinta delgada de doble cara.
- Asegure firmemente la cámara en el escenario HPICM con cinta de doble cara.
- Durante la toma de imágenes, cierre la jaula de Faraday y cúbrala con una manta para minimizar la interferencia eléctrica y la deriva térmica, en consecuencia.
3.Probar la resolución con los estándares de calibración AFM
NOTA: Se recomienda encarecidamente obtener imágenes de los estándares AFM (consulte la Tabla de materiales)antes de obtener imágenes de células vivas para solucionar problemas del sistema y probar su resolución en los ejes X-Z-Y. Los estándares de calibración tienen pilares de dióxido de silicio y agujeros de diferentes formas, pero alturas / profundidades fijas (es decir, 20 o 100 nm) en un chip de silicio de 5 x 5 mm. Se recomienda comenzar con el estándar de calibración de 100 nm, para garantizar que la resolución Z sea inferior a 100 nm. Después de lograr una imagen exitosa de alta resolución de los pilares o agujeros en esta muestra de calibración(Figura 3A),pase al estándar de 20 nm. Si la imagen de este último estándar es exitosa (Figura 3B), se garantiza que la resolución en el eje Z es inferior a 20 nm y apropiada para la obtención de imágenes de los haces de estereocilios de célulasciliadas 12. Los siguientes pasos se utilizan para obtener imágenes de ambos estándares de calibración.
- Conecte el estándar de calibración a la cámara con pegamento de silicio.
- Agregue 4 ml de HBSS a la cámara para cubrir la muestra de calibración. A continuación, asegure la cámara a la etapa XY de la configuración de HPICM con cinta de doble cara.
- Sujete el soporte magnético del electrodo de tierra al escenario cercano a la cámara y sumerja el electrodo en la solución de baño (Figura 1B).
- Monte la nanopipeta en el soporte, sumérjala en la solución de baño y ajuste su corriente a ~ 1 nA siguiendo los pasos descritos en la Sección 1.
- Coloque la nanopipeta aproximadamente por encima del centro del estándar de calibración utilizando un manipulador de abrazadera de parche de curso. La inspección visual suele ser suficiente para este posicionamiento, ya que el área cubierta por estructuras de dióxido de silicio es relativamente grande (1 x 1 mm). A diferencia del órgano de los explantes corti (ver más abajo), el estándar de calibración no es transparente y, por lo tanto, no es posible un posicionamiento más preciso guiado por imágenes ópticas para esta muestra.
- Aumente el punto de consigna mientras monitorea la señal del sensor del actuador piezoeléctrico Z en un osciloscopio en tiempo real. Después de establecer un ciclo de aproximación Z repetible estable (como en la Figura 1C,abajo), disminuya el punto de consigna al valor que está justo por encima del punto de inestabilidad. Este procedimiento garantizaría el punto de consigna óptimo para esta nanopipeta en particular.
- Mueva la pipeta hacia abajo a una velocidad de ~5 μm/s con un micromanipulador de abrazadera de parche hasta que llegue a la muestra. En este momento, el nivel inferior de la señal de posicionamiento Z en tiempo real(Figura 1C)aumentará, lo que indica que la nanopipeta se retira debido a la "detección" de la superficie de la muestra. Cualquier movimiento adicional de la nanopipeta resultará en un mayor cambio positivo de la señal de posicionamiento Z.
NOTA: Tenga cuidado de no exceder el límite superior del movimiento del actuador piezoeléctrico Z. - Comience a tomar imágenes a baja resolución (consulte la Tabla 1). Debido al montaje desigual del estándar AFM, el punto más alto del área de interés puede ser desconocido. Por lo tanto, establezca la amplitud de la retracción de la pipeta (amplitud de salto) en al menos 200-500 nm.
- Una vez que se identifica el punto más alto de la muestra en el área de imágenes, disminuya la amplitud del salto. Una amplitud de salto más pequeña permite un escaneo más rápido, que se prefiere para imágenes de alta resolución debido a la disminución de los efectos de las derivas y la disminución de la vibración.
- Antes de mover la pipeta a una nueva ubicación X-Y, retírela unos 200 μm en el eje Z para evitar colisiones no deseadas con la muestra.
NOTA: En los casos en que la nanopipeta no está alineada con el centro del estándar de calibración, es posible que el escaneo comience justo fuera del área de las características de la superficie. - Una vez que se encuentre el área de interés, comience a tomar imágenes a una resolución más alta (consulte la Tabla 1).
4. Fabricación de cámaras a medida para asegurar los explantes cocleares
NOTA: Monte los explantes cocleares en las cámaras con sistemas de sujeción personalizados que utilicen pipetas de vidrio flexibles (paso 4.1)(Figura 4A)o hilo dental (paso 4.2)(Figura 4B). La cámara de pipeta de vidrio podría esterilizarse y utilizarse para los órganos cultivados de Corti, mientras que la cámara de hilo dental proporciona una sujeción más segura de la muestra y un control sobre la orientación del haz de estereocilios durante el montaje. Estas cámaras personalizadas deben prepararse con anticipación, pero se pueden limpiar y reutilizar en varias sesiones de imágenes.
- Hacer una cámara con pipetas de vidrio flexibles
- Extraiga dos fibras de vidrio delgadas y flexibles de los capilares de vidrio con un extractor de pipetas. Nuestras fibras de vidrio estiradas suelen medir de 1 a 2 cm de longitud y son bastante flexibles.
- Coloque una pequeña gota del elastómero de silicona sobre una funda de vidrio. Use fundas de 2 cm de diámetro.
- Coloque los extremos de dos fibras de vidrio en la gota de silicona y organice las fibras para que tengan un pequeño grado de separación entre ellas(Figura 4A).
- Coloque el cubrehojas en una placa caliente para curar rápidamente el elastómero (1 a 3 min).
- Pegue la cubierta en el fondo de vidrio de la cámara descrita en la Sección 2 utilizando una pequeña cantidad (1-3 μL) de elastómero de silicona y permitiendo que se cure durante la noche.
- Hacer una cámara con hilo dental:
- Retire la porción de vidrio de un plato con fondo de vidrio de 50 mm, dejando intactas las paredes de plástico. Luego pegue la porción de plástico de la placa de cultivo celular sobre un portaobjetos de vidrio de 1,2 mm de espesor con pegamento de silicio.
- Monte una funda de plástico (6,5 x 6,5 mm) con el mismo pegamento en el centro de la cámara. Luego repita el proceso con otra cubierta encima de la anterior.
- Monte dos pequeños alambres de tungsteno o chapados en oro (12 mm de longitud y ~ 0,5 mm de diámetro) con pegamento de silicio, cada uno en lados opuestos de las diapositivas de la cubierta. Péguelos lo suficientemente lejos (> 10-15 mm) de las diapositivas de la cubierta(Figura 4B).
- Separe dos hebras de hilo dental y colóquelas en la parte superior de los portaobjetos de la cubierta y asegúrelas a los cables haciendo un nudo. Deje un pequeño espacio entre ambas hebras(Figura 4B,flechas cortas).
- Limpie las cámaras después de cada uso
- Retire suavemente el tejido de la cámara con pinzas finas y raspe ligeramente cualquier residuo de tejido que quede.
- Enjuague la cámara primero con etanol al 70% y luego con agua destilada.
- Repita el ciclo de enjuague si es necesario.
- Coloque la cámara boca abajo sobre un papel de filtro para dejarla secar hasta el próximo experimento. Las cámaras no necesitan ser esterilizadas, a menos que se planifique el cultivo del órgano de Corti después de la toma de imágenes.
5. Disección del órgano del roedor de Corti
- Realizar la disección de los explantes cocleares postnatales jóvenes como se describe en detalle en otra parte13.
- Para las imágenes hpicm, diseccionar el órgano de Corti de ratones entre los días postnatales 3 y 6 (P3-6), y de ratas entre los días postnatales 3 y 8 (P3-8).
NOTA: Las células ciliadas más viejas son más susceptibles al daño durante la disección y, por lo tanto, no se pueden usar para imágenes HPICM de lapso de tiempo de horas de duración. - No olvide retirar la membrana tectorial antes de la obtención de imágenes HPICM.
- Inmediatamente después de la disección, asegure el tejido en una de las cámaras descritas en la Sección 4, colocándolo debajo de las pipetas de vidrio flexible o debajo de las dos hebras de hilo dental (Figura 4). Llene previamente estas cámaras con 4 ml de la solución de baño a temperatura ambiente (para minimizar la formación de burbujas).
6. Imágenes de las células ciliadas auditivas
- Monte la cámara con un órgano recién aislado de Corti en la etapa piezoeléctrica X-Y con cinta adhesiva de doble cara y asegúrese de que esté firmemente asegurada para minimizar la deriva de la cámara en los ejes X e Y(Figura 1B).
- Siga los pasos de la Sección 1 para colocar una nueva nanopipeta y compruebe la resistencia correcta de la pipeta.
- Usando el micromanipulador de pinza de parche, coloque la nanopipeta sobre la región de las células ciliadas, mientras observa el órgano del explante de Corti en un microscopio invertido.
- Compruebe si el sistema es estable con un punto de consigna del 0,5% o inferior registrando la señal de corriente y posicionamiento Z en tiempo real en el osciloscopio (como en la Figura 1C). Si la señal Z no es estable, intente disminuir la frecuencia de corte del filtro de paso bajo del amplificador de abrazadera de parche. Sin embargo, no puede ser inferior al tiempo de respuesta del actuador piezoeléctrico Z (para evitar la colisión de la pipeta con la muestra debido a lecturas de corriente retrasadas).
NOTA: En la práctica, se considera que el ajuste de 5 kHz de este filtro es óptimo. Es mejor reemplazar la nanopipeta, si la señal Z aún es inestable. - Una vez que se logra una grabación estable, determine el punto de consigna óptimo y aborde la muestra con pipeta HPICM como se describe en los pasos 3.6-3.7 anteriores.
- En primer lugar, realice imágenes de baja resolución (consulte la Tabla 1),utilizando una amplitud de salto de al menos 6 a 8 μm. Para obtener imágenes de estructuras altas, como los haces de estereocilios de células ciliadas, asegúrese de que la amplitud del salto sea suficiente para evitar la colisión con estas estructuras.
NOTA: Si la amplitud del salto no es suficiente, la pipeta no podrá saltar sobre un estereocilio y habrá una colisión inminente. La colisión de la sonda HPICM con un estereocilio puede dañar el haz de pelo. Por lo tanto, en los casos en que la altura del haz de estereocilios es incierta, use una amplitud de salto más grande. - Familiarizarse con la topografía del órgano de Corti realizando y/o estudiando primero imágenes obtenidas con microscopía electrónica de barrido (Figura 5).
NOTA: Si la imagen HPICM es uniforme con las alturas inferiores a 1 μm en cada punto de imagen, es probable que la pipeta esté escaneando el fondo de vidrio y no el tejido. Alternativamente, la pipeta puede "aterrizar" en una región diferente del explante coclear, lejos de las células ciliadas. - Si la pipeta necesita ser movida a una nueva ubicación X-Y, retraiga aproximadamente 500 nm para evitar colisiones con cualquier característica alta dentro del tejido. Repita las imágenes HPICM de baja resolución hasta que se encuentre la región de interés con las células ciliadas.
- Una vez encontrada la región de interés, comience a tomar imágenes a una resolución más alta (ver Tabla 1). Trate de pasar menos de 15 minutos al obtener imágenes de un paquete de cabello entero.
NOTA: Los haces de células ciliadas en el tejido vivo no están quietos, pero pueden cambiar su orientación, por ejemplo, debido a cambios de forma en las células de soporte subyacentes. Por lo tanto, las imágenes pueden exhibir artefactos de movimiento si la adquisición de la imagen es demasiado lenta. - Una vez más, determine las características más altas en las imágenes de baja resolución antes de disminuir la amplitud de salto para las imágenes de alta resolución. Para una región de interés que cubra todo el haz de células ciliadas, reduzca la amplitud del salto a 4-5 μm, mientras que para una región relativamente pequeña y "plana" dentro del haz (por ejemplo, 2 x 2 μm) reduzca la amplitud del salto aún más, hasta menos de 1 μm, aumentando así la velocidad y la resolución de las imágenes.
7. Procesamiento de imágenes
NOTA: Los artefactos de imágenes son comunes en las imágenes HPICM. Algunos de ellos pueden corregirse mediante parámetros de adquisición de imágenes, mientras que otros requieren postprocesamiento con un visor SICM especializado o con programas de procesamiento de datos más generales como ImageJ o MatLab. Aquí describimos los artefactos más comunes y cómo los arreglamos con el visor SICM.
- Realizar corrección de pendientes
NOTA: No es obvio para un principiante, pero el ojo humano no puede resolver las características de tamaño submicrométrico en la superficie de una célula, si el área de imágenes tiene una pendiente general de igual o mayor tamaño(Figura 3A,B,izquierda). Por lo tanto, es necesario determinar la pendiente promedio de un área fotografiada (ajustando los datos de la imagen 3D HPICM a un solo plano) y restarla de la imagen HPICM(Figura 3A,B,medio).- Haga clic en Abrir para abrir una imagen con el visor SICM.
- Seleccione la pestaña Corrección de imagen.
- Seleccione la pestaña Pendiente correcta.
- Pulse el botón Pendiente correcta para una corrección automática de pendientes.
- Realizar la alineación de líneas
NOTA: Como se mencionó anteriormente, las derivas mecánicas y / o térmicas, así como los artefactos de movimiento celular, representan un problema significativo en las imágenes HPICM. Una pequeña deriva con una velocidad de menos de un micrómetro por minuto generalmente no se nota en una configuración de abrazadera de parche regular. Sin embargo, podría producir artefactos de varias decenas de nanómetros en imágenes HPICM, que es significativamente más grande que la resolución de HPICM. Por lo tanto, no es raro encontrar saltos repentinos en el eje Z entre dos líneas de escaneo HPICM vecinas durante la toma de imágenes. Esto podría corregirse analizando las diferencias entre los valores Z iniciales (y/o finales) en estas líneas de escaneo vecinas.- Haga clic en Abrir para abrir una imagen con el visor SICM.
- Seleccione la pestaña Corrección de imagen.
- Seleccione la pestaña Pendiente correcta.
- Elija el ancho de las líneas que desea alinear. Pulse el botón ButtonDestripeLineFit para una corrección automatizada de la alineación de la línea.
- Realizar reducción de ruido
NOTA: Al obtener imágenes con HPICM, pequeñas fluctuaciones en la corriente de nanopipeta pueden hacer que la nanopipeta se detenga lejos de la superficie de la muestra, especialmente con puntos de ajuste bajos. Da como resultado la aparición de pequeños puntos blancos en la imagen. Para corregir este artefacto de imagen, es necesario identificar los puntos de imagen con el valor Z significativamente mayor que el de los vecinos y reemplazar este valor con un promedio de los vecinos. Esto se hace mediante un filtro mediano ajustable.- Haga clic en Abrir para abrir una imagen con el visor SICM.
- Seleccione la pestaña Procesamiento de imágenes.
- Seleccione la pestaña Reducción de ruido.
- Establezca el filtro Umbral (μm) para los píxeles que se van a quitar.
Resultados
El protocolo presentado en este artículo se puede utilizar para visualizar cualquier célula viva con topografía compleja. Siguiendo estos pasos, obtenemos rutinariamente imágenes de haces de células ciliadas auditivas de ratas vivas(Figura 6B,D). A pesar de tener una resolución X-Y más baja en comparación con las imágenes SEM, nuestras imágenes HPICM pueden resolver con éxito las diferentes filas de estereocilios, la forma de las puntas de los estereocilios e incluso los pequeños enlaces (~ 5 nm de diámetro) que conectan los estereocilios adyacentes(Figura 6F). Además, las imágenes HPICM tienen información en 3D de la que carecen las imágenes SEM. Dada la naturaleza sin contacto de este tipo de técnica de imagen, también pudimos realizar imágenes HPICM de lapso de tiempo continuo del mismo haz de células ciliadas durante varias horas (es decir, 5-6 h regularmente) sin dañar la cohesión del haz(Figura 7). Por lo tanto, HPICM exhibe un gran potencial para el estudio de los cambios estructurales dinámicos de los haces de células ciliadas a lo largo del tiempo.
Aunque proporcionamos varios rangos para el tamaño de la pipeta, el punto de consigna actual, los parámetros de baja y alta resolución y las amplitudes de salto, es posible que cada usuario necesite optimizar ligeramente su configuración para obtener imágenes HPICM exitosas de paquetes de células ciliadas vivas. Los puntos de ajuste más pequeños producen imágenes de mejor calidad. Sin embargo, con un punto de ajuste muy bajo, el sistema podría interpretar pequeñas fluctuaciones en la corriente como si se encontraran con la superficie de la celda y esto conducirá al ruido de "punto blanco" en la imagen(Figura 8A). Del mismo modo, las grandes amplitudes de salto pueden aumentar la resonancia lateral de la pipeta y también producir píxeles ruidosos(Figura 8B). Por el contrario, si la amplitud del salto es demasiado pequeña o el punto de consigna es demasiado alto, la nanopipeta podría colisionar con la muestra y dar lugar a artefactos de imagen o incluso dañar el haz de cabello(Figura 8C,D). Recomendamos realizar la toma de imágenes a menor resolución mientras se ajustan todos estos parámetros para minimizar el daño a la muestra o a la nanopipeta.

Figura 1: Principios de la microscopía de conductancia iónica de sonda de salto (HPICM). (A) Una corriente eléctrica que pasa a través de la nanopipeta genera un "volumen de detección" en la punta de la pipeta. Para obtener imágenes de estructuras complejas como los haces de estereocilios de células ciliadas, la pipeta se acerca hacia la superficie celular desde arriba y se retrae después de detectar la superficie. Después de un movimiento lateral en cada paso, la pipeta continúa "saltando" por encima de la muestra generando la imagen de la célula. Observe que la amplitud del salto debe ser suficiente para que la pipeta "suba" a un estereocilio. La amplitud de salto ilustrada funcionaría para el escaneo de izquierda a derecha (desde el más pequeño hasta el estereocilio más alto, indicado por una flecha). Sin embargo, es demasiado pequeño para escanear de derecha a izquierda cuando la pipeta se encuentra primero con el estereocilio más alto. (B) Configuración experimental. Una cámara hecha a medida con el órgano del explante Corti se monta en una etapa de nanoposicionamiento XY con una apertura para la observación de microscopía óptica. La nanopipeta es movida por un actuador piezoeléctrico Z ultrarrápido separado. Para posicionar la nanopipeta sobre la región de interés, el actuador Z se monta en un micromanipulador convencional (no se muestra) junto con el cabezaldel amplificador de abrazadera de parche. El electrodo de tierra se monta en un soporte magnético y se inserta en el baño. (C) Registros representativos de la corriente de pipeta (trazasuperior) y la posición Z de la pipeta (traza inferior) durante la toma de imágenes. Cuando la pipeta está lejos de la superficie de la celda, se determina el valor de referencia de la corriente que pasa a través de la pipeta (Iref). Luego, la pipeta se mueve hacia la muestra (enfoque). Cuando el "volumen de detección" se encuentra con la superficie de la celda, la corriente de pipeta comienza a disminuir. El comando para el retiro se emite cuando la disminución actual alcanza un punto de consigna, que generalmente es 0.2% - 1% de Iref. (D) Esquemas del equipo que deben agregarse a una configuración de abrazadera de parche convencional para imágenes HPICM. Un amplificador de abrazadera de parche dedicado registra la corriente de nanopipeta (I) que utiliza el controlador SICM en modo HPICM para generar señales de comando a los ejes X, Yy Z. El amplificador de instrumentación proporciona compensación, escalado y filtrado de paso bajo a estas señales, si es necesario. Desafortunadamente, las señales X / Y / Z del controlador no se pueden aplicar directamente a los actuadores piezoeléctricos debido a los grandes errores causados por la histéresis y el arrastre que son inherentes a la piezocerámica. Por lo tanto, cada actuador piezoeléctrico (etapa de traslación)tiene un sensor de movimiento incorporado que envía una señal de retroalimentación al controlador proporcional-integral-derivado (PID) que preforma la señal de comando para corregir estos errores. Tenga en cuenta que los ejes X e Y relativamente lentos podrían usar controladores PID que están integrados en el amplificador piezoeléctrico,mientras que un eje Z más rápido requiere un controlador PIDrápido dedicado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Fabricación y llenado de nanopipetas. (A) Una nanopipeta de aproximadamente 2 cm de largo llena con la solución de intrapipetas (HBSS). (B) Una imagen de la burbuja (flecha) que normalmente se forma después de llenar la pipeta. La burbuja generalmente se aleja a los pocos minutos de la iluminación del microscopio (un microscopio digital LCD a 10x). (C) Una nanopipeta montada en el cabezal SICM. La flecha apunta al electrodo AgCl dentro de la pipeta. Observe que el soporte de la pipeta está pintado de plata y conectado a tierra para minimizar la captación eléctrica radiativa del actuador piezoeléctrico Z. Haga clic aquí para ver una versión más grande de esta figura.
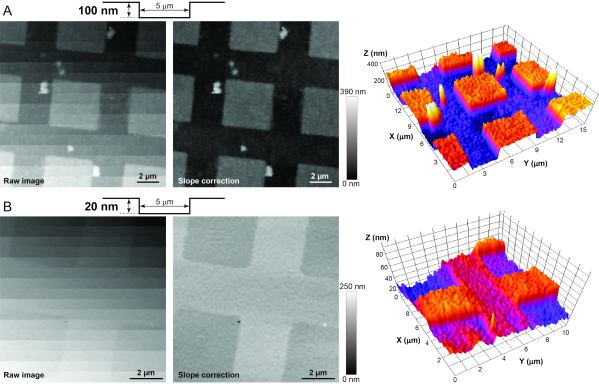
Figura 3: Imágenes de los estándares de calibración AFM para determinar la estabilidad adecuada, el aislamiento de vibraciones y el ruido eléctrico en el sistema. (A) Imágenes en bruto (izquierda), postprocesadas (centro) y 3D (derecha) del estándar de calibración HS-100MG. El perfil de superficie del estándar se muestra esquemáticamente en la parte superior. Dado que el estándar nunca está perfectamente alineado perfectamente perpendicular a la nanopipeta, se necesita la corrección de pendiente posterior al procesamiento para revelar pequeñas características verticales de la muestra. (B) Imágenes similares en bruto (izquierda), postprocesadas (centro) y 3D (derecha) del estándar de calibración HS-20MG que tiene hendiduras más pequeñas de 20 nm de profundidad. Tenga en cuenta que la escala de grises de un píxel en una imagen HPICM indica la altura de la muestra en ese punto. Haga clic aquí para ver una versión más grande de esta figura.
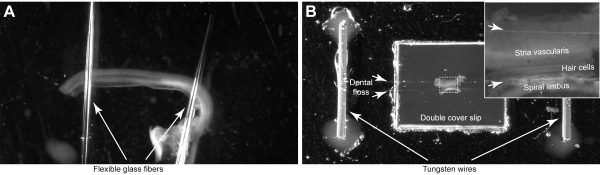
Figura 4: Montaje del órgano de explante de Corti. (A) El explante está sostenido por dos pipetas de vidrio que están pegadas a la placa de Petri con fondo de vidrio. (B) El explante está asegurado por dos hebras de hilo dental (flechas cortas) en una cámara de imágenes hecha a medida. El recuadro muestra la imagen ampliada del órgano de Corti. Haga clic aquí para ver una versión más grande de esta figura.
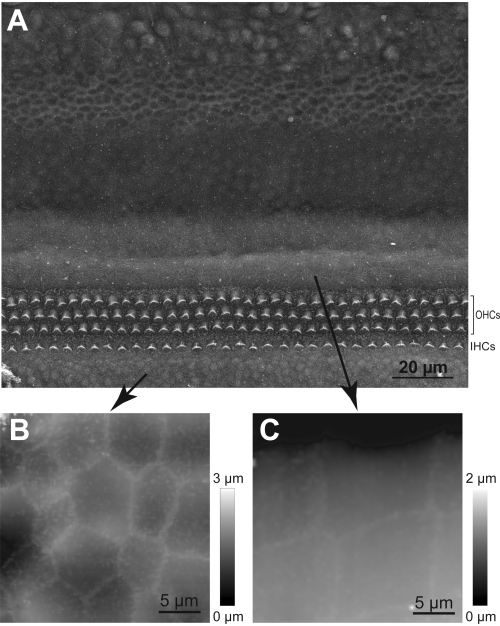
Figura 5: Navegación de la sonda HPICM a la región de las células ciliadas. (A) Imagen SEM del explante coclear que muestra filas de células ciliadas internas (IHC) y externas (OHC) y distintos tipos de células de soporte. (B) Imagen hpicm representativa de las células en el órgano de Kolliker. (C) Una imagen HPICM de las células de Hensen. Tenga en cuenta que estos dos tipos de células de soporte tienen formas muy distintas, lo que ayuda a determinar si la sonda HPICM aterrizó en un área que es radial o periférica a las células ciliadas. Haga clic aquí para ver una versión más grande de esta figura.
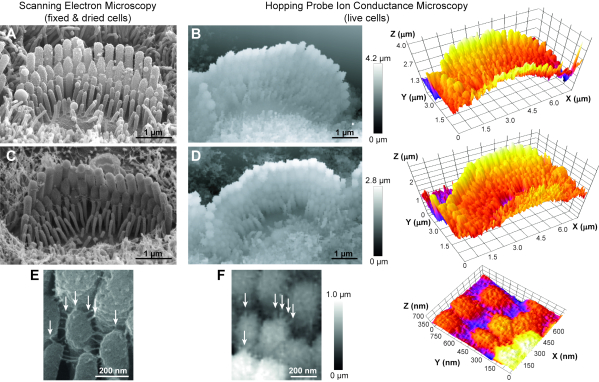
Figura 6: Comparación entre la microscopía electrónica de barrido (SEM) y la microscopía de conductancia iónica de sonda de salto (HPICM) de haces de estereocilios en células ciliadas internas de roedores postnatales jóvenes. (A,C) Las imágenes SEM proporcionan una resolución subnanométrica de los detalles de la superficie, pero en las celdas que se fijan y se reducen debido al secado de puntos críticos. Además, las imágenes SEM no permiten el análisis 3D. (B,D) Las imágenes HPICM (izquierda) tienen una resolución peor (~5-10 nm) pero se obtienen en células vivas, permiten imágenes de lapso de tiempo y llevan información sobre alturas exactas, lo que permite la reconstrucción y mediciones en 3D (derecha). (E,F) Los vínculos extracelulares entre los estereocilios son evidentes tanto en las imágenes SEM (E) como en las HPICM(F) (flechas). Edades celulares: A, ratón postnatal día 5 (P5); B, rata P6; C, ratón P8; D, rata P5; E, ratón P7; y F, rata P5. En todas las imágenes HPICM, la escala de grises de un píxel indica la altura de la muestra en ese punto. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Imágenes HPICM de lapso de tiempo continuo del haz de estereocilios. (A) Una visión general de un haz de células ciliadas internas de rata P5 que muestra distintos estereocilios de filas más cortas. (B) Imágenes de lapso de tiempo de la región de interés indicada en (A) a lo largo de seis horas. Tenga en cuenta que, a diferencia de un experimento típico de patch camp, las células ciliadas no muestran signos de deterioro durante varias horas in vitro. Esto se debe a una disección cuidadosa y la ausencia de cualquier alteración mecánica de la célula. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Artefactos comunes al tomar imágenes con HPICM. (A) Efecto de un punto de consigna demasiado bajo. Imágenes HPICM de baja resolución de los mismos haces de células ciliadas internas vivas en ratones P3 adquiridas con punto de consigna 0.05% (izquierda) y 0.07% (derecha). Observe un ruido de punto blanco que desaparece con un punto de consigna más alto. (B) Efecto de una amplitud de salto demasiado alta. El ruido de puntos blancos también aparece en una imagen HPICM de un haz de células ciliadas internas de rata P7 obtenido con una gran amplitud de salto de 5,8 μm (izquierda). Este ruido desaparece cuando se visualiza el mismo haz con la amplitud de salto de 3,4 μm (derecha) debido a la disminución de las vibraciones en el sistema. (C) Una amplitud de salto demasiado baja da como resultado la colisión de la sonda HPICM a los estereocilios y su arrastre (flechas en el panel izquierdo). Aumentar la amplitud del salto lo suficiente como para "trepar" por los estereocilios elimina este artefacto (derecha), pero también puede aumentar el tiempo de imagen, lo que resulta en una deriva notable (líneas verticales en el panel derecho). Haz de estereocilios de una célula ciliada externa viva de rata P7. (D) Un punto de consigna demasiado alto causa una forma cuadrada de puntas de estereocilios (flechas) en una imagen HPICM (izquierda), nuevamente debido a la colisión de la nanopipeta con los estereocilios. La disminución del punto de consigna (con disminución simultánea de la amplitud de la esperanza para eliminar el ruido blanco) mejora la imagen (derecha). Haz de estereocilios de una célula ciliada interna viva de una rata P6. Haga clic aquí para ver una versión más grande de esta figura.
| Resolución | Área de imagen (μm) | Resolución lateral (nm) | Tiempo por imagen (minutos) |
| Bajo | 20×20 | ≥300 | ≤20 |
| Bajo | 10×10 | ≥156 | ≤15 |
| Bajo | 5×5 | ≥75 | ≤4 |
| Alto | 20×20 | ≤200 | ≤20 |
| Alto | 10×10 | ≤110 | ≤15 |
| Alto | 5×5 | ≤55 | ≤4 |
Tabla 1: Tiempos típicos de las imágenes HPICM dependiendo del tamaño del área de imágenes y la resolución de escaneo.
Discusión
Para obtener imágenes HPICM exitosas, los usuarios deben establecer un sistema de bajo ruido y baja vibración y fabricar pipetas apropiadas. Recomendamos encarecidamente el uso de estándares de calibración AFM para probar la estabilidad del sistema antes de intentar realizar cualquier imagen de células vivas. Una vez que se prueba la resolución del sistema, los usuarios pueden considerar la posibilidad de obtener imágenes de muestras de órganos fijos de Corti para familiarizarse con la configuración de imágenes antes de intentar cualquier imagen de células vivas.
El punto de consigna óptimo para la obtención de imágenes varía entre las diferentes pipetas, dependiendo de la forma individual de sus puntas (que se desconoce hasta que se examina mediante microscopía electrónica) y de la cantidad de suciedad unida a la punta, que también es impredecible. Las nanopipetas con un punto de consigna óptimo superior al 0,7% deben desecharse.
Durante las imágenes de células vivas, la cantidad de polvo y desechos en la solución extracelular aumenta con el tiempo. Todas estas partículas pueden terminar en la punta de la pipeta, causando una reducción en la corriente y haciendo imposible continuar escaneando el tejido: la imagen se volverá completamente blanca ya que la retroalimentación "pensará" que la nanopipeta siempre está cerca de la muestra. Si esto sucede, se recomienda retraer la pipeta en el eje Z de esa área del tejido. Esta retracción podría despejar la "suciedad". Si la pipeta todavía está sucia, es necesario cambiar la pipeta y moverse a un área diferente de la muestra. Luego, el usuario puede continuar escaneando el tejido.
A partir de hoy, la limitación más esencial del HPICM es la cantidad de tiempo requerido para tomar una imagen a alta resolución mientras se trabaja con muestras con topografía compleja. Dependiendo de la resolución deseada, las imágenes pueden tardar hasta media hora o más. En imágenes adquiridas durante más de quince minutos, la deriva puede hacerse evidente y las estructuras específicas pueden ser desplazadas y más difíciles de distinguir. Esto está sucediendo porque las células vivas se mueven constantemente o cambian de forma con el tiempo. Para visualizar los eventos moleculares y los cambios en las estructuras de las células a lo largo del tiempo, se necesitan más desarrollos para optimizar la resolución temporal del HPICM11.
El ruido de la corriente nanopipeta representa otra limitación porque establece el punto de consigna mínimo prácticamente alcanzable. La corriente generada por la nanopipeta en la solución se atenúa rápidamente (inversa proporcional a la distancia cúbica desde la punta de la pipeta), estableciendo así un "volumen de detección", más allá del cual la nanopipeta no puede "sentir" la superficie. Previamente hemos desarrollado un modelo de este fenómeno y hemos demostrado que la resolución lateral de la sonda SICM está determinada por la sección transversal de este "volumen de detección" con la superficie celular, que podría ser extremadamente pequeña en puntos de consigna bajos25. Esto es particularmente importante para obtener imágenes de enlaces de punta de células ciliadas que tienen un diámetro de ~ 5 nm12,33. A primera vista, las pipetas con un diámetro interior más pequeño darían como resultado una mejor resolución de las imágenes HPICM. Esto es cierto para pipetas relativamente grandes (>50 nm). Sin embargo, la disminución del diámetro interno de la nanopipeta por debajo de ~ 50 nm da como resultado un aumento desproporcionadamente grande del ruido de la pipeta y, por lo tanto, la pérdida de resolución en puntos de ajuste bajos que son esenciales para obtener imágenes de haces de estereocilios. A día de hoy, no sabemos cómo resolver este problema y estamos trabajando para encontrar la solución adecuada.
En resumen, este artículo presenta un protocolo detallado para la visualización de haces de estereocilios en células ciliadas auditivas de mamíferos vivos con HPICM. Las mayores ventajas del HPICM son: i) su capacidad para visualizar estructuras a nanoescala sin etiquetas en la superficie de las células vivas sin tocarlas; y ii) sondear la función de estas estructuras con registros de pinzas de parche y/o entrega local a nanoescala de estímulos mecánicos o químicos. Hasta donde sabemos, estas ventajas son exclusivas de HPICM. Por supuesto, hay algunas desventajas. En primer lugar, debido a las limitaciones en la altura de las estructuras a fotografiar, hpICM puede no ser adecuado para obtener imágenes de estructuras extremadamente altas, como los haces de estereocilios de las células ciliadas vestibulares en las ampollas de los mamíferos. En segundo lugar, HPICM todavía se está desarrollando y se necesitan más mejoras en la velocidad y la resolución de las imágenes. Sin embargo, los principios físicos de HPICM y nuestra propia experiencia sugieren que es posible. Creemos que HPICM proporcionará datos únicos sobre la función de los complejos de proteínas individuales en la superficie de los estereocilios.
Divulgaciones
Los autores no tienen intereses contrapuestos.
Agradecimientos
Agradecemos al Prof. Yuri Korchev (Imperial College, Reino Unido) por el apoyo y asesoramiento a largo plazo en todas las etapas del proyecto. También agradecemos a los Dres. Pavel Novak y Andrew Shevchuk (Imperial College, Reino Unido), así como a Oleg Belov (Centro Nacional de Investigación de Audiología, Rusia) por su ayuda con el desarrollo de software. El estudio fue apoyado por NIDCD/NIH (R01 DC008861 y R01 DC014658 a G.I.F.).
Materiales
| Name | Company | Catalog Number | Comments |
| Analog oscilloscope | B&K Precision | 2160C | Analog oscilloscope for real-time monitoring of nanopipette current and Z-axis approach |
| AFM calibration standards | TED PELLA Inc | HS-100MG; HS-20MG | These 100 and 20 nm calibration standards are used to test the performance of HPICM system |
| Benchtop vibration Isolator | AMETEK/TMC | Everstill K-400 | Active vibration isolation |
| Borosilicate glass capillaries | World Precision Instruments (WPI) | 1B100F-4 | Borosilicate glass capillaries for the nanopipettes |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | To be added to the bath solution to adjust osmolarity |
| Digitizer | National Instruments Corporation | PCI-6221 | Multi-channel input/output digitizer |
| Fast analog Proportional-Integral-Derivative (PID) control for Z movement | Standford Research Systems | SIM900, SIM960, SIM980 | Instrumentation modules integrated in an external PID controller for Z movement. It requires a fast response that is usually not implemented in commercial piezo amplifiers. |
| Faraday cage | AMETEK/TMC | Type II | Required to shield electromagnetic interference |
| Glass bottom dish | World Precision Instruments (WPI) | FD5040-100 | Used as the dish for the chamber for the tissue |
| Hanks' Balanced Salt Solution (HBSS) | Gibco, Thermo Fisher Scientific | 14025092 | Extracellular (bath) solution |
| Instrumentation amplifier | Brownlee Precision | Model 440 | Instrumentation amplifier provides required offsets, filtering, and secondary magnification or attenuation |
| Laser-based micropipette puller | Sutter Instrument | P-2000/G | Micropipette puller to fabricate the nanopipettes. Laser is needed for sharp quartz pipettes. |
| Lebovitz's L-15, without phenol red | Gibco, Thermo Fisher Scientific | 21083027 | Extracellular (bath) solution |
| Micromanipulator | Scientifica | PatchStar | Used for "course" positioning of the Z piezo actuator |
| Microscope | Nikon | Eclipse TS100 | Inverted optical microscope |
| Patch amplifier | Molecular Devices | Axopatch 200B | The patch clamp amplifier measures the current through the nanopipette |
| Piezo amplifier (XY axes) | Physik Instrumente (PI) | E-500.00, E-505.00, E-509.C2A | Amplification and PID control for XY piezo translation stage |
| Piezo amplifier (Z axis) | Piezosystem jena | ENT 400 & 800 | Custom amplifier consisting of ENT 400 power supply and two ENT 800 amplifiers in parallel to achieve max current of 1.6 nA |
| Plastic Coverslips | TED PELLA Inc | 26028 | Used in the fabrication of the chambers for the tissue |
| SICM controller & software* | Ionscope, UK (ionscope.com) | N/A | Custom controller based on SBC6711 digital signal processing board from Innovative Integration Ltd |
| Silicone elastomer (Sylgard) | World Precision Instruments (WPI) | SYLG184 | Used to attach the flexible glass fibers to the chamber for the tissue |
| Silicon glue | The Dow Chemical Company | 734 | Used to glue the different parts of the chamber for the tissue |
| Tungsten rod | A-M Systems | 717500 | Used for holding the dental floss strands in the chamber for the tissue |
| XY piezo nanopositioner | Physik Instrumente (PI) | P-733.2DD | XY translation stage with capacitive sensors |
| Z piezo nanopositioner | Piezosystem jena | RA 12/24 SG | Ring piezoactuator with a strain gage sensor |
| *Ionscope does not sell separate SICM controllers anymore. There are few other commercial systems: NX12-Bio and NX10 SICM, | |||
| Park Systems, Korea and SICM modules from ICAPPIC Limited, UK (icappic.com). All these systems are based on the original | |||
| HPICM principles. However, imaging stereocilia bundles in the hair cells requires several custom modifications that are technically | |||
| challenging (or even impossible) in the closed “ready-to-go” systems such as Ionscope or NX12-Bio/NX10. Currently, there is only one | |||
| modular system (ICAPPIC) that has the flexibility to suit any SICM/HPICM experiment but requires some component integration. |
Referencias
- Beurg, M., Fettiplace, R., Nam, J. H., Ricci, A. J. Localization of inner hair cell mechanotransducer channels using high-speed calcium imaging. Nature Neuroscience. 12 (5), 553-558 (2009).
- Effertz, T., Becker, L., Peng, A. W., Ricci, A. J. Phosphoinositol-4,5-bisphosphate regulates auditory hair-cell mechanotransduction-channel pore properties and fast adaptation. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 37 (48), 11632-11646 (2017).
- Peng, A. W., Gnanasambandam, R., Sachs, F., Ricci, A. J. Adaptation independent modulation of auditory hair cell mechanotransduction channel open probability implicates a role for the lipid bilayer. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 36 (10), 2945-2956 (2016).
- Engström, H., Engström, B. Structure of the hairs on cochlear sensory cells. Hearing research. 1 (1), 49-66 (1978).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Wäldchen, S., Lehmann, J., Klein, T., van de Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348(2015).
- Pickles, J. O., Comis, S. D., Osborne, M. P. Cross-links between stereocilia in the guinea pig organ of Corti, and their possible relation to sensory transduction. Hearing Research. 15 (2), 103-112 (1984).
- Furness, D. N., Hackney, C. M. Cross-links between stereocilia in the guinea pig cochlea. Hearing Research. 18 (2), 177-188 (1985).
- Jacobs, R. A., Hudspeth, A. J. Ultrastructural correlates of mechanoelectrical transduction in hair cells of the bullfrog’s internal ear. Cold Spring Harbor Symposia on Quantitative Biology. 55, 547-561 (1990).
- Goodyear, R. J., Marcotti, W., Kros, C. J., Richardson, G. P. Development and properties of stereociliary link types in hair cells of the mouse cochlea. The Journal of Comparative Neurology. 485 (1), 75-85 (2005).
- Kachar, B., Parakkal, M., Kurc, M., Zhao, Y., Gillespie, P. G. High-resolution structure of hair-cell tip links. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13336-13341 (2000).
- Vélez-Ortega, A. C., Freeman, M. J., Indzhykulian, A. A., Grossheim, J. M., Frolenkov, G. I. Mechanotransduction current is essential for stability of the transducing stereocilia in mammalian auditory hair cells. eLife. 6, 1-22 (2017).
- Ivanchenko, M. V., et al. Serial scanning electron microscopy of anti-PKHD1L1 immuno-gold labeled mouse hair cell stereocilia bundles. Scientific Data. 7 (1), 182(2020).
- Hadi, S., Alexander, A. J., Vélez-Ortega, A. C., Frolenkov, G. I. Myosin-XVa controls both staircase architecture and diameter gradation of stereocilia rows in the auditory hair cell bundles. Journal of the Association for Research in Otolaryngology JARO. 21 (2), 121-135 (2020).
- Metlagel, Z., et al. Electron cryo-tomography of vestibular hair-cell stereocilia. Journal of Structural Biology. 206 (2), 149-155 (2019).
- Langer, M. G., et al. Mechanical stimulation of individual stereocilia of living cochlear hair cells by atomic force microscopy. Ultramicroscopy. 82 (1-4), 269-278 (2000).
- Dufrêne, Y. F. Towards nanomicrobiology using atomic force microscopy. Nature Reviews Microbiology. 6 (9), 674-680 (2008).
- Putman, C. A., van der Werf, K. O., de Grooth, B. G., van Hulst, N. F., Greve, J. Viscoelasticity of living cells allows high resolution imaging by tapping mode atomic force microscopy. Biophysical journal. 67 (4), 1749-1753 (1994).
- Gavara, N., Chadwick, R. S. Noncontact microrheology at acoustic frequencies using frequency-modulated atomic force microscopy. Nature Methods. 7 (8), 650-654 (2010).
- Cartagena-Rivera, A. X., Van Itallie, C. M., Anderson, J. M., Chadwick, R. S. Apical surface supracellular mechanical properties in polarized epithelium using noninvasive acoustic force spectroscopy. Nature Communications. 8 (1), 1030(2017).
- Katsuno, T., et al. TRIOBP-5 sculpts stereocilia rootlets and stiffens supporting cells enabling hearing. JCI Insight. 4 (12), (2019).
- Hansma, P. K., Drake, B., Marti, O., Gould, S. A., Prater, C. B. The scanning ion-conductance microscope. Science. 243 (4891), 641-643 (1989).
- Korchev, Y. E., et al. Specialized scanning ion-conductance microscope for imaging of living cells. Journal of Microscopy. 188 (Pt 1), 17-23 (1997).
- Shevchuk, A. I., et al. Imaging proteins in membranes of living cells by high-resolution scanning ion conductance microscopy. Angewandte Chemie (International ed in English. 45 (14), 2212-2216 (2006).
- Novak, P., et al. Nanoscale live-cell imaging using hopping probe ion conductance microscopy. Nature Methods. 6 (4), 279-281 (2009).
- Vélez-Ortega, A. C., Frolenkov, G. I. Visualization of live cochlear stereocilia at a nanoscale resolution using hopping probe ion conductance microscopy. Methods in Molecular Biology. 1427, 203-221 (2016).
- Gu, Y., et al. High-resolution scanning patch-clamp: new insights into cell function. FASEB Journal Official Publication of the Federation of American Societies for Experimental Biology. 16 (7), 748-750 (2002).
- Frolenkov, G. I., et al. Single-channel recordings from the apical surface of outer hair cells with a scanning ion conductance probe. Association for Research in Otolaryngology. Abs. 444, (2004).
- Sánchez, D., et al. Noncontact measurement of the local mechanical properties of living cells using pressure applied via a pipette. Biophysical Journal. 95 (6), 3017-3027 (2008).
- Korchev, Y. E., Negulyaev, Y. A., Edwards, C. R., Vodyanoy, I., Lab, M. J. Functional localization of single active ion channels on the surface of a living cell. Nature Cell Biology. 2 (9), 616-619 (2000).
- Shevchuk, A., et al. Angular approach scanning ion conductance microscopy. Biophysical Journal. 110 (10), 2252-2265 (2016).
- Furness, D. N., Katori, Y., Nirmal Kumar, B., Hackney, C. M. The dimensions and structural attachments of tip links in mammalian cochlear hair cells and the effects of exposure to different levels of extracellular calcium. Neuroscience. 154 (1), 10-21 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados