Method Article
生きた哺乳類聴覚毛細胞におけるナノスケール分解能によるステレオシリアバンドルイメージング
要約
ここでは、ホッピングプローブイオン伝導顕微鏡(HPICM)、ライブ聴覚ヘアセルの立体束のナノスケールイメージングを可能にする非接触スキャンプローブ技術のプロトコルを提示します。
要約
内耳の毛髪細胞は、音によって引き起こされる変位を検出し、高さが増加する列に配置された立体からなる毛束の電気信号にこれらの刺激を変換します。ステレオ繊毛が偏向すると、それらは、メカノイ感受性の伝達チャネルに力を伝達するステレオチリアを相互接続する小さな(直径5nm)の細胞外先端リンクを引っ張る。メカノトランスダクションは何十年もの間、生毛細胞で研究されてきましたが、立体(チップリンクダイナミクスや伝達依存ステレオシリアリモデリングなど)の先端におけるメカノトランスダクション機構の機能的に重要な超構造的詳細は、電子顕微鏡を用いた死細胞でのみ研究することができます。理論的には、原子間力顕微鏡のような走査プローブ技術は、立体の表面を視覚化するのに十分な解像度を有する。しかし、撮像モードとは無関係に、立体束との原子間力顕微鏡プローブのわずかな接触であっても、通常はバンドルに損傷を与える。ここでは、生げ歯類聴覚毛細胞のホッピングプローブイオン伝導顕微鏡(HPICM)イメージングの詳細なプロトコルを提示する。この非接触スキャンプローブ技術は、単一のナノメートルの解像度で、サンプルと物理的に接触することなく、髪の細胞のような複雑な地形を有する生細胞の表面のタイムラプスイメージングを可能にする。HPICMはガラスナノピペットを通過する電流を使用してピペットに近い近くの細胞表面を検出し、3Dポジショニング圧電システムは表面をスキャンしてその画像を生成します。HPICMを使用すると、立体束とライブ聴覚ヘアセルの立体を相互接続するリンクを、目立った損傷なしに数時間画像化することができました。HPICMの使用により、生きた毛髪細胞の立体構造の超構造変化を直接探索し、その機能をより深く理解できるようになると予想されます。
概要
聴覚毛髪細胞の立体束は、光学顕微鏡で視覚化するのに十分な大きさであり、パッチクランプ実験で生細胞で偏向するという事実にもかかわらず、先端リンクなどの伝達機構の必須の構造成分は、死細胞の電子顕微鏡検査でのみ画像化することができた。哺乳類聴覚毛細胞において、伝達機械は先端リンクの下端に位置し、すなわち、短い列立体1の先端に位置し、立体2,3の先端で信号を通して局所的に調節される。しかし、生きた毛髪細胞のこの場所での表面構造のラベルフリーイメージングは、立体の小さなサイズのために不可能です。
哺乳類の内毛細胞には、内毛細胞と外毛細胞の2種類の聴覚感覚細胞があります。内側の毛細胞では、立体は外毛細胞4に比べて長く、より厚い。立体の第1および第2列は、マウスまたはラットの内側の毛細胞の直径300〜500 nmを有する。光の回折により、ラベルフリー光学顕微鏡で達成可能な最大解像度は約200nmです。したがって、内側の毛細胞束の第1および第2列内の個々の立体の可視化は、光学顕微鏡検査で比較的容易である。対照的に、内側の毛細胞および外髪細胞のすべての立体体の短い立体は、100〜200nmの周りに直径を有し、光学顕微鏡5では視覚化できない。超解像イメージングの最近の進歩にもかかわらず、この基本的な制限は、任意の光学ラベルフリーイメージングに残っています。現在市販されているすべての超分解能技術は、その用途を制限する蛍光分子6のいくつかの並べ替えを必要とします。特定の蛍光的にタグ付けされた分子の必要性による制限に加えて、強烈な光照射への暴露は細胞損傷を誘発し、細胞プロセスに影響を与える可能性が示されているが、これは生細胞7を研究する際に大きな欠点である。
毛髪細胞立体線の超構造詳細に関する我々の現在の知識は、主に走査型電子顕微鏡(SEM)、透過電子顕微鏡(TEM)、凍結破壊EM、および最近ではイオンビームまたはクライオEMトモグラフィーまたはクライオEMトモグラフィーを用いたシリアル断面化などの3D技術を用いて、様々な電子顕微鏡(EM)技術で得られた。 14、15、16.残念ながら、これらのすべてのEM技術は、サンプルの化学的または凍結を必要とします。現象の時間スケールに応じて、この要件は、ステレオ繊毛の先端での動的プロセスの研究を不可能または非常に労働集約的に行います。
原子間力顕微鏡(AFM)17,18を用いた生毛細胞の毛束の画像化に限られた努力がなされている。AFMは生理学的な溶液で動作するので、理論的には、時間の経過とともに生きた毛髪細胞の立体束の動的変化を視覚化することができる。問題は、AFMプローブとサンプルの間の特定の物理的接触を意味する高解像度AFMの原理にあります。AFMプローブがステレオシリウムに遭遇すると、通常はクラッシュし、毛束の構造を損傷します。その結果、この技術は、生きている、あるいは固定された、毛細胞束17、18を視覚化するのに適していない。この問題は、試料20の表面に流体力のみを加える大きなボール型AFMプローブを用いることで部分的に緩和され得る。しかし、このようなプローブはサンプル21の機械的特性をテストするのに理想的であるが、コルティ22の器官を撮像する場合にはサブマイクロメートルの解像度しか提供せず、依然として高感度の立体束に対して実質的な力をサンプルに適用する。
走査イオン伝導顕微鏡(SICM)は、導電性溶液23を充填したガラスピペットプローブを用いた走査プローブ顕微鏡のバージョンである。SICMは、ピペットが細胞に近づくと表面を検出し、ピペットを通して電流が減少します。これは細胞に触れる前によく起こっているので、SICMは生理学的溶液24中の生細胞の非接触イメージングに理想的に適している。SICMの最良の解像度は、単一ナノメートルの順序で、生細胞25の形質膜で個々のタンパク質複合体を解決することができます。しかし、他の走査プローブ技術と同様に、SICMは比較的平坦な表面のみを画像化することができます。この限界を克服するために、ホッピングプローブイオン伝導顕微鏡(HPICM)26、ナノピペットが各イメージングポイントでサンプルに近づく(図1A)。HPICMを用いて、ナノスケール分解能27の生きた聴覚毛細胞の立体束を画像化することができた。
この技術のもう一つの基本的な利点は、HPICMが単なるイメージングツールではないということです。他の走査プローブ技術とは対照的に、HPICM/SICMプローブは、様々な刺激の電気記録および局所送達のために細胞生理学で広く使用されている電極である。イオンチャネル活性は、通常、HPICMイメージングを妨げないが、HPICMプローブを介した総電流は、最大のイオンチャネル25によって生成された細胞外電流より数桁大きいからである。しかし、HPICMは、この構造28からの目的の構造とその後の単一チャネルパッチクランプ記録に対するナノピペットの正確な位置決めを可能にする。このようにして、外毛細胞ステレオ繊毛29の先端で単一チャネル活動の最初の予備記録を得た。ナノピペットを通る大電流でさえ、細胞外媒体の膨大な電気シャントのために、形質膜全体の電位の有意な変化を生じることができないことは言及する価値があります。しかし、個々のイオンチャネルは、アゴニスト31の局所的な適用によってナノピペット30を通る液体の流れによって機械的に活性化することができる。
HPICMでは、ナノピペットがサンプルを順次に近づいてサンプルを一点で進み、後退し、横方向に移動してアプローチを繰り返すと、画像が生成されます(図1A)。パッチクランプアンプは、ピペット(図1B)のAgClワイヤーに常に電圧を適用し、浴液中に〜1nAの電流を発生させます。ピペットがセルの表面から離れている場合のこの電流の値は、参照電流として決定されます(Iref,図1C)。次に、ピペットはZ軸内を移動して、電流がユーザによって事前定義された量(設定点)によって減少するまでサンプルに近づくため、通常はIrefの0.2%-1%(図1C、上トレース)を示す。システムは、この時点での Z 値をサンプルの高さとして、このイメージング ポイントの X 座標と Y 座標と共に保存します。次に、ピペットは、ユーザーが定義する速度(通常は700-900 nm/ms)で表面(図1C、下のトレース)から引き込まれる。引き込み後、ピペット(または、我々の場合、サンプル-図1Bを参照)が次のイメージングポイントに横に移動し、新しい基準電流値が得られ、ピペットが再びサンプルに近づき、プロセスを繰り返します。ピペットのX-Y運動は、毛細胞メカノトランスダクション電流の記録に通常使用される直立顕微鏡セットアップで好ましい。この設定では、HPICM プローブは、上からではなく、角度32でヘア セル バンドルに近づきます。しかし、HPICMイメージングの最良の解像度は、反転顕微鏡のセットアップ(図1A、B)で達成され、X-Y方向のサンプルの動きはナノピペットのZ運動から結合され、潜在的な機械的アーティファクトを排除します。
HPICMを用いて、マウスおよびラットの内毛および外毛細胞の立体構造束の地形画像を得て、直径26、27の約5nmの立体間のリンクを視覚化した。この技術によるヘアセルバンドルイメージングの成功は、いくつかの要因に依存します。まず、ナノピペット電流のノイズ(分散)は、HPICMイメージングの可能な限り低い設定点を可能にする限り小さくする必要があります。低い設定値を設定すると、HPICMプローブは、より大きな距離で、プローブアプローチに対して任意の角度で立体表面を「感知」することができ、驚くべきことに、HPICMイメージングのX-Y解像度が向上します(説明を参照)。第二に、システム内の振動とドリフトは、イメージングアーティファクトに直接寄与するため、10nm未満に減少する必要があります。最後に、HPICMプローブと試料ステージは、単一ナノメートル以上の精度を有する較正されたフィードバック制御圧電器によってZ軸とX-Y軸で移動する場合でも、ナノピペット先端の直径は電流(感知量)の広がりとそれゆえに分解能(図1A)を決定する。したがって、生きた毛細胞をイメージングする前に、適切なピペットを引っ張り、キャリブレーションサンプルで所望の解像度に到達し、記録システムで低ノイズを達成することが重要です。
少なくとも数十年の間、SICM技術は商業的に入手可能ではなく、インペリアル・カレッジ(英国)のコルチェフ教授の主要な研究室で世界のいくつかの研究室によって開発されています。最近では、いくつかのSICMシステムが市販されるようになった( 材料表を参照)、そのすべてが元のHPICM原則に基づいています。しかし、ヘアセル内のステレオシリアバンドルをイメージングするには、クローズドの「すぐに使える」システムでは技術的に困難な(あるいは不可能な)いくつかのカスタム修正が必要です。そのため、コンポーネントの統合が必要になります。HPICMのセットアップはより厳しい振動および漂流の条件およびHPICMの調査およびサンプル(図1D)の圧造によって動く動きを有するパッチクランプ装置を表すので(図1D)、この統合は、パッチクランプに熟練している研究者にとって比較的容易である。しかし、適切な背景を持たない科学者は、間違いなく最初に電気生理学のいくつかの訓練を必要とします。イメージングの速度を上げるなどの課題が残っていますが( 議論参照)、私たちは生きた毛髪細胞の立体束をナノスケールの解像度で損傷を与えることなく画像化することができました。
本論文では、当社のカスタムシステムを用いて、若い出生後ラットまたはマウス人工内葉植物の生聴覚毛細胞束のHPICMイメージングを成功させるための詳細なプロトコルを提示する。統合されたコンポーネントは、 の一覧を参照してください。また、発生する可能性のある一般的な問題とそのトラブルシューティング方法についても説明します。
プロトコル
この研究は、国立衛生研究所の実験動物のケアと使用に関するガイドの推奨事項に従って行われました。すべての動物の手順は、ケンタッキー大学の制度的動物のケアと使用委員会(IACUC)によって承認されました(プロトコル00903M2005)。
1.ナノピペットの製造と試験
- マイクロピペットプーラーでプログラムを作成し、約50〜70nmの内先端径に対応する200~400 MΩの抵抗を持つピペットを得ます。パラメータはマイクロピペットの引き手によって異なります。非柔軟な細かいチップを持つ短いピペットを取得するには、引き手の操作マニュアルを確認してください。
- 1/0.58 mmの外径/内径のホウケイ酸ガラスキャピラリーと内フィラメントを使用して充填を容易にします。ピペットの横の機械的共鳴の頻度を決定するので、ピペットの長さは非常に重要です。ピペットが長ければ長いほど、低い周波数は共振周波数であり、この共振を避けるのが難しくなります。
注:ユーザーは、ホルダーが受け入れることができる最短ピペットを製造しようとする必要があります。この実験におけるナノピペットの長さは、通常15〜25mmである(図2A)。 - ナノピペットを中点まで充填し(図2A)、ライボヴィッツのL-15またはハンクスバランス塩溶液(HBSS)に20mM Dグルコースを加えた(浸透率を調整する)お風呂溶液で満たします。潜在的なアーティファクトを避けるために、記録のために風呂で使用されるのと同じ溶液を使用してください。
- 10倍の倍率で光学顕微鏡を使用して、ピペットの先端にある気泡がないか確認する(図2B)。気泡は現在の流れを防ぐでしょう。実験の数時間前に引っ張られたピペットの気泡を取り除くのは難しいです。したがって、すべての実験で新しいピペットを引っ張ることをお勧めします。
- ピペットに気泡が含まれると、HPICMピペットホルダーに取り付けます(図2C)。
- サンプル(組織またはキャリブレーション標準)をカスタムメイドのチャンバーに置き、上記の風呂溶液の4 mLを加えます。
- カスタムメイドのチャンバーをHPICMステージに設置し、溶液に接地電極を導入します。
- パッチクランプアンプによってピペットに印加される電圧がゼロであることを確認します。
- ピペットが液体に触れるまでZで動かします。
- アンプのオフセットをゼロに設定し、+100 mVを加え、ピペット電流をチェックします。
- オームの法則に基づいて、ピペットの抵抗と直径を計算します。
R = V/I
ここでRは抵抗(MOhm)、Vはナノピペット(mV)に印加される電圧であり、Iはナノピペット(nA)を流れる電流である。- 次の式12に従って他の場所で説明されているようにピペットの内径を計算します。
IDヒント= 1000/ √R
注:理想的な抵抗値は200〜400 MΩです。抵抗が400 MΩを超えるピペットは、サイズが小さいため不安定な電流(<50 nm内径)につながる可能性があります。逆に、抵抗が200MΩ未満のピペットは大きすぎて(>70 nm内径)、小さな特徴を解決しません。200 MΩ抵抗のピペットでのイメージングを開始することをお勧めします, 彼らは製造が容易であり、より少ない電気ノイズを提供する傾向があるため、 .
- 次の式12に従って他の場所で説明されているようにピペットの内径を計算します。
2.サンプルのドリフトと振動を最小限に抑える
注:イメージング中にシステムの機械的なノイズを低減するには、厚いガラススライド(約1.2ミリメートル)を使用してカスタムメイドのチャンバーにサンプルを取り付けます。
- 50 mm のガラス底皿からガラス部分を取り除き、プラスチック製の壁はそのままにしておきます。
- 厚いガラススライドの上に細胞培養皿のプラスチック部分をシリコン接着剤で接着します。
- シリコン接着剤または薄い両面テープを使用して、チャンバーの中央(ガラススライドの上)にキャリブレーションサンプルを取り付けます。
- 両サイドテープを使用して、チャンバーをHPICMステージにしっかりと固定します。
- イメージング中に、ファラデーケージを閉じ、それに応じて電気干渉と熱ドリフトを最小限に抑えるために毛布で覆います。
3.AFMキャリブレーション規格による分解能のテスト
メモ:システムのトラブルシューティングを行い、X-Z-Y軸で解像度をテストするために、ライブセルをイメージングする前にAFM標準( 材料表を参照)をイメージすることを強くお勧めします。校正基準には、2酸化珪素の柱と異なる形状の穴がありますが、5 x 5 mm シリコンチップ上に固定された高さ/深さ(20 または 100 nm)があります。Z解像度が100 nm以下であることを保証するために、100 nmキャリブレーション標準から始めることをお勧めします。このキャリブレーションサンプル(図3A)の柱または穴の高解像度画像を正常に作成した後(図3A)、20 nm標準に移行します。後者の標準の撮像が成功した場合(図3B)、Z軸の解像度は20nm以下であることが保証され、毛細胞ステレオシリアバンドル12の撮像に適している。次の手順は、両方のキャリブレーション標準をイメージ化するために使用されます。
- シリコン接着剤でチャンバに校正標準を取り付けます。
- 4 mLのHBSSをチャンバに加え、キャリブレーションサンプルをカバーします。次に、両面テープを使用して、HPICMセットアップのXY段階にチャンバを固定します。
- グランド電極の磁気ホルダをチャンバー近くのステージにクランプし、電極を槽溶液に浸します(図1B)。
- ナノピペットをホルダーに取り付け、浴液に浸し、セクション1に記載されている手順に従ってその電流を〜1nAに設定します。
- コースパッチクランプマニピュレータを使用して、キャリブレーション規格の中心よりナノピペットをほぼ上に配置します。二酸化ケイ素構造で覆われた面積が比較的大きい(1 x 1 mm)ため、目視検査は通常この位置決めで十分です。コルチ外植の器官(下記参照)とは対照的に、校正規格は透明ではなく、したがって、光学イメージングによって導かれるより正確な位置決めはこのサンプルでは不可能である。
- オシロスコープ上のZピエゾアクチュエータのセンサーからの信号をリアルタイムで監視しながら、セットポイントを増やします。安定した反復可能なZアプローチサイクル( 図1C、下)を確立した後、設定点を不安定点のすぐ上にある値に減らします。この手順は、この特定のナノピペットの最適なセットポイントを確保します。
- ピペットをサンプルに到達するまでパッチクランプマイクロマニピュレータで約5μm/sの速度で下に移動します。この時点で、リアルタイムZ測位信号の底面レベル(図1C)が増加し、試料表面を「センシング」してナノピペットが抜け出すことを示す。ナノピペットのそれ以上の動きは、Zポジショニング信号のさらなる正のシフトをもたらす。
注:Z圧電アクチュエータの動きの上限を超えないように注意してください。 - 低解像度でイメージングを開始します( 表1を参照)。AFM規格の不均一な実装により、対象領域の最高点は不明である可能性があります。したがって、ピペットの振幅(ホップ振幅)を少なくとも200〜500nmに設定してください。
- 一旦、撮像領域内のサンプルの最も高い点が特定されたら、ホップ振幅を減少させる。ホップ振幅が小さいほど、ドリフトの影響が減少し、振動が減少するため、高解像度イメージングに適したスキャンが高速化されます。
- ピペットを新しいX-Y位置に移動する前に、Z軸で約200μmを引き込み、サンプルとの望ましくない衝突を防ぎます。
注: ナノピペットがキャリブレーション規格の中心に合致しない場合、表面の特徴の領域からスキャンが開始される可能性があります。 - 対象領域が見つかったら、より高い解像度でイメージングを開始します(表1を参照)。
4.人工の外植を確保するために、カスタムメイドのチャンバーを作ります
注:柔軟なガラスピペット(ステップ4.1)(図4A)または歯科フロス(ステップ4.2)のいずれかを利用するカスタム構築クランプシステムでチャンバーに人工の外植体を取り付けます(図4B)。ガラスピペットチャンバーは、コルティの培養器官に殺菌して使用することができ、歯科フロスチャンバーは、サンプルのより安全な保持と取り付け時のステレオシリアバンドルの向きを制御します。これらのカスタムメイドのチャンバーは事前に準備する必要がありますが、いくつかのイメージングセッションで洗浄して再利用することができます。
- 柔軟なガラスピペットを使用してチャンバーを作る
- ピペットプーラーを使用して、ガラスの毛細血管から2つの薄くて柔軟なガラス繊維を引き出します。当社の引っ張られたガラス繊維は、通常、長さが1〜2cmを測定し、かなり柔軟です。
- ガラスカバースリップの上にシリコーンエラストマーの小さな滴を置きます。直径2cmのカバーリップを使用してください。
- 2つのガラス繊維の端部をシリコーンドロップに置き、それらの間に少しの分離を持つ繊維を配置する(図4A)。
- ホットプレートの上にカバースリップを置き、エラストマーを素早く治します(1〜3分)。
- シリコーンエラストマーの少量(1-3 μL)を使用してセクション2で説明したチャンバーのガラス底にカバースリップを接着し、一晩硬化させます。
- 歯科フロスを使用してチャンバーを作る:
- 50 mm のガラス底皿のガラス部分を取り外し、プラスチック製の壁はそのままにしておきます。その後、1.2 mm 厚いガラススライドの上に細胞培養皿のプラスチック部分をシリコン接着剤で接着します。
- 同じ接着剤を使用して、同じ接着剤で1つのプラスチックカバースリップ(6.5 x 6.5 mm)をチャンバーの中央に取り付けます。その後、前のカバースリップの上に別のカバースリップでプロセスを繰り返します。
- シリコン接着剤を使用して、2本の小さなタングステンまたは金メッキワイヤー(長さ12mm、直径約0.5mm)を取り付け、それぞれカバースライドの反対側に取り付けます。カバースライドから十分に(>10〜15mm)まで接着します(図4B)。
- 2本のデンタルフロスストランドを分離し、カバースライドの上に置き、結び目を作ることによってワイヤーに固定します。両方のストランド間に小さな隙間を残します(図4B、短い矢印)。
- すべての使用後にチャンバーをきれいにする
- 細かいピンセットを使用してチャンバーから組織を静かに取り除き、残された組織残渣を軽く削ります。
- 最初に70%エタノールでチャンバーをすすい、次に蒸留水ですすいます。
- 必要に応じて、すすいサイクルを繰り返します。
- チャンバーをフィルターペーパーの上に逆さまに置き、次の実験まで乾燥させます。チャンバーは、画像処理後にコルチの臓器の培養が計画されない限り、滅菌する必要はない。
コルティのげっ歯類の器官を解剖する
- 若い出生後人工内葉の分離を行なう。
- HPICMイメージングの場合、出生後3日から6日目(P3-6)の間のマウスから、および出生後3日から8日目(P3-8)の間のラットからコルチの器官を解剖する。
注: 古いヘアセルは解剖中の損傷を受けやすいため、時間経過時間 HPICM イメージングには使用できません。 - HPICMイメージングの前にテクトリアル膜を除去することを忘れないでください。
- 解剖直後に、セクション4に記載されているチャンバーの1つに組織を固定し、柔軟なガラスピペットの下に置くか、または2つのデンタルフロスストランドの下に置く(図4)。これらのチャンバを4 mLの室温バス溶液で事前充填します(泡形成を最小限に抑えます)。
6.聴覚毛細胞のイメージング
- 両面テープを使用してX-Yピエゾステージ上のコルティの新たに単離された器官でチャンバーをマウントし、X軸とY軸のチャンバードリフトを最小限に抑えるためにしっかりと固定されていることを確認します(図1B)。
- セクション1の手順に従って、新しいナノピペットを配置し、正しいピペット耐性を確認します。
- パッチクランプマイクロマニピュレータを用いて、ナノピペットを毛細胞領域上に配置し、逆顕微鏡でコルチ外植の器官を観察する。
- オシロスコープ上のリアルタイム電流とZ位置信号を記録して、0.5%以下の設定点でシステムが安定しているかどうかを確認します( 図1Cのように)。Z信号が安定していない場合は、パッチクランプアンプのローパスフィルタのカットオフ周波数を下げてみてください。しかし、Z piezoアクチュエータの応答時間より低くすることはできません(電流測定値の遅延によるサンプルとのピペット衝突を避けるため)。
メモ:実際には、このフィルタの5kHz設定が最適であることがわかりました。Z信号がまだ不安定な場合は、ナノピペットを交換する方が良いです。 - 安定した記録が達成されたら、最適な設定点を決定し、上記のステップ3.6-3.7で説明したように、HPICMピペットでサンプルにアプローチします。
- まず、低分解能イメージング(表1参照)を、6~8μm以上のホップ振幅を使用して実行します。ヘア セルステレオシリア バンドルなどの高い構造をイメージするには、ホップの振幅がこれらの構造体との衝突を避けるために十分であることを確認します。
注:ホップの振幅が十分でない場合、ピペットはステレオシリウムを飛び越えることができ、差し迫った衝突が発生します。HPICMプローブと立体素子の衝突により、毛束が損傷する可能性があります。したがって、立体束の高さが不確実な場合には、より大きなホップ振幅を使用する。 - まず、走査型電子顕微鏡で得られた画像を実行および/または研究することによって、コルティの器官の地形に慣れる(図5)。
注:HPICM画像が、すべてのイメージングポイントで1μm未満の高さで均一である場合、ピペットは組織ではなくガラス底部をスキャンしている可能性があります。あるいは、ピペットは、毛細胞から離れて、人工内皮の異なる領域に「着陸」し得る。 - ピペットを新しいX-Y位置に移動させる必要がある場合は、組織内の高い特徴との衝突を避けるために約500nmを引き込みます。低解像度 HPICM イメージングを、毛細胞との関心領域が見つかるまで繰り返します。
- 対象領域が見つかったら、より高い解像度でイメージングを開始します( 表1を参照)。髪の束全体をイメージングする場合は、15分未満を過ごしてみてください。
注: 生きた組織の毛細胞束はまだありませんが、例えば、基礎となる支持細胞の形状変化などにより、その向きが変わる可能性があります。したがって、画像取得が遅すぎると、画像が動きのアーティファクトを示す場合があります。 - もう一度、高解像度イメージングのホップ振幅を減少させる前に、低解像度の画像で最も高いフィーチャを決定します。ヘアセルバンドル全体をカバーする対象領域では、ホップ振幅を4~5μmに下げ、バンドル内の比較的小さく「平坦」な領域(例えば、2 x 2 μm)の場合はホップの振幅をさらに小さくし、1μm未満まで下げ、イメージングの速度と分解能を向上させます。
7.画像処理
注: イメージングアーティファクトは HPICM イメージングでは一般的です。一部のパラメータは画像取得パラメータで修正できますが、特殊なSICMビューアまたはImageJやMatLabのような一般的なデータ処理プログラムで後処理を行う必要があるものもあります。ここでは、最も一般的なアーティファクトと、SICMビューアで修正する方法について説明します。
- 勾配補正を実行する
注: 初心者にとっては明らかではありませんが、イメージング領域の全体的な傾斜が等しいかそれより大きい場合(図3A、B、左)、人間の目は細胞の表面のサブマイクロメートルサイズの特徴を解決できません。したがって、(HPICM 3D画像データを単一平面にフィットさせることによって)画像領域の平均勾配を決定し、HPICM画像(図3A、B、中央)から差し引く必要があります。- [ 開く ] をクリックして、SICM ビューアで画像を開きます。
- [画像補正]タブを選択します。
- [ 正しい勾配 ]タブを選択します。
- 自動勾配補正を行う場合は、[ 正しい勾配 ]ボタンを押します。
- ラインの配置を実行する
注: 前述したように、機械的および/または熱ドリフト、セル移動アーティファクトは HPICM イメージングで重大な問題を示しています。1分あたりのマイクロメートル未満の速度を持つ小さなドリフトは、通常のパッチクランプ設定では通常顕著ではありません。しかし、HPICMイメージングでは数十ナノメートルのアーティファクトを生成することができ、これはHPICMの分解能よりも有意に大きい。したがって、イメージング中に隣接する 2 本の HPICM スキャン ライン間で Z 軸が急激にジャンプすることは珍しくありません。この問題は、これらの隣接するスキャン ラインの開始 (および/または終了) の Z 値の違いを分析することで修正できます。- [ 開く ] をクリックして、SICM ビューアで画像を開きます。
- [画像補正]タブを選択します。
- [ 正しい勾配 ]タブを選択します。
- 整列する線の幅を選択します。ボタンを押して ボタンを押して行揃え自動調整を行います。
- ノイズリダクションを実行する
注:HPICMで画像を取得する間、ナノピペット電流の小さな変動は、特に低いセットポイントで、サンプルの表面からナノピペットが止まる可能性があります。画像に小さな白い点が現われます。このイメージングアーティファクトを補正するためには、撮像点を隣接者のそれよりも有意に大きいZ値で識別し、この値を隣接者の平均値に置き換える必要があります。これは、調整可能な中央値フィルタによって行われます。- [ 開く ] をクリックして、SICM ビューアで画像を開きます。
- [ 画像処理 ] タブを選択します。
- [ ノイズ除去 ]タブを選択します。
- 削除するピクセルの しきい値フィルタ (μm)を設定します。
結果
本稿で紹介するプロトコルは、複雑な地形を持つあらゆる生細胞を可視化するために使用することができる。これらの手順に従って、我々は日常的に生きたラット聴覚毛細胞束の画像を取得します(図6B,D)。SEM画像と比較するとX-Y解像度が低いにもかかわらず、私たちのHPICM画像は、ステレオチリアの異なる列、立体先端の形状、さらには隣接するステレオチリアを結ぶ小さなリンク(直径5nm)を解決することができます(図6F)。さらに、HPICM 画像には、SEM 画像に不足している情報が 3D に含まれます。この種のイメージング技術の非接触性を考えると、バンドルの凝集性を損なうことなく、同じヘアセルバンドルの連続的なタイムラプスHPICMイメージングを数時間(すなわち、5〜6時間定期的に)行うこともできた(図7)。このように、HPICMは、時間の経過とともに毛細胞束の動的構造変化の研究のための大きな可能性を示す。
ピペットサイズ、現在の設定値、低/高解像度パラメータ、およびホップ振幅に関するいくつかの範囲を提供していますが、各ユーザーは、ライブヘアセルバンドルのHPICM画像を正常に取得するために設定をわずかに最適化する必要があります。セットポイントを小さくすると、より高品質なイメージが生成されます。しかし、設定点が非常に低い場合、システムは電流の小さな変動をセル表面に遭遇すると解釈し、画像内の「ホワイトドット」ノイズを引き起こします(図8A)。同様に、ホップの振幅が大きいとピペットの横共鳴が増加し、また、雑多なピクセルを生成する可能性があります(図8B)。これに対し、ホップ振幅が小さすぎる場合や、設定点が高すぎる場合、ナノピペットがサンプルと衝突して、画像化アーティファクトを引き起こしたり、毛束を損傷したりすることもあります(図8C,D)。これらのパラメータをすべて調整しながら、低解像度でイメージングを実行して、サンプルやナノピペットへのダメージを最小限に抑えることをお勧めします。

図1:ホッピングプローブイオン伝導顕微鏡(HPICM)の原理(A)ナノピペットを流れる電流は、ピペットの先端に「感知量」を発生させる。毛細胞の立体束のような複雑な構造を画像化するために、ピペットは上から細胞表面に向かって近づき、表面を検出した後に後退する。各ステップで横移動した後、ピペットは、細胞の画像を生成するサンプルの上に「ホップ」し続けます。ピペットが立体に「上昇」するには、ホップの振幅が十分でなければならないことに注意してください。図示されたホップ振幅は、左から右へのスキャン(矢印で示される最も小さいステレオシリウムから最も高いステレオシリウムまで)に対して機能します。しかし、ピペットが最初に最も高いステレオシリウムに会うとき、右から左へのスキャンには小さすぎます。(B) 実験用セットアップ。コルチ外植の器官を持つカスタムメイドのチャンバーは、光学顕微鏡観察のための開口部を備えたXYナノ配置ステージに取り付けられています。ナノピペットは、別の超高速Zピエゾアクチュエータによって移動されます。対象領域にナノピペットを配置するために、Zアクチュエータはパッチクランプアンプヘッドステージと共に従来のマイクロマニピュレータ(図示せず)に搭載される。接地電極は磁気ホルダーに取り付けられ、バスに挿入されます。(C)撮像中のピペット電流(上トレース)とピペットのZ位置(下トレース)の代表的な記録。ピペットが細胞表面から離れていると、ピペットを通過する電流の基準値が決定される(Iref)。次いで、ピペットをサンプル(アプローチ)に向かって移動する。「センシング体積」が細胞表面と合致すると、ピペット電流は減少し始めます。撤退のためのコマンドは、現在の減少が設定点に達したときに発行されます。 (D) HPICM イメージング用の従来のパッチ クランプ セットアップに追加する必要がある機器の概略図。専用パッチクランプアンプは、SICMコントローラがHPICMモードで使用するナノピペット電流(I)を記録し、X、Y、Z軸へのコマンド信号を生成します。 計測アンプは、必要に応じて、これらの信号にオフセット、スケーリング、ローパスフィルタリングを提供します。残念ながら、コントローラーからのX/Y/Z信号は、ピエゾセラミックに固有のヒステリシスとクリープによって引き起こされる大きなエラーのために、ピエゾアクチュエータに直接適用することはできません。したがって、各ピエゾアクチュエータ(変換段階)には、これらのエラーを修正するためにコマンド信号を事前に整形する比例積分微分(PID)コントローラにフィードバック信号を送信するモーションセンサーが内蔵されています。比較的遅い X 軸と Y 軸は、piezo アンプに組み込まれているPID コントローラを使用できますが、より高速な Z 軸には専用の高速 PIDコントローラが必要です。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:ナノピペットの製造および充填法(A)イントラピペット溶液(HBSS)で満たされた約2cmのナノピペット。(B)ピペットを充填した後に典型的に形成される気泡(矢印)の画像。気泡は、通常、顕微鏡の照明(10xでLCDデジタル顕微鏡)の数分以内に離れて移動します。(C) SICMヘッドに取り付けられたナノピペット。矢印はピペットの内側のAgCl電極を指しています。ピペットホルダーは銀色に塗装され、Z piezoアクチュエータからの放射電気的ピックアップを最小限に抑えるため接地されていることに注意してください。この図の大きなバージョンを表示するには、ここをクリックしてください。
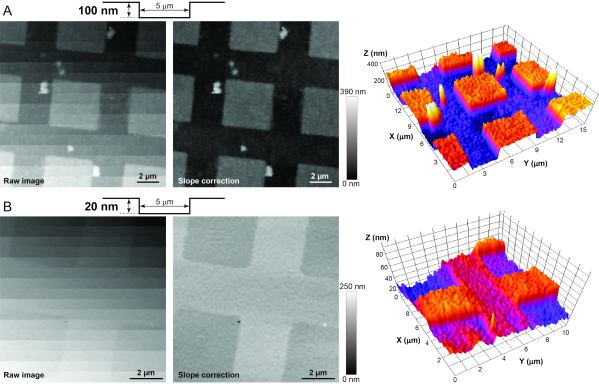
図3:システム内の適切な安定性、振動絶縁、および電気的ノイズを決定するためのAFMキャリブレーション標準のイメージング。(A)生(左)、後処理(中央)、HS-100MGキャリブレーション標準の3D(右)画像。規格の表面プロファイルは、上部に概略的に表示されます。標準はナノピペットに完全に垂直に整列することはないので、サンプルの小さな垂直特徴を明らかにするために後処理の斜面補正が必要です。(B) 類似生(左)、後処理(中央)、およびHS-20MGキャリブレーション規格の3D(右)画像は、より小さく、20nmの深いインデントを有する。HPICM イメージ内のピクセルのグレースケールは、そのポイントでのサンプルの高さを示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
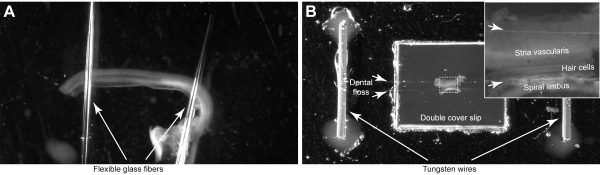
図4:コルチ外植の器官の取り付け。(A)外植はガラス底のペトリ皿に接着された2つのガラスピペットによって保持されます。(B)外植は、カスタムメイドの画像処理室に2本のフロスストランド(短い矢印)によって固定される。インセットは、コルティの器官の拡大画像を示しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
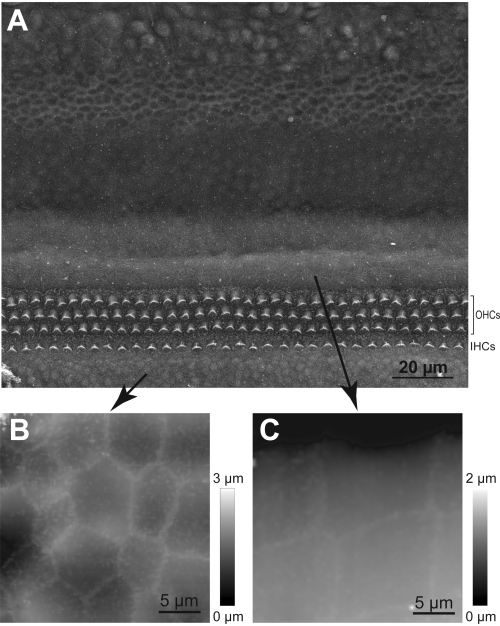
図5:ヘアセル領域へのHPICMプローブのナビゲーション。 (A) 内(IHC)および外(OHC)の毛細胞の行と、支持細胞の特殊なタイプを示す人工内外植物のSEM画像。(B) コルライカーの器官における細胞の代表HPICM画像。(C) ヘンセンの細胞の HPICM 画像。これら2種類の支持細胞は非常に異なる形状を有し、HPICMプローブが毛細胞に対して放射状または末梢領域に着陸したかどうかを判断するのに役立ちます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
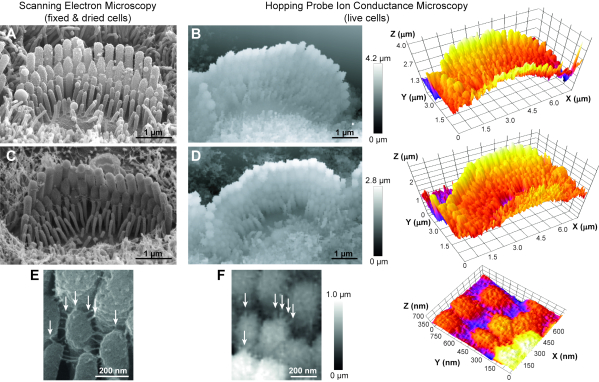
図6:若い出生後げっ歯類の内側の毛細胞における立体束の走査型電子顕微鏡(SEM)とホッピングプローブイオン伝導顕微鏡(HPICM)イメージングの比較。(A,C)SEM画像は、表面の細部のサブナノメートル解像度を提供しますが、臨界点乾燥のために固定され、縮んでいる細胞内で。また、SEM 画像では 3D 解析はできません。(B,D)HPICM画像(左)は、より悪い解像度(〜5〜10nm)を有するが、それらは、生細胞で得られ、タイムラプスイメージングを可能にし、正確な高さに関する情報を運び、3Dの再構成および測定を可能にする(右)。(E, F)立体間の細胞外リンクは、SEM(E)とHPICM(F)画像(矢印)の両方で明らかである。細胞の年齢: A, 出生後 5 日目 (P5) マウス;B, P6ラット;C, P8 マウス;D, P5ラット;E, P7 マウス;そしてF、P5ラット。すべての HPICM イメージでは、ピクセルのグレースケールは、そのポイントでのサンプルの高さを示します。この図の大きなバージョンを表示するには、ここをクリックしてください。

図7:立体束の連続的な時間経過HPICMイメージング(A)明確な短い列立体立体を示すP5ラットからの内側の毛細胞束の概要。(B)6時間を通して(A)に示された対象領域のタイムラプス撮像。なお、一般的なパッチキャンプ実験とは対照的に、毛細胞は、インビトロで数時間の劣化の兆候を示さない。これは、慎重な解剖と細胞への機械的な障害の欠如によるものです。この図の大きなバージョンを表示するには、ここをクリックしてください。

図8:HPICMによるイメージング中の一般的なアーティファクト。 (A) 設定値が低すぎる場合の効果設定値0.05%(左)と0.07%(右)で取得したP3マウスの同じライブ内毛細胞束の低解像度HPICM画像。設定値が高いほど白色のドット ノイズが消えます。(B) ホップ振幅が高すぎる効果。ホワイトドットノイズは、5.8μmの大きなホップ振幅で得られたP7ラットの内側のヘアセルバンドルのHPICM画像にも現れます(左)。このノイズは、システム内の振動の減少により、同じバンドルが3.4 μm(右)のホップ振幅で画像化されると消えます。(C)ホップ振幅が低すぎると、HPICM プローブが立体視に衝突し、ドラッグします(左側のパネルの矢印)。ステレオクテリアを「乗り越える」のに十分なホップ振幅を上げると、このアーティファクト(右)が排除されますが、イメージング時間が長くなり、目立つドリフト(右側のパネルの垂直線)が発生する可能性があります。P7ラットからの生きた外毛細胞の立体束。(D)設定点が高すぎると、HPICM画像(左)において、ナノピペットがステレオシリアに衝突するため、立体の先端(矢印)の二乗形状が生じます。設定点を減らす(ホワイトノイズを除去するために希望振幅を同時に減少させる)、イメージング(右)を改善します。P6ラットからの生きた内側の毛細胞の立体束。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 解決 | 画像領域(μm) | 横解像度 (nm) | 画像あたりの時間 (分) |
| 低い | 20×20 | ≥300 | ≤20 |
| 低い | 10×10 | ≥156 | ≤15 |
| 低い | 5×5 | ≥75 | ≤4 |
| 高い | 20×20 | ≤200 | ≤20 |
| 高い | 10×10 | ≤110 | ≤15 |
| 高い | 5×5 | ≤55 | ≤4 |
表1:イメージング領域のサイズとスキャン解像度に応じて、HPICMイメージングの典型的な時間。
ディスカッション
HPICM画像を正常に取得するには、低ノイズと低振動システムを確立し、適切なピペットを製造する必要があります。ライブセルイメージングを実行する前に、AFMキャリブレーション標準を使用してシステムの安定性をテストすることを強くお勧めします。システムの解像度をテストしたら、ユーザーは、ライブセルイメージングを試みる前に、画像処理の設定に精通するためにCortiサンプルの固定臓器をイメージングすることを検討することができます。
イメージングの最適な設定点は、チップの個々の形状(電子顕微鏡で調べるまで不明)と先端に付着した汚れの量によって異なりますが、これは予測不可能です。0.7%を超える最適な設定点を持つナノピペットは廃棄する必要があります。
生きた細胞のイメージング中に、細胞外溶液中のほこりや破片の量は時間の経過とともに増加します。これらの粒子はすべてピペットの先端で終わり、電流の減少を引き起こし、組織のスキャンを続けることを不可能にする可能性があります - フィードバックはナノピペットが常にサンプルの近くにあることを「考える」ので、画像は完全に白くなります。この場合、組織のその領域からZ軸方向のピペットを引き込むのが推奨されます。この撤回は「汚れ」を取り除くことができました。ピペットがまだ汚れている場合は、ピペットを交換し、サンプルの別の領域に移動する必要があります。その後、ユーザは組織をスキャンし続けることができる。
今日の時点で、HPICMの最も重要な制限は、複雑な地形を持つサンプルを扱っている間、高解像度で画像を撮るために必要な時間の量です。必要な解像度に応じて、画像には最大 30 分以上かかることがあります。15分以上撮影した画像では、ドリフトが明らかになり、特定の構造がシフトし、区別が難しくなる可能性があります。これは、生きている細胞が時間の経過とともに絶えず移動または形状を変化させ続けているために起こっています。時間の経過に伴う細胞の構造の分子事象と変化を可視化するために、HPICM11の時間的分解能を最適化するためにさらなる開発が必要である。
ナノピペット電流のノイズは、実質的に達成可能な最小限のセットポイントを設定するため、別の制限を表しています。溶液中のナノピペットによって生成される電流は、迅速に減衰し(ピペット先端からの立方距離に反比例する)、それによってナノピペットが表面を「感知」することができない「感知量」を確立する。我々は、この現象のモデルを以前に開発し、SICMプローブの横解像度が、この細胞表面の断面によって決定されることを示した。これは、直径が〜5 nm12、33のヘアセルチップリンクをイメージングする場合に特に重要です。一見すると、内径が小さいピペットは、HPICMイメージングの解像度が向上します。これは、比較的大きいピペット(>50 nm)に当てはまります。しかし、ナノピペットの内径を〜50nm以下に減らすと、ピペットノイズが比例して大きく増加し、したがって、ステレオシリアバンドルのイメージングに不可欠な低い設定点での分解能の損失が生じます。今日の時点で、私たちはこの問題を解決する方法を知らないし、我々は適切な解決策を見つけることに取り組んでいます。
要約すると、HPICMを有する生きた哺乳類聴覚毛細胞における立体束の可視化のための詳細なプロトコルを提示する。HPICMの最大の利点は、i)それらに触れることなく、生きている細胞の表面でラベルフリーのナノスケール構造を視覚化する能力です。ii)は、パッチクランプ記録および/または機械的または化学的刺激の局所的なナノスケールの配信でこれらの構造の機能をプローブする。私たちの知る限りでは、これらの利点はHPICMに固有です。もちろん、いくつかの欠点があります。まず、画像化する構造の高さの制限のために、HPICMは哺乳類アンプラー中の前庭の毛細胞の立体束のような非常に高い構造を撮像するのに適していないかもしれない。第二に、HPICMは、まだ開発中であり、画像処理の速度と解像度のさらなる改善が必要です。しかし、HPICMの物理的原理と私たち自身の経験は、それが可能であることを示唆しています。HPICMは、立体表面における個々のタンパク質複合体の機能に関するユニークなデータを提供すると考えています。
開示事項
著者には競合する利害関係はない。
謝辞
プロジェクトの全段階で、長期にわたる支援と助言を得て、コルチェフ氏(英国・インペリアル・カレッジ)に感謝します。また、パヴェル・ノバク博士とアンドリュー・シェフチュク博士(英国インペリアル・カレッジ)、オレグ・ベロフ(ロシア国立聴覚研究センター)のソフトウェア開発に対する支援に感謝します。この研究は、NIDCD/NIH(R01 DC008861およびR01 DC014658からG.I.F.まで)によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| Analog oscilloscope | B&K Precision | 2160C | Analog oscilloscope for real-time monitoring of nanopipette current and Z-axis approach |
| AFM calibration standards | TED PELLA Inc | HS-100MG; HS-20MG | These 100 and 20 nm calibration standards are used to test the performance of HPICM system |
| Benchtop vibration Isolator | AMETEK/TMC | Everstill K-400 | Active vibration isolation |
| Borosilicate glass capillaries | World Precision Instruments (WPI) | 1B100F-4 | Borosilicate glass capillaries for the nanopipettes |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | To be added to the bath solution to adjust osmolarity |
| Digitizer | National Instruments Corporation | PCI-6221 | Multi-channel input/output digitizer |
| Fast analog Proportional-Integral-Derivative (PID) control for Z movement | Standford Research Systems | SIM900, SIM960, SIM980 | Instrumentation modules integrated in an external PID controller for Z movement. It requires a fast response that is usually not implemented in commercial piezo amplifiers. |
| Faraday cage | AMETEK/TMC | Type II | Required to shield electromagnetic interference |
| Glass bottom dish | World Precision Instruments (WPI) | FD5040-100 | Used as the dish for the chamber for the tissue |
| Hanks' Balanced Salt Solution (HBSS) | Gibco, Thermo Fisher Scientific | 14025092 | Extracellular (bath) solution |
| Instrumentation amplifier | Brownlee Precision | Model 440 | Instrumentation amplifier provides required offsets, filtering, and secondary magnification or attenuation |
| Laser-based micropipette puller | Sutter Instrument | P-2000/G | Micropipette puller to fabricate the nanopipettes. Laser is needed for sharp quartz pipettes. |
| Lebovitz's L-15, without phenol red | Gibco, Thermo Fisher Scientific | 21083027 | Extracellular (bath) solution |
| Micromanipulator | Scientifica | PatchStar | Used for "course" positioning of the Z piezo actuator |
| Microscope | Nikon | Eclipse TS100 | Inverted optical microscope |
| Patch amplifier | Molecular Devices | Axopatch 200B | The patch clamp amplifier measures the current through the nanopipette |
| Piezo amplifier (XY axes) | Physik Instrumente (PI) | E-500.00, E-505.00, E-509.C2A | Amplification and PID control for XY piezo translation stage |
| Piezo amplifier (Z axis) | Piezosystem jena | ENT 400 & 800 | Custom amplifier consisting of ENT 400 power supply and two ENT 800 amplifiers in parallel to achieve max current of 1.6 nA |
| Plastic Coverslips | TED PELLA Inc | 26028 | Used in the fabrication of the chambers for the tissue |
| SICM controller & software* | Ionscope, UK (ionscope.com) | N/A | Custom controller based on SBC6711 digital signal processing board from Innovative Integration Ltd |
| Silicone elastomer (Sylgard) | World Precision Instruments (WPI) | SYLG184 | Used to attach the flexible glass fibers to the chamber for the tissue |
| Silicon glue | The Dow Chemical Company | 734 | Used to glue the different parts of the chamber for the tissue |
| Tungsten rod | A-M Systems | 717500 | Used for holding the dental floss strands in the chamber for the tissue |
| XY piezo nanopositioner | Physik Instrumente (PI) | P-733.2DD | XY translation stage with capacitive sensors |
| Z piezo nanopositioner | Piezosystem jena | RA 12/24 SG | Ring piezoactuator with a strain gage sensor |
| *Ionscope does not sell separate SICM controllers anymore. There are few other commercial systems: NX12-Bio and NX10 SICM, | |||
| Park Systems, Korea and SICM modules from ICAPPIC Limited, UK (icappic.com). All these systems are based on the original | |||
| HPICM principles. However, imaging stereocilia bundles in the hair cells requires several custom modifications that are technically | |||
| challenging (or even impossible) in the closed “ready-to-go” systems such as Ionscope or NX12-Bio/NX10. Currently, there is only one | |||
| modular system (ICAPPIC) that has the flexibility to suit any SICM/HPICM experiment but requires some component integration. |
参考文献
- Beurg, M., Fettiplace, R., Nam, J. H., Ricci, A. J. Localization of inner hair cell mechanotransducer channels using high-speed calcium imaging. Nature Neuroscience. 12 (5), 553-558 (2009).
- Effertz, T., Becker, L., Peng, A. W., Ricci, A. J. Phosphoinositol-4,5-bisphosphate regulates auditory hair-cell mechanotransduction-channel pore properties and fast adaptation. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 37 (48), 11632-11646 (2017).
- Peng, A. W., Gnanasambandam, R., Sachs, F., Ricci, A. J. Adaptation independent modulation of auditory hair cell mechanotransduction channel open probability implicates a role for the lipid bilayer. The Journal of Neuroscience the Official Journal of the Society for Neuroscience. 36 (10), 2945-2956 (2016).
- Engström, H., Engström, B. Structure of the hairs on cochlear sensory cells. Hearing research. 1 (1), 49-66 (1978).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Wäldchen, S., Lehmann, J., Klein, T., van de Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348(2015).
- Pickles, J. O., Comis, S. D., Osborne, M. P. Cross-links between stereocilia in the guinea pig organ of Corti, and their possible relation to sensory transduction. Hearing Research. 15 (2), 103-112 (1984).
- Furness, D. N., Hackney, C. M. Cross-links between stereocilia in the guinea pig cochlea. Hearing Research. 18 (2), 177-188 (1985).
- Jacobs, R. A., Hudspeth, A. J. Ultrastructural correlates of mechanoelectrical transduction in hair cells of the bullfrog’s internal ear. Cold Spring Harbor Symposia on Quantitative Biology. 55, 547-561 (1990).
- Goodyear, R. J., Marcotti, W., Kros, C. J., Richardson, G. P. Development and properties of stereociliary link types in hair cells of the mouse cochlea. The Journal of Comparative Neurology. 485 (1), 75-85 (2005).
- Kachar, B., Parakkal, M., Kurc, M., Zhao, Y., Gillespie, P. G. High-resolution structure of hair-cell tip links. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13336-13341 (2000).
- Vélez-Ortega, A. C., Freeman, M. J., Indzhykulian, A. A., Grossheim, J. M., Frolenkov, G. I. Mechanotransduction current is essential for stability of the transducing stereocilia in mammalian auditory hair cells. eLife. 6, 1-22 (2017).
- Ivanchenko, M. V., et al. Serial scanning electron microscopy of anti-PKHD1L1 immuno-gold labeled mouse hair cell stereocilia bundles. Scientific Data. 7 (1), 182(2020).
- Hadi, S., Alexander, A. J., Vélez-Ortega, A. C., Frolenkov, G. I. Myosin-XVa controls both staircase architecture and diameter gradation of stereocilia rows in the auditory hair cell bundles. Journal of the Association for Research in Otolaryngology JARO. 21 (2), 121-135 (2020).
- Metlagel, Z., et al. Electron cryo-tomography of vestibular hair-cell stereocilia. Journal of Structural Biology. 206 (2), 149-155 (2019).
- Langer, M. G., et al. Mechanical stimulation of individual stereocilia of living cochlear hair cells by atomic force microscopy. Ultramicroscopy. 82 (1-4), 269-278 (2000).
- Dufrêne, Y. F. Towards nanomicrobiology using atomic force microscopy. Nature Reviews Microbiology. 6 (9), 674-680 (2008).
- Putman, C. A., van der Werf, K. O., de Grooth, B. G., van Hulst, N. F., Greve, J. Viscoelasticity of living cells allows high resolution imaging by tapping mode atomic force microscopy. Biophysical journal. 67 (4), 1749-1753 (1994).
- Gavara, N., Chadwick, R. S. Noncontact microrheology at acoustic frequencies using frequency-modulated atomic force microscopy. Nature Methods. 7 (8), 650-654 (2010).
- Cartagena-Rivera, A. X., Van Itallie, C. M., Anderson, J. M., Chadwick, R. S. Apical surface supracellular mechanical properties in polarized epithelium using noninvasive acoustic force spectroscopy. Nature Communications. 8 (1), 1030(2017).
- Katsuno, T., et al. TRIOBP-5 sculpts stereocilia rootlets and stiffens supporting cells enabling hearing. JCI Insight. 4 (12), (2019).
- Hansma, P. K., Drake, B., Marti, O., Gould, S. A., Prater, C. B. The scanning ion-conductance microscope. Science. 243 (4891), 641-643 (1989).
- Korchev, Y. E., et al. Specialized scanning ion-conductance microscope for imaging of living cells. Journal of Microscopy. 188 (Pt 1), 17-23 (1997).
- Shevchuk, A. I., et al. Imaging proteins in membranes of living cells by high-resolution scanning ion conductance microscopy. Angewandte Chemie (International ed in English. 45 (14), 2212-2216 (2006).
- Novak, P., et al. Nanoscale live-cell imaging using hopping probe ion conductance microscopy. Nature Methods. 6 (4), 279-281 (2009).
- Vélez-Ortega, A. C., Frolenkov, G. I. Visualization of live cochlear stereocilia at a nanoscale resolution using hopping probe ion conductance microscopy. Methods in Molecular Biology. 1427, 203-221 (2016).
- Gu, Y., et al. High-resolution scanning patch-clamp: new insights into cell function. FASEB Journal Official Publication of the Federation of American Societies for Experimental Biology. 16 (7), 748-750 (2002).
- Frolenkov, G. I., et al. Single-channel recordings from the apical surface of outer hair cells with a scanning ion conductance probe. Association for Research in Otolaryngology. Abs. 444, (2004).
- Sánchez, D., et al. Noncontact measurement of the local mechanical properties of living cells using pressure applied via a pipette. Biophysical Journal. 95 (6), 3017-3027 (2008).
- Korchev, Y. E., Negulyaev, Y. A., Edwards, C. R., Vodyanoy, I., Lab, M. J. Functional localization of single active ion channels on the surface of a living cell. Nature Cell Biology. 2 (9), 616-619 (2000).
- Shevchuk, A., et al. Angular approach scanning ion conductance microscopy. Biophysical Journal. 110 (10), 2252-2265 (2016).
- Furness, D. N., Katori, Y., Nirmal Kumar, B., Hackney, C. M. The dimensions and structural attachments of tip links in mammalian cochlear hair cells and the effects of exposure to different levels of extracellular calcium. Neuroscience. 154 (1), 10-21 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved