Method Article
Caracterização citométrica de fluxo do desenvolvimento de células B murinas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Descrevemos aqui uma simples análise da heterogeneidade do compartimento de células B imunes da murina nos tecidos peritônio, baço e medula óssea por citometria de fluxo. O protocolo pode ser adaptado e estendido a outros tecidos do mouse.
Resumo
Estudos extensivos caracterizaram o desenvolvimento e diferenciação de células murinas B em órgãos linfoides secundários. Anticorpos secretados por células B foram isolados e desenvolvidos em terapêutica bem estabelecida. A validação do desenvolvimento de células murinas B, no contexto de camundongos propensos a autoimunes, ou em camundongos com sistemas imunológicos modificados, é um componente crucial para desenvolver ou testar agentes terapêuticos em camundongos e é um uso apropriado da citometria de fluxo. Parâmetros citométricos de fluxo celular B bem estabelecidos podem ser usados para avaliar o desenvolvimento de células B no peritônio murina, medula óssea e baço, mas uma série de melhores práticas devem ser aderidas. Além disso, a análise citométrica de fluxo dos compartimentos de células B também deve complementar leituras adicionais do desenvolvimento de células B. Os dados gerados usando essa técnica podem promover nossa compreensão de modelos de camundongos propensos a doenças, autoimunes, bem como camundongos humanizados que podem ser usados para gerar anticorpos ou moléculas semelhantes a anticorpos como terapêuticas.
Introdução
Os anticorpos monoclonais têm se tornado cada vez mais a terapia de escolha para muitas doenças humanas à medida que se tornam parte da medicina convencional1,2. Descrevemos anteriormente camundongos geneticamente modificados que produzem anticorpos de forma eficiente abrigando regiões variáveis totalmente humanas com constantes de IgH de camundongos3,4. Mais recentemente, descrevemos camundongos geneticamente modificados que produzem moléculas semelhantes a anticorpos que têm antígeno-vinculativos distintos5. Anticorpos são secretados por células B e formam a base da imunidade humorativa adaptativa. Existem dois tipos distintos de células B, B-1 e B-2. Em mamíferos, as células B-1 originam-se no fígado fetal e são enriquecidas em tecidos mucosas e nas cavidades pleural e peritoneal após o nascimento, enquanto as células B-2 se originam no fígado fetal antes do nascimento e posteriormente na medula óssea (MMO). As células B-2 são enriquecidas em órgãos linfoides secundários, incluindo o baço e o sangue 6,7,8. No BM, progenitores hematopoiéticos B-2 começam a se diferenciar para células pró-B após o início do rearranjo da cadeia pesada Ig mu9,10. O rearranjo bem sucedido da cadeia pesada de Ig e sua montagem no receptor de células pré-B (pré-BCR), juntamente com sinalização e expansão proliferativa, leva à diferenciação das células pré-B. Depois que as células pré-B reorganizam suas cadeias leves Ig kappa (Igκ), ou se improdutivas, Ig lambda (Igλ), elas combinam com μ corrente pesada, resultando na expressão IgM BCR superficial. É importante ressaltar que a expressão superficial IgM é conhecida por ser reduzida em condições de autoreatividade, contribuindo assim para a auto tolerância em células B funcionalmente não respondidas ou argicasas11,12. As células B imaturas então entram em um estágio de transição, onde começam a co-expressar IgD e migram do BM para o baço. No baço, a expressão igD aumenta ainda mais e as células amadurecem em um segundo estágio de células B transitórias, seguidas pela conclusão de seu status de maturação e desenvolvimento em células de zona marginal (MZ) ou folicular (Fol)13,14,15. Em camundongos adultos, em um ambiente não doente, o número de células B maduras permanece constante, apesar de 10-20 milhões de células B imaturas serem geradas diariamente no BM. Destes, apenas 3% entram no pool de células B maduras. O tamanho do compartimento celular B periférico é limitado pela morte celular, devido em parte a vários fatores, incluindo auto-reatividade e maturação incompleta16,17,18. A análise citométrica de fluxo tem sido amplamente usada para caracterizar e enumerar muitos subcompartimentais de células imunes em humanos e camundongos. Embora existam algumas semelhanças entre compartimentos de células B humanas e murinas, este protocolo se aplica apenas à análise de células murinas B. Este protocolo foi desenvolvido com o propósito de fenotipar camundongos geneticamente modificados, para determinar se a manipulação genética alteraria o desenvolvimento de células B. A citometria de fluxo também tem sido extremamente popular em muitas aplicações adicionais, incluindo na medição da ativação celular, função, proliferação, análise de ciclo, análise de conteúdo de DNA, apoptose e classificação celular 19,20.
A citometria de fluxo é a ferramenta escolhida para caracterizar vários compartimentos de linfócitos em camundongos e humanos, inclusive em órgãos complexos como o baço, BM e sangue. Devido a reagentes de anticorpos específicos do rato amplamente disponíveis para citometria de fluxo, esta técnica pode ser usada para investigar não apenas proteínas da superfície celular, mas também fosfoproteínas intracelulares e citocinas, bem como leituras funcionais21. Aqui demonstramos como reagentes de citometria de fluxo podem ser usados para identificar subconjuntos de células B à medida que amadurecem e diferenciam em órgãos linfoides secundários. Após a otimização das condições de coloração, manuseio de amostras, configuração correta do instrumento e aquisição de dados e, finalmente, análise de dados, um protocolo para análise citométrica de fluxo abrangente do compartimento celular B em camundongos pode ser utilizado. Tal análise abrangente baseia-se em uma nomenclatura de décadas concebida por Hardy e colegas, onde o desenvolvimento de células BM B-2 pode ser dividido em diferentes frações (Fração) dependendo de sua expressão de B220, CD43, BP-1, CD24, IgM e IgD22. Hardy et al., mostraram que as células B220+ CD43 BM B podem ser subdivididas em quatro subconjuntos (Fração A-C') com base na expressão BP-1 e CD24 (30F1), enquanto as células B220+ CD43-(dim to neg) BM B podem ser resolvidas em três subconjuntos (Fração D-F) com base na expressão diferencial de IgD e IgM23 de superfície. A fração A (células pré-pró-B) são definidas como BP-1- CD24 (30F1)-, A fração B (células pro-B precoces) são definidas como BP-1- CD24 (30F1)+, Fração C (células pro-B tardias) são definidas como BP-1+ CD24 (30F1)+, e Fração C' (células pré-B precoces) são definidas como BP-1+ e CD24nenta. Além disso, as células Fração D (pré-B) são definidas como células B220+ CD43-IgM-B e Fração E (células B recém-geradas, combinação de imaturo e transitório) são definidas como células B220+ CD43- IgM+ B e Fraction F (células B maduras e recircuturas) são definidas como células B220high CD43- IgM+ B. Em contraste, a maioria das células B ingênuas encontradas no baço pode ser dividida em células B maduras (B220+ CD93-) e células transitórias (T1, T2, T3) dependendo da expressão de CÉLULAS CD93, CD23 e IgM. Células B maduras podem ser resolvidas em subconjuntos marginais e foliculares baseados na expressão de IgM e CD21/CD35, e subconjuntos foliculares podem ser ainda divididos em subconjuntos de células foliculares maduras tipo I e folicular tipo II B, dependendo do nível de sua expressão de superfície IgM e IgD24. Essas populações de células B esplênicas expressam predominantemente cadeia de luz Igκ. Finalmente, as populações de células B-1 B, que se originam no fígado fetal e são encontradas principalmente nas cavidades peritoneal e pleural de camundongos adultos, foram descritas na literatura. Estas células B peritoneal podem ser distinguidas das células B-2 B descritas anteriormente pela falta de expressão CD23. Eles são então subdivididos em populações B-1a ou B-1b, com o primeiro definido pela presença de CD5 e o segundo por sua ausência25. Progenitores de células B-1 são abundantes no fígado fetal, mas não são encontrados em BM adulto. Enquanto as células B-1a e B-1b são originárias de diferentes progenitores, ambas semearam as cavidades peritoneal e pleural24. Em contraste com as células B-2, as células B-1 são exclusivamente capazes de auto-renovação e são responsáveis pela produção de anticorpos IgM naturais.
Defeitos no desenvolvimento celular B podem surgir em muitos casos, incluindo deficiências nos componentes do BCR26,27, perturbações de moléculas de sinalização que impactam a força de sinalização BCR14,28,29, ou interrupção de citocinas que modulam a sobrevivência celular B30,31 . A análise da citometria de fluxo dos compartimentos linfoides contribuiu para a caracterização dos blocos de desenvolvimento de células B nesses camundongos e muitos outros. Uma vantagem da análise citométrica de fluxo dos compartimentos linfoides é que ele oferece a capacidade de fazer medições em células individuais obtidas a partir de tecido dissociado vivo. A disponibilidade de reagentes em uma gama cada vez maior de fluoroforos permite a análise simultânea de múltiplos parâmetros e permite a avaliação da heterogeneidade celular B. Além disso, a enumeração das células B por análise citométrica de fluxo complementa outros ensaios imunológicos, como métodos imunohistoquímicos que visualizam a localização celular dentro de órgãos linfoides, detecção de níveis de anticorpos circulantes como medida de imunidade humoral, bem como duas microscopia fótons para medir as respostas das células B no espaço real e no tempo32.
Protocolo
Todos os estudos sobre camundongos foram supervisionados e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Regeneron. O experimento foi realizado em tecidos de três camundongos C57BL/6J femininos (17 semanas de idade) dos Laboratórios Jackson. Titular todos os anticorpos antes de iniciar o experimento para determinar a concentração ideal. Ao usar contas de compensação para compensação de cor única, certifique-se de que elas colorem tão brilhantes ou brilhantes do que suas amostras. Mantenha todos os buffers, anticorpos e células no gelo ou a 4 °C. Após a adição de corante de viabilidade, realize todas as etapas e incubações a 4°C em luz baixa ou no escuro.
1. Colheita de células peritoneais e isolamento celular único
- Eutanize o mouse usando CO2 ou de acordo com o protocolo aprovado.
- Coloque o rato nas costas, pulverize com 70% de etanol, e corte a pele abdominal externa com uma tesoura, tomando cuidado para não cortar o peritônio.
- Injete 3 mL de tampão de lavagem gelada (0,5% de albumina de soro bovino (BSA) em DPBS [vol/vol]) na cavidade peritoneal com uma seringa de 3 mL equipada com uma agulha de calibre 25.
- Massageie suavemente o peritônio com as pontas dos dedos.
- Repita as etapas 1.3 e 1.4.
- Insira uma seringa de 3 mL equipada com uma agulha de 18 G através do peritônio, tomando cuidado para evitar órgãos e gordura.
- Extrair o tampão de lavagem, agora contendo células peritoneais, e transferir para tubo cônico de 15 mL no gelo.
- Repita as etapas 1.3 e 1.4.
- Faça um pequeno buraco no peritônio enquanto segura com pinças.
- Insira uma pipeta de transferência descartável no orifício e colete o tampão de lavagem restante, mais uma vez evitando gordura e órgãos.
- Transfira as células peritoneais remanescentes coletadas para o tubo cônico de 15 mL no gelo.
NOTA: Descarte a amostra se a contaminação sanguínea for evidente. - Incubar as células no gelo até que o baço e a extração óssea estejam completos.
- Centrifugar as células a 300 x g por 8 min a 4 °C. Aspire o supernatante.
- Resuspense a pelota da célula em 1 mL de tampão de lavagem.
- Filtre as células através de um coador de células de 70 μM em um tubo cônico limpo de 15 mL no gelo.
- Determine a concentração celular usando um instrumento de contador celular ou hemócito.
2. Colheita de baço e isolamento de célula única
- Coloque o rato em sua barriga e corte o peritônio na parte traseira esquerda usando uma tesoura limpa. Corte o baço, removendo gordura e tecido conjuntivo.
- Transfira o baço para um tubo de microcentrifusagem de 1,5 mL contendo 1 mL de tampão de lavagem no gelo.
- Incubar o baço no gelo até que a extração óssea esteja completa.
- Mova o baço para o tubo de dissociação automatizado com 5 mL de tampão de lise de glóbulos vermelhos. Coloque o tubo no instrumento dissociador do tecido e dissociar por 60 s para criar uma única suspensão celular.
NOTA: Também é permitido usar outros métodos de rotina para obter suspensões de baço de célula única, como quebrar entre lâminas de vidro fosco no tampão de lavagem. Se for utilizado outro método de dissociação, siga a dissociação com centrifugação, aspiração e, em seguida, resuspensão em 5 mL de tampão de lise de glóbulos vermelhos antes de continuar a etapa 2.5. - Incubar as células à temperatura ambiente por 3 minutos.
- Adicione 10 mL de tampão de lavagem de 4 °C contendo 2mM EDTA.
- Transfira para um tubo cônico limpo de 15 mL.
- Centrifugar as células a 300 x g por 8 min a 4 °C. Aspire o supernatante.
- Resuspenda a pelota da célula em 5 mL de tampão de lavagem de 4 °C.
- Filtre as células através de um coador de células de 70 μM em um tubo cônico limpo de 15 mL no gelo.
- Determine a concentração celular usando um instrumento de contador celular ou hemócito.
3. Colheita de BM e isolamento de célula única
- Remova a pele da metade inferior do corpo do rato. Corte o excesso de músculo da perna. Retire toda a perna com uma tesoura, tomando cuidado para não cortar o fêmur. Limpe o fêmur e a tíbia removendo o músculo, gordura e pés restantes.
- Transfira os ossos para um tubo de microcentrifuuge de 1,5 mL contendo 1 mL de tampão de lavagem no gelo.
- Perfure o fundo de um tubo de microcentrifuuge de 0,5 mL, deixando um orifício pequeno o suficiente para os ossos das pernas não se projetarem. Insira o tubo de 0,5 mL em um tubo de microcentrifusagem de 1,5 mL limpo. Corte a extremidade do fêmur e da tíbia proximal até o joelho e coloque as extremidades de corte voltadas para baixo no tubo de 0,5 mL.
- Centrifugar as células a 6.780 x g por 2 min a 4 °C.
- Resuspenha a pelota celular em 1 mL de tampão de lise de glóbulos vermelhos e transfira para um tubo cônico de 15 mL contendo um adicional de 3 mL de tampão de lise de glóbulos vermelhos.
- Incubar em temperatura ambiente por 3 minutos.
- Adicione 10 mL de tampão de lavagem de 4 °C contendo 2mM EDTA.
- Centrifugar as células a 300 x g por 8 min a 4 °C. Aspire o supernatante.
- Resuspenda a pelota da célula em 3 mL de tampão de lavagem de 4 °C.
- Filtrar células através de um coador de células de 70 μM em um tubo cônico limpo de 15 mL no gelo.
- Determine a concentração celular usando um instrumento de contador celular ou hemócito.
4. Colori manchas de células e prepare compensação
- Alíquota 106 células de cada tipo de célula de cada animal para uma placa inferior 96 bem U.
- Certifique-se de incluir poços suficientes para todas as amostras e controles, incluindo mancha completa, fluorescência-menos-um (FMO), não manchada, e finalmente a compensação opcional de cor única para cada fluoróforo usado.
- Para o painel de maturação BM e o painel de maturação do baço, as células de alíquota em 2 poços, 106 células por poço, para cada amostra completa de manchas. Para os controles de viabilidade de compensação de uma cor única, adicione 2 x 106 células de cada tipo de célula a poços individuais.
- Centrifugar a placa a 845 x g por 2 min a 4 °C. Decante o supernatante invertendo rapidamente e sacudindo a placa sobre uma pia, tomando cuidado para não contaminar cruzmente os poços.
- Resuspensar as células em 200 μL de DPBS (sem BSA ou FBS). Este passo é importante para remover a proteína antes de colorir com corante de viabilidade amina-reativa.
- Repita as etapas 4.2 e 4.3.
- Repita o passo 4.2.
- Resuspend as células em 100 μL de diluição de corante de viabilidade diluído 1:1.000 em DPBS.
NOTA: Se usar células para compensação de cor única, não adicione corante de viabilidade a esses poços.- Para cada conjunto de manchas, deixe vários poços não manchados para uma amostra completamente inconteídia e quaisquer outros controles que você possa precisar.
- Para cada conjunto de manchas, deixe um poço adicional não manchado para o controle FMO de viabilidade.
- Para os controles de compensação de viabilidade de cor única: Resuspend as células 2 x 106 , aliquos na etapa 4.1, em 200 μL de corante diluído de viabilidade. Transfira 100 μL de células para um tubo de microcentrifuuge de 1,5 mL, células de calor por 5 min a 65 °C e transfira os 100 μL de células mortas pelo calor de volta ao poço original com as células vivas restantes de 100 μL.
- Incubar células a 4 °C, protegidas da luz, por 30 minutos.
- Centrifugar a placa a 845 x g por 2 min a 4 °C. Decante o supernatante invertendo rapidamente e sacudindo a placa sobre uma pia, tomando cuidado para não contaminar cruzmente os poços.
- Resuspensar as células em 200 μL de DPBS (sem BSA ou FBS).
- Repita as etapas 4.8 e 4.9.
- Repita o passo 4.8.
- Resuspense as células em 50 μL de bloco Fc diluído 1:50 (concentração final=10 μg/mL) no tampão de manchas (0,5% BSA em DPBS [vol/vol]).
- Para células peritoneais - adicione também 5 μL de bloqueador de monócitos para reduzir a coloração não específica.
- Incubar as células a 4 °C, protegidas da luz, por 15 minutos.
- Prepare misturas completas de mestre de manchas e FMOs no tampão de manchas para um volume final de 100 μl por 106 células. Consulte a Tabela 1-Tabela 4 para as listas de anticorpos.
NOTA: Os FMOs são feitos por incluir todos os anticorpos em um conjunto de manchas, exceto um. Prepare um FMO para cada anticorpo em um conjunto de manchas. Quando um conjunto de manchas contém vários corantes brilhantes, substitua 50 μL de tampão de manchas brilhante para tampão de manchas por amostra - Sem remover o bloco Fc, adicione 100 μL de misturas de manchas completas e FMOs aos poços selecionados.
- Prepare controles de compensação de cores únicas para cada anticorpo em um conjunto de manchas.
- Se usar contas de compensação siga as instruções do fabricante para uso.
- Se usar células, adicione anticorpos titutados a 106 células, reservada anteriormente na etapa 4.6.1 sem corante de viabilidade, em tampão de manchas de 100 μL. Se todas as células da amostra forem positivas para um marcador específico, reserve células não manchadas para serem usadas ao adquirir dados de compensação no citómetro de fluxo.
- Incubar as células e as contas a 4 °C, protegidas da luz, por 30 minutos.
- Centrifugar a placa a 845 x g por 2 min a 4 °C. Decante o supernatante invertendo rapidamente e sacudindo a placa sobre uma pia, tomando cuidado para não contaminar cruzmente os poços.
- Resuspense as células e contas em 200 μL de tampão de manchas.
- Repita as etapas 4.18 e 4.19 duas vezes.
- Repita o passo 4.18.
- Para fixar as amostras para análise dentro de 48 h, resuspend células e contas em 200 μL de 2% paraformaldeído em DPBS.
ATENÇÃO: O parafomaldeído é um sério risco à saúde e inflamável. Consulte a Folha de Dados Safty antes de usar. - Incubar as células e as contas a 4 °C, protegidas da luz, por 30 minutos.
- Repita as etapas 4.18 e 4.19 duas vezes.
- Coloque uma placa de filtro sobre uma placa de fundo U limpa de 96 poços. Usando uma multi-pipeta, transfira cada amostra para um poço da placa do filtro.
- Centrifugar a placa do filtro-96 bem configuração de placa de fundo U a 845 x g para 2 min a 4 °C. Remova a placa do filtro e decante o supernatante invertendo rapidamente e movendo a placa sobre uma pia, tomando cuidado para não contaminar os poços.
- Para os painéis de maturação de BM e baço, resuspenja as células totalmente manchadas em 100 μL de tampão de manchas. Misture os 2 poços para cada animal em 1 bem. Resuspenque os painéis restantes, FMOs e controles em 200 μL de tampão de manchas.
- Incubar células fixas e contas a 4 °C, protegidas da luz, durante a noite.
5. Aquisição de dados citométricos de fluxo
- Inicialize e QC o citômetro de fluxo de acordo com as instruções do fabricante.
- Carregue o modelo específico para cada painel.
- Antes de registrar dados, certifique-se de que todos os eventos para cada amostra estejam em escala e visíveis nas parcelas de pontos.
- Controle de compensação recorde para cada painel de manchas utilizando compensações de manchas únicas preparadas na etapa 4.16. Estabeleça portões positivos e negativos para cada amostra. Que o software calcule a matriz de compensação.
- Comece a adquirir a primeira amostra e certifique-se de que os portões sejam definidos adequadamente.
- Defina a máquina para gravar pelo menos 50.000 eventos de células B para o painel de células B peritoneal e o painel de baço Igκ e Igλ; Eventos de células B de 150.000 para o painel de maturação BM; e 300.000 eventos de células B para o painel de maturação do baço.
- Para cada painel de manchas, execute e regise as amostras totalmente manchadas para cada animal, uma amostra não manchada e as FMOs.
6. Analisar dados
- Prossiga com a análise de dados usando o software de análise de citometria de fluxo. Siga as estratégias de gating descritas na Figura 1, Figura 2, Figura 3,Figura 4.
Resultados
Aqui apresentamos a estratégia de gating para caracterizar o desenvolvimento de células B no peritônio do rato, BM e baço. A base da análise é formada em torno do conceito de coloração com corante viável, em seguida, gating out doublets com base nas características de Forward-Scatter-Area (FSC-A) e Forward-Scatter-Height (FSC-H), e finalmente gating out detritos selecionando células de acordo com suas características FSC-A e Side-Scatter-Area (SSC-A), referidos aqui como o portão de tamanho, que são reflexo do tamanho relativo da célula e da granularidade celular, antes de gating sobre a população de interesse.
A análise citométrica de fluxo das células B peritoneal mostra as frequências de células peritoneal viáveis, células B totais, subconjuntos B-1 e B-2, bem como células B-1a e B-1b em camundongos C57BL/6J (Figura 1), utilizando um painel de coloração delineado na Tabela 1. O número médio de células absolutas dessas frequências é mostrado na Tabela 5. Perturbações em células B-1 podem ser delineadas pela distribuição de subconjuntos celulares, seja por frequência celular ou número absoluto de células por rato.
A análise citométrica de fluxo das células BM mostra as frequências de células BM viáveis, células B totais, Fração A (células pré-pró-B e linfócitos contaminantes), células pré-pró-B, Fração B, Fração C, Fração C', Fração D, imaturo (subconjunto na Fração E), transitório (subconjunto na Fração E) e Fração F B em camundongos C57BL/6J (Figura 2), utilizando um painel de coloração delineado na Tabela 2. O número médio de células absolutas dessas frequências é mostrado na Tabela 6. Perturbações em células BM B podem ser delineadas pela distribuição de subconjuntos celulares, seja por frequência celular ou número absoluto de células por perna(s).
A análise citométrica de fluxo de células B esplênicas mostra as frequências de células de baço viáveis, células B totais, células B transitórias, células T1, T2, T3, células B maduras, células I foliculares (Fol I), células foliculares II (Fol II), células precursoras da zona marginal (MZ), células MZ maduras e células B-1 em camundongos C57BL/6J (Figura 3), usando um painel de coloração delineado na Tabela 3. O número médio de células absolutas dessas frequências é mostrado na Tabela 7. Perturbações em células B esplênicas podem ser delineadas pela distribuição de subconjuntos celulares, seja por frequência celular ou número absoluto de células por baço.
Da mesma forma, a análise citométrica de fluxo do baço mostra as frequências das células Igκ+ e Igλ+ B em camundongos C57BL/6J (Figura 4), utilizando um painel de coloração delineado na Tabela 4. O número médio de células absolutas dessas frequências é mostrado na Tabela 8. Perturbações em Bcells Igκ+ e Igλ+ podem ser delineadas pela distribuição de subconjuntos celulares, seja por frequência celular ou número absoluto de células por baço.
| Anticorpo | Fluoróforo | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Grão-mestre | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | FITC | S7 |
| CD23 | BUV395 | B3B4 |
| CD11b | BV711 | M1/70 |
| CD5 | BV605 | 53-7.3 |
Tabela 1: Painel de células B peritoneal
| Anticorpo | Fluoróforo | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Grão-mestre | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | FITC | 1B11 |
| CD24 (HSA) | PE | 30-F1 |
| Kit-C | BUV395 | 2B8 |
| BP-1 | BV786 | BP-1 |
| CD93 | BV711 | AA4.1 |
| canal de despejo | ||
| CD3 | AF700 | 17-A2 |
| CD11b | AF700 | M1/70 |
| GR1 (Ly6C/6G) | AF700 | RB6-8C5 |
| Ter119 | AF700 | TER-119 |
Tabela 2: Painel de Maturação da Medula Óssea
| Anticorpo | Fluoróforo | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Grão-mestre | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | FITC | S7 |
| CD23 | BUV395 | B3B4 |
| CD21/35 | BV421 | 7G6 |
| CD11b | AF700 | M1/70 |
| CD5 | BV605 | 53-7.3 |
| CD93 | PE | AA4.1 |
Tabela 3: Painel de maturação do baço
| Anticorpo | Fluoróforo | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Grão-mestre | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD3 | PB | 17-A2 |
| Cá | FITC | 187.1 |
| Lambda | PE | RML-42 |
Tabela 4: Painel Baço Igκ e Igλ
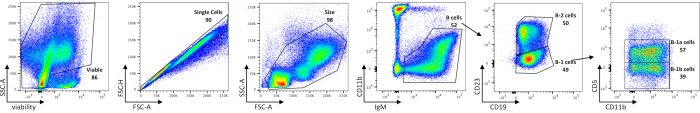
Figura 1: Caracterização de populações de células B no peritônio. Células B viáveis, unicelulares, tamanho fechado são primeiramente separadas de células contaminantes por gating em células IgM+. As células B-1 e B-2 são então distinguidas umas das outras por ausência (B-1) ou presença de CD23 (B-2). A próxima expressão CD5 é usada para delinear células B-1a (CD5+) de células B-1b (CD5-). As FMOs foram usadas para determinar empiricamente onde desenhar portões. Os números são percentuais de cada população dentro da mesma parcela de densidade. Clique aqui para ver uma versão maior desta figura.
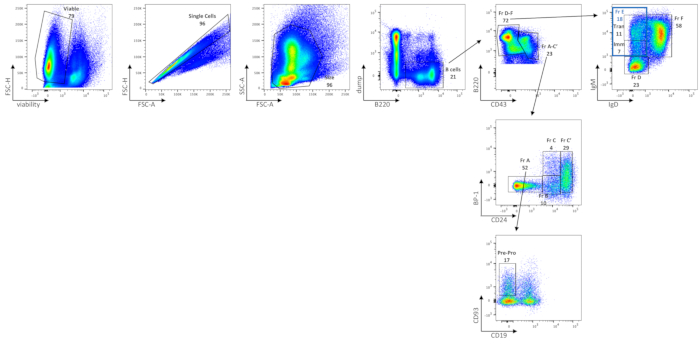
Figura 2: Caracterização de subconjuntos de células B no BM. Células BM B viáveis, únicas, tamanho fechado são separadas de células não-B por gating no despejo B220+ (onde o despejo se refere às células CD3/GR-1/CD11b/TER119). A expressão CD43 e B220 define ainda mais a Hardy Fraction A-C' (CD43+ B220+) e a Hardy Fraction D-F (CD43low/neg B220+/++). A fração A-C' é ainda separada pela expressão de BP-1 e CD24. A fração A (BP-1- CD24-) corresponde a células pré-pró-B, juntamente com células contaminantes. Para separar as células pré-pró-B das células contaminantes na Fração A, utiliza-se a expressão do CD93 e a ausência de CD19. A fração B (BP-1- CD24int) e a Fração C (BP-1+ CD24int) correspondem a células pro-B precoces e tardias, respectivamente, e a Fração C' (BP-1+/- CD24+) corresponde às células pré-B precoces. Para separar a Fração D-F, a expressão de IgM e IgD é utilizada. A fração D corresponde a células pré-B tardias (IgM-/baixo IgD);); Fração E (portão azul, IgMint/IgD-alto) para células B imaturas (Imm, IgMint IgD-) e transitórias (Tran, IgMhigh IgD-) B; e Fração F (IgMint/IgD+) para recircular células B maduras. As FMOs foram usadas para determinar empiricamente onde desenhar portões. Os números são percentuais de cada população dentro da mesma parcela de densidade. Clique aqui para ver uma versão maior desta figura.

Figura 3: Caracterização da maturação de células B esplênicas. Células B viáveis, unicelulares, tamanho fechado são separadas de células não-B por gating em células B220+. Para identificar o subconjunto B-1, as células CD23-CD19+ são identificadas e definidas pela expressão de CD43. Para classificar as populações B-2, as células CD19+ são separadas em células B (CD93+ B220+) e maduras (CD93- B220+). As células transitórias (CD93+ B220+) são ainda divididas em populações T1 (IgM+ CD23-), T2 (IgM+ CD23+) e T3 (IgMint CD23+). As células maduras (CD93- B220+) são separadas em células B de zona marginal (CD21/35+ IgM+) e folicular (CD21/35int IgMint/+) células B. A expressão do CD23 é ainda usada para separar células precursoras MZ (CD23+ B220+) de células MZ mais maduras (CD23- B220+). As populações foliculares são então delineadas nas células Fol I (IgD+ IgMint) e Fol II (IgD+ IgM+). As FMOs foram usadas para determinar empiricamente onde desenhar portões. Números são percentuais de cada população dentro do mesmo lote de densidade Clique aqui para ver uma versão maior desta figura.

Figura 4: Expressão Igκ e Igλ de células B esplênicas. Células bplenicas viáveis, únicas, tamanho fechado são separadas de células não-B por gating em células B220+ CD3. As células B são então distinguidas pela expressão de Igλ e Igκ. Os números são percentuais de cada população dentro da mesma parcela de densidade. Clique aqui para ver uma versão maior desta figura.
| Número de células absolutas | |||||
| Número de animais | Células peritoneais viáveis | Células B | Células B-1a | Células B-1b | Células B-2 |
| 1 | 1.02E+07 | 4.67E+06 | 1.28E+06 | 8.95E+05 | 2.35E+06 |
| 2 | 9.92E+06 | 4.52E+06 | 1.49E+06 | 9.60E+05 | 1.91E+06 |
| 3 | 1.15E+07 | 4.56E+06 | 1.71E+06 | 9.19E+05 | 1.78E+06 |
| Média | 1.05E+07 | 4.58E+06 | 1.49E+06 | 9.25E+05 | 2.01E+06 |
Tabela 5: Números absolutos de células absolutas de subconjuntos de células B peritoneal
| Número de células absolutas | |||||||||||
| Número de animais | Células de medula óssea viáveis | Células B | Fração A | Pré-pro | Fração B | Fração C | Fração C' | Fração D | Imaturo | Transicional | Fração F |
| 1 | 5.05E+07 | 9.70E+06 | 1.13E+06 | 1.95E+05 | 2.22E+05 | 9.14E+04 | 6.31E+05 | 1.59E+06 | 4.56E+05 | 7.81E+05 | 4.03E+06 |
| 2 | 5.39E+07 | 1.03E+07 | 1.14E+06 | 2.29E+05 | 2.89E+05 | 1.22E+05 | 8.40E+05 | 2.11E+06 | 5.39E+05 | 8.07E+05 | 3.67E+06 |
| 3 | 5.93E+07 | 1.01E+07 | 1.10E+06 | 2.12E+05 | 2.84E+05 | 1.05E+05 | 9.02E+05 | 2.72E+06 | 5.94E+05 | 7.62E+05 | 2.59E+06 |
| Média | 5.46E+07 | 1.00E+07 | 1.12E+06 | 2.12E+05 | 2.65E+05 | 1.06E+05 | 7.91E+05 | 2.14E+06 | 5.29E+05 | 7.83E+05 | 3.43E+06 |
Tabela 6: Números absolutos de células de subconjuntos de células B de medula óssea
| Número de células absolutas | ||||||||||||
| Número de animais | Células de baço viável | Células B | Células B transitórias | Células T1 | Células T2 | Células T3 | Células B maduras | Células foliculares I | Células foliculares II | Células precursoras da zona marginal | Células de zona marginal maduras | Células B-1 |
| 1 | 9.16E+07 | 4.61E+07 | 3.66E+06 | 1.55E+06 | 1.10E+06 | 7.16E+05 | 4.06E+07 | 2.39E+07 | 5.27E+06 | 2.17E+06 | 3.98E+06 | 8.83E+05 |
| 2 | 9.97E+07 | 5.18E+07 | 4.88E+06 | 1.97E+06 | 1.57E+06 | 1.00E+06 | 4.49E+07 | 2.68E+07 | 7.33E+06 | 3.42E+06 | 3.84E+06 | 8.15E+05 |
| 3 | 1.02E+08 | 5.34E+07 | 4.64E+06 | 1.98E+06 | 1.41E+06 | 8.54E+05 | 4.62E+07 | 2.81E+07 | 5.84E+06 | 3.58E+06 | 4.02E+06 | 1.01E+06 |
| Média | 9.77E+07 | 5.04E+07 | 4.39E+06 | 1.83E+06 | 1.36E+06 | 8.58E+05 | 4.39E+07 | 2.63E+07 | 6.15E+06 | 3.06E+06 | 3.94E+06 | 9.02E+05 |
Tabela 7: Números absolutos de células de subconjuntos de células B esplênicas
| Número de células absolutas | ||||
| Número de animais | Células de baço viáveis | Células B | Células Igκ+ B | Células Igλ+ B |
| 1 | 9.16E+07 | 4.97E+07 | 4.51E+07 | 2.46E+06 |
| 2 | 9.97E+07 | 5.63E+07 | 5.08E+07 | 3.16E+06 |
| 3 | 1.02E+08 | 5.91E+07 | 5.33E+07 | 3.24E+06 |
| Média | 9.77E+07 | 5.50E+07 | 4.97E+07 | 2.95E+06 |
Tabela 8: Números absolutos de células de subconjuntos de células Igκ e Igλ B
Discussão
A análise citométrica do fluxo de tecidos linfoides e não linfoides permitiu a identificação e enumeração simultânea de sub-populações de células B em camundongos e humanos desde a década de 1980. Tem sido usado como uma medida de imunidade humoral e pode ser aplicado ainda mais para avaliar a funcionalidade de células B. Este método aproveita a disponibilidade de reagentes para avaliar diferentes estágios de maturação celular B em camundongos e humanos, por meio da análise simultânea de múltiplos parâmetros que permitem a avaliação da heterogeneidade celular B, mesmo em populações raras. Se usado para medir amostras heterogêneas complexas, pode detectar subsu populações em minutos, em células individuais33. A estratégia de análise de gating sequencial, na maioria das vezes aplicada à análise citométrica de fluxo, pode ser simples e intuitiva quando uma população específica deve ser identificada34. Finalmente, outra vantagem da citometria de fluxo é que ela é facilmente adaptável na maioria dos laboratórios acadêmicos, enquanto sob orientação de usuários experientes. Nosso protocolo descreve com sucesso a avaliação das populações de células B no peritônio, BM e baços de camundongos, descrevendo e enumerando populações B-1 e aprofundando-se no desenvolvimento de células B-2 pró-B, células pré-B, células Imaturas, transitórias e maduras B, bem como sua expressão superficial de cadeias leves Igκ ou Igλ. A citometria de fluxo é o método mais utilizado e fácil de aplicar, ao investigar o desenvolvimento de células B em camundongos.
Embora a citometria de fluxo gere dados inestimáveis, existem alguns limites para essa tecnologia quando usados para investigar a heterogeneidade do compartimento de células B imunes. Conjuntos de dados enormes podem ser esmagadores porque 10 manchas de cor permitem o reconhecimento de mais de 1.024 populações de células diferentes34. Deve-se levar em consideração que alguns marcadores de células linfoides comumente usados provaram ser menos específicos do que se pensava originalmente. Isso pode ser resolvido empregando uma infinidade de marcadores de superfície celular para determinar gating em populações desejadas. Embora a análise citométrica do fluxo possa ser simples e intuitiva, outra restrição para a análise citométrica de fluxo é que ela normalmente permite a visualização de apenas dois parâmetros por vez, embora ferramentas de visualização de dados como o T-SNE possam ser usadas para agrupar populações de células de forma mais eficiente ao usar citometria de fluxo de parâmetros elevados. Outra limitação importante é que os portões utilizados durante a aquisição e análise às vezes dependem da subjetividade do operador.
Para uma adaptação ou replicação bem-sucedida deste protocolo, existem vários parâmetros críticos que devem ser levados em consideração35. Deve-se considerar cuidadosamente o desenho do painel e a seleção fluorocromática. É imperativo emparelhar antígenos escuros ou importantes com fluorocromes brilhantes. A titulação de anticorpos deve ser realizada para evitar o excesso de ligação de anticorpos às células não especificamente, aumentando potencialmente a coloração de fundo e a diminuição da resolução. A titulação de anticorpos é realizada pela coloração de um número conhecido de células com concentrações de anticorpos, para determinar o melhor índice de separação36. Isso deve ser repetido para cada monte de anticorpos. Durante a preparação e coloração da amostra, é importante garantir uma única suspensão celular evitando Ca++ e Mg++. Além disso, a adição de EDTA pode ajudar a prevenir a agregação celular e atividade enzimática que podem levar à etimilação mediada por anticorpos e à internalização de marcadores rotulados. Antes da aquisição de dados, as amostras devem ser devidamente suspensas, filtradas e livres de agregados. O derramamento de sinal de um parâmetro para outro é resolvido usando controles de compensação, na forma de células manchadas únicas ou contas de compensação disponíveis comercialmente35. Outra consideração importante é ter controles adequados em cada experimento. Células não manchadas estabelecem a linha de base da autofluorescência. Os controles isótipos não são mais considerados controles apropriados para gating devido a vinculação não específica. O passo mais importante para ajudar a fazer portões precisos é o uso de controles FMO. Em um controle FMO, todos os anticorpos conjugados estão presentes na mancha, exceto aquele que está sendo controlado. Os controles FMO permitem a medição da propagação de todos os fluoroforos no canal perdido e, portanto, permitem a instalação de portões em conformidade. É fundamental que células suficientes sejam adquiridas para maior precisão. Como regra geral, pelo menos 2.000 eventos da população de interesse devem ser coletados. Por fim, os controles de compensação, sejam contas ou células, devem ser exatamente combinados com os fluorcromas que estão sendo utilizados e os controles devem ser pelo menos tão brilhantes quanto as amostras experimentais37.
No geral, a baixa análise citométrica dos compartimentos celulares B é amplamente utilizada no campo da imunologia. Esta técnica pode ser usada para investigar perturbações na imunidade humoral tanto em camundongos selvagens quanto geneticamente modificados, em estados não-doenças e em desafio imunológico.
Divulgações
Todos os autores são funcionários e acionistas da Regeneron Pharmaceuticals, Inc.
Agradecimentos
Agradecemos matthew Sleeman pela leitura crítica do manuscrito. Agradecemos também aos departamentos do Vivarium Operations and Flow Cytometry Core da Regeneron por apoiarem esta pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 mL safe-lock Eppendorf tubes | Eppendorf | 22363611 | 0.5 mL microcentrifuge tube |
| 1.5mL Eppendorf tubes | Eppendorf | 22364111 | 1.5 mL microcentrifuge tube |
| 15 mL Falcon tubes | Corning | 352097 | 15 mL conical tube |
| 18 gauge needle | BD | 305196 | |
| 25 gauge needle | BD | 305124 | |
| 3 mL syringe | BD | 309657 | |
| 70 mM MACS SmartStrainer | Miltenyi Biotec | 130-110-916 | 70 mM cell strainer |
| 96 well U bottom plate | VWR | 10861-564 | |
| ACK lysis buffer | GIBCO | A1049201 | red blood cell lysis buffer |
| Acroprep Advance 96 Well Filter Plate | Pall Corporation | 8027 | filter plate |
| B220 | eBiosciences | 17-0452-82 | |
| BD CompBead Anti-Mouse Ig/κ | BD | 552843 | compensation beads |
| BD CompBead Anti-Rat Ig/κ | BD | 552844 | compensation beads |
| Bovine Serum Albumin | Sigma-Aldrich | A8577 | BSA |
| BP-1 | BD | 740882 | |
| Brilliant Stain Buffer | BD | 566349 | brilliant stain buffer |
| C-Kit | BD | 564011 | |
| CD11b | BD | 563168 | |
| CD11b | BioLegend | 101222 | |
| CD19 | BD | 560143 | |
| CD21/35 | BD | 562756 | |
| CD23 | BD | 740216 | |
| CD24 (HSA) | BioLegend | 138504 | |
| CD3 | BD | 561388 | |
| CD3 | BioLegend | 100214 | |
| CD43 | BD | 553270 | |
| CD43 | BioLegend | 121206 | |
| CD5 | BD | 563194 | |
| CD93 | BD | 740750 | |
| CD93 | BioLegend | 136504 | |
| DPBS (1x) | ThermoFisher | 14190-144 | DPBS |
| eBioscience Fixable Viability Dye eFluor 506 | ThermoFisher | 65-0866-14 | viability dye |
| Extended Fine Tip Transfer Pipette | Samco | 233 | disposable transfer pipette |
| FACSymphony A3 flow cytometer | BD | custom order | flow cytometer |
| Fc Block, CD16/CD32 (2.4G2) | BD | 553142 | Fc block |
| FlowJo | Flowjo | flow cytometer analysis software | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | automated dissociation tube |
| gentleMACS Octo Dissociator with Heaters | Miltenyi Biotec | 130-095-937 | tissue dissociator instrument |
| GR1 (Ly6C/6G) | BioLegend | 108422 | |
| IgD | BioLegend | 405710 | |
| IgM | eBiosciences | 25-5790-82 | |
| Kappa | BD | 550003 | |
| Lambda | BioLegend | 407308 | |
| paraformaldehyde, 32% Solution | Electron Microscopy Sciences | 15714 | |
| Ter119 | BioLegend | 116220 | |
| True-Stain Monocyte Blocker | BioLegend | 426103 | monocyte blocker |
| UltraPure EDTA, pH 8.0 | ThermoFisher | 15575038 | EDTA |
| Vi-CELL XR | Beckman Coulter | 731050 | cell counter instrument |
Referências
- Shepard, H. M., Philips, G. L., Thanos, D., Feldman, M. Developments in therapy with monoclonal antibodies and related proteins. Clinical Medicine. 17 (3), 220 (2017).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Macdonald, L. E., et al. Precise and in situ genetic humanization of 6 Mb of mouse immunoglobulin genes. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5147-5152 (2014).
- Murphy, A. J., et al. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5153-5158 (2014).
- Macdonald, L. E., et al. Kappa-on-Heavy (KoH) bodies are a distinct class of fully-human antibody-like therapeutic agents with antigen-binding properties. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 292-299 (2020).
- Pieper, K., Grimbacher, B., Eibel, H. B-cell biology and development. Journal of Allergy and Clinical Immunology. 131 (4), 959-971 (2013).
- Nagasawa, T. Microenvironmental niches in the bone marrow required for B-cell development. Nature Reviews: Immunology. 6 (2), 107-116 (2006).
- Lund, F. E. Cytokine-producing B lymphocytes-key regulators of immunity. Current Opinion in Immunology. 20 (3), 332-338 (2008).
- Martensson, I. L., Keenan, R. A., Licence, S. The pre-B-cell receptor. Current Opinion in Immunology. 19 (2), 137-142 (2007).
- von Boehmer, H., Melchers, F. Checkpoints in lymphocyte development and autoimmune disease. Nature Immunology. 11 (1), 14-20 (2010).
- Goodnow, C. C., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Zikherman, J., Parameswaran, R., Weiss, A. Endogenous antigen tunes the responsiveness of naive B cells but not T cells. Nature. 489 (7414), 160-164 (2012).
- Melchers, F. Checkpoints that control B cell development. Journal of Clinical Investigation. 125 (6), 2203-2210 (2015).
- Henderson, R. B., et al. A novel Rac-dependent checkpoint in B cell development controls entry into the splenic white pulp and cell survival. Journal of Experimental Medicine. 207 (4), 837-853 (2010).
- Pillai, S., Cariappa, A. The follicular versus marginal zone B lymphocyte cell fate decision. Nature Reviews: Immunology. 9 (11), 767-777 (2009).
- Shahaf, G., Zisman-Rozen, S., Benhamou, D., Melamed, D., Mehr, R. B. Cell Development in the Bone Marrow Is Regulated by Homeostatic Feedback Exerted by Mature B Cells. Frontiers in Immunology. 7, 77 (2016).
- Nemazee, D. Mechanisms of central tolerance for B cells. Nature Reviews: Immunology. 17 (5), 281-294 (2017).
- Petkau, G., Turner, M. Signalling circuits that direct early B-cell development. Biochemical Journal. 476 (5), 769-778 (2019).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-5 (2018).
- Betters, D. M. Use of Flow Cytometry in Clinical Practice. Journal of the Advanced Practioner in Oncology. 6 (5), 435-440 (2015).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews: Immunology. 12 (3), 191-200 (2012).
- Van Epps, H. L. Bringing order to early B cell chaos. Journal of Experimental Medicine. 203 (6), 1389 (2006).
- Hardy, R. R., Carmack, C. E., Shinton, S. A., Kemp, J. D., Hayakawa, K. Resolution and characterization of pro-B and pre-pro-B cell stages in normal mouse bone marrow. Journal of Experimental Medicine. 173 (5), 1213-1225 (1991).
- Allman, D., Pillai, S. Peripheral B cell subsets. Current Opinion in Immunology. 20 (2), 149-157 (2008).
- Shapiro-Shelef, M., Calame, K. Regulation of plasma-cell development. Nature Reviews: Immunology. 5 (3), 230-242 (2005).
- Kitamura, D., Roes, J., Kuhn, R., Rajewsky, K. A B cell-deficient mouse by targeted disruption of the membrane exon of the immunoglobulin mu chain gene. Nature. 350 (6317), 423-426 (1991).
- Keenan, R. A., et al. Censoring of autoreactive B cell development by the pre-B cell receptor. Science. 321 (5889), 696-699 (2008).
- Chan, V. W., Meng, F., Soriano, P., DeFranco, A. L., Lowell, C. A. Characterization of the B lymphocyte populations in Lyn-deficient mice and the role of Lyn in signal initiation and down-regulation. Immunity. 7 (1), 69-81 (1997).
- Zikherman, J., Doan, K., Parameswaran, R., Raschke, W., Weiss, A. Quantitative differences in CD45 expression unmask functions for CD45 in B-cell development, tolerance, and survival. Proceedings of the National Academy of Sciences of the United States of America. 109 (1), 3-12 (2012).
- Miyamoto, A., et al. Increased proliferation of B cells and auto-immunity in mice lacking protein kinase Cdelta. Nature. 416 (6883), 865-869 (2002).
- Mecklenbrauker, I., Kalled, S. L., Leitges, M., Mackay, F., Tarakhovsky, A. Regulation of B-cell survival by BAFF-dependent PKCdelta-mediated nuclear signalling. Nature. 431 (7007), 456-461 (2004).
- Okada, T., et al. Antigen-engaged B cells undergo chemotaxis toward the T zone and form motile conjugates with helper T cells. PLoS Biology. 3 (6), 150 (2005).
- Robinson, J. P. Flow Cytometry. Encyclopedia of Biomaterials and Biomedical Engineering. , 630-640 (2004).
- Lugli, E., Roederer, M., Cossarizza, A. Data analysis in flow cytometry: the future just started. Cytometry A. 77 (7), 705-713 (2010).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. European Journal of Immunology. 47 (10), 1584 (2017).
- Bigos, M. Separation index: an easy-to-use metric for evaluation of different configurations on the same flow cytometer. Current Protocols in Cytometry. , 21 (2007).
- Pillai, S., Mattoo, H., Cariappa, A. B. B cells and autoimmunity. Current Opinion in Immunology. 23 (6), 721-731 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados