Method Article
Caractérisation cytométrique en flux du développement des lymphocytes B murins
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons ici une analyse simple de l’hétérogénéité du compartiment des cellules B immunitaires murines dans le péritoine, la rate et les tissus de la moelle osseuse par cytométrie en flux. Le protocole peut être adapté et étendu à d’autres tissus de souris.
Résumé
Des études approfondies ont caractérisé le développement et la différenciation des cellules B murines dans les organes lymphoïdes secondaires. Les anticorps sécrétés par les lymphocytes B ont été isolés et développés en thérapies bien établies. La validation du développement des cellules B murines, dans le contexte de souris sujettes auto-immunes, ou chez des souris dont le système immunitaire est modifié, est un élément crucial du développement ou du test d’agents thérapeutiques chez la souris et constitue une utilisation appropriée de la cytométrie en flux. Des paramètres cytométriques en flux de cellules B bien établis peuvent être utilisés pour évaluer le développement des cellules B dans le péritoine murin, la moelle osseuse et la rate, mais un certain nombre de meilleures pratiques doivent être respectées. En outre, l’analyse cytométrique en flux des compartiments des cellules B devrait également compléter des lectures supplémentaires du développement des cellules B. Les données générées à l’aide de cette technique peuvent approfondir notre compréhension des modèles murins de type sauvage et sujets à tendance auto-immune ainsi que des souris humanisées qui peuvent être utilisées pour générer des anticorps ou des molécules semblables à des anticorps à titre thérapeutique.
Introduction
Les anticorps monoclonaux sont devenus de plus en plus la thérapie de choix pour de nombreuses maladies humaines à mesure qu’ils font partie de la médecine traditionnelle1,2. Nous avons déjà décrit des souris génétiquement modifiées qui produisent efficacement des anticorps hébergeant des régions variables entièrement humaines avec des constantes IgH de souris3,4. Plus récemment, nous avons décrit des souris génétiquement modifiées qui produisent des molécules semblables à des anticorps qui ont une liaison distincte à l’antigène5. Les anticorps sont sécrétés par les cellules B et forment la base de l’immunité humorale adaptative. Il existe deux types distincts de cellules B, B-1 et B-2. Chez les mammifères, les cellules B-1 proviennent du foie fœtal et sont enrichies dans les tissus muqueux et les cavités pleurales et péritonéales après la naissance, tandis que les cellules B-2 proviennent du foie fœtal avant la naissance et par la suite dans la moelle osseuse (BM). Les cellules B-2 sont enrichies dans les organes lymphoïdes secondaires, y compris la rate et le sang6,7,8. Dans le BM, les progéniteurs hématopoïétiques B-2 commencent à se différencier en cellules pro-B lors de l’initiation du réarrangement de la chaîne lourde Ig mu9,10. Le réarrangement réussi de la chaîne lourde Ig et son assemblage dans le récepteur des cellules pré-B (pré-BCR), ainsi que la signalisation et l’expansion proliférative, conduisent à la différenciation des cellules pré-B. Une fois que les cellules pré-B ont réarrangé leurs chaînes légères Ig kappa (Igκ) ou, si elles sont improductives, Ig lambda (Igλ), elles s’associent à μ chaîne lourde, ce qui entraîne une expression igM BCR de surface. Il est important de souligner que l’expression de surface des IgM est connue pour être réduite dans des conditions d’autoréactivité, contribuant ainsi à l’auto-tolérance dans les cellules B fonctionnellement insensibles ou anergiques11,12. Les lymphocytes B immatures entrent alors dans une phase de transition, où ils commencent à co-exprimer les IgD et à migrer du BM vers la rate. Dans la rate, l’expression des IgD augmente encore et les cellules mûrissent dans une deuxième étape de cellules B transitionnelles, suivie de l’achèvement de leur état de maturation et de leur développement en cellules de zone marginale (MZ) ou folliculaires (Fol)13,14,15. Chez les souris adultes, dans un environnement non malade, le nombre de cellules B matures reste constant malgré 10 à 20 millions de cellules B immatures générées quotidiennement dans le BM. Parmi ceux-ci, seulement trois pour cent entrent dans le pool de cellules B matures. La taille du compartiment périphérique des lymphocytes B est limitée par la mort cellulaire, due en partie à plusieurs facteurs, notamment l’autoréactivité et la maturation incomplète16,17,18. L’analyse cytométrique en flux a été largement utilisée pour caractériser et dénombrer de nombreux sous-compartiments de cellules immunitaires chez l’homme et la souris. Bien qu’il existe certaines similitudes entre les compartiments des cellules B humaines et murines, ce protocole ne s’applique qu’à l’analyse des cellules B murines. Ce protocole a été développé dans le but de phénotyper des souris génétiquement modifiées, afin de déterminer si la manipulation génétique modifierait le développement des cellules B. La cytométrie en flux a également été extrêmement populaire dans de nombreuses autres applications, notamment dans la mesure de l’activation cellulaire, de la fonction, de la prolifération, de l’analyse du cycle, de l’analyse du contenu de l’ADN, de l’apoptose et du tri cellulaire 19,20.
La cytométrie en flux est l’outil de choix pour caractériser divers compartiments lymphocytaires chez la souris et l’homme, y compris dans des organes complexes tels que la rate, le BM et le sang. En raison des réactifs d’anticorps spécifiques à la souris largement disponibles pour la cytométrie en flux, cette technique peut être utilisée pour étudier non seulement les protéines de surface cellulaire, mais aussi les phosphoprotéines intracellulaires et les cytokines, ainsi que les lectures fonctionnelles21. Nous démontrons ici comment les réactifs de cytométrie en flux peuvent être utilisés pour identifier les sous-ensembles de cellules B à mesure qu’ils mûrissent et se différencient dans les organes lymphoïdes secondaires. Après l’optimisation des conditions de coloration, la manipulation des échantillons, la configuration correcte de l’instrument et l’acquisition des données, et enfin l’analyse des données, un protocole d’analyse cytométrique en flux complète du compartiment des cellules B chez la souris peut être utilisé. Une telle analyse complète est basée sur une nomenclature vieille de plusieurs décennies conçue par Hardy et ses collègues, où le développement de cellules BM B-2 peut être divisé en différentes fractions (Fraction) en fonction de leur expression de B220, CD43, BP-1, CD24, IgM et IgD22. Hardy et al., ont montré que les cellules B B CD220+ CD43 peuvent être subdivisées en quatre sous-ensembles (Fraction A-C') sur la base de l’expression BP-1 et CD24 (30F1), tandis que les cellules B BM B 220+ (dim to neg) peuvent être résolues en trois sous-ensembles (Fraction D-F) basés sur l’expression différentielle des IgD et des IgM23 de surface. La fraction A (cellules pré-pro-B) est définie comme BP-1-CD24 (30F1)-, la fraction B (cellules pro-B précoces) est définie comme BP-1-CD24 (30F1)+, la fraction C (cellules pro-B tardives) est définie comme BP-1+ CD24 (30F1)+, et la fraction C'(cellules pré-B précoces) est définie comme BP-1+ et CD24high. En outre, la fraction D (cellules pré-B) est définie comme des cellules B220+ CD43-IgM-B, et la fraction E (cellules B nouvellement générées, combinaison de cellules immatures et transitionnelles) est définie comme des cellules B B B220+ CD43- IgM+ et la fraction F (cellules B matures et recirculantes) est définie comme des cellules B B B220high CD43- IgM+. En revanche, la majorité des lymphocytes B naïfs présents dans la rate peuvent être divisés en cellules B matures (B220+ CD93-) et cellules transitionnelles (T1, T2, T3) en fonction de l’expression de CD93, CD23 et IgM. Les cellules B matures peuvent être résolues en sous-ensembles marginaux et folliculaires basés sur l’expression des IgM et des CD21/CD35, et les sous-ensembles folliculaires peuvent être divisés en sous-ensembles folliculaires matures de type I et folliculaires de type II B en fonction du niveau de leur expression de surface IgM et IgD24. Ces populations de lymphocytes B spléniques expriment principalement la chaîne légère Igκ. Enfin, les populations de cellules B-1 B, qui proviennent du foie fœtal et se trouvent principalement dans les cavités péritonéales et pleurales de souris adultes, ont été décrites dans la littérature. Ces lymphocytes B péritonéaux peuvent être distingués des lymphocytes B-2 décrits précédemment par leur manque d’expression de CD23. Ils sont ensuite subdivisés en populations B-1a ou B-1b, la première étant définie par la présence de CD5 et la seconde par son absence25. Les progéniteurs des cellules B-1 sont abondants dans le foie fœtal, mais ne se trouvent pas chez le BM adulte. Bien que les cellules B-1a et B-1b proviennent de différents progéniteurs, elles ensemencent toutes deux les cavités péritonéale et pleurale24. Contrairement aux cellules B-2, les cellules B-1 sont uniquement capables de s’auto-renouveler et sont responsables de la production d’anticorps IgM naturels.
Des défauts dans le développement des lymphocytes B peuvent survenir dans de nombreux cas, y compris des déficiences dans les composants du BCR26,27, des perturbations des molécules de signalisation qui ont un impact sur la force de signalisation BCR14,28,29, ou une perturbation des cytokines qui modulent la survie des lymphocytes B30,31 . L’analyse par cytométrie en flux des compartiments lymphoïdes a contribué à la caractérisation des blocs de développement des cellules B chez ces souris et bien d’autres. L’un des avantages de l’analyse cytométrique en flux des compartiments lymphoïdes est qu’elle offre la possibilité d’effectuer des mesures sur des cellules individuelles obtenues à partir de tissus dissociés vivants. La disponibilité de réactifs dans une gamme sans cesse croissante de fluorophores permet l’analyse simultanée de plusieurs paramètres et permet d’évaluer l’hétérogénéité des cellules B. En outre, le dénombrement des cellules B par analyse cytométrique en flux complète d’autres tests immunologiques tels que les méthodes d’immunohistochimie qui visualisent la localisation cellulaire dans les organes lymphoïdes, la détection des niveaux d’anticorps circulants comme mesure de l’immunité humorale, ainsi que la microscopie à deux photons pour mesurer les réponses des cellules B dans l’espace et le temps réels32.
Protocole
Toutes les études sur la souris ont été supervisées et approuvées par le Comité institutionnel de soins et d’utilisation des animaux (IACUC) de Regeneron. L’expérience a été menée sur des tissus de trois souris femelles C57BL / 6J (âgées de 17 semaines) de Jackson Laboratories. Titrer tous les anticorps avant de commencer l’expérience pour déterminer la concentration idéale. Lorsque vous utilisez des perles de compensation pour une compensation unicolore, assurez-vous qu’elles tachent aussi brillantes ou plus brillantes que vos échantillons. Conservez tous les tampons, anticorps et cellules sur la glace ou à 4 °C. Après l’ajout d’un colorant de viabilité, effectuez toutes les étapes et incubations à 4 ° C en basse lumière ou dans l’obscurité.
1. Récolte de cellules péritonéales et isolement unicellulaire
- Euthanasier la souris en utilisant du CO2 ou selon un protocole approuvé.
- Posez la souris sur le dos, vaporisez avec de l’éthanol à 70% et coupez la peau abdominale externe avec des ciseaux, en prenant soin de ne pas couper le péritoine.
- Injecter 3 mL de tampon de lavage glacé (0,5 % d’albumine sérique bovine (BSA) dans du DPBS [vol/vol]) dans la cavité péritonéale à l’aide d’une seringue de 3 mL munie d’une aiguille de calibre 25.
- Massez doucement le péritoine du bout des doigts.
- Répétez les étapes 1.3 et 1.4.
- Insérez une seringue de 3 mL munie d’une aiguille de 18 G à travers le péritoine, en veillant à éviter les organes et la graisse.
- Extraire le tampon de lavage, contenant maintenant des cellules péritonéales, et transférer dans un tube conique de 15 mL sur de la glace.
- Répétez les étapes 1.3 et 1.4.
- Coupez un petit trou dans le péritoine tout en tenant avec une pince à épiler.
- Insérez une pipette de transfert jetable dans le trou et collectez le tampon de lavage restant, en évitant encore une fois la graisse et les organes.
- Transférer les cellules péritonéales restantes recueillies dans le tube conique de 15 mL sur la glace.
REMARQUE : Jeter l’échantillon si la contamination du sang est évidente. - Incuber les cellules sur de la glace jusqu’à ce que l’extraction de la rate et des os soit terminée.
- Centrifuger les cellules à 300 x g pendant 8 min à 4 °C. Aspirer le surnageant.
- Remettre en suspension la pastille de cellule dans 1 mL de tampon de lavage.
- Filtrer les cellules à travers une passoire cellulaire de 70 μM dans un tube conique propre de 15 mL sur de la glace.
- Déterminez la concentration cellulaire à l’aide d’un compteur cellulaire ou d’un hémocytomètre.
2. Récolte de la rate et isolement unicellulaire
- Posez la souris sur son ventre et coupez à travers le péritoine sur le dos gauche à l’aide de ciseaux propres. Découpez la rate, en enlevant la graisse et le tissu conjonctif.
- Transférer la rate dans un tube de microcentrifugation de 1,5 mL contenant 1 mL de tampon de lavage sur de la glace.
- Incuber la rate sur de la glace jusqu’à ce que l’extraction osseuse soit terminée.
- Déplacez la rate vers un tube de dissociation automatisé avec 5 mL de tampon de lyse des globules rouges. Placez le tube sur l’instrument de dissociateur tissulaire et dissociez-le pendant 60 s pour créer une suspension à cellule unique.
REMARQUE: Il est également permis d’utiliser d’autres méthodes de routine pour obtenir des suspensions de rate unicellulaires telles que le fracassage entre des lames de verre dépoli dans le tampon de lavage. Si une autre méthode de dissociation est utilisée, suivez la dissociation par centrifugation, aspiration, puis remise en suspension dans 5 mL de tampon de lyse des globules rouges avant de passer à l’étape 2.5. - Incuber les cellules à température ambiante pendant 3 min.
- Ajouter 10 mL de tampon de lavage à 4 °C contenant 2 mM d’EDTA.
- Transférer dans un tube conique propre de 15 mL.
- Centrifuger les cellules à 300 x g pendant 8 min à 4 °C. Aspirer le surnageant.
- Remettre en suspension la pastille de cellule dans 5 mL de tampon de lavage à 4 °C.
- Filtrer les cellules à travers une passoire cellulaire de 70 μM dans un tube conique propre de 15 mL sur de la glace.
- Déterminez la concentration cellulaire à l’aide d’un compteur cellulaire ou d’un hémocytomètre.
3. Récolte de BM et isolement unicellulaire
- Retirez la peau de la moitié inférieure du corps de la souris. Couper l’excès de muscle de la jambe. Retirez toute la jambe avec des ciseaux, en faisant attention à ne pas couper le fémur. Nettoyez le fémur et le tibia en enlevant les muscles, la graisse et les pieds restants.
- Transférer les os dans un tube de microcentrifugation de 1,5 mL contenant 1 mL de tampon de lavage sur de la glace.
- Perforez le fond d’un tube de microcentrifugation de 0,5 mL, en laissant un trou suffisamment petit pour que les os des jambes ne dépassent pas. Insérez le tube de 0,5 mL dans un tube de microcentrifugation propre de 1,5 mL. Coupez l’extrémité du fémur et du tibia proximal au genou et placez les extrémités coupées vers le bas dans le tube de 0,5 mL.
- Centrifuger les cellules à 6 780 x g pendant 2 min à 4 °C.
- Remettre en suspension la pastille cellulaire dans 1 mL de tampon de lyse des globules rouges et transférer dans un tube conique de 15 mL contenant 3 mL supplémentaires de tampon de lyse des globules rouges.
- Incuber à température ambiante pendant 3 min.
- Ajouter 10 mL de tampon de lavage à 4 °C contenant 2 mM d’EDTA.
- Centrifuger les cellules à 300 x g pendant 8 min à 4 °C. Aspirer le surnageant.
- Remettre en suspension la pastille de cellule dans 3 mL de tampon de lavage à 4 °C.
- Filtrer les cellules à travers une passoire cellulaire de 70 μM dans un tube conique propre de 15 mL sur de la glace.
- Déterminez la concentration cellulaire à l’aide d’un compteur cellulaire ou d’un hémocytomètre.
4. Tacher les cellules et préparer la compensation
- Aliquote 106 cellules de chaque type de cellule de chaque animal vers une plaque inférieure de 96 puits U.
- Assurez-vous d’inclure suffisamment de puits pour tous les échantillons et contrôles, y compris la coloration complète, la fluorescence moins un (FMO), non colorée, et enfin la compensation monocolore facultative pour chaque fluorophore utilisé.
- Pour le panel de maturation BM et le panneau de maturation de la rate, les cellules aliquotes en 2 puits, 106 cellules par puits, pour chaque échantillon de coloration complet. Pour les contrôles de viabilité de la compensation monocolore, ajoutez 2 x 106 cellules de chaque type de cellule à des puits individuels.
- Centrifuger la plaque à 845 x g pendant 2 min à 4 °C. Décantez le surnageant en inversant et en faisant glisser rapidement la plaque sur un évier, en veillant à ne pas contaminer les puits.
- Remettre en suspension les cellules dans 200 μL de DPBS (sans BSA ou FBS). Cette étape est importante pour éliminer les protéines avant de les colorer avec un colorant de viabilité réactif aux amines.
- Répétez les étapes 4.2 et 4.3.
- Répétez l’étape 4.2.
- Remettre en suspension les cellules dans un colorant de viabilité de 100 μL dilué à 1:1 000 dans du DPBS.
REMARQUE: Si vous utilisez des cellules pour la compensation unicolore, n’ajoutez pas de colorant de viabilité à ces puits.- Pour chaque ensemble de taches, laissez plusieurs puits non colorés pour un échantillon complètement non coloré et tout autre contrôle dont vous pourriez avoir besoin.
- Pour chaque ensemble de taches, laissez un puits supplémentaire non coloré pour le contrôle FMO de viabilité.
- Pour les contrôles de compensation de viabilité monocolore : Remettez en suspension les 2 x 106 cellules, aliquotes à l’étape 4.1, dans 200 μL de colorant de viabilité dilué. Transférer 100 μL de cellules dans un tube de microcentrifugation de 1,5 mL, chauffer les cellules pendant 5 min à 65 °C et transférer les 100 μL de cellules tuées thermiquement vers le puits d’origine avec les 100 μL restants.
- Incuber les cellules à 4 °C, à l’abri de la lumière, pendant 30 min.
- Centrifuger la plaque à 845 x g pendant 2 min à 4 °C. Décantez le surnageant en inversant et en faisant glisser rapidement la plaque sur un évier, en veillant à ne pas contaminer les puits.
- Remettre en suspension les cellules dans 200 μL de DPBS (sans BSA ou FBS).
- Répétez les étapes 4.8 et 4.9.
- Répétez l’étape 4.8.
- Remettre les cellules en suspension dans 50 μL de bloc Fc dilué à 1:50 (concentration finale = 10 μg/mL) dans un tampon de coloration (0,5 % de BSA dans le DPBS [vol/vol]).
- Pour les cellules péritonéales - ajoutez également 5 μL de bloqueur de monocytes pour réduire la coloration non spécifique.
- Incuber les cellules à 4 °C, à l’abri de la lumière, pendant 15 min.
- Préparer des mélanges maîtres de coloration complets et des AMFO dans un tampon de coloration pour un volume final de 100 μl par 106 cellules. Reportez-vous au tableau 1-tableau 4 pour les listes d’anticorps.
REMARQUE: Les AMFO sont fabriqués en incluant tous les anticorps dans un ensemble de taches sauf un. Préparez un FMO pour chaque anticorps dans un ensemble de taches. Lorsqu’un ensemble de taches contient plusieurs colorants brillants, remplacez 50 μL de tampon de tache brillant par un tampon de coloration par échantillon - Sans enlever le bloc Fc, ajoutez 100 μL de mélanges de teinture complète et d’AMFO aux puits sélectionnés.
- Préparez des contrôles de compensation unicolores pour chaque anticorps dans un ensemble de taches.
- Si vous utilisez des perles de compensation, suivez les instructions d’utilisation du fabricant.
- Si vous utilisez des cellules, ajoutez un anticorps titré à 106 cellules, réservée précédemment à l’étape 4.6.1 sans colorant de viabilité, dans un tampon de coloration de 100 μL. Si toutes les cellules de l’échantillon sont positives pour un marqueur particulier, mettez de côté les cellules non colorées à utiliser lors de l’acquisition des données de compensation sur le cytomètre en flux.
- Incuber les cellules et les billes à 4 °C, à l’abri de la lumière, pendant 30 min.
- Centrifuger la plaque à 845 x g pendant 2 min à 4 °C. Décantez le surnageant en inversant et en faisant glisser rapidement la plaque sur un évier, en veillant à ne pas contaminer les puits.
- Remettre en suspension les cellules et les billes dans 200 μL de tampon de coloration.
- Répétez les étapes 4.18 et 4.19 deux fois.
- Répétez l’étape 4.18.
- Pour fixer les échantillons pour analyse dans les 48 h, remettre en suspension les cellules et les billes dans 200 μL de paraformaldéhyde à 2% dans le DPBS.
ATTENTION : Le parafomaldéhyde est un danger grave pour la santé et inflammable. Reportez-vous à la fiche technique de Safty avant utilisation. - Incuber les cellules et les billes à 4 °C, à l’abri de la lumière, pendant 30 min.
- Répétez les étapes 4.18 et 4.19 deux fois.
- Placez une plaque filtrante sur une plaque propre à fond en U de 96 puits. À l’aide d’une multi-pipette, transférer chaque échantillon dans un puits de la plaque filtrante.
- Centrifugez la plaque filtrante-96 puits U-bottom plate configuration à 845 x g pendant 2 min à 4 °C. Retirez la plaque filtrante et décantez le surnageant en inversant et en faisant glisser rapidement la plaque au-dessus d’un évier, en prenant soin de ne pas contaminer les puits.
- Pour les panneaux de maturation de la BM et de la rate, remettez en suspension les cellules entièrement colorées dans 100 μL de tampon de coloration. Combinez les 2 puits pour chaque animal en 1 puits. Remettez en suspension les panneaux, les AMFO et les contrôles restants dans 200 μL de tampon anti-taches.
- Incuber des cellules fixes et des billes à 4 °C, à l’abri de la lumière, pendant la nuit.
5. Acquisition de données cytométriques en flux
- Initialisez et contrôlez le cytomètre en flux conformément aux instructions du fabricant.
- Chargez le modèle spécifique à chaque panneau.
- Avant d’enregistrer les données, assurez-vous que tous les événements de chaque échantillon sont à l’échelle et visibles sur les diagrammes à points.
- Enregistrer les contrôles de compensation pour chaque panneau de coloration à l’aide de compensations de tache uniques préparées à l’étape 4.16. Définissez des portes positives et négatives pour chaque échantillon. Demandez au logiciel de calculer la matrice de compensation.
- Commencez à acquérir le premier échantillon et assurez-vous que les portes sont bien définies.
- Réglez la machine pour enregistrer au moins 50 000 événements de cellules B pour le panneau de cellules B péritonéales et le panneau Igκ et Igλ de la rate; 150 000 événements de cellules B pour le panel de maturation BM; et 300 000 événements de cellules B pour le panel de maturation de la rate.
- Pour chaque panneau de coloration, exécutez et enregistrez les échantillons entièrement colorés pour chaque animal, un échantillon non taché et les FMO.
6. Analyser les données
- Procéder à l’analyse des données à l’aide d’un logiciel d’analyse par cytométrie en flux. Suivez les stratégies de contrôle décrites à la Figure 1, Figure 2, Figure 3, Figure 4.
Résultats
Nous présentons ici la stratégie de contrôle pour caractériser le développement des cellules B dans le péritoine, le BM et la rate de souris. La base de l’analyse est formée autour du concept de coloration avec un colorant de viabilité, puis de griller des doublets en fonction de la zone de diffusion avant (FSC-A) et de la hauteur de diffusion avant (FSC-H), et enfin de la rétention des débris en sélectionnant les cellules en fonction de leurs caractéristiques FSC-A et SSC-A (Side-Scatter-Area), appelées ici porte de taille, qui reflètent la taille relative des cellules et la granularité cellulaire, avant de se concentrer sur la population d’intérêt.
L’analyse cytométrique en flux des cellules B péritonéales montre les fréquences des cellules péritonéales viables, des cellules B totales, des sous-ensembles B-1 et B-2, ainsi que des cellules B-1a et B-1b chez les souris C57BL/6J (figure 1), à l’aide d’un panneau de coloration décrit dans le tableau 1. Le nombre absolu moyen de cellules de ces fréquences est indiqué dans le tableau 5. Les perturbations dans les cellules B-1 pourraient être délimitées par la distribution des sous-ensembles cellulaires, soit par la fréquence cellulaire, soit par le nombre absolu de cellules par souris.
L’analyse cytométrique en flux des cellules B BM montre les fréquences des cellules BM viables, des cellules B totales, de la fraction A (cellules pré-pro-B et lymphocytes contaminants), des cellules pré-pro-B, de la fraction B, de la fraction C, de la fraction C', de la fraction D, immatures (sous-ensemble de la fraction E), transitionnelles (sous-ensemble de la fraction E) et de la fraction F B chez les souris C57BL/6J (figure 2), à l’aide d’un panneau de coloration décrit dans le tableau 2. Le nombre absolu moyen de cellules de ces fréquences est indiqué dans le tableau 6. Les perturbations dans les cellules BM B pourraient être délimitées par la distribution des sous-ensembles cellulaires, soit par la fréquence cellulaire, soit par le nombre absolu de cellules par jambe(s).
L’analyse cytométrique en flux des cellules B spléniques montre les fréquences des cellules de la rate viables, des cellules B totales, des cellules B transitionnelles, des cellules T1, T2, T3, des cellules B matures, des cellules Folliculaires I (Fol I), des cellules folliculaires II (Fol II), des cellules précurseurs de la zone marginale (MZ), des cellules MZ matures et des cellules B-1 chez les souris C57BL/6J (figure 3), à l’aide d’un panneau de coloration décrit dans le tableau 3. Le nombre absolu moyen de cellules de ces fréquences est indiqué dans le tableau 7. Les perturbations dans les cellules B spléniques pourraient être délimitées par la distribution des sous-ensembles cellulaires, soit par la fréquence cellulaire, soit par le nombre absolu de cellules par rate.
De même, l’analyse cytométrique en flux de la rate montre les fréquences des cellules Igκ+ et Igλ+ B chez les souris C57BL/6J (Figure 4), à l’aide d’un panneau de coloration décrit dans le tableau 4. Le nombre absolu moyen de cellules de ces fréquences est indiqué dans le tableau 8. Les perturbations dans les cellules Igκ+ et Igλ+ pourraient être délimitées par la distribution des sous-ensembles cellulaires, soit par la fréquence cellulaire, soit par le nombre absolu de cellules par rate.
| Anticorps | Fluorophore | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | Le | S7 |
| CD23 | BUV395 | B3B4 |
| CD11b | BV711 | M1/70 |
| CD5 | BV605 | 53-7.3 |
Tableau 1 : Panneau de cellules B péritonéales
| Anticorps | Fluorophore | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | Le | 1B11 |
| CD24 (HSA) | PE | 30-F1 |
| C-Kit | BUV395 | 2B8 |
| BP-1 | BV786 | BP-1 |
| CD93 | BV711 | AA4.1 |
| canal de vidage | ||
| CD3 | AF700 | 17-A2 |
| CD11b | AF700 | M1/70 |
| GR1 (Ly6C/6G) | AF700 | RB6-8C5 |
| Ter119 | AF700 | TER-119 |
Tableau 2 : Panneau de maturation de la moelle osseuse
| Anticorps | Fluorophore | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | Le | S7 |
| CD23 | BUV395 | B3B4 |
| CD21/35 | BV421 | 7G6 |
| CD11b | AF700 | M1/70 |
| CD5 | BV605 | 53-7.3 |
| CD93 | PE | AA4.1 |
Tableau 3 : Panneau de maturation de la rate
| Anticorps | Fluorophore | clone |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD3 | PB | 17-A2 |
| Kappa | Le | 187.1 |
| Lambda | PE | RML-42 |
Tableau 4 : Igκ de la rate et groupe Igλ
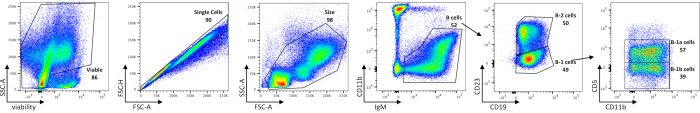
Figure 1 : Caractérisation des populations de lymphocytes B dans le péritoine. Les cellules B péritonéales viables, à cellule unique et de taille fermée, sont d’abord séparées des cellules contaminantes par des cellules IgM+. Les cellules B-1 et B-2 se distinguent ensuite par l’absence (B-1) ou la présence de CD23 (B-2). L’expression CD5 suivante est utilisée pour délimiter les cellules B-1a (CD5+) des cellules B-1b (CD5-). Les ORF ont été utilisés pour déterminer empiriquement où dessiner des portes. Les chiffres sont des pourcentages de chaque population dans le même diagramme de densité. Veuillez cliquer ici pour voir une version agrandie de cette figure.
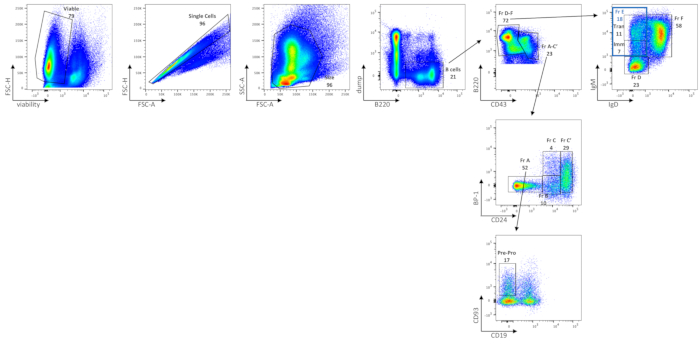
Figure 2 : Caractérisation des sous-ensembles de cellules B dans le BM. Les cellules B BM viables, à cellule unique et de taille fermée, sont séparées des cellules non B par gating sur des cellules B220+ dump- (où dump fait référence à CD3 / GR-1 / CD11b / TER119). L’expression CD43 et B220 définit en outre la fraction de Hardy A-C'(CD43+ B220+) et la fraction de Hardy D-F (CD43low/neg B220+/++). La fraction A-C’est ensuite séparée par l’expression de BP-1 et de CD24. La fraction A (BP-1-CD24-) correspond aux cellules pré-pro-B ainsi qu’aux cellules contaminantes. Pour séparer les cellules pré-pro-B des cellules contaminantes de la fraction A, l’expression de CD93 et l’absence de CD19 sont utilisées. La fraction B (BP-1- CD24int) et la fraction C (BP-1+ CD24int) correspondent respectivement aux cellules pro-B précoces et tardives, et la fraction C'(BP-1+/- CD24+) correspond aux cellules pré-B précoces. Pour séparer la fraction D-F, l’expression des IgM et des IgD est utilisée. La fraction D correspond aux cellules pré-B tardives (IgM-/Faible IgD-); Fraction E (porte bleue, IgMint/IgD élevée-) aux cellules B immatures (Imm, IgMint IgD-) et transitionnelles (Tran, IgMhigh IgD-); et fraction F (IgMint/IgD+ élevée) pour faire recirculer les cellules B matures. Les ORF ont été utilisés pour déterminer empiriquement où dessiner des portes. Les chiffres sont des pourcentages de chaque population dans le même diagramme de densité. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Caractérisation de la maturation des lymphocytes B spléniques. Les cellules B spléniques viables, à cellule unique et de taille fermée, sont séparées des cellules non B en tapant sur les cellules B220+. Afin d’identifier le sous-ensemble B-1, les cellules CD23-CD19+ sont identifiées et définies par l’expression de CD43. Pour classer les populations B-2, les cellules CD19+ sont séparées en cellules B transitionnelles (CD93+ B220+) et matures (CD93-B220+). Les cellules transitionnelles (CD93+ B220+) sont en outre divisées en populations T1 (IgM+ CD23-), T2 (IgM+ CD23+) et T3 (IgMint CD23+). Les cellules matures (CD93-B220+) sont séparées en cellules B de zone marginale (CD21/35+ IgM+) et folliculaires (CD21/35int IgMint/+). L’expression de CD23 est également utilisée pour séparer les cellules précurseurs de MZ (CD23+ B220+) des cellules MZ (CD23-B220+) plus matures. Les populations folliculaires sont ensuite délimitées en cellules Fol I (IgD+ IgMint) et Fol II (IgD+ IgM+). Les ORF ont été utilisés pour déterminer empiriquement où dessiner des portes. Les chiffres sont des pourcentages de chaque population dans le même diagramme de densité Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Expression Igκ et Igλ des lymphocytes B spléniques. Les cellules B spléniques viables, à cellule unique et de taille fermée, sont séparées des cellules non B en râpant sur les cellules B220+ CD3. Les lymphocytes B se distinguent alors par l’expression d’Igλ et d’Igκ. Les chiffres sont des pourcentages de chaque population dans le même diagramme de densité. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nombre absolu de cellules | |||||
| Numéro d’animal | Cellules péritonéales viables | Cellules B | Cellules B-1a | Cellules B-1b | Cellules B-2 |
| 1 | 1.02E+07 | 4,67E+06 | 1.28E+06 | 8,95E+05 | 2.35F+06 |
| 2 | 9,92E+06 | 4.52E+06 | 1,49E+06 | 9,60E+05 | 1,91E+06 |
| 3 | 1.15E+07 | 4.56E+06 | 1,71E+06 | 9.19E+05 | 1,78E+06 |
| Moyenne | 1.05E+07 | 4.58E+06 | 1,49E+06 | 9.25E+05 | 2.01E+06 |
Tableau 5 : Nombre absolu de cellules des sous-ensembles de cellules B péritonéales
| Nombre absolu de cellules | |||||||||||
| Numéro d’animal | Cellules viables de la moelle osseuse | Cellules B | Fraction A | Pré-pro | Fraction B | Fraction C | Fraction C' | Fraction D | Immature | Transitoire | Fraction F |
| 1 | 5.05E+07 | 9,70E+06 | 1.13E+06 | 1,95E+05 | 2.22E+05 | 9.14E+04 | 6.31E+05 | 1,59E+06 | 4,56E+05 | 7,81E+05 | 4.03E+06 |
| 2 | 5,39E+07 | 1.03E+07 | 1.14E+06 | 2.29E+05 | 2,89E+05 | 1.22E+05 | 8.40E+05 | 2.11E+06 | 5,39E+05 | 8.07E+05 | 3.67F+06 |
| 3 | 5,93E+07 | 1.01E+07 | 1.10E+06 | 2.12E+05 | 2,84E+05 | 1.05E+05 | 9.02E+05 | 2.72E+06 | 5,94E+05 | 7,62E+05 | 2,59E+06 |
| Moyenne | 5,46E+07 | 1.00E+07 | 1.12E+06 | 2.12E+05 | 2,65E+05 | 1.06E+05 | 7,91E+05 | 2.14E+06 | 5.29E+05 | 7,83E+05 | 3.43E+06 |
Tableau 6 : Nombre absolu de cellules des sous-ensembles de cellules B de la moelle osseuse
| Nombre absolu de cellules | ||||||||||||
| Numéro d’animal | Cellules viables de la rate | Cellules B | Lymphocytes B transitionnels | Cellules T1 | Cellules T2 | Cellules T3 | Cellules B matures | Cellules Folliculaires I | Cellules folliculaires II | Cellules de la zone marginale précurseur | Cellules matures de la zone marginale | Cellules B-1 |
| 1 | 9.16E+07 | 4,61E+07 | 3.66E+06 | 1,55E+06 | 1.10E+06 | 7.16E+05 | 4.06E+07 | 2.39E+07 | 5.27E+06 | 2.17E+06 | 3,98E+06 | 8,83E+05 |
| 2 | 9,97E+07 | 5.18E+07 | 4,88E+06 | 1,97E+06 | 1,57E+06 | 1.00E+06 | 4.49E+07 | 2,68E+07 | 7.33E+06 | 3.42E+06 | 3.84E+06 | 8.15E+05 |
| 3 | 1.02E+08 | 5.34E+07 | 4.64E+06 | 1,98E+06 | 1.41E+06 | 8,54E+05 | 4.62E+07 | 2,81E+07 | 5,84E+06 | 3.58E+06 | 4.02E+06 | 1.01E+06 |
| Moyenne | 9,77E+07 | 5.04E+07 | 4,39E+06 | 1,83E+06 | 1,36E+06 | 8,58E+05 | 4.39E+07 | 2,63E+07 | 6.15F+06 | 3.06E+06 | 3,94E+06 | 9.02E+05 |
Tableau 7 : Nombre absolu de cellules des sous-ensembles de cellules B spléniques
| Nombre absolu de cellules | ||||
| Numéro d’animal | Cellules viables de la rate | Cellules B | Cellules Igκ+ B | Cellules Igλ+ B |
| 1 | 9.16E+07 | 4,97E+07 | 4,51E+07 | 2.46E+06 |
| 2 | 9,97E+07 | 5,63E+07 | 5.08E+07 | 3.16E+06 |
| 3 | 1.02E+08 | 5,91E+07 | 5.33E+07 | 3.24E+06 |
| Moyenne | 9,77E+07 | 5.50E+07 | 4,97E+07 | 2,95E+06 |
Tableau 8 : Nombre absolu de cellules des sous-ensembles de cellules Igκ et Igλ B
Discussion
L’analyse cytométrique en flux des tissus lymphoïdes et non lymphoïdes a permis l’identification et le dénombrement simultanés des sous-populations de cellules B chez la souris et l’homme depuis les années 1980. Il a été utilisé comme mesure de l’immunité humorale et peut être appliqué davantage pour évaluer la fonctionnalité des cellules B. Cette méthode tire parti de la disponibilité des réactifs pour évaluer les différentes étapes de la maturation des lymphocytes B chez la souris et l’homme, par le biais d’une analyse simultanée de multiples paramètres permettant d’évaluer l’hétérogénéité des lymphocytes B, même dans des populations rares. S’il est utilisé pour mesurer des échantillons hétérogènes complexes, il peut détecter des sous-populations en quelques minutes, sur des cellules individuelles33. La stratégie d’analyse séquentielle du contrôle, le plus souvent appliquée à l’analyse cytométrique en flux, peut être simple et intuitive lorsqu’une population spécifique doit être identifiée34. Enfin, un autre avantage de la cytométrie en flux est qu’elle est facilement adaptable dans la plupart des laboratoires universitaires, tout en étant sous la direction d’utilisateurs expérimentés. Notre protocole décrit avec succès l’évaluation des populations de cellules B dans le péritoine, la BM et la rate de souris, en décrivant et en dénommant les populations B-1 et en approfondissant le développement des cellules B-2 pro-B, des cellules pré-B, des cellules B immatures, transitionnelles et matures, ainsi que de leur expression de surface des chaînes légères Igκ ou Igλ. La cytométrie en flux est la méthode la plus largement utilisée et la plus facile à appliquer lors de l’étude du développement des cellules B chez la souris.
Bien que la cytométrie en flux génère des données inestimables, cette technologie présente certaines limites lorsqu’elle est utilisée pour étudier l’hétérogénéité du compartiment immunitaire des cellules B. D’énormes ensembles de données peuvent être accablants car la coloration à 10 couleurs permet la reconnaissance de plus de 1 024 populations cellulaires différentes34. Il faut tenir compte du fait que certains marqueurs de cellules lymphoïdes couramment utilisés se sont avérés moins spécifiques qu’on ne le pensait à l’origine. Cela peut être résolu en utilisant une multitude de marqueurs de surface cellulaire pour déterminer les populations souhaitées. Bien que l’analyse cytométrique en flux puisse être simple et intuitive, une autre contrainte de l’analyse cytométrique en flux est qu’elle ne permet généralement la visualisation que de deux paramètres à la fois, bien que des outils de visualisation de données tels que t-SNE puissent être utilisés pour regrouper plus efficacement les populations cellulaires lors de l’utilisation de la cytométrie en flux à paramètres élevés. Une autre limitation importante est que les portes utilisées lors de l’acquisition et de l’analyse dépendent parfois de la subjectivité de l’opérateur.
Pour une adaptation ou une réplication réussie de ce protocole, plusieurs paramètres critiques doivent être pris en considération35. Une attention particulière doit être prise en compte dans la conception du panneau et la sélection du fluorochrome. Il est impératif d’associer des antigènes sombres ou importants à des fluorochromes brillants. Le titrage des anticorps doit être effectué pour éviter que l’excès d’anticorps ne se lie aux cellules de manière non spécifique, ce qui pourrait augmenter la coloration de fond et diminuer la résolution. Le titrage des anticorps est effectué en colorant un nombre connu de cellules avec des concentrations décroissantes d’anticorps, afin de déterminer le meilleur indice de séparation36. Cela devrait être répété pour chaque lot d’anticorps. Lors de la préparation et de la coloration de l’échantillon, il est important d’assurer une suspension à cellule unique en évitant Ca++ et Mg++. De plus, l’ajout d’EDTA peut aider à prévenir l’agrégation cellulaire et l’activité enzymatique, ce qui peut entraîner une stimilulation médiée par les anticorps et l’internalisation des marqueurs marqués. Avant l’acquisition des données, les échantillons doivent être correctement suspendus, filtrés et exempts d’agrégats. Le débordement du signal d’un paramètre à l’autre est résolu à l’aide de contrôles de compensation, sous la forme de cellules colorées uniques ou de billes de compensation disponibles dans le commerce35. Une autre considération importante est d’avoir des contrôles appropriés dans chaque expérience. Les cellules non colorées établissent la base de l’autofluorescence. Les contrôles d’isotype ne sont plus considérés comme des contrôles appropriés pour le contrôle en raison d’une liaison non spécifique. L’étape la plus importante pour aider à fabriquer des portes précises est l’utilisation de contrôles FMO. Dans un contrôle FMO, tous les anticorps conjugués sont présents dans la tache, à l’exception de celui qui est contrôlé. Les contrôles FMO permettent de mesurer la propagation de tous les fluorophores dans le canal manquant et permettent ainsi de mettre en place des portes en conséquence. Il est essentiel que suffisamment de cellules soient acquises pour plus de précision. En règle générale, au moins 2 000 événements de la population d’intérêt devraient être collectés. Enfin, les contrôles de compensation, qu’il s’agisse de billes ou de cellules, doivent être exactement adaptés aux fluorochromes utilisés et les contrôles doivent être au moins aussi brillants que les échantillons expérimentaux37.
Dans l’ensemble, l’analyse cytométrique faible des compartiments des cellules B est largement utilisée dans le domaine de l’immunologie. Cette technique peut être utilisée pour étudier les perturbations de l’immunité humorale chez les souris de type sauvage et les souris génétiquement modifiées, dans des états non pathologiques et en cas de défi immunologique.
Déclarations de divulgation
Tous les auteurs sont des employés et des actionnaires de Regeneron Pharmaceuticals, Inc.
Remerciements
Nous remercions Matthew Sleeman pour la lecture critique du manuscrit. Nous remercions également les départements Vivarium Operations et Flow Cytometry Core de Regeneron pour leur soutien à cette recherche.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5 mL safe-lock Eppendorf tubes | Eppendorf | 22363611 | 0.5 mL microcentrifuge tube |
| 1.5mL Eppendorf tubes | Eppendorf | 22364111 | 1.5 mL microcentrifuge tube |
| 15 mL Falcon tubes | Corning | 352097 | 15 mL conical tube |
| 18 gauge needle | BD | 305196 | |
| 25 gauge needle | BD | 305124 | |
| 3 mL syringe | BD | 309657 | |
| 70 mM MACS SmartStrainer | Miltenyi Biotec | 130-110-916 | 70 mM cell strainer |
| 96 well U bottom plate | VWR | 10861-564 | |
| ACK lysis buffer | GIBCO | A1049201 | red blood cell lysis buffer |
| Acroprep Advance 96 Well Filter Plate | Pall Corporation | 8027 | filter plate |
| B220 | eBiosciences | 17-0452-82 | |
| BD CompBead Anti-Mouse Ig/κ | BD | 552843 | compensation beads |
| BD CompBead Anti-Rat Ig/κ | BD | 552844 | compensation beads |
| Bovine Serum Albumin | Sigma-Aldrich | A8577 | BSA |
| BP-1 | BD | 740882 | |
| Brilliant Stain Buffer | BD | 566349 | brilliant stain buffer |
| C-Kit | BD | 564011 | |
| CD11b | BD | 563168 | |
| CD11b | BioLegend | 101222 | |
| CD19 | BD | 560143 | |
| CD21/35 | BD | 562756 | |
| CD23 | BD | 740216 | |
| CD24 (HSA) | BioLegend | 138504 | |
| CD3 | BD | 561388 | |
| CD3 | BioLegend | 100214 | |
| CD43 | BD | 553270 | |
| CD43 | BioLegend | 121206 | |
| CD5 | BD | 563194 | |
| CD93 | BD | 740750 | |
| CD93 | BioLegend | 136504 | |
| DPBS (1x) | ThermoFisher | 14190-144 | DPBS |
| eBioscience Fixable Viability Dye eFluor 506 | ThermoFisher | 65-0866-14 | viability dye |
| Extended Fine Tip Transfer Pipette | Samco | 233 | disposable transfer pipette |
| FACSymphony A3 flow cytometer | BD | custom order | flow cytometer |
| Fc Block, CD16/CD32 (2.4G2) | BD | 553142 | Fc block |
| FlowJo | Flowjo | flow cytometer analysis software | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | automated dissociation tube |
| gentleMACS Octo Dissociator with Heaters | Miltenyi Biotec | 130-095-937 | tissue dissociator instrument |
| GR1 (Ly6C/6G) | BioLegend | 108422 | |
| IgD | BioLegend | 405710 | |
| IgM | eBiosciences | 25-5790-82 | |
| Kappa | BD | 550003 | |
| Lambda | BioLegend | 407308 | |
| paraformaldehyde, 32% Solution | Electron Microscopy Sciences | 15714 | |
| Ter119 | BioLegend | 116220 | |
| True-Stain Monocyte Blocker | BioLegend | 426103 | monocyte blocker |
| UltraPure EDTA, pH 8.0 | ThermoFisher | 15575038 | EDTA |
| Vi-CELL XR | Beckman Coulter | 731050 | cell counter instrument |
Références
- Shepard, H. M., Philips, G. L., Thanos, D., Feldman, M. Developments in therapy with monoclonal antibodies and related proteins. Clinical Medicine. 17 (3), 220 (2017).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Macdonald, L. E., et al. Precise and in situ genetic humanization of 6 Mb of mouse immunoglobulin genes. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5147-5152 (2014).
- Murphy, A. J., et al. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5153-5158 (2014).
- Macdonald, L. E., et al. Kappa-on-Heavy (KoH) bodies are a distinct class of fully-human antibody-like therapeutic agents with antigen-binding properties. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 292-299 (2020).
- Pieper, K., Grimbacher, B., Eibel, H. B-cell biology and development. Journal of Allergy and Clinical Immunology. 131 (4), 959-971 (2013).
- Nagasawa, T. Microenvironmental niches in the bone marrow required for B-cell development. Nature Reviews: Immunology. 6 (2), 107-116 (2006).
- Lund, F. E. Cytokine-producing B lymphocytes-key regulators of immunity. Current Opinion in Immunology. 20 (3), 332-338 (2008).
- Martensson, I. L., Keenan, R. A., Licence, S. The pre-B-cell receptor. Current Opinion in Immunology. 19 (2), 137-142 (2007).
- von Boehmer, H., Melchers, F. Checkpoints in lymphocyte development and autoimmune disease. Nature Immunology. 11 (1), 14-20 (2010).
- Goodnow, C. C., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Zikherman, J., Parameswaran, R., Weiss, A. Endogenous antigen tunes the responsiveness of naive B cells but not T cells. Nature. 489 (7414), 160-164 (2012).
- Melchers, F. Checkpoints that control B cell development. Journal of Clinical Investigation. 125 (6), 2203-2210 (2015).
- Henderson, R. B., et al. A novel Rac-dependent checkpoint in B cell development controls entry into the splenic white pulp and cell survival. Journal of Experimental Medicine. 207 (4), 837-853 (2010).
- Pillai, S., Cariappa, A. The follicular versus marginal zone B lymphocyte cell fate decision. Nature Reviews: Immunology. 9 (11), 767-777 (2009).
- Shahaf, G., Zisman-Rozen, S., Benhamou, D., Melamed, D., Mehr, R. B. Cell Development in the Bone Marrow Is Regulated by Homeostatic Feedback Exerted by Mature B Cells. Frontiers in Immunology. 7, 77 (2016).
- Nemazee, D. Mechanisms of central tolerance for B cells. Nature Reviews: Immunology. 17 (5), 281-294 (2017).
- Petkau, G., Turner, M. Signalling circuits that direct early B-cell development. Biochemical Journal. 476 (5), 769-778 (2019).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-5 (2018).
- Betters, D. M. Use of Flow Cytometry in Clinical Practice. Journal of the Advanced Practioner in Oncology. 6 (5), 435-440 (2015).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews: Immunology. 12 (3), 191-200 (2012).
- Van Epps, H. L. Bringing order to early B cell chaos. Journal of Experimental Medicine. 203 (6), 1389 (2006).
- Hardy, R. R., Carmack, C. E., Shinton, S. A., Kemp, J. D., Hayakawa, K. Resolution and characterization of pro-B and pre-pro-B cell stages in normal mouse bone marrow. Journal of Experimental Medicine. 173 (5), 1213-1225 (1991).
- Allman, D., Pillai, S. Peripheral B cell subsets. Current Opinion in Immunology. 20 (2), 149-157 (2008).
- Shapiro-Shelef, M., Calame, K. Regulation of plasma-cell development. Nature Reviews: Immunology. 5 (3), 230-242 (2005).
- Kitamura, D., Roes, J., Kuhn, R., Rajewsky, K. A B cell-deficient mouse by targeted disruption of the membrane exon of the immunoglobulin mu chain gene. Nature. 350 (6317), 423-426 (1991).
- Keenan, R. A., et al. Censoring of autoreactive B cell development by the pre-B cell receptor. Science. 321 (5889), 696-699 (2008).
- Chan, V. W., Meng, F., Soriano, P., DeFranco, A. L., Lowell, C. A. Characterization of the B lymphocyte populations in Lyn-deficient mice and the role of Lyn in signal initiation and down-regulation. Immunity. 7 (1), 69-81 (1997).
- Zikherman, J., Doan, K., Parameswaran, R., Raschke, W., Weiss, A. Quantitative differences in CD45 expression unmask functions for CD45 in B-cell development, tolerance, and survival. Proceedings of the National Academy of Sciences of the United States of America. 109 (1), 3-12 (2012).
- Miyamoto, A., et al. Increased proliferation of B cells and auto-immunity in mice lacking protein kinase Cdelta. Nature. 416 (6883), 865-869 (2002).
- Mecklenbrauker, I., Kalled, S. L., Leitges, M., Mackay, F., Tarakhovsky, A. Regulation of B-cell survival by BAFF-dependent PKCdelta-mediated nuclear signalling. Nature. 431 (7007), 456-461 (2004).
- Okada, T., et al. Antigen-engaged B cells undergo chemotaxis toward the T zone and form motile conjugates with helper T cells. PLoS Biology. 3 (6), 150 (2005).
- Robinson, J. P. Flow Cytometry. Encyclopedia of Biomaterials and Biomedical Engineering. , 630-640 (2004).
- Lugli, E., Roederer, M., Cossarizza, A. Data analysis in flow cytometry: the future just started. Cytometry A. 77 (7), 705-713 (2010).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. European Journal of Immunology. 47 (10), 1584 (2017).
- Bigos, M. Separation index: an easy-to-use metric for evaluation of different configurations on the same flow cytometer. Current Protocols in Cytometry. , 21 (2007).
- Pillai, S., Mattoo, H., Cariappa, A. B. B cells and autoimmunity. Current Opinion in Immunology. 23 (6), 721-731 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon