Method Article
マウスB細胞の発達におけるフロー細胞量測定
* これらの著者は同等に貢献しました
要約
ここでは、フローサイトメトリーによる腹膜、脾臓、および骨髄組織におけるマウス免疫B細胞区画の不均一性の単純な分析について説明する。プロトコルは、他のマウス組織に適応し、拡張することができます。
要約
広範な研究は、二次リンパ器官におけるマウスB細胞の発達および分化を特徴付けている。B細胞によって分泌される抗体は、単離され、確立された治療薬へと発展してきた。マウスB細胞の発達の検証は、自己免疫性の多いマウスの文脈において、または免疫系を改変したマウスにおいて、マウスにおける治療薬の開発または試験の重要な構成要素であり、フローサイトメトリーの適切な使用である。十分に確立されたB細胞フローサイトメトリックパラメータは、マウス腹膜、骨髄、脾臓におけるB細胞の発達を評価するために使用できますが、多くのベストプラクティスを遵守する必要があります。さらに、B細胞区画のフローサイトメトリクス分析もB細胞開発の追加の読み出しを補完すべきである。この技術を用いて生成されたデータは、野生型、自己免疫しやすいマウスモデル、ならびに治療薬として抗体または抗体様分子を生成するために使用できるヒト化マウスの理解をさらに深めることができます。
概要
モノクローナル抗体は、主流の医学の一部となるにつれて、多くのヒト疾患の選択療法となっています 1,2.我々は、マウスIgH定数3,4を有する完全ヒト可変領域を有する抗体を効率的に産生する遺伝子操作マウスについて以前に説明した。最近では、明確な抗原結合を有する抗体様分子を産生する遺伝子操作マウスについて説明した。抗体はB細胞によって分泌され、体液性免疫の適応の基礎を形成する。B細胞にはB-1とB-2の2つの異なるタイプがあります。哺乳類では、B-1細胞は胎児肝臓に由来し、生後に粘膜組織および胸膜および腹腔に富み、B-2細胞は出生前に胎児肝臓に由来し、その後骨髄(BM)で生まれる。B-2細胞は、脾臓および血液を含む二次リンパ器官で濃縮される6,7,8.BMにおいて、B-2造血前駆物質は、Ig mu重鎖の再配列の開始時にプロB細胞に分化し始める9,10。Ig重鎖のプレB細胞受容体への組み立て(プレBCR)への組み換えが成功し、シグナル伝達および増殖増殖が、B細胞前細胞への分化をもたらす。プレB細胞がIg κ(Igκ)を再配置した後、または非生産的な場合、Igλ(Igλ)軽鎖は、μ重鎖と組み合わせ、表面IgM BCR発現をもたらす。IgM表面発現は自己反応性の条件下で低下することが知られており、機能的に無反応または無値B細胞11,12の自己耐性に寄与することが重要である。その後、未熟なB細胞は過渡期に入り、そこでIgDを共同発現させ、BMから脾臓に移行します。脾臓では、IgD発現がさらに増加し、細胞は移行B細胞の第2段階に成熟し、その後、その成熟状態が完了し、限界領域(MZ)または濾胞(Fol)細胞13、14、15のいずれかに発達する。成体マウスでは、非疾患の設定では、成熟したB細胞の数は、BMで毎日10〜2000万個の未熟なB細胞が生成されているにもかかわらず一定のままである。これらのうち、成熟B細胞のプールに入るのはわずか3%である。末梢B細胞区画のサイズは、自己反応性および不完全な成熟を含むいくつかの要因による細胞死によって制約される16、17、18。フローサイトメトリック解析は、ヒトおよびマウスにおける多くの免疫細胞サブコンパートメントを特徴付け、列挙するために広く使用されてきた。ヒトとマウスB細胞コンパートメントには類似点がいくつかありますが、このプロトコルはマウスB細胞の分析にのみ適用されます。このプロトコルは、遺伝子操作がB細胞の発達を変えるかどうかを判断するために、遺伝子操作されたマウスのフェノタイピングを目的に開発された。フローサイトメトリーは、細胞の活性化、機能、増殖、サイクル分析、DNA含有量分析、アポトーシス、細胞分類19,20など、多くの追加用途でも非常に人気があります。
フローサイトメトリーは、脾臓、BMおよび血液などの複雑な器官を含むマウスおよびヒトにおける様々なリンパ球コンパートメントを特徴付ける選択のツールである。フローサイトメトリー用のマウス特異的抗体試薬が広く利用可能なため、細胞表面タンパク質だけでなく、細胞内リンタンパク質やサイトカイン、機能読み出し21も調べることができます。ここで我々は、フローサイトメトリー試薬が、二次リンパ器官において成熟し、分化するB細胞サブセットを同定するためにどのように使用できるかを示す。染色条件の最適化、サンプル処理、正しい計測器のセットアップおよびデータ取得、そして最後にデータ分析の後、マウスにおけるB細胞区画の包括的なフローサイトメトリック分析用のプロトコルを利用することができる。このような包括的な分析は、ハーディと同僚によって考案された数十年前の命名法に基づいており、B220、CD43、BP-1、CD24、IgMおよびIgD22の発現に応じて、BM B-2細胞の開発を異なる画分(画分)に分割することができる。Hardy et al.は、B220+ CD43 BM B細胞がBP-1およびCD24(30F1)発現に基づいて4つのサブセット(フラクションA-C')に細分化され得ることを示し、B220+ CD43-(薄暗い暗い)BM B細胞はIgDおよびIg3の微分発現に基づいて3つのサブセット(分画D-F)に分解できることを示した。分数A(プレプロB細胞)はBP-1-CD24(30F1)と定義され、フラクションB(初期のプロB細胞)はBP-1-CD24(30F1)+と定義され、フラクションC(後期プロB細胞)はBP-1+CD24(30F1)+と定義され、フラクションCはBP-1+として定義される(前B細胞)はBP-1+として定義される。さらに、分画D(前B細胞)はB220+ CD43-IgM-B細胞と定義され、画分E(新たに生成されたB細胞、未熟および過渡的の組み合わせ)はB220+ CD43-IgM+B細胞と定義され、画分F(成熟、再循環B細胞)と定義される。対照的に、脾臓に見られるナイーブB細胞の大部分は、成熟(B220+CD93-)B細胞と移行(T1、T2、T3)細胞に分けることができるCD93、CD23およびIgMの発現に依存する。成熟B細胞は、IgMおよびCD21/CD35の発現に基づいて、限界領域および濾胞サブセットに分解することができ、濾胞サブセットは、それらのIgMおよびIgD表面発現のレベルに応じて、成熟濾胞型Iおよび濾胞タイプIIB細胞サブセットにさらに分割することができる。これらの脾細胞B細胞集団は主にIgκ軽鎖を発現する。最後に、B-1 B細胞集団は、胎児の肝臓に由来し、主に成体マウスの腹膜および胸膜腔に見られるが、文献に記載されている。これらの腹膜B細胞は、CD23発現の欠如によって先述したB-2B細胞と区別することができる。その後、B-1aまたはB-1b集団にさらに細分化され、前者はCD5の存在によって定義され、後者は不在25によって定義される。B-1細胞前駆細胞は胎児の肝臓に豊富であるが、成人のBMには見られません。B-1aおよびB-1b細胞は異なる前駆細胞に由来するが、両方とも腹膜腔と胸膜腔24を播種する。B-2細胞とは対照的に、B-1細胞は自己再生が可能であり、天然IgM抗体の産生を担っています。
B細胞の発達における欠陥は、BCR26,27の成分の欠陥、BCRシグナル伝達強度に影響を与えるシグナル伝達分子の摂動14,28,29、またはB細胞生存を調節するサイトカインの破壊を含む多くの例で生じる可能性がある30,31.リンパ区画のフローサイトメトリー解析は、これらのマウスおよび他の多くのB細胞の発生ブロックの特性評価に寄与している。リンパ区画のフローサイトメトリック解析の利点の1つは、生きた解離組織から得られた個々の細胞に対して測定を行う能力を提供することです。拡大し続ける蛍光HOREの範囲で試薬が利用できることにより、複数のパラメータを同時に分析することができ、B細胞の不均一性の評価が可能になります。さらに、フロー細胞量分析によるB細胞の列挙は、リンパ器官内の細胞局在化を可視化する免疫組織化学法、液体免疫の尺度としての循環抗体レベルの検出、ならびに2つの光子顕微鏡をリアルタイムおよびtime32で測定する他の免疫学的アッセイを補完する。
プロトコル
すべてのマウス研究は、レジェネロンの制度的動物ケアと使用委員会(IACUC)によって監督され、承認されました。実験は、ジャクソン研究所の3匹のC57BL/6J雌マウス(17週齢)の組織に対して行われた。実験を開始する前にすべての抗体を活性化し、理想的な濃度を決定します。単色補正に補正ビーズを使用する場合は、サンプルよりも明るい色や明るい色で染色してください。すべてのバッファー、抗体、および細胞を氷上または 4 °C に保管してください。 生菌性染料を添加した後、低光または暗い状態で4°Cですべてのステップとインキュベーションを行います。
1. 腹膜細胞の収穫と単一細胞分離
- CO2を使用するか、承認されたプロトコルに従ってマウスを安楽死させます。
- 背中にマウスを置き、70%エタノールでスプレーし、腹膜を切らないで外腹部の皮膚をはさみで切ります。
- 25ゲージ針を装着した3mLの注射器を用いて、氷冷洗浄バッファー(0.5%ウシ血清アルブミン(BSA)DPBS[vol/vol])を腹腔に注入します。
- 腹の指先を軽くマッサージします。
- 手順 1.3 と 1.4 を繰り返します。
- 腹骨を通して18Gの針を取り付けた3mLの注射器を挿入し、臓器や脂肪を避けるように注意してください。
- 洗浄バッファーを抽出し、腹膜細胞を含み、氷上の15 mL円錐管に移します。
- 手順 1.3 と 1.4 を繰り返します。
- ピンセットで持ちこたえながら腹骨に小さな穴を切ります。
- 使い捨て転送ピペットを穴に挿入し、残りの洗浄バッファーを収集し、もう一度脂肪や臓器を避けます。
- 採取した残りの腹膜細胞を氷上の15mL円錐管に移します。
注:血液汚染が明らかな場合は、サンプルを廃棄してください。 - 脾臓と骨の抽出が完了するまで、氷上の細胞をインキュベートします。
- 4°Cで8分間300xgで細胞を遠心分離する。上清を吸引する。
- 細胞ペレットを1mLの洗浄バッファーに再懸濁します。
- 70 μM の細胞ストレーナーを通して、氷上のきれいな 15 mL 円錐形チューブに細胞をフィルターします。
- 細胞カウンター計器またはヘモサイトメーターを使用して細胞濃度を決定します。
2. 脾臓収穫と単一細胞分離
- その腹の上にマウスを置き、きれいなはさみを使用して左裏側の腹腹を切り取ります。脾臓を切り取り、脂肪と結合組織を取り除きます。
- 1 mLの洗浄バッファーを含む1.5 mLマイクロ遠心分離チューブに脾臓を氷上に移します。
- 骨の抽出が完了するまで、氷の上に脾臓をインキュベートします。
- 脾臓を5 mLの赤血球のリシスバッファーを用いた自動解離管に移動します。チューブを組織解離器器具に置き、60 sの解離して単一の細胞懸濁液を作成します。
注:洗浄バッファの曇ったガラススライド間でスマッシングするなど、単細胞脾臓懸濁液を得る他の日常的な方法を使用することも許されます。別の解離方法を使用する場合は、遠心分離、吸引、および5 mLの赤血球リシスバッファーで再懸濁してからステップ2.5に進みます。 - 室温で細胞を3分間インキュベートする。
- 2mM EDTAを含む4°C洗浄バッファーの10 mLを加えます。
- きれいな15 mL円錐形の管に移す。
- 4°Cで8分間300xgで細胞を遠心分離する。 上清を吸引する。
- 4°C洗浄バッファーの5 mLで細胞ペレットを再懸濁します。
- 70 μM の細胞ストレーナーを通して、氷上のきれいな 15 mL 円錐形チューブに細胞をフィルターします。
- 細胞カウンター計器またはヘモサイトメーターを使用して細胞濃度を決定します。
3. BM収穫および単一細胞の分離
- マウス本体の下半分から皮膚を取り除きます。脚から余分な筋肉をトリミングします。.大腿骨を切らないように注意して、脚全体をはさみで取り除く。残りの筋肉、脂肪、足を取り除くことによって大腿骨と脛骨をきれいにします。
- 1 mLの洗浄バッファーを含む1.5 mLマイクロ遠心分離チューブに骨を氷上に移します。
- 0.5 mLマイクロ遠心分離チューブの底部を穿孔し、脚の骨が突き出ないように十分な小さな穴を残します。0.5 mLチューブをクリーンな1.5 mLマイクロ遠心分離チューブに挿入します。大腿骨の端部と脛骨の近位を膝に切り取り、切り端を0.5 mLチューブに下に置きます。
- 4°Cで2分間6,780 x g で細胞を遠心分離する。
- 赤血球のリシスバッファーの1 mLで細胞ペレットを再懸濁し、赤血球のリシスバッファーの追加 3 mL を含む 15 mL 円錐管に転送します。.
- 室温で3分間インキュベートします。
- 2mM EDTAを含む4°C洗浄バッファーの10 mLを加えます。
- 4°Cで8分間300xgで細胞を遠心分離する。 上清を吸引する。
- 細胞ペレットを4°C洗浄バッファーの3 mLに再懸濁します。
- 70 μMの細胞ストレーナーを通して、きれいな15 mLの円錐形チューブに細胞をフィルターします。
- 細胞カウンター計器またはヘモサイトメーターを使用して細胞濃度を決定します。
4.細胞を染色し、補償を準備する
- アリコート106細胞は各動物から96 ウェルU底板まで各細胞型の細胞である。
- 完全な染色、蛍光マイナス1(FMO)、染色されていない、最後に使用される各フルオロフォアのオプションの単色補償を含むすべてのサンプルとコントロールのための十分な井戸を含むようにしてください。
- BM成熟パネルおよび脾臓成熟パネルについては、アリコート細胞を2つのウェルに、ウェルあたり106個の細胞、完全な染色サンプルごとに106 個ずつ含む。単色補正の生存率制御の場合は、各セルタイプの 2 x 106 セルを個々のウェルに追加します。
- プレートを4°Cで2分間845 x g で遠心します。 上清を素早く反転させて、シンクの上にフリックし、井戸を交差しないように注意してデカントします。
- 200 μL の DPBS でセルを再中断します(BSA または FBS を使用しない)。このステップは、アミン反応性の生き生き性染料で染色する前にタンパク質を除去することが重要です。
- ステップ 4.2 と 4.3 を繰り返します。
- ステップ 4.2 を繰り返します。
- DPBSで1:1,000を希釈した100μLの生き生き性染料で細胞を再懸濁する。
注:単色補正にセルを使用する場合は、それらのウェルに生存性染料を追加しないでください。- 各染色セットについて、完全に染色されていないサンプルと必要な他のコントロールのためにいくつかの染色されていない井戸を残します。
- 各染色セットについて、生存率FMO制御のために追加の染色されていない井戸を残します。
- 単色生存率補償コントロールの場合:ステップ4.1で200μLの希釈生存率染料で2 x 106 細胞を再中断します。100 μL の細胞を 1.5 mL マイクロ遠心分離チューブに移し、65 °C で 5 分間加熱し、100 μL の残存生細胞で 100 μL の熱死細胞を元のウェルに戻します。
- 4°Cで細胞をインキュベートし、光から保護し、30分間培養する。
- プレートを4°Cで2分間845 x g で遠心します。 上清を素早く反転させて、シンクの上にフリックし、井戸を交差しないように注意してデカントします。
- 200 μL の DPBS でセルを再中断します(BSA または FBS を使用しない)。
- 手順 4.8 と 4.9 を繰り返します。
- ステップ 4.8 を繰り返します。
- 染色バッファー(DPBS [vol/vol]の 0.5% BSA) で 1:50 (最終濃度 = 10 μg/mL) を希釈した Fc ブロックの 50 μL で細胞を再中断します。
- 腹膜細胞の場合-非特異的な染色を減らすために5μLの単球ブロッカーも加える。
- 細胞を光から保護した4°Cで15分間インキュベートします。
- 完全な染色マスターミックスとFMOを染色バッファに用意し、106 個の細胞あたり100 μlの最終容積を準備します。抗体リストについては 、表1-表4 を参照してください。
注:FMOは、1つを除くすべての抗体を染色セットに含めることによって作られます。各抗体のFMOを染色セットで準備します。染色セットに複数のブリリアント染料が含まれている場合、サンプルあたりの染色バッファー用に50 μLのブリリアントステインバッファーを代用 - Fcブロックを取り外さずに、100 μLのフルステインミックスとFMOを選択したウェルに追加します。
- 染色セット内の各抗体に対して単色補正コントロールを用意します。
- 補償ビーズを使用する場合は、使用するために製造の指示に従ってください。
- 細胞を使用する場合、100μL染色バッファーで、100 μL染色体で、前に工程4.6.1で生存率染めなしで予約された106 細胞に滴定抗体を添加する。サンプル内のすべてのセルが特定のマーカーに対して正の場合は、フローサイトメーターで補正データを取得するときに使用される染色されていないセルを確保します。
- 細胞とビーズを4°Cでインキュベートし、光から保護し、30分間培養します。
- プレートを4°Cで2分間845 x g で遠心します。 上清を素早く反転させて、シンクの上にフリックし、井戸を交差しないように注意してデカントします。
- 200 μL の染色バッファーで細胞とビーズを再懸濁します。
- ステップ 4.18 と 4.19 を 2 回繰り返します。
- ステップ 4.18 を繰り返します。
- 48時間以内の分析のためにサンプルを固定するには、DPBSで2%パラホルムアルデヒドの200 μLで細胞とビーズを再懸濁します。
注意:パラフォマルデヒドは深刻な健康被害であり、可燃性です。使用前に、Safty データ シートを参照してください。 - 細胞とビーズを4°Cでインキュベートし、光から保護し、30分間培養します。
- ステップ 4.18 と 4.19 を 2 回繰り返します。
- きれいな96ウェルU-底板の上にフィルタープレートを置きます。マルチピペットを使用して、各サンプルをフィルタープレートのウェルに移します。
- フィルタープレート-96ウェルU-底板の設定を4°Cで2分間2分間845 x g に遠心します。 フィルタープレートを取り外し、上清を素早く反転させて、シンク上でプレートをフリックし、井戸を交差しないように注意します。
- BMおよび脾臓成熟パネルについては、完全に染色された細胞を100 μLの染色バッファに再懸濁します。各動物のための2つの井戸を1井戸に組み合わせます。残りのパネル、FMO、およびコントロールを200 μLの汚れバッファーで再中断します。
- 固定細胞とビーズを4°Cでインキュベートし、一晩光から保護します。
5. フローサイトメトリックデータ取得
- メーカーの指示に従ってフローサイトメーターを初期化し、QCします。
- 各パネルに固有のテンプレートをロードします。
- データを記録する前に、各サンプルのすべてのイベントがスケールで、ドットプロットに表示されていることを確認してください。
- ステップ4.16で作成した単一の汚れ補償を使用して、各染色パネルの補償制御を記録します。各サンプルに正のゲートと負のゲートを設定します。ソフトウェアに補償行列を計算してもらいます。
- 最初のサンプルの取得を開始し、ゲートが適切に設定されていることを確認します。
- 腹膜B細胞パネルと脾臓IgκおよびIgλパネルの少なくとも50,000 B細胞イベントを記録するようにマシンを設定します。BM成熟パネルのための150,000 B細胞イベント;脾臓成熟パネルのための300,000 B細胞イベント。
- 各染色パネルについて、動物、染色されていないサンプル、およびFMOの完全に染色されたサンプルを実行して記録します。
6. データの分析
- フローサイトメトリー解析ソフトウェアを用いたデータ解析を進める。図 1、図 2、図 3、図 4 に示す格言の戦略に従います。
結果
ここでは、マウス腹膜、BMおよび脾臓におけるB細胞の発達を特徴付けるための格言戦略を提示する。分析の基礎は、生存性染料で染色し、前方散乱領域(FSC-A)と前方散乱高さ(FSC-H)に基づいてダブレットをゲーティングし、最後にFSC-Aおよび側散乱領域(SSC-A)特性に従って細胞を選択することによって破片を取り除くという概念を中心に形成され、ここでの大きさは、セルの大きさ、つまり、セルの高さである 関心のある人口に基づいて行く前に。
腹膜B細胞のフローサイトメトリック解析は、生存可能な腹膜細胞、総B細胞、B-1およびB-2サブセット、ならびにC57BL/6JマウスにおけるB-1aおよびB-1b細胞の頻度を示す(図1)、 表1に概説した染色パネルを用いた。これらの周波数の平均絶対セル数を 表5に示す。B-1細胞における摂動は、細胞の周波数またはマウスあたりの絶対細胞数のいずれかによって、細胞サブセットの分布によって描き出すことができる。
BM B細胞のフローサイトメトリック解析は、生存可能なBM細胞、総B細胞、フラクションA(プレプロB細胞および汚染リンパ球)、プリプロB細胞、画分B、画分C、画数C、フラクションD、未熟(画分E中サブセット)、移行期(画端Eのサブセット)、およびC57BL/6JマウスにおけるフラクションFB細胞の頻度を示す(図2)、これらの周波数の平均絶対セル数を表6に示す。BM B細胞における摂動は、細胞の頻度または1脚あたりの絶対細胞数によって、細胞サブセットの分布によって表される可能性がある。
脾臓B細胞のフロー細胞測定解析は、生存可能な脾細胞、総B細胞、移行B細胞、T1、T2、T3細胞、成熟B細胞、濾胞I細胞(Fol I)、卵胞II(Fol II)細胞、限界領域(MZ)前駆細胞、成熟MZ細胞、およびB-1細胞の頻度を示す3つの染色法を示すこれらの周波数の平均絶対セル数を表7に示す。脾臓B細胞における摂動は、細胞の頻度または脾臓あたりの絶対細胞数のいずれかによって、細胞サブセットの分布によって線引することができる。
同様に、脾臓のフローサイトメトリック分析は、C57BL/6JマウスにおけるIgκ+およびIgλ+B細胞の周波数を示し(図4)、 表4に概説した染色パネルを用いた。これらの周波数の平均絶対セル数を 表8に示す。Igκ+ およびIgλ+ B細胞の摂動は、細胞の頻度または脾臓あたりの絶対細胞数のいずれかによって、細胞サブセットの分布によって分線化することができる。
| 抗体 | フルオロフォア | クローン |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| イグム | ペシー7 | II/41 |
| イグド | パーCpCy5.5 | 11-26c.2a |
| CD43 | フィット | S7 |
| CD23 | BUV395 | B3B4 |
| CD11b | BV711 | M1/70 |
| CD5 | BV605 | 53-7.3 |
表1:腹膜Bセルパネル
| 抗体 | フルオロフォア | クローン |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| イグム | ペシー7 | II/41 |
| イグド | パーCpCy5.5 | 11-26c.2a |
| CD43 | フィット | 1B11 |
| CD24 (HSA) | PE | 30-F1 |
| Cキット | BUV395 | 2B8 |
| BP-1 | BV786 | BP-1 |
| CD93 | BV711 | AA4.1 |
| ダンプ チャネル | ||
| CD3 | AF700 | 17-A2 |
| CD11b | AF700 | M1/70 |
| GR1 (Ly6C/6G) | AF700 | RB6-8C5 |
| テル119 | AF700 | TER-119 |
表2:骨髄成熟パネル
| 抗体 | フルオロフォア | クローン |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| イグム | ペシー7 | II/41 |
| イグド | パーCpCy5.5 | 11-26c.2a |
| CD43 | フィット | S7 |
| CD23 | BUV395 | B3B4 |
| CD21/35 | BV421 | 7G6 |
| CD11b | AF700 | M1/70 |
| CD5 | BV605 | 53-7.3 |
| CD93 | PE | AA4.1 |
表3:脾臓成熟パネル
| 抗体 | フルオロフォア | クローン |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| イグム | ペシー7 | II/41 |
| イグド | パーCpCy5.5 | 11-26c.2a |
| CD3 | PB | 17-A2 |
| カッパ | フィット | 187.1 |
| ラムダ | PE | RML-42 |
表 4: 脾臓 Igκ および Igλ パネル
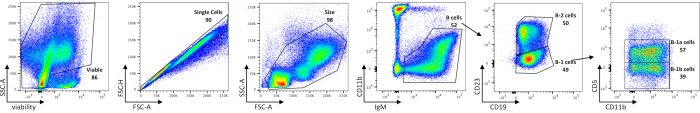
図1:腹関節におけるB細胞集団の特性評価 生存可能な単一細胞、サイズゲート付き腹膜B細胞は、まずIgM+細胞上でゲートすることにより汚染細胞から分離される。次いでB-1細胞とB-2細胞は、不在(B-1)またはCD23(B-2)の存在によって互いに区別される。次のCD5発現はB-1b細胞(CD5-)からB-1a細胞(CD5+)を線引するのに用いられる。FMOは、ゲートを描画する場所を経験的に決定するために使用されました。数値は、同じ密度プロット内の各母集団のパーセンテージです。この図の大きなバージョンを表示するには、ここをクリックしてください。
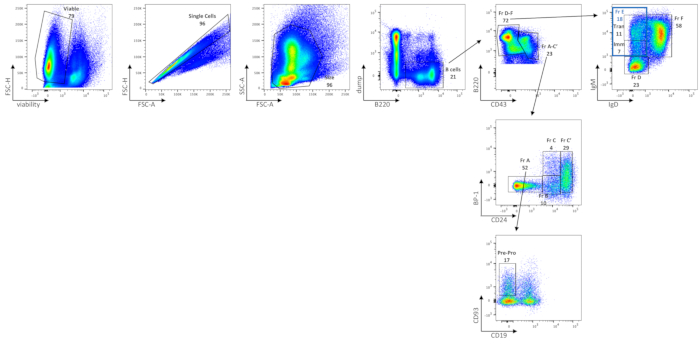
図2:BMにおけるBセルサブセットの特性評価生存可能な単一セル、サイズゲート付きBM B細胞は、B220+ダンプ(ダンプはCD3/GR-1/CD11b/TER119)細胞上でゲートすることにより非B細胞から分離される。CD43 および B220 表現は、ハーディフラクション A-C (CD43+ B220+ ) およびハーディフラクション D-F (CD43low/neg B220+/++) をさらに定義します。分率A−C'は、BP−1およびCD24の発現によってさらに分離される。フラクションA(BP-1-CD24-)は、汚染細胞と共にプロB細胞前に対応する。 プロB細胞を分画Aの汚染細胞から分離するために、CD93の発現とCD19の不在が利用される。フラクションB(BP-1-CD24int)および画分C(BP-1+CD24int)はそれぞれ初期および後期のプロB細胞に対応し、画分C'(BP-1+/-CD24+)は初期のプレB細胞に対応する。分画D-Fを分離するために、IgMとIgDの発現が利用される。分率Dは、後期B細胞(IgM-/低IgD-)に相当する。フラクションE(青いゲート、IgMint/高IgD-)の両方に未熟(Imm、IgMint IgD-)および移行(トラン、IgMhigh IgD-)B細胞;そしてフラクションF(IgMint/高IgD+)を成熟B細胞に再循環させる。FMOは、ゲートを描画する場所を経験的に決定するために使用されました。数値は、同じ密度プロット内の各母集団のパーセンテージです。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:脾臓B細胞成熟の特徴付け生存可能な単一細胞、サイズゲート化脾臓B細胞は、B220+細胞上でゲートすることにより非B細胞から分離される。B-1サブセットを同定するために、CD23−CD19+細胞はCD43の発現によって同定され、定義される。B-2集団を分類するために、CD19+細胞は移行期(CD93+B220+)および成熟(CD93-B220+)B細胞に分離される。移行期(CD93+B220+)細胞は、さらにT1(IgM+ CD23-)、T2(IgM+ CD23+)、およびT3(IgMint CD23+)集団に分けられる。成熟した(CD93-B220+)細胞は、限界領域(CD21/35+IgM+)および濾胞(CD21/35int IgMint/+)B細胞に分離される。CD23の発現は、より成熟したMZ(CD23-B220+)細胞からMZ前駆体(CD23+B220+)細胞を分離するためにさらに使用される。その後、濾胞集団は、Fol I(IgD+ IgMint)およびFol II(IgD+ IgM+)細胞に線引されます。FMOは、ゲートを描画する場所を経験的に決定するために使用されました。数値は、同じ密度プロット内の各母集団の割合であるこの図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:脾細胞B細胞のIgκおよびIgλ発現生存可能な単一細胞、サイズゲート化脾臓B細胞は、B220+CD3-細胞上でゲートすることにより非B細胞から分離される。次に、B細胞はIgλとIgκの発現によって区別される。数値は、同じ密度プロット内の各母集団のパーセンテージです。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 絶対セル番号 | |||||
| 動物番号 | 生存可能な腹膜細胞 | B細胞 | B-1a細胞 | B-1b細胞 | B-2細胞 |
| 1 | 1.02E+07 | 4.67E+06 | 1.28E+06 | 8.95E+05 | 2.35E+06 |
| 2 | 9.92E+06 | 4.52E+06 | 1.49E+06 | 9.60E+05 | 1.91E+06 |
| 3 | 1.15E+07 | 4.56E+06 | 1.71E+06 | 9.19E+05 | 1.78E+06 |
| 平均 | 1.05E+07 | 4.58E+06 | 1.49E+06 | 9.25E+05 | 2.01E+06 |
表5 腹膜B細胞サブセットの絶対細胞数
| 絶対セル番号 | |||||||||||
| 動物番号 | 生存可能な骨髄細胞 | B細胞 | 分数A | プレプロ | 分数B | 分数C | 分数C' | 分数 D | 幼稚 | 過渡期の | フラクション F |
| 1 | 5.05E+07 | 9.70E+06 | 1.13E+06 | 1.95E+05 | 2.22E+05 | 9.14E+04 | 6.31E+05 | 1.59E+06 | 4.56E+05 | 7.81E+05 | 4.03E+06 |
| 2 | 5.39E+07 | 1.03E+07 | 1.14E+06 | 2.29E+05 | 2.89E+05 | 1.22E+05 | 8.40E+05 | 2.11E+06 | 5.39E+05 | 8.07E+05 | 3.67E+06 |
| 3 | 5.93E+07 | 1.01E+07 | 1.10E+06 | 2.12E+05 | 2.84E+05 | 1.05E+05 | 9.02E+05 | 2.72E+06 | 5.94E+05 | 7.62E+05 | 2.59E+06 |
| 平均 | 5.46E+07 | 1.00E+07 | 1.12E+06 | 2.12E+05 | 2.65E+05 | 1.06E+05 | 7.91E+05 | 2.14E+06 | 5.29E+05 | 7.83E+05 | 3.43E+06 |
表 6: 骨髄 B 細胞サブセットの絶対細胞数
| 絶対セル番号 | ||||||||||||
| 動物番号 | 実行可能な脾臓細胞 | B細胞 | 移行B細胞 | T1 セル | T2 細胞 | T3細胞 | 成熟B細胞 | 濾胞I細胞 | 濾胞II細胞 | 前駆体限界ゾーンセル | 成熟した限界ゾーン細胞 | B-1細胞 |
| 1 | 9.16E+07 | 4.61E+07 | 3.66E+06 | 1.55E+06 | 1.10E+06 | 7.16E+05 | 4.06E+07 | 2.39E+07 | 5.27E+06 | 2.17E+06 | 3.98E+06 | 8.83E+05 |
| 2 | 9.97E+07 | 5.18E+07 | 4.88E+06 | 1.97E+06 | 1.57E+06 | 1.00E+06 | 4.49E+07 | 2.68E+07 | 7.33E+06 | 3.42E+06 | 3.84E+06 | 8.15E+05 |
| 3 | 1.02E+08 | 5.34E+07 | 4.64E+06 | 1.98E+06 | 1.41E+06 | 8.54E+05 | 4.62E+07 | 2.81E+07 | 5.84E+06 | 3.58E+06 | 4.02E+06 | 1.01E+06 |
| 平均 | 9.77E+07 | 5.04E+07 | 4.39E+06 | 1.83E+06 | 1.36E+06 | 8.58E+05 | 4.39E+07 | 2.63E+07 | 6.15E+06 | 3.06E+06 | 3.94E+06 | 9.02E+05 |
表7:脾細胞B細胞サブセットの絶対細胞数
| 絶対セル番号 | ||||
| 動物番号 | 生存可能な脾臓細胞 | B細胞 | Igκ+ B細胞 | Igλ+ B細胞 |
| 1 | 9.16E+07 | 4.97E+07 | 4.51E+07 | 2.46E+06 |
| 2 | 9.97E+07 | 5.63E+07 | 5.08E+07 | 3.16E+06 |
| 3 | 1.02E+08 | 5.91E+07 | 5.33E+07 | 3.24E+06 |
| 平均 | 9.77E+07 | 5.50E+07 | 4.97E+07 | 2.95E+06 |
表8:IgκおよびIgλB細胞サブセットの絶対細胞数
ディスカッション
リンパ球組織と非リンパ組織のフローサイトメトリック解析により、1980年代以降、マウスとヒトにおけるB細胞サブ集団の同時同定と列挙が可能になった。これは、液性免疫の尺度として使用されており、さらにB細胞の機能性を評価するために適用することができます。この方法は、試薬の可用性を利用して、マウスおよびヒトにおけるB細胞成熟の異なる段階を評価し、複数のパラメータを同時に分析することにより、稀な集団であってもB細胞の不均一性の評価を可能にする。複雑な異種サンプルを測定するために使用すれば、それは、個々のcells33上で、数分以内にサブ集団を検出することができる。流動サイトメトリック解析に最も頻繁に適用される逐次格言解析戦略は、特定の集団を特定する必要がある場合に、単純かつ直感的にすることができます34。最後に、フローサイトメトリーのもう一つの利点は、経験豊富なユーザーの指導の下で、ほとんどの学術ラボで簡単に適応できることです。我々のプロトコルは、B-1集団を記述および列挙し、B-2プロB細胞、前B細胞、未熟、過渡期および成熟B細胞の発達ならびにIgκまたはIgλ軽鎖の表面発現を掘り下げ、マウスの腹膜、BM、および脾臓におけるB細胞集団の評価を正常に記述する。フローサイトメトリーは、マウスのB細胞の発達を調査する際に最も広く使用され、最も簡単な方法です。
フローサイトメトリーは貴重なデータを生成しますが、免疫B細胞コンパートメントの不均一性を調査するために使用される場合、この技術にはいくつかの限界があります。10 色染色で 1,024 以上の異なる細胞母集団34 の認識が可能になるため、膨大なデータセットが圧倒的になる可能性があります。一般的に使用されるリンパ球細胞マーカーの一部は、当初考えられていたよりも特異的でないことが証明されていることを考慮する必要があります。.これは、所望の集団の格言を確認するために多数の細胞表面マーカーを採用することによって解決することができる。フローサイトメトリー解析は簡単で直感的ですが、フローサイトメトリック解析のもう 1 つの制約は、通常は 2 つのパラメータのみを一度に視覚化できることですが、t-SNE などのデータ視覚化ツールを使用すると、高いパラメータ フロー サイトメトリーを使用する場合にセル集団をより効率的にクラスター化できます。もう 1 つの重要な制限は、取得と解析の両方で使用されるゲートが、オペレータの主観性に依存する場合があることです。
このプロトコルの適合または複製を成功させるためには、考慮すべき重要なパラメータがいくつかあります。パネルデザインとフッ化クロムの選択には慎重に検討する必要があります。薄暗い抗原や重要な抗原と明るい蛍光色素を組み合わせる必要があります。抗体滴定は、細胞に過剰な抗体結合を非特異的に回避し、バックグラウンド染色および分解能の低下を避けるために行わなければならない。抗体滴定は、抗体の濃度を減少させる既知の数の細胞を染色することによって行われ、最良の分離インデックス36を決定する。これは、抗体のすべてのロットのために繰り返されるべきです.サンプルの調製および染色中に、Ca++ および Mg++ を避けることで、単一のセルの中断を保証することが重要です。さらに、EDTAの添加は、標識マーカーの抗体媒介体スティミルレーションおよび内在化につながる細胞凝集および酵素活性を防ぐのに役立ちます。データ取得の前に、サンプルは適切に中断され、フィルタリングされ、集計が含まれていなければなりません。あるパラメータから別のパラメータへのシグナルの波及は、単一の染色された細胞または市販の報酬ビーズ35の形態で、補償制御を用いて解決される。もう 1 つの重要な考慮事項は、各実験で適切なコントロールを持つ必要があります。染色されていない細胞は、自己蛍光のベースラインを確立します。アイソタイプコントロールは、非特異的な結合のために、もはや適切な制御と見なされません。正確なゲートを作成する上で最も重要なステップは、FMO コントロールの使用です。FMO制御では、すべての共役抗体が、制御されている抗体を除いて染色体に存在する。FMOコントロールは、すべての蛍光体を欠落したチャネルに広がって測定することを可能にし、それに応じてゲートを設定することを可能にする。精度を高めるには十分なセルを獲得することが重要です。経験則として、関心のある人口の少なくとも2,000のイベントを収集する必要があります。最後に、報酬制御は、ビーズまたは細胞のいずれであっても、利用されているフルオロクロムと正確に一致し、コントロールは少なくとも実験サンプル37と同じ明るさでなければならない。
全体として、B細胞区画の低細胞量分析は、免疫学分野で広く使用されている。この技術は、非疾患状態および免疫学的課題の下で、野生型および遺伝子組み換えマウスの両方における体液性免疫の摂動を調べるのに使用することができる。
開示事項
すべての著者は、レジェネロン・ファーマシューティカルズ社の従業員および株主です。
謝辞
原稿を批判的に読んでくださったマシュー・スリーマンに感謝します。また、この研究を支援してくれたRegeneronのビバリウム・オペレーション部門とフローサイトメトリーコア部門に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.5 mL safe-lock Eppendorf tubes | Eppendorf | 22363611 | 0.5 mL microcentrifuge tube |
| 1.5mL Eppendorf tubes | Eppendorf | 22364111 | 1.5 mL microcentrifuge tube |
| 15 mL Falcon tubes | Corning | 352097 | 15 mL conical tube |
| 18 gauge needle | BD | 305196 | |
| 25 gauge needle | BD | 305124 | |
| 3 mL syringe | BD | 309657 | |
| 70 mM MACS SmartStrainer | Miltenyi Biotec | 130-110-916 | 70 mM cell strainer |
| 96 well U bottom plate | VWR | 10861-564 | |
| ACK lysis buffer | GIBCO | A1049201 | red blood cell lysis buffer |
| Acroprep Advance 96 Well Filter Plate | Pall Corporation | 8027 | filter plate |
| B220 | eBiosciences | 17-0452-82 | |
| BD CompBead Anti-Mouse Ig/κ | BD | 552843 | compensation beads |
| BD CompBead Anti-Rat Ig/κ | BD | 552844 | compensation beads |
| Bovine Serum Albumin | Sigma-Aldrich | A8577 | BSA |
| BP-1 | BD | 740882 | |
| Brilliant Stain Buffer | BD | 566349 | brilliant stain buffer |
| C-Kit | BD | 564011 | |
| CD11b | BD | 563168 | |
| CD11b | BioLegend | 101222 | |
| CD19 | BD | 560143 | |
| CD21/35 | BD | 562756 | |
| CD23 | BD | 740216 | |
| CD24 (HSA) | BioLegend | 138504 | |
| CD3 | BD | 561388 | |
| CD3 | BioLegend | 100214 | |
| CD43 | BD | 553270 | |
| CD43 | BioLegend | 121206 | |
| CD5 | BD | 563194 | |
| CD93 | BD | 740750 | |
| CD93 | BioLegend | 136504 | |
| DPBS (1x) | ThermoFisher | 14190-144 | DPBS |
| eBioscience Fixable Viability Dye eFluor 506 | ThermoFisher | 65-0866-14 | viability dye |
| Extended Fine Tip Transfer Pipette | Samco | 233 | disposable transfer pipette |
| FACSymphony A3 flow cytometer | BD | custom order | flow cytometer |
| Fc Block, CD16/CD32 (2.4G2) | BD | 553142 | Fc block |
| FlowJo | Flowjo | flow cytometer analysis software | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | automated dissociation tube |
| gentleMACS Octo Dissociator with Heaters | Miltenyi Biotec | 130-095-937 | tissue dissociator instrument |
| GR1 (Ly6C/6G) | BioLegend | 108422 | |
| IgD | BioLegend | 405710 | |
| IgM | eBiosciences | 25-5790-82 | |
| Kappa | BD | 550003 | |
| Lambda | BioLegend | 407308 | |
| paraformaldehyde, 32% Solution | Electron Microscopy Sciences | 15714 | |
| Ter119 | BioLegend | 116220 | |
| True-Stain Monocyte Blocker | BioLegend | 426103 | monocyte blocker |
| UltraPure EDTA, pH 8.0 | ThermoFisher | 15575038 | EDTA |
| Vi-CELL XR | Beckman Coulter | 731050 | cell counter instrument |
参考文献
- Shepard, H. M., Philips, G. L., Thanos, D., Feldman, M. Developments in therapy with monoclonal antibodies and related proteins. Clinical Medicine. 17 (3), 220 (2017).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Macdonald, L. E., et al. Precise and in situ genetic humanization of 6 Mb of mouse immunoglobulin genes. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5147-5152 (2014).
- Murphy, A. J., et al. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5153-5158 (2014).
- Macdonald, L. E., et al. Kappa-on-Heavy (KoH) bodies are a distinct class of fully-human antibody-like therapeutic agents with antigen-binding properties. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 292-299 (2020).
- Pieper, K., Grimbacher, B., Eibel, H. B-cell biology and development. Journal of Allergy and Clinical Immunology. 131 (4), 959-971 (2013).
- Nagasawa, T. Microenvironmental niches in the bone marrow required for B-cell development. Nature Reviews: Immunology. 6 (2), 107-116 (2006).
- Lund, F. E. Cytokine-producing B lymphocytes-key regulators of immunity. Current Opinion in Immunology. 20 (3), 332-338 (2008).
- Martensson, I. L., Keenan, R. A., Licence, S. The pre-B-cell receptor. Current Opinion in Immunology. 19 (2), 137-142 (2007).
- von Boehmer, H., Melchers, F. Checkpoints in lymphocyte development and autoimmune disease. Nature Immunology. 11 (1), 14-20 (2010).
- Goodnow, C. C., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Zikherman, J., Parameswaran, R., Weiss, A. Endogenous antigen tunes the responsiveness of naive B cells but not T cells. Nature. 489 (7414), 160-164 (2012).
- Melchers, F. Checkpoints that control B cell development. Journal of Clinical Investigation. 125 (6), 2203-2210 (2015).
- Henderson, R. B., et al. A novel Rac-dependent checkpoint in B cell development controls entry into the splenic white pulp and cell survival. Journal of Experimental Medicine. 207 (4), 837-853 (2010).
- Pillai, S., Cariappa, A. The follicular versus marginal zone B lymphocyte cell fate decision. Nature Reviews: Immunology. 9 (11), 767-777 (2009).
- Shahaf, G., Zisman-Rozen, S., Benhamou, D., Melamed, D., Mehr, R. B. Cell Development in the Bone Marrow Is Regulated by Homeostatic Feedback Exerted by Mature B Cells. Frontiers in Immunology. 7, 77 (2016).
- Nemazee, D. Mechanisms of central tolerance for B cells. Nature Reviews: Immunology. 17 (5), 281-294 (2017).
- Petkau, G., Turner, M. Signalling circuits that direct early B-cell development. Biochemical Journal. 476 (5), 769-778 (2019).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-5 (2018).
- Betters, D. M. Use of Flow Cytometry in Clinical Practice. Journal of the Advanced Practioner in Oncology. 6 (5), 435-440 (2015).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews: Immunology. 12 (3), 191-200 (2012).
- Van Epps, H. L. Bringing order to early B cell chaos. Journal of Experimental Medicine. 203 (6), 1389 (2006).
- Hardy, R. R., Carmack, C. E., Shinton, S. A., Kemp, J. D., Hayakawa, K. Resolution and characterization of pro-B and pre-pro-B cell stages in normal mouse bone marrow. Journal of Experimental Medicine. 173 (5), 1213-1225 (1991).
- Allman, D., Pillai, S. Peripheral B cell subsets. Current Opinion in Immunology. 20 (2), 149-157 (2008).
- Shapiro-Shelef, M., Calame, K. Regulation of plasma-cell development. Nature Reviews: Immunology. 5 (3), 230-242 (2005).
- Kitamura, D., Roes, J., Kuhn, R., Rajewsky, K. A B cell-deficient mouse by targeted disruption of the membrane exon of the immunoglobulin mu chain gene. Nature. 350 (6317), 423-426 (1991).
- Keenan, R. A., et al. Censoring of autoreactive B cell development by the pre-B cell receptor. Science. 321 (5889), 696-699 (2008).
- Chan, V. W., Meng, F., Soriano, P., DeFranco, A. L., Lowell, C. A. Characterization of the B lymphocyte populations in Lyn-deficient mice and the role of Lyn in signal initiation and down-regulation. Immunity. 7 (1), 69-81 (1997).
- Zikherman, J., Doan, K., Parameswaran, R., Raschke, W., Weiss, A. Quantitative differences in CD45 expression unmask functions for CD45 in B-cell development, tolerance, and survival. Proceedings of the National Academy of Sciences of the United States of America. 109 (1), 3-12 (2012).
- Miyamoto, A., et al. Increased proliferation of B cells and auto-immunity in mice lacking protein kinase Cdelta. Nature. 416 (6883), 865-869 (2002).
- Mecklenbrauker, I., Kalled, S. L., Leitges, M., Mackay, F., Tarakhovsky, A. Regulation of B-cell survival by BAFF-dependent PKCdelta-mediated nuclear signalling. Nature. 431 (7007), 456-461 (2004).
- Okada, T., et al. Antigen-engaged B cells undergo chemotaxis toward the T zone and form motile conjugates with helper T cells. PLoS Biology. 3 (6), 150 (2005).
- Robinson, J. P. Flow Cytometry. Encyclopedia of Biomaterials and Biomedical Engineering. , 630-640 (2004).
- Lugli, E., Roederer, M., Cossarizza, A. Data analysis in flow cytometry: the future just started. Cytometry A. 77 (7), 705-713 (2010).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. European Journal of Immunology. 47 (10), 1584 (2017).
- Bigos, M. Separation index: an easy-to-use metric for evaluation of different configurations on the same flow cytometer. Current Protocols in Cytometry. , 21 (2007).
- Pillai, S., Mattoo, H., Cariappa, A. B. B cells and autoimmunity. Current Opinion in Immunology. 23 (6), 721-731 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved