Method Article
Caracterización citométrica de flujo del desarrollo de células B murinas
* Estos autores han contribuido por igual
En este artículo
Resumen
Describimos aquí un análisis simple de la heterogeneidad del compartimento de células B inmunes murinas en el peritoneo, el bazo y los tejidos de la médula ósea por citometría de flujo. El protocolo se puede adaptar y extender a otros tejidos de ratón.
Resumen
Extensos estudios han caracterizado el desarrollo y la diferenciación de las células B murinas en los órganos linfoides secundarios. Los anticuerpos secretados por las células B han sido aislados y desarrollados en terapias bien establecidas. La validación del desarrollo de células B murinas, en el contexto de ratones propensos a la autoinmunidad, o en ratones con sistemas inmunes modificados, es un componente crucial del desarrollo o prueba de agentes terapéuticos en ratones y es un uso apropiado de la citometría de flujo. Se pueden utilizar parámetros citométricos de flujo de células B bien establecidos para evaluar el desarrollo de células B en el peritoneo murino, la médula ósea y el bazo, pero se deben seguir una serie de mejores prácticas. Además, el análisis citométrico de flujo de los compartimentos de células B también debe complementar las lecturas adicionales del desarrollo de células B. Los datos generados utilizando esta técnica pueden ampliar nuestra comprensión de los modelos de ratón propensos autoinmunes de tipo salvaje, así como de los ratones humanizados que se pueden usar para generar anticuerpos o moléculas similares a anticuerpos como terapéuticos.
Introducción
Los anticuerpos monoclonales se han convertido cada vez más en la terapia de elección para muchas enfermedades humanas a medida que se convierten en parte de la medicina convencional1,2. Hemos descrito previamente ratones genéticamente modificados que producen eficientemente anticuerpos que albergan regiones variables completamente humanas con constantes de IgH de ratón3,4. Más recientemente, hemos descrito ratones genéticamente modificados que producen moléculas similares a anticuerpos que tienen una unión a antígenos distinta5. Los anticuerpos son secretados por las células B y forman la base de la inmunidad humoral adaptativa. Hay dos tipos distintos de células B, B-1 y B-2. En los mamíferos, las células B-1 se originan en el hígado fetal y se enriquecen en los tejidos de la mucosa y las cavidades pleural y peritoneal después del nacimiento, mientras que las células B-2 se originan en el hígado fetal antes del nacimiento y posteriormente en la médula ósea (BM). Las células B-2 se enriquecen en órganos linfoides secundarios, incluyendo el bazo y la sangre6,7,8. En el BM, los progenitores hematopoyéticos B-2 comienzan a diferenciarse a células pro-B al iniciar el reordenamiento de la cadena pesada Ig mu9,10. El reordenamiento exitoso de la cadena pesada de Ig y su ensamblaje en el receptor de células pre-B (pre-BCR), junto con la señalización y la expansión proliferativa, conduce a la diferenciación a células pre-B. Después de que las células pre-B reorganizan sus cadenas ligeras Ig kappa (Igκ), o si son improductivas, Ig lambda (Igλ), se emparejan con μ cadena pesada, lo que resulta en la expresión superficial de IgM BCR. Es importante señalar que se sabe que la expresión superficial de IgM se reduce en condiciones de autorreactividad, contribuyendo así a la autotolerancia en células B funcionalmente insensibles o anérgicas11,12. Las células B inmaduras entran en una etapa de transición, donde comienzan a coexpresar IgD y migran de la BM al bazo. En el bazo, la expresión de IgD aumenta aún más y las células maduran en una segunda etapa de células B de transición, seguida de la finalización de su estado de maduración y el desarrollo en células de zona marginal (MZ) o foliculares (Fol)13,14,15. En ratones adultos, en un entorno no enfermo, el número de células B maduras permanece constante a pesar de que se generan diariamente 10-20 millones de células B inmaduras en el BM. De estos, solo el tres por ciento ingresa al grupo de células B maduras. El tamaño del compartimento periférico de las células B está limitado por la muerte celular, debido en parte a varios factores, incluida la autorreactividad y la maduración incompleta16,17,18. El análisis citométrico de flujo se ha utilizado ampliamente para caracterizar y enumerar muchos subcompartimentos de células inmunes en humanos y ratones. Si bien existen algunas similitudes entre los compartimentos de células B humanas y murinas, este protocolo se aplica solo al análisis de células B murinas. Este protocolo fue desarrollado con el propósito de fenotipar ratones genéticamente modificados, para determinar si la manipulación genética alteraría el desarrollo de las células B. La citometría de flujo también ha sido muy popular en muchas aplicaciones adicionales, incluida la medición de la activación celular, la función, la proliferación, el análisis del ciclo, el análisis del contenido de ADN, la apoptosis y la clasificación celular 19,20.
La citometría de flujo es la herramienta de elección para caracterizar varios compartimentos de linfocitos en ratones y humanos, incluso en órganos complejos como el bazo, la BM y la sangre. Debido a los reactivos de anticuerpos específicos de ratón ampliamente disponibles para la citometría de flujo, esta técnica se puede utilizar para investigar no solo las proteínas de la superficie celular, sino también las fosfoproteínas y citoquinas intracelulares, así como las lecturas funcionales21. Aquí demostramos cómo los reactivos de citometría de flujo se pueden usar para identificar subconjuntos de células B a medida que maduran y se diferencian en los órganos linfoides secundarios. Después de la optimización de las condiciones de tinción, el manejo de muestras, la configuración correcta del instrumento y la adquisición de datos, y finalmente el análisis de datos, se puede utilizar un protocolo para el análisis citométrico de flujo integral del compartimiento de células B en ratones. Este análisis exhaustivo se basa en una nomenclatura de décadas de antigüedad ideada por Hardy y sus colegas, donde las células BM B-2 en desarrollo se pueden dividir en diferentes fracciones (Fracción) dependiendo de su expresión de B220, CD43, BP-1, CD24, IgM e IgD22. Hardy et al., demostraron que las células B B B220+ CD43 BM se pueden subdividir en cuatro subconjuntos (Fracción A-C') sobre la base de la expresión BP-1 y CD24 (30F1), mientras que las células B B BM B B CD43-(dim a neg) se pueden resolver en tres subconjuntos (Fracción D-F) basados en la expresión diferencial de IgD e IgM23 de superficie. La fracción A (células pre-pro-B) se definen como BP-1- CD24 (30F1)-, la fracción B (células pro-B tempranas) se definen como BP-1- CD24 (30F1)+, la fracción C (células pro-B tardías) se definen como BP-1+ CD24 (30F1)+, y la fracción C' (células pre-B tempranas) se definen como BP-1+ y CD24high. Además, la Fracción D (células pre-B) se definen como células B220+ CD43- IgM-B, y la Fracción E (células B recién generadas, combinación de células B inmaduras y de transición) se definen como células B B220+ CD43- IgM+ y la Fracción F (células B maduras, recircultantes) se definen como células B B220high CD43- IgM+. Por el contrario, la mayoría de las células B naïve que se encuentran en el bazo se pueden dividir en células B maduras (B220 + CD93-) y células de transición (T1, T2, T3) dependiendo de la expresión de CD93, CD23 e IgM. Las células B maduras pueden resolverse en subconjuntos de zonas marginales y foliculares basados en la expresión de IgM y CD21/CD35, y los subconjuntos foliculares se pueden dividir en subconjuntos de células B foliculares maduras tipo I y folicular tipo II dependiendo del nivel de su expresión superficial de IgM e IgD24. Estas poblaciones de células B esplénicas expresan predominantemente cadena ligera Igκ. Finalmente, las poblaciones de células B-1 B, que se originan en el hígado fetal y se encuentran principalmente en las cavidades peritoneal y pleural de ratones adultos, se han descrito en la literatura. Estas células B peritoneales se pueden distinguir de las células B B-2 descritas anteriormente por su falta de expresión de CD23. Luego se subdividen en poblaciones B-1a o B-1b, con la primera definida por la presencia de CD5 y la segunda por su ausencia25. Los progenitores de células B-1 son abundantes en el hígado fetal, pero no se encuentran en la BM adulta. Mientras que las células B-1a y B-1b se originan a partir de diferentes progenitores, ambas siembran las cavidades peritoneal y pleural24. A diferencia de las células B-2, las células B-1 son excepcionalmente capaces de autorrenovarse y son responsables de la producción de anticuerpos IgM naturales.
Los defectos en el desarrollo de las células B pueden surgir en muchos casos, incluyendo deficiencias en los componentes de la BCR26,27, perturbaciones de moléculas de señalización que afectan la intensidad de señalización de BCR14,28,29, o interrupción de citoquinas que modulan la supervivencia de las células B30,31 . El análisis de citometría de flujo de los compartimentos linfoides ha contribuido a la caracterización de los bloques de desarrollo de células B en estos ratones y muchos otros. Una ventaja del análisis citométrico de flujo de compartimentos linfoides es que ofrece la capacidad de realizar mediciones en células individuales obtenidas de tejido vivo disociado. La disponibilidad de reactivos en una gama cada vez mayor de fluoróforos permite el análisis simultáneo de múltiples parámetros y permite la evaluación de la heterogeneidad de las células B. Además, la enumeración de células B por análisis citométrico de flujo complementa otros ensayos inmunológicos como los métodos de inmunohistoquímica que visualizan la localización celular dentro de los órganos linfoides, la detección de niveles de anticuerpos circulantes como medida de la inmunidad humoral, así como la microscopía de dos fotones para medir las respuestas de las células B en el espacio y el tiempo reales32.
Protocolo
Todos los estudios con ratones fueron supervisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de Regeneron. El experimento se llevó a cabo en tejidos de tres ratones hembra C57BL / 6J (17 semanas de edad) de Jackson Laboratories. Valore todos los anticuerpos antes de comenzar el experimento para determinar la concentración ideal. Cuando use perlas de compensación para la compensación de un solo color, asegúrese de que se manchen tan brillantes o más brillantes que sus muestras. Mantenga todos los tampones, anticuerpos y células en hielo o a 4 °C. Después de la adición de tinte de viabilidad, realice todos los pasos e incubaciones a 4 ° C en condiciones de poca luz o en la oscuridad.
1. Recolección de células peritoneales y aislamiento unicelular
- Sacrificar al ratón usando CO2 o de acuerdo con el protocolo aprobado.
- Coloque el ratón sobre su espalda, rocíe con etanol al 70% y corte la piel abdominal externa con tijeras, teniendo cuidado de no cortar el peritoneo.
- Inyecte 3 ml de tampón de lavado helado (albúmina sérica bovina (BSA) al 0,5% en DPBS [vol/vol]) en la cavidad peritoneal con una jeringa de 3 ml equipada con una aguja de calibre 25.
- Masajee suavemente el peritoneo con las yemas de los dedos.
- Repita los pasos 1.3 y 1.4.
- Inserte una jeringa de 3 ml equipada con una aguja de 18 G a través del peritoneo, teniendo cuidado de evitar órganos y grasa.
- Extraiga el tampón de lavado, que ahora contiene células peritoneales, y transfiéralo a un tubo cónico de 15 ml en hielo.
- Repita los pasos 1.3 y 1.4.
- Corte un pequeño agujero en el peritoneo mientras sostiene con pinzas.
- Inserte una pipeta de transferencia desechable en el orificio y recoja el tampón de lavado restante, evitando una vez más la grasa y los órganos.
- Transfiera las células peritoneales restantes recolectadas al tubo cónico de 15 ml en hielo.
NOTA: Deseche la muestra si la contaminación de la sangre es evidente. - Incubar las células en hielo hasta que se complete la extracción del bazo y el hueso.
- Centrifugar las células a 300 x g durante 8 min a 4 °C. Aspirar el sobrenadante.
- Resuspend el pellet celular en 1 ml de tampón de lavado.
- Filtre las células a través de un colador de células de 70 μM en un tubo cónico limpio de 15 ml sobre hielo.
- Determine la concentración celular utilizando un instrumento de contador celular o hemocitómetro.
2. Cosecha del bazo y aislamiento unicelular
- Coloque el ratón sobre su vientre y corte el peritoneo en la parte posterior izquierda con tijeras limpias. Cortar el bazo, eliminando la grasa y el tejido conectivo.
- Transfiera el bazo a un tubo de microcentrífuga de 1,5 ml que contenga 1 ml de tampón de lavado sobre hielo.
- Incubar el bazo en hielo hasta que se complete la extracción ósea.
- Mueva el bazo al tubo de disociación automatizado con 5 ml de tampón de lisis de glóbulos rojos. Coloque el tubo en el instrumento disociador de tejido y disocie durante 60 s para crear una suspensión de una sola célula.
NOTA: También está permitido utilizar otros métodos de rutina para obtener suspensiones de bazo de una sola célula, como romper entre portaobjetos de vidrio esmerilado en el tampón de lavado. Si se utiliza otro método de disociación, siga la disociación con centrifugación, aspiración y luego resuspensión en 5 ml de tampón de lisis de glóbulos rojos antes de continuar con el paso 2.5. - Incubar las células a temperatura ambiente durante 3 min.
- Añadir 10 ml de tampón de lavado de 4 °C que contenga 2 mM de EDTA.
- Transfiera a un tubo cónico limpio de 15 ml.
- Centrifugar las células a 300 x g durante 8 min a 4 °C. Aspirar el sobrenadante.
- Resuspend el pellet celular en 5 mL de tampón de lavado de 4 °C.
- Filtre las células a través de un colador de células de 70 μM en un tubo cónico limpio de 15 ml sobre hielo.
- Determine la concentración celular utilizando un instrumento de contador celular o hemocitómetro.
3. Cosecha de BM y aislamiento de una sola célula
- Retire la piel de la mitad inferior del cuerpo del ratón. Recorte el exceso de músculo de la pierna. Retire toda la pierna con tijeras, teniendo cuidado de no cortar el fémur. Limpie el fémur y la tibia eliminando el músculo, la grasa y los pies restantes.
- Transfiera los huesos a un tubo de microcentrífuga de 1,5 ml que contenga 1 ml de tampón de lavado sobre hielo.
- Perfore la parte inferior de un tubo de microcentrífuga de 0,5 ml, dejando un orificio lo suficientemente pequeño como para que los huesos de las piernas no sobresalgan. Inserte el tubo de 0,5 ml en un tubo de microcentrífuga limpio de 1,5 ml. Corte el extremo del fémur y la tibia proximal a la rodilla y coloque los extremos cortados hacia abajo en el tubo de 0,5 ml.
- Centrifugar las células a 6.780 x g durante 2 min a 4 °C.
- Resuspender el pellet celular en 1 ml de tampón de lisis de glóbulos rojos y transferirlo a un tubo cónico de 15 ml que contenga 3 ml adicionales de tampón de lisis de glóbulos rojos.
- Incubar a temperatura ambiente durante 3 min.
- Añadir 10 ml de tampón de lavado de 4 °C que contenga 2 mM de EDTA.
- Centrifugar las células a 300 x g durante 8 min a 4 °C. Aspirar el sobrenadante.
- Resuspendir el pellet celular en 3 ml de tampón de lavado de 4 °C.
- Filtre las células a través de un colador de células de 70 μM en un tubo cónico limpio de 15 ml sobre hielo.
- Determine la concentración celular utilizando un instrumento de contador celular o hemocitómetro.
4. Manchar las células y preparar la compensación
- Alícuota 106 células de cada tipo de célula de cada animal a una placa inferior de 96 pozos U.
- Asegúrese de incluir suficientes pocillos para todas las muestras y controles, incluida la tinción completa, la fluorescencia menos uno (FMO), sin teñir y, finalmente, la compensación opcional de un solo color para cada fluoróforo utilizado.
- Para el panel de maduración de BM y el panel de maduración del bazo, alícuotas en 2 pocillos, 106 células por pozo, por cada muestra de tinción completa. Para los controles de viabilidad de compensación de un solo color, agregue 2 x 106 celdas de cada tipo de celda a los pozos individuales.
- Centrifugar la placa a 845 x g durante 2 min a 4 °C. Decantar el sobrenadante invirtiendo rápidamente y moviendo la placa sobre un fregadero, teniendo cuidado de no contaminar los pozos cruzados.
- Resuspendir las células en 200 μL de DPBS (sin BSA o FBS). Este paso es importante para eliminar la proteína antes de teñirla con colorante de viabilidad reactivo a la amina.
- Repita los pasos 4.2 y 4.3.
- Repita el paso 4.2.
- Resuspend las células en colorante de viabilidad de 100 μL diluido 1:1.000 en DPBS.
NOTA: Si usa celdas para la compensación de un solo color, no agregue tinte de viabilidad a esos pozos.- Para cada juego de manchas, deje varios pozos sin manchar para una muestra completamente sin manchar y cualquier otro control que pueda necesitar.
- Para cada juego de manchas, deje un pozo adicional sin manchar para el control FMO de viabilidad.
- Para los controles de compensación de viabilidad de un solo color: Resuspendir las 2 x 106 celdas, aludidas en el paso 4.1, en 200 μL de colorante de viabilidad diluido. Transfiera 100 μL de células a un tubo de microcentrífuga de 1,5 ml, celdas de calor durante 5 min a 65 °C y transfiera los 100 μL de células muertas por calor al pozo original con las células vivas restantes de 100 μL.
- Incubar las células a 4 °C, protegidas de la luz, durante 30 min.
- Centrifugar la placa a 845 x g durante 2 min a 4 °C. Decantar el sobrenadante invirtiendo rápidamente y moviendo la placa sobre un fregadero, teniendo cuidado de no contaminar los pozos cruzados.
- Resuspendir las células en 200 μL de DPBS (sin BSA o FBS).
- Repita los pasos 4.8 y 4.9.
- Repita el paso 4.8.
- Resuspend las células en 50 μL de bloque Fc diluido 1:50 (concentración final =10 μg/mL) en tampón de tinción (0,5% BSA en DPBS [vol/vol]).
- Para las células peritoneales: también agregue 5 μL de bloqueador de monocitos para reducir la tinción inespecífica.
- Incubar las células a 4 °C, protegidas de la luz, durante 15 min.
- Prepare mezclas maestras de tinción completas y FMO en tampón de manchas para un volumen final de 100 μl por cada 106 células. Consulte la Tabla 1-Tabla 4 para las listas de anticuerpos.
NOTA: Los FMO se fabrican mediante la inclusión de todos los anticuerpos en un juego de manchas excepto uno. Prepare un FMO para cada anticuerpo en un conjunto de manchas. Cuando un juego de manchas contiene varios tintes brillantes, sustituya 50 μL de tampón de manchas brillantes por tampón de manchas por tampón de manchas por muestra - Sin eliminar el bloque Fc, agregue 100 μL de mezclas de manchas completas y FMO a los pozos seleccionados.
- Prepare controles de compensación de un solo color para cada anticuerpo en un conjunto de manchas.
- Si utiliza perlas de compensación, siga las instrucciones de uso del fabricante.
- Si utiliza células, agregue anticuerpos titulados a 106 células, reservadas previamente en el paso 4.6.1 sin colorante de viabilidad, en tampón de tinción de 100 μL. Si todas las células de la muestra son positivas para un marcador en particular, reserve las células no teñidas para usarlas al adquirir datos de compensación en el citómetro de flujo.
- Incubar las células y perlas a 4 °C, protegidas de la luz, durante 30 min.
- Centrifugar la placa a 845 x g durante 2 min a 4 °C. Decantar el sobrenadante invirtiendo rápidamente y moviendo la placa sobre un fregadero, teniendo cuidado de no contaminar los pozos cruzados.
- Resuspend las células y perlas en 200 μL de tampón de manchas.
- Repita los pasos 4.18 y 4.19 dos veces.
- Repita el paso 4.18.
- Para fijar las muestras para su análisis dentro de las 48 h, resuspenda las células y perlas en 200 μL de paraformaldehído al 2% en DPBS.
PRECAUCIÓN: El parafomaldehído es un grave peligro para la salud e inflamable. Consulte la hoja de datos de Safty antes de usarlo. - Incubar las células y perlas a 4 °C, protegidas de la luz, durante 30 min.
- Repita los pasos 4.18 y 4.19 dos veces.
- Coloque una placa de filtro sobre una placa limpia de 96 pozos con fondo en U. Usando una pipeta múltiple, transfiera cada muestra a un pozo de la placa de filtro.
- Centrifugar la placa de filtro-96 bien configuración de placa de fondo en U a 845 x g durante 2 min a 4 °C. Retire la placa de filtro y decante el sobrenadante invirtiendo y moviendo rápidamente la placa sobre un fregadero, teniendo cuidado de no contaminar los pozos cruzados.
- Para los paneles de maduración de BM y bazo, resuspend las células completamente teñidas en 100 μL de tampón de tinción. Combine los 2 pocillos para cada animal en 1 pozo. Resuspender los paneles, FMO y controles restantes en 200 μL de tampón de manchas.
- Incubar células fijas y perlas a 4 °C, protegidas de la luz, durante la noche.
5. Adquisición de datos citométricos de flujo
- Inicialice y controle el control de calidad del citómetro de flujo según las instrucciones del fabricante.
- Cargue la plantilla específica para cada panel.
- Antes de registrar los datos, asegúrese de que todos los eventos de cada muestra estén a escala y visibles en los diagramas de puntos.
- Registre los controles de compensación para cada panel de manchas utilizando compensaciones de una sola mancha preparadas en el paso 4.16. Establezca puertas positivas y negativas para cada muestra. Haga que el software calcule la matriz de compensación.
- Comience a adquirir la primera muestra y asegúrese de que las puertas estén configuradas adecuadamente.
- Configure la máquina para que registre al menos 50,000 eventos de células B para el panel peritoneal de células B y el panel Igκ e Igλ del bazo; 150.000 eventos de células B para el panel de maduración BM; y 300.000 eventos de células B para el panel de maduración del bazo.
- Para cada panel de manchas, ejecute y registre las muestras completamente teñidas de cada animal, una muestra sin teñir y las FMO.
6. Analizar datos
- Proceda con el análisis de datos utilizando el software de análisis de citometría de flujo. Siga las estrategias de cierre descritas en la Figura 1, Figura 2, Figura 3, Figura 4.
Resultados
Aquí presentamos la estrategia de gating para caracterizar el desarrollo de células B en peritoneo de ratón, BM y bazo. La base del análisis se forma en torno al concepto de tinción con tinte de viabilidad, luego se eliminan los dobletes basados en el Área de Dispersión Hacia Adelante (FSC-A) y la Altura de Dispersión Hacia Adelante (FSC-H), y finalmente se eliminan los desechos seleccionando las células de acuerdo con sus características FSC-A y Área de Dispersión Lateral (SSC-A), conocidas aquí como la puerta de tamaño, que reflejan el tamaño relativo de la célula y la granularidad celular. antes de la lista de población de interés.
El análisis citométrico de flujo de células B peritoneales muestra las frecuencias de células peritoneales viables, células B totales, subconjuntos B-1 y B-2, así como células B-1a y B-1b en ratones C57BL/6J (Figura 1), utilizando un panel de tinción descrito en la Tabla 1. El número de celdas absoluto promedio de estas frecuencias se muestra en la Tabla 5. Las perturbaciones en las células B-1 podrían delinearse mediante la distribución de subconjuntos celulares, ya sea por frecuencia celular o número absoluto de células por ratón.
El análisis citométrico de flujo de células BM B muestra las frecuencias de células BM viables, células B totales, fracción A (células pre-pro-B y linfocitos contaminantes), células pre-pro-B, fracción B, fracción C, fracción C', fracción D, inmaduras (subconjunto en la fracción E), transicionales (subconjunto en la fracción E) y células B de la fracción F en ratones C57BL / 6J (Figura 2), utilizando un panel de tinción descrito en la Tabla 2. El número de celdas absoluto promedio de estas frecuencias se muestra en la Tabla 6. Las perturbaciones en las células BM B podrían delinearse mediante la distribución de subconjuntos celulares, ya sea por frecuencia celular o número absoluto de células por pierna(s).
El análisis citométrico de flujo de células B esplénicas muestra las frecuencias de células viables del bazo, células B totales, células B de transición, células T1, T2, T3, células B maduras, células foliculares I (Fol I), células foliculares II (Fol II), células precursoras de zona marginal (MZ), células MZ maduras y células B-1 en ratones C57BL / 6J (Figura 3), utilizando un panel de tinción descrito en la Tabla 3. El número de celdas absoluto promedio de estas frecuencias se muestra en la Tabla 7. Las perturbaciones en las células B esplénicas podrían delinearse mediante la distribución de subconjuntos celulares, ya sea por frecuencia celular o número absoluto de células por bazo.
Del mismo modo, el análisis citométrico de flujo del bazo muestra las frecuencias de las células B Igκ+ e Igλ+ en ratones C57BL/6J (Figura 4), utilizando un panel de tinción descrito en la Tabla 4. El número de celdas absoluto promedio de estas frecuencias se muestra en la Tabla 8. Las perturbaciones en Igκ+ e Igλ+ Bcells podrían ser delineadas por la distribución de subconjuntos celulares, ya sea por frecuencia celular o número absoluto de células por bazo.
| Anticuerpo | Fluoróforo | clon |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | FITC | S7 |
| CD23 | BUV395 | B3B4 |
| CD11b | BV711 | M1/70 |
| CD5 | BV605 | 53-7.3 |
Tabla 1: Panel de células B peritoneales
| Anticuerpo | Fluoróforo | clon |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | FITC | 1B11 |
| CD24 (HSA) | PEI | 30-F1 |
| C-Kit | BUV395 | 2B8 |
| BP-1 | BV786 | BP-1 |
| CD93 | BV711 | AA4.1 |
| canal de volcado | ||
| CD3 | AF700 | 17-A2 |
| CD11b | AF700 | M1/70 |
| GR1 (Ly6C/6G) | AF700 | RB6-8C5 |
| Ter119 | AF700 | TER-119 |
Tabla 2: Panel de maduración de la médula ósea
| Anticuerpo | Fluoróforo | clon |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD43 | FITC | S7 |
| CD23 | BUV395 | B3B4 |
| CD21/35 | BV421 | 7G6 |
| CD11b | AF700 | M1/70 |
| CD5 | BV605 | 53-7.3 |
| CD93 | PEI | AA4.1 |
Tabla 3: Panel de maduración del bazo
| Anticuerpo | Fluoróforo | clon |
| CD19 | APC-H7 | 1D3 |
| B220 | APC | RA3-6B2 |
| Igm | PeCy7 | II/41 |
| IgD | PerCpCy5.5 | 11-26c.2a |
| CD3 | PB | 17-A2 |
| Kappa | FITC | 187.1 |
| Lambda | PEI | RML-42 |
Tabla 4: Panel igκ e igλ del bazo
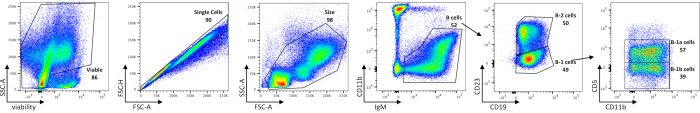
Figura 1: Caracterización de poblaciones de células B en el peritoneo. Las células B peritoneales viables, de una sola célula y de tamaño cerrado se separan primero de las células contaminantes mediante la activación de células IgM +. Las células B-1 y B-2 se distinguen entre sí por ausencia (B-1) o presencia de CD23 (B-2). La siguiente expresión de CD5 se utiliza para delinear células B-1a (CD5+) de células B-1b (CD5-). Las FMO se utilizaron para determinar empíricamente dónde dibujar puertas. Los números son porcentajes de cada población dentro de la misma gráfica de densidad. Haga clic aquí para ver una versión más grande de esta figura.
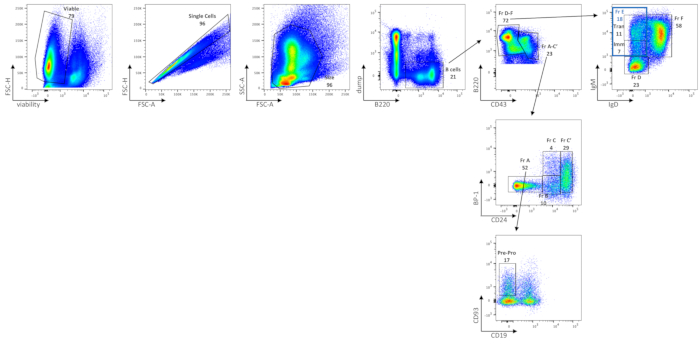
Figura 2: Caracterización de subconjuntos de células B en el BM. Las células B BM viables, de una sola célula, de tamaño cerrado se separan de las células no B mediante la compuerta en células de descarga B220 + (donde el volcado se refiere a las células CD3 / GR-1 / CD11b / TER119). La expresión CD43 y B220 define además la fracción Hardy A-C' (CD43+ B220+) y la fracción Hardy D-F (CD43low/neg B220+/++). La fracción A-C' se separa aún más por la expresión de BP-1 y CD24. La fracción A (BP-1-CD24-) corresponde a las células pre-pro-B junto con las células contaminantes. Para separar las células pre-pro-B de las células contaminantes en la Fracción A, se utiliza la expresión de CD93 y la ausencia de CD19. La fracción B (BP-1- CD24int) y la fracción C (BP-1+ CD24int) corresponden a células pro-B tempranas y tardías, respectivamente, y la fracción C' (BP-1+/- CD24+) corresponde a células pre-B tempranas. Para separar la fracción D-F, se utiliza la expresión de IgM e IgD. La fracción D corresponde a células pre-B tardías (IgM-/IgD baja-); Fracción E (puerta azul, IgMint/igD alta-) a células B inmaduras (Imm, IgMint IgD-) y transicionales (Tran, IgMhigh IgD-); y fracción F (IgMint/igD+alta) para recircular células B maduras. Las FMO se utilizaron para determinar empíricamente dónde dibujar puertas. Los números son porcentajes de cada población dentro de la misma gráfica de densidad. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Caracterización de la maduración de células B esplénicas. Las células B esplénicas viables, de una sola célula y de tamaño cerrado se separan de las células no B mediante la formación de células B220 +. Para identificar el subconjunto B-1, las células CD23-CD19+ se identifican y definen mediante la expresión de CD43. Para clasificar las poblaciones B-2, las células CD19+ se separan en células B de transición (CD93+ B220+) y maduras (CD93-B220+). Las células de transición (CD93+ B220+) se dividen en poblaciones T1 (IgM+ CD23-), T2 (IgM+ CD23+) y T3 (IgMint CD23+). Las células maduras (CD93- B220+) se separan en células B de zona marginal (CD21/35+ IgM+) y foliculares (CD21/35int IgMint/+). La expresión de CD23 se utiliza además para separar las células precursoras de MZ (CD23+ B220+) de las células MZ (CD23-B220+) más maduras. Las poblaciones foliculares se delinean en células Fol I (IgD+ IgMint) y Fol II (IgD+ IgM+). Las FMO se utilizaron para determinar empíricamente dónde dibujar puertas. Los números son porcentajes de cada población dentro de la misma gráfica de densidad Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Expresión de Igκ e Igλ de células B esplénicas. Las células B esplénicas viables, de una sola célula, de tamaño cerrado, se separan de las células no B mediante la formación de células CD3 B220 +. Las células B se distinguen entonces por la expresión de Igλ e Igκ. Los números son porcentajes de cada población dentro de la misma gráfica de densidad. Haga clic aquí para ver una versión más grande de esta figura.
| Número de celda absoluto | |||||
| Número de animal | Células peritoneales viables | Células B | Células B-1a | Células B-1b | Células B-2 |
| 1 | 1.02E+07 | 4,67E+06 | 1.28E+06 | 8,95E+05 | 2.35E+06 |
| 2 | 9.92E+06 | 4.52E+06 | 1.49E+06 | 9.60E+05 | 1.91E+06 |
| 3 | 1.15E+07 | 4.56E+06 | 1.71E+06 | 9.19E+05 | 1.78E+06 |
| Promedio | 1,05E+07 | 4.58E+06 | 1.49E+06 | 9.25E+05 | 2.01E+06 |
Tabla 5: Números absolutos de células de subconjuntos peritoneales de células B
| Número de celda absoluto | |||||||||||
| Número de animal | Células viables de la médula ósea | Células B | Fracción A | Pre-pro | Fracción B | Fracción C | Fracción C' | Fracción D | Inmaduro | Transicional | Fracción F |
| 1 | 5.05E+07 | 9.70E+06 | 1.13E+06 | 1.95E+05 | 2.22E+05 | 9.14E+04 | 6.31E+05 | 1.59E+06 | 4.56E+05 | 7.81E+05 | 4.03E+06 |
| 2 | 5.39E+07 | 1.03E+07 | 1.14E+06 | 2.29E+05 | 2.89E+05 | 1.22E+05 | 8.40E+05 | 2.11E+06 | 5.39E+05 | 8.07E+05 | 3.67E+06 |
| 3 | 5,93E+07 | 1.01E+07 | 1.10E+06 | 2.12E+05 | 2,84E+05 | 1.05E+05 | 9.02E+05 | 2.72E+06 | 5,94E+05 | 7.62E+05 | 2,59E+06 |
| Promedio | 5.46E+07 | 1.00E+07 | 1.12E+06 | 2.12E+05 | 2.65E+05 | 1.06E+05 | 7.91E+05 | 2.14E+06 | 5.29E+05 | 7.83E+05 | 3.43E+06 |
Tabla 6: Números absolutos de células de los subconjuntos de células B de la médula ósea
| Número de celda absoluto | ||||||||||||
| Número de animal | Células viables del bazo | Células B | Células B de transición | Células T1 | Células T2 | Células T3 | Células B maduras | Células foliculares I | Células foliculares II | Células precursoras de la zona marginal | Células maduras de la zona marginal | Células B-1 |
| 1 | 9.16E+07 | 4.61E+07 | 3.66E+06 | 1,55E+06 | 1.10E+06 | 7.16E+05 | 4.06E+07 | 2.39E+07 | 5.27E+06 | 2.17E+06 | 3.98E+06 | 8.83E+05 |
| 2 | 9.97E+07 | 5.18E+07 | 4.88E+06 | 1,97E+06 | 1.57E+06 | 1.00E+06 | 4.49E+07 | 2,68E+07 | 7.33E+06 | 3.42E+06 | 3.84E+06 | 8.15E+05 |
| 3 | 1.02E+08 | 5.34E+07 | 4.64E+06 | 1,98E+06 | 1.41E+06 | 8.54E+05 | 4.62E+07 | 2.81E+07 | 5.84E+06 | 3.58E+06 | 4.02E+06 | 1.01E+06 |
| Promedio | 9.77E+07 | 5.04E+07 | 4.39E+06 | 1,83E+06 | 1.36E+06 | 8.58E+05 | 4.39E+07 | 2,63E+07 | 6.15E+06 | 3.06E+06 | 3.94E+06 | 9.02E+05 |
Tabla 7: Números absolutos de células de subconjuntos de células B esplénicas
| Número de celda absoluto | ||||
| Número de animal | Células viables del bazo | Células B | Células B Igκ+ | Células B Igλ+ |
| 1 | 9.16E+07 | 4.97E+07 | 4.51E+07 | 2.46E+06 |
| 2 | 9.97E+07 | 5.63E+07 | 5.08E+07 | 3.16E+06 |
| 3 | 1.02E+08 | 5.91E+07 | 5.33E+07 | 3.24E+06 |
| Promedio | 9.77E+07 | 5.50E+07 | 4.97E+07 | 2,95E+06 |
Tabla 8: Números celulares absolutos de subconjuntos de células Igκ e Igλ B
Discusión
El análisis citométrico de flujo de tejidos linfoides y no linfoides ha permitido la identificación y enumeración simultánea de subpoblaciones de células B en ratones y humanos desde la década de 1980. Se ha utilizado como una medida de la inmunidad humoral y se puede aplicar aún más para evaluar la funcionalidad de las células B. Este método aprovecha la disponibilidad de reactivos para evaluar diferentes etapas de maduración de células B en ratones y humanos, mediante el análisis simultáneo de múltiples parámetros que permiten evaluar la heterogeneidad de las células B, incluso en poblaciones raras. Si se utiliza para medir muestras heterogéneas complejas, puede detectar subpoblaciones en cuestión de minutos, en células individuales33. La estrategia de análisis secuencial de gating, aplicada con mayor frecuencia al análisis citométrico de flujo, puede ser simple e intuitiva cuando se debe identificar una población específica34. Finalmente, otra ventaja de la citometría de flujo es que es fácilmente adaptable en la mayoría de los laboratorios académicos, mientras que bajo la guía de usuarios experimentados. Nuestro protocolo describe con éxito la evaluación de las poblaciones de células B en el peritoneo, BM y bazo de ratones, describiendo y enumerando poblaciones B-1 y profundizando en el desarrollo de células B-2 pro-B, células pre-B, células B inmaduras, de transición y maduras, así como su expresión superficial de cadenas ligeras Igκ o Igλ. La citometría de flujo es el método más utilizado y más fácil de aplicar cuando se investiga el desarrollo de células B en ratones.
Si bien la citometría de flujo genera datos invaluables, existen algunos límites para esta tecnología cuando se usa para investigar la heterogeneidad del compartimiento de células B inmunes. Los enormes conjuntos de datos pueden ser abrumadores porque la tinción de 10 colores permite el reconocimiento de más de 1.024 poblaciones celulares diferentes34. Hay que tener en cuenta que algunos marcadores de células linfoides de uso común han demostrado ser menos específicos de lo que se pensaba originalmente. Esto se puede resolver empleando una multitud de marcadores de superficie celular para determinar la apertura en las poblaciones deseadas. Si bien el análisis citométrico de flujo puede ser simple e intuitivo, otra restricción para el análisis citométrico de flujo es que generalmente permite la visualización de solo dos parámetros a la vez, aunque las herramientas de visualización de datos como t-SNE se pueden usar para agrupar poblaciones de células de manera más eficiente cuando se utiliza citometría de flujo de alto parámetro. Otra limitación importante es que las compuertas utilizadas tanto durante la adquisición como durante el análisis a veces dependen de la subjetividad del operador.
Para una adaptación o replicación exitosa de este protocolo, hay varios parámetros críticos que deben tenerse en cuenta35. Se debe tener una cuidadosa consideración en el diseño del panel y la selección de fluorocromo. Es imperativo emparejar antígenos tenues o importantes con fluorocromos brillantes. La titulación de anticuerpos debe llevarse a cabo para evitar el exceso de unión de anticuerpos a las células de forma no específica, lo que podría aumentar la tinción de fondo y disminuir la resolución. La titulación de anticuerpos se realiza mediante la tinción de un número conocido de células con concentraciones decrecientes de anticuerpos, para determinar el mejor índice de separación36. Esto debe repetirse para cada lote de anticuerpos. Durante la preparación y tinción de la muestra, es importante asegurar una suspensión de una sola célula evitando Ca++ y Mg++. Además, la adición de EDTA puede ayudar a prevenir la agregación celular y la actividad enzimática que puede conducir a la estimulación mediada por anticuerpos y la internalización de los marcadores marcados. Antes de la adquisición de datos, las muestras deben suspenderse adecuadamente, filtrarse y estar libres de agregados. El desbordamiento de la señal de un parámetro a otro se resuelve mediante el uso de controles de compensación, en forma de celdas teñidas individuales o perlas de compensación disponibles comercialmente35. Otra consideración importante es tener controles adecuados en cada experimento. Las células no teñidas establecen la línea de base de la autofluorescencia. Los controles de isotipo ya no se consideran controles apropiados para la puerta debido a la unión no específica. El paso más importante para ayudar a hacer puertas precisas es el uso de controles FMO. En un control FMO, todos los anticuerpos conjugados están presentes en la mancha excepto el que está siendo controlado. Los controles FMO permiten la medición de la propagación de todos los fluoróforos en el canal faltante y, por lo tanto, permiten configurar las puertas en consecuencia. Es fundamental que se adquieran suficientes células para una mayor precisión. Como regla general, se deben recopilar al menos 2,000 eventos de la población de interés. Por último, los controles de compensación, ya sean perlas o células, deben coincidir exactamente con los fluorocromos que se utilizan y los controles deben ser al menos tan brillantes como las muestras experimentales37.
En general, el análisis citométrico bajo de los compartimentos de células B es ampliamente utilizado en el campo de la inmunología. Esta técnica se puede utilizar para investigar perturbaciones en la inmunidad humoral tanto en ratones de tipo salvaje como en ratones modificados genéticamente, en estados no relacionados con la enfermedad y en caso de desafío inmunológico.
Divulgaciones
Todos los autores son empleados y accionistas de Regeneron Pharmaceuticals, Inc.
Agradecimientos
Agradecemos a Matthew Sleeman por la lectura crítica del manuscrito. También agradecemos a los departamentos de Operaciones de Vivarium y Núcleo de Citometría de Flujo en Regeneron por apoyar esta investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5 mL safe-lock Eppendorf tubes | Eppendorf | 22363611 | 0.5 mL microcentrifuge tube |
| 1.5mL Eppendorf tubes | Eppendorf | 22364111 | 1.5 mL microcentrifuge tube |
| 15 mL Falcon tubes | Corning | 352097 | 15 mL conical tube |
| 18 gauge needle | BD | 305196 | |
| 25 gauge needle | BD | 305124 | |
| 3 mL syringe | BD | 309657 | |
| 70 mM MACS SmartStrainer | Miltenyi Biotec | 130-110-916 | 70 mM cell strainer |
| 96 well U bottom plate | VWR | 10861-564 | |
| ACK lysis buffer | GIBCO | A1049201 | red blood cell lysis buffer |
| Acroprep Advance 96 Well Filter Plate | Pall Corporation | 8027 | filter plate |
| B220 | eBiosciences | 17-0452-82 | |
| BD CompBead Anti-Mouse Ig/κ | BD | 552843 | compensation beads |
| BD CompBead Anti-Rat Ig/κ | BD | 552844 | compensation beads |
| Bovine Serum Albumin | Sigma-Aldrich | A8577 | BSA |
| BP-1 | BD | 740882 | |
| Brilliant Stain Buffer | BD | 566349 | brilliant stain buffer |
| C-Kit | BD | 564011 | |
| CD11b | BD | 563168 | |
| CD11b | BioLegend | 101222 | |
| CD19 | BD | 560143 | |
| CD21/35 | BD | 562756 | |
| CD23 | BD | 740216 | |
| CD24 (HSA) | BioLegend | 138504 | |
| CD3 | BD | 561388 | |
| CD3 | BioLegend | 100214 | |
| CD43 | BD | 553270 | |
| CD43 | BioLegend | 121206 | |
| CD5 | BD | 563194 | |
| CD93 | BD | 740750 | |
| CD93 | BioLegend | 136504 | |
| DPBS (1x) | ThermoFisher | 14190-144 | DPBS |
| eBioscience Fixable Viability Dye eFluor 506 | ThermoFisher | 65-0866-14 | viability dye |
| Extended Fine Tip Transfer Pipette | Samco | 233 | disposable transfer pipette |
| FACSymphony A3 flow cytometer | BD | custom order | flow cytometer |
| Fc Block, CD16/CD32 (2.4G2) | BD | 553142 | Fc block |
| FlowJo | Flowjo | flow cytometer analysis software | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | automated dissociation tube |
| gentleMACS Octo Dissociator with Heaters | Miltenyi Biotec | 130-095-937 | tissue dissociator instrument |
| GR1 (Ly6C/6G) | BioLegend | 108422 | |
| IgD | BioLegend | 405710 | |
| IgM | eBiosciences | 25-5790-82 | |
| Kappa | BD | 550003 | |
| Lambda | BioLegend | 407308 | |
| paraformaldehyde, 32% Solution | Electron Microscopy Sciences | 15714 | |
| Ter119 | BioLegend | 116220 | |
| True-Stain Monocyte Blocker | BioLegend | 426103 | monocyte blocker |
| UltraPure EDTA, pH 8.0 | ThermoFisher | 15575038 | EDTA |
| Vi-CELL XR | Beckman Coulter | 731050 | cell counter instrument |
Referencias
- Shepard, H. M., Philips, G. L., Thanos, D., Feldman, M. Developments in therapy with monoclonal antibodies and related proteins. Clinical Medicine. 17 (3), 220 (2017).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Macdonald, L. E., et al. Precise and in situ genetic humanization of 6 Mb of mouse immunoglobulin genes. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5147-5152 (2014).
- Murphy, A. J., et al. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5153-5158 (2014).
- Macdonald, L. E., et al. Kappa-on-Heavy (KoH) bodies are a distinct class of fully-human antibody-like therapeutic agents with antigen-binding properties. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 292-299 (2020).
- Pieper, K., Grimbacher, B., Eibel, H. B-cell biology and development. Journal of Allergy and Clinical Immunology. 131 (4), 959-971 (2013).
- Nagasawa, T. Microenvironmental niches in the bone marrow required for B-cell development. Nature Reviews: Immunology. 6 (2), 107-116 (2006).
- Lund, F. E. Cytokine-producing B lymphocytes-key regulators of immunity. Current Opinion in Immunology. 20 (3), 332-338 (2008).
- Martensson, I. L., Keenan, R. A., Licence, S. The pre-B-cell receptor. Current Opinion in Immunology. 19 (2), 137-142 (2007).
- von Boehmer, H., Melchers, F. Checkpoints in lymphocyte development and autoimmune disease. Nature Immunology. 11 (1), 14-20 (2010).
- Goodnow, C. C., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Zikherman, J., Parameswaran, R., Weiss, A. Endogenous antigen tunes the responsiveness of naive B cells but not T cells. Nature. 489 (7414), 160-164 (2012).
- Melchers, F. Checkpoints that control B cell development. Journal of Clinical Investigation. 125 (6), 2203-2210 (2015).
- Henderson, R. B., et al. A novel Rac-dependent checkpoint in B cell development controls entry into the splenic white pulp and cell survival. Journal of Experimental Medicine. 207 (4), 837-853 (2010).
- Pillai, S., Cariappa, A. The follicular versus marginal zone B lymphocyte cell fate decision. Nature Reviews: Immunology. 9 (11), 767-777 (2009).
- Shahaf, G., Zisman-Rozen, S., Benhamou, D., Melamed, D., Mehr, R. B. Cell Development in the Bone Marrow Is Regulated by Homeostatic Feedback Exerted by Mature B Cells. Frontiers in Immunology. 7, 77 (2016).
- Nemazee, D. Mechanisms of central tolerance for B cells. Nature Reviews: Immunology. 17 (5), 281-294 (2017).
- Petkau, G., Turner, M. Signalling circuits that direct early B-cell development. Biochemical Journal. 476 (5), 769-778 (2019).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-5 (2018).
- Betters, D. M. Use of Flow Cytometry in Clinical Practice. Journal of the Advanced Practioner in Oncology. 6 (5), 435-440 (2015).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews: Immunology. 12 (3), 191-200 (2012).
- Van Epps, H. L. Bringing order to early B cell chaos. Journal of Experimental Medicine. 203 (6), 1389 (2006).
- Hardy, R. R., Carmack, C. E., Shinton, S. A., Kemp, J. D., Hayakawa, K. Resolution and characterization of pro-B and pre-pro-B cell stages in normal mouse bone marrow. Journal of Experimental Medicine. 173 (5), 1213-1225 (1991).
- Allman, D., Pillai, S. Peripheral B cell subsets. Current Opinion in Immunology. 20 (2), 149-157 (2008).
- Shapiro-Shelef, M., Calame, K. Regulation of plasma-cell development. Nature Reviews: Immunology. 5 (3), 230-242 (2005).
- Kitamura, D., Roes, J., Kuhn, R., Rajewsky, K. A B cell-deficient mouse by targeted disruption of the membrane exon of the immunoglobulin mu chain gene. Nature. 350 (6317), 423-426 (1991).
- Keenan, R. A., et al. Censoring of autoreactive B cell development by the pre-B cell receptor. Science. 321 (5889), 696-699 (2008).
- Chan, V. W., Meng, F., Soriano, P., DeFranco, A. L., Lowell, C. A. Characterization of the B lymphocyte populations in Lyn-deficient mice and the role of Lyn in signal initiation and down-regulation. Immunity. 7 (1), 69-81 (1997).
- Zikherman, J., Doan, K., Parameswaran, R., Raschke, W., Weiss, A. Quantitative differences in CD45 expression unmask functions for CD45 in B-cell development, tolerance, and survival. Proceedings of the National Academy of Sciences of the United States of America. 109 (1), 3-12 (2012).
- Miyamoto, A., et al. Increased proliferation of B cells and auto-immunity in mice lacking protein kinase Cdelta. Nature. 416 (6883), 865-869 (2002).
- Mecklenbrauker, I., Kalled, S. L., Leitges, M., Mackay, F., Tarakhovsky, A. Regulation of B-cell survival by BAFF-dependent PKCdelta-mediated nuclear signalling. Nature. 431 (7007), 456-461 (2004).
- Okada, T., et al. Antigen-engaged B cells undergo chemotaxis toward the T zone and form motile conjugates with helper T cells. PLoS Biology. 3 (6), 150 (2005).
- Robinson, J. P. Flow Cytometry. Encyclopedia of Biomaterials and Biomedical Engineering. , 630-640 (2004).
- Lugli, E., Roederer, M., Cossarizza, A. Data analysis in flow cytometry: the future just started. Cytometry A. 77 (7), 705-713 (2010).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. European Journal of Immunology. 47 (10), 1584 (2017).
- Bigos, M. Separation index: an easy-to-use metric for evaluation of different configurations on the same flow cytometer. Current Protocols in Cytometry. , 21 (2007).
- Pillai, S., Mattoo, H., Cariappa, A. B. B cells and autoimmunity. Current Opinion in Immunology. 23 (6), 721-731 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados