Method Article
Caratterizzazione citometrica a flusso dello sviluppo delle cellule B murine
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo qui una semplice analisi dell'eterogeneità del compartimento delle cellule B immunitarie murine nel peritoneo, nella milza e nei tessuti del midollo osseo mediante citometria a flusso. Il protocollo può essere adattato ed esteso ad altri tessuti di topo.
Abstract
Studi approfonditi hanno caratterizzato lo sviluppo e la differenziazione delle cellule B murine negli organi linfoidi secondari. Gli anticorpi secreti dalle cellule B sono stati isolati e sviluppati in terapie ben consolidate. La convalida dello sviluppo delle cellule B murine, nel contesto di topi autoimmuni o in topi con sistema immunitario modificato, è una componente cruciale dello sviluppo o della sperimentazione di agenti terapeutici nei topi ed è un uso appropriato della citometria a flusso. Parametri citometrici a flusso di cellule B ben consolidati possono essere utilizzati per valutare lo sviluppo delle cellule B nel peritoneo murino, nel midollo osseo e nella milza, ma è necessario rispettare una serie di migliori pratiche. Inoltre, l'analisi citometrica a flusso dei compartimenti delle cellule B dovrebbe anche integrare ulteriori letture dello sviluppo delle cellule B. I dati generati utilizzando questa tecnica possono migliorare la nostra comprensione di modelli murini selvatici, autoimmuni e di topi umanizzati che possono essere utilizzati per generare anticorpi o molecole simili a anticorpi come terapeutici.
Introduzione
Gli anticorpi monoclonali sono diventati sempre più la terapia di scelta per molte malattie umane in quanto entrano a far parte della medicina tradizionale1,2. Abbiamo precedentemente descritto topi geneticamente modificati che producono in modo efficiente anticorpi che ospitano regioni variabili completamente umane con costanti IgH di topo3,4. Più recentemente, abbiamo descritto topi geneticamente modificati che producono molecole simili a anticorpi che hanno un legame antigene distinto5. Gli anticorpi sono secreti dalle cellule B e costituiscono la base dell'immunità umorale adattativa. Esistono due tipi distinti di cellule B, B-1 e B-2. Nei mammiferi, le cellule B-1 hanno origine nel fegato fetale e sono arricchite nei tessuti mucosi e nelle cavità pleurica e peritoneale dopo la nascita, mentre le cellule B-2 hanno origine nel fegato fetale prima della nascita e successivamente nel midollo osseo (BM). Le cellule B-2 sono arricchite negli organi linfoidi secondari tra cui la milza e il sangue6,7,8. Nel BM, i progenitori ematopoietici B-2 iniziano a differenziarsi in cellule pro-B all'inizio del riarrangiamento della catena pesante Ig mu9,10. Il riarrangiamento riuscito della catena pesante Ig e il suo assemblaggio nel recettore delle cellule pre-B (pre-BCR), insieme alla segnalazione e all'espansione proliferativa, porta alla differenziazione in cellule pre-B. Dopo che le cellule pre-B riorganizzano le loro catene leggere Ig kappa (Igκ), o se improduttive, Ig lambda (Igλ), si accoppiano con μ catena pesante, con conseguente espressione superficiale di IgM BCR. È importante sottolineare che l'espressione superficiale delle IgM è nota per essere ridotta in condizioni di autoreattività, contribuendo così all'autotolleranza nelle cellule B funzionalmente non reattive o anergiche11,12. Le cellule B immature entrano quindi in una fase di transizione, dove iniziano a co-esprimere IgD e migrano dal BM alla milza. Nella milza, l'espressione di IgD aumenta ulteriormente e le cellule maturano in un secondo stadio di cellule B di transizione, seguito dal completamento del loro stato di maturazione e dallo sviluppo in cellule della zona marginale (MZ) o follicolari (Fol)13,14,15. Nei topi adulti, in un ambiente non malato, il numero di cellule B mature rimane costante nonostante 10-20 milioni di cellule B immature vengano generate quotidianamente nel BM. Di questi, solo il tre per cento entra nel pool di cellule B mature. La dimensione del compartimento periferico delle cellule B è limitata dalla morte cellulare, dovuta in parte a diversi fattori tra cui l'auto-reattività e la maturazione incompleta16,17,18. L'analisi citometrica a flusso è stata ampiamente utilizzata per caratterizzare ed enumerare molti sottocompartimenti delle cellule immunitarie negli esseri umani e nei topi. Mentre ci sono alcune somiglianze tra compartimenti di cellule B umane e murine, questo protocollo si applica solo all'analisi delle cellule B murine. Questo protocollo è stato sviluppato con lo scopo di fenotipizzare topi geneticamente modificati, per determinare se la manipolazione genetica avrebbe alterato lo sviluppo delle cellule B. La citometria a flusso è stata anche molto popolare in molte applicazioni aggiuntive, tra cui la misurazione dell'attivazione cellulare, della funzione, della proliferazione, dell'analisi del ciclo, dell'analisi del contenuto del DNA, dell'apoptosi e dello smistamento cellulare 19,20.
La citometria a flusso è lo strumento di scelta per caratterizzare vari compartimenti linfocitari nei topi e nell'uomo, anche in organi complessi come la milza, il BM e il sangue. Grazie ai reagenti anticorpali specifici del topo ampiamente disponibili per la citometria a flusso, questa tecnica può essere utilizzata per studiare non solo le proteine di superficie cellulare, ma anche le fosfoproteine intracellulari e le citochine, nonché le letture funzionali21. Qui dimostriamo come i reagenti per citometria a flusso possono essere utilizzati per identificare i sottoinsiemi di cellule B man mano che maturano e si differenziano negli organi linfoidi secondari. Dopo l'ottimizzazione delle condizioni di colorazione, la gestione dei campioni, la corretta configurazione dello strumento e l'acquisizione dei dati e, infine, l'analisi dei dati, è possibile utilizzare un protocollo per l'analisi citometrica a flusso completa del compartimento delle cellule B nei topi. Tale analisi completa si basa su una nomenclatura vecchia di decenni ideata da Hardy e colleghi, in cui lo sviluppo di cellule BM B-2 può essere diviso in diverse frazioni (Frazione) a seconda della loro espressione di B220, CD43, BP-1, CD24, IgM e IgD22. Hardy et al., hanno dimostrato che le cellule B220+ CD43 BM B possono essere suddivise in quattro sottoinsiemi (Frazione A-C') sulla base dell'espressione DI BP-1 e CD24 (30F1), mentre le cellule B220+ CD43-(dim to neg) possono essere risolte in tre sottoinsiemi (Frazione D-F) basati sull'espressione differenziale di IgD e IgM23 di superficie. La frazione A (cellule pre-pro-B) è definita come BP-1- CD24 (30F1)-, la frazione B (prime cellule pro-B) è definita come BP-1- CD24 (30F1)+, la frazione C (cellule pro-B tardive) è definita come BP-1+ CD24 (30F1)+, e la frazione C' (prime cellule pre-B) è definita come BP-1+ e CD24high. Inoltre, la Frazione D (cellule pre-B) è definita come B220+ CD43- IgM- B, e la Frazione E (cellule B di nuova generazione, combinazione di cellule immature e transitorie) è definita come B220+ CD43- IgM+ B cells e la Frazione F (cellule B mature, a ricircolo) è definita come B220high CD43- IgM+ B cells. Al contrario, la maggior parte delle cellule B naïve presenti nella milza può essere suddivisa in cellule B mature (B220+ CD93-) e cellule transizionali (T1, T2, T3) a seconda dell'espressione di CD93, CD23 e IgM. Le cellule B mature possono essere risolte in zone marginali e sottoinsiemi follicolari basati sull'espressione di IgM e CD21/CD35, e sottoinsiemi follicolari possono essere ulteriormente suddivisi in sottoinsiemi follicolari maturi di tipo I e follicolari di tipo II B a seconda del livello della loro espressione superficiale IgM e IgD24. Queste popolazioni di cellule B spleniche esprimono prevalentemente la catena leggera Igκ. Infine, in letteratura sono state descritte popolazioni di cellule B-1 B, che hanno origine nel fegato fetale e si trovano principalmente nelle cavità peritoneale e pleurica di topi adulti. Queste cellule B peritoneali possono essere distinte dalle cellule B-2 B precedentemente descritte per la loro mancanza di espressione di CD23. Sono poi ulteriormente suddivisi in popolazioni B-1a o B-1b, con la prima definita dalla presenza di CD5 e la seconda dalla sua assenza25. I progenitori delle cellule B-1 sono abbondanti nel fegato fetale, ma non si trovano nel BM adulto. Mentre le cellule B-1a e B-1b provengono da diversi progenitori, entrambe seminano le cavità peritoneale e pleurica24. A differenza delle cellule B-2, le cellule B-1 sono in grado di auto-rinnovarsi e sono responsabili della produzione di anticorpi IgM naturali.
Difetti nello sviluppo delle cellule B possono insorgere in molti casi, tra cui carenze nei componenti del BCR26,27, perturbazioni di molecole di segnalazione che influenzano la potenza di segnalazione BCR14,28,29, o interruzione delle citochine che modulano la sopravvivenza delle cellule B30,31 . L'analisi citometrica a flusso dei compartimenti linfoidi ha contribuito alla caratterizzazione dei blocchi di sviluppo delle cellule B in questi topi e in molti altri. Un vantaggio dell'analisi citometrica a flusso dei compartimenti linfoidi è che offre la possibilità di effettuare misurazioni su singole cellule ottenute da tessuto dissociato vivo. La disponibilità di reagenti in una gamma sempre più ampia di fluorofori consente l'analisi simultanea di più parametri e consente la valutazione dell'eterogeneità delle cellule B. Inoltre, l'enumerazione delle cellule B mediante analisi citometrica a flusso integra altri saggi immunologici come i metodi immunoistochimici che visualizzano la localizzazione cellulare all'interno degli organi linfoidi, il rilevamento dei livelli di anticorpi circolanti come misura dell'immunità umorale, nonché due microscopi a fotoni per misurare le risposte delle cellule B nello spazio e nel tempo reali32.
Protocollo
Tutti gli studi sui topi sono stati supervisionati e approvati dall'Institutional Animal Care and Use Committee (IACUC) di Regeneron. L'esperimento è stato condotto su tessuti di tre topi femmina C57BL / 6J (17 settimane di età) dei Jackson Laboratories. Titolare tutti gli anticorpi prima di iniziare l'esperimento per determinare la concentrazione ideale. Quando si utilizzano perline di compensazione per la compensazione monocolore, assicurarsi che siano brillanti o più luminose dei campioni. Mantenere tutti i tamponi, gli anticorpi e le cellule sul ghiaccio o a 4 °C. Dopo l'aggiunta del colorante di vitalità, eseguire tutte le fasi e le incubazioni a 4 ° C in condizioni di scarsa illuminazione o al buio.
1. Raccolta delle cellule peritoneali e isolamento delle singole cellule
- Eutanasia del mouse utilizzando CO2 o secondo protocollo approvato.
- Appoggiare il mouse sulla schiena, spruzzare con etanolo al 70% e tagliare la pelle addominale esterna con le forbici, facendo attenzione a non tagliare il peritoneo.
- Iniettare 3 mL di tampone di lavaggio ghiacciato (0,5% di albumina sierica bovina (BSA) in DPBS [vol/vol]) nella cavità peritoneale con una siringa da 3 mL dotata di ago calibro 25.
- Massaggiare delicatamente il peritoneo con la punta delle dita.
- Ripetere i passaggi 1.3 e 1.4.
- Inserire una siringa da 3 ml dotata di un ago da 18 G attraverso il peritoneo, facendo attenzione ad evitare organi e grasso.
- Estrarre il tampone di lavaggio, ora contenente cellule peritoneali, e trasferire in tubo conico da 15 ml su ghiaccio.
- Ripetere i passaggi 1.3 e 1.4.
- Tagliare un piccolo foro nel peritoneo mentre si tiene in piedi con una pinzetta.
- Inserire una pipetta di trasferimento usa e getta nel foro e raccogliere il tampone di lavaggio rimanente, evitando ancora una volta grasso e organi.
- Trasferire le cellule peritoneali rimanenti raccolte nel tubo conico da 15 ml sul ghiaccio.
NOTA: Scartare il campione se la contaminazione del sangue è evidente. - Incubare le cellule sul ghiaccio fino al completamento dell'estrazione della milza e dell'osso.
- Centrifugare le celle a 300 x g per 8 min a 4 °C. Aspirare il surnatante.
- Risospendare il pellet cellulare in 1 mL di tampone di lavaggio.
- Filtrare le cellule attraverso un filtro cellulare da 70 μM in un tubo conico pulito da 15 ml su ghiaccio.
- Determinare la concentrazione cellulare utilizzando uno strumento contatore cellulare o un emocitometro.
2. Raccolta della milza e isolamento monocellulare
- Appoggia il mouse sulla pancia e taglia il peritoneo sul retro sinistro usando le forbici pulite. Tagliare la milza, rimuovendo il grasso e il tessuto connettivo.
- Trasferire la milza in un tubo microcentrifuga da 1,5 mL contenente 1 mL di tampone di lavaggio su ghiaccio.
- Incubare la milza sul ghiaccio fino al completamento dell'estrazione ossea.
- Spostare la milza in un tubo di dissociazione automatizzato con 5 ml di tampone di lisi dei globuli rossi. Posizionare il tubo sullo strumento di dissociatore tissutale e dissociarsi per 60 s per creare una sospensione a singola cellula.
NOTA: È anche consentito utilizzare altri metodi di routine per ottenere sospensioni di milza a singola cellula come la frantumazione tra vetrini smerigliati nel tampone di lavaggio. Se viene utilizzato un altro metodo di dissociazione, seguire la dissociazione con centrifugazione, aspirazione e quindi risospensione in 5 ml di tampone di lisi dei globuli rossi prima di continuare con il passaggio 2.5. - Incubare le celle a temperatura ambiente per 3 min.
- Aggiungere 10 mL di tampone di lavaggio a 4 °C contenente 2mM EDTA.
- Trasferire in un tubo conico pulito da 15 ml.
- Centrifugare le celle a 300 x g per 8 min a 4 °C. Aspirare il surnatante.
- Risospesare il pellet cellulare in 5 mL di tampone di lavaggio a 4 °C.
- Filtrare le cellule attraverso un filtro cellulare da 70 μM in un tubo conico pulito da 15 ml su ghiaccio.
- Determinare la concentrazione cellulare utilizzando uno strumento contatore cellulare o un emocitometro.
3. Raccolta BM e isolamento a singola cellula
- Rimuovere la pelle dalla metà inferiore del corpo del mouse. Tagliare il muscolo in eccesso dalla gamba. Rimuovere l'intera gamba con le forbici, facendo attenzione a non tagliare il femore. Pulire il femore e la tibia rimuovendo i muscoli, il grasso e i piedi rimanenti.
- Trasferire le ossa in un tubo microcentrifuga da 1,5 mL contenente 1 mL di tampone di lavaggio su ghiaccio.
- Perforare il fondo di un tubo microcentrifuga da 0,5 ml, lasciando un foro abbastanza piccolo da non sporgere le ossa delle gambe. Inserire il tubo da 0,5 mL in un tubo microcentrifuga pulito da 1,5 mL. Tagliare l'estremità del femore e della tibia prossimale al ginocchio e posizionare le estremità tagliate rivolte verso il basso nel tubo da 0,5 ml.
- Centrifugare le celle a 6.780 x g per 2 min a 4 °C.
- Risospendare il pellet cellulare in 1 mL di tampone di lisi dei globuli rossi e trasferirlo in un tubo conico da 15 mL contenente ulteriori 3 mL di tampone di lisi dei globuli rossi.
- Incubare a temperatura ambiente per 3 min.
- Aggiungere 10 mL di tampone di lavaggio a 4 °C contenente 2mM EDTA.
- Centrifugare le celle a 300 x g per 8 min a 4 °C. Aspirare il surnatante.
- Risospendare il pellet di cella in 3 mL di tampone di lavaggio a 4 °C.
- Filtrare le celle attraverso un filtro cellulare da 70 μM in un tubo conico pulito da 15 ml su ghiaccio.
- Determinare la concentrazione cellulare utilizzando uno strumento contatore cellulare o un emocitometro.
4. Macchiare le cellule e preparare la compensazione
- Aliquot 106 cellule di ogni tipo di cellula da ogni animale a una piastra inferiore a 96 pozzetti U.
- Assicurati di includere abbastanza pozzetti per tutti i campioni e i controlli, tra cui la colorazione completa, la fluorescenza meno uno (FMO), non macchiata e infine la compensazione monocolore opzionale per ogni fluoroforo utilizzato.
- Per il pannello di maturazione BM e il pannello di maturazione della milza, cellule aliquote in 2 pozzetti, 106 cellule per pozzetto, per ogni campione di macchia completo. Per i controlli di vitalità della compensazione a colore singolo, aggiungere 2 x 106 celle di ciascun tipo di cella ai singoli pozzetti.
- Centrifugare la piastra a 845 x g per 2 min a 4 °C. Decantare il surnatante invertendo rapidamente e facendo scorrere la piastra su un lavandino, facendo attenzione a non contaminare i pozzi.
- Risospesare le cellule in 200 μL di DPBS (senza BSA o FBS). Questo passaggio è importante per rimuovere le proteine prima di colorare con colorante di vitalità amminico-reattivo.
- Ripetere i passaggi 4.2 e 4.3.
- Ripetere il passaggio 4.2.
- Risospesso le cellule in un colorante di vitalità da 100 μL diluito 1:1.000 in DPBS.
NOTA: se si utilizzano celle per la compensazione di un solo colore, non aggiungere colorante di vitalità a tali pozzetti.- Per ogni set di macchie, lasciare diversi pozzetti non macchiati per un campione completamente non macchiato e qualsiasi altro controllo di cui potresti aver bisogno.
- Per ogni set di macchie, lasciare un ulteriore pozzo non macchiato per il controllo FMO di viabilità.
- Per i controlli di compensazione della vitalità monocolore: risospesso le 2 x 106 celle, aliquotate nello stadio 4.1, in 200 μL di colorante di vitalità diluito. Trasferire 100 μL di cellule in un tubo microcentrifuga da 1,5 mL, celle termiche per 5 minuti a 65 °C e trasferire i 100 μL di cellule uccise termicamente al pozzo originale con i 100 μL rimanenti cellule vive.
- Incubare le cellule a 4 °C, al riparo dalla luce, per 30 min.
- Centrifugare la piastra a 845 x g per 2 min a 4 °C. Decantare il surnatante invertendo rapidamente e facendo scorrere la piastra su un lavandino, facendo attenzione a non contaminare i pozzi.
- Risospesare le cellule in 200 μL di DPBS (senza BSA o FBS).
- Ripetere i passaggi 4.8 e 4.9.
- Ripetere il passaggio 4.8.
- Risospesare le cellule in 50 μL di blocco Fc diluito 1:50 (concentrazione finale= 10 μg/mL) in tampone colorante (0,5% BSA in DPBS [vol/vol]).
- Per le cellule peritoneali - aggiungere anche 5 μL di bloccante monocitario per ridurre la colorazione non specifica.
- Incubare le cellule a 4 °C, al riparo dalla luce, per 15 min.
- Preparare miscele complete di stain master e FMO in stain buffer per un volume finale di 100 μl per 106 celle. Fare riferimento alla Tabella 1-Tabella 4 per gli elenchi degli anticorpi.
NOTA: gli FMO sono realizzati includendo tutti gli anticorpi in un set di macchie tranne uno. Preparare un FMO per ogni anticorpo in un set di macchie. Quando un set di macchie contiene più coloranti brillanti, sostituire 50 μL di tampone di macchia brillante per tampone di macchia per campione - Senza rimuovere il blocco Fc, aggiungere 100 μL di miscele di macchie complete e FMO ai pozzetti selezionati.
- Preparare controlli di compensazione monocolore per ogni anticorpo in un set di macchie.
- Se si utilizzano perline di compensazione, seguire le istruzioni per l'uso del produttore.
- Se si utilizzano cellule, aggiungere anticorpi titolati a 106 cellule, riservate in precedenza nel passaggio 4.6.1 senza colorante di vitalità, in tampone di colorazione da 100 μL. Se tutte le cellule del campione sono positive per un particolare marcatore, mettere da parte le cellule non macchiate da utilizzare per acquisire i dati di compensazione sul citometro a flusso.
- Incubare le cellule e le perline a 4 °C, al riparo dalla luce, per 30 min.
- Centrifugare la piastra a 845 x g per 2 min a 4 °C. Decantare il surnatante invertendo rapidamente e facendo scorrere la piastra su un lavandino, facendo attenzione a non contaminare i pozzi.
- Risospendare le cellule e le perline in 200 μL di tampone antimacchia.
- Ripetere i passaggi 4.18 e 4.19 due volte.
- Ripetere il passaggio 4.18.
- Per fissare i campioni per l'analisi entro 48 ore, risospese le cellule e le perline in 200 μL di paraformaldeide al 2% in DPBS.
ATTENZIONE: La parafomaldeide è un grave pericolo per la salute e infiammabile. Fare riferimento alla scheda tecnica di Safty prima dell'uso. - Incubare le cellule e le perline a 4 °C, al riparo dalla luce, per 30 min.
- Ripetere i passaggi 4.18 e 4.19 due volte.
- Posizionare una piastra filtrante su una piastra a U pulita da 96 pozzetti. Utilizzando una pipetta multipla, trasferire ogni campione in un pozzetto della piastra filtrante.
- Centrifugare la piastra filtrante-96 pozzo U-bottom piastra impostata a 845 x g per 2 min a 4 °C. Rimuovere la piastra filtrante e decantare il surnatante invertendo e facendo scorrere rapidamente la piastra su un lavandino, facendo attenzione a non contaminare i pozzi.
- Per i pannelli di maturazione bm e milza, sospendere le cellule completamente colorate in 100 μL di tampone antimacchia. Unire i 2 pozzetti per ogni animale in 1 pozzo. Sospendere i pannelli, gli FMO e i controlli rimanenti in 200 μL di tampone antimacchia.
- Incubare cellule fisse e perline a 4 °C, al riparo dalla luce, durante la notte.
5. Acquisizione dati citometrici a flusso
- Inizializzare e qc il citometro a flusso secondo le istruzioni del produttore.
- Carica il modello specifico per ogni pannello.
- Prima di registrare i dati, assicurarsi che tutti gli eventi per ciascun campione siano in scala e visibili sui dot plot.
- Registrare i controlli di compensazione per ciascun pannello di macchia utilizzando compensazioni di macchia singola preparate nel passaggio 4.16. Impostare porte positive e negative per ciascun campione. Chiedi al software di calcolare la matrice di compensazione.
- Inizia ad acquisire il primo campione e assicurati che i cancelli siano impostati in modo appropriato.
- Impostare la macchina in modo da registrare almeno 50.000 eventi di cellule B per il pannello cellulare B peritoneale e il pannello della milza Igκ e Igλ; 150.000 eventi di cellule B per il pannello di maturazione BM; e 300.000 eventi di cellule B per il pannello di maturazione della milza.
- Per ogni pannello di macchia, eseguire e registrare i campioni completamente macchiati per ogni animale, un campione non macchiato e gli FMO.
6. Analizza i dati
- Procedere con l'analisi dei dati utilizzando il software di analisi della citometria a flusso. Seguire le strategie di gating descritte in Figura 1, Figura 2, Figura 3, Figura 4.
Risultati
Qui presentiamo la strategia di gating per caratterizzare lo sviluppo delle cellule B nel peritoneo di topo, nel BM e nella milza. La base dell'analisi si forma attorno al concetto di colorazione con colorante di vitalità, quindi estraendo doppietti basati su Forward-Scatter-Area (FSC-A) e Forward-Scatter-Height (FSC-H), e infine estraendo i detriti selezionando le celle in base alle loro caratteristiche FSC-A e Side-Scatter-Area (SSC-A), qui indicate come size gate, che riflettono la dimensione relativa della cella e la granularità della cella, prima di gating sulla popolazione di interesse.
L'analisi citometrica a flusso delle cellule B peritoneali mostra le frequenze delle cellule peritoneali vitali, delle cellule B totali, dei sottoinsiemi B-1 e B-2, nonché delle cellule B-1a e B-1b nei topi C57BL/ 6J (Figura 1), utilizzando un pannello di colorazione delineato nella Tabella 1. Il numero medio assoluto di celle di queste frequenze è mostrato nella Tabella 5. Le perturbazioni nelle cellule B-1 potrebbero essere delineate dalla distribuzione di sottoinsiemi cellulari, sia per frequenza cellulare che per numero assoluto di cellule per topo.
L'analisi citometrica a flusso delle cellule BM B mostra le frequenze delle cellule BM vitali, delle cellule B totali, della frazione A (cellule pre-pro-B e linfociti contaminanti), delle cellule pre-pro-B, della frazione B, della frazione C, della frazione C', della frazione D, immature (sottoinsieme nella frazione E), delle transizioni (sottoinsieme nella frazione E) e delle cellule della frazione F B nei topi C57BL / 6J (Figura 2), utilizzando un pannello di colorazione delineato nella Tabella 2. Il numero medio assoluto di celle di queste frequenze è mostrato nella Tabella 6. Le perturbazioni nelle cellule BM B potrebbero essere delineate dalla distribuzione di sottoinsiemi cellulari, sia per frequenza cellulare che per numero assoluto di cellule per gamba(e).
L'analisi citometrica a flusso delle cellule B della milza mostra le frequenze delle cellule della milza vitali, delle cellule B totali, delle cellule B di transizione, delle cellule T1, T2, T3, delle cellule B mature, delle cellule follicolari I (Fol I), delle cellule follicolari II (Fol II), delle cellule precursori della zona marginale (MZ), delle cellule MZ mature e delle cellule B-1 nei topi C57BL / 6J (Figura 3), utilizzando un pannello di colorazione delineato nella Tabella 3. Il numero medio assoluto di celle di queste frequenze è mostrato nella Tabella 7. Le perturbazioni nelle cellule B della milza potrebbero essere delineate dalla distribuzione di sottoinsiemi cellulari, sia per frequenza cellulare che per numero assoluto di cellule per milza.
Allo stesso modo, l'analisi citometrica a flusso della milza mostra le frequenze delle cellule B Igκ+ e Igλ+ nei topi C57BL/6J (Figura 4), utilizzando un pannello di colorazione delineato nella Tabella 4. Il numero medio assoluto di celle di queste frequenze è mostrato nella Tabella 8. Le perturbazioni nelle Bcell Igκ+ e Igλ+ potrebbero essere delineate dalla distribuzione dei sottoinsiemi cellulari, sia per frequenza cellulare che per numero assoluto di cellule per milza.
| Anticorpo | Fluoroforo | clone |
| CD19 · | APC-H7 · | 1D3 · |
| B220 · | APC | RA3-6B2 · |
| Igm | PeCy7 · | II/41 · |
| IgD · | PerCpCy5,5 | 11-26c.2a |
| CD43 · | FITC · | S7 · |
| CD23 · | BUV395 · | B3B4 · |
| CD11b · | BV711 · | M1/70 · |
| CD5 · | BV605 · | 53-7.3 |
Tabella 1: Pannello peritoneale delle cellule B
| Anticorpo | Fluoroforo | clone |
| CD19 · | APC-H7 · | 1D3 · |
| B220 · | APC | RA3-6B2 · |
| Igm | PeCy7 · | II/41 · |
| IgD · | PerCpCy5,5 | 11-26c.2a |
| CD43 · | FITC · | 1B11 · |
| CD24 (HSA) | PE | 30-F1 |
| C-Kit | BUV395 · | 2B8 · |
| BP-1 · | BV786 · | BP-1 · |
| CD93 · | BV711 · | AA4,1 |
| canale dump | ||
| CD3 · | AF700 · | 17-A2 |
| CD11b · | AF700 · | M1/70 · |
| GR1 (Ly6C/6G) | AF700 · | RB6-8C5 · |
| Ter119 · | AF700 · | TER-119 · |
Tabella 2: Pannello di maturazione del midollo osseo
| Anticorpo | Fluoroforo | clone |
| CD19 · | APC-H7 · | 1D3 · |
| B220 · | APC | RA3-6B2 · |
| Igm | PeCy7 · | II/41 · |
| IgD · | PerCpCy5,5 | 11-26c.2a |
| CD43 · | FITC · | S7 · |
| CD23 · | BUV395 · | B3B4 · |
| CD21/35 · | BV421 · | 7G6 · |
| CD11b · | AF700 · | M1/70 · |
| CD5 · | BV605 · | 53-7.3 |
| CD93 · | PE | AA4,1 |
Tabella 3: Pannello di maturazione della milza
| Anticorpo | Fluoroforo | clone |
| CD19 · | APC-H7 · | 1D3 · |
| B220 · | APC | RA3-6B2 · |
| Igm | PeCy7 · | II/41 · |
| IgD · | PerCpCy5,5 | 11-26c.2a |
| CD3 · | PB | 17-A2 |
| Kappa | FITC · | 187.1 |
| Lambda | PE | RML-42 · |
Tabella 4: Spleen Igκ e Igλ Panel
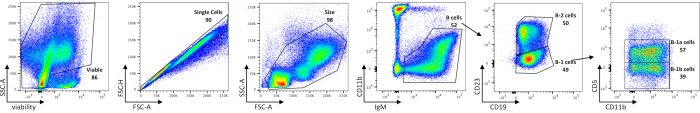
Figura 1: Caratterizzazione delle popolazioni di cellule B nel peritoneo. Le cellule B peritoneali vitali, a singola cellula, di dimensioni gated, vengono prima separate dalle cellule contaminanti mediante gating su cellule IgM +. Le cellule B-1 e B-2 si distinguono quindi l'una dall'altra per assenza (B-1) o presenza di CD23 (B-2). La successiva espressione CD5 viene utilizzata per delineare le cellule B-1a (CD5+) dalle cellule B-1b (CD5-). Gli FMO sono stati utilizzati per determinare empiricamente dove disegnare i cancelli. I numeri sono percentuali di ogni popolazione all'interno dello stesso grafico di densità. Fare clic qui per visualizzare una versione più grande di questa figura.
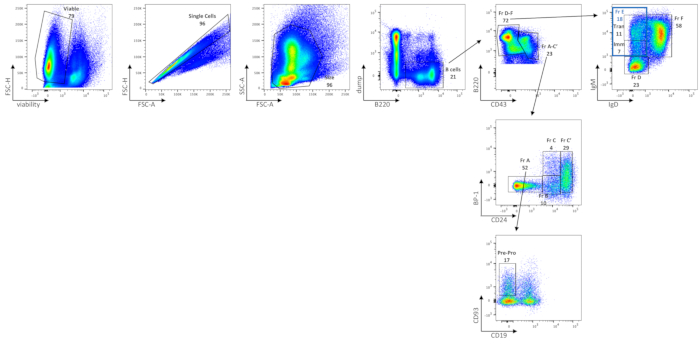
Figura 2: Caratterizzazione di sottoinsiemi di cellule B nel BM. Le cellule BM B vitali, a cella singola, di dimensioni gated sono separate dalle cellule non B gating su celle B220+ dump( dove dump si riferisce a CD3 / GR-1 / CD11b / TER119). L'espressione CD43 e B220 definisce ulteriormente la frazione di Hardy A-C' (CD43+ B220+) e la frazione di Hardy D-F (CD43low/neg B220+/++). La frazione A-C' è ulteriormente separata dall'espressione di BP-1 e CD24. La frazione A (BP-1- CD24-) corrisponde alle cellule pre-pro-B insieme alle cellule contaminanti. Per separare le cellule pre-pro-B dalle cellule contaminanti nella frazione A, vengono utilizzate l'espressione di CD93 e l'assenza di CD19. La frazione B (BP-1- CD24int) e la frazione C (BP-1+ CD24int) corrispondono rispettivamente alle cellule pro-B precoci e tardive e alla frazione C' (BP-1+/- CD24+) corrisponde alle prime cellule pre-B. Per separare la frazione D-F, viene utilizzata l'espressione di IgM e IgD. La frazione D corrisponde alle cellule pre-B tardive (IgM-/IgD basse-); Frazione E (blue gate, IgMint/high IgD-) a cellule B immature (Imm, IgMint IgD-) e transizionali (Tran, IgMhigh IgD-); e la frazione F (IgMint/IgD+ alta) alle cellule B mature a ricircolo. Gli FMO sono stati utilizzati per determinare empiricamente dove disegnare i cancelli. I numeri sono percentuali di ogni popolazione all'interno dello stesso grafico di densità. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Caratterizzazione della maturazione delle cellule B della milza. Le cellule B spleniche vitali, a singola cellula, di dimensioni gated sono separate dalle cellule non B mediante gating su cellule B220+. Al fine di identificare il sottoinsieme B-1, le cellule CD23- CD19+ sono identificate e definite dall'espressione di CD43. Per classificare le popolazioni B-2, le cellule CD19+ sono separate in cellule B transizionali (CD93+ B220+) e mature (CD93- B220+). Le cellule di transizione (CD93+ B220+) sono ulteriormente suddivise in popolazioni T1 (IgM+ CD23-), T2 (IgM+ CD23+) e T3 (IgMint CD23+). Le cellule mature (CD93- B220+) sono separate in cellule B della zona marginale (CD21/35+ IgM+) e follicolari (CD21/35int IgMint/+). L'espressione di CD23 viene ulteriormente utilizzata per separare le cellule precursori MZ (CD23+ B220+) dalle cellule MZ (CD23- B220+) più mature. Le popolazioni follicolari vengono quindi delineate in cellule Fol I (IgD+ IgMint) e Fol II (IgD+ IgM+). Gli FMO sono stati utilizzati per determinare empiricamente dove disegnare i cancelli. I numeri sono percentuali di ogni popolazione all'interno dello stesso grafico di densità Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Espressione di Igκ e Igλ delle cellule B spleniche. Le cellule B spleniche vitali, a singola cellula, di dimensioni gated sono separate dalle cellule non B mediante gating su cellule B220 + CD3-. Le cellule B si distinguono quindi per l'espressione di Igλ e Igκ. I numeri sono percentuali di ogni popolazione all'interno dello stesso grafico di densità. Fare clic qui per visualizzare una versione più grande di questa figura.
| Numero di cella assoluto | |||||
| Numero animale | Cellule peritoneali vitali | Cellule B | Cellule B-1a | Cellule B-1b | Cellule B-2 |
| 1 | 1,02E+07 | 4,67E+06 | 1,28E+06 | 8,95E+05 | 2,35E+06 |
| 2 | 9,92E+06 | 4,52E+06 | 1,49E+06 | 9,60E+05 | 1,91E+06 |
| 3 | 1,15E+07 | 4,56E+06 | 1,71E+06 | 9,19E+05 | 1,78E+06 |
| Nella media | 1,05E+07 | 4,58E+06 | 1,49E+06 | 9,25E+05 | 2,01E+06 |
Tabella 5: Numeri assoluti di cellule B peritoneali
| Numero di cella assoluto | |||||||||||
| Numero animale | Cellule vitali del midollo osseo | Cellule B | Frazione A | Pre-pro | Frazione B | Frazione C | Frazione C' | Frazione D | Immaturo | Transitorio | Frazione F |
| 1 | 5,05E+07 | 9,70E+06 | 1,13E+06 | 1,95E+05 | 2,22E+05 | 9,14E+04 | 6,31E+05 | 1,59E+06 | 4,56E+05 | 7,81E+05 | 4,03E+06 |
| 2 | 5,39E+07 | 1,03E+07 | 1,14E+06 | 2,29E+05 | 2,89E+05 | 1,22E+05 | 8,40E+05 | 2,11E+06 | 5,39E+05 | 8,07E+05 | 3,67E+06 |
| 3 | 5,93E+07 | 1,01E+07 | 1,10E+06 | 2,12E+05 | 2,84E+05 | 1,05E+05 | 9,02E+05 | 2,72E+06 | 5,94E+05 | 7,62E+05 | 2,59E+06 |
| Nella media | 5,46E+07 | 1,00E+07 | 1,12E+06 | 2,12E+05 | 2,65E+05 | 1,06E+05 | 7,91E+05 | 2,14E+06 | 5,29E+05 | 7,83E+05 | 3,43E+06 |
Tabella 6: Numeri assoluti di cellule B del midollo osseo sottoinsiemi di cellule B
| Numero di cella assoluto | ||||||||||||
| Numero animale | Cellule vitali della milza | Cellule B | Cellule B di transizione | Cellule T1 | Cellule T2 | Cellule T3 | Cellule B mature | Cellule follicolari I | Cellule follicolari II | Cellule della zona marginale precursore | Cellule mature della zona marginale | Cellule B-1 |
| 1 | 9,16E+07 | 4,61E+07 | 3,66E+06 | 1,55E+06 | 1,10E+06 | 7,16E+05 | 4,06E+07 | 2,39E+07 | 5,27E+06 | 2,17E+06 | 3,98E+06 | 8,83E+05 |
| 2 | 9,97E+07 | 5,18E+07 | 4,88E+06 | 1,97E+06 | 1,57E+06 | 1,00E+06 | 4,49E+07 | 2,68E+07 | 7,33E+06 | 3,42E+06 | 3,84E+06 | 8,15E+05 |
| 3 | 1,02E+08 | 5,34E+07 | 4,64E+06 | 1,98E+06 | 1,41E+06 | 8,54E+05 | 4,62E+07 | 2,81E+07 | 5,84E+06 | 3,58E+06 | 4,02E+06 | 1,01E+06 |
| Nella media | 9,77E+07 | 5,04E+07 | 4,39E+06 | 1,83E+06 | 1,36E+06 | 8,58E+05 | 4,39E+07 | 2,63E+07 | 6,15E+06 | 3,06E+06 | 3,94E+06 | 9,02E+05 |
Tabella 7: Numeri assoluti di cellule B dei sottoinsiemi di cellule B della milza
| Numero di cella assoluto | ||||
| Numero animale | Cellule vitali della milza | Cellule B | Cellule Igκ+ B | Cellule Igλ+ B |
| 1 | 9,16E+07 | 4,97E+07 | 4,51E+07 | 2,46E+06 |
| 2 | 9,97E+07 | 5,63E+07 | 5,08E+07 | 3,16E+06 |
| 3 | 1,02E+08 | 5,91E+07 | 5,33E+07 | 3,24E+06 |
| Nella media | 9,77E+07 | 5,50E+07 | 4,97E+07 | 2,95E+06 |
Tabella 8: Numeri assoluti di celle Igκ e Igλ B sottoinsiemi
Discussione
L'analisi citometrica a flusso di tessuti linfoidi e non linfoidi ha permesso l'identificazione simultanea e l'enumerazione delle sottopopolazioni di cellule B nei topi e negli esseri umani dal 1980. È stato usato come misura dell'immunità umorale e può essere applicato ulteriormente per valutare la funzionalità delle cellule B. Questo metodo sfrutta la disponibilità di reagenti per valutare le diverse fasi della maturazione delle cellule B nei topi e nell'uomo, attraverso l'analisi simultanea di più parametri che consentono la valutazione dell'eterogeneità delle cellule B, anche in popolazioni rare. Se utilizzato per misurare campioni eterogenei complessi, è in grado di rilevare sottopopolazioni in pochi minuti, su singole cellule33. La strategia di analisi sequenziale del gating, più spesso applicata all'analisi citometrica a flusso, può essere semplice e intuitiva quando è necessario identificare una popolazione specifica34. Infine, un altro vantaggio della citometria a flusso è che è facilmente adattabile nella maggior parte dei laboratori accademici, sotto la guida di utenti esperti. Il nostro protocollo descrive con successo la valutazione delle popolazioni di cellule B nel peritoneo, bm e milza dei topi, descrivendo ed enumerando le popolazioni B-1 e approfondendo lo sviluppo di cellule B-2 pro-B, cellule pre-B, cellule B immature, transizionali e mature, nonché la loro espressione superficiale di catene leggere Igκ o Igλ. La citometria a flusso è il metodo più utilizzato e più semplice da applicare quando si studia lo sviluppo delle cellule B nei topi.
Mentre la citometria a flusso genera dati inestimabili, ci sono alcuni limiti a questa tecnologia quando viene utilizzata per indagare l'eterogeneità del compartimento delle cellule B immunitarie. Enormi set di dati possono essere travolgenti perché 10 colorazioni consentono il riconoscimento di oltre 1.024 diverse popolazioni cellulari34. Si deve prendere in considerazione che alcuni marcatori di cellule linfoidi comunemente usati hanno dimostrato di essere meno specifici di quanto si pensasse inizialmente. Questo può essere risolto impiegando una moltitudine di marcatori di superficie cellulare per accertare il gating sulle popolazioni desiderate. Mentre l'analisi citometrica a flusso può essere semplice e intuitiva, un altro vincolo all'analisi citometrica a flusso è che in genere consente la visualizzazione di soli due parametri alla volta, sebbene gli strumenti di visualizzazione dei dati come t-SNE possano essere utilizzati per raggruppare popolazioni cellulari in modo più efficiente quando si utilizza la citometria a flusso ad alto parametro. Un'altra importante limitazione è che le porte utilizzate sia durante l'acquisizione che durante l'analisi dipendono talvolta dalla soggettività dell'operatore.
Per un adattamento o una replica di successo di questo protocollo, ci sono diversi parametri critici che devono essere presi in considerazione35. Un'attenta considerazione deve essere presa nella progettazione del pannello e nella selezione del fluorocromo. È imperativo accoppiare antigeni deboli o importanti con fluorocromi luminosi. La titolazione degli anticorpi deve essere effettuata per evitare che l'eccesso di legame anticorpale alle cellule non sia specifico, aumentando potenzialmente la colorazione di fondo e diminuendo la risoluzione. La titolazione degli anticorpi viene effettuata colorando un numero noto di cellule con concentrazioni decrescenti di anticorpi, per determinare il miglior indice di separazione36. Questo dovrebbe essere ripetuto per ogni lotto di anticorpi. Durante la preparazione e la colorazione del campione, è importante assicurare una sospensione a singola cellula evitando Ca++ e Mg++. Inoltre, l'aggiunta di EDTA può aiutare a prevenire l'aggregazione cellulare e l'attività enzimatica che può portare a stimilulazione mediata da anticorpi e internalizzazione di marcatori marcati. Prima dell'acquisizione dei dati, i campioni devono essere adeguatamente sospesi, filtrati e privi di aggregati. Lo spillover del segnale da un parametro all'altro viene risolto utilizzando controlli di compensazione, sotto forma di singole celle colorate o di perline di compensazione disponibili in commercio35. Un'altra considerazione importante è quella di avere controlli adeguati in ogni esperimento. Le cellule non macchiate stabiliscono la linea di base dell'autofluorescenza. I controlli isotipici non sono più considerati controlli appropriati per il gating a causa di un legame non specifico. Il passo più importante per aiutare a realizzare cancelli accurati è l'uso di controlli FMO. In un controllo FMO, tutti gli anticorpi coniugati sono presenti nella macchia tranne quello per cui viene controllato. I controlli FMO consentono di misurare la diffusione di tutti i fluorofori nel canale mancante e quindi consentono di impostare i cancelli di conseguenza. È fondamentale che vengano acquisite abbastanza celle per una maggiore precisione. Come regola generale, dovrebbero essere raccolti almeno 2.000 eventi della popolazione di interesse. Infine, i controlli di compensazione, siano essi perline o cellule, dovrebbero essere esattamente abbinati ai fluorocromi utilizzati e i controlli devono essere almeno altrettanto luminosi dei campioni sperimentali37.
Nel complesso, l'analisi citometrica bassa dei compartimenti delle cellule B è ampiamente utilizzata nel campo dell'immunologia. Questa tecnica può essere utilizzata per studiare le perturbazioni nell'immunità umorale sia in topi selvatici che geneticamente modificati, in stati non patologici e su sfida immunologica.
Divulgazioni
Tutti gli autori sono dipendenti e azionisti di Regeneron Pharmaceuticals, Inc.
Riconoscimenti
Ringraziamo Matthew Sleeman per la lettura critica del manoscritto. Ringraziamo anche i dipartimenti Vivarium Operations e Flow Cytometry Core di Regeneron per aver supportato questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5 mL safe-lock Eppendorf tubes | Eppendorf | 22363611 | 0.5 mL microcentrifuge tube |
| 1.5mL Eppendorf tubes | Eppendorf | 22364111 | 1.5 mL microcentrifuge tube |
| 15 mL Falcon tubes | Corning | 352097 | 15 mL conical tube |
| 18 gauge needle | BD | 305196 | |
| 25 gauge needle | BD | 305124 | |
| 3 mL syringe | BD | 309657 | |
| 70 mM MACS SmartStrainer | Miltenyi Biotec | 130-110-916 | 70 mM cell strainer |
| 96 well U bottom plate | VWR | 10861-564 | |
| ACK lysis buffer | GIBCO | A1049201 | red blood cell lysis buffer |
| Acroprep Advance 96 Well Filter Plate | Pall Corporation | 8027 | filter plate |
| B220 | eBiosciences | 17-0452-82 | |
| BD CompBead Anti-Mouse Ig/κ | BD | 552843 | compensation beads |
| BD CompBead Anti-Rat Ig/κ | BD | 552844 | compensation beads |
| Bovine Serum Albumin | Sigma-Aldrich | A8577 | BSA |
| BP-1 | BD | 740882 | |
| Brilliant Stain Buffer | BD | 566349 | brilliant stain buffer |
| C-Kit | BD | 564011 | |
| CD11b | BD | 563168 | |
| CD11b | BioLegend | 101222 | |
| CD19 | BD | 560143 | |
| CD21/35 | BD | 562756 | |
| CD23 | BD | 740216 | |
| CD24 (HSA) | BioLegend | 138504 | |
| CD3 | BD | 561388 | |
| CD3 | BioLegend | 100214 | |
| CD43 | BD | 553270 | |
| CD43 | BioLegend | 121206 | |
| CD5 | BD | 563194 | |
| CD93 | BD | 740750 | |
| CD93 | BioLegend | 136504 | |
| DPBS (1x) | ThermoFisher | 14190-144 | DPBS |
| eBioscience Fixable Viability Dye eFluor 506 | ThermoFisher | 65-0866-14 | viability dye |
| Extended Fine Tip Transfer Pipette | Samco | 233 | disposable transfer pipette |
| FACSymphony A3 flow cytometer | BD | custom order | flow cytometer |
| Fc Block, CD16/CD32 (2.4G2) | BD | 553142 | Fc block |
| FlowJo | Flowjo | flow cytometer analysis software | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-096-334 | automated dissociation tube |
| gentleMACS Octo Dissociator with Heaters | Miltenyi Biotec | 130-095-937 | tissue dissociator instrument |
| GR1 (Ly6C/6G) | BioLegend | 108422 | |
| IgD | BioLegend | 405710 | |
| IgM | eBiosciences | 25-5790-82 | |
| Kappa | BD | 550003 | |
| Lambda | BioLegend | 407308 | |
| paraformaldehyde, 32% Solution | Electron Microscopy Sciences | 15714 | |
| Ter119 | BioLegend | 116220 | |
| True-Stain Monocyte Blocker | BioLegend | 426103 | monocyte blocker |
| UltraPure EDTA, pH 8.0 | ThermoFisher | 15575038 | EDTA |
| Vi-CELL XR | Beckman Coulter | 731050 | cell counter instrument |
Riferimenti
- Shepard, H. M., Philips, G. L., Thanos, D., Feldman, M. Developments in therapy with monoclonal antibodies and related proteins. Clinical Medicine. 17 (3), 220 (2017).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Macdonald, L. E., et al. Precise and in situ genetic humanization of 6 Mb of mouse immunoglobulin genes. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5147-5152 (2014).
- Murphy, A. J., et al. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (14), 5153-5158 (2014).
- Macdonald, L. E., et al. Kappa-on-Heavy (KoH) bodies are a distinct class of fully-human antibody-like therapeutic agents with antigen-binding properties. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 292-299 (2020).
- Pieper, K., Grimbacher, B., Eibel, H. B-cell biology and development. Journal of Allergy and Clinical Immunology. 131 (4), 959-971 (2013).
- Nagasawa, T. Microenvironmental niches in the bone marrow required for B-cell development. Nature Reviews: Immunology. 6 (2), 107-116 (2006).
- Lund, F. E. Cytokine-producing B lymphocytes-key regulators of immunity. Current Opinion in Immunology. 20 (3), 332-338 (2008).
- Martensson, I. L., Keenan, R. A., Licence, S. The pre-B-cell receptor. Current Opinion in Immunology. 19 (2), 137-142 (2007).
- von Boehmer, H., Melchers, F. Checkpoints in lymphocyte development and autoimmune disease. Nature Immunology. 11 (1), 14-20 (2010).
- Goodnow, C. C., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Zikherman, J., Parameswaran, R., Weiss, A. Endogenous antigen tunes the responsiveness of naive B cells but not T cells. Nature. 489 (7414), 160-164 (2012).
- Melchers, F. Checkpoints that control B cell development. Journal of Clinical Investigation. 125 (6), 2203-2210 (2015).
- Henderson, R. B., et al. A novel Rac-dependent checkpoint in B cell development controls entry into the splenic white pulp and cell survival. Journal of Experimental Medicine. 207 (4), 837-853 (2010).
- Pillai, S., Cariappa, A. The follicular versus marginal zone B lymphocyte cell fate decision. Nature Reviews: Immunology. 9 (11), 767-777 (2009).
- Shahaf, G., Zisman-Rozen, S., Benhamou, D., Melamed, D., Mehr, R. B. Cell Development in the Bone Marrow Is Regulated by Homeostatic Feedback Exerted by Mature B Cells. Frontiers in Immunology. 7, 77 (2016).
- Nemazee, D. Mechanisms of central tolerance for B cells. Nature Reviews: Immunology. 17 (5), 281-294 (2017).
- Petkau, G., Turner, M. Signalling circuits that direct early B-cell development. Biochemical Journal. 476 (5), 769-778 (2019).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-5 (2018).
- Betters, D. M. Use of Flow Cytometry in Clinical Practice. Journal of the Advanced Practioner in Oncology. 6 (5), 435-440 (2015).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews: Immunology. 12 (3), 191-200 (2012).
- Van Epps, H. L. Bringing order to early B cell chaos. Journal of Experimental Medicine. 203 (6), 1389 (2006).
- Hardy, R. R., Carmack, C. E., Shinton, S. A., Kemp, J. D., Hayakawa, K. Resolution and characterization of pro-B and pre-pro-B cell stages in normal mouse bone marrow. Journal of Experimental Medicine. 173 (5), 1213-1225 (1991).
- Allman, D., Pillai, S. Peripheral B cell subsets. Current Opinion in Immunology. 20 (2), 149-157 (2008).
- Shapiro-Shelef, M., Calame, K. Regulation of plasma-cell development. Nature Reviews: Immunology. 5 (3), 230-242 (2005).
- Kitamura, D., Roes, J., Kuhn, R., Rajewsky, K. A B cell-deficient mouse by targeted disruption of the membrane exon of the immunoglobulin mu chain gene. Nature. 350 (6317), 423-426 (1991).
- Keenan, R. A., et al. Censoring of autoreactive B cell development by the pre-B cell receptor. Science. 321 (5889), 696-699 (2008).
- Chan, V. W., Meng, F., Soriano, P., DeFranco, A. L., Lowell, C. A. Characterization of the B lymphocyte populations in Lyn-deficient mice and the role of Lyn in signal initiation and down-regulation. Immunity. 7 (1), 69-81 (1997).
- Zikherman, J., Doan, K., Parameswaran, R., Raschke, W., Weiss, A. Quantitative differences in CD45 expression unmask functions for CD45 in B-cell development, tolerance, and survival. Proceedings of the National Academy of Sciences of the United States of America. 109 (1), 3-12 (2012).
- Miyamoto, A., et al. Increased proliferation of B cells and auto-immunity in mice lacking protein kinase Cdelta. Nature. 416 (6883), 865-869 (2002).
- Mecklenbrauker, I., Kalled, S. L., Leitges, M., Mackay, F., Tarakhovsky, A. Regulation of B-cell survival by BAFF-dependent PKCdelta-mediated nuclear signalling. Nature. 431 (7007), 456-461 (2004).
- Okada, T., et al. Antigen-engaged B cells undergo chemotaxis toward the T zone and form motile conjugates with helper T cells. PLoS Biology. 3 (6), 150 (2005).
- Robinson, J. P. Flow Cytometry. Encyclopedia of Biomaterials and Biomedical Engineering. , 630-640 (2004).
- Lugli, E., Roederer, M., Cossarizza, A. Data analysis in flow cytometry: the future just started. Cytometry A. 77 (7), 705-713 (2010).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. European Journal of Immunology. 47 (10), 1584 (2017).
- Bigos, M. Separation index: an easy-to-use metric for evaluation of different configurations on the same flow cytometer. Current Protocols in Cytometry. , 21 (2007).
- Pillai, S., Mattoo, H., Cariappa, A. B. B cells and autoimmunity. Current Opinion in Immunology. 23 (6), 721-731 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon