Method Article
Administração Intratraqueal de Formulação de Pó Seco em Camundongos
Neste Artigo
Resumo
Formulações de pó seco para inalação têm grande potencial no tratamento de doenças respiratórias. Antes de entrar em estudos humanos, é necessário avaliar a eficácia da formulação de pó seco em estudos pré-clínicos. É apresentado um método simples e não invasivo de administração de pó seco em camundongos através da rota intratraqueal.
Resumo
No desenvolvimento de formulações inaláveis de pó seco, é essencial avaliar suas atividades biológicas em modelos animais pré-clínicos. Este artigo introduz um método não invasivo de entrega intratraqueal de formulação de pó seco em camundongos. Um dispositivo de carregamento de pó seco que consiste em uma ponta de pipeta de carregamento de gel de 200 μL conectada a uma seringa de 1 mL através de uma torneira de três vias é apresentado. Uma pequena quantidade de pó seco (1-2 mg) é carregada na ponta da pipeta e dispersada por 0,6 mL de ar na seringa. Como as pontas da pipeta são descartáveis e baratas, diferentes formulações de pó seco podem ser carregadas em diferentes pontas com antecedência. Várias formulações podem ser avaliadas no mesmo experimento animal sem limpeza de dispositivos e recarga de dose, economizando tempo e eliminando o risco de contaminação cruzada do pó residual. A extensão da dispersão do pó pode ser inspecionada pela quantidade de pó restante na ponta da pipeta. Um protocolo de entubação no mouse com uma fonte de luz personalizada e uma cânula orientadora está incluído. A intubação adequada é um dos fatores-chave que influencia a entrega intratraqueal da formulação de pó seco para a região pulmonar profunda do camundongo.
Introdução
A rota pulmonar da administração oferece diversos benefícios na entrega de terapêuticas para ações locais e sistêmicas. Para o tratamento de doenças pulmonares, a alta concentração de medicamentos locais pode ser alcançada por parto pulmonar, reduzindo assim a dose necessária e diminuindo a incidência de efeitos colaterais sistêmicos. Além disso, as atividades enzimáticas relativamente baixas no pulmão podem reduzir o metabolismo de drogas prematuras. Os pulmões também são eficientes para a absorção de medicamentos para ação sistêmica devido à grande e bem perfusada superfície, a camada de célula epitelial extremamente fina e o alto volume sanguíneo em capilares pulmonares1.
Formulações em pó seco inaladas têm sido amplamente investigadas para a prevenção e tratamento de diversas doenças como asma, doença pulmonar obstrutiva crônica, diabetes mellitus evacinaçãopulmonar 2,3,4. As drogas no estado sólido são geralmente mais estáveis do que na forma líquida, e os inaladores de pó seco são mais portáteis e fáceis de usar do que os nebulizadores5,6. No desenvolvimento de formulações de pó seco inalado, a segurança, o perfil farmacocinético e a eficácia terapêutica precisam ser avaliados em modelos animais pré-clínicos após a administração pulmonar7. Ao contrário dos humanos que podem inalar pó seco ativamente, a entrega pulmonar de pó seco para animais de pequeno porte é um desafio. É necessário estabelecer um protocolo eficiente de entrega de pó seco aos pulmões dos animais.
Os camundongos são amplamente utilizados como modelos animais de pesquisa porque são econômicos e se reproduzem bem. Eles também são fáceis de manusear e muitos modelos de doenças são bem estabelecidos. Existem duas abordagens principais para administrar pó seco no pulmão do camundongo: inalação e administração intratraqueal. Para inalação, o camundongo é colocado em uma câmara de corpo inteiro ou nariz, onde o pó seco é aerossolizado e os animais respiram no aerossol sem sedação8,9. Equipamentos caros são necessários e a eficiência de entrega de medicamentos é baixa. Embora a câmara do corpo inteiro possa ser tecnicamente menos desafiadora, a câmara de exposição apenas para nariz poderia minimizar a exposição de drogas à superfície do corpo. Independentemente disso, ainda é difícil controlar com precisão e determinar a dose entregue aos pulmões. O pó seco é depositado principalmente na região da nasofaringe, onde o despejo mucociliar é proeminente10. Além disso, os camundongos dentro da câmara estão sob estresse significativo durante o processo de administração porque são constrangidos e privados de alimentos e abastecimento de água11. Para a administração intratraqueal, geralmente refere-se à introdução da substância diretamente na traqueia. Existem duas técnicas diferentes para conseguir isso: traqueotomia e intubação orotraqueal. O primeiro requer um procedimento cirúrgico que faça uma incisão na traqueia, que é invasiva e raramente utilizada para administração de pó. Apenas a segunda técnica é descrita aqui. Em comparação com o método de inalação, a administração intratracheal é o método mais utilizado para a entrega pulmonar no camundongo devido à sua alta eficiência de entrega com perda mínima de medicamentos12,13. É um método simples e rápido para entregar precisamente uma pequena quantidade de pó dentro de alguns miligramas para o mouse. Embora o camundongo seja anatomicamente e fisiologicamente distinto dos seres humanos e a anestesia seja necessária durante o processo de intubação, a administração intratraqueal contorna o trato respiratório superior e oferece uma maneira mais eficaz de avaliar as atividades biológicas da formulação de pó seco, como a absorção pulmonar, a biodisponibilidade e os efeitos terapêuticos14,15.
Para administrar pó seco intratracheicamente, o rato tem que ser entubado, o que pode ser desafiador. Neste artigo, descreve-se a fabricação de um insuflê de pó seco feito sob medida e um dispositivo de intubação. Os procedimentos de intubação e insuficiência de pó seco no pulmão do camundongo são demonstrados.
Protocolo
Os experimentos realizados neste estudo foram aprovados pelo Comitê de Uso de Animais Vivos para Ensino e Pesquisa (CULATR), da Universidade de Hong Kong. Formulações de pó seco preparadas pela secagem de congelamento de spray (SFD) contendo 0,5% do RNA mensageiro da luciferase (mRNA), 5% de peptídeo sintético PEG12KL4 e 94,5% de mannitol (w/w) são utilizadas neste estudo para demonstrar a expressão mRNA no pulmão16. O diâmetro aerodinâmico médio de massa (MMAD) do pó SFD é de 2,4 μm. Pó de manitol seco (SD) são usados para investigar o efeito do volume de ar usado na dispersão de pó16. O pó de SD de SD é de 1,5 μm.
1. Fabricação de insufrante de pó seco e carregamento de pó seco
- (Opcional) Neutralizar as cargas estáticas de pó seco (em um frasco) e a ponta de pipeta de carregamento de gel redondo de 200 μL. Use uma arma antiestática ou um equilíbrio com função desionizante de acordo com a instrução do fabricante.
- Prepare um papel de pesagem com um tamanho de cerca de 4 cm x 4 cm. Dobre o papel ao meio diagonalmente e, em seguida, desdobre-o.
- Pesar 1-2 mg de pó seco no papel de pesagem.
- Encha uma ponta de pipeta de carregamento de gel com pó através da abertura mais ampla da ponta. Bata suavemente para embalar o pó até que o pó se forme agglomerados soltos perto da extremidade estreita da ponta(Figura 1A). Evite embalar o pó muito fortemente, pois pode dificultar a dispersão do pó.
- Conecte a ponta carregada em pó a uma seringa de 1 mL através de uma torneira de três vias(Figura 1B). O tamanho da seringa pode ser alterado de acordo com o volume de ar usado para dispersar o pó. Segure a ponta e a seringa verticalmente durante a conexão para evitar derramamento de pó. Se a administração não for realizada imediatamente, use o parafilm para selar as aberturas da ponta e armazená-la temporariamente em condições adequadas até a administração.
2. Fabricação de dispositivo de intubação
- Fonte de luz(Figura 2)
- Prepare uma fonte de luz personalizada com uma tocha de diodo emissor de luz (LED) e uma fibra óptica flexível com diâmetro de 0,8-1 mm.
- Faça um orifício centrado na lente clara da tocha LED com uma broca de mão ou uma broca para que a fibra óptica mal possa passar.
- Insira a fibra óptica através do orifício. Ligue a tocha LED para ajustar a posição e a profundidade de inserção para o brilho máximo na outra extremidade da fibra óptica.
- Fixar a fibra óptica em posição com cola epóxi clara.
- Cânula orientadora (Figura 3)
- Pegue uma pipeta Pasteur de plástico de 1 mL(Figura 3A)e segure a pipeta em ambas as extremidades.
- Use uma lâmpada de álcool (ou outras fontes de calor no laboratório, como um queimador de Bunsen) para aquecer o meio da pipeta colocando-a a 5-10 cm acima da chama(Figura 3B). Gire a pipeta para ter certeza de que está aquecida uniformemente.
- Quando o plástico ficar macio e deformado, mova a pipeta para longe da chama e estique a pipeta suavemente.
- Corte a pipeta esticada no meio com um par de tesouras na Parte A e Parte B(Figura 3C-E). Use a peça A como uma pipeta de ponta fina e parte B como uma cânula guia. Para aumentar a chance de intubação bem sucedida com a cânula guia, faça um bisbigo (não muito afiado que pode aumentar o risco de ferir o animal) no final da Parte B (Figura 3F). Quando uma ponta de pipeta de carregamento de gel de 200 μL (para carregamento em pó) é inserida na cânula guia, ela deve projetar a cânula por 1-2 mm.
NOTA: Uma cânula guia (Parte B) com a dimensão apropriada (diâmetro interno e externo) para intubação poderia ter uma agulha de calibre 21 dentro dela, enquanto também pode caber dentro de uma agulha de calibre 17. Podem ser necessárias múltiplas tentativas no alongamento das pipetas para alcançar a dimensão apropriada. - (Opcional): Corte uma pequena abertura na extremidade mais larga da cânula guia para torná-la mais flexível para que seja mais fácil segurar a fibra óptica(Figura 3F). Esta abertura também permite a montagem de um microsprayer para a administração de aerossol líquido.
3. Intubação
- Anestesiar o rato (BALB/c, 7-9 semanas) com cetamina (100 mg/kg) e xilazina (10 mg/kg) por injeção intraperitoneal.
- Prepare uma plataforma feita de Plexiglass e monte-a em um suporte com um grampo(Figura 4A). Coloque o mouse anestesiado na plataforma (em torno de 60° de inclinação) em uma posição supina. A altura e o ângulo de inclinação da plataforma poderiam ser ajustados pela posição do grampo no suporte.
- Suspenda o mouse enganchando seus incisivos em um fio dental de nylon(Figura 4B). Fixar a posição do mouse por um pedaço de fita ou um elástico.
- Insira a fibra óptica na cânula guia antes da intubação com a ponta do nível de fibra com a abertura da cânula guia. Ligue a tocha led para iluminar.
- Saliente suavemente a língua do rato com um par de fórceps para expor sua traqueia.
- Use a outra mão para segurar a cânula guia com fibra óptica dentro. Insira-os através da cavidade oral. Com a iluminação da fibra óptica, a abertura da traqueia pode ser visualizada como um orifício entre as cordas vocais.
- Alinhe o chanfrado da cânula guia para a linha média da abertura (Figura 5A). Entuba suavemente a cânula guia com fibra óptica na traqueia, apontando a melhor ponta da cânula na abertura traqueal.
- Após a intubação, remova rapidamente a fibra óptica e deixe a cânula guia dentro da traqueia (Figura 5B). Uma respiração normal deve ser observada.
- Segure a pipeta de ponta fina (Parte A) na abertura da cânula guia e insufre um pequeno sopro de ar (cerca de 0,2 mL) no pulmão do camundongo. Uma ligeira inflação no peito do mouse indica intubação adequada. Remova a pipeta de ponta fina antes da administração do pó.
4. Administração de pó
- Segure a ponta carregada em pó que está conectada à seringa conforme descrito na etapa 1.5. Certifique-se de que o fluxo de ar entre a seringa e a ponta esteja desconectado.
- Puxe o êmbolo da seringa para trás para retirar 0,6 mL de ar.
NOTA: O volume de ar utilizado para dispersar o pó depende das propriedades do pó e da quantidade de pó carregado. Isso é descrito ainda na seção de resultados. - Gire a válvula da torneira de três vias para conectar o fluxo de ar entre a seringa e a ponta carregada em pó.
- Insira a ponta carregada em pó na cânula guia que já foi colocada na traqueia do mouse(Figura 5C). Segure a cânula guia e empurre o êmbolo da seringa com força em uma ação contínua para dispersar o pó enquanto aerossóis para dentro do pulmão.
NOTA: Qualquer movimento dianteiro do dispositivo deve ser minimizado para evitar ferir o animal. - Retire a ponta e verifique se o pó dentro da ponta foi esvaziado. Se não, repita o passo 4.1 para 4.4.
NOTA: Se o pó estiver muito apertado devido ao toque excessivo, pode não ser dispersado corretamente. - Uma vez que a administração esteja completa, remova a cânula guia da traqueia.
- Deixe o mouse se recuperar posicionando-o horizontalmente em uma posição supina com a língua meio salientes para evitar o bloqueio das vias aéreas.
Resultados
Quando um insuflê de pó seco é usado para fornecer aerossol em pó para o pulmão de um animal, o volume de ar utilizado é crítico, pois afeta a segurança, bem como a eficiência de dispersão em pó. Para otimizar o método, foram utilizados diferentes volumes de ar (0,3 mL, 0,6 mL e 1,0 mL) para dispersar o pó seco (1 mg de mannil seco com spray) e o peso dos camundongos foi monitorado por 48 horas após a administração(Figura 6). O uso de 0,3 mL e 0,6 mL de ar não causou perda de peso dos camundongos até 48h após a administração. Dispersar o pó com 1 mL de ar resultou em mais de 5% de perda de peso dentro de 24 h, que não foi totalmente recuperado após 48 h. Neste protocolo, foram utilizados camundongos BALB/c de 7 a 9 semanas de idade. Dependendo da espécie, da cepa e da idade do animal, das propriedades em pó (por exemplo, distribuição do tamanho das partículas, coesão e densidade) e da massa de pó a ser administrado, o volume de ar a ser usado para dispersão eficiente de pó e tolerância animal pode exigir otimização por parte dos pesquisadores para diferentes modelos animais.
A formulação de pó seco preparada pela secagem por congelamento de spray (SFD) foi entregue aos camundongos usando o método descrito acima. A formulação do SFD continha 0,5% de mRNA expressando proteína luciferase, 5% de peptídeo sintético como vetor de entrega e 94,5% de mannil16. Os camundongos BALB/c foram administrados intratracheicamente com 1 mg de pó SFD contendo 5 μg de mRNA e a expressão de luciferase nos pulmões foi avaliada em 24h pós-administração utilizando sistema de imagem in vivo (IVIS) (Figura 7). O pó SFD foi dispersado no pulmão profundo e a expressão da luciferase foi observada. Como comparação, o pó SFD foi reconstituído em PBS (a um volume final de 75 μL) e administrado em camundongos como líquido com o mesmo procedimento de intubação, mas um microsprayer foi usado em vez de gerar aerossol líquido16. A expressão luciferase da formulação reconstituída foi significativamente maior do que a formulação de pó seco, o que pode ser devido à questão da dissolução do pó ou diferente perfil farmacocinético entre a forma em pó e o líquido. As características histológicas dos pulmões tratados com aerossol de pó seco mRNA foram comparadas com o controle não tratado e os grupos tratados de lipopólise (LPS)(Figura 8). Os pulmões sem qualquer tratamento ilustraram uma apresentação saudável, enquanto o pulmão tratado com 10 μg de LPS intratracheally mostrou distribuição irregular do espaço aéreo e infiltração de células inflamatórias nos espaços intersticiais e alveolares. Os pulmões tratados com pó SFD não apresentaram sinais de inflamação.
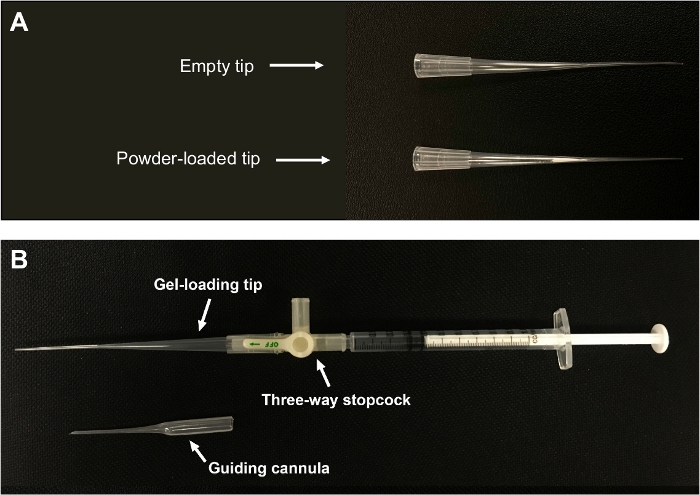
Figura 1: Insuflê de pó seco feito sob medida.
(A) O pó é embalado perto da extremidade estreita da ponta. (B) Uma ponta de pipeta de carregamento de gel é conectada a uma seringa de 1 mL através de uma torneira de três vias. A figura é adaptada de Liao et al.21. Clique aqui para ver uma versão maior desta figura.

Figura 2: Fonte de luz personalizada para intubação.
Uma fibra óptica flexível é conectada a uma tocha LED criando um pequeno orifício na lente. Clique aqui para ver uma versão maior desta figura.

Figura 3: Canânula guia.
(A) Uma pipeta pasteur de plástico de 1 mL é usada para fazer uma cânula guia. (B) A pipeta é suavizada pelo aquecimento. (C) A pipeta aquecida é esticada e cortada. (D) A parte A da pipeta é usada como pipeta de ponta fina. (E&F) A parte B da pipeta é usada como cânula guia. Um bisel é criado para facilitar o procedimento de intubação. Uma pequena abertura (opcional) pode ser feita para aumentar a flexibilidade da cânula. Clique aqui para ver uma versão maior desta figura.

Figura 4: Plataforma de intubação.
(A) A plataforma para intubação consiste em uma placa de Plexiglass que é montada em um suporte. (B) Um rato anestesiado é colocado na plataforma em uma posição supina, suspenso por enganchar seus incisivos com um fio dental de nylon. Clique aqui para ver uma versão maior desta figura.
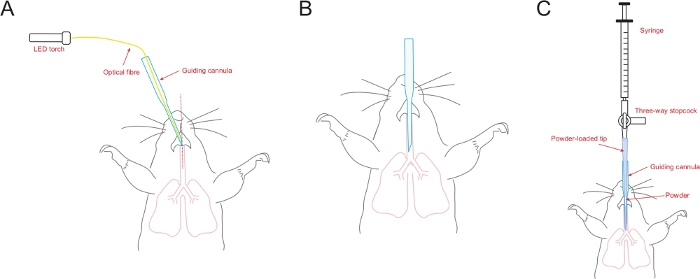
Figura 5: Diagrama esquemático ilustrando o procedimento de intubação.
(A) O bisel da cânula guia está alinhado com a linha média da abertura traqueal. (B) A cânula guia é inserida na traqueia e pronta para administração de pó. (C) A ponta carregada em pó (conectada à seringa através de uma torneira de três vias) é inserida na cânula guia que já foi colocada na traqueia do mouse. Clique aqui para ver uma versão maior desta figura.
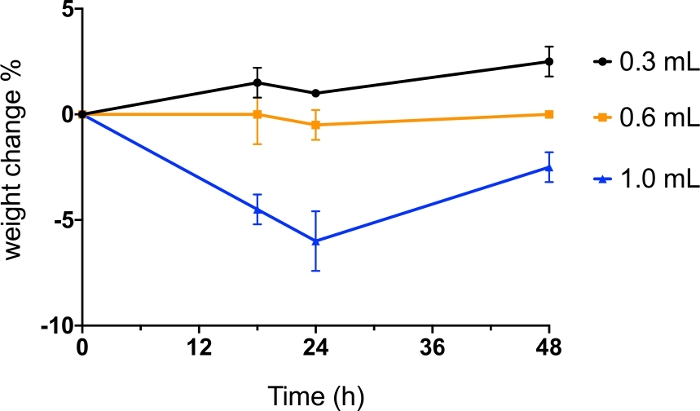
Figura 6: Administração intratraqueal de pó seco com volume diferente de ar.
Os camundongos BALB/c foram administrados intratrachealmente com pó de manitol seco com spray dispersado por 0,3 mL, 0,6 mL e 1,0 mL de ar. O peso corporal dos camundongos foi monitorado antes da administração e às 18h, 24h e 48h pós-administração. Os dados foram apresentados como valor médio do percentual de variação de peso (n=2). Clique aqui para ver uma versão maior desta figura.

Figura 7: Administração intratraqueal da formulação de mRNA como pó seco e aerossol líquido reconstituído.
Os camundongos BALB/c foram administrados intratrachealmente com spray congelado (SFD) formulação de 0,5% mRNA (luciferase) como aerossol em pó (1 mg) utilizando insuflar pó seco personalizado ou aerossol líquido reconstituído (1 mg em 75 μL PBS) usando microsprayer. Cada rato recebeu uma dose de 5 μg de mRNA. O PBS (75 μL) foi utilizado como controle. Às 24h pós-administração (A) os pulmões foram isolados para bioluminescência; (B) a expressão proteica luciferase dos tecidos pulmonares foi medida. Os dados foram expressos como o valor médio da unidade de luz relativa (RLU) por mg de proteína, analisada pela ANOVA unidirecional seguida pelo teste pós-hoc de Tukey, ***p < 0,001 (n=4). A figura é adaptada de Qiu et al.16. Clique aqui para ver uma versão maior desta figura.
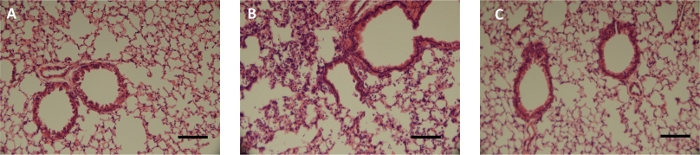
Figura 8: Histologia dos pulmões de camundongos após administração intratraqueal de formulação de pó seco mRNA.
(A) controle não tratado; os camundongos foram administrados intratrachealmente com (B) LPS (10 mgs em 25 μL PBS), e (C) spray congelar mRNA em pó seco (1 mg). Os slides foram vistos usando um microscópio vertical a 20x de ampliação (barra de escala = 100 mm). A figura é adaptada de Qiu et al.16. Clique aqui para ver uma versão maior desta figura.
Discussão
Neste artigo, são apresentados dispositivos personalizados para insuficiência de pó seco e intubação intratraqueal. Na etapa de carga em pó, o pó seco é carregado em uma ponta de pipeta de carregamento de gel de 200 μL. É importante tocar suavemente a ponta para permitir a embalagem solta de pó na extremidade estreita da ponta. No entanto, se o pó estiver muito apertado, eles ficarão presos na ponta e não poderão ser devidamente dispersos. Recomenda-se neutralizar as cargas estáticas do pó e da ponta da pipeta, a fim de facilitar o carregamento em pó, particularmente para pó com baixa densidade e em baixa umidade relativa. A cânula guia é um componente crítico do dispositivo. É usado para facilitar a intubação da ponta de pipeta carregada em pó na traqueia do mouse. O diâmetro da cânula guia não deve ser muito largo; caso contrário, será difícil inseri-lo na traqueia e pode ferir o rato. O diâmetro da cânula guia deve ser apenas largo o suficiente para caber a fibra óptica e a ponta de pipeta carregada em pó, e a ponta da pipeta deve projetar a cânula guiada por aproximadamente 1-2 mm.
A capacidade de visualizar a abertura da traqueia é crucial no processo de intubação, permitindo que a cânula orientadora seja corretamente inserida. A abertura traqueal consiste em cartilagem aritóide branca com movimento regular de abertura e fechamento na parte de trás da garganta. Com a iluminação de fibra óptica, a abertura da traqueia poderia ser facilmente visualizada. Ao soprar um pequeno volume de ar através da pipeta de plástico de ponta fina, uma inflação no peito indica uma intubação adequada. Se a inflação no peito não for observada ou a resistência for sentida durante a inserção, retraia a cânula guiada rapidamente e repita os passos novamente.
Havia um insufrador de pó seco amplamente utilizado comercialmente12,17,18 (Tabela de Materiais; este dispositivo está agora descontinuado). O pó seco é carregado na câmara de amostra do dispositivo e dispersado pelo ar de uma seringa de ar de plástico de 3 mL ou de uma bomba de ar. Para medir a dose emitida, o dispositivo deve ser pesado antes e depois da administração do pó, o que leva à imprecisão considerando que a dose de pó geralmente é muito pequena (em relação à massa do dispositivo). Em comparação com o insufflator comercial, a maior vantagem do dispositivo personalizado é que o sucesso da dispersão em pó poderia ser observado pela ausência de pó nas pontas transparentes de pipeta de carregamento de gel. Como a ponta da pipeta é leve, também pode ser ponderada com precisão antes e depois da administração para medir a dose emitida. A ponta da pipeta é inserida na cânula guia em vez de ser exposta à traqueia do animal. Há um risco mínimo de contaminar a ponta com a umidade ou secreção na traqueia (o que pode afetar a precisão da medição da dose emitida). Como as pontas da pipeta são descartáveis e baratas, diferentes formulações de pó seco podem ser carregadas em diferentes pontas com antecedência. Várias formulações podem ser avaliadas no mesmo experimento animal sem a necessidade de limpeza de dispositivos e recarga de dose, economizando tempo e eliminando o risco de contaminação cruzada do pó residual. Além disso, o padrão de dispersão em pó gerado pelo insufflator comercial variou entre diferentes formulações. Vários estudos relataram que o pó seco dispersado pelo insusutor comercial foi facilmente aglomerado e não conseguiu atingir o pulmão profundo após a administração19,20. Em contraste, outras formulações dispersas por dispositivos semelhantes aos nossos são relatadas como ter uma deposição pulmonar alta15,21,22.
Existem outros dispositivos personalizados similares relatados na literatura para a administração de aerossol em pó ao pulmão de animais. Por exemplo, Chaurasiya et al. descreveram o uso de um tubo de cânula para intubação, bem como o carregamento em pó, com uma seringa conectada ao tubo de cânula após a intubação para dispersão de pó23. Embora sua abordagem use equipamentos e materiais padronizados (por exemplo, otoscópio, cânula e seringa) com menos personalização, o método aqui oferece algumas vantagens distintas. Em primeiro lugar, permite a confirmação da intubação correta antes da administração de drogas. Esta etapa é particularmente útil para usuários menos experientes. Em segundo lugar, a cânula guia pode atuar como um escudo protetor para evitar que qualquer secreção ou umidade na traqueia contamine a ponta de pipeta de carregamento de gel, permitindo uma medição de dose emitida mais precisa por pesagem. Por fim, a cânula norteadora mais flexível juntamente com a fibra óptica pode permitir uma intubação mais fácil.
Em resumo, um insuflê de pó seco feito sob medida que é barato, descartável, reprodutível e eficiente na dispersão de pequena quantidade de pó é introduzido precisamente neste papel. O processo de intubação mencionado é não invasivo, rápido e pode entregar formulações em pó aos camundongos com segurança e precisão. Também pode ser adotado para administrar a formulação líquida para o parto pulmonar.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Os autores gostariam de agradecer ao Sr. Ray Lee, Sr. HC Leung e Sr. Wallace So por sua gentil ajuda na fabricação da fonte de luz e do insufrador de pó; e o Centro de Atendimento à Faculdade para a assistência em imagens de animais. O trabalho foi apoiado pelo Research Grant Council, Hong Kong (17300319).
Materiais
| Name | Company | Catalog Number | Comments |
| BALB/c mouse | Female; 7-9 weeks old; Body weight 20-25 g | ||
| CleanCap Firefly Luciferase mRNA | TriLink Biotechnology | L-7602 | |
| Dry Powder Insufflator | PennCentury | Model DP-4M | |
| Ketamine 10% | Alfasan International B.V. | NA | |
| Light emitting diode (LED) torch | Unilite Internation | PS-K1 | |
| Mannitol (Pearlitol 160C) | Roquette | 450001 | |
| Non-filter round gel loading pipette tip (200 µL) | Labcon | 1034-800-000 | |
| Nylon floss | Reach | 30017050 | |
| One milliliter syringe without needle | Terumo | SS-01T | |
| Optical fibre | Fibre Data | OMPF1000 | |
| PEG12KL4 peptide | EZ Biolab | (PEG12)-KLLLLKLLLLKLLLLKLLLLK-NH2 | |
| Plastic Pasteur fine tip pipette | Alpha Labotatories | LW4061 | |
| Three-way stopcock | Braun | D201 | |
| Xylazine 2% | Alfasan International B.V. | NA | |
| Zerostat 3 anti-static gun | MILTY | 5036694022153 |
Referências
- Newman, S. P. Drug delivery to the lungs: challenges and opportunities. Therapeutic Delivery. 8 (8), 647-661 (2017).
- Setter, S. M., et al. Inhaled dry powder insulin for the treatment of diabetes mellitus. Clinical Therapeutics. 29 (5), 795-813 (2007).
- Muralidharan, P., Hayes, D., Mansour, H. M. Dry powder inhalers in COPD, lung inflammation and pulmonary infections. Expert Opinion on Drug Delivery. 12 (6), 947-962 (2015).
- de Boer, A. H., et al. Dry powder inhalation: past, present and future. Expert Opinion on Drug Delivery. 14 (4), 499-512 (2017).
- Das, S., Tucker, I., Stewart, P. Inhaled dry powder formulations for treating tuberculosis. Current Drug Delivery. 12 (1), 26-39 (2015).
- Okamoto, H., et al. Stability of chitosan-pDNA complex powder prepared by supercritical carbon dioxide process. International Journal of Pharmaceutics. 290 (1-2), 73-81 (2005).
- He, J., et al. Evaluation of inhaled recombinant human insulin dry powders: pharmacokinetics, pharmacodynamics and 14-day inhalation. Journal of Pharmacy and Pharmacology. 71 (2), 176-184 (2019).
- Durham, P. G., Young, E. F., Braunstein, M. S., Welch, J. T., Hickey, A. J. A dry powder combination of pyrazinoic acid and its n-propyl ester for aerosol administration to animals. International Journal of Pharmaceutics. 514 (2), 384-391 (2016).
- Phillips, J. E., Zhang, X., Johnston, J. A. Dry powder and nebulized aerosol inhalation of pharmaceuticals delivered to mice using a nose-only exposure system. JoVE (Journal of Visualized Experiments). (122), e55454(2017).
- Nahar, K., et al. In vitro, in vivo and ex vivo models for studying particle deposition and drug absorption of inhaled pharmaceuticals). European Journal of Pharmaceutical Sciences. 49 (5), 805-818 (2013).
- Price, D. N., Muttil, P. Delivery of Therapeutics to the Lung. Methods in Molecular Biology. 1809, 415-429 (2018).
- Chang, R. Y. K., et al. Proof-of-Principle Study in a Murine Lung Infection Model of Antipseudomonal Activity of Phage PEV20 in a Dry-Powder Formulation. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Ito, T., Okuda, T., Takayama, R., Okamoto, H. Establishment of an Evaluation Method for Gene Silencing by Serial Pulmonary Administration of siRNA and pDNA Powders: Naked siRNA Inhalation Powder Suppresses Luciferase Gene Expression in the Lung. Journal of pharmaceutical sciences. 108 (8), 2661-2667 (2019).
- Patil, J. S., Sarasija, S. Pulmonary drug delivery strategies: A concise, systematic review. Lung India. 29 (1), 44-49 (2012).
- Ihara, D., et al. Histological Quantification of Gene Silencing by Intratracheal Administration of Dry Powdered Small-Interfering RNA/Chitosan Complexes in the Murine Lung. Pharmaceutical Research. 32 (12), 3877-3885 (2015).
- Qiu, Y., et al. Effective mRNA pulmonary delivery by dry powder formulation of PEGylated synthetic KL4 peptide. Journal of Controlled Release. 314, 102-115 (2019).
- Pfeifer, C., et al. Dry powder aerosols of polyethylenimine (PEI)-based gene vectors mediate efficient gene delivery to the lung. Journal of Controlled Release. 154 (1), 69-76 (2011).
- Kim, I., et al. Doxorubicin-loaded highly porous large PLGA microparticles as a sustained- release inhalation system for the treatment of metastatic lung cancer. Biomaterials. 33 (22), 5574-5583 (2012).
- Tonnis, W. F., et al. A novel aerosol generator for homogenous distribution of powder over the lungs after pulmonary administration to small laboratory animals. European Journal of Pharmaceutics and Biopharmaceutics. 88 (3), 1056-1063 (2014).
- Hoppentocht, M., Hoste, C., Hagedoorn, P., Frijlink, H. W., de Boer, A. H. In vitro evaluation of the DP-4M PennCentury insufflator. European Journal of Pharmaceutics and Biopharmaceutics. 88 (1), 153-159 (2014).
- Liao, Q., et al. Porous and highly dispersible voriconazole dry powders produced by spray freeze drying for pulmonary delivery with efficient lung deposition. International Journal of Pharmaceutics. 560, 144-154 (2019).
- Ito, T., Okuda, T., Takashima, Y., Okamoto, H. Naked pDNA Inhalation Powder Composed of Hyaluronic Acid Exhibits High Gene Expression in the Lungs. Molecular Pharmaceutics. 16 (2), 489-497 (2019).
- Chaurasiya, B., Zhou, M., Tu, J., Sun, C. Design and validation of a simple device for insufflation of dry powders in a mice model. European Journal of Pharmaceutical Sciences. 123, 495-501 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados