Method Article
الإدارة داخل الراشية لصياغة مسحوق جاف في الفئران
In This Article
Summary
تركيبات مسحوق جاف للاستنشاق لديها إمكانات كبيرة في علاج أمراض الجهاز التنفسي. قبل الدخول في الدراسات البشرية ، من الضروري تقييم فعالية تركيبة المسحوق الجاف في الدراسات ما قبل السريرية. يتم تقديم طريقة بسيطة وغير باضعة لإدارة مسحوق جاف في الفئران من خلال الطريق داخل التراكشي.
Abstract
في تطوير تركيبات مسحوق جاف قابل للاستنشاق ، من الضروري تقييم أنشطتهم البيولوجية في نماذج الحيوانات قبل السريرية. تقدم هذه الورقة طريقة غير باضعة لتوصيل مسحوق جاف داخل التراكي في الفئران. يتم تقديم جهاز تحميل مسحوق جاف يتكون من هلام 200 ميكرولتر تحميل تلميح ماصة متصلة حقنة 1 مل عن طريق stopcock ثلاثية. يتم تحميل كمية صغيرة من مسحوق جاف (1-2 ملغ) في طرف ماصة وتفرقت من قبل 0.6 مل من الهواء في الحقنة. لأن نصائح ماصة هي المتاح وغير مكلفة، تركيبات مسحوق جاف مختلف يمكن تحميلها في نصائح مختلفة مقدما. ويمكن تقييم تركيبات مختلفة في نفس التجربة الحيوانية دون تنظيف الجهاز وإعادة ملء الجرعة، وبالتالي توفير الوقت والقضاء على خطر التلوث المتبادل من مسحوق المتبقية. يمكن فحص مدى تشتت المسحوق من خلال كمية المسحوق المتبقية في طرف ماصة. يتم تضمين بروتوكول التنبيب في الماوس مع مصدر ضوء حسب الطلب وقنية إرشادية. التنبيب السليم هو واحد من العوامل الرئيسية التي تؤثر على تسليم داخل التراكشية من تركيبة مسحوق جاف إلى منطقة الرئة العميقة من الماوس.
Introduction
يوفر مسار الإدارة الرئوي فوائد مختلفة في تقديم العلاجات لكل من الإجراءات المحلية والنظامية. لعلاج أمراض الرئة ، يمكن تحقيق تركيز المخدرات المحلية العالية عن طريق الولادة الرئوية ، وبالتالي تقليل الجرعة المطلوبة وخفض حدوث الآثار الجانبية الجهازية. وعلاوة على ذلك، فإن الأنشطة الأنزيمية منخفضة نسبيا في الرئة يمكن أن تقلل من التمثيل الغذائي للدواء قبل الأوان. الرئتين هي أيضا فعالة لامتصاص المخدرات للعمل الجهازية بسبب مساحة سطح كبيرة وجيدة التغلغل، وطبقة الخلايا الظهارية رقيقة للغاية وارتفاع حجم الدم في الشعيرات الدموية الرئوية1.
وقد تم على نطاق واسع استنشاق تركيبات مسحوق جاف للوقاية والعلاج من مختلف الأمراض مثل الربو، مرض الانسداد الرئوي المزمن، مرض السكري والتطعيم الرئوي2،3،4. الأدوية في الحالة الصلبة هي عموما أكثر استقرارا مما كانت عليه في شكل سائل، وأجهزة استنشاق مسحوق جاف هي أكثر المحمولة وسهلة الاستخدام من البخاخات5،6. في تطوير تركيبات مسحوق جاف استنشاقه، والسلامة، وملامح الدوائية والفعالية العلاجية تحتاج إلى تقييم في نماذج الحيوانات قبل السريرية بعد الإدارة الرئوية7. على عكس البشر الذين يمكن أن يستنشق مسحوق جاف بنشاط، تسليم الرئوية من مسحوق جاف للحيوانات الصغيرة يشكل تحديا. من الضروري وضع بروتوكول فعال لتوصيل مسحوق جاف إلى رئتي الحيوانات.
وتستخدم الفئران على نطاق واسع كنماذج حيوانية بحثية لأنها اقتصادية وتتكاثر بشكل جيد. كما أنها سهلة التعامل معها والعديد من نماذج المرض راسخة. هناك نهجان رئيسيان لإدارة المسحوق الجاف لرئة الفأر: الاستنشاق والإدارة داخل التراكشي. للاستنشاق ، يتم وضع الماوس في غرفة الجسم كله أو الأنف فقط حيث يتم الهباء الجوي مسحوق جاف والحيوانات تتنفس في الهباء الجوي دونتخدير 8،9. المعدات باهظة الثمن مطلوبة وكفاءة توصيل الأدوية منخفضة. في حين أن غرفة الجسم كله قد تكون أقل تحديا من الناحية الفنية ، فإن غرفة التعرض للأنف فقط يمكن أن تقلل من تعرض الأدوية لسطح الجسم. بغض النظر عن ذلك، فإنه لا يزال من الصعب السيطرة بدقة وتحديد الجرعة التي يتم تسليمها إلى الرئتين. يتم إيداع المسحوق الجاف بشكل رئيسي في منطقة البلعوم الأنفي حيث يكون إزالة المخاطية بارزا10. وعلاوة على ذلك، الفئران داخل الغرفة تتعرض لضغوط كبيرة خلال عملية الإدارة لأنها مقيدة ومحرومة من إمدادات الغذاء والمياه11. بالنسبة للإدارة داخل التراكشي ، فإنه يشير بشكل عام إلى إدخال المادة مباشرة إلى القصبة الهوائية. هناك تقنيتان مختلفتان لتحقيق ذلك: استئصال القصبة الهوائية والتنبيب القصبي. الأول يتطلب إجراء جراحيا يجعل شق في القصبة الهوائية، وهو الغازية ونادرا ما تستخدم لإدارة مسحوق. يتم وصف التقنية الثانية فقط هنا. بالمقارنة مع طريقة الاستنشاق ، فإن الإدارة داخل الوتر هي الطريقة الأكثر شيوعا للتسليم الرئوي في الماوس بسبب كفاءتها العالية في التسليم مع الحد الأدنى من فقدان الدواء12،13. بل هو وسيلة بسيطة وسريعة لتقديم بدقة كمية صغيرة من مسحوق في غضون بضعة ملليغرام إلى الماوس. على الرغم من أن الماوس هو تشريحيا وفسيولوجيا متميزة للبشر والتخدير مطلوب أثناء عملية التنبيب، والإدارة داخل التراتشي يتجاوز الجهاز التنفسي العلوي ويقدم وسيلة أكثر فعالية لتقييم الأنشطة البيولوجية لصياغة مسحوق جاف مثل امتصاص الرئة، والتوافر البيولوجي والآثار العلاجية14،15.
لإدارة مسحوق جاف intratracheally، يجب أن يتم تنبيب الماوس، والتي يمكن أن تكون صعبة. في هذه الورقة ، يتم وصف تصنيع مسحوق جاف مصنوع خصيصا وجهاز تنبيب. يتم توضيح إجراءات التنبيب وخنق المسحوق الجاف في رئة الفأر.
Protocol
وقد وافقت لجنة استخدام الحيوانات الحية في التدريس والبحث، جامعة هونغ كونغ، على التجارب التي أجريت في هذه الدراسة. تركيبات مسحوق جاف أعدت عن طريق رذاذ تجميد التجفيف (SFD) التي تحتوي على 0.5٪ من لوسيفيراز رسول الجيش الملكي النيبالي (ميرنا)، 5٪ الببتيد الاصطناعي PEG12KL4 و 94.5٪ من مانيتول (ث / ث) وتستخدم في هذه الدراسة لإثبات التعبير ميرنا في الرئة16. يبلغ متوسط القطر الأيرودينامية (MMAD) من مسحوق SFD 2.4 ميكرومتر. يستخدم مسحوق مانيتول المجفف بالرذاذ (SD) للتحقيق في تأثير حجم الهواء المستخدم في تشتت المسحوق16. وMMAD من مسحوق SD هو 1.5 ميكرومتر.
1. تصنيع مسحوق جاف insufflator وتحميل مسحوق جاف
- (اختياري) تحييد التهم ثابتة من مسحوق جاف (في قارورة) و200 ميكرولتر غير مرشح جولة هلام تحميل ماصة تلميح. استخدام بندقية مضادة للساكنة أو التوازن مع وظيفة deionizing وفقا لتعليمات الشركة المصنعة.
- إعداد ورقة وزن بحجم حوالي 4 سم × 4 سم. أضعاف ورقة في نصف قطريا ومن ثم تتكشف عليه.
- تزن 1-2 ملغ من مسحوق جاف على ورقة الوزن.
- ملء تلميح ماصة هلام التحميل مع مسحوق من خلال فتح أوسع من طرف. اضغط برفق لحزم المسحوق حتى يشكل المسحوق تجمعات فضفاضة بالقرب من الطرف الضيق للطرف(الشكل 1A). تجنب التعبئة مسحوق بإحكام جدا لأنها قد تعوق تشتت مسحوق.
- قم بتوصيل الطرف المحمل بالمسحوق بحقنة 1 مل من خلال stopcock ثلاثي الاتجاه(الشكل 1B). يمكن تغيير حجم الحقنة وفقا لحجم الهواء المستخدم لتفريق المسحوق. عقد طرف والمحاقن عموديا أثناء الاتصال لمنع تسرب مسحوق. إذا لم يتم إجراء الإدارة على الفور، استخدم البارافيلم لإغلاق فتحات الطرف وتخزينه مؤقتا تحت شرط مناسب حتى الإدارة.
2. تصنيع جهاز التنبيب
- مصدر الضوء (الشكل 2)
- إعداد مصدر ضوء حسب الطلب مع ضوء الصمام الثنائي المنبعث (LED) الشعلة والألياف البصرية مرنة مع قطرها 0.8-1 ملم.
- جعل فتحة تركزت على عدسة واضحة من الشعلة LED مع حفر اليد أو بت الحفر بحيث الألياف البصرية يمكن أن تمر بالكاد من خلال.
- أدخل الألياف البصرية من خلال فتحة. قم بتشغيل مصباح LED لضبط موضع وعمق الإدخال للحصول على أقصى قدر من السطوع في الطرف الآخر من الألياف البصرية.
- لصق الألياف البصرية في موقف مع الغراء الايبوكسي واضحة.
- القنية التوجيهية (الشكل 3)
- اتخاذ 1 مل البلاستيك باستور ماصة (الشكل 3A) وعقد ماصة في كلا الطرفين.
- استخدام مصباح الكحول (أو مصادر الحرارة الأخرى في المختبر مثل الموقد Bunsen) لتسخين منتصف ماصة عن طريق وضعه في 5-10 سم فوق اللهب(الشكل 3B). تدوير ماصة للتأكد من تسخينها بالتساوي.
- عندما يصبح البلاستيك لينة وتشوه، نقل ماصة بعيدا عن اللهب وتمتد ماصة بلطف.
- قطع ماصة امتدت في الوسط مع زوج من مقص في الجزء A والجزء باء (الشكل 3C-E). استخدام الجزء A كما ماصة تلميح غرامة والجزء باء كقنية توجيهية. لزيادة فرصة التنبيب الناجح مع القنية التوجيهية ، قم بعمل شطبة (ليست حادة للغاية مما قد يزيد من خطر إصابة الحيوان) في نهاية الجزء B(الشكل 3F). عندما يتم إدخال 200 ميكرولتر هلام تحميل ماصة تلميح (لتحميل مسحوق) في القنية التوجيهية، فإنه ينبغي أن تبرز القنية من قبل 1-2 ملم.
ملاحظة: يمكن أن يكون للقنية التوجيهية (الجزء B) ذات البعد المناسب (القطر الداخلي والخارجي) للتنبيب إبرة قياس 21 تناسب داخلها في حين أنها يمكن أن تناسب أيضا داخل إبرة قياس 17. قد تكون هناك حاجة إلى محاولات متعددة في تمديد ماصة لتحقيق البعد المناسب. - (اختياري): قطع فتحة صغيرة في الطرف الأوسع من cannula التوجيهية لجعلها أكثر مرونة بحيث يكون من الأسهل لعقد الألياف البصرية(الشكل 3F). هذا الافتتاح يسمح أيضا تركيب microsprayer لإدارة الهباء الجوي السائل.
3. التنبيب
- تخدير الماوس (BALB / c ، 7-9 أسابيع) مع الكيتامين (100 ملغ / كجم) وزين (10 ملغ / كجم) عن طريق الحقن داخل الصفاق.
- إعداد منصة مصنوعة من زجاج شبكي وجبل على موقف مع المشبك(الشكل 4A). ضع الماوس المخدر على المنصة (عند حوالي 60 درجة من الميل) في وضع ية. يمكن تعديل ارتفاع وزاوية الميل للمنصة من خلال وضع المشبك على الحامل.
- تعليق الماوس عن طريق ربط القواطع على خيط النايلون(الشكل 4B). تأمين موضع الماوس بقطعة من الشريط أو شريط مطاطي.
- أدخل الألياف البصرية في القنية التوجيهية قبل التنبيب مع غيض من مستوى الألياف مع فتح القنية التوجيهية. قم بتشغيل مصباح LED للإضاءة.
- تبرز بلطف لسان الفأرة مع زوج من ملقط لفضح القصبة الهوائية.
- استخدام اليد الأخرى لعقد cannula التوجيهية مع الألياف البصرية في الداخل. أدخلها من خلال تجويف الفم. مع الإضاءة من الألياف البصرية ، يمكن تصور فتح القصبة الهوائية كمبرر بين الحبال الصوتية.
- محاذاة شطبة من cannula التوجيهية نحو خط الوسط من افتتاح (الشكل 5A). intubate بلطف cannula التوجيهية مع الألياف البصرية في القصبة الهوائية من خلال توجيه خيرة غيض من القنية في افتتاح القصبة الهوائية.
- عند التنبيب، وإزالة بسرعة الألياف البصرية وترك القنية التوجيهية داخل القصبة الهوائية(الشكل 5B). وينبغي ملاحظة التنفس الطبيعي.
- عقد ماصة طرف غرامة (الجزء A) في افتتاح cannula التوجيهية و insufflate نفخة صغيرة من الهواء (حوالي 0.2 مل) في الرئة من الماوس. يشير التضخم الطفيف في صدر الفأر إلى التنبيب السليم. إزالة ماصة طرف غرامة قبل إدارة مسحوق.
4. إدارة مسحوق
- عقد مسحوق محملة تلميح التي ترتبط بحقنة كما هو موضح في الخطوة 1.5. تأكد من قطع تدفق الهواء بين الحقنة والطرف.
- سحب المكبس حقنة إلى الوراء لسحب 0.6 مل من الهواء.
ملاحظة: يعتمد حجم الهواء المستخدم لتفريق المسحوق على خصائص المسحوق وكمية المسحوق المحملة. ويرد وصف آخر لذلك في قسم النتائج. - بدوره صمام stopcock ثلاثية لربط تدفق الهواء بين الحقنة والطرف مسحوق محملة.
- إدراج تلميح مسحوق محملة في القنية التوجيهية التي وضعت بالفعل في القصبة الهوائية من الماوس(الشكل 5C). عقد cannula التوجيهية ودفع المكبس حقنة بقوة في عمل واحد مستمر لتفريق مسحوق والهباء الجوي في الرئة.
ملاحظة: يجب تقليل أي حركة أمامية للجهاز لتجنب إصابة الحيوان. - قم بإزالة الطرف وتحقق مما إذا كان المسحوق داخل الطرف قد تم إفراغه. إذا لم يكن كذلك، كرر الخطوة 4.1 إلى 4.4.
ملاحظة: إذا كان المسحوق معبأ بإحكام شديد بسبب الإفراط في التنصت، فقد لا يتم تفريقه بشكل صحيح. - بمجرد اكتمال الإدارة ، قم بإزالة القنية المرشدة من القصبة الهوائية.
- السماح للفأر لاسترداد عن طريق وضعه أفقيا في موقف supine مع لسانه نصف جاحظ لتجنب الحصار على الشعب الهوائية.
النتائج
عندما يتم استخدام مسحوق جاف insufflator لتوصيل مسحوق الهباء الجوي إلى الرئة من حيوان، وحجم الهواء المستخدم أمر بالغ الأهمية لأنه يؤثر على السلامة، فضلا عن كفاءة تشتت مسحوق. لتحسين الطريقة ، تم استخدام كميات مختلفة من الهواء (0.3 مل ، 0.6 مل و 1.0 مل) لتفريق المسحوق الجاف (1 ملغ من مانيتول المجفف بالرذاذ) وتم رصد وزن الفئران لمدة 48 ساعة بعد الإدارة(الشكل 6). استخدام 0.3 مل و 0.6 مل من الهواء لم يسبب فقدان وزن الفئران تصل إلى 48 ساعة بعد الإدارة. فض مسحوق مع 1 مل من الهواء أدى إلى أكثر من 5٪ من فقدان الوزن في غضون 24 ساعة، والتي لم تتعافى تماما بعد 48 ساعة. في هذا البروتوكول، تم استخدام الفئران BALB / c من 7-9 أسابيع من العمر. اعتمادا على الأنواع، وسلالة وعمر الحيوان، وخصائص مسحوق (على سبيل المثال، توزيع حجم الجسيمات، والتماسك والكثافة) وكتلة من مسحوق أن تدار، وحجم الهواء لاستخدامها لتشتت مسحوق كفاءة والتسامح الحيواني قد تتطلب التحسين من قبل المحققين لنماذج حيوانية مختلفة.
تم تسليم تركيبة مسحوق جاف أعدت عن طريق رذاذ تجميد التجفيف (SFD) إلى الفئران باستخدام الطريقة المذكورة أعلاه. صيغة SFD تحتوي على 0.5٪ من الحمض النووي الريبي التعبير عن بروتين لوسيفيراز، 5٪ من الببتيد الاصطناعية كناقل التسليم و 94.5٪ من مانيتول16. تم إعطاء الفئران BALB / c intratracheally مع 1 ملغ من مسحوق SFD يحتوي على 5 ميكروغرام من الحمض النووي الريبي وتم تقييم تعبير لوسيفيراز في الرئتين في 24 ساعة بعد الإدارة باستخدام في نظام التصوير في الجسم الحي (IVIS) (الشكل 7). تم تفريق مسحوق SFD في الرئة العميقة ولوحظ تعبير لوسيفيراز. وعلى سبيل المقارنة، تم إعادة تشكيل مسحوق SFD في PBS (إلى حجم نهائي قدره 75 ميكرولتر) وأعطيت للفئران كسائل مع نفس إجراء التنبيب ولكن تم استخدام رذاذ صغير بدلا من ذلك لتوليد الهباء الجوي السائل16. كان تعبير لوسيفيراز عن التركيبة المعاد تشكيلها أعلى بكثير من تركيبة المسحوق الجاف ، والتي يمكن أن تكون بسبب مشكلة انحلال المسحوق أو ملف تعريف دوائي مختلف بين المسحوق والشكل السائل. تمت مقارنة الخصائص النسيجية للرئتين المعالجة بالهباء الجوي الجاف من الحمض النووي الريبي (mRNA) مع مجموعات معالجة التحكم غير المعالجة وlipopolysaccharide (LPS)(الشكل 8). الرئتين دون أي علاج يوضح عرضا صحيا في حين أن الرئة تعامل مع 10 ميكروغرام من LPS intratracheally أظهرت التوزيع غير المنتظم للفضاء الجوي وتسلل الخلايا الالتهابية في المساحات الخلالية والغذائية. لم تظهر على الرئتين المعالجتين بمسحوق SFD أي علامات على الالتهاب.
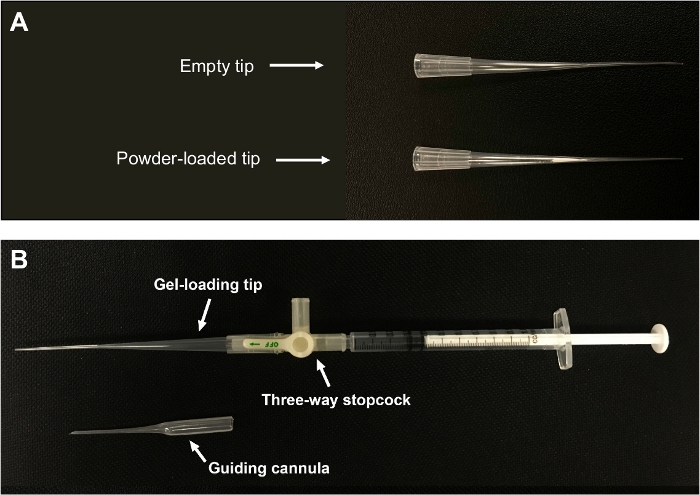
الشكل 1: مسحوق جاف مصنوع خصيصا.
(أ)يتم تعبئة مسحوق بالقرب من نهاية ضيقة من طرف. (ب)يتم توصيل طرف ماصة هلام التحميل إلى حقنة 1 مل عن طريق stopcock ثلاثية. هذا الرقم مقتبس من لياووآخرون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مصدر ضوء مصنوع خصيصا للتنبيب.
يتم توصيل الألياف البصرية المرنة إلى الشعلة LED عن طريق خلق ثقب صغير على العدسة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: القنية التوجيهية.
(أ) يستخدم 1 مل البلاستيك باستور ماصة لجعل cannula التوجيهية. (ب) يتم تليين ماصة عن طريق التدفئة. (ج)امتدت ماصة ساخنة وقطع. (د)الجزء أ من ماصة يستخدم ماصة غرامة تلميح. (E &؛ F) يستخدم الجزء B من ماصة كقنية توجيهية. يتم إنشاء شطبة لتسهيل إجراء التنبيب. يمكن إجراء فتحة صغيرة (اختياري) لزيادة مرونة القنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: منصة التنبيب.
(أ) منصة للتنبيب يتكون من لوحة زجاج شبكي التي شنت على موقف. (ب)يتم وضع فأر مخدر على المنصة في وضعية غير واضحة، مع وقف التنفيذ عن طريق ربط قواطعه بخيط نايلون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
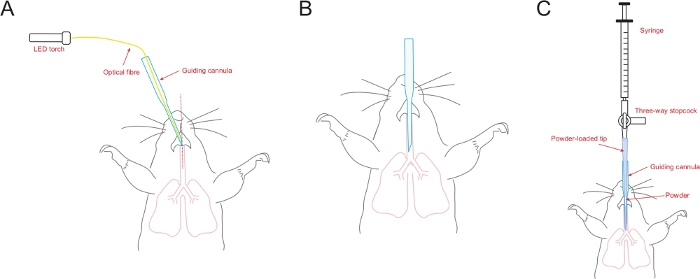
الشكل 5: مخطط تخطيطي يوضح إجراء التنبيب.
(أ)يتم محاذاة شطبة من cannula التوجيهية مع خط الوسط من افتتاح القصبة الهوائية. (ب) يتم إدخال القنية التوجيهية في القصبة الهوائية وجاهزة لإدارة مسحوق. (ج)يتم إدخال طرف مسحوق محملة (متصلة المحقنة من خلال stopcock ثلاثية) في cannula التوجيهية التي وضعت بالفعل في القصبة الهوائية من الماوس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
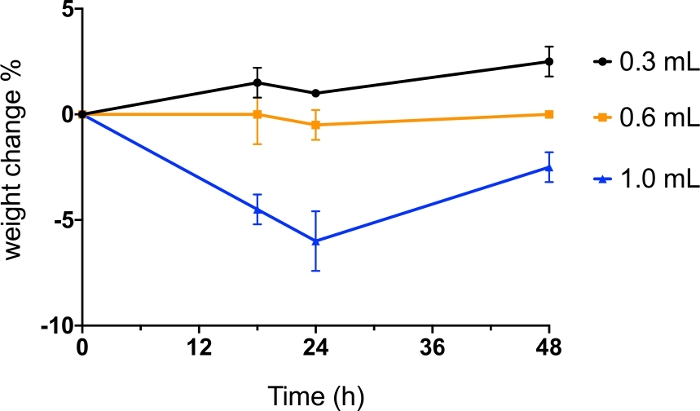
الشكل 6: الإدارة Intratracheal من مسحوق جاف مع حجم مختلف من الهواء.
تدار BALB / ج الفئران intratracheally مع رذاذ المجففة (SD) مسحوق مانيتول موزعة من قبل 0.3 مل، 0.6 مل و 1.0 مل من الهواء. تم رصد وزن جسم الفئران قبل الإدارة وعلى مدار 18 ساعة و24 ساعة و48 ساعة بعد الإدارة. تم تقديم البيانات على أنها متوسط قيمة النسبة المئوية لتغير الوزن (n = 2). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: الإدارة داخل التراكشية لصياغة مرنا كما مسحوق جاف والهباء الجوي السائل المعاد تشكيلها.
تدار BALB / ج الفئران intratracheally مع رذاذ تجميد المجففة (SFD) 0.5٪ مرنا (لوسيفيراز) صياغة كما مسحوق الهباء الجوي (1 ملغ) باستخدام مسحوق جاف مخصص أو الهباء الجوي السائل المعاد تشكيلها (1 ملغ في 75 ميكرولتر PBS) باستخدام ميكروسبراير. تلقى كل فأر جرعة من 5 ميكروغرام من الحمض النووي الريبي. تم استخدام برنامج تلفزيوني (75 ميكرولتر) كتحكم. في 24 ساعة بعد الإدارة (أ) تم عزل الرئتين للتصوير الإضاءة الحيوية; (ب) تم قياس التعبير البروتين لوسيفيراز من أنسجة الرئة. تم التعبير عن البيانات على أنها متوسط قيمة وحدة الضوء النسبي (RLU) لكل ملغ من البروتين ، وتحليلها من قبل ANOVA في اتجاه واحد تليها اختبار توكي بعد المخصصة ، ***ع < 0.001 (ن = 4). هذا الرقم مقتبس من تشيو وآخرون16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 8: الأنسجة من رئتي الفئران بعد الإدارة داخل الراشية من صياغة مسحوق جاف مرنا.
(أ) السيطرة غير المعالجة؛ وكانت تدار الفئران intratracheally مع (ب) LPS (10 ملغ في 25 μL PBS), و (ج) رذاذ تجميد مسحوق مرنا المجففة (1 ملغ). تم عرض الشرائح باستخدام مجهر مستقيم عند تكبير 20x (شريط المقياس = 100 مم). هذا الرقم مقتبس من تشيو وآخرون16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذه الورقة، يتم تقديم أجهزة مصنوعة خصيصا لخنق مسحوق جاف والتنبيب داخل الوتر. في خطوة تحميل مسحوق، يتم تحميل مسحوق جاف في 200 ميكرولتر هلام تحميل ماصة تلميح. من المهم الاستفادة بلطف من طرف للسماح التعبئة فضفاضة من مسحوق في نهاية ضيقة من طرف. ومع ذلك، إذا كانت معبأة مسحوق بإحكام جدا، وسوف تتعثر في الطرف ولا يمكن تفريقها بشكل صحيح. من المستحسن تحييد الشحنات الثابتة للمسحوق وطرف المصصة من أجل تسهيل تحميل المسحوق ، خاصة بالنسبة للمسحوق ذو الكثافة المنخفضة والرطوبة النسبية المنخفضة. القنية التوجيهية هي مكون حاسم للجهاز. يتم استخدامه لتسهيل التنبيب من طرف ماصة مسحوق محملة في القصبة الهوائية من الماوس. يجب أن لا يكون قطر القنية التوجيهية واسعا جدا ؛ وإلا سيكون من الصعب إدراجها في القصبة الهوائية وقد تصيب الماوس. يجب أن يكون قطر القنية التوجيهية واسعا بما يكفي لتناسب الألياف البصرية وطرف ماصة محملة بالمسحوق ، ويجب أن يبرز طرف ماصة القنية التوجيهية بحوالي 1-2 مم.
القدرة على تصور فتح القصبة الهوائية أمر بالغ الأهمية في عملية التنبيب ، مما يسمح بإدخال القنية التوجيهية بشكل صحيح. يتكون فتحة القصبة الهوائية من غضروف أبيض من الأرينويد مع حركة فتح وإغلاق منتظمة في الجزء الخلفي من الحلق. مع إضاءة الألياف البصرية ، يمكن تصور فتح القصبة الهوائية بسهولة. عن طريق نفخ حجم صغير من الهواء من خلال ماصة بلاستيكية تلميح غرامة، والتضخم في الصدر يشير إلى التنبيب السليم. إذا لم يلاحظ التضخم في الصدر أو شعرت المقاومة أثناء الإدراج، تراجع عن القنية التوجيهية بسرعة وتكرار الخطوات مرة أخرى.
كان هناك على نطاق واسع المستخدمة تجاريا مسحوق جاف insufflator12,17,18 ( جدولالمواد; توقف هذا الجهاز الآن). يتم تحميل المسحوق الجاف في غرفة عينة الجهاز ويشتت عن طريق الهواء من حقنة هوائية بلاستيكية سعة 3 مل أو مضخة هواء. لقياس الجرعة المنبعثة ، يجب وزن الجهاز قبل وبعد إعطاء المسحوق ، مما يؤدي إلى عدم الدقة بالنظر إلى أن جرعة المسحوق عادة ما تكون صغيرة جدا (بالنسبة لكتلة الجهاز). بالمقارنة مع insufflator التجارية، وأكبر ميزة للجهاز حسب الطلب هو أن نجاح تشتت مسحوق يمكن ملاحظتها من خلال عدم وجود مسحوق في نصائح ماصة هلام تحميل شفافة. منذ تلميح ماصة خفيفة, ويمكن أيضا أن يكون وزنه بدقة قبل وبعد الإدارة لقياس الجرعة المنبعثة. يتم إدخال طرف ماصة في القنية التوجيهية بدلا من التعرض للرغامى من الحيوان. هناك خطر ضئيل من تلويث الطرف مع الرطوبة أو إفراز في القصبة الهوائية (والتي قد تؤثر على دقة قياس الجرعة المنبعثة). كما نصائح ماصة هي المتاح وغير مكلفة، تركيبات مسحوق جاف مختلف يمكن تحميلها في نصائح مختلفة مقدما. ويمكن تقييم تركيبات مختلفة في نفس التجربة الحيوانية دون الحاجة إلى تنظيف الجهاز وإعادة ملء الجرعة، وبالتالي توفير الوقت والقضاء على خطر التلوث المتبادل من مسحوق المتبقية. وعلاوة على ذلك، فإن نمط تشتت المسحوق الناتج عن المختنق التجاري يختلف باختلاف التركيبات. وأفاد عدد من الدراسات أن مسحوق جاف تشتت بواسطة insufflator التجارية كانت تجمع بسهولة وفشلت في الوصول إلى الرئة العميقة على الإدارة19،20. في المقابل، يتم الإبلاغ عن تركيبات أخرى موزعة بواسطة أجهزة مشابهة لأجهزةنا أن يكون ترسب الرئة عالية15،21،22.
هناك أجهزة أخرى مماثلة حسب الطلب ذكرت في الأدب لإدارة مسحوق الهباء الجوي إلى رئة الحيوان. على سبيل المثال، وصف Chaurasiya وآخرون استخدام أنبوب قنية للتنبيب وكذلك تحميل مسحوق، مع حقنة متصلة أنبوب القنية بعد التنبيب لتشتت مسحوق23. في حين أن نهجها يستخدم معدات ومواد موحدة (على سبيل المثال ، otoscope ، cannula والمحاقن) مع تخصيص أقل ، فإن الطريقة هنا توفر بعض المزايا المتميزة. أولا، فإنه يسمح بتأكيد التنبيب الصحيح قبل تناول الدواء. هذه الخطوة مفيدة بشكل خاص للمستخدم الأقل خبرة. ثانيا، يمكن أن تعمل القنية التوجيهية كدرع حماية لمنع أي إفراز أو رطوبة في القصبة الهوائية من تلويث طرف ماصة تحميل الجل، مما يسمح بقياس الجرعة المنبعثة بشكل أكثر دقة عن طريق الوزن. وأخيرا، فإن القنية التوجيهية الأكثر مرونة جنبا إلى جنب مع الألياف البصرية قد تمكن من التنبيب أسهل.
وباختصار، يتم إدخال مسحوق جاف مخصصة insufflator التي هي غير مكلفة، يمكن التخلص منها، استنساخها وكفاءة في تفريق كمية صغيرة من مسحوق على وجه التحديد في هذه الورقة. عملية التنبيب المذكورة غير باضعة وسريعة ويمكن أن توفر تركيبات مسحوق للفئران بأمان ودقة. ويمكن أيضا أن تعتمد لإدارة تركيبة السائل للولادة الرئوية.
Disclosures
ولا يوجد لدى صاحبي البلاغ تضارب في المصالح يكشفان عنه.
Acknowledgements
ويود أصحاب البلاغ أن يشكروا السيد راي لي والسيد إتش سي ليونغ والسيد والاس سو على مساعدتهم الكريمة في جعل مصدر الضوء ومسحوق النازح؛ ومرفق الكلية الأساسي للمساعدة في تصوير الحيوانات. وقد دعم هذا العمل مجلس منح البحوث، هونغ كونغ (17300319).
Materials
| Name | Company | Catalog Number | Comments |
| BALB/c mouse | Female; 7-9 weeks old; Body weight 20-25 g | ||
| CleanCap Firefly Luciferase mRNA | TriLink Biotechnology | L-7602 | |
| Dry Powder Insufflator | PennCentury | Model DP-4M | |
| Ketamine 10% | Alfasan International B.V. | NA | |
| Light emitting diode (LED) torch | Unilite Internation | PS-K1 | |
| Mannitol (Pearlitol 160C) | Roquette | 450001 | |
| Non-filter round gel loading pipette tip (200 µL) | Labcon | 1034-800-000 | |
| Nylon floss | Reach | 30017050 | |
| One milliliter syringe without needle | Terumo | SS-01T | |
| Optical fibre | Fibre Data | OMPF1000 | |
| PEG12KL4 peptide | EZ Biolab | (PEG12)-KLLLLKLLLLKLLLLKLLLLK-NH2 | |
| Plastic Pasteur fine tip pipette | Alpha Labotatories | LW4061 | |
| Three-way stopcock | Braun | D201 | |
| Xylazine 2% | Alfasan International B.V. | NA | |
| Zerostat 3 anti-static gun | MILTY | 5036694022153 |
References
- Newman, S. P. Drug delivery to the lungs: challenges and opportunities. Therapeutic Delivery. 8 (8), 647-661 (2017).
- Setter, S. M., et al. Inhaled dry powder insulin for the treatment of diabetes mellitus. Clinical Therapeutics. 29 (5), 795-813 (2007).
- Muralidharan, P., Hayes, D., Mansour, H. M. Dry powder inhalers in COPD, lung inflammation and pulmonary infections. Expert Opinion on Drug Delivery. 12 (6), 947-962 (2015).
- de Boer, A. H., et al. Dry powder inhalation: past, present and future. Expert Opinion on Drug Delivery. 14 (4), 499-512 (2017).
- Das, S., Tucker, I., Stewart, P. Inhaled dry powder formulations for treating tuberculosis. Current Drug Delivery. 12 (1), 26-39 (2015).
- Okamoto, H., et al. Stability of chitosan-pDNA complex powder prepared by supercritical carbon dioxide process. International Journal of Pharmaceutics. 290 (1-2), 73-81 (2005).
- He, J., et al. Evaluation of inhaled recombinant human insulin dry powders: pharmacokinetics, pharmacodynamics and 14-day inhalation. Journal of Pharmacy and Pharmacology. 71 (2), 176-184 (2019).
- Durham, P. G., Young, E. F., Braunstein, M. S., Welch, J. T., Hickey, A. J. A dry powder combination of pyrazinoic acid and its n-propyl ester for aerosol administration to animals. International Journal of Pharmaceutics. 514 (2), 384-391 (2016).
- Phillips, J. E., Zhang, X., Johnston, J. A. Dry powder and nebulized aerosol inhalation of pharmaceuticals delivered to mice using a nose-only exposure system. JoVE (Journal of Visualized Experiments). (122), e55454(2017).
- Nahar, K., et al. In vitro, in vivo and ex vivo models for studying particle deposition and drug absorption of inhaled pharmaceuticals). European Journal of Pharmaceutical Sciences. 49 (5), 805-818 (2013).
- Price, D. N., Muttil, P. Delivery of Therapeutics to the Lung. Methods in Molecular Biology. 1809, 415-429 (2018).
- Chang, R. Y. K., et al. Proof-of-Principle Study in a Murine Lung Infection Model of Antipseudomonal Activity of Phage PEV20 in a Dry-Powder Formulation. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Ito, T., Okuda, T., Takayama, R., Okamoto, H. Establishment of an Evaluation Method for Gene Silencing by Serial Pulmonary Administration of siRNA and pDNA Powders: Naked siRNA Inhalation Powder Suppresses Luciferase Gene Expression in the Lung. Journal of pharmaceutical sciences. 108 (8), 2661-2667 (2019).
- Patil, J. S., Sarasija, S. Pulmonary drug delivery strategies: A concise, systematic review. Lung India. 29 (1), 44-49 (2012).
- Ihara, D., et al. Histological Quantification of Gene Silencing by Intratracheal Administration of Dry Powdered Small-Interfering RNA/Chitosan Complexes in the Murine Lung. Pharmaceutical Research. 32 (12), 3877-3885 (2015).
- Qiu, Y., et al. Effective mRNA pulmonary delivery by dry powder formulation of PEGylated synthetic KL4 peptide. Journal of Controlled Release. 314, 102-115 (2019).
- Pfeifer, C., et al. Dry powder aerosols of polyethylenimine (PEI)-based gene vectors mediate efficient gene delivery to the lung. Journal of Controlled Release. 154 (1), 69-76 (2011).
- Kim, I., et al. Doxorubicin-loaded highly porous large PLGA microparticles as a sustained- release inhalation system for the treatment of metastatic lung cancer. Biomaterials. 33 (22), 5574-5583 (2012).
- Tonnis, W. F., et al. A novel aerosol generator for homogenous distribution of powder over the lungs after pulmonary administration to small laboratory animals. European Journal of Pharmaceutics and Biopharmaceutics. 88 (3), 1056-1063 (2014).
- Hoppentocht, M., Hoste, C., Hagedoorn, P., Frijlink, H. W., de Boer, A. H. In vitro evaluation of the DP-4M PennCentury insufflator. European Journal of Pharmaceutics and Biopharmaceutics. 88 (1), 153-159 (2014).
- Liao, Q., et al. Porous and highly dispersible voriconazole dry powders produced by spray freeze drying for pulmonary delivery with efficient lung deposition. International Journal of Pharmaceutics. 560, 144-154 (2019).
- Ito, T., Okuda, T., Takashima, Y., Okamoto, H. Naked pDNA Inhalation Powder Composed of Hyaluronic Acid Exhibits High Gene Expression in the Lungs. Molecular Pharmaceutics. 16 (2), 489-497 (2019).
- Chaurasiya, B., Zhou, M., Tu, J., Sun, C. Design and validation of a simple device for insufflation of dry powders in a mice model. European Journal of Pharmaceutical Sciences. 123, 495-501 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved