Method Article
쥐에서 건조 분말 제형의 장내 투여
요약
흡입을 위한 건식 분말 제형은 호흡기 질환 치료에 큰 잠재력을 가지고 있습니다. 인간 연구에 들어가기 전에, 전임상 연구에서 건식 분말 제형의 효능을 평가할 필요가 있다. 간 내 막 경로를 통해 마우스에서 건조 분말을 투여하는 간단하고 비침습적 방법이 제시된다.
초록
흡입 할 수없는 건조 분말 제제의 개발에서, 전임상 동물 모델에서 자신의 생물학적 활동을 평가하는 것이 필수적이다. 본 논문은 마우스에서 건식 분말 제형의 비침습적 전달 방법을 소개합니다. 3방향 스톱콕을 통해 1mL 주사기에 연결된 200 μL 젤 로딩 파이펫 팁으로 구성된 드라이 파우더 로딩 장치가 제시됩니다. 소량의 건조 분말(1-2 mg)이 파이펫 팁에 적재되어 주사기에 0.6mL의 공기가 분산됩니다. 파이펫 팁은 일회용이고 저렴하기 때문에 다른 건조 분말 제형은 사전에 다른 팁으로 로드 할 수 있습니다. 다양한 제형은 장치 세척 및 용량 리필 없이 동일한 동물 실험에서 평가될 수 있으므로 시간을 절약하고 잔류 분말로부터 의 교차 오염의 위험을 제거합니다. 분말 분산의 정도는 파이펫 팁에 남아있는 분말의 양에 의해 검사 될 수있다. 사용자 정의 광원과 안내 캐뉼라가있는 마우스에 삽관 프로토콜이 포함되어 있습니다. 적절한 관착은 마우스의 깊은 폐 부위에 건조 분말 제형의 장내 전달에 영향을 미치는 주요 요인 중 하나입니다.
서문
투여의 폐 경로는 지역 및 조직 적 행동 모두에 대한 치료를 제공하는 다양한 혜택을 제공합니다. 폐 질환의 치료를 위해, 높은 국부 약물 농도는 폐 전달에 의해 달성 될 수있다, 따라서 필요한 용량을 감소시키고 전신 부작용의 발생률을 낮추는. 더욱이, 폐에서 상대적으로 낮은 효소 활동은 조기 약물 대사를 줄일 수 있습니다. 폐는 또한 크고 잘 퍼진 표면적, 매우 얇은 상피 세포 층 및 폐 모세혈관1의높은 혈액 부피로 인한 전신 작용에 대한 약물 흡수에 효율적입니다.
흡입건조분말제제는 천식, 만성폐쇄성 폐질환, 당뇨병 및 폐예방접종2,3,4등 다양한 질환의 예방 및 치료를 위해 널리 조사되고있다. 고체 상태의 약물은 일반적으로 액체 형태보다 더 안정하며, 건조 분말 흡입기는 분무기5,6보다휴대성이 뛰어나고 사용자 친화적이다. 흡입건조분말제형의 개발에서, 안전성, 약동성 프로파일 및 치료효능은 폐투여에 따른 전임상 동물모델에서 평가될 필요가있다 7. 건조 분말을 적극적으로 흡입할 수 있는 인간과 달리, 작은 동물에게 건조 분말을 폐로 전달하는 것은 어려운 일입니다. 동물의 폐에 건조 분말을 전달하는 효율적인 프로토콜을 확립 할 필요가있다.
마우스는 경제적이기 때문에 연구 동물 모델로 널리 사용되며 잘 번식합니다. 그들은 또한 취급하기 쉽고 많은 질병 모형이 잘 설치되어 있습니다. 마우스의 폐에 건조 분말을 관리 하는 두 가지 주요 접근 이 있다: 흡입 및 장 내 관리. 흡입을 위해 마우스는 건조 분말이 에어로졸화되고 동물이 체증 없이 에어로졸에서 호흡하는 전신 또는 코 전용챔버에배치됩니다8,9. 고가의 장비가 필요하며 약물 전달 효율이 낮습니다. 전신 챔버는 기술적으로 덜 어려울 수 있지만, 코 전용 노출 챔버는 신체 표면에 약물의 노출을 최소화 할 수 있습니다. 에 관계없이, 폐에 전달 된 복용량을 정확하게 제어하고 결정하는 것은 여전히 어렵습니다. 건조 분말은 주로 점막 간격이 눈에 띄는 비소하린스 지역에 증착된다10. 더욱이, 챔버 내부의 마우스는 식량 및급수(11)를제한하고 박탈당하기 때문에 투여 과정에서 상당한 스트레스를 받고 있다. 장내 투여를 위해, 일반적으로 기관내로 직접 물질의 도입을 의미한다. 이를 달성하기 위한 두 가지 기술이 있습니다: 기관 절제술과 오로트라세이션 삽관. 전자는 침입적이고 분말 투여에 거의 사용되지 않는 기관에서 절개를하는 수술 절차가 필요합니다. 두 번째 기술만 여기에 설명되어 있습니다. 흡입 방법에 비해, 내막 투여는 최소한의 약물 손실로 높은 전달 효율때문에 마우스내 폐 전달을 위해 보다 일반적으로 사용되는방법이다(12,13). 그것은 정확 하 게 마우스에 몇 밀리 그램 내에서 분말의 작은 금액을 제공 하는 간단 하 고 빠른 방법. 마우스는 해부학적으로 인간과 생리적으로 구별되지만, 관적 과정에서 마취가 요구되지만, 내내 투여는 상부 호흡기를 우회하고 폐 흡수, 생체 이용률 및 치료효과(14,15)와같은 건조 분말 제형의 생물학적 활성을 평가하는 보다 효과적인 방법을 제공한다.
건조 분말을 장내 관리하려면 마우스를 삽관해야 하므로 어려울 수 있습니다. 이 논문에서는 맞춤형 건조 분말 인수프플레이터 및 삽관 장치의 제조가 설명되어 있습니다. 마우스의 폐에 있는 건식 분말의 삽관 및 부당의 절차가 입증됩니다.
프로토콜
이 연구에서 수행 된 실험은 홍콩 대학 인 교육 및 연구를위한 살아있는 동물 사용위원회 (CULATR)의 승인을 받았습니다. 루시파라기 메신저 RNA(mRNA)의 0.5%를 함유한 스프레이 동결 건조(SFD)에 의해 제조된 건식 분말 제형은, 5% 합성 펩타이드 PEG12KL4 및 94.5%의 매니톨(w/w)을 함유하여 폐16에서mRNA 발현을 입증하기 위해 이 연구에서 사용된다. SFD 분말의 질량 중앙공기역학적 직경(MMAD)은 2.4 μm입니다. 분무 건조(SD) 매니톨 분말은 분말분산(16)에사용되는 공기 부피의 효과를 조사하는 데 사용된다. SD 분말의 MMAD는 1.5 μm입니다.
1. 건조 분말 인수프플랫터 의 제조 및 건조 분말의 적재
- (선택 사항) 건식 분말(유리병)과 200 μL 비필터 라운드 젤 로딩 파이펫 팁의 정적 충전을 중화시합니다. 제조업체의 지시에 따라 정전기 방지 총 또는 탈이온화 기능과의 균형을 사용합니다.
- 약 4cm x 4cm 크기의 계량 용지를 준비합니다. 용지를 대각선으로 반으로 접은 다음 전개합니다.
- 계량 용지에 1-2 mg의 드라이 파우더를 계량합니다.
- 팁의 넓은 개구부를 통해 분말로 젤 로딩 파이펫 팁을 채웁니다. 파우더가 팁의 좁은 끝 부근에서 느슨한 응집체가 형성될 때까지 분말을 부드럽게 포장하십시오(그림1A). 분말 분산을 방해할 수 있으므로 분말을 너무 단단히 포장하지 마십시오.
- 3방향 스톱콕(도1B)을통해 분말로드 팁을 1mL 주사기에 연결합니다. 주사기의 크기는 분말을 분산하는 데 사용되는 공기의 부피에 따라 변경할 수 있습니다. 가루의 유출을 방지하기 위해 연결 중에 팁과 주사기를 수직으로 잡습니다. 즉시 투여가 수행되지 않으면 파라필름을 사용하여 팁의 개구부를 밀봉하고 투여 전까지 적절한 상태로 일시적으로 보관하십시오.
2. 관착 장치의 제조
- 광원(그림 2)
- 발광 다이오드(LED) 토치와 직경 0.8-1mm의 유연한 광섬유를 통해 맞춤형 광원을 준비합니다.
- 광섬유가 간신히 통과할 수 있도록 LED 토치의 투명 렌즈에 핸드 드릴 또는 드릴 비트로 중앙 오리피스를 만듭니다.
- 오리피스를 통해 광섬유를 삽입합니다. LED 토치를 켜서 광섬유의 다른 쪽 끝에서 최대 밝기를 위해 삽입의 위치와 깊이를 조정합니다.
- 투명 에폭시 접착제로 광학 섬유를 제자리에 부착합니다.
- 가이딩 캐뉼라(그림 3)
- 1mL 플라스틱 파스퇴르 파이펫(그림3A)을가지고 파이펫을 양쪽 끝에 두십시오.
- 알코올 램프(또는 분젠 버너와 같은 실험실내의 다른 열원)를 사용하여 피펫 의 중간을 화염 위 5-10cm(그림3B)에배치하여 가열합니다. 파이펫을 회전하여 균일하게 가열되었는지 확인합니다.
- 플라스틱이 부드럽고 변형이 되면 파이펫을 화염에서 멀리 옮기고 파이펫을 부드럽게 펴십시오.
- 파트 A와 파트 B(그림 3C-E)로가위 한 쌍으로 중간에 늘어난 파이펫을 잘라. 파트 A를 미세 팁 파이펫으로 사용하고 B파트를 안내 캐뉼라로 사용하십시오. 안내 캐뉼라와 성공적인 삽의 기회를 증가하려면, 파트 B(그림 3F)의끝에 bevel (너무 날카로운 동물을 다치게의 위험을 증가시킬 수 있습니다) 확인합니다. 200 μL 젤 로딩 파이펫 팁(분말 적재용)이 가이딩 캐뉼라에 삽입되면 캐뉼라를 1-2mm 돌출해야 합니다.
참고: 삽관을 위한 적절한 치수(내부 및 외부 직경)를 가진 안내 캐뉼라(Part B)는 17 게이지 바늘 내부에 들어갈 수 있는 동안 21게이지 바늘내부에 들어갈 수 있습니다. 적절한 치수를 달성하기 위해 파이펫을 스트레칭하는 데 여러 번 시도할 수 있습니다. - (선택 사항): 가이딩 캐뉼라의 넓은 끝에서 작은 개구부를 잘라 서 광섬유(그림3F)를더 쉽게 보유할 수 있도록 보다 유연하게 만듭니다. 이 개방은 또한 액체 에어로졸의 투여를위한 마이크로 스프레이의 피팅을 허용합니다.
3화 삽관
- 마우스 (BALB/c, 7-9 주) 케타민 (100 mg/kg) 및 자일라진 (10 mg/kg) 관면 주사에 의해 마취.
- 플렉시글래스로 만든 플랫폼을 준비하고 클램프가 있는 스탠드에 장착합니다(도4A). 마취된 마우스를 플랫폼(약 60°의 경사)에 척추 위치에 놓습니다. 플랫폼의 높이와 경사각도는 스탠드의 클램프 위치에 의해 조정할 수 있습니다.
- 나일론 치실(도 4B)에절개를 연결하여 마우스를 일시 중단합니다. 테이프 또는 고무 밴드로 마우스의 위치를 고정합니다.
- 가이딩 캐뉼라의 개구부와 함께 섬유 레벨의 끝으로 관착하기 전에 가이딩 캐뉼라에 광섬유를 삽입합니다. LED 토치를 켜서 조명합니다.
- 마우스의 혀를 집게 한 쌍으로 부드럽게 돌출하여 기관지노출을 합니다.
- 다른 손으로 광학 섬유가 있는 가이딩 캐뉼라를 내부에 보관하십시오. 구강을 통해 삽입합니다. 광섬유의 조명으로 기관지의 개구부는 성대 사이의 오리피스로 시각화될 수 있다.
- 개구부(그림5A)의중간선쪽으로 안내 캐뉼라의 경사를 정렬합니다. 기관 개구부에서 캐뉼라의 최고급 끝을 조준하여 광섬유로 가이딩 캐뉼라를 기관으로 부드럽게 삽관합니다.
- 관관시, 광섬유를 신속하게 제거하고 기관 내부에 안내 캐뉼라를 둡니다(도5B). 정상적인 호흡을 관찰해야 합니다.
- 안내 캐뉼라의 개구부에서 미세 팁 파이펫(파트 A)을 잡고 작은 공기 퍼프(약 0.2mL)를 마우스의 폐에 주입한다. 마우스 의 가슴에 약간의 인플레이션은 적절한 삽관을 나타냅니다. 분말 투여 전에 미세 팁 파이펫을 제거합니다.
4. 분말 투여
- 1.5 단계에서 설명된 바와 같이 주사기에 연결된 분말 로드 팁을 누를 수 있습니다. 주사기와 팁 사이의 공기 흐름이 분리되었는지 확인합니다.
- 주사기 플런저를 뒤로 당겨 0.6 mL의 공기를 인출하십시오.
참고: 분말을 분산하는 데 사용되는 공기의 양은 분말의 특성과 적재된 분말의 양에 따라 달라집니다. 이것은 결과 섹션에 더 설명됩니다. - 3방향 스톱콕의 밸브를 돌려 주사기와 분말로 적재된 팁 사이의 기류를 연결합니다.
- 이미마우스(도 5C)의기관체에 배치된 가루 캐뉼라에 분말로드 팁을 삽입한다. 안내 캐뉼라를 잡고 주사기 플런저를 한 번의 연속 작용으로 강제로 밀어 에어로졸이 폐에 분말을 분산시보세요.
참고: 동물의 부상을 피하기 위해 장치의 전방 모션을 최소화해야 합니다. - 팁을 제거하고 팁 내부의 분말이 비워졌는지 확인합니다. 그렇지 않은 경우 4.1에서 4.4 단계를 반복합니다.
참고: 과도한 도청으로 인해 분말이 너무 단단히 포장되면 제대로 분산되지 않을 수 있습니다. - 투여가 완료되면 기관에서 안내 캐뉼라를 제거하십시오.
- 마우스가 기도의 봉쇄를 피하기 위해 혀반이 튀어나온 척추 위치에 수평으로 배치하여 마우스를 복구할 수 있도록 합니다.
결과
건조 분말 insufflator동물의 폐에 분말 에어로졸을 전달하는 데 사용되는 경우, 사용되는 공기의 양은 분말 분산 효율뿐만 아니라 안전에 영향을 미치기 때문에 매우 중요합니다. 이를 최적화하기 위해, 다양한 공기량(0.3mL, 0.6mL 및 1.0mL)을 사용하여 건조 분말(1 mg의 분무 건조 매니톨)을 분산시키고 마우스의 무게를 투여 후 48시간 동안 모니터링하였다(도6). 0.3 mL 및 0.6 mL의 공기 사용은 투여 후 최대 48h까지 마우스의 체중 감소를 일으키지 않았다. 1mL의 공기로 분말을 분산하면 24 시간 이내에 체중 감량의 5 % 이상이 발생했으며 48 시간 후에 완전히 회복되지 않았습니다. 이 프로토콜에서, 7-9주 된 BALB/c 마우스가 사용되었다. 종의 종, 동물의 변형 및 나이, 분말 특성(예를 들어, 입자 크기 분포, 응집력 및 밀도) 및 분말의 질량에 따라 효율적인 분말 분산 및 동물 내성을 위해 사용되는 공기의 부피는 다른 동물 모델에 대한 조사자들에 의한 최적화를 요구할 수 있다.
상기에 설명된 방법을 사용하여 분무 동결 건조(SFD)에 의해 제조된 건식 분말 제형이 마우스에 전달되었다. SFD 제형은 루시파아제 단백질을 발현하는 mRNA의 0.5%, 합성 펩타이드의 5%를 전달 벡터로, 매니톨16의94.5%를 함유했다. BALB/c 마우스는 폐내 의 5 μg를 함유한 SFD 분말 1mg을 내다투여하였고, 폐내의 루시파아제 발현은 생체 내 이미징 시스템(IVIS)(도7)을이용한 투여 후 24시간 에서 평가하였다. SFD 분말은 깊은 폐에 분산되었고 루시파아제 발현이 관찰되었다. 비교로, SFD 분말은 PBS(75 μL의 최종 부피)로 재구성되고 동일한 삽관 절차를 가진 액체로 마우스에 투여되었지만 대신 액체에어로졸(16)을생성하는 마이크로스프레이를 사용하였다. 재구성된 제제의 루시파아제 발현은 분말 용해 문제 또는 분말 및 액체 형태 사이의 상이한 약동 프로파일 때문일 수 있는 건조 분말 제형보다 현저히 높았다. mRNA 건조 분말 에어로졸로 처리된 폐의 조직학적 특성은 처리되지 않은 대조군 및 리포폴리삭카라이드(LPS) 처리군(도8)과비교하였다. 어떤 치료도 없는 폐는 LPS 내 10μg의 폐가 간질 및 폐포 공간으로 공기 공간과 염증세포 침투의 불규칙한 분포를 보였을 때 건강한 프리젠테이션을 보여주었다. SFD 분말로 치료된 폐는 염증의 징후를 보이지 않았습니다.
그림 1: 맞춤형 건조 분말 인수프플랫터.
(A)분말은 팁의 좁은 끝 근처에 포장됩니다. (B)젤로딩 파이펫 팁은 3방향 스톱콕을 통해 1mL 주사기에 연결됩니다. 그림은 랴오 등에서적응된다. 21.. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 삽관을 위한 맞춤형 광원.
유연한 광섬유가 렌즈에 작은 구멍을 만들어 LED 토치에 연결됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 가이딩 캐뉼라.
(A)1mL 플라스틱 파스퇴르 파이펫을 사용하여 안내 캐뉼라를 만듭니다. (B)파이펫은 가열에 의해 부드러워져 있습니다. (C)가열 된 파이펫이 늘어나고 절단됩니다. (D)파이펫의 파트 A는 미세 팁 파이펫으로 사용됩니다. (E&F) 파이펫의 파트 B는 안내 캐뉼라로 사용됩니다. 배관 절차를 용이하게 하기 위해 bevel이 만들어집니다. 캐뉼라의 유연성을 높이기 위해 작은 개구부(선택 사항)를 만들 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 삽관 플랫폼.
(A)삽관 플랫폼은 스탠드에 장착된 플렉시글라스 플레이트로 구성됩니다. (B)마취 마우스는 나일론 치실로 절개를 연결하여 중단된 척추 위치에 플랫폼에 배치된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 5: 삽관 절차를 설명하는 회로도 다이어그램입니다.
(A)가이딩 캐뉼라의 벨은 기관 개구부의 중간선과 정렬된다. (B)가이딩 캐뉼라는 기관체에 삽입되어 분말 투여를 위한 준비가 되어 있다. (C)분말로드 팁(3방향 스톱콕을 통해 주사기에 연결)은 이미 마우스의 기관에 배치된 가이딩 캐뉼라에 삽입된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
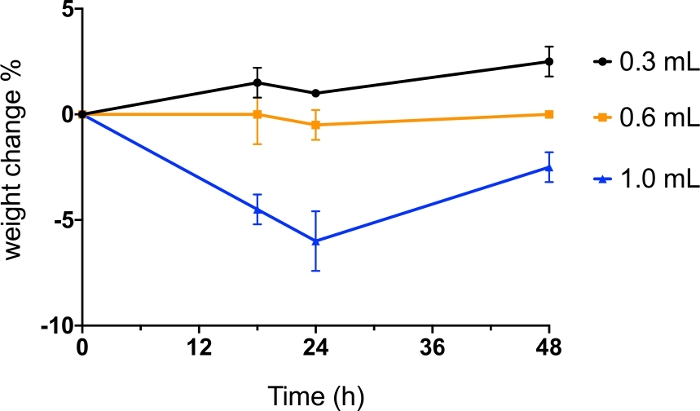
그림 6: 공기의 다른 부피를 가진 건조 분말의 장내 투여.
BALB/c 마우스는 0.3mL, 0.6mL 및 1.0mL의 공기에 의해 분산된 분무 건조(SD) 매니톨 분말로 내막 투여하였다. 마우스의 체중은 투여 전과 투여 전 과 투여 후 18시간, 24시간 및 48h에서 모니터링하였다. 데이터는 체중 변화 비율(n=2)의 평균 값으로 제시되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 7: mRNA 제형의 장외 투여는 건조 분말 및 재구성된 액체 에어로졸로.
BALB/c 마우스는 마이크로스프레이를 사용하여 맞춤형 건조 분말 인수프플레이터 또는 재구성된 액체 에어로졸(75 μL PBS에서 1 mg)을 사용하여 분말 에어로졸(1 mg)으로 분무 동결 건조(SFD) 0.5% mRNA(luciferase) 제형으로 내내 투여하였다. 각 마우스는 mRNA의 5 μg의 복용량을 받았다. PBS(75 μL)를 제어로 사용하였다. 24시간 투여 후(A)에서 폐는 생체 발광 이미징을 위해 격리되었다; (B) 폐 조직의 루시파라제 단백질 발현을 측정하였다. 데이터는 단백질의 mg 당 상대광 단위 (RLU)의 평균 값으로 표현되었으며, 양방향 ANOVA로 분석한 후 Tukey의 후항선 테스트인 ***p < 0.001 (n=4). 그림은 Qiu 외16에서적응된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 8: mRNA 건조 분말 제형의 장내 투여에 따른 마우스의 폐의 조직학.
(A)처리되지 않은 대조군; 마우스는(B)LPS(25 μL PBS에서 10 mg)로 내내 투여되었고,(C)분무 동결 건조 된 mRNA 분말 (1 mg). 슬라이드는 20배율(스케일 바 = 100mm)에서 직립 현미경을 사용하여 볼 수 있었다. 그림은 Qiu 외16에서적응된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 논문에서는 건조 분말 부피 및 장내 삽관을 위한 맞춤형 장치가 제공됩니다. 분말 적재 단계에서, 건조 분말은 200 μL 젤 로딩 파이펫 팁에로드됩니다. 팁의 좁은 끝에 분말의 느슨한 포장을 허용 하기 위해 팁을 부드럽게 탭 하는 것이 중요 하다. 그러나 분말이 너무 단단히 포장되면 팁에 갇히고 제대로 분산 될 수 없습니다. 분말 로딩을 용이하게 하기 위해 분말 및 파이펫 팁의 정적 충전을 중화하는 것이 좋습니다. 가이딩 캐뉼라는 장치의 중요한 구성 요소입니다. 그것은 마우스의 기관으로 분말로드 파이펫 팁의 삽관을 용이하게하는 데 사용됩니다. 가이딩 캐뉼라의 직경이 너무 넓어서는 안 됩니다. 그렇지 않으면 기관지에 삽입하기가 어렵고 마우스가 손상될 수 있습니다. 가이딩 캐뉼라의 직경은 광섬유와 분말로 된 파이펫 팁에 맞게 충분히 넓어야 하며, 파이펫 팁은 약 1-2mm의 안내 캐뉼라를 돌출해야 한다.
기관의 개방을 시각화하는 능력은 관독 과정에서 매우 중요하며, 가이딩 캐뉼라를 올바르게 삽입할 수 있습니다. 기관 개방은 목구멍 뒤쪽의 규칙적인 개폐 모션이 있는 흰색 아리티노이드 연골로 구성됩니다. 광섬유 조명으로 기관개방을 쉽게 시각화할 수 있습니다. 미세 한 팁 플라스틱 파이펫을 통해 공기의 작은 볼륨을 퍼프함으로써, 가슴의 인플레이션은 적절한 삽관을 나타냅니다. 가슴의 인플레이션이 관찰되지 않거나 삽입 중에 저항이 느껴지면 안내 캐뉼라를 신속하게 철회하고 단계를 다시 반복하십시오.
널리 사용 되는 시판되는 건조 분말 insufflator12,17,18 (재료의 표;이 장치는 지금 단종). 건조 분말은 장치의 샘플 챔버에 로드되고 3mL 플라스틱 공기 주사기 또는 공기 펌프에서 공기에 의해 분산된다. 방출 된 복용량을 측정하기 위해, 장치는 분말 투여 전후에 무게를 달아야하며, 이는 분말의 투여량이 일반적으로 매우 작다 (장치의 질량에 상대적)을 고려하여 부정확하게 이어집니다. 상용 insufflator에 비해, 사용자 정의 된 장치의 가장 큰 장점은 투명 젤 로딩 파이펫 팁에 분말의 부재에 의해 분말 분산의 성공을 관찰 할 수 있다는 것입니다. 파이펫 팁은 가볍기 때문에, 또한 방출된 복용량을 측정하기 위하여 투여 전후에 정확하게 무게를 측정할 수 있습니다. 파이펫 팁은 동물의 기관에 노출되는 대신 안내 캐뉼라에 삽입됩니다. 기관에서 수분이나 분비로 팁을 오염시킬 위험이 최소화됩니다(방출된 용량 측정의 정확도에 영향을 줄 수 있음). 파이펫 팁은 일회용이고 저렴하기 때문에 다른 건조 분말 제형은 사전에 다른 팁에 로드 될 수 있습니다. 다양한 제형은 장치 세척 및 용량 리필 없이 동일한 동물 실험에서 평가될 수 있으므로 시간을 절약하고 잔류 분말로부터의 교차 오염 위험을 제거합니다. 더욱이, 상용 insufflator에 의해 생성된 분말 분산 패턴은 상이한 제형 들 사이에서 다양하다. 다수의 연구는 상용 insufflator에 의해 분산된 건조 분말이 쉽게 응집되었고 투여 시 깊은 폐에 도달하지 못했다고보고19,20. 대조적으로, 당사와 유사한 장치에 의해 분산된 다른 제형은 높은 폐증착(15,21,22)을갖는 것으로 보고된다.
동물의 폐에 분말 에어로졸의 투여를 위한 문헌에 보고된 다른 유사한 맞춤형 장치가 있습니다. 예를 들어, Chaurasiya 외. 분말 분산에 대한 삽관 후 캐뉼라 튜브에 연결된 주사기와 분말 적재뿐만 아니라 분말 적재를위한 캐뉼라 튜브의 사용을설명했다(23) 그들의 접근 방식은 표준화 된 장비 와 재료 (예 : 이스코프, 캐뉼라 및 주사기)를 덜 사용자 정의로 사용하지만, 여기에 있는 방법은 몇 가지 뚜렷한 장점을 제공합니다. 첫째, 그것은 약물 투여 전에 올바른 삽관의 확인을 허용합니다. 이 단계는 경험이 적은 사용자에게 특히 유용합니다. 둘째, 가이딩 캐뉼라는 기관내 분비 또는 습기가 젤 로딩 파이펫 팁을 오염시키지 못하도록 보호하는 보호막 역할을 할 수 있어 계량에 의한 보다 정확한 방출 용량 측정을 가능하게 합니다. 마지막으로, 광섬유와 함께 보다 유연한 가이딩 캐뉼라를 사용하면 관착이 더 쉬워질 수 있습니다.
요약하자면, 소량의 분말을 정확하게 분산시키는 데 있어 저렴하고 일회용적이며 재현 가능하며 효율적인 맞춤형 드라이 파우더 인수프플랫터가 이 논문에 도입된다. 언급 된 관착 과정은 비침습적, 빠르며 마우스에 분말 제형을 안전하고 정확하게 전달할 수 있습니다. 또한 폐 전달을 위한 액체 제형을 투여하도록 채택될 수 있다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
저자는 레이 리 씨, HC 렁 씨와 월리스 소 씨에게 광원과 분말 인수프플레이터를 만드는 데 친절한 도움을 준 것에 대해 감사드립니다. 동물 화상 진찰에 대한 지원을위한 교수 핵심 시설. 이 작품은 홍콩 연구 보조금 위원회(17300319)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| BALB/c mouse | Female; 7-9 weeks old; Body weight 20-25 g | ||
| CleanCap Firefly Luciferase mRNA | TriLink Biotechnology | L-7602 | |
| Dry Powder Insufflator | PennCentury | Model DP-4M | |
| Ketamine 10% | Alfasan International B.V. | NA | |
| Light emitting diode (LED) torch | Unilite Internation | PS-K1 | |
| Mannitol (Pearlitol 160C) | Roquette | 450001 | |
| Non-filter round gel loading pipette tip (200 µL) | Labcon | 1034-800-000 | |
| Nylon floss | Reach | 30017050 | |
| One milliliter syringe without needle | Terumo | SS-01T | |
| Optical fibre | Fibre Data | OMPF1000 | |
| PEG12KL4 peptide | EZ Biolab | (PEG12)-KLLLLKLLLLKLLLLKLLLLK-NH2 | |
| Plastic Pasteur fine tip pipette | Alpha Labotatories | LW4061 | |
| Three-way stopcock | Braun | D201 | |
| Xylazine 2% | Alfasan International B.V. | NA | |
| Zerostat 3 anti-static gun | MILTY | 5036694022153 |
참고문헌
- Newman, S. P. Drug delivery to the lungs: challenges and opportunities. Therapeutic Delivery. 8 (8), 647-661 (2017).
- Setter, S. M., et al. Inhaled dry powder insulin for the treatment of diabetes mellitus. Clinical Therapeutics. 29 (5), 795-813 (2007).
- Muralidharan, P., Hayes, D., Mansour, H. M. Dry powder inhalers in COPD, lung inflammation and pulmonary infections. Expert Opinion on Drug Delivery. 12 (6), 947-962 (2015).
- de Boer, A. H., et al. Dry powder inhalation: past, present and future. Expert Opinion on Drug Delivery. 14 (4), 499-512 (2017).
- Das, S., Tucker, I., Stewart, P. Inhaled dry powder formulations for treating tuberculosis. Current Drug Delivery. 12 (1), 26-39 (2015).
- Okamoto, H., et al. Stability of chitosan-pDNA complex powder prepared by supercritical carbon dioxide process. International Journal of Pharmaceutics. 290 (1-2), 73-81 (2005).
- He, J., et al. Evaluation of inhaled recombinant human insulin dry powders: pharmacokinetics, pharmacodynamics and 14-day inhalation. Journal of Pharmacy and Pharmacology. 71 (2), 176-184 (2019).
- Durham, P. G., Young, E. F., Braunstein, M. S., Welch, J. T., Hickey, A. J. A dry powder combination of pyrazinoic acid and its n-propyl ester for aerosol administration to animals. International Journal of Pharmaceutics. 514 (2), 384-391 (2016).
- Phillips, J. E., Zhang, X., Johnston, J. A. Dry powder and nebulized aerosol inhalation of pharmaceuticals delivered to mice using a nose-only exposure system. JoVE (Journal of Visualized Experiments). (122), e55454(2017).
- Nahar, K., et al. In vitro, in vivo and ex vivo models for studying particle deposition and drug absorption of inhaled pharmaceuticals). European Journal of Pharmaceutical Sciences. 49 (5), 805-818 (2013).
- Price, D. N., Muttil, P. Delivery of Therapeutics to the Lung. Methods in Molecular Biology. 1809, 415-429 (2018).
- Chang, R. Y. K., et al. Proof-of-Principle Study in a Murine Lung Infection Model of Antipseudomonal Activity of Phage PEV20 in a Dry-Powder Formulation. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Ito, T., Okuda, T., Takayama, R., Okamoto, H. Establishment of an Evaluation Method for Gene Silencing by Serial Pulmonary Administration of siRNA and pDNA Powders: Naked siRNA Inhalation Powder Suppresses Luciferase Gene Expression in the Lung. Journal of pharmaceutical sciences. 108 (8), 2661-2667 (2019).
- Patil, J. S., Sarasija, S. Pulmonary drug delivery strategies: A concise, systematic review. Lung India. 29 (1), 44-49 (2012).
- Ihara, D., et al. Histological Quantification of Gene Silencing by Intratracheal Administration of Dry Powdered Small-Interfering RNA/Chitosan Complexes in the Murine Lung. Pharmaceutical Research. 32 (12), 3877-3885 (2015).
- Qiu, Y., et al. Effective mRNA pulmonary delivery by dry powder formulation of PEGylated synthetic KL4 peptide. Journal of Controlled Release. 314, 102-115 (2019).
- Pfeifer, C., et al. Dry powder aerosols of polyethylenimine (PEI)-based gene vectors mediate efficient gene delivery to the lung. Journal of Controlled Release. 154 (1), 69-76 (2011).
- Kim, I., et al. Doxorubicin-loaded highly porous large PLGA microparticles as a sustained- release inhalation system for the treatment of metastatic lung cancer. Biomaterials. 33 (22), 5574-5583 (2012).
- Tonnis, W. F., et al. A novel aerosol generator for homogenous distribution of powder over the lungs after pulmonary administration to small laboratory animals. European Journal of Pharmaceutics and Biopharmaceutics. 88 (3), 1056-1063 (2014).
- Hoppentocht, M., Hoste, C., Hagedoorn, P., Frijlink, H. W., de Boer, A. H. In vitro evaluation of the DP-4M PennCentury insufflator. European Journal of Pharmaceutics and Biopharmaceutics. 88 (1), 153-159 (2014).
- Liao, Q., et al. Porous and highly dispersible voriconazole dry powders produced by spray freeze drying for pulmonary delivery with efficient lung deposition. International Journal of Pharmaceutics. 560, 144-154 (2019).
- Ito, T., Okuda, T., Takashima, Y., Okamoto, H. Naked pDNA Inhalation Powder Composed of Hyaluronic Acid Exhibits High Gene Expression in the Lungs. Molecular Pharmaceutics. 16 (2), 489-497 (2019).
- Chaurasiya, B., Zhou, M., Tu, J., Sun, C. Design and validation of a simple device for insufflation of dry powders in a mice model. European Journal of Pharmaceutical Sciences. 123, 495-501 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유