Method Article
マウスにおける乾燥粉末製剤の気管内投与
要約
吸入用の乾燥粉末製剤は、呼吸器疾患の治療に大きな可能性を秘めています。ヒト研究に入る前に、前臨床試験における乾燥粉末製剤の有効性を評価する必要がある。気管内経路を介したマウスにおける乾燥粉末の投与の簡便かつ非侵襲的な方法が提示される。
要約
吸入可能な乾燥粉末製剤の開発では、前臨床動物モデルにおけるそれらの生物学的活性を評価することが不可欠である。本論文では、マウスにおける乾燥粉末製剤の非侵襲的な方法を紹介する。3方向のストップコックを介して1 mLシリンジに接続された200 μLのゲルローディングピペットチップから成る乾燥粉末ローディング装置が提示されます。少量の乾燥粉末(1〜2mg)をピペットチップに装填し、0.6mLの空気をシリンジに分散させます。ピペットチップは使い捨てで安価であるため、異なる乾燥粉末製剤を事前に異なるチップにロードすることができます。様々な製剤は、デバイスの洗浄および用量補充なしで同じ動物実験で評価することができ、それによって時間を節約し、残留粉末からの交差汚染のリスクを排除する。粉末分散の程度は、ピペットチップに残っている粉末の量によって検査することができる。カスタムメイドの光源と導くカニューレを使用したマウスの挿管のプロトコルが含まれています。適切な挿管は、マウスの深部肺領域への乾燥粉末製剤の気管内送達に影響を与える重要な要因の1つである。
概要
肺投与経路は、局所的および全身的な行動の両方の治療薬を提供する上で様々な利点を提供する。肺疾患の治療のために、高い局所薬物濃度は肺分娩によって達成され、それにより必要な用量を減少させ、全身的な副作用の発生率を低下させる。さらに、肺における比較的低い酵素活動は、早期薬物代謝を減少させることができる。肺はまた、大きく、よく浸透した表面積、極めて薄い上皮細胞層および肺毛細血管における高血中量による全身作用のための薬物吸収のために有効である1。
吸入乾燥粉末製剤は、喘息、慢性閉塞性肺疾患、糖尿病および肺ワクチン接種2、3、4などの様々な疾患の予防および治療のために広く検討されている。固体状態の薬物は、一般的に液体の形態よりも安定しており、乾燥粉末吸入器はネブライザー5、6よりも携帯性と使いやすさである。吸入乾燥粉末製剤の開発において、安全性、薬物動態プロファイルおよび治療効果は、肺投与7に続く前臨床動物モデルにおいて評価される必要がある。乾燥粉末を積極的に吸い込むことができる人間とは異なり、乾燥粉末を小動物に肺分娩することは困難である。動物の肺に乾燥粉末を送達する効率的なプロトコルを確立する必要があります。
マウスは経済的で繁殖性が高いため、研究動物モデルとして広く使用されています。彼らはまた、扱いやすく、多くの疾患モデルが確立されています。マウスの肺に乾燥粉末を投与する2つの主要なアプローチがあります: 吸入と気管内投与.吸入のために、マウスは乾燥粉末がエアロゾル化され、動物がセデレーション8、9なしでエアロゾルで呼吸する全身または鼻のみのチャンバーに置かれる。高価な機器が必要であり、薬物送達効率が低い。全身室は技術的にはそれほど難しいかもしれませんが、鼻のみの暴露室は身体表面への薬物の暴露を最小限に抑えることができます。いずれにせよ、肺に送達される用量を正確に制御し、決定することは依然として困難である。乾燥粉末は主に、粘液性クリアランスが顕著である鼻咽頭領域に堆積する10.また、チャンバー内のマウスは、食糧および水供給11を制約し、奪われるため、投与プロセス中に大きなストレスを受けている。気管内投与の場合、一般的に気管内に直接物質を導入することをいう。これを達成するための2つの異なる技術があります:気管切開術と口内挿管。前者は、侵襲的で粉末投与にめったに使用されない気管の切開を行う外科的処置を必要とする。ここでは、2 番目のテクニックのみを説明します。吸入方法と比較して、気管内投与は、薬物損失を最小限に抑える12,13の高い送達効率のためにマウスでの肺送達のためにより一般的に使用される方法である。これは、マウスに数ミリグラム以内の粉末を正確に少量を提供する簡単で迅速な方法です。マウスはヒトに対して解剖学的および生理的に区別され、挿管過程では麻酔が必要であるが、気管内投与は上気道をバイパスし、肺吸収、生体利用能および治療効果14、15などの乾燥粉末製剤の生物学的活性を評価するより効果的な方法を提供する。
乾燥粉末を気管内に投与するには、マウスを挿管する必要があり、これは困難である可能性があります。本論文では、カスタムメイドのドライパウダーインスフレーターと挿管装置の製造について説明する。マウスの肺における乾燥粉末の挿管および浸潤の手順が実証されている。
プロトコル
本研究で行われた実験は、香港大学の生きた動物の教育研究用使用委員会(CULATR)によって承認されています。ルシファーゼメッセンジャーRNA(mRNA)の0.5%を含む噴霧凍結乾燥(SFD)によって調製された乾燥粉末製剤は、5%合成ペプチドPEG12KL4および94.5%のマンニトール(w/w)を肺16におけるmRNA発現を実証するために本研究で使用される。SFD粉末の質量中央値空気力学直径(MMAD)は2.4μmです。噴霧乾燥(SD)マンニトール粉末は、粉末分散液16に用いられる空気量の影響を調べるため使用される。SD粉末のMMADは1.5μmです。
1. 乾燥粉末インスフレーターの製造と乾燥粉末のローディング
- (オプション)乾燥粉末(バイアル内)の静電荷と200 μLノンフィルター丸いゲルローディングピペットチップを中和します。メーカーの指示に従って、帯電防止銃または脱イオン機能を備えたバランスを使用してください。
- 約4cm x 4cmのサイズの計量用紙を用意します。紙を斜めに半分に折り、折り返します。
- 計量紙に1〜2mgの乾燥粉末を計量する。
- ゲルローディングピペットチップに、チップの広い開口部を通して粉末を充填します。粉末が先端の狭い端付近に緩い凝集体を形成するまで粉末を軽くたたきます(図1A)。粉末の分散を妨げる可能性があるため、粉末をしっかりと詰め込むのは避けてください。
- パウダーロードされたチップを3方向のストップコックを通して1 mLのシリンジに接続します(図1B)。シリンジのサイズは、粉末を分散させるために使用される空気の量に応じて変更することができます。取り付け時にチップとシリンジを垂直に持ち、粉がこぼれないようにします。投与がすぐに行われない場合は、パラフィルムを使用して先端の開口部を密封し、投与するまで適当な状態で一時的に保管する。
2. 挿管装置の製造
- 光源(図2)
- 発光ダイオード(LED)トーチと直径0.8~1mmのフレキシブル光ファイバを使用して、カスタムメイドの光源を用意します。
- LEDトーチのクリアレンズに、光ファイバが通り過ぎるのがやっとになるように、ハンドドリルまたはドリルビットで中央のオリフィスを作ります。
- オリフィスを通して光ファイバを挿入します。LEDトーチのスイッチを入れ、光ファイバのもう一方の端で最大の明るさを得るために、位置と挿入深度を調整します。
- 透明エポキシ接着剤で光ファイバを位置に貼り付ける。
- 導くカニューレ(図3)
- 1 mLプラスチック製のパスツールピペット(図3A)を取り、両端にピペットを持ちなさい。
- アルコールランプ(またはブンゼンバーナーなどの実験室の他の熱源)を使用して、ピペットの真ん中を火炎の上に5〜10cmに置いて加熱する(図3B)。ピペットを回転させて、均一に加熱します。
- プラスチックが柔らかく変形可能になったら、ピペットを炎から離し、ピペットを軽く伸ばします。
- 中央に伸ばしたピペットを、はさみでパートAとパートB(図3C-E)に切ります。細かいチップピペットとしてパーツAを使用し、ガイドカニューレとしてパートBを使用します。導くカニューレで挿管が成功する可能性を高めるために、パートBの終わりにベベル(動物を傷つけやすいリスクを高める可能性のある鋭すぎない)を作ります(図3F)。200 μLのゲルローディングピペットチップ(粉末ローディング用)を導くカニューレに挿入すると、カニューレを1~2mm突き出す必要があります。
注:挿管のための適切な次元(内径および外径)を有する導くカニューレ(パートB)は、17ゲージ針の中に収まる一方で、その中に21ゲージの針を収めることができます。適切な寸法を達成するためにピペットを伸ばすに複数の試みが必要な場合があります。 - (オプション):導くカニューレの広い端にある小さな開口部を切り取り、光ファイバを保持しやすくするために、より柔軟にします(図3F)。この開口部はまた液体エアロゾルの管理のためのマイクロスプレイヤーの付属品を可能にする。
3. 挿管
- 腹腔内注射によりケタミン(100mg/kg)およびキシラジン(10mg/kg)でマウス(BALB/c、7-9週)を麻酔します。
- プレキシガラス製のプラットフォームを準備し、クランプ付きスタンドに取り付けます(図4A)。麻酔マウスをプラットフォーム上(約60°の傾き)に置きます。プラットフォームの高さと傾斜角度は、スタンドのクランプの位置によって調整できます。
- ナイロンフロスに切歯を掛けてマウスを吊り下げます(図4B)。テープまたはゴムバンドでマウスの位置を固定します。
- 誘導カニューレの開口部を持つファイバーレベルの先端を使用して挿管前に誘導カニューレに光ファイバを挿入します。LEDトーチをオンにして点灯します。
- マウスの舌を一対の鉗子で軽く突き出して気管を露出させる。
- もう一方の手を使用して、内部の光ファイバーと導くカニューレを保持します。口腔を通してそれらを挿入します。光ファイバからの照明により、気管の開口部を声帯間のオリフィスとして可視化することができます。
- ガイドカニューレのベベルを開口部の中線に向かって位置合わせします(図5A)。気管開口部でカニューレの最高級先端を狙って、光ファイバーで導くカニューレを気管にそっと挿管します。
- 挿管時に、光ファイバを素早く取り外し、導くカニューレを気管の中に残します(図5B)。正常な呼吸を観察する必要があります。
- 導くカニューレの開口部に細かい先端ピペット(パートA)を持ち、マウスの肺に空気の小さなパフ(約0.2 mL)を注入します。マウスの胸部にわずかなインフレが適切な挿管を示す。粉末投与前に細かいチップピペットを取り除きます。
4. 粉末管理
- ステップ 1.5 で説明したように、シリンジに接続されている粉末のチップを保持します。シリンジとチップの間の気流が切断されていることを確認します。
- 0.6 mLの空気を引き出すために、シリンジプランジャーを後方に引っ張ります。
注:粉末を分散させるために使用される空気の量は、粉末の特性と粉末の積み込みの量に依存します。これは、結果のセクションで詳しく説明します。 - 三方向ストップコックのバルブを回して、シリンジと粉末を積んだ先端の間の気流を接続します。
- 粉末を装填したチップを、マウスの気管に既に入れられていた導きカニューレに挿入します(図5C)。導くカニューレを保持し、肺にエアロゾルとして粉末を分散させる1つの連続的なアクションで注射器プランジャーを強引に押します。
メモ:デバイスの前方運動は、動物が傷つくことを避けるために最小限に抑える必要があります。 - 先端を取り出し、先端の中の粉が空になっているかどうかを確認します。ない場合は、ステップ 4.1 から 4.4 を繰り返します。
メモ:過度のタッピングのために粉末がしっかりと詰め込みすぎると、適切に分散していない可能性があります。 - 投与が完了したら、導くカニューレを気管から取り出します。
- マウスは、気道の封鎖を避けるために、舌を半分突き出した後、縦方向に縦方向に配置して回復させます。
結果
乾燥粉末インスフレーターを使用して動物の肺に粉末エアロゾルを送達する場合、使用される空気の量は、安全性と粉末分散効率に影響を与えるため、非常に重要です。この方法を最適化するために、異なる量の空気(0.3mL、0.6mLおよび1.0mL)を用いて乾燥粉末(1mgの噴霧乾燥マンイトール)を分散させ、マウスの体重を投与後48時間監視した(図6)。0.3 mLおよび0.6 mLの空気の使用は、投与後48時間までのマウスの体重減少を引き起こさなかった。1 mLの空気で粉末を分散させることで、24時間以内の体重減少の5%以上が生じ、48時間後には完全には回収されなかった。このプロトコルでは、7〜9週齢のBALB/cマウスが使用された。動物の種、菌株および年齢、粉末特性(例えば、粒度分布、凝集度および密度)および投与される粉末の質量に応じて、効率的な粉末分散および動物耐性に使用される空気の量は、異なる動物モデルの研究者による最適化を必要とすることがある。
噴霧凍結乾燥(SFD)により調製した乾燥粉末製剤は、上述の方法を用いてマウスに送達した。SFD製剤には、ルシファーゼタンパク質を発現するmRNAの0.5%、送達ベクターとして合成ペプチドの5%、マンリトール16の94.5%を含有した。BALB/cマウスは、5μgのmRNAを含むSFD粉末1mgで気管内投与し、肺におけるルシファーゼ発現をインビボイメージングシステム(IVIS)を用いた投与後24時間で評価した(図7)。SFD粉末を肺深部に分散し、ルシファーゼ発現が観察された。比較として、SFD粉末をPBS(最終容積75μL)で再構成し、同じ挿管手順を有する液体としてマウスに投与したが、代わりにマイクロ噴霧器を用いて液体エアロゾル16を生成した。再構成された製剤のルシファーゼーゼ発現は、乾燥粉末製剤よりも有意に高く、これは粉末と液体形態の間の粉末溶解の問題または異なる薬物動態プロファイルに起因する可能性がある。mRNA乾燥粉末エアロゾルで処理した肺の組織学的特徴を、未処理のコントロールとリポ多糖(LPS)処理群と比較した(図8)。何の治療もしない肺は健全な提示を示し、肺は10μgのLPSで治療し、気管内に空気空間および炎症性細胞浸潤が間質および肺胞空間への不規則な分布を示した。SFD粉末で治療された肺は炎症の徴候を示さなかった。
図1:カスタムメイドのドライパウダーインスフレーター。
(A)粉は先端の狭い端の近くに詰め込まれます。(B)ゲルローディングピペットチップは、3方向のストップコックを介して1mLシリンジに接続されます。この図は遼ら21.この図の大きなバージョンを表示するには、ここをクリックしてください。

図 2: 挿管用のカスタム光源
レンズに小さな穴を開け、LEDトーチに柔軟な光ファイバを接続します。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:導くカニューレ。
(A)1 mLプラスチックパスツールピペットは、導くカニューレを作るために使用されます。(B)ピペットは加熱によって軟化する。(C)加熱されたピペットを伸ばして切る。(D)ピペットのパートAは、細かいピペットとして使用される。(E&F)ピペットのパートBは、導くカニューレとして使用されます。傾斜法を容易にするためにベベルが作成されます。小さな開口部(任意)はカニューレの柔軟性を高めるために作ることができる。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 4: 挿管プラットフォーム
(A) 挿管用プラットフォームは、スタンドに取り付けられたプレキシガラス板から構成されています。(B)麻酔マウスを、ナイロンフロスで切開器を引っ掛けて吊り下げ、supineの位置にプラットフォーム上に置かれる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
図5:挿管手順を示す模式図。
(A)導くカニューレのベベルは気管の開口部の正中線に合わせられる。(B)導くカニューレは気管に挿入され、粉末投与の準備が整う。(C)粉末を装填した先端(三方ストップコックを通して注射器に接続)は、すでにマウスの気管に入っている導くカニューレに挿入される。この図の大きなバージョンを表示するには、ここをクリックしてください。
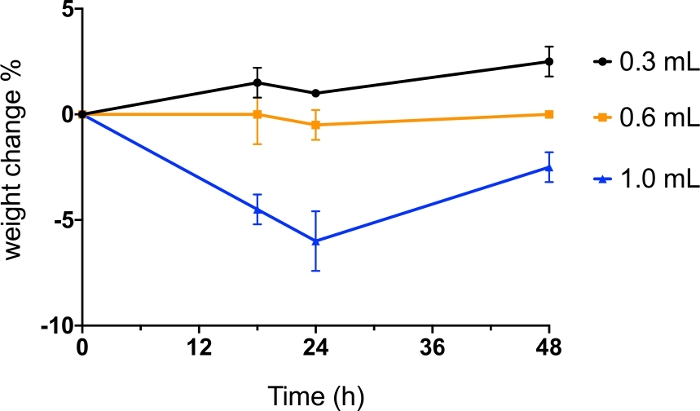
図6:空気の異なる量を有する乾燥粉末の気管内投与。
BALB/cマウスは、0.3mL、0.6mLおよび1.0mLの空気によって分散した噴霧乾燥(SD)マンニトール粉末で気管内投与した。マウスの体重は投与前および投与後18時間、24時間および48時間で監視した。データは、体重変化の割合の平均値として表示されました (n =2)。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図7:乾燥粉末および再構成液エアロゾルとしてのmRNA製剤の気管内投与。
BALB/cマウスは、マイクロスエベヤを用いて、カスタムメイドの乾燥粉末インスフレーターまたは再構成された液体エアロゾル(1mg)を用いて、噴霧凍結乾燥(SFD)0.5%mRNA(ルシファーゼ)製剤を粉末エアロゾル(1mg)で気管内投与した。各マウスは5μgのmRNAの用量を受け取った。PBS(75μL)をコントロールとして使用した。24時間投与後(A)で肺を生物発光イメージングのために単離した。(B)肺組織のルシファーゼタンパク質発現を測定した。データは、タンパク質のmg当たりの相対光単位(RLU)の平均値として表され、一方向ANOVAで分析され、続いてTukeyのポストホックテスト、***p<0.001(n=4)によって分析された。この図は、Qiuら16から適応される。この図の大きなバージョンを表示するには、ここをクリックしてください。
図8:mRNA乾燥粉末製剤の気管内投与後のマウスの肺のヒストロジー。
(A) 未処理のコントロール;マウスを(B)LPS(25μLPBS中10mg)、および(C)スプレー凍結乾燥mRNA粉末(1mg)で気管内投与した。スライドは、20倍の倍率(スケールバー=100mm)で直立した顕微鏡を使用して見た。この図は、Qiuら16から適応される。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本論文では乾燥粉末の浸潤と気管内挿管用のカスタムメイドの装置を紹介する。粉末ローディングステップでは、乾燥粉末を200 μLのゲルローディングピペットチップに積み込みます。先端の狭い端で粉の緩いパッキングを可能にするために、先端を軽くタップすることが重要です。ただし、粉末が固く詰めすぎると、先端に詰まり、適切に分散することはできません。特に低密度で相対湿度の低い粉末に対して、粉末の負荷を容易にするために、粉末とピペットチップの静電荷を中和することをお勧めします。導くカニューレは、デバイスの重要なコンポーネントです。これは、マウスの気管に粉末をロードしたピペットチップの挿管を容易にするために使用されます。導くカニューレの直径は広すぎないようにしてください。そうしないと気管に挿入するのが難しくなり、マウスを傷つける可能性があります。導くカニューレの直径は、光ファイバーと粉末を積んだピペットチップに合うほどの幅にする必要があり、ピペット先端は約1〜2mmの導管を突き出す必要があります。
管切開を可視化する能力は挿管プロセスにおいて非常に重要であり、導くカニューレを正しく挿入することができます。気管の開口部は、喉の後ろに定期的な開閉運動を有する白いアロイテノイド軟骨で構成されています。光ファイバー照明を使用すると、気管の開口部を容易に可視化することができました。細かい先端のプラスチックピペットを通して空気の小さな容積をふくらませることによって、胸部のインフレは適切な挿管を示す。胸部のインフレーションが観察されないか、挿入中に抵抗が感じられる場合は、導くカニューレを素早く引き込み、ステップを再度繰り返します。
広く使用されている市販のドライパウダーインスフレーター12、17、18(材料表;この装置は現在中止されています)。乾燥した粉は装置のサンプルの部屋に荷を積まれ、3 mLプラスチック空気のスポイトまたは空気ポンプからの空気によって分散される。放出された用量を測定するために、デバイスは粉末投与の前後に計量する必要があり、これは粉末の用量を考慮して不正確さをもたらす、通常は非常に小さい(装置の質量に対して)。市販のインスフレーターと比較して、カスタムメイドのデバイスの最大の利点は、透明なゲルローディングピペットチップに粉末がないことで粉末分散の成功を観察できることです。ピペット先端は軽いので、投与前後で正確に秤量して放出された線量を測定することもできる。ピペットチップは、動物の気管にさらされるのではなく、導くカニューレに挿入されます。気管の水分または分泌物で先端を汚染するリスクは最小限です(これは放出された線量測定の精度に影響を与える可能性があります)。ピペットの先端は使い捨てで安価であるように、異なる乾燥粉末製剤は、事前に異なる先端にロードすることができます。さまざまな製剤は、デバイスの洗浄と用量補充を必要とせずに同じ動物実験で評価することができ、それによって時間を節約し、残留粉末からの交差汚染のリスクを排除する。また、市販のインスフレーターによって生成された粉末分散パターンは、異なる製剤間で変化した。多くの研究は、市販のインスフレーターによって分散された乾燥粉末が容易に凝集し、投与19,20で深部肺に到達できなかったことを報告した。対照的に、我々と同様の装置によって分散された他の製剤は、高い肺堆積物15、21、22を有することが報告されている。
動物の肺に粉末エアロゾルを投与するための文献で報告されている他の同様のカスタムメイドのデバイスがあります。例えば、Chaurasiyaらは、粉末負荷と同様に挿管用カニューレチューブの使用を説明し、粉末分散液23の挿管後にカニューレチューブに接続された注射器を用いた。彼らのアプローチは、標準化された機器や材料(例えば、otoscope、カニューレ、注射器)を使用して、より少ないカスタマイズを使用するが、ここでの方法は、いくつかの明確な利点を提供しています。まず、薬物投与前に正しい挿管の確認が可能です。この手順は、経験の浅いユーザーにとって特に役立ちます。第二に、導くカニューレは、気管内の分泌や水分がゲル負荷ピペット先端を汚染するのを防ぐための保護シールドとして機能し、計量によってより正確に放出された用量測定を可能にする。最後に、より柔軟な導管を光ファイバと共に使用すると、容易な挿管が可能になる可能性があります。
要約すると、少量の粉末を正確に分散させる際に、安価で使い捨て可能で効率的なカスタムメイドのドライパウダーインスフレーターが紹介されています。記載された挿管プロセスは、非侵襲的で迅速であり、安全かつ正確にマウスに粉末製剤を送達することができる。また、肺分娩のための液体製剤を投与するために採用することができる。
開示事項
著者らは開示する利益相反を持っていません。
謝辞
著者らは、レイ・リー氏、HCリョン氏、ウォレス氏に対し、光源と粉末のインスフレーターを作る際の親切な支援に感謝したいと考えている。動物イメージングの支援のための教員コア施設。研究助成金協議会(17300319)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| BALB/c mouse | Female; 7-9 weeks old; Body weight 20-25 g | ||
| CleanCap Firefly Luciferase mRNA | TriLink Biotechnology | L-7602 | |
| Dry Powder Insufflator | PennCentury | Model DP-4M | |
| Ketamine 10% | Alfasan International B.V. | NA | |
| Light emitting diode (LED) torch | Unilite Internation | PS-K1 | |
| Mannitol (Pearlitol 160C) | Roquette | 450001 | |
| Non-filter round gel loading pipette tip (200 µL) | Labcon | 1034-800-000 | |
| Nylon floss | Reach | 30017050 | |
| One milliliter syringe without needle | Terumo | SS-01T | |
| Optical fibre | Fibre Data | OMPF1000 | |
| PEG12KL4 peptide | EZ Biolab | (PEG12)-KLLLLKLLLLKLLLLKLLLLK-NH2 | |
| Plastic Pasteur fine tip pipette | Alpha Labotatories | LW4061 | |
| Three-way stopcock | Braun | D201 | |
| Xylazine 2% | Alfasan International B.V. | NA | |
| Zerostat 3 anti-static gun | MILTY | 5036694022153 |
参考文献
- Newman, S. P. Drug delivery to the lungs: challenges and opportunities. Therapeutic Delivery. 8 (8), 647-661 (2017).
- Setter, S. M., et al. Inhaled dry powder insulin for the treatment of diabetes mellitus. Clinical Therapeutics. 29 (5), 795-813 (2007).
- Muralidharan, P., Hayes, D., Mansour, H. M. Dry powder inhalers in COPD, lung inflammation and pulmonary infections. Expert Opinion on Drug Delivery. 12 (6), 947-962 (2015).
- de Boer, A. H., et al. Dry powder inhalation: past, present and future. Expert Opinion on Drug Delivery. 14 (4), 499-512 (2017).
- Das, S., Tucker, I., Stewart, P. Inhaled dry powder formulations for treating tuberculosis. Current Drug Delivery. 12 (1), 26-39 (2015).
- Okamoto, H., et al. Stability of chitosan-pDNA complex powder prepared by supercritical carbon dioxide process. International Journal of Pharmaceutics. 290 (1-2), 73-81 (2005).
- He, J., et al. Evaluation of inhaled recombinant human insulin dry powders: pharmacokinetics, pharmacodynamics and 14-day inhalation. Journal of Pharmacy and Pharmacology. 71 (2), 176-184 (2019).
- Durham, P. G., Young, E. F., Braunstein, M. S., Welch, J. T., Hickey, A. J. A dry powder combination of pyrazinoic acid and its n-propyl ester for aerosol administration to animals. International Journal of Pharmaceutics. 514 (2), 384-391 (2016).
- Phillips, J. E., Zhang, X., Johnston, J. A. Dry powder and nebulized aerosol inhalation of pharmaceuticals delivered to mice using a nose-only exposure system. JoVE (Journal of Visualized Experiments). (122), e55454(2017).
- Nahar, K., et al. In vitro, in vivo and ex vivo models for studying particle deposition and drug absorption of inhaled pharmaceuticals). European Journal of Pharmaceutical Sciences. 49 (5), 805-818 (2013).
- Price, D. N., Muttil, P. Delivery of Therapeutics to the Lung. Methods in Molecular Biology. 1809, 415-429 (2018).
- Chang, R. Y. K., et al. Proof-of-Principle Study in a Murine Lung Infection Model of Antipseudomonal Activity of Phage PEV20 in a Dry-Powder Formulation. Antimicrobial Agents and Chemotherapy. 62 (2), (2018).
- Ito, T., Okuda, T., Takayama, R., Okamoto, H. Establishment of an Evaluation Method for Gene Silencing by Serial Pulmonary Administration of siRNA and pDNA Powders: Naked siRNA Inhalation Powder Suppresses Luciferase Gene Expression in the Lung. Journal of pharmaceutical sciences. 108 (8), 2661-2667 (2019).
- Patil, J. S., Sarasija, S. Pulmonary drug delivery strategies: A concise, systematic review. Lung India. 29 (1), 44-49 (2012).
- Ihara, D., et al. Histological Quantification of Gene Silencing by Intratracheal Administration of Dry Powdered Small-Interfering RNA/Chitosan Complexes in the Murine Lung. Pharmaceutical Research. 32 (12), 3877-3885 (2015).
- Qiu, Y., et al. Effective mRNA pulmonary delivery by dry powder formulation of PEGylated synthetic KL4 peptide. Journal of Controlled Release. 314, 102-115 (2019).
- Pfeifer, C., et al. Dry powder aerosols of polyethylenimine (PEI)-based gene vectors mediate efficient gene delivery to the lung. Journal of Controlled Release. 154 (1), 69-76 (2011).
- Kim, I., et al. Doxorubicin-loaded highly porous large PLGA microparticles as a sustained- release inhalation system for the treatment of metastatic lung cancer. Biomaterials. 33 (22), 5574-5583 (2012).
- Tonnis, W. F., et al. A novel aerosol generator for homogenous distribution of powder over the lungs after pulmonary administration to small laboratory animals. European Journal of Pharmaceutics and Biopharmaceutics. 88 (3), 1056-1063 (2014).
- Hoppentocht, M., Hoste, C., Hagedoorn, P., Frijlink, H. W., de Boer, A. H. In vitro evaluation of the DP-4M PennCentury insufflator. European Journal of Pharmaceutics and Biopharmaceutics. 88 (1), 153-159 (2014).
- Liao, Q., et al. Porous and highly dispersible voriconazole dry powders produced by spray freeze drying for pulmonary delivery with efficient lung deposition. International Journal of Pharmaceutics. 560, 144-154 (2019).
- Ito, T., Okuda, T., Takashima, Y., Okamoto, H. Naked pDNA Inhalation Powder Composed of Hyaluronic Acid Exhibits High Gene Expression in the Lungs. Molecular Pharmaceutics. 16 (2), 489-497 (2019).
- Chaurasiya, B., Zhou, M., Tu, J., Sun, C. Design and validation of a simple device for insufflation of dry powders in a mice model. European Journal of Pharmaceutical Sciences. 123, 495-501 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved