Method Article
Um ensaio automatizado de coloração nuclear diferencial para determinação precisa da citotoxicidade mitocana
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O protocolo descreve um ensaio rápido, de alto rendimento, confiável, barato e imparcial para determinar eficientemente a viabilidade celular. Este ensaio é particularmente útil quando as mitocôndrias das células foram danificadas, o que interfere com outros ensaios. O ensaio utiliza a contagem automatizada de células manchadas com dois corantes nucleares – Hoechst 33342 e iodeto de propidium.
Resumo
A contribuição das mitocôndrias para a transformação oncogênica é um assunto de amplo interesse e estudo ativo. À medida que o campo do metabolismo do câncer se torna mais complexo, o objetivo de atingir mitocôndrias usando vários compostos que infligem danos mitocondriais (os chamados mitocanos) está se tornando bastante popular. Infelizmente, muitos ensaios de citotoxicidade existentes, como aqueles baseados em sais de tetrazolium ou resazurina, requerem enzimas mitocondriais funcionais para seu desempenho. O dano infligido por compostos que atingem mitocôndrias muitas vezes compromete a precisão desses ensaios. Aqui, descrevemos um protocolo modificado baseado em coloração diferencial com dois corantes fluorescentes, um deles é permeante celular (Hoechst 33342) e o outro não é (iodeto de propidium). A diferença na coloração permite que células vivas e mortas sejam discriminadas. O ensaio é amenável à microscopia automatizada e à análise de imagens, o que aumenta o throughput e reduz o viés. Isso também permite que o ensaio seja usado de forma de alta produtividade usando placas de 96 poços, tornando-se uma opção viável para os esforços de descoberta de drogas, particularmente quando as drogas em questão têm algum nível de mitotoxicidade. É importante ressaltar que os resultados obtidos pelo ensaio de coloração de Hoechst/PI mostram maior consistência, tanto com resultados de exclusão azul trypan quanto entre réplicas biológicas quando o ensaio é comparado a outros métodos.
Introdução
O primeiro passo para identificar tratamentos eficazes contra o câncer é a seleção de um robusto e imparcial ensaio de citotoxicidade que pode ser usado para examinar o efeito do tratamento. Uma escolha comum para experimentos de baixo rendimento é a exclusão do corante azul trypan das células vivas. Este método é favorecido porque permite um método relativamente imparcial para quantificar a sobrevivência celular. trypan azul passivamente difunde em células cujas membranas estão comprometidas, mas é efetivamente impedido de entrar em células saudáveis1. O quociente das células vivas e do total das células representa a viabilidade percentual, o que indica a eficácia do tratamento. A desvantagem mais significativa do ensaio azul trypan é que ele é mal adequado para metodologias de alta produtividade. Tem uma relação sinal-ruído relativamente baixa e a coloração prolongada pode resultar em artefatos devido à coloração de células viáveis. Consequentemente, a exclusão azul trypan é tipicamente, mas nem sempre2, relegada à contagem manual. Isso o torna muito lento e introduz a forte possibilidade de viés devido ao julgamento subjetivo do pesquisador (a menos que sejam utilizadas contagens cegas ou independentes, o que reduz ainda mais o rendimento laboratorial). Em geral, o rendimento deste ensaio é insuficiente para a descoberta moderna de drogas.
Os ensaios de viabilidade, que geralmente têm um rendimento muito maior, permitem que os pesquisadores contornem essa limitação, mas vêm com ressalvas significativas (ver Tabela 1). Esses métodos geralmente se enquadram em dois grupos. Um grupo é composto por ensaios colorimétricos que são baseados na função das enzimas de redox celular. Substratos incolores ou não fluorescentes são convertidos em produtos vibrantes que podem ser quantificados usando um espectrofotômetro. Exemplos clássicos incluem sais de tetrazolium (MTT, WST-1, XTT, etc.) e resazurina. Esta categoria também inclui ensaios luminescentes que utilizam luciferina para avaliar o nível ATP. Ensaios deste tipo têm a limitação subjacente de que eles estão medindo o metabolismo celular, que não é a viabilidade celular em si. É bastante comum que as células se tornem quiescentes em condições adversas, mas ainda mantêm a capacidade de dividir3,4,5. Por exemplo, as células-tronco cancerígenas são muitas vezes relativamente metabolicamente quiescentes6,7,8,9, e são susceptíveis de ser difíceis de avaliar usando essas técnicas. A eficácia de tratamentos que prejudicam a função mitocondrial, como a maioria dos mitocanos, também é provável que seja significativamente superestimada.
Uma metodologia alternativa aproveita as propriedades químicas de várias substâncias que lhes permitem atravessar ou não membranas biológicas. Um exemplo são manchas nucleares como SYTOX ou propidium iodide (PI). Esta categoria também inclui ensaios semelhantes no conceito, mas diferentes em função, como o ensaio lactato desidrogenase (LDH), que mede a liberação de LDH no meio extracelular como um indicador de necrose celular(Figura 1,Tabela 1). Estes ensaios são mais capazes de distinguir entre células metabolicamente inativas e mortas.
| Ensaio/corante | Tipos(s) de morte celular detectada | Equipamento necessário | Principais características |
| MTT, CKK-8, Alamar Blue (resazurin) | Apoptose/Necrose | Espectrofotômetro | Barato, rápido; ensaio de ponto final; dependente da atividade das enzimas (exclusivamente mitocondrial no caso de MTT) e não discrimina entre modos de morte celular1,10 |
| Lançamento do LDH | Necrose | Espectrofotômetro | Rápido, independente da atividade das enzimas mitocondriais; caro para testes de alto rendimento; detecta células necróticas com membrana plasmática compromizada11,12 |
| Trypan Blue (TB) | Apoptose/Necrose | Microscópio | Célula-impermeável; não discrimina entre modos de morte celular; laborous e não é adequado para triagem de alto rendimento; mais difícil de usar com células aderentes; propenso a julgamento subjetivo do usuário, mas é considerado o método padrão de medição de viabilidade celular13 |
| Laranja acridina (AO) | Apoptose/Necrose/ | Microscópio de fluorescência | Um corante de ácido nucleico com propriedades espectrais únicas, pode distinguir entre apoptose e necrose/necroptose14 |
| Necroptose | |||
| Hoechst 33342, DAPI | Apoptose | Microscópio de fluorescência ou citômetro de fluxo | Célula permeável; inapropriado por si só para monitorar a morte celular; útil para a co-coloração; podem ser utilizados para avaliar a condensação da cromatina e a fragmentação dos núcleos na apoptose precoce; pode ser emparelhado com iodeto propidium para distinguir apoptose da necrose15,16 |
| Iodeto de propidium (PI) | Apoptose tardia/Necrose | Microscópio de fluorescência ou citômetro de fluxo | Intercalador de células impermeável; detecta os modos de apoptose tardia e necrose da mortecelular 17. Tóxico e permeável após longos tempos de incubação18 |
Mesa 1. Lista de ensaios de citotoxicidade. Ensaios de citotoxicidade, alguns dos quais foram utilizados neste estudo, listados juntamente com a breve descrição de suas principais características.
Estudos recentes demonstraram que o metabolismo mitocondrial é alterado em alguns cânceres19,20,21,22,23,24,25. Por exemplo, leucemias mielóides agudas (LMA) têm sido mostradas para aumentar sua massa mitocondrial, conteúdo mtDNA e respiração mitocondrial para atender às suas demandas energéticas19,26,27. Por outro lado, alguns tumores sólidos são caracterizados por disfunção mitocondrial, ou melhor, "reprogramação metabólica", como a redução da regulação de proteínas mitocondriais envolvidas no OXPHOS ou diminuição do teor de MTDNA, que tem sido associada à invasão tumoral, potencial metastático e resistência a medicamentos indutores de apoptose28,29. Além disso, recentemente, houve um aumento do interesse em usar compostos mecanicamente diversos que afetam a função mitocondrial (geralmente chamadas mitocans30), como terapias potenciais para determinados cânceres. Essas drogas têm como alvo a síntese ATP, DNA mitocondrial, OXPHOS e produção ros, bem como proteínas pró-apoptóticas e anti-apoptóticas associadas às mitocôndrias30,31. Vários estudos têm demonstrado que essa abordagem tem uma promessa significativa19,32,33,34. No entanto, esses desvios metabólicos na biologia celular do câncer ou tratamentos direcionados a mitocôndrias podem afetar significativamente ensaios de viabilidade convencional que são baseados na funcionalidade mitocondrial.
Aqui, é descrito um protocolo otimizado para um ensaio diferenciado de coloração nuclear. O protocolo permite uma determinação rápida e precisa da citotoxicidade das mitocanas ou suas combinações com outros compostos. Hoechst 33342 é um corante nuclear permeante celular que prontamente cruza as membranas celulares para manchar o DNA, permitindo que a contagem total de células seja obtida. Ao co-coloração com PI, que só entra nos núcleos de células mortas, a proporção de células vivas (somente hoechst) e mortas (manchadas com ambas) podem ser determinadas com precisão. Este protocolo refina o ensaio publicado35 adicionando um passo para a otimização da concentração de corante (cruzando resultados com método azul de trippan ortogonal) e centrifugação da placa antes da imagem. Como muitas linhas celulares são semi-aderentes ou suspensas, a centrifugação aumenta a proporção de células que são imagens e melhora fortemente a precisão. O ensaio tem várias vantagens, incluindo que a coloração não requer remoção de mídia ou lavagem. A mistura de corante também é barata, fácil de preparar e compatível com sistemas multicanais/robóticos de tubulação.
Depois que as células foram manchadas, elas são imagens com um microscópio automatizado. Isso tem a vantagem adicional de criar um registro permanente das imagens que podem ser re-analisadas posteriormente e os efeitos de determinados compostos podem ser reavaliados por inspeção visual de imagens capturadas. Uma vez obtidas imagens, as células podem ser contadas manualmente ou usando qualquer um dos vários pacotes de software, incluindo tanto gratuitos (por exemplo, ImageJ, CellProfiler, etc) quanto software comercial (por exemplo, Metamorfo, Gen5, etc). A contagem automatizada de células é geralmente preferível, uma vez que os pipelines automatizados de contagem de células desenvolvidos adequadamente são mais precisos e menos tendenciosos do que as contagens manuais. Eles também desconsideram mais efetivamente detritos celulares ou complexos insolúveis. O desenvolvimento desses gasodutos é geralmente simples e é simplificado pela eficiência das manchas utilizadas. A saída é quantitativa, uma vez que o número real de células mortas é calculado automaticamente em relação ao número total da célula, e diferentes limiares podem ser aplicados para aumentar ou diminuir a stringency da detecção35. Para conveniência, parâmetros otimizados para contar células usando o software Gen5 v. 3.00 compatível com software Cytation 5 Cell Imaging Multi-Mode Reader estão incluídos.
Protocolo
1. Ensaio de Citotoxicidade: Configuração
- Preparar soluções de compostos de interesse em concentrações desejadas nos meios de comunicação apropriados (sem soro ou 1, 2,5 ou 5% FBS RPMI-1640).
- Para medir a citotoxicidade de um único composto (por exemplo, para determinar doses eficazes), prepare os compostos em 2x concentração final.
- Para medir a citotoxicidade das combinações compostas, prepare os compostos em 4x concentração final.
- Prepare controles somente de solventes misturando a mesma quantidade de solvente com o meio apropriado. Por exemplo, se os compostos de teste dissolvidos em DMSO e metanol, faça um controle somente de solvente para cada solvente.
- Coletar células de prato de cultura ou frasco em um tubo cônico de 15 mL.
- Transfira 10 μL de suspensão celular para um tubo de microcentrifutura e colora com 10 μL 0,4% azul trypan. Use um hemótmetro para contar células viáveis e inviáveis para cada fonte celular.
- Células de pelotas a 200 g por 5 min. Aspirado ou decantante.
- Pelota de célula resuspenda em mídia apropriada para ensaios (sem soro ou 1, 2,5, 5% FBS RPMI-1640) a uma densidade celular de 3*105 células/mL.
NOTA 1: A densidade celular de 3*105 células/mL fornece uma densidade de semeadura de 15.000 células/bem. A densidade de semeadura é um parâmetro importante e, idealmente, deve ser pré-definida antes do experimento. A densidade de semeadura deve levar em conta o tamanho das células 1 – geralmente as células maiores são semeadas a uma densidade menor; 2) duração do tratamento – as células são tipicamente semeadas em menor densidade para experimentos que durarão mais; e 3) taxa de divisão celular – as células com maior taxa de divisão são semeadas a uma densidade menor. Exemplos específicos de densidades otimizadas de semeadura: células K562, maiores, 24h de duração – 10.000 células/poço; Células MOLM-13, tamanho moderado, tratamento de 24h – 15.000/bem; Células MOLM-13, tratamento de 48h – 8.000/poço; pequenas células mononucleares periféricas saudáveis (PBMCs), tratamento de 24h – 50.000/bem; células LMA primárias, tratamento de 24 h – 15.000-20.000/bem.
NOTA 2: A presença de FBS na mídia pode afetar a atividade dos compostos. Reduzir a concentração de FBS pode tornar os resultados de ensaio mais simples de interpretar, mas também reduz a precisão fisiológica. - Semente 50 μL de suspensão celular a partir da etapa 1.5 em cada poço de uma placa de 96 poços usando uma pipeta multicanal.
- Adicione compostos da seguinte forma:
- Para ensaios compostos únicos, adicione 50 μL de solução composta de 2x em cada poço. Para poços de controle de solventes, adicione 50 μL de mídia de teste contendo o solvente na concentração de 2x.
- Para ensaios de combinação, adicione 25 μL de cada um dos compostos (soluções 4x) em cada poço. Para poços de controle composto único, adicione 25 μL de solução composta 4x e 25 μL de meio de teste. Para poços de controle de solventes, adicione 50 μL de meio de teste ou meio de teste contendo o solvente.
NOTA 1: A concentração final do DMSO não deve exceder 0,5%.
NOTA 2: Recomenda-se adicionar a mídia que contém os compostos com a pipeta tocando a parede de cada poço devido ao baixo volume.
- Bata suavemente na placa para garantir a mistura do conteúdo dos poços.
- Incubar placas a 37 °C em uma atmosfera umidificada de 5% de CO2 por um tempo adequado, por exemplo, 24 h.
2. Ensaio de Citotoxicidade: coloração com Hoechst 33342 e iodeto de propidium
- Prepare a solução de coloração 10x. Esta solução precisa ser preparada fresca antes de cada experimento, não pode ser armazenada. As concentrações finais de corante devem ser determinadas antes do experimento.
- Para linhas celulares de leucemia e células primárias de leucemia, 1 mL de tampão de coloração de 10x contém 10 μL de 20 mM Hoechst 33342 e 50 μL de 1 mg/mL propidium iodida em PBS estéril (concentrações finais: Hoechst 33342 20 μM, PI 5 μg/mL).
- Para PBMCs saudáveis, 1 mL de tampão de coloração de 10x contém 10 μL de 20 mM Hoechst 33342 e 10 μL de 1 mg/mL de iodeto de propidium em PBS estéril (concentrações finais: Hoechst 33342 20 μM, PI 1 μg/mL).
NOTA: A concentração final de iodeto de propídio deve ser determinada antes dos experimentos. As células devem ser testadas usando uma gama de concentrações de PI (1, 2,5, 5 μg/mL), e então a viabilidade calculada por Hoechst/PI deve ser comparada com a viabilidade medida via azul trypan. As concentrações de PI listadas acima foram escolhidas com base na viabilidade celular-alvo em poços de controle de mídia (acima de ~90% para linhas celulares de leucemia, acima de ~70% para PBMCs saudáveis).
ATENÇÃO: Hoechst 33342 e iodeto de propidium são potenciais cancerígenos. Use equipamentos de proteção individual adequados ao manuseá-los.
- Após a incubação, use uma pipeta multicanal para adicionar 10 μL de tampão de coloração de 10x a cada poço.
NOTA: Para evitar contaminação cruzada, certifique-se de que as pontas da pipeta não toquem na mídia. - Bata suavemente na placa para misturar e limpar bolhas. Mancha a 37 °C por 15 min.
- Centrifugar a placa a 200 g por 4 minutos para trazer todas as células para o fundo da placa. Limpe cuidadosamente a parte inferior da placa com um kimwipe úmido para remover fibras e/ou detritos que interferirão com a imagem.
NOTA 1: A centrifugação da placa garante as maiores chances de todas as células serem capturadas na imagem. Muitas vezes as células mortas se desprendem e flutuam, fornecendo valores enganosos de citotoxicidade. A centrifugação atenua esse efeito.
NOTA 2: A placa deve ser imageda o mais rápido possível após a centrifugação, idealmente, dentro de 15 minutos. A centrifugação pode reduzir a seletividade da coloração de PI e pode permitir que as células acumulem lentamente iodeto de propídio. A melhora na precisão obtida pela visualização das células mortas supera o ligeiro aumento na coloração de PI. Recomenda-se terminar a imagem dentro de 1 h de centrifugação.
3. Ensaio de Citotoxicidade: aquisição de dados
- Defina o software para o microscópio/imager automatizado de placas para detectar fluorescência tanto para Hoechst 33342 (máximo de excitação de 350 nm, emissão máxima de 461 nm) quanto PI (máximo de excitação de 493 nm, emissão máxima de 636 nm). Adquira imagens para cada poço em ambos os canais.
- Usando o software (como o CellProfiler, um estúdio gratuito de análise de imagens baseado em matlab http://cellprofiler.org/, ImageJ ou software proprietário, como o Gen5) conta as células em cada poço em cada canal.
NOTA: Como todas as células devem ser manchadas com Hoechst 33342, e as células mortas devem ser manchadas com PI, a proporção de mortos para todos representa a fração de células que estão mortas. Por exemplo, se a contagem automatizada em amostras não tratadas mostrar 467 células manchadas com PI (células mortas) e 2335 células manchadas com Hoechst 33342 (células totais), a fração morta é de 0,2 ou 20%. Este valor é então comparado a uma amostra manipulada de forma idêntica onde o tratamento foi utilizado. - Descrição detalhada da aquisição de dados da Hoechst/PI usando o cytation5 Cell Imaging Multi-Mode Reader e o software Gen5 v. 3.00:
- Defina o leitor/imager de placa multimoda Cytation5 para células de imagem em fundo plano, placas de plástico preto genérica de 96 poços.
- Defina um protocolo de imagem para utilizar os conjuntos de filtros DAPI e Texas Red padrão. Faça imagens no centro do poço usando um objetivo de ampliação 4x. Não use compensação (X/Y ou Z). Use as seguintes configurações de imagem: DAPI – LED - 10, tempo de integração - 99, ganho – 0; Texas Red – LED - 8, tempo de integração - 950, ganho - 18. Realizar o foco automático usando o sinal DAPI; não deve haver compensação no foco entre os canais.
- Realize a análise de imagens usando o software Gen5 v 3.00. Nas configurações do software, defina as células como formas entre 5 e 25 μm em seu tamanho. Exclua objetos de borda primária e divida objetos tocando, ligando a opção especial "Divida objetos de toque". Em seguida, processe a imagem para remover o fundo (subtração de fundo escuro), aplique uma máscara nuclear (valor limiar DAPI >= 6000 UA) e conte objetos. Realize uma análise de subpopulação baseada na coloração de PI (valor limiar Texas Red >= 5000 UA) e conte objetos. A viabilidade celular % é definida como (1 -
 .
.
Resultados
O protocolo supracitado foi desenvolvido utilizando células OCI-AML2, que foram tomadas como uma linha celular representativa de leucemia mielóide aguda. A LMA é caracterizada pela proliferação anormal de células hematopoiéticas indiferenciadas e não funcionais na medula óssea26. Apesar dos recentes desenvolvimentos na terapia-alvo da LMA, o padrão de cuidado permaneceu inalterado por várias décadas, e consiste em terapia de indução (tipicamente composta por três dias de antreracyclina, por exemplo, daunorubicina, idarubicina ou antrazanthrone anthracenedione, e 7 dias de cytarabina) seguida de consolidação (tipicamente composta por rodadas de tratamento de cicloabina seguidos por períodos derecuperação) 36.
Seguindo o protocolo descrito na Figura 1A, as células OCI-AML2 foram semeadas em placas de 96 poços e tratadas com o cianeto carbonilto desacoplador mitocondrial m-hidrazil (CCCP) ou o inibidor glicolítico 2-deoxy-D-glicose (2-DG) em uma série de concentrações. As células foram tratadas por 24 h a 37 °C em mídia RPMI-1640 sem soro e, em seguida, a viabilidade foi avaliada usando a exclusão azul trypan (TB) ou um dos quatro ensaios de viabilidade (mancha nuclear diferencial Hoechst/PI, ensaio de liberação LDH, MTT ou alamarBlue). Imagens representativas de células manchadas com Hoechst/PI são mostradas na Figura 2A. Várias observações importantes podem ser feitas imediatamente. Primeiro, o número total de células (coloração de Hoechst) é razoavelmente alto e é significativamente maior do que o número de células mortas (mancha de PI). Isso sugere que as condições da mídia não estão desencadeando altas taxas de morte celular. Em segundo lugar, uma vez que apenas as células que estão sendo rotuladas com Hoechst e PI são contadas como mortas (células roxas na imagem mesclada), a probabilidade de contar detritos é muito baixa. Esta imagem mostra um bom exemplo de células devidamente manchadas.
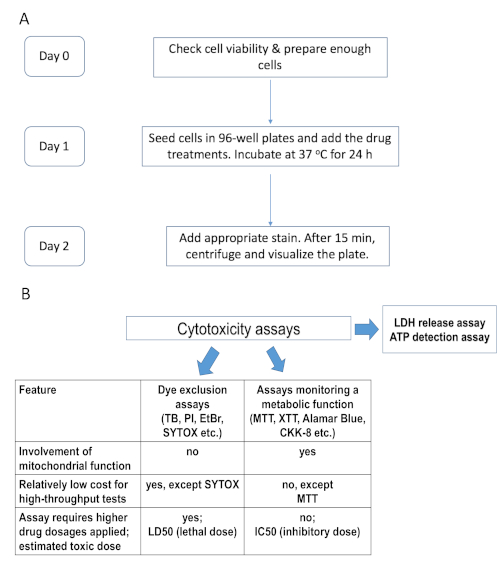
Figura 1. Cronograma experimental e comparação dos ensaios de citotoxicidade existentes. (A) Fluxograma resumindo a linha do tempo para o procedimento experimental, por exemplo, coloração hoechst/pi. (B) Comparação dos ensaios de citotoxicidade, alguns dos quais foram utilizados neste estudo. Os ensaios de exclusão de corantes envolvem corantes nucleares impermeáveis que mancham células mortas com membrana plasmática comprometida: TB – azul trypan, PI – iodeto de propidium, EtBr – brometo de ethidium e SYTOX. O segundo grupo de ensaios depende do metabolismo celular, por exemplo, os sais de tetrazolium MTT, XTT e CKK-8 (WST-8), reagente à base de resazurina alamarBlue, etc. Por favor clique aqui para ver uma versão maior desta figura.
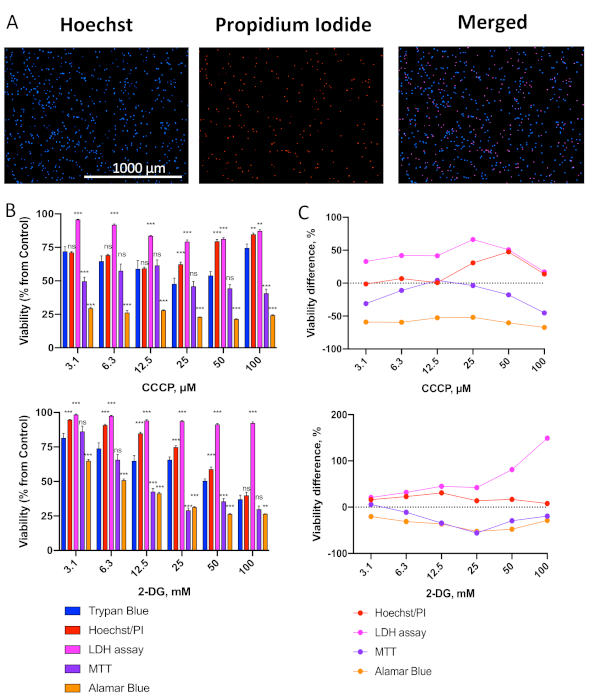
Figura 2. Comparação de um painel de ensaios de citotoxicidade com exclusão azul trypan. (A) Imagens representativas do total (Hoechst 33342) e mortas (iodeto de propídio, PI) Células OCI-AML2 via coloração Hoechst/PI. (B) Avaliação da viabilidade das células OCI-AML2 utilizando diferentes métodos após o tratamento com um gradiente de concentrações CCCP(superior) ou 2-DG(inferior). OCI-AML2 foram tratados com CCCP ou 2-DG em RPMI-1640 sem soro por 24 h antes da determinação da viabilidade celular. Mostradas é média, as barras de erro representam SEM. C. Diferença na viabilidade celular entre ensaios de citotoxicidade em (B) vs. coloração azul trypan (ver Tabelas Suplementares S1-2 para os números exatos e diferença mediana). As estrelas indicam diferença significativa vs. coloração azul trypan. ** p < 0,01, *** p < 0,001, ns – não significativo. A comparação em grupo foi feita via t-testcom correção para testes de hipóteses múltiplas. Foram realizadas três réplicas biológicas independentes. Clique aqui para ver uma versão maior desta figura.
Como relatamos recentemente19,as leucemias são muito sensíveis aos tratamentos mitotóxicos, o que indica que as células já têm danos mitocondriais subjacentes. Com base nisso, prevemos que os ensaios MTT e alamarBlue, que são baseados na atividade enzimária mitocondrial, mediriam imprecisamente a viabilidade celular. Como esperado, esses ensaios (especialmente alamarBlue) apresentaram viabilidade significativamente menor em comparação com a exclusão azul trypan, ver Figura 2B,C, Tabelas Suplementares S1-S2). Isso é consistente com o fato de que as doses desses compostos necessários para induzir apoptose ou necrose são maiores do que as necessárias para comprometer a função mitocondrial.
Entre os ensaios testados, a coloração dupla com Hoechst 33342 e PI apresentou a melhor combinação de robustez, sensibilidade e consistência com coloração de TB, com o menor desvio mediano do método de exclusão da TB após o tratamento CCCP ou 2-DG(Tabelas Suplementares S1-2). Curiosamente, em doses mais elevadas de CCCP (50 e 100 μM) a viabilidade estimada com Hoechst/PI ou TB foi aumentada em comparação com doses mais baixas(Figura 2B, topo). Isso é provável devido à precipitação de CCCP em doses mais altas devido à sua hidroofobidade, reduzindo sua concentração e impacto efetivos nas células. O aumento da dose de CCCP reduziu ainda mais a viabilidade média estimada de Hoechst/PI das células OCI-AML2, no entanto: 74% a 150 μM, 62% a 200 μM, 6% a 300 μM(dados não mostrados).
O ensaio hoechst/pi também foi eficaz na determinação da viabilidade celular após o tratamento com outras moléculas alvo de mitocôndrias. Estes incluíam rotenona, um veneno que compromete o Complexo I da cadeia de transporte de elétrons mitocondrial37, e 3-bromopyruvate, um inibidor glicóltico e agente alquilante que prejudica a respiração mitocondrial e o metabolismo mitocondrial38 (Figura 3A-D, Tabelas Suplementares S3-4).
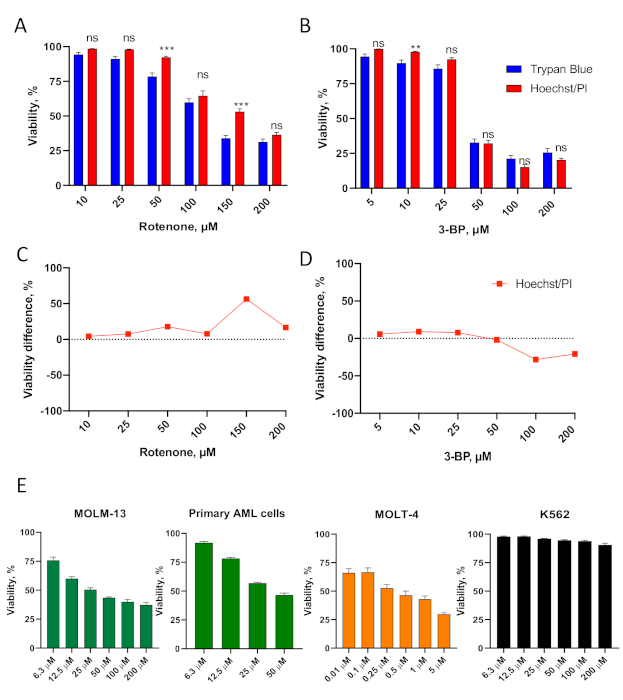
Figura 3. Validação do ensaio de citotoxicidade hoechst/PI em células de leucemia. (A,B) As células OCI-AML2 (AML) foram tratadas com diferentes concentrações de rotenona(A) ou 3-bromopyruvate, 3-BP (B) em mídia RPMI-1640 sem soro por 24 horas, então a viabilidade foi determinada. Mostrado é média com SEM. (C,D) Comparação da diferença de viabilidade entre ensaio hoechst/PI vs. coloração azul trypan (para as células em A-B, ver Tabelas Suplementares S3-4 para quantitação). As estrelas indicam significância estatística vs. coloração azul trypan. ** p < 0,01, *** p < 0,001, ns – não significativo. A comparação em grupo foi feita via t-testcom correção para testes de hipóteses múltiplas. E. MOLM-13 (LMA), células primárias de LMA isoladas de um paciente, MOLT-4 (ALL) e células K562 (CML) foram tratadas com as concentrações indicadas de rotenona em mídia RPMI-1640 sem soro por 24 h, antes da determinação de viabilidade usando a coloração hoechst/pi. Mostrado é maldade com SEM. Foram realizadas três réplicas biológicas independentes. Clique aqui para ver uma versão maior desta figura.
O ensaio de citotoxicidade Hoechst/PI foi validado ainda mais usando um painel de linhas celulares de leucemia representando vários tipos de leucemia, bem como células primárias. Eles incluíram MOLM-13 (uma linha celular AML), células LMA primárias derivadas de uma amostra representativa do paciente, MOLT-4 (uma linha celular de leucemia linfoblástica aguda, ALL) e K562 (uma linha celular de leucemia mielogenosa crônica, CML) (Figura 3E, Figura Suplementar S1). Os resultados do ensaio hoechst/pi mostraram que essas células apresentavam profundas diferenças na sensibilidade da rotenona, variando de células muito sensíveis (MOLT-4) a resistentes (K562).
Para demonstrar a robustez do ensaio, as células OCI-AML2 foram tratadas com um gradiente de concentração de 3-bromopyruvate, conforme descrito no protocolo acima. As contagens celulares foram coletadas para 6 poços em cada concentração e são mostradas(Figura 4A,B). Essas contagens foram utilizadas para calcular a viabilidade, e mostraram que apenas 4 poços foram suficientes para capturar com precisão o resultado do ensaio(Figura 4C). A curva dose-resposta resultante é mostrada(Figura 4D).

Figura 4. Reprodutibilidade da coloração de Hoechst/PI. Viabilidade de células OCI-AML2 após 24h de tratamento com diferentes concentrações de 3-bromopyruvate (3-BP). (A) Número total de células contadas através de manchas hoechst 33342, (B) Número de células mortas contadas através da coloração de iodeto de propídio. (C) Viabilidade (%) calculado utilizando(A-B). (D) Gráfico de dose-resposta representativo. Mostrado é maldade com SEM. Foram realizadas três réplicas biológicas independentes. Clique aqui para ver uma versão maior desta figura.
Embora o ensaio seja relativamente robusto, ainda deve ser tomado cuidado. O desempenho inadequado do ensaio pode comprometer sua precisão. Vários desfechos comprometidos são mostrados para fins de solução de problemas(Figura 5). O primeiro conjunto de imagens mostra as consequências do excesso de coloração com pi, que podem surgir das seguintes fontes: usar o corante em concentração muito alta, colorir por muito tempo ou usar muito alto tempo de intensidade/integração do LED no canal vermelho(Figura 5A). Esses erros gerarão um número artificialmente inflado de células mortas. A segunda questão decorre da negligência da etapa de centrifugação. Muitas vezes, as células mortas começam a perder seu apego da superfície do prato. Consequentemente, eles serão sub-representados durante a aquisição de imagem, o que geralmente ocorre perto da parte inferior do poço (Figura 5B). Finalmente, a superexposição no canal Hoechst expande artificialmente o tamanho das células, reduzindo significativamente a contagem total por poço e limitando o poder de ensaio(Figura 5C).
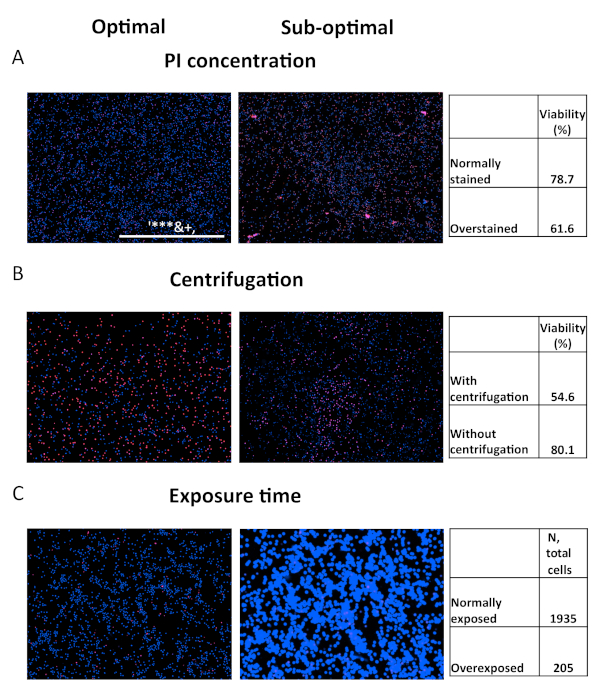
Figura 5. Comparação dos parâmetros de ensaio ótimos e sub-ideais. Comparação dos resultados adquiridos através de parâmetros otimizados (esquerda) ou parâmetros sub-ideais (direita). (A) Os PBMCs saudáveis foram manchados com iodeto de propidium a 1 μg/mL (esquerda) ou 5 μg/mL (direita) por 15 minutos antes da imagem. (B) Imagens de células OCI-AML2 tiradas com (esquerda) ou sem (direita) centrifugação de placa. (C) Imagens de células OCI-AML2 adquiridas com tempo de integração ideal (esquerda) ou excessiva (direita) para o canal Hoechst. Clique aqui para ver uma versão maior desta figura.
| Diferença com método azul trypan, % | ||||
| CCCP, μM | Hoechst/PI | Ensaio LDH | Mtt | Alamar Azul |
| 3.1 | -1.19 | 33.00 | -31.05 | -59.04 |
| 6.3 | 6.99 | 41.90 | -11.03 | -59.34 |
| 12.5 | 0.71 | 41.60 | 4.31 | -52.52 |
| 25 | 30.73 | 66.33 | -3.68 | -51.85 |
| 50 | 47.38 | 50.71 | -17.71 | -60.27 |
| 100 | 13.81 | 17.12 | -45.31 | -67.25 |
| Mediana | 10.40 | 41.75 | -14.37 | -59.19 |
Tabela Suplementar S1. Diferenças de viabilidade para um painel de ensaios em células OCI-AML2 após o tratamento cccp. A avaliação da viabilidade foi realizada após 24h de tratamento com diferentes concentrações de CCCP. As diferenças medianas de viabilidade entre ensaios testados (Hoechst/PI, LDH, MTT ou alamarBlue) e coloração azul trypan com contagem automatizada foram calculadas com base em diferenças de viabilidade em cada concentração de medicamentos.
| Diferença com método azul trypan, % | ||||
| 2-DG, mM | Hoechst/PI | Ensaio LDH | Mtt | Alamar Azul |
| 3.1 | 16.16 | 20.77 | 5.82 | -20.27 |
| 6.3 | 22.93 | 31.96 | -11.13 | -31.11 |
| 12.5 | 30.85 | 45.07 | -34.27 | -36.29 |
| 25 | 13.81 | 42.39 | -55.79 | -52.29 |
| 50 | 16.96 | 81.12 | -29.38 | -47.68 |
| 100 | 7.79 | 149.16 | -19.37 | -28.67 |
| Mediana | 16.56 | 43.73 | -24.38 | -33.70 |
Tabela Suplementar S2. Diferenças de viabilidade para um painel de ensaios em células OCI-AML2 após o tratamento de 2 DG. A avaliação da viabilidade foi realizada após 24h de tratamento com diferentes concentrações de 2-DG. As diferenças medianas de viabilidade entre ensaios testados (Hoechst/PI, LDH, MTT ou alamarBlue) e coloração azul trypan com contagem automatizada foram calculadas com base nas diferenças de viabilidade em cada concentração de medicamentos.
| Rotenone, μM | Diferença de viabilidade, % (Hoechst/PI-trypan azul) |
| 10 | 4.45 |
| 25 | 7.61 |
| 50 | 17.70 |
| 100 | 7.74 |
| 150 | 56.38 |
| 200 | 16.57 |
| Mediana | 12.15 |
Tabela Suplementar S3. Diferença de viabilidade entre hoechst/PI e método de exclusão de TB em células OCI-AML2 após o tratamento rotenone. A avaliação da viabilidade foi realizada após 24h de tratamento com diferentes concentrações de rotenone. A diferença mediana de viabilidade entre a coloração azul de Hoechst/PI e a coloração azul do tripano com contagem automatizada foi calculada com base nas diferenças de viabilidade em cada concentração de medicamentos.
| 3-BP, μM | Diferença de viabilidade, % (Hoechst/PI-trypan azul) |
| 5 | 5.73 |
| 10 | 9.00 |
| 25 | 7.72 |
| 50 | -1.90 |
| 100 | -28.23 |
| 200 | -20.77 |
| Median | 1.91 |
Tabela Suplementar S4. Diferença de viabilidade entre o método de exclusão de Hoechst/PI e TB em células OCI-AML2 após o tratamento de 3-bromopyruvate (3-BP). A avaliação da viabilidade foi realizada após 24 horas de tratamento com diferentes concentrações de 3-BP. A diferença de viabilidade mediana entre a mancha azul hoechst/PI e a coloração azul do tripano com contagem automatizada foi calculada com base nas diferenças de viabilidade em cada concentração de medicamentos.
Figura suplementar S1. Imagens representativas de células manchadas com Hoechst/PI, com ou sem tratamento rotenone em concentrações indicadas em mídia RPMI-1640 sem soro por 24 h: A-B. AML: Linha celular MOLM-13 (A),e células LMA primárias(B)derivadas de uma amostra representativa do paciente. C. Linha celular MOLT-4. D. Linha celular K562. Clique aqui para baixar este arquivo.
Discussão
Embora o protocolo para o ensaio de citotoxicidade Hoechst/PI seja robusto e exija relativamente pouco tempo prático, existem vários detalhes experimentais que são muito importantes para garantir resultados precisos. Em primeiro lugar, é essencial garantir que a concentração de DMSO permaneça abaixo de 0,5% (v/v). É geralmente acordado que a exposição a doses até baixas de DMSO pode alterar substancialmente a morfologia e a fixação das células e retardar significativamente a progressão do ciclo celular39,40.
Em segundo lugar, a coloração deve ser realizada o mais rápido possível após o tratamento. Como não há etapas de lavagem, o composto permanece nos poços e pode continuar a causar danos nas células. Em comparação com o protocoloanterior 35,as células ficaram manchadas por apenas 15 minutos. Isso limita a possibilidade de que células viáveis possam ser inadvertidamente manchadas com iodeto de propídio. Por essa razão, sugerimos tratamentos e manchas escalonantes se mais de duas placas forem tratadas. Isso permite o tempo de imagem entre as placas e melhora a reprodutibilidade.
Em terceiro lugar, a concentração de corante apropriada depende do tipo celular. É importante determinar empiricamente a concentração otimizada de iodeto propidium, começando com células não tratadas, usando a coloração azul trypan como referência ortogonal.
Finalmente, a etapa de centrifugação imediatamente antes da visualização também é crítica. Com base neste protocolo, é registrada uma faixa de 500-4.000 células (dependendo da densidade de semeadura). Trata-se de uma notável melhoria em relação às 100-400 células por bem utilizado anteriormente35. Considerando a variação da população de células cancerígenas (especialmente células primárias), ter mais células para análise é importante, podendo permitir uma análise de dados mais robusta.
Devido à relativa simplicidade do método, uma grande variedade de modificações pode ser facilmente realizada. Por exemplo, muitos outros corantes impermeável de células estão disponíveis em vários fornecedores e podem ser substituídos por iodeto de propidium. Embora essa substituição tenha relativamente pouco valor por si só, o aumento da paleta de cores significa que experimentos mais complexos podem ser realizados. Por exemplo, a adição de uma terceira cor permitirá que a sobrevivência diferencial seja avaliada entre subpopulações de células, como é comumente realizada com citometria de fluxo.
Uma modificação mais substancial do protocolo é a visualização de células anteriores e o uso de um espectrômetro em vez disso. Essa abordagem tem a vantagem de utilizar um equipamento quase onipresente (um espectrofotômetro padrão com leitor de microplaca) e é o método mais rápido para adquirir dados. No entanto, este método é muito menos preciso. A intensidade da fluorescência é representativa da coloração celular, mas variações estocásticas na intensidade da coloração, combinadas com a área amostral relativamente menor, introduzem variabilidade significativa. Embora uma otimização adicional (como a inclusão de uma etapa de lavagem fixa, adicional ou um número maior de amostras) possa resolver esses problemas, a microscopia de fluorescência é geralmente uma abordagem superior.
Em conclusão, o protocolo Hoechst/PI modificado é um ensaio de citotoxicidade de alto rendimento, rápido, preciso, barato e de alto rendimento que é independente da função mitocondrial. Este ensaio tem utilidade substancial para triagem eficiente de compostos ou combinações compostas que visam mitocôndrias.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A NVK, uma estudiosa da CPRIT em Pesquisa do Câncer, agradece ao Instituto de Prevenção e Pesquisa do Câncer do Texas (CPRIT) por seu generoso apoio, a CPRIT concede RR150044. Este trabalho também foi apoiado pelo Welch Foundation Research Grant C-1930, e pelos Institutos Nacionais de Saúde R35 GM129294 concedidos à NVK. Os financiadores não tiveram papel na concepção do estudo, coleta e análise de dados, decisão de publicar ou elaboração do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
Referências
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8(2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , Chapter 12, Unit 12.18 (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698(2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617(2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295(2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102(2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435(2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465(2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828(2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados