Method Article
マイトカン細胞毒性の正確な決定のための自動差動核染色アッセイ
要約
このプロトコルは、細胞の生存率を効率的に決定するための、高速で高スループット、信頼性、安価、および公平なアッセイを記述します。このアッセイは、細胞のミトコンドリアが損傷し、他のアッセイに干渉する場合に特に有用である。このアッセイは、Hoechst 33342とヨウ化プロピジウムの2つの核染料で染色された細胞の自動カウントを使用します。
要約
発癌性転換へのミトコンドリアの寄与は、広い関心と活発な研究の対象である。がん代謝の分野が複雑化する中で、ミトコンドリアの損傷を与える様々な化合物(いわゆるミトカン)を用いてミトコンドリアを標的にするという目標が非常に人気を集めています。残念なことに、テトラゾリウム塩やレサズリンに基づくものなど、多くの既存の細胞傷害性アッセイは、その性能のために機能的なミトコンドリア酵素を必要とします。ミトコンドリアを標的とする化合物によって与える損傷は、しばしばこれらのアッセイの正確さを損なう。ここでは、2つの蛍光色素による微分染色に基づく改変プロトコルについて説明するが、そのうちの1つは細胞透過性(Hoechst 33342)であり、他方は(ヨウ化プロピジウム)ではない。染色の違いにより、生きている細胞と死んだ細胞を区別することができます。このアッセイは、自動顕微鏡検査と画像解析に適しており、スループットを向上させ、バイアスを低減します。これにより、アッセイは96ウェルプレートを使用してハイスループットの方法で使用することができ、特に問題の薬物がある程度の有糸分裂性がある場合には、創薬の取り組みに実行可能な選択肢となる。重要なことに、Hoechst/PI染色アッセイによって得られた結果は、トリパンブルー排除結果と、アッセイが他の方法と比較されたときに生物学的複製の間の両方で、一貫性の増加を示す。
概要
効果的ながん治療を特定するための最初のステップは、治療の効果を調べるために使用できる堅牢で公平な細胞傷害性アッセイの選択です。低スループット実験の一般的な選択肢は、生細胞からのトリパンブルー染料の除外です。この方法は、細胞生存を定量化するための比較的公平な方法を可能にするので好ましい。trypanブルーは、膜が損なわれている細胞に受動的に拡散するが、健康な細胞1に入るのを効果的に遮断される。生きている細胞と全細胞の商は、治療の有効性を示す生存率の割合を表す。trypan blue アッセイの最も大きな欠点は、高スループットの方法論に適していることです。それは比較的低い信号対雑音比を有し、長期染色は、生存細胞の染色のために人工物をもたらす可能性がある。したがって、trypan blue の除外は通常、必ずしも2ではなく、手動カウントに降格されます。これはあまりにも遅くなり、研究者の主観的判断によるバイアスの可能性が強くなります(ブラインドまたは独立したカウントを使用しない限り、実験室のスループットをさらに低下させます)。一般に、このアッセイのスループットは、現代の創薬には不十分です。
一般的にスループットがはるかに高い生存アッセイは、研究者がこの制限を回避することを可能にしますが、重大な注意点が付属しています(表1を参照)。これらの方法は、一般的に2つのグループに分類されます。1つのグループは、細胞レドックス酵素の機能に基づく比色アッセイで構成されています。無色または非蛍光基質は、分光光度計を使用して定量することができる活気に満ちた製品に変換されます。古典的な例としては、テトラゾリウム塩(MTT、WST-1、XTTなど)およびレサズリンが挙げられる。このカテゴリには、ATP レベルを評価するためにルシフェリンを利用する発光アッセイも含まれています。このタイプのアッセイは、細胞代謝を測定しているという根本的な制限を有するが、これは細胞の生存率それ過ではない。細胞が不利な条件下で静止することは非常に一般的ですが、それでも3、4、5を分割する能力を保持しています。例えば、癌幹細胞は、比較的代謝的に6、7、8、9であることが多く、これらの技術を用いてアッセイが困難である可能性が高い。ミトコンドリア機能を損なう治療の有効性も、ほとんどのミトカンなど、著しく過大評価される可能性が高い。
代替方法論は、生物学的膜を交差するか、または交差しないのいずれかを可能にする様々な物質の化学的性質を活用する。その一例が、SYTOXやヨウ化プロピジウム(PI)などの核染色である。このカテゴリには、細胞壊死の指標として細胞外ミリューへのLDHの放出を測定する乳酸脱水素酵素(LDH)アッセイのような概念は類似しているが機能が異なるアッセイも含まれる(図1、表1)。これらのアッセイは、代謝不活性細胞と死細胞を区別することがより可能である。
| アッセイ/染料 | 細胞死の種類が検出されました | 必要な機器 | 主な機能 |
| MTT, CKK-8, アラマーブルー (レザズリン) | アポトーシス/壊死 | 分光 光度 計 | 安価で、迅速。エンドポイントアッセイ;酵素の活性(MTTの場合はミトコンドリアのみ)に依存し、細胞死のモードを区別しない1,10 |
| LDH リリース | 壊死 | 分光 光度 計 | ミトコンドリア酵素の活性とは無関係の迅速な;高スループットテストの場合は高価です。コンプロマ化された形質膜11,12で壊死細胞を検出する |
| トリパンブルー(TB) | アポトーシス/壊死 | 顕微鏡 | 細胞非透過性;細胞死のモードを区別しません。働きがく、ハイスループットスクリーニングには適していません。接着細胞での使用がより困難。ユーザーの主観的判断を受けやすいが、標準的な細胞生存率測定方法13と考えられている |
| アクリジンオレンジ(AO) | アポトーシス/壊死/ | 蛍光顕微鏡 | 独特なスペクトル特性を有する核酸色素は、アポトーシスと壊死/ネクロトーシス14を区別できる |
| ネクロトーシス | |||
| ホークスト 33342, DAPI | アポトーシス | 蛍光顕微鏡またはフローサイトメーター | 細胞透過性;細胞死を監視するために単独で不適切。共同染色に有用である。初期アポトーシスにおけるクロマチン縮合と核断片化を評価するために使用することができます。ヨウ化プロピジウムと組み合わせることで、アポトーシスと壊死を区別することができます15,16 |
| ヨウ化プロピジウム(PI) | 後期アポトーシス/壊死 | 蛍光顕微鏡またはフローサイトメーター | 細胞非透過インターカレーター;細胞死17の後期アポトーシスおよび壊死モードの両方を検出する。長いインキュベーションの後の有毒で透過性18 |
表 1.細胞毒性アッセイのリスト細胞毒性アッセイは、その一部がこの研究で使用され、その主要な特徴の簡単な説明と共にリストされた。
最近の研究では、ミトコンドリア代謝が一部の癌で変化することが実証されています19,20,21,22,23,24,25.例えば、急性骨髄性白血病(AML)は、彼らのエネルギー需要19、26、27を満たすためにミトコンドリア質量、mtDNA含有量、およびミトコンドリア呼吸をアップレレートすることが示されている。一方、いくつかの固形腫瘍は、ミトコンドリア機能障害、またはむしろ「代謝リプログラミング」、OXPHOSに関与するミトコンドリアタンパク質のダウンレギュレーションやmtDNA含有量の低下など、腫瘍浸潤性、転移電位およびアポトーシス誘発薬28、29に対する耐性に関連している。さらに最近では、ミトコンドリア機能に影響を与える機械学的に多様な化合物(一般にミトカン30と呼ばれる)を特定の癌の潜在的な治療法として使用することに対する関心が高まっています。これらの薬物は、ATP合成、ミトコンドリアDNA、OXPHOS、およびROS産生、ならびにミトコンドリア30、31に関連するプロアポトーシスおよび抗アポトーシスタンパク質を標的とする。いくつかの研究は、このアプローチが重要な約束を持っていることを示しています19,32,33,34.しかし、がん細胞生物学やミトコンドリア標的治療におけるこれらの代謝偏差は、ミトコンドリア機能に基づく従来の生存アッセイに大きな影響を与える可能性があります。
ここでは、微分核染色アッセイ用の最適化されたプロトコルについて説明する。このプロトコルは、ミトカンの細胞毒性や他の化合物との組み合わせの迅速かつ正確な決定を可能にします。Hoechst 33342は細胞膜を容易に横切ってDNAを染色する細胞透過核色素であり、全細胞数が得られるようになる。死細胞の核にしか入るPIとの共染色により、生きている細胞(Hoechstのみ)と死んだ(両方で染色)細胞の割合を正確に決定することができる。このプロトコルは、(直交トリパンブルー法との交差参照結果による)およびイメージング前のプレートの遠心分離による色素濃度の最適化のためのステップを加えることによって、公表アッセイ35 を改良する。多くの細胞株は半接着または懸濁されているため、遠心分離は、画像化される細胞の割合を増加させ、精度を大幅に向上させます。アッセイには、染色が媒体の除去または洗浄を必要としないことを含むいくつかの利点がある。染料混合物はまた安価で、準備が容易で、多チャンネル/ロボティックピペットシステムと互換性がある。
細胞が染色された後、それらは自動化された顕微鏡でイメージされる。これは、後で再分析することができる画像の永久的な記録を作成し、特定の化合物の効果をキャプチャされた画像の目視検査によって再評価することができるという付加的な利点を有する。画像が取得されると、セルは手動で、または無料(ImageJ、CellProfilerなど)と商用ソフトウェア(例えば、変身、Gen5など)の両方を含むいくつかのソフトウェアパッケージのいずれかを使用してカウントすることができます。自動セルカウントは、一般に、自動セルカウントパイプラインが手動カウントよりも正確でバイアスが低いため、一般的に好ましいです。また、細胞の破片や不溶性複合体をより効果的に無視します。これらのパイプラインの開発は一般的に簡単であり、使用される汚れの効率によって簡素化されます。出力は、死細胞の実際の数が総細胞数に対して自動的に計算されるため定量的であり、異なる閾値を適用して検出35のストリンジェンシーを増減することができる。利便性のために、Gen5 v. 3.00ソフトウェア互換Cytation 5セルイメージングマルチモードリーダーを使用してセルをカウントするための最適化されたパラメータが含まれています。
プロトコル
1. 細胞毒性アッセイ: セットアップ
- 適切な培地(無血清または1、2.5、または5%FBS RPMI-1640)で所望の濃度で目的の化合物の溶液を調製する。
- 単一の化合物の細胞毒性を測定するには(例えば、有効用量を決定するために)、2倍の最終濃度で化合物を調製する。
- 化合物の組み合わせの細胞毒性を測定するには、4倍の最終濃度で化合物を調製する。
- 適切な培地と同量の溶媒を混合して、溶媒のみの制御を準備します。例えば、DMSOやメタノールに溶解した化合物を試験する場合、溶媒ごとに溶媒のみの制御を行います。
- 培養皿またはフラスコから細胞を15 mL円錐形チューブに集めます。
- 10 μL のセル懸濁液をマイクロ遠心分離チューブに移し、10 μL 0.4% トリパンブルーの染色を行います。ヘモサイトメーターを使用して、各細胞ソースの生存可能な細胞と生存不可能な細胞を数えます。
- ペレット細胞は200gで5分間用いった。吸引またはデカント上清。
- 細胞ペレットをアッセイに適した培地(無血清または1、2.5、5%FBS RPMI-1640)の細胞密度3*105 細胞/mLで再懸濁します。
注1:細胞密度は3*105 セル/mLで、15,000個の細胞/ウェルの播種密度を提供します。シード密度は重要なパラメータであり、実験の前に事前に定義しておくことが理想的です。シード密度は、1)細胞サイズを考慮に入れる必要があります - 通常、より大きなセルは、より低い密度で播種されます。2)治療期間 - 細胞は通常、より長く続く実験のために低密度で播種される。3)細胞分裂率 – より高い分裂率を持つ細胞は、より低い密度で播種される。最適化された播種密度の具体例: K562細胞、より大きい、24時間の持続時間 – 10,000細胞/ウェル;MOLM-13細胞, 適度なサイズ, 24 時間治療 – 15,000/well;MOLM-13細胞, 48時間治療 – 8,000/well;小さな健康な末梢血単核細胞(PBMC),24時間治療 – 50,000/well;原発性AML細胞, 24時間治療 – 15,000-20,000/well.
注2:メディア内のFBSの存在は、化合物の活性に影響を与える可能性があります。FBSの濃度を下げると、アッセイの結果を解釈しやすくすることができますが、生理学的精度も低下します。 - ステップ1.5からマルチチャンネルピペットを使用して96ウェルプレートの各ウェルに細胞懸濁液のシード50 μL。
- 次のようにコンパウンドを追加します。
- 単一化合物アッセイの場合、2x化合物溶液を各ウェルに50 μL加えます。溶剤制御ウェルの場合は、2倍の濃度で溶媒を含む試験培地を50μL加えます。
- 併用アッセイの場合、各化合物(4x溶液)の25μLを各ウェルに加えます。単一の化合物制御ウェルの場合、4x化合物溶液25μLと25μLの試験媒体を加えます。溶剤制御ウェルの場合は、50 μLのテスト媒体または溶剤を含む試験媒体を追加します。
注1: DMSOの最終濃度は0.5%を超えてはなりません。
注2:低体積のため、ピペットが各ウェルの壁に触れる化合物を含む培地を追加することをお勧めします。
- プレートを軽くタップして、ウェルの内容物が混ざっていることを確認します。
- 37°Cで37°Cでプレートを適宜、例えば24時間加湿した5%CO2雰囲気でインキュベートする。
細胞毒性アッセイ:ヘヒスト33342とヨウ化プロピジウムで染色
- 10倍の染色液を用意します。このソリューションは、各実験の前に新鮮な準備をする必要があります, それは保存することはできません.最終的な染料濃度は、実験の前に決定する必要があります。
- 白血病細胞株および原発性白血病細胞の場合、10x染色バッファーの1mLは、滅菌PBS中の20mMのHoechst 33342の10 μLおよび1mg/mLヨウ化プロピジウムの50 μLを含む(最終濃度:Hoechst 33342 20 μM、5 μg/mL)。
- 健康なPBMCの場合、10x染色バッファーの1mLは、20 mMのHoechst 33342の10 μLおよび1mg/mLのヨウ化プロピジウムの10 μLを含んでいます(最終濃度:Hoechst 33342 20 μM、PI 1 μg/mL)。
注:ヨウ化プロピジウムの最終的な濃度は、実験の前に決定する必要があります。細胞はPI濃度(1,2.5,5 μg/mL)の範囲を用いて試験し、次にHoechst/PI計算された生存率をトリパンブルーで測定する生存率と比較する必要があります。上記のPI濃度は、培地制御ウェルにおける標的細胞の生存率に基づいて選択された(白血病細胞株では90%以上、健康なPBMCsでは〜70%以上)
注意:Hoechst 33342およびヨウ化プロピジウムは潜在的な発がん性物質である。取り扱い時には、適切な個人用保護具を着用してください。
- インキュベーション後、マルチチャンネルピペットを使用して、10倍の染色バッファーを各ウェルに10 μL加えます。
注:クロスコンタミネーションを防ぐために、ピペットチップがメディアに触れないようにしてください。 - プレートを軽くタップして、泡を混ぜてクリアします。37°Cで15分間汚す。
- プレートを200gで4分間遠心し、すべての細胞をプレートの底に持ち込みます。プレートの底部を湿ったキムワイプで慎重に拭き取り、画像処理を妨げる繊維や破片を取り除きます。
注1:プレートの遠心分離は、画像内のすべての細胞がキャプチャされる可能性が最も高くなります。死んだ細胞は、しばしば、細胞毒性の誤解を招く値を提供し、剥離し、浮遊します。遠心分離は、この効果を軽減します。
注2:プレートは遠心分離後、理想的には15分以内にできるだけ早く画像化する必要があります。遠心分離は、PI染色の選択性を低下させ、細胞がヨウ化プロピジウムをゆっくりと発生させる可能性がある。死細胞を可視化することで得られる精度の向上は、PI染色のわずかな増加を上回る。遠心分離の1時間以内にイメージングを完了することをお勧めします。
3. 細胞毒性アッセイ:データ取得
- 自動顕微鏡/プレートイメージャー用のソフトウェアを設定して、Hoechst 33342(励起最大350 nm、最大461nm)およびPI(励起最大493nm、最大636nm)の両方の蛍光を検出します。両方のチャンネルの各ウェルの画像を取得します。
- ソフトウェア(CellProfilerなど)を使用すると、MatLab http://cellprofiler.org/、ImageJ、またはGen5などの独自のソフトウェアに基づく無料の画像解析スタジオが、各チャネルの各ウェル内のセルをカウントします。
注:すべての細胞はHoechst 33342で染色されるべきであり、死んだ細胞はPIで染色されるべきであるので、死んだ細胞の比率は死んでいる細胞の割合を表します。例えば、未処理サンプル中の自動カウントがPI(死細胞)で染色された467個の細胞と、Hoechst 33342(全細胞)で染色された2335個の細胞を示す場合、その分率は0.2または20%である。この値は、処理が使用された同一の処理サンプルと比較されます。 - Cytation5セルイメージングマルチモードリーダーとGen5 v.3.00ソフトウェアを使用したHoechst/ PIデータ取得の詳細な説明:
- Cytation5 マルチモード プレート リーダー/イメージャーを、フラットボトム、96 ウェル、汎用の黒いプラスチック プレートのイメージ セルに設定します。
- 標準 DAPI およびテキサスレッドフィルターセットを使用するイメージングプロトコルを設定します。4倍の倍率の目的を使用して、ウェルセンターで画像を撮ります。オフセットを使用しない(X/Y または Z)。次のイメージング設定を使用してください: DAPI – LED - 10,統合時間 - 99,ゲイン - 0;テキサスレッド - LED - 8、統合時間 - 950、ゲイン - 18。DAPI 信号を使用して自動焦点を実行します。チャネル間のフォーカスにオフセットがあってはならない。
- Gen5ソフトウェアv 3.00を使用して画像解析を実行します。ソフトウェア設定では、セルをサイズの5~25μmの形状として定義します。特殊オプション「分割接触オブジェクト」をオンにして、プライマリエッジオブジェクトを除外し、接触オブジェクトを分割します。 次に、背景を削除するイメージ (暗い背景減算) を処理し、核マスク (しきい値 DAPI >= 6000 AU) を適用し、オブジェクトをカウントします。PI 染色(しきい値 Texas Red >= 5000 AU)に基づいてサブ人口分析を実行し、オブジェクトをカウントします。セル生存率 % は (1 -
 と定義されます。
と定義されます。
結果
前述のプロトコルは、代表的な急性骨髄性白血病細胞株として取られたOCI-AML2細胞を用いて開発された。AMLは、骨髄26における未分化および非機能的造血細胞の異常増殖を特徴とする。AML標的療法の最近の発展にもかかわらず、ケアの水準は数十年間変わらず、誘導療法(典型的には3日間のアントラサイクリン、例えば、ダウノルビシン、イダルビシン、またはアントラセネジオンミトキサントロント座、および7日間のシタラビンの回復期から構成される)から成る)
図1Aに概説したプロトコルに従って、OCI-AML2細胞を96ウェルプレートに播種し、ミトコンドリアアンカボニルシアニドm-クロロフェニルヒドラゾン(CCCP)または解糖分解阻害剤2-デオキシDグルコース(2-DG)で一定の濃度で処理した。細胞を無血清RPMI-1640培地中で37°Cで24時間処理し、次いでトリパンブルー(TB)排除または4つの生存アッセイ(Hoechst/PI差動核染色、LDH放出アッセイ、MTT、またはアラマブルー)のいずれかを使用して生存率を評価した。Hoechst/PI で染色された細胞の代表的な画像を図 2Aに示します。いくつかの重要な観察がすぐに行うことができます。まず、細胞の総数(Hoechst染色)は、かなり多く、死細胞数(PI染色)よりも著しく多い。これは、メディアの状態が細胞死率の高さを引き起こしていないことを示唆している。第二に、HoechstとPIの両方で標識されている細胞のみが死んだと数えられるので(マージされた画像では紫色の細胞)、破片を数える確率は非常に低い。この画像は、適切に染色された細胞の良い例を示しています。
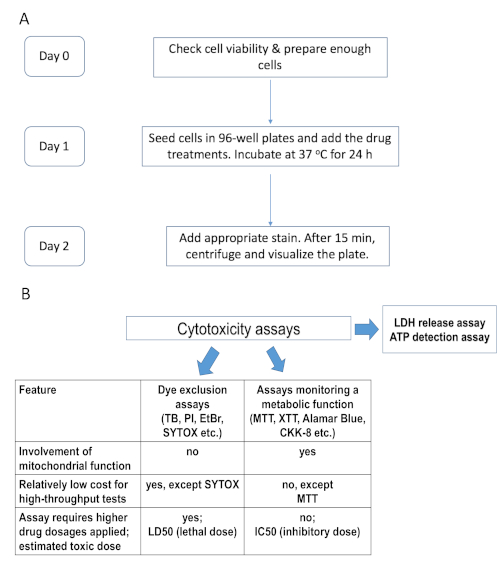
図 1. 実験的なタイムラインと既存の細胞傷害性アッセイの比較 (A) 実験手順のタイムラインを要約したフローチャート(例えばHoechst/PI染色)。(B) 細胞傷害性アッセイの比較は、その一部を本研究で用いた。色素排除アッセイは、損なわれた原形質膜を有する死んだ細胞を染色する不定形核染料を含む:TB - トリパンブルー、PI - ヨウ化プロピジウム、EtBr - 臭化エチジウム、およびSYTOX。第2群のアッセイは細胞代謝に依存し、例えばテトラゾリウム塩MTT、XTT、CKK-8(WST-8)、レサズリン系試薬alamarBlueなど、 この図のより大きなバージョンを見るにはここをクリックしてください。
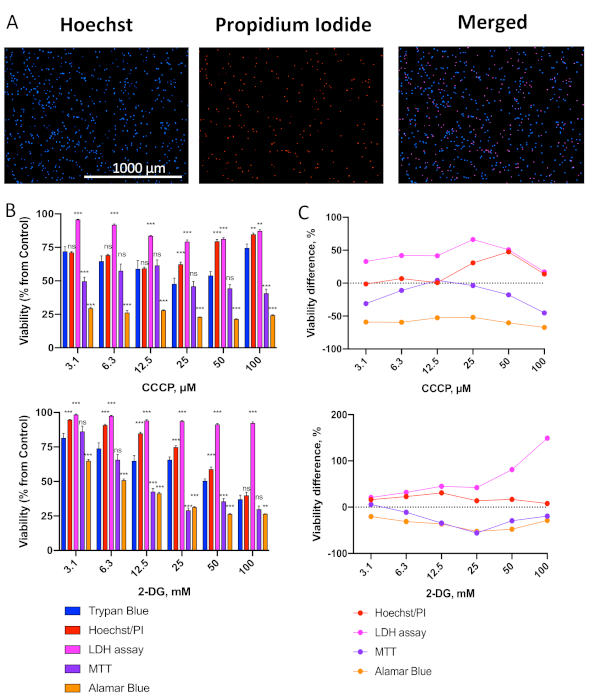
図 2.細胞毒性アッセイのパネルとトリパンブルー排除の比較(A)総(Hoechst 33342)および死んだ(ヨウ化プロピジウム、PI)のOCI-AML2細胞の代表的な画像を、Hoechst/PI染色を介して。(B) CCCP(上)または2-DG(下)濃度の勾配で処理後の異なる方法を用いたOCI-AML2細胞の生存率の評価。OCI-AML2は、細胞生存率の決定前に24時間、24時間の間、無血清RPMI-1640でCCCPまたは2-DGで処置した。示された平均値は、SEM.C.細胞毒性アッセイ(B)とトリパンブルー染色における細胞生存率の差を表す(正確な数値と中央値差については補足表S1-2を参照)。星は有意差を示す。トライパンブルー染色。** p < 0.01, *** p < 0.001, ns – 重要ではない。グループ比較は、複数仮説検定の補正を伴うt-testを介して行われた。3つの独立した生物学的複製が行われた。この図の大きなバージョンを表示するには、ここをクリックしてください。
我々は最近報告したように19,白血病は、細胞が既に基礎的なミトコンドリアの損傷を持っていることを示す、有糸分裂性の治療に非常に敏感です。これに基づいて、ミトコンドリア酵素活性に基づくMTTおよびalamarBlueアッセイは、細胞の生存率を不正確に測定すると予測した。予想通り、これらのアッセイ(特にalamarBlue)は、トリパンブルー排除に比べて有意に低い生存率を示し、 図2B、C、補足表S1-S2を参照)。これは、アポトーシスまたは壊死を誘発するために必要なこれらの化合物の用量がミトコンドリア機能を損なうために必要なものよりも高いという事実と一致しています。
試験されたアッセイの中で、Hoechst 33342およびPIによる二重染色は、堅牢性、感受性、および結核染色との一貫性の最良の組み合わせを有し、CCCPまたは2-DG治療後の結核排除法からの最小中央値偏差を有する(補足表S1-2)。興味深いことに、CCCPの高用量(50および100 μM)では、Hoechst/PIまたはTBで推定される生存率が低用量と比較して増加した(図2B、上)。これは、その疎水性のために高用量でのCCCPの沈殿による可能性が高く、その効果的な濃度と細胞への影響を減少させる。しかし、CCCPの用量を増加させることで、OCI-AML2細胞の平均生存率は150μMで74%、200μMで62%、300μMで6%(データは示されていない)を更に減少させた。
Hoechst/PIアッセイは、他のミトコンドリア標的分子で処理した後の細胞生存率の決定にも有効であった。これらには、ミトコンドリア電子輸送鎖37の複合体Iを損なう毒物であるロテノーネと、ミトコンドリア呼吸およびミトコンドリア代謝を損なう解糖抑制剤およびアルキル化剤である3-ブロモピルビン酸が含まれていた(図3A-D、補助表S3-4)。
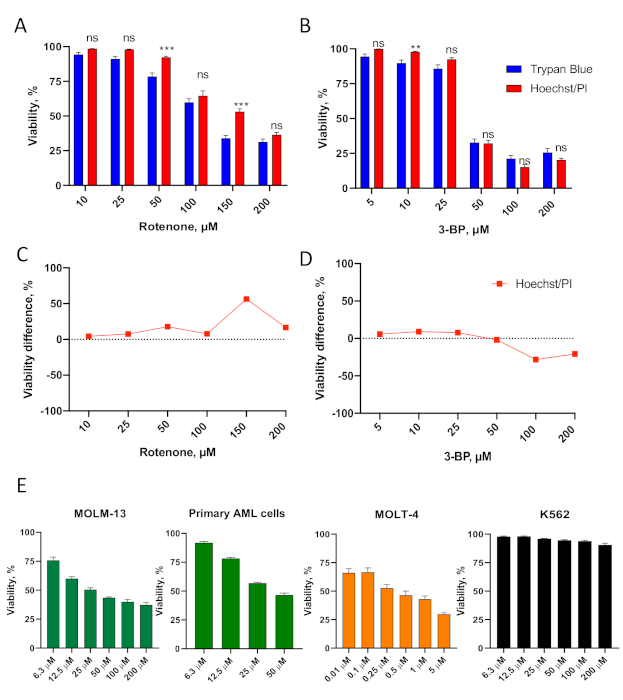
図 3.白血病細胞におけるHoechst/PI細胞毒性アッセイの検証(A,B)OCI-AML2(AML)細胞を、ロテノン(A)または3-ブロモピルビン酸の異なる濃度で処理し、3-BP(B)を24時間の無血清RPMI-1640培地で処理し、次いで生存率を決定した。SEM(C,D)との平均値は、Hoechst/PIアッセイとトリパンブルー染色の生存率差の比較(A-Bの細胞については、定量の補足表S3-4を参照)星は統計的有意性とトリパンブルー染色を示す。** p < 0.01, *** p < 0.001, ns – 重要ではない。グループ比較は、複数仮説検定の補正を伴うt-testを介して行われた。E.MOLM-13 (AML)、患者から分離された原発AML細胞、MOLT-4(ALL)、およびK562(CML)細胞を、Hoechst/PI染色を使用して生存率判定を行う前に、血清フリーRPMI-1640培地中のロテノン濃度を24時間処理した。SEM で平均値を示します。3つの独立した生物学的複製が行われた。この図の大きなバージョンを表示するには、ここをクリックしてください。
Hoechst/PI細胞毒性アッセイは、複数のタイプの白血病を表す白血病細胞株のパネルと一次細胞を使用してさらに検証された。MOLM-13(AML細胞株)、代表的患者試料由来の原発AML細胞、MOLT-4(急性リンパ芽球性白血病細胞株、ALL)、K562(慢性骨髄性白血病細胞株、CML)が含まれていた(図3E、補助図S1)。Hoechst/PIアッセイの結果、これらの細胞は非常に感受性(MOLT-4)から耐性(K562)細胞に至るまで、ロテノーネ感受性に深い違いがあることを示した。
アッセイの堅牢性を実証するために、OCI-AML2細胞は、上記のプロトコルに記載されるように、3-ブロモピルビン酸の濃度勾配で処理した。細胞数は、各濃度で6ウェルについて収集され、図示されている(図4A,B)。これらの数は生存率を計算するために使用され、アッセイ結果を正確に捕捉するのに十分なウェルは4つしかなく、示された(図4C)。得られた線量応答曲線を示す(図4D)。

図 4.ホーヒスト/PI染色の再現性3-ブロモピルビン酸(3-BP)の異なる濃度で24時間の処理後のOCI-AML2細胞の生存率。(A)Hoechst 33342染色を介して計数された細胞の総数、(B)ヨウ化プロピジウム染色を介して数えられる死細胞の数。(C) 生存率 (%)を使用して計算します (A-B)。(D)代表的な線量応答グラフ。SEM で平均値を示します。3つの独立した生物学的複製が行われた。この図の大きなバージョンを表示するには、ここをクリックしてください。
アッセイは比較的堅牢ですが、注意を払う必要があります。アッセイの性能が不適切な場合、その精度が損なわれる可能性があります。トラブルシューティングの目的で、いくつかの危険な結果が示されています (図 5)。最初の画像セットは、PIによる過剰染色の結果を示しており、これは次のソースから生じる可能性があります:染料を高濃度で使用する、長すぎる染色、または赤チャネルでのLED強度/積分時間が高すぎる(図5A)。これらのエラーは、人工的に膨らんだ死んだ細胞の数を生成します。第二の問題は、遠心分離ステップを無視することから生じる。死んだ細胞は、多くの場合、皿の表面からその付着を失い始める。結果として、これらは、一般的にウェルの底部付近で発生する画像取得中に過小評価されます(図5B)。最後に、Hoechstチャネルの過露光は人工的に細胞のサイズを拡大し、ウェルあたりの総カウントを大幅に減少させ、アッセイ力を制限する(図5C)。
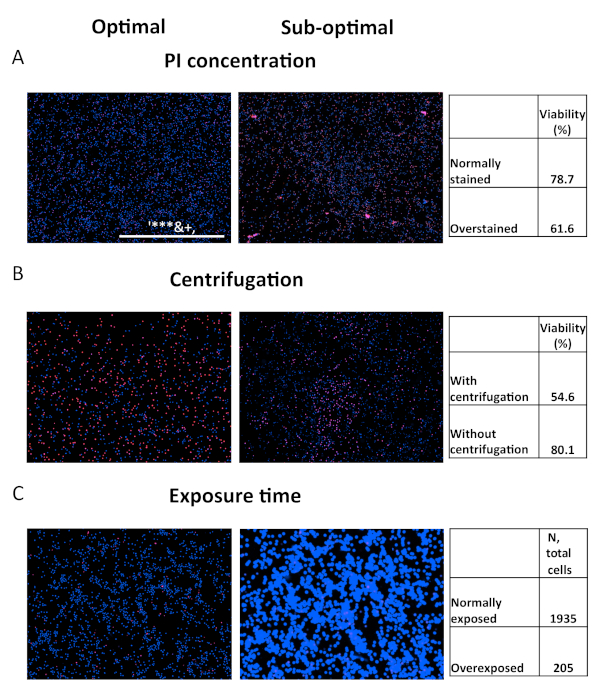
図 5.最適と最適以下のアッセイパラメータの比較 最適化されたパラメータ(左)または最適でないパラメータ(右)を介して取得した結果の比較。(A)健康なPBMCsは、イメージングの前に15分間、1μg/mL(左)または5μg/mL(右)でヨウ化プロピジウムで染色した。(B) プレート遠心分離(左)または無(右)プレート遠心で撮影したOCI-AML2細胞の画像。(C) HOEchst チャネルの最適な (左) または過剰な (右) 統合時間で取得した OCI-AML2 細胞の画像。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| トリパンブルー法との違い、% | ||||
| CCCP、μM | ホークスト/PI | LDHアッセイ | Mtt | アラマーブルー |
| 3.1 | -1.19 | 33.00 | -31.05 | -59.04 |
| 6.3 | 6.99 | 41.90 | -11.03 | -59.34 |
| 12.5 | 0.71 | 41.60 | 4.31 | -52.52 |
| 25 | 30.73 | 66.33 | -3.68 | -51.85 |
| 50 | 47.38 | 50.71 | -17.71 | -60.27 |
| 100 | 13.81 | 17.12 | -45.31 | -67.25 |
| 中央 | 10.40 | 41.75 | -14.37 | -59.19 |
補足表 S1.CCCP処理後のOCI-AML2細胞におけるアッセイのパネルの生存率の違い。 生存率の評価は、異なる濃度のCCCPで24時間の治療の後に行われた。試験アッセイ(Hoechst/PI、LDH、MTT、またはalamarBlue)と自動計数によるトリパンブルー染色との間の生存率の中央値差は、各薬物濃度における生存率差に基づいて計算した。
| トリパンブルー法との違い、% | ||||
| 2-DG、mM | ホークスト/PI | LDHアッセイ | Mtt | アラマーブルー |
| 3.1 | 16.16 | 20.77 | 5.82 | -20.27 |
| 6.3 | 22.93 | 31.96 | -11.13 | -31.11 |
| 12.5 | 30.85 | 45.07 | -34.27 | -36.29 |
| 25 | 13.81 | 42.39 | -55.79 | -52.29 |
| 50 | 16.96 | 81.12 | -29.38 | -47.68 |
| 100 | 7.79 | 149.16 | -19.37 | -28.67 |
| 中央 | 16.56 | 43.73 | -24.38 | -33.70 |
補足表 S2.2-DG処理後のOCI-AML2細胞におけるアッセイのパネルの生存率の違い。 生存率の評価は、2-DGの異なる濃度で24時間の治療の後に行った。試験アッセイ(Hoechst/PI、LDH、MTT、またはalamarBlue)と自動計数によるトリパンブルー染色との間の生存率の中央値差は、各薬物濃度における生存率の違いに基づいて計算した。
| ロテノーネ、μM | 生存率差、% (Hoechst/PI-トリパンブルー) |
| 10 | 4.45 |
| 25 | 7.61 |
| 50 | 17.70 |
| 100 | 7.74 |
| 150 | 56.38 |
| 200 | 16.57 |
| 中央 | 12.15 |
補足表 S3.ロテノーン処理後のOCI-AML2細胞におけるHoechst/PIと結核排除法の生存率差 生存率の評価は、ロテノンの異なる濃度で24時間の治療の後に行った。自動カウントによるHoechst/PIとトリパンブルー染色との間の生存率の中央値差は、各薬物濃度における生存率差に基づいて計算した。
| 3-BP、μM | 生存率差、% (Hoechst/PI-トリパンブルー) |
| 5 | 5.73 |
| 10 | 9.00 |
| 25 | 7.72 |
| 50 | -1.90 |
| 100 | -28.23 |
| 200 | -20.77 |
| Mエディアン | 1.91 |
補足表 S4.3-ブロモピルビン酸(3-BP)処理後のOCI-AML2細胞におけるヘヒスト/PIと結核排除法の生存率差。 生存率の評価は、3-BPの異なる濃度で24時間の治療の後に行われ、オートカウントによるHoechst/PIとトリパンブルー染色との間の中央値生存率差を各薬物濃度における生存率差に基づいて計算した。
補助図 S1.Hoechst/PIで染色された細胞の代表的な画像は、24時間用無血清RPMI-1640培地中で示された濃度でのロテノン処理の有無にかかわらず、A-B。AML: MOLM-13細胞株(A)および代表患者試料由来の一次AML細胞(B)C.すべて:MOLT-4細胞株。D.CML: K562細胞株。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
Hoechst/PI細胞毒性アッセイのプロトコルは堅牢で、比較的実践的な時間を必要としますが、正確な結果を確実にするために非常に重要な実験的な詳細がいくつかあります。まず、DMSOの濃度が0.5%(v/v)未満であることを確認することが不可欠です。DMSOの低用量への暴露は、細胞の形態および付着を実質的に変化させ、細胞周期進行を39,40に著しく遅らせることができるということは一般に合意されている。
第二に、染色は、処置後できるだけ早く行われるべきである。洗浄ステップがないので、化合物は井戸に残り、細胞に損傷を与え続けることができます。先のプロトコル35と比較して、細胞は15分間だけ染色された。これは、実行可能な細胞が誤ってヨウ化プロピジウムで染色される可能性を制限します。このため、2つ以上のプレートを処理する場合は、驚異的な治療と染色をお勧めします。これにより、プレート間の撮像時間が可能になり、再現性が向上します。
第3に、適切な色素濃度は、細胞の種類に依存する。トリパンブルー染色を直交基準として使用して、未治療の細胞から始まる最適化されたヨウ化プロピジウム濃度を経験的に決定することが重要です。
最後に、可視化の直前の遠心段階も重要です。このプロトコルに基づいて、500-4,000セルの範囲が記録されます(シード密度に応じて)。これは、以前に使用されたウェルあたり100-400セルに対する顕著な改善です 35.がん細胞(特に初代細胞)の集団の変動を考慮すると、分析のために細胞が多く存在することが重要であり、より堅牢なデータ分析が可能になる可能性があります。
メソッドの相対的な単純性により、多種多様な修正を容易に行うことができます。例えば、多くの他の細胞非透過染料は、多くのベンダーから入手可能であり、ヨウ化プロピジウムに代用することができます。この置換自体は比較的価値が低いですが、色のパレットが増加すると、より複雑な実験を行うことができます。例えば、第3色を追加すると、フローサイトメトリーで一般的に行われるように、細胞のサブ集団間で差動生存期間を評価することができます。
プロトコルのより実質的な変更は、細胞の可視化を前に、代わりに分光光度計を使用することです。このアプローチは、ほぼユビキタスな機器(マイクロプレートリーダー付きの標準分光光度計)を利用できるという利点があり、データを取得する最速の方法です。しかし、この方法は、はるかに精度が低いです。蛍光強度は、細胞染色の代表であるが、染色強度の確率的な変動は、比較的小さいサンプル領域と組み合わせることで、有意な変動性を導入する。さらなる最適化(固定剤、追加の洗浄工程、またはより多くのサンプルを含むなど)がこれらの問題に対処する可能性があるが、蛍光顕微鏡は一般的に優れたアプローチである。
結論として、修正されたHoechst/PIプロトコルは、ミトコンドリア機能とは無関係の高速、正確、安価、高スループットの細胞傷害アッセイです。このアッセイは、ミトコンドリアを標的とする化合物または化合物の組み合わせを効率的にスクリーニングするための実質的な有用性を有する。
開示事項
著者らは開示するものは何もない。
謝辞
がん研究のCPRIT学者であるNVKは、テキサス州がん予防研究所(CPRIT)の寛大な支援、CPRIT助成金RR150044に感謝します。この研究は、ウェルチ財団研究助成金C-1930、およびNVKに授与された国立衛生研究所R35 GM129294によっても支援されました。資金提供者は、研究デザイン、データ収集と分析、出版の決定、原稿の作成に何の役割も持っていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
参考文献
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8(2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , Chapter 12, Unit 12.18 (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698(2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617(2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295(2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102(2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435(2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465(2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved