Method Article
תסיסה אוטומטית של כתמים גרעיניים דיפרנציאליים לקביעה מדויקת של ציטוקוקסיות מיטוקאן
* These authors contributed equally
In This Article
Summary
הפרוטוקול מתאר תפוקה מהירה, גבוהה, אמינה, זולה, ובלתי משוחדת, לקביעת יעילות של הכדאיות הסלולרית. תסה זו שימושית במיוחד כאשר המיטוכונדריה של התאים נפגעה, מה שמפריע לאסות אחרות. ההסתה משתמשת בספירה אוטומטית של תאים המוכתמים בשני צבעים גרעיניים – Hoechst 33342 ו-propidium iodide.
Abstract
התרומה של המיטוכונדריה לטרנספורמציה אונקוגנית היא נושא של עניין רחב ומחקר פעיל. ככל שתחום חילוף החומרים של הסרטן הופך מורכב יותר, המטרה של מיקוד המיטוכונדריה באמצעות תרכובות שונות שגורמות לנזק מיטוכונדריאלי (מה שנקרא מיטוקנים) הופך פופולרי למדי. למרבה הצער, רבים קיימים cytotoxicity assays, כגון אלה המבוססים על מלחי tetrazolium או resazurin דורשים אנזימים מיטוכונדריאליים פונקציונליים עבור הביצועים שלהם. הנזק שנגרם על ידי תרכובות כי היעד המיטוכונדריה לעתים קרובות פוגע הדיוק של אלה. כאן, אנו מתארים פרוטוקול שונה המבוסס על כתם דיפרנציאלי עם שני צבעי פלורסנט, אחד מהם הוא תא חודר (Hoechst 33342) והשני הוא לא (פרודיד פרופידיום). ההבדל בכתמים מאפשר להפלות תאים חיים ומתים. ההסכם ניתן למיקרוסקופ אוטומטי וניתוח תמונה, אשר מגביר את התפוקה ומפחית הטיה. זה גם מאפשר את ההסחמה לשמש באופן בתפוקה גבוהה באמצעות צלחות 96-באר, מה שהופך אותו אופציה בת קיימא עבור מאמצי גילוי סמים, במיוחד כאשר התרופות המדוברות יש רמה מסוימת של מיטוקסיות. חשוב לציין, תוצאות שהושגו על ידי Hoechst / PI כתמים assay להראות עקביות מוגברת, הן עם תוצאות הדרה כחול trypan ובין שכפולים ביולוגיים כאשר ההשוואה מושווה שיטות אחרות.
Introduction
הצעד הראשון לזיהוי טיפולים יעילים בסרטן הוא הבחירה של סיסוקסיות cytotoxicity חזקה, משוחדת שניתן להשתמש בה כדי לבחון את ההשפעה של הטיפול. בחירה נפוצה לניסויים בתפוקה נמוכה היא הדרה של צבע כחול trypan מתאי חיים. שיטה זו מועדפת כי היא מאפשרת שיטה יחסית משוחדת לכמת את הישרדות התא. טריפאן כחול מפזר באופן פסיבי לתוך תאים שהמברנות שלהם בסכנה, אבל זה חסום ביעילות מלהיכנס לתאים בריאים1. המנה של התאים החיים ואת התאים הכולל מייצג את הכדאיות אחוז, אשר מצביע על היעילות של הטיפול. החיסרון המשמעותי ביותר של ה-trypan Blue assay הוא שהוא אינו מתאים באופן גרוע לתודולוגיות בתפוקה גבוהה. יש לו יחס אות לרעש נמוך יחסית וכתמים ממושכים יכולים לגרום לחפצים בשל הכתמה של תאים קיימא. כתוצאה מכך, הדרה כחול trypan הוא בדרך כלל, אבל לא תמיד2, ירד לספירה ידנית. זה עושה את זה איטי מדי ומציג את האפשרות החזקה של הטיה בשל שיפוט סובייקטיבי של החוקר (אלא אם כן ספירות מסנוור או עצמאי משמשים, אשר להפחית עוד יותר את תפוקת המעבדה). באופן כללי, התפוקה של תפוקה זו אינה מספיקה לגילוי סמים מודרני.
הכדאיות, שבדרך כלל יש לה תפוקה הרבה יותר גבוהה, מאפשרת לחוקרים לעקוף מגבלה זו, אך מגיעים עם אזהרות משמעותיות (ראה טבלה 1). שיטות אלה בדרך כלל נופלות לשתי קבוצות. קבוצה אחת מורכבת מאסרים צבעוניים המבוססים על הפונקציה של אנזימי רדוקס תאיים. מצעים חסרי צבע או שאינם פלורסנט מומרים למוצרים מלאי חיים שניתן לכמת באמצעות ספקטרופוטומטר. דוגמאות קלאסיות כוללות מלחי טרטאזוליום (MTT, WST-1, XTT וכו') ורסזורין. קטגוריה זו כוללת גם תסדירות זוהרות המשתמשות בלוציפרין כדי להעריך את רמת ה-ATP. לנתונים מסוג זה יש את המגבלה הבסיסית שהם מודדים את חילוף החומרים התאי, שהוא לא יכולת הכדאיות הסלולרית כשעצמה. זה די נפוץ עבור תאים להיות התרכך בתנאים שליליים, אבל עדיין לשמור על היכולת לחלק3,4,5. לדוגמה, תאי גזע סרטניים הם לעתים קרובות יחסית מטבוליתהרהיות 6,7,8,9, והם צפויים להיות קשה לומר באמצעות טכניקות אלה. יעילות של טיפולים המים נזק לתפקוד המיטוכונדריאלי, כגון רוב המיטוקנים, גם צפוי להיות מוערך יתר על המידה באופן משמעותי.
מתודולוגיה חלופית ממנפת את המאפיינים הכימיים של חומרים שונים המאפשרים להם לחצות או לא לחצות קרום ביולוגי. דוגמה אחת היא כתמים גרעיניים כגון SYTOX או פרודיד פרופידיום (PI). קטגוריה זו כוללת גם מאמרים הדומים בקונספט אך שונים בתפקודם, כגון ההירוגנאז של הקטט (LDH), המודד את שחרורו של LDH לתוך המילייה החוץ-תאי כאינדיקטור של נמק תאי (איור 1, טבלה 1). ההתאסות האלה מסוגלות יותר להבחין בין תאים לא פעילים מבחינה מטבולית לבין תאים מתים.
| תסה/צבע | זוהו סוגים של מוות בתאים | ציוד נחוץ | תכונות עיקריות |
| MTT, CKK-8, אלמר בלו (רזורין) | אפופטוזיס/נמק | ספקטרופוטומטר | זול, מהיר; תסה נקודת קצה; תלוי בפעילות של אנזימים (מיטוכונדריאלי באופן בלעדי במקרה של MTT) ואינו מפלה בין מצבי מוות של תאים1,10 |
| שחרור LDH | נמק | ספקטרופוטומטר | מהיר, ללא תלות בפעילות אנזימים מיטוכונדריאליים; יקר לבדיקות בתפוקה גבוהה; מזהה תאים נמקים עם קרום פלזמה מופשר11,12 |
| כחול טריפאן (ש"ב) | אפופטוזיס/נמק | מיקרוסקופ | תא מושלם; אינו מפלה בין מצבי מוות של תאים; עבודה ולא מתאים להקרנה בתפוקה גבוהה; קשה יותר לשימוש עם תאים נדבקים; נוטה לשיפוט סובייקטיבי של המשתמש, אך נחשב לשיטת מדידת הכדאיות הסטנדרטית של התא13 |
| תפוז ים עצין (AO) | אפופטוזיס/נמק/ | מיקרוסקופ פלואורסצי | צבע חומצה גרעין עם תכונות ספקטרליות ייחודיות, יכול להבחין בין אפופטוזיס ונמק/נמק14 |
| נקרופטוזיס (נמק) | |||
| הוצ'סט 33342, DAPI | אפופטוזיס | מיקרוסקופ פלואורסציטי או ציטומטר זרימה | חדיר לתא; לא הולם בכוחות עצמו כדי לפקח על מוות תאים; שימושי להכתמה ב- co; יכול לשמש כדי להעריך עיסוק כרומטין ופיצול גרעין אפופטוזיס מוקדם; ניתן לזווג עם פרודיד פרופידיום להבחין אפופטוזיס מן הנמק15,16 |
| פרופידיום לודיד(פי אי) | אפופטוזיס/נמק מאוחר | מיקרוסקופ פלואורסציטי או ציטומטר זרימה | מנטרל תאי מושלם; מזהה הן אפופטוזיס מאוחר והן מצב נמק של מוות תא17. רעיל וחמלי לאחר דגירה ארוכה פעמים18 |
שולחן 1 . רשימת ההתארות של ציטו-אקסיות. Cytotoxicity assays, שחלקם שימשו במחקר זה, המפורטים יחד עם התיאור הקצר של התכונות העיקריות שלהם.
מחקרים שנעשו לאחרונה הראו כי חילוף החומרים המיטוכונדריאלי משתנה בכמהסוגי סרטן 19,20,21,22,23,24,25. לדוגמה, לוקמיה מיאלואידית חריפה (AML) הוצגו כדי להגן על המסה המיטוכונדריאלית שלהם, תוכן mtDNA, ונשימה מיטוכונדריאלית כדי לענות עלדרישות האנרגיה שלהם 19,26,27. מצד שני, כמה גידולים מוצקים מאופיינים בתפקוד מיטוכונדריאלי, או ליתר דיוק "תכנות מחדש חילוף חומרים", כגון downregulation של חלבונים מיטוכונדריאלי מעורב OXPHOS או ירידה בתכנים mtDNA, כי היה קשור פולשניות גידול, פוטנציאל גרורתי והתנגדות לתרופות מעוררות אפופטוזיס28,29. יתר על כן, לאחרונה, יש כבר עניין מוגבר באמצעות תרכובות מגוונות מכנית המשפיעים על תפקוד המיטוכונדריאלי (נקרא בדרך כללמיטוקאן 30),כטיפוליו פוטנציאליים עבור סוגי סרטן מסוימים. תרופות אלה מתמקדות סינתזה ATP, DNA מיטוכונדריאלי, OXPHOS, ו- ROS ייצור, כמו גם פרו אפופטוטי ואנטי אפופטוטי חלבונים הקשורים המיטוכונדריה30,31. מספר מחקרים הראו כי גישה זו יש הבטחהמשמעותית 19,32,33,34. עם זאת, סטיות מטבוליות אלה בביולוגיה של תאים סרטניים או טיפולים פילוח מיטוכונדריה עשוי להשפיע באופן משמעותי על הכדאיות המקובלת המבוססת על פונקציונליות מיטוכונדריאלית.
כאן, פרוטוקול ממוטב לתגרה גרעינית דיפרנציאלית מתואר. הפרוטוקול מאפשר קביעה מהירה ומדויקת של רעילות ציטוקוקסיות של מיטוקנים או השילובים שלהם עם תרכובות אחרות. Hoechst 33342 הוא צבע גרעיני חדיר לתא כי בקלות חוצה קרום התא להכתים DNA, המאפשר את ספירת התא הכוללת כדי להשיג. על ידי כתמים שותף עם PI, אשר רק נכנס הגרעין של תאים מתים, את חלקם של חיים (Hoechst בלבד) ומת (מוכתם בשניהם) תאים ניתן לקבוע במדויק. פרוטוקול זה מחדד את assayשפורסם 35 על ידי הוספת שלב אופטימיזציה של ריכוז הצבע (על ידי הצלבת תוצאות עם שיטת טריפאן כחול orthogonal) וצנטריפוגציה של הצלחת לפני הדמיה. מאז קווי תא רבים הם חצי דבק או מושעה, צנטריפוגציה מגדילה את חלקם של תאים התמונה ומשפר מאוד את הדיוק. ל-assay יש מספר יתרונות, כולל כתמים אלה אינם דורשים הסרת מדיה או כביסה. תערובת הצבע גם זולה, קלה להכנה ותואם למערכות צנרת רב-ערוציות/רובוטיות.
לאחר תאים כבר מוכתם, הם תמונה עם מיקרוסקופ אוטומטי. זה יש את היתרון הנוסף של יצירת רשומה קבועה של התמונות שניתן לנתח מחדש מאוחר יותר ואת ההשפעות של תרכובות מסוימות ניתן להעריך מחדש על ידי בדיקה חזותית של תמונות שנתפסו. לאחר שהושגו תמונות, ניתן לספור תאים באופן ידני או באמצעות כל אחת מחבילות תוכנה שונות, כולל הן בחינם (למשל, ImageJ, CellProfiler וכו') ותוכנה מסחרית (לדוגמה, Metamorph, Gen5 וכו'). ספירת תאים אוטומטית עדיפה בדרך כלל מאחר שצינורות ספירת תאים אוטומטיים שפותחו כראוי מדויקים יותר ומוטה פחות מספירת תאים ידנית. הם גם מתעלמים בצורה יעילה יותר מפסולת תאים או ממתחמים לא מסיסים. פיתוח של צינורות אלה הוא בדרך כלל פשוט והוא פשוט על ידי היעילות של הכתמים בשימוש. הפלט הוא כמותי מאחר שמספר התאים המתים בפועל מחושב באופן אוטומטי ביחס למספר תא כולל, וניתן להחיל ספי סף שונים כדי להגדיל או להקטין את המחרוזת שלזיהוי 35. לנוחיותכם, נכללים פרמטרים ממוטבים לספירת תאים באמצעות Gen5 v. 3.00 תואם תוכנת Cytation 5 Cell Imaging קורא מרובה מצבים.
Protocol
1. סיסאי ציטוטוקסיסיטי: התקנה
- הכן פתרונות של תרכובות עניין בריכוזים הרצויים במדיה המתאימה (ללא סרום או 1, 2.5, או 5% FBS RPMI-1640).
- כדי למדוד cytotoxicity של תרכובת אחת (למשל, כדי לקבוע מינונים יעילים), להכין תרכובות בריכוז הסופי 2x.
- כדי למדוד את רעילות ציטוקסיסיטי של שילובים מורכבים, להכין תרכובות בריכוז הסופי 4x.
- הכן פקדים ממס בלבד על-ידי ערבוב אותה כמות של ממס עם המדיום המתאים. לדוגמה, אם תרכובות בדיקה מומסות DMSO ומתנול, להפוך את בקרת ממס בלבד עבור כל ממס.
- לאסוף תאים מצלחת תרבות או בקבוקון לתוך צינור חסונים 15 מ"ל.
- להעביר 10 μL של מתלה תא לתוך צינור microcentrifuge וכתם עם 10 μL 0.4% טריפאן כחול. השתמש במוציתומטר כדי לספור תאים קיימא ולא מעשיים עבור כל מקור תא.
- כדורי ב 200 גרם במשך 5 דקות. לשאוף או לשתות סופרנטנט.
- גלולת תא תולה מחדש במדיה המתאימה לאסא (ללא סרום או 1, 2.5, 5% FBS RPMI-1640) בצפיפות תא של 3*105 תאים/מ"ל.
הערה 1: צפיפות תאים של 3*105 תאים/מ"ל מספקת צפיפות זריעה של 15,000 תאים/באר. צפיפות זריעה היא פרמטר חשוב ובאופן אידיאלי יש להגדיר מראש לפני הניסוי. צפיפות זריעה צריכה לקחת בחשבון 1) גודל התא – בדרך כלל תאים גדולים יותר נזרעים בצפיפות נמוכה יותר; 2) משך הטיפול – תאים הם בדרך כלל זרעים בצפיפות נמוכה יותר לניסויים שימשך זמן רב יותר; ו 3) שיעור חלוקת תאים – תאים עם שיעור גבוה יותר של חלוקה נזרעים בצפיפות נמוכה יותר. דוגמאות ספציפיות של צפיפויות זריעה ממוטבות: תאי K562, גדול יותר, 24 שעות משך – 10,000 תאים / גם; MOLM-13 תאים, גודל בינוני, 24 שעות טיפול – 15,000 / גם; MOLM-13 תאים, 48 שעות טיפול – 8,000 / גם; תאים חד-תאיים חד-תאיים קטנים ובריאים בדם היקפי (PBMCs), טיפול של 24 שעות – 50,000/גם; תאי AML ראשוניים, 24 שעות טיפול – 15,000-20,000 / גם.
הערה 2: הנוכחות של FBS במדיה עשויה להשפיע על הפעילות של התרכובות. הפחתת הריכוז של FBS עשויה להפוך את תוצאות ההסתה לפשוטות יותר לפענוח, אך היא גם מפחיתה את הדיוק הפיזיולוגי. - זרע 50 μL של מתלה תא מ שלב 1.5 לתוך כל באר של צלחת 96-גם באמצעות פיפטה רב ערוצית.
- הוסף תרכובות באופן הבא:
- עבור תרכובת אחת אומר, להוסיף 50 μL של 2x פתרון מורכב לתוך כל באר. עבור בארות בקרת ממס, להוסיף 50 μL של מדיית בדיקה המכילה את הממס בריכוז 2x.
- לשילוב, הוסף 25 μL של כל אחד מהמתחם (4x פתרונות) לתוך כל באר. עבור בארות יחיד תרכובת שליטה, להוסיף 25 μL של פתרון מורכב 4x ו 25 μL של בינוני מבחן. עבור בארות בקרת ממס, להוסיף 50 μL של בינוני בדיקה או בינוני בדיקה המכילה את הממס.
הערה 1: הריכוז הסופי של DMSO לא יעלה על 0.5%.
הערה 2: מומלץ להוסיף את המדיה המכילה את התרכובות עם פיפטה נוגע בקיר של כל באר בשל נפח נמוך.
- הקש בעדינות על הצלחת כדי להבטיח ערבוב של תכולת הבארות.
- דגירה צלחות ב 37 ° C באווירה לחה 5% CO2 לזמן מתאים, למשל, 24 שעות.
2. סיסאי Cytotoxicity: כתמים עם Hoechst 33342 ו פרופידיום לודיד
- הכן תמיסת כתמים 10x. פתרון זה צריך להיות מוכן טרי לפני כל ניסוי, זה לא יכול להיות מאוחסן. ריכוזי צבע סופיים צריכים להיקבע לפני הניסוי.
- עבור קווי תאים לוקמיה ותאי לוקמיה ראשיים, 1 מ"ל של 10x כתמים מאגר מכיל 10 μL של 20 mM Hoechst 33342 ו 50 μL של 1 מ"ג/ מ"ל פרופידיום iodide ב PBS סטרילי (ריכוזים סופיים: Hoechst 33342 20 μM, PI 5 μg/mL).
- עבור PBMCs בריא, 1 מ"ל של 10x כתמים מאגר מכיל 10 μL של 20 m Hoechst 33342 ו 10 μL של 1 מ"ג / מ"ל פרופידיום iodide ב PBS סטרילי (ריכוזים סופיים: Hoechst 33342 20 μM, PI 1 μg/mL).
הערה: הריכוז הסופי של פרודיד פרופידיום צריך להיקבע לפני הניסויים. יש לבדוק תאים באמצעות טווח של ריכוזי PI (1, 2.5, 5 μg/mL), ולאחר מכן יש להשוות את הכדאיות המחושבת Hoechst/PI לכדאיות הנמדדת באמצעות טריפאן בלו. ריכוזי PI המפורטים לעיל נבחרו בהתבסס על יכולת הכדאיות של תא היעד בארות בקרת מדיה (מעל ~ 90% עבור קווי תאים לוקמיה, מעל ~ 70% עבור מחשבים אישיים בריאים).
התראה: Hoechst 33342 ו- propidium iodide הם מסרטנים פוטנציאליים. ללבוש ציוד מגן אישי מתאים בעת טיפול בהם.
- לאחר הדגירה, השתמש פיפטה רב ערוצית כדי להוסיף 10 μL של 10x כתמים מאגר לכל באר.
הערה: כדי למנוע זיהום צולב, ודא כי עצות פיפטה אינן נוגעות במדיה. - הקש בעדינות על הצלחת כדי לערבב ולנקה בועות. מכתים ב-37°C למשך 15 דקות.
- צנטריפוגה הצלחת ב 200 גרם במשך 4 דקות כדי להביא את כל התאים לתחתית הצלחת. נגב בזהירות את תחתית הצלחת עם קימוויפ לח כדי להסיר סיבים ו/או פסולת שתפריע להדמיה.
הערה 1: צנטריפוגציה של הצלחת מבטיחה את הסיכויים הגבוהים ביותר עבור כל התאים להיתפס בתמונה. לעתים קרובות תאים מתים יתנתקו ויציפו, ויספקו ערכים מטעים של ציטוקוקסיות. צנטריפוגציה מפחיתה את האפקט הזה.
הערה 2: יש למצוא את הלוח במהירות האפשרית לאחר צנטריפוגציה, באופן אידיאלי, בתוך 15 דקות. צנטריפוגציה יכולה להפחית את הבחירה של כתמי PI, עשויה לאפשר לתאים לצבור לאט את האדיד פרופידיום. השיפור ברמת הדיוק שנצבר על ידי הדמיית התאים המתים עולה על העלייה הקלה בכתמים PI. מומלץ לסיים את ההדמיה בתוך שעה אחת של צנטריפוגה.
3. סיסאי ציטוטוקסיסיטי: רכישת נתונים
- הגדר את התוכנה עבור מיקרוסקופ אוטומטי / צלחת imager כדי לזהות פלואורסצסצנת עבור שני Hoechst 33342 (פליטה מקסימלית 350 צפון ל', פליטה מקסימלית 461 nm) ו PI (פליטה מקסימלית 493 צפון השנייה, פליטה מקסימלית 636 צפון ל"ר). לרכוש תמונות עבור כל באר בשני הערוצים.
- באמצעות התוכנה (כגון CellProfiler, סטודיו לניתוח תמונות חינם המבוסס על MatLab http://cellprofiler.org/, ImageJ או תוכנה קניינית כגון Gen5) לספור את התאים בכל באר בכל ערוץ.
הערה: מאז כל תא צריך להיות מוכתם עם Hoechst 33342, תאים מתים צריך להיות מוכתם עם PI, היחס של מת לכל מייצג את השבר של תאים מתים. לדוגמה, אם הספירה האוטומטית בדגימה לא מטופלת מציגה 467 תאים מוכתמים ב- PI (תאים מתים) ו- 2335 תאים מוכתמים ב- Hoechst 33342 (סה"כ תאים), השבר המת הוא 0.2 או 20%. ערך זה מושווה לאחר מכן לדוגמה שטופלה באופן זהה שבה נעשה שימוש בטיפול. - תיאור מפורט של רכישת נתונים Hoechst/PI באמצעות Cytation5 תא הדמיה קורא מרובה מצבים ותוכנות Gen5 v. 3.00:
- הגדר את קורא לוחות Multimode Cytation5 / imager לתאי תמונה בתחתית שטוחה, 96-גם, צלחות פלסטיק שחור גנרי.
- הגדר פרוטוקול הדמיה כדי לנצל את ערכות המסנן הסטנדרטיות DAPI ו- Texas Red. לצלם תמונות במרכז הבאר באמצעות מטרת הגדלה של פי 4. אין להשתמש בהיסט (X/Y או Z). השתמש בהגדרות ההדמיה הבאות: DAPI – LED - 10, זמן שילוב - 99, רווח - 0; טקסס אדום - LED - 8, זמן אינטגרציה - 950, רווח - 18. בצע מיקוד אוטומטי באמצעות אות DAPI; לא צריך להיות היסט בהתמקדות בין ערוצים.
- בצע ניתוח תמונה באמצעות תוכנת Gen5 v 3.00. בהגדרות התוכנה, הגדר תאים כצורות בין 5 ל- 25 μm בגודלם. אל תכלול אובייקטי קצה ראשי וצלל אובייקטים נוגעים על-ידי הפעלת אפשרות מיוחדת "פצל אובייקטים נוגעים". לאחר מכן, עבד את התמונה כדי להסיר את הרקע (חיסור רקע כהה), החל מסיכה גרעינית (DAPI ערך סף >= 6000 AU) וספור אובייקטים. בצע ניתוח תת-אוכלוסיה המבוסס על כתמי PI (ערך סף טקסס רד >= 5000 AU) וספירת אובייקטים. % קיימות תא מוגדר כ( 1 -
 .
.
תוצאות
הפרוטוקול הנ"ל פותח באמצעות תאי OCI-AML2, אשר נלקחו כנציג קו תא לוקמיה מיאלואידית חריפה. AML מאופיין בהתפשטות חריגה של תאים המטופואיטיים לא מושונים ולא פונקציונליים במח העצם26. למרות ההתפתחויות האחרונות בטיפול ממוקד AML, רמת הטיפול נותרה ללא שינוי במשך כמה עשורים, ומורכבת מטיפול אינדוקציה (המורכב בדרך כלל משלושה ימים של אנתרופיקלין, למשל, daunorubicin, idarubicin, או mitoxanthrone אינדוקציה, ו 7 ימים של cytarabine) ואחריו קונסולידציה (מורכב בדרך כלל של סיבובים של טיפול cytarabine ואחריו תקופותשל התאוששות) 36.
בעקבות הפרוטוקול המתואר איור 1A, OCI-AML2 תאים נזרעו 96-גם צלחות וטופלו עם מיטוכונדריאלי uncoupler קרבוניל ציאניד m-כלורופיל הידרזון (CCCP) או מעכב גליקוליטי 2-deoxy-D-גלוקוז (2-DG) במגוון של ריכוזים. תאים טופלו במשך 24 שעות ב 37 °C ב RPMI-1640 ללא סרום מדיה, ולאחר מכן הכדאיות הוערכה באמצעות הדרת טריפאן כחול (TB) או אחד מארבעת רמות קיימות (הכתמים גרעיניים דיפרנציאליים Hoechst / PI, LDH שחרור הודעה, MTT, או alamarBlue). תמונות מייצגות של תאים המוכתמים ב- Hoechst/PI מוצגות באות 2A. מספר תצפיות חשובות יכולות להיעשות באופן מיידי. ראשית, המספר הכולל של תאים (הכתמת Hoechst) הוא גבוה למדי והוא גדול במידה ניכרת ממספר התאים המתים (כתמי PI). זה מצביע על כך שהתנאים התקשורתיים אינם מעוררים שיעור גבוה של מוות בתאים. שנית, מכיוון שרק תאים המסווים עם Hoechst ו- PI נחשבים כמתים (תאים סגולים בתמונה הממוזגת), ההסתברות לספירת פסולת נמוכה מאוד. תמונה זו מציגה דוגמה טובה לתאים מוכתמים כראוי.
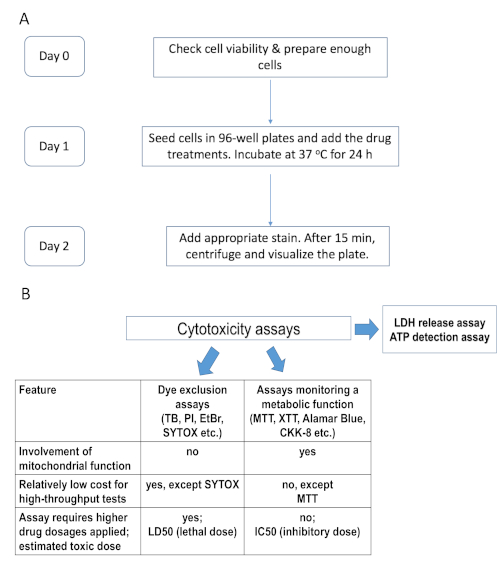
איור 1. ציר זמן ניסיוני והשוואה של ציטוטוקסיות קיימת. (א)תרשים זרימה המסכם את ציר הזמן עבור ההליך הניסיוני, למשל הכתמת Hoechst/PI. (ב)השוואה של ציטוטוקסיות, שחלקם שימשו במחקר זה. אי-הכללת צבע כרוכה בצבעים גרעיניים אטומים המכתימים תאים מתים עם קרום פלזמה בסכנה: TB – טריפאן כחול, PI – פרודיד פרופידיום, EtBr – אתידיום ברומיד, ו SYTOX. קבוצה שנייה של אסות תלויות בחילוף החומרים התאי, למשל, מלחי tetrazolium MTT, XTT, ו CKK-8 (WST-8), resazurin מבוסס ריאגנט alamarBlue, וכו 'לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
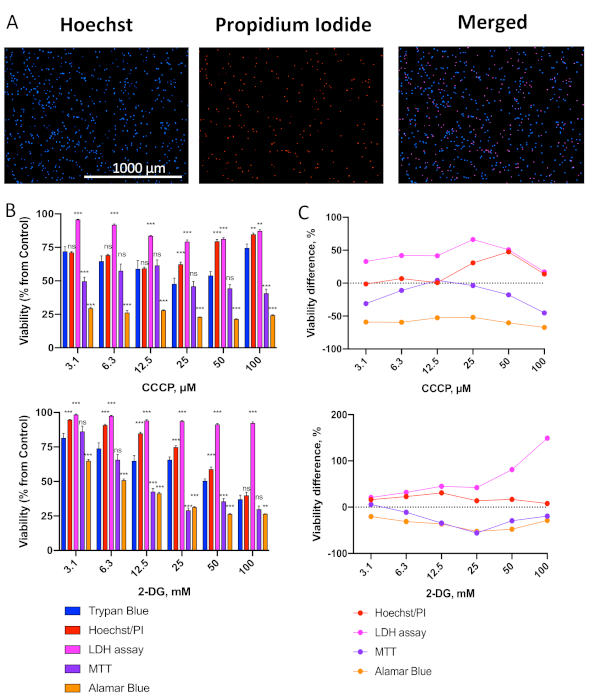
איור 2. השוואה של פאנל של cytotoxicity אומר עם הדרה כחול trypan. (א)תמונות מייצגות של סך הכל (Hoechst 33342) ומת (פרודיד פרופידיום, PI) OCI-AML2 תאים באמצעות הכתמת Hoechst / PI. (ב)הערכת כדאיות של תאי OCI-AML2 בשיטות שונות לאחר הטיפול עם הדרגתיות של ריכוזי CCCP(למעלה) או 2-DG(למטה). OCI-AML2 טופלו עם CCCP או 2-DG ב RPMI-1640 ללא סרום במשך 24 שעות לפני קביעת כדאיות התא. מוצג הוא ממוצע, קווי שגיאה מייצגים SEM. C. ההבדל בכדאיות התא בין cytotoxicity assays ב (B) לעומת כתמים כחולים trypan (ראה טבלאות משלימות S1-2 עבור המספרים המדויקים ההבדל החציוני). כוכבים מציינים הבדל משמעותי לעומת. כתמים כחולים טריפאן. ** p < 0.01, *** p < 0.001, ns – לא משמעותי. השוואת קבוצות נעשתה באמצעות t-test עם תיקון עבור בדיקות השערה מרובות. שלושה משכפלים ביולוגיים עצמאיים בוצעו. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
כפי שדיווחנולאחרונה 19, לוקמיה רגישים מאוד לטיפולים מיטוקסיים, אשר מציין כי התאים כבר יש נזק מיטוכונדריאלי הבסיסי. על בסיס זה, חזינו כי MTT ו alamarBlue assays, אשר מבוססים על פעילות אנזימים מיטוכונדריאלי, יהיה למדוד באופן לא מדויק את הכדאיות הסלולרית. כצפוי, אלה assays (במיוחד alamarBlue) הראה קיימא נמוכה באופן משמעותי בהשוואה להחרגה כחול trypan, ראה איור 2B,C, טבלאות משלימות S1-S2). זה עולה בקנה אחד עם העובדה כי מינונים של תרכובות אלה הנדרשים כדי לגרום אפופטוזיס או נמק גבוהים יותר מאלה הדרושים כדי להתפשר על תפקוד המיטוכונדריאלי.
בין ההתמרמרות שנבדקו, כתמים כפולים עם Hoechst 33342 ו PI היה השילוב הטוב ביותר של חוסן, רגישות, ועקביות עם כתמי TB, עם סטייה החציוני הקטן ביותר משיטת החרגת TB לאחר CCCP או טיפול 2-DG(טבלאות משלימות S1-2). מעניין, במינונים גבוהים יותר של CCCP (50 ו 100 μM) הכדאיות המוערכת עם Hoechst / PI או TB גדל בהשוואה במינונים נמוכים יותר(איור 2B, למעלה). זה כנראה בשל המשקעים של CCCP במינונים גבוהים יותר בשל הידרופוביות שלה, הפחתת הריכוז היעיל שלה ואת ההשפעה על תאים. הגדלת המינון של CCCP מופחת עוד יותר Hoechst / PI מוערך הכדאיות אומר של תאי OCI-AML2, עם זאת: 74% ב 150 μM, 62% ב 200 μM, 6% ב 300 μM(נתונים לא מוצגים).
ההסתה Hoechst/PI הייתה יעילה גם בקביעת הכדאיות הסלולרית לאחר הטיפול מולקולות אחרות המיטוכונדריה מיקוד. אלה כללו רוטנון, רעל הפוגע במתחם I של שרשרת תחבורת אלקטרונים מיטוכונדריאלית37, ו-3-ברומופירובאט, מעכב גליקוליטי וסוכן אלקילטים הפוגעים בנשימה מיטוכונדריאלית וחילוף חומרים מיטוכונדריאלי38 (איור 3ל-ד', טבלאות משלימות S3-4).
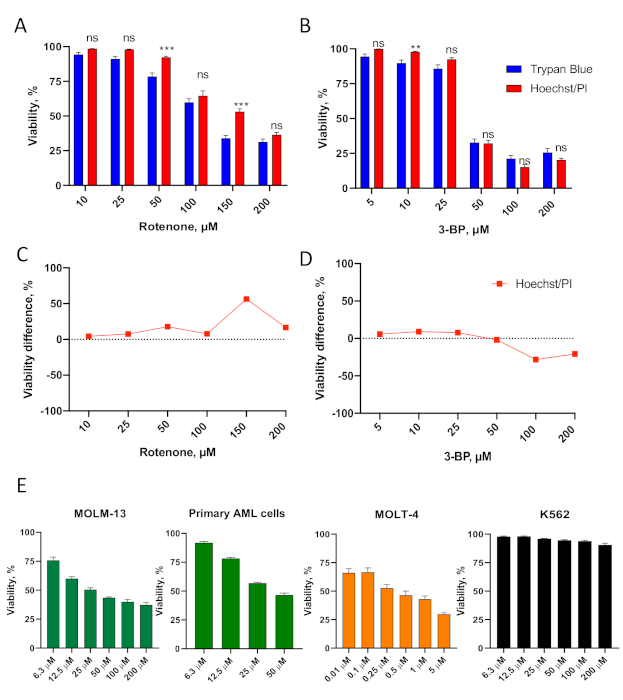
איור 3. אימות של Hoechst / PI cytotoxicity assay בתאי לוקמיה. (A,B)OCI-AML2 (AML) תאים טופלו עם ריכוזים שונים של רוטנון (A) או 3-bromopyruvate, 3-BP (B) ב RPMI-1640 ללא סרום מדיה במשך 24 שעות, אז הכדאיות נקבעה. מוצג הוא ממוצע עם SEM.(C,D)השוואה של הבדל כדאיות בין Hoechst / PI assay לעומת כתמים כחולים trypan (עבור התאים ב- A-B, ראה טבלאות משלימות S3-4 עבור כמות). כוכבים מצביעים על משמעות סטטיסטית לעומת כתמי טריפאן כחולים. ** p < 0.01, *** p < 0.001, ns – לא משמעותי. השוואת קבוצות נעשתה באמצעות t-test עם תיקון עבור בדיקות השערה מרובות. E. MOLM-13 (AML), תאי AML ראשיים מבודדים ממטופל, MOLT-4 (ALL) ו K562 (CML) תאים טופלו עם ריכוזים שצוינו של רוטנון בסרום ללא RPMI-1640 מדיה במשך 24 שעות, לפני קביעת הכדאיות באמצעות הכתמת Hoechst / PI. מוצג הוא מרושע עם SEM. שלושה משכפלים ביולוגיים עצמאיים בוצעו. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
Assay cytotoxicity Hoechst/PI אומת עוד יותר באמצעות פאנל של קווי תאים לוקמיה המייצגים סוגים מרובים של לוקמיה, כמו גם תאים ראשיים. הם כללו MOLM-13 (קו תא AML), תאי AML ראשוניים נגזר מדגם מטופל מייצג, MOLT-4 (קו תא לוקמיה לימפובלסטית חריפה, ALL), ו K562 (קו תא לוקמיה מיאלוגני כרוני, CML) (איור 3E, דמות משלימה S1). תוצאות ה-Hoechst/PI הראו כי לתאים אלה היו הבדלים עמוקים ברגישות רוטנון, החל מתאי רגישים מאוד (MOLT-4) ועד לתאים עמידים (K562).
כדי להדגים את החוסן של ההסתה, תאי OCI-AML2 טופלו עם הדרגתי ריכוז של 3-bromopyruvate, כמתואר בפרוטוקול לעיל. ספירות תאים נאספו עבור 6 בארות בכל ריכוז ומוצגות(איור 4א', ב). ספירות אלה שימשו לחישוב הכדאיות, והראו כי כמה שפחות 4 בארות היו מספיקות כדי ללכוד במדויק את התוצאה שלאסאי (איור 4C). עקומת תגובת מינון וכתוצאה מכך מוצגת(איור 4D).

איור 4. שכפול של הכתמת Hoechst/PI. הכדאיות של תאי OCI-AML2 לאחר 24 שעות של טיפול עם ריכוזים שונים של 3-bromopyruvate (3-BP). (א)מספר תאים הכולל הנספר באמצעות הכתמים Hoechst 33342,(ב)מספר תאים מתים נספרו באמצעות הכתמת פרודיד פרופידיום. (ג)קיימות (%) מחושב באמצעות (A-B). (ד)גרף תגובה מינון מייצג. מוצג הוא מרושע עם SEM. שלושה משכפלים ביולוגיים עצמאיים בוצעו. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
למרות שהאסה חזקה יחסית, עדיין יש לנקוט בטיפול. ביצועים לא נאותים של ההסתה עלולים לסכן את הדיוק שלה. מספר תוצאות שנפשרו מוצגות למטרות פתרון בעיות (איור 5). הסט הראשון של תמונות מראה את ההשלכות של כתמים יתר עם PI, אשר עשוי לנבוע מהמקורות הבאים: שימוש בצבע בריכוז גבוה מדי, הכתמה במשך זמן רב מדי, או באמצעות עוצמת LED גבוהה מדי / זמן אינטגרציה בערוץ האדום (איור 5A). שגיאות אלה ייצרו מספרים מנופחים באופן מלאכותי של תאים מתים. הבעיה השנייה נובעת מהזנחת שלב הצנטריפוגה. לעתים קרובות, תאים מתים מתחילים לאבד את ההחזקה שלהם מפני השטח של המנה. כתוצאה מכך, הם יהיו מיוצגים פחות במהלך רכישת תמונה, אשר מתרחשת בדרך כלל ליד החלק התחתון של הבאר (איור 5B). לבסוף, חשיפת יתר בערוץ Hoechst מרחיבה באופן מלאכותי את גודל התאים, מפחיתה באופן משמעותי את סך הספירות לבאר ומגבילה את כוח ה-assay (איור 5C).
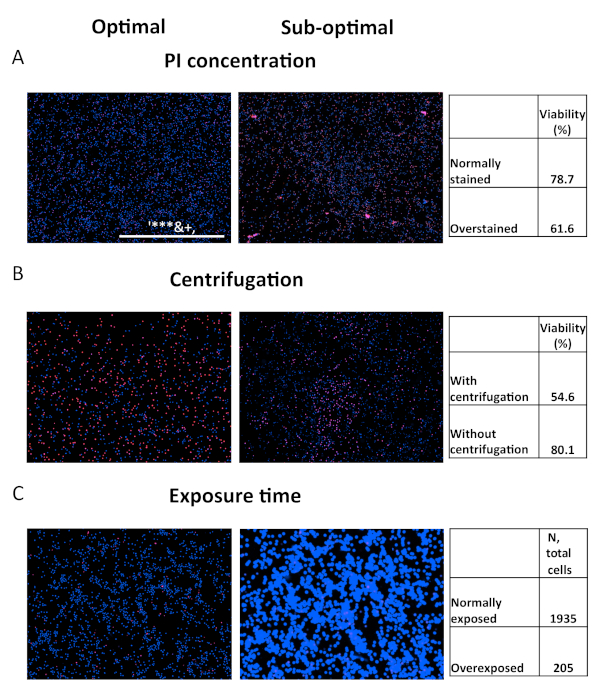
איור 5. השוואה בין פרמטרים אופטימליים ותת-אופטימליים. השוואת תוצאות שנרכשו באמצעות פרמטרים ממוטבים (משמאל) או פרמטרים תת-אופטימליים (מימין). (A)מחשבים אישיים בריאים היו מוכתמים עם פרודיד פרופידיום ב 1 μg / mL (שמאל) או 5 μg / מ"ל (מימין) במשך 15 דקות לפני ההדמיה. (ב)תמונות של תאי OCI-AML2 שצולמו עם צנטריפוגה (משמאל) או ללא (מימין) צנטריפוגציה צלחת. (C) תמונות של תאי OCI-AML2 שנרכשו עם זמן אינטגרציה אופטימלי (משמאל) או מוגזם (מימין) עבור ערוץ Hoechst. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
| הבדל עם שיטת טריפאן כחולה, % | ||||
| CCCP, μM | הוצ'סט/פי.אי | LDH תסה | MTT (1000 | כחול אלמר |
| 3.1 | -1.19 | 33.00 | -31.05 | -59.04 |
| 6.3 | 6.99 | 41.90 | -11.03 | -59.34 |
| 12.5 | 0.71 | 41.60 | 4.31 | -52.52 |
| 25 | 30.73 | 66.33 | -3.68 | -51.85 |
| 50 | 47.38 | 50.71 | -17.71 | -60.27 |
| 100 | 13.81 | 17.12 | -45.31 | -67.25 |
| חציון | 10.40 | 41.75 | -14.37 | -59.19 |
שולחן משלים S1. הבדלי יכולת הכדאיות עבור לוח של אסות בתאי OCI-AML2 לאחר טיפול CCCP. הערכת הכדאיות בוצעה לאחר 24 שעות של טיפול עם ריכוזים שונים של CCCP. הבדלי הכדאיות החציוני בין בדיקות (Hoechst/PI, LDH, MTT או alamarBlue) לבין הכתמה כחולה טריפאן עם ספירה אוטומטית חושב בהתבסס על הבדלי יכולת הכדאיות בכל ריכוז סמים.
| הבדל עם שיטת טריפאן כחולה, % | ||||
| 2-DG, mM | הוצ'סט/פי.אי | LDH תסה | MTT (1000 | כחול אלמר |
| 3.1 | 16.16 | 20.77 | 5.82 | -20.27 |
| 6.3 | 22.93 | 31.96 | -11.13 | -31.11 |
| 12.5 | 30.85 | 45.07 | -34.27 | -36.29 |
| 25 | 13.81 | 42.39 | -55.79 | -52.29 |
| 50 | 16.96 | 81.12 | -29.38 | -47.68 |
| 100 | 7.79 | 149.16 | -19.37 | -28.67 |
| חציון | 16.56 | 43.73 | -24.38 | -33.70 |
שולחן משלים S2. הבדלי כדאיות עבור לוח של אימות בתאי OCI-AML2 לאחר טיפול 2-DG. הערכת הכדאיות בוצעה לאחר 24 שעות של טיפול עם ריכוזים שונים של 2-DG. הבדלי הכדאיות החציוני בין בדיקות (Hoechst/PI, LDH, MTT או alamarBlue) לבין הכתמה כחולה טריפאן עם ספירה אוטומטית חושבו בהתבסס על הבדלי יכולת הכדאיות בכל ריכוז סמים.
| רוטנונה, μM | הפרשי הכדאיות, % (Hoechst / PI-טריפאן כחול) |
| 10 | 4.45 |
| 25 | 7.61 |
| 50 | 17.70 |
| 100 | 7.74 |
| 150 | 56.38 |
| 200 | 16.57 |
| חציון | 12.15 |
שולחן משלים S3. הבדלי הכדאיות בין שיטת האי-הכללה Hoechst/PI לבין שיטת החרגת TB בתאי OCI-AML2 לאחר טיפול רוטנון. הערכת הכדאיות בוצעה לאחר 24 שעות של טיפול עם ריכוזים שונים של רוטנון. ההבדל בכדאיות החציוני בין Hoechst/PI לבין הכתמה כחולה טריפאן עם ספירה אוטומטית חושב בהתבסס על הבדלי הכדאיות בכל ריכוז סמים.
| 3-BP, μM | הפרשי הכדאיות, % (Hoechst / PI-trypan כחול) |
| 5 | 5.73 |
| 10 | 9.00 |
| 25 | 7.72 |
| 50 | -1.90 |
| 100 | -28.23 |
| 200 | -20.77 |
| מ'אדיאן | 1.91 |
שולחן משלים S4. הבדלי הכדאיות בין שיטת האי-הכללה Hoechst/PI לבין שיטת החרגת TB בתאי OCI-AML2 לאחר טיפול ב-3-bromopyruvate (3-BP). הערכת הכדאיות בוצעה לאחר 24 שעות של טיפול עם ריכוזים שונים של 3-BP. הבדל הכדאיות החציוני בין Hoechst /PI ו כתמים כחולים trypan עם ספירה אוטומטית חושב בהתבסס על הבדלי הכדאיות בכל ריכוז סמים.
דמות משלימה S1. תמונות מייצגות של תאים מוכתמים ב-Hoechst/PI, עם או בלי טיפול רוטנון בריכוזים המצוינים במדיה RPMI-1640 ללא סרום למשך 24 שעות: A-B. AML: קו תא MOLM-13 (A) ותאי AML ראשיים (B) הנגזרים מדגימת מטופל מייצגת. ג., אתה בסדר? קו סלולרי של מולט-4. די.די. קו תא K562. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
למרות הפרוטוקול עבור Hoechst / PI cytotoxicity assay הוא חזק ודורש זמן מעשי קטן יחסית, ישנם מספר פרטים ניסיוניים חשובים מאוד כדי להבטיח תוצאות מדויקות. ראשית, חשוב לוודא כי הריכוז של DMSO נשאר מתחת 0.5% (v /v). מוסכם בדרך כלל כי חשיפה אפילו במינונים נמוכים של DMSO יכול לשנות באופן משמעותי את מורפולוגיה וחיבור של תאים ולעכב באופן משמעותי את התקדמות מחזורהתא 39,40.
שנית, יש לבצע את הכתמים בהקדם האפשרי לאחר הטיפול. מכיוון שאין מדרגות כביסה, המתחם נשאר בארות והוא יכול להמשיך לגרום נזק לתאים. בהשוואה לפרוטוקולהקודם 35, התאים היו מוכתמים במשך 15 דקות בלבד. זה מגביל את האפשרות כי תאים קיימא יכול להיות מוכתם בשוגג עם אידיד פרופידיום. מסיבה זו, אנו מציעים טיפולים מדהימים וכתמים אם יותר משתי צלחות יטופלו. הדבר מאפשר זמן הדמיה בין צלחות ומשפר את הרבייה.
שלישית, ריכוז הצבע המתאים תלוי בסוג התא. חשוב לקבוע באופן אמפירי את ריכוז פרודיד פרופידיום ממוטב, החל תאים לא מטופלים, באמצעות הכתמה כחול trypan כהתייחסות אורתוגונלית.
לבסוף, שלב הצנטריפוגה מיד לפני ההדמיה הוא גם קריטי. בהתבסס על פרוטוקול זה, טווח של 500-4,000 תאים נרשם (בהתאם לצפיפות זריעה). זהו שיפור בולט על 100-400 תאים לכל בשימוש גם בעבר35. בהתחשב וריאציה באוכלוסייה של תאים סרטניים (במיוחד תאים ראשוניים), לאחר תאים יותר לניתוח חשוב, עשוי לאפשר ניתוח נתונים חזקים יותר.
בשל הפשטות היחסית של השיטה, ניתן לבצע בקלות מגוון רחב של שינויים. לדוגמה, צבעים רבים אחרים של תאים-מפגם זמינים ממספר ספקים ותוחלף ב-propidium iodide. בעוד שלתחליף זה יש ערך מועט יחסית בפני עצמו, לוח הצבעים המוגבר משמעו שניתן לבצע ניסויים מורכבים יותר. לדוגמה, הוספת צבע שלישי תאפשר הערכה של הישרדות דיפרנציאלית בין תת-אוכלוסיות של תאים, כפי שמבוצע בדרך כלל עם ציתום זרימה.
שינוי משמעותי יותר של הפרוטוקול הוא החזותית תא והשתמש בספקטרופוטומטר במקום. לגישה זו יש את היתרון של שימוש בציוד כמעט בכל מקום (ספקטרופוטומטר סטנדרטי עם קורא מיקרו-פלטות) והיא השיטה המהירה ביותר להשגת נתונים. עם זאת, שיטה זו היא הרבה פחות מדויקת. עוצמת הפלואורסצנה מייצגת את כתמי התא, אך וריאציות סטוכסטיות בעוצמת הכתמים, בשילוב עם אזור המדגם הקטן יחסית, מציגות שונות משמעותית. בעוד אופטימיזציה נוספת (כגון הכללה של קיבעון, שלבי כביסה נוספים, או מספר גדול יותר של דגימות) עשוי לטפל בבעיות אלה, מיקרוסקופ פלואורסץ היא בדרך כלל גישה מעולה.
לסיכום, פרוטוקול Hoechst/PI ששונה הוא מהיר, מדויק, זול, תפוקה גבוהה cytotoxicity תפוקה אסטואיזמי כי הוא אינו תלוי פונקציה מיטוכונדריאלית. תס"א זה יש כלי משמעותי עבור ביעילות הקרנה תרכובות או שילובים מורכבים כי היעד מיטוכונדריה.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
NVK, חוקר CPRIT בחקר הסרטן, מודה המכון למניעת סרטן ומחקר של טקסס (CPRIT) על תמיכתם הנדיבה, CPRIT גרנט RR150044. עבודה זו נתמכה גם על ידי מענק המחקר של קרן וולש C-1930, ועל ידי המכונים הלאומיים לבריאות R35 GM129294 שהוענק ל-NVK. למימון לא היה כל תפקיד בעיצוב מחקר, איסוף וניתוח נתונים, החלטה לפרסם או הכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
References
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8(2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , Chapter 12, Unit 12.18 (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698(2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617(2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295(2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102(2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435(2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465(2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved